Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Enriquecimiento de vesículas extracelulares derivadas de astrocitos a partir de plasma humano
En este artículo
Resumen
Este protocolo describe el enriquecimiento de vesículas extracelulares derivadas de astrocitos (ADEVs) a partir de plasma humano. Se basa en la separación de los EV mediante precipitación de polímeros, seguida de la inmunocaptura de los ADEV basada en ACSA-1. El análisis de los ADEV puede ofrecer pistas para estudiar los cambios en las vías inflamatorias de pacientes vivos, de forma no invasiva mediante biopsia líquida.
Resumen
Las vesículas extracelulares (VE) son nanopartículas biológicas secretadas por todas las células para la comunicación celular y la eliminación de desechos. Participan en una amplia gama de funciones actuando y transfiriendo sus cargas a otras células en condiciones fisiológicas y patológicas. Dada su presencia en biofluidos, las VE representan un excelente recurso para el estudio de los procesos patológicos y pueden considerarse una biopsia líquida para el descubrimiento de biomarcadores. Un aspecto atractivo del análisis de VE es que pueden seleccionarse en función de los marcadores de su célula de origen, reflejando así el entorno de un tejido específico en su carga. Sin embargo, uno de los principales hándicaps relacionados con los métodos de aislamiento de VE es la falta de consensos metodológicos y protocolos estandarizados. Los astrocitos son células gliales con funciones esenciales en el cerebro. En las enfermedades neurodegenerativas, la reactividad de los astrocitos puede conducir a una alteración de la carga de EV y a una comunicación celular aberrante, lo que facilita/mejora la progresión de la enfermedad. Por lo tanto, el análisis de los VE de los astrocitos puede conducir al descubrimiento de biomarcadores y posibles dianas patológicas. Este protocolo describe un método de 2 pasos para el enriquecimiento de EV derivadas de astrocitos (ADEV) a partir de plasma humano. En primer lugar, los vehículos eléctricos se enriquecen a partir de plasma desfibrilado mediante precipitación basada en polímeros. A esto le sigue el enriquecimiento de los ADEV mediante la inmunocaptura basada en ACSA-1 con microesferas magnéticas, en la que los EV resuspendidos se cargan en una columna colocada en un campo magnético. Los EV ACSA-1+ etiquetados magnéticamente se retienen dentro de la columna, mientras que otros EV fluyen a través de ella. Una vez que se retira la columna del imán, los ADEV se eluyen y están listos para su almacenamiento y análisis. Para validar el enriquecimiento de marcadores de astrocitos, se puede medir la proteína ácida fibrilar glial (GFAP) u otros marcadores astrocíticos específicos de origen intracelular en el eluido y compararlos con el flujo a través. Este protocolo propone un método fácil y eficiente en el tiempo para enriquecer ADEVs a partir de plasma que se puede utilizar como plataforma para examinar marcadores relevantes para los astrocitos.
Introducción
Las vesículas extracelulares (VE) son un grupo heterogéneo de nanopartículas membranosas secretadas por todo tipo de células, portadoras de proteínas, lípidos y ácidos nucleicos1. Las microvesículas (100-1000 nm), los exosomas (30-100 nm) y los cuerpos apoptóticos (1000-5000 nm) constituyen los principales tipos de EV, distinguidos por su sitio de origen 2,3. Las VE regulan procesos fisiológicos importantes, como la presentación de antígenos y las respuestas inmunitarias4, el reciclaje de receptores, la eliminación de metabolitos5 y la comunicación celular6. La regulación de estos procesos puede ocurrir por la unión directa entre proteínas enriquecidas en la membrana de la célula EV y dianas en las células receptoras, y/o a través de la internalización y liberación de su carga en el citoplasma de la célula receptora7. Si bien las VE realizan funciones celulares esenciales, han ganado cada vez más interés desde una perspectiva patológica en los campos del cáncer y la neurología. De hecho, varios estudios han demostrado que los VE pueden ayudar a promover la migración de células tumorales 8,9 o semillas de agregados de proteínas tóxicas en enfermedades neurodegenerativas, como la enfermedad de Alzheimer10,11.
Los VE pueden seleccionarse y enriquecerse a partir de biofluidos a partir de marcadores de superficie celular relacionados con su célula de origen, reflejando así el entorno de un tejido específico en su carga 12,13,14,15,16,17,18,19,20. Además, dada su presencia en la sangre, el líquido cefalorraquídeo (LCR), la saliva, la orina y la leche materna, las VE representan una excelente herramienta no invasiva para el diagnóstico, y pueden considerarse una biopsia líquida para el descubrimiento de biomarcadores. Esto es de especial interés en neurología, dadas las dificultades de estudiar los analitos cerebrales en fluidos accesibles distintos del LCR.
Los astrocitos han ganado un interés creciente, ya que se encuentran en la intersección de la comunicación neurovascular21. En condiciones fisiológicas, son responsables de la preservación de la barrera hematoencefálica, del reciclaje de neurotransmisores, del suministro de nutrientes y factores de crecimiento a las neuronas y otras células gliales 22,23,24, así como de la defensa neuroinmune, dada su plasticidad metabólica de estados proinflamatorios a antiinflamatorios y viceversa 25,26,27. Un mecanismo importante por el cual los astrocitos cumplen sus funciones reguladoras es la comunicación a través de los EV28,29. La astrocitosis reactiva es un sello distintivo clave de varias enfermedades neurodegenerativas, como la enfermedad de Alzheimer,30 la atrofia multisistémica (AMS), la parálisis supranuclear progresiva (PSP)31 y la esclerosis lateral amiotrófica (ELA)32. La reactividad de los astrocitos puede conducir a una alteración de la carga de EV, liberación de mediadores inflamatorios y comunicación celular aberrante, facilitando así la propagación de la patología y conduciendo a la neurodegeneración10,11. Por lo tanto, el estudio de los VE derivados de astrocitos (ADEV) y los cambios en su carga es un recurso atractivo para examinar los procesos neurodegenerativos de manera no invasiva.
En la actualidad, existen varias metodologías para el aislamiento de los vehículos eléctricos, cada una con sus correspondientes ventajas y desventajas33. Es fundamental considerar qué método es el más adecuado para un uso específico, en función de la aplicación final de interés. En el campo de la neurología, y más concretamente en los estudios de astrocitos, la precipitación basada en polímeros seguida de inmunocaptura ha sido el método predominantemente utilizado 12,18,19,20,34. Sin embargo, incluso cuando se aplica el mismo enfoque, sigue habiendo heterogeneidad entre los estudios en los diferentes pasos aplicados para el aislamiento de EV. Por lo tanto, existe la necesidad de una metodología estandarizada clara y paso a paso para facilitar los estudios de VE de astrocitos y la reproducibilidad del estudio. La precipitación basada en polímeros facilita el cribado de biomarcadores, ya que se trata de un procedimiento rápido, sencillo y que no requiere de equipos complejos, lo que permite un alto rendimiento de las VE sin afectar a su actividad biológica35.
El presente protocolo describe un método detallado, sencillo y de dos pasos para el enriquecimiento de ADEVs a partir de plasma humano. Se basa en una precipitación basada en polímeros de la fracción total de EV, seguida de una inmunocaptura de VE de astrocitos. Dadas las importantes funciones de los astrocitos, el análisis de los ADEV puede arrojar luz para el descubrimiento de biomarcadores y vías inflamatorias cerebrales que puedan estudiarse de forma no invasiva.
Access restricted. Please log in or start a trial to view this content.
Protocolo
La investigación descrita en este protocolo se ha llevado a cabo con muestras de plasma humano de donantes adultos sanos de ambos sexos (rango de edad 65,9-81,3 años, 45,5% mujeres), de la cohorte de la Iniciativa de Sant Pau en Neurodegeneración (SPIN), Barcelona, España36. Los participantes dieron su consentimiento informado. El estudio se ha llevado a cabo siguiendo las directrices éticas internacionales para la investigación médica contenidas en la declaración de Helsinki y la legislación española. El Comité de Ética de la Investigación de Sant Pau (CEIC) revisó y aprobó el protocolo de recogida y almacenamiento de muestras de plasma humano de la cohorte SPIN (#16/2013).
1. Enriquecimiento de astrocitos EV a partir de plasma humano
NOTA: Este protocolo implica el uso de muestras de plasma humano. Todos los detalles sobre los reactivos y el material de laboratorio utilizados en este protocolo se incluyen en la Tabla de Materiales. No se requiere ningún equipo especial para este procedimiento, sin embargo, revise las consideraciones de seguridad de cada reactivo, según lo especificado individualmente por cada fabricante.
- Recogida y almacenamiento de muestras
- Recolectar sangre en tubos vacutainer de EDTA lavanda, siguiendo protocolos estandarizados para la recolección de plasma36,37. Centrifugar a 2000 x g durante 10 min a 4 °C dentro de 30-120 min después de la recolección para la separación por plasma. Separe el plasma, que es el líquido claro superior que aparece como sobrenadante, en alícuotas de 500 μL.
- Para eliminar los restos de celdas, centrifugar las alícuotas a 3000 x g durante 15 min a temperatura ambiente. Recuperar el sobrenadante. Almacene el plasma a -80 °C hasta el análisis. Como es práctica común para los análisis de biofluidos, alícuota las muestras antes del almacenamiento y evite más de tres ciclos de congelación y descongelación.
- Enriquecimiento total de vehículos eléctricos
NOTA: Todos los reactivos utilizados deben filtrarse a través de un filtro de 0,22 μm.- Descongelar 500 μL de muestras de plasma. Añadir trombina en una proporción de 1:100 para eliminar los factores de coagulación. Mezclar por inversión tres veces y dejar reposar durante 5 min a temperatura ambiente.
- Complete el volumen hasta alcanzar 1 mL con la solución de trabajo salina tamponada con fosfato (DPBS) de Dulbecco: DPBS + cóctel de inhibidores de proteasa concentrado 3x (diluido a partir de 10 veces el stock de cóctel de inhibidores de proteasa). Mezclar por inversión.
- Centrifugar las muestras a 6000 x g durante 20 min a 4 °C. Recuperar el sobrenadante. Complete el volumen con la solución de trabajo DBPS para alcanzar 1 mL.
- Añadir 252 μL de la solución de precipitación EV y mezclar por inversión tres veces. Incubar a 4 °C durante 60 min.
- Centrifugar las muestras a 1500 x g durante 20 min a 4 °C para precipitar la fracción total de EV (pellet). Recoja 1 mL del sobrenadante. Etiquete la fracción como plasma empobrecido en EV para utilizarla como control negativo de los marcadores de enriquecimiento de EV (sin EV) y almacene a -80 °C.
- Centrifugar el pellet restante a 1500 x g durante 5 min a 4 °C. Deseche el sobrenadante restante. Vuelva a suspender el pellet en 500 μL de agua ultrapura que contenga inhibidores concentrados de proteasa y fosfatasa (concentración final 3x, diluida a partir de un stock de 100x, ver Tabla de Materiales).
- Pipetear hacia arriba y hacia abajo vigorosamente para aflojar el pellet, evitando la formación de espuma; Agitar en un agitador de tubo giratorio durante 30 minutos a temperatura ambiente hasta la resuspensión completa. Asegurar la resuspensión completa de los pellets, ya que es un paso crítico para el siguiente paso de inmunocaptura.
- Inmunocaptura de ADEVs
NOTA: Los ADEV llevan marcadores de astrocitos. El marcador seleccionado para el enriquecimiento de ADEV mediante inmunocaptura es GLAST. GLAST, que significa transportador de glutamato-aspartato (UniProtKB-P43003), es el transportador de glutamato más abundante expresado predominantemente por los astrocitos en el cerebelo y el neocórtex cerebral38. El anticuerpo anti-GLAST (ACSA-1, antígeno de superficie celular de astrocitos-1) es específico para un epítopo extracelular de GLAST y ha sido desarrollado para la identificación de astrocitos. Es la diana más utilizada para la inmunocaptura de ADEVs a partir de plasma humano 12,20,34.- Añadir 10 μL de anticuerpo biotinilado anti-GLAST (ACSA-1) a cada muestra que contenga el preparado total de EV. Mezclar bien y suavemente. Incubar durante 1 h a 4 °C en un agitador de tubo giratorio.
- Añadir 10 μL de microperlas magnéticas conjugadas con anticuerpos monoclonales anti-biotina (IgG1 de ratón). Mezclar bien y suavemente. Incubar durante 1 h a 4 °C en un agitador de tubo giratorio.
- Coloque una microcolumna en el campo magnético de un separador MACS. Prepare la columna enjuagándola con 500 μL de PBS-0,5% albúmina sérica bovina (BSA). Deseche el flujo continuo.
- Cargue la suspensión EV/ACSA-1/microbead en la columna. No empuje con el émbolo en este paso. Recoja el flujo continuo. Etiquételo como EV no astrocítico (No ADEV) y manténgalo como control si es necesario.
- Lave la columna dos veces con 500 μL de PBS-0,5% BSA. Deseche el flujo continuo.
- Retire la columna del separador magnético y colóquela en un tubo de recolección de baja adherencia de 1,5 mL. Pipetea 500 μL de PBS-0,5% BSA en la columna. Empuje firmemente con un émbolo en la columna y recoja el eluido.
- Etiqueta como ACSA-1+ EV (ADEVs). Almacene los vehículos eléctricos no lisados a -20 °C durante períodos cortos o a -80 °C durante períodos más largos (>6 meses).
NOTA: Los anticuerpos anti-ACSA-1 se unirán al epítopo GLAST-1/EAAT-1. Las microperlas magnéticas se unirán con afinidad al complejo anti-ACSA-1-EV. Las microcolumnas MACS contienen una matriz optimizada para generar un fuerte campo magnético cuando se colocan en un imán, que es necesario para retener los ADEV etiquetados.
Para obtener una representación esquemática del procedimiento de enriquecimiento de ADEV, consulte la Figura 1.
- Lisis de vehículos eléctricos
NOTA: Los EV deben estar completamente lisados para la detección de marcadores intravesiculares. Se recomienda el uso de dos métodos secuenciales, como el químico seguido de la lisis mecánica.- Realizar una lisis química de los EV añadiendo reactivo de extracción de proteínas (ver Tabla de Materiales) en una proporción de 100 μL de muestra por 150 μL de reactivo de extracción. Agregue 100x inhibidores de proteasa y fosfatasa para alcanzar una concentración final 1x. Agite vigorosamente y deje reposar a temperatura ambiente durante 15 minutos.
- Realice una lisis mecánica mediante un procedimiento de dos pasos: pase la solución EV lisada químicamente a través de una jeringa dos veces (aguja G29). A continuación, sonique las muestras durante 45 s en un baño ultrasónico de agua fría. Congele los EV lisados a -80 °C.
- Descongele las muestras a 37 °C durante 5 min. Congelar de nuevo a -80 °C para el almacenamiento de vehículos eléctricos lisados. Descongele nuevamente durante 5 minutos a 37 °C antes del análisis.
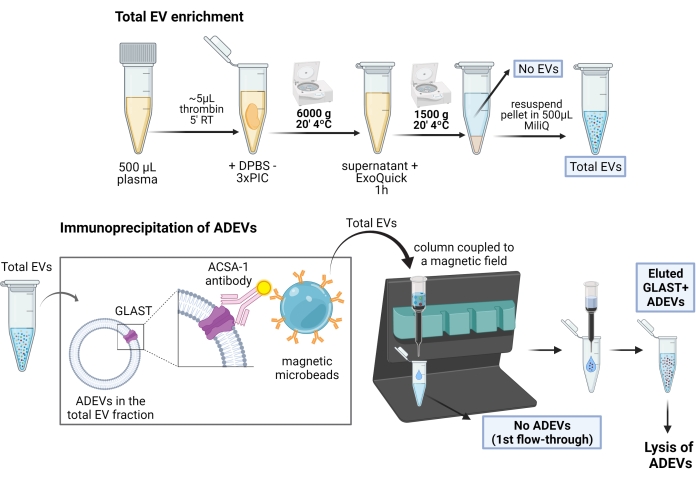
Figura 1: Representación esquemática del procedimiento de dos pasos para el enriquecimiento de EVs derivadas de astrocitos. En el primer paso, los VE se enriquecen a partir de plasma humano desfibrilado mediante pasos de precipitación y centrifugación basados en polímeros. Después de la resuspensión total de EV, los VE de astrocitos se seleccionan mediante inmunocaptura con anticuerpos anti-GLAST biotinilados (ACSA-1) y microesferas magnéticas anti-biotina. Abreviaturas: ACSA-1 = antígeno 1 de superficie de la célula de astrocitos; ADEVs = vesículas extracelulares derivadas de astrocitos; DPBS = solución salina tamponada con fosfato de Dulbecco; EV = vesículas extracelulares; GLAST = transportador de glutamato-aspartato; Sin ADEVs = vesículas extracelulares no astrocíticas; Sin EV = Sin vesículas extracelulares (plasma empobrecido por EV); PIC = cóctel de inhibidores de proteasa; RT = temperatura ambiente. Figura creada con BioRender. Haga clic aquí para ver una versión más grande de esta figura.
2. Validación de protocolo
- Caracterización de la fracción total de EV antes de la inmunocaptura
- Utilice EV totales lisados (pellets resuspendidos después de la precipitación del polímero) y muestras de plasma diluido para el análisis de Western blot. Complemente las muestras con 4 tampones de muestra Laemmli (5 μL para 15 μL de muestra), hierva durante 10 minutos a 90 °C y cárguelo en geles de acrilamida sin manchas al 10%.
- Realice la electroforesis en gel de poliacrilamida SDS (SDS-PAGE) en tampón Tris/Glycine/SDS a 80 V durante 30 min, seguido de 200 V durante 40 min. Después de la SDS-PAGE, retire el gel de las placas de vidrio y visualice el contenido total de proteínas después de una excitación UV de 1 min.
- Transfiera las proteínas del gel a una membrana de PVDF de 0,2 μm activada por metanol a través de un sistema semiseco a 25 V, 2,5 A durante 10 minutos (consulte la Tabla de materiales para obtener detalles sobre el equipo). Después de la transferencia, bloquee la membrana en tampón de bloqueo durante 5 min a temperatura ambiente y posteriormente incube durante la noche a 4 °C con los anticuerpos primarios contra Alix (1:1000), CD9 (1:1000) o Calnexin (1:1000); consulte la Tabla de materiales para obtener más detalles.
- Lavar la membrana en solución salina tamponada con Tris con 0,1% Tween 20 (TBST) tres veces durante 10 min e incubar durante 1 h a temperatura ambiente con un anticuerpo secundario anti-conejo HRP diluido a 1:7500 en tampón de bloqueo. Lave la membrana en TBST cuatro veces durante 10 min. Realice todos los lavados y pasos de incubación con una suave agitación de la membrana en un balancín de banco.
- Mezclar en una proporción de 1:1 la solución quimioluminiscente con el tampón de peróxido e incubar las membranas durante 5 min a temperatura ambiente. Exponga y adquiera bandas utilizando un sistema de imágenes de quimioluminiscencia (consulte la Tabla de materiales para obtener más detalles).
- Validación del enriquecimiento de marcadores específicos de astrocitos en la fracción ADEV
NOTA: La proteína ácida fibrilar glial (GFAP) es la principal proteína de filamento intermedio en las células astrocíticas y un elemento esencial de su citoesqueleto durante el desarrollo. El GFAP puede detectarse en el tejido cerebral y en los biofluidos, siendo un marcador de astrocitos bien conocido39. Por lo tanto, este marcador se cuantificó utilizando una tecnología comercial de detección de biomarcadores para demostrar el enriquecimiento de marcadores derivados de astrocitos en la fracción ADEV. Esta tecnología de biomarcadores es una técnica ultrasensible que permite la medición de moléculas individuales de proteínas con una sensibilidad de hasta 1.000 veces mayor que los inmunoensayos convencionales. Esta técnica se basa en el uso de micropartículas paramagnéticas acopladas a anticuerpos diseñados para unirse a dianas específicas40,41 (ver Tabla de Materiales).- Utilice muestras de EV lisadas para el análisis de biomarcadores. Para probar el enriquecimiento de los marcadores de astrocitos, compare los niveles de GFAP en el eluido (ADEVs) versus los de flujo (No ADEVs) utilizando un inmunoensayo ultrasensible comercial.
- Diluir las muestras en una proporción de 1:4 (25 μL de EVs + 75 μL de tampón de ensayo), preparar los calibradores y realizar el ensayo en el equipo de detección de biomarcadores, según lo especificado en las instrucciones del fabricante (ver Tabla de Materiales). Las muestras se pueden diluir directamente en la placa.
- Pruebe las muestras y los calibradores por duplicado. El rango de cuantificación para el ensayo GFAP fue de 1,37-1000 pg/mL. Utilice la plataforma de análisis de software del fabricante para calcular las concentraciones de GFAP a partir de la curva de calibración.
- Para estimar el coeficiente de variación (CV) del protocolo para el enriquecimiento de marcadores de astrocitos, se midieron los niveles de GFAP en preparaciones de ADEV obtenidas a partir de réplicas idénticas de muestras de plasma humano agrupadas y se calculó el CV como desviación estándar/media x 100. En este protocolo, el CV se calculó utilizando N = 10 muestras de plasma idénticas.
- Validación del enriquecimiento de marcadores EV en la fracción ADEV
- Para validar el enriquecimiento de los marcadores de EV, mida los niveles de Alix y CD81 mediante ELISA (consulte la Tabla de materiales) en muestras de EV lisadas sin diluir, siguiendo las recomendaciones del fabricante. Muestras de prueba y calibradores por duplicado.
- Lea las placas a 450 nm y 570 nm utilizando un lector de microplacas. Utilice una curva de calibración lineal para calcular las concentraciones de Alix y CD81. El rango de cuantificación para el ensayo Alix fue de 47-3000 pg/mL y para CD81 fue de 0,156-10 ng/mL.
- Caracterización del tamaño y morfología de los ADEV
- Análisis de seguimiento de nanopartículas
- Utilice el análisis de seguimiento de nanopartículas (NTA) para medir la concentración de partículas y la distribución del tamaño de las preparaciones frescas de EV no lisadas.
- Diluya las suspensiones de ADEV frescas no lisadas (10 μL) con PBS filtrado de acuerdo con el rango de detección del instrumento (20-100 partículas/fotograma), utilizando el software suministrado, grabe tres videos de 60 s con los siguientes ajustes: caudal de la jeringa a 30 u.a., nivel de la cámara a 13 y umbral de detección a 5. Corrija las concentraciones de partículas para el volumen de la muestra de entrada, el volumen de resuspensión de EV y la dilución necesaria para la lectura de NTA.
NOTA: Se recomienda previsualizar una muestra que contenga la solución para vehículos eléctricos para verificar el efecto de la matriz y la pureza del medio en el que se resuspenden los vehículos eléctricos.
- Criomicroscopía electrónica
- Utilice la criomicroscopía electrónica (Cryo-EM) para confirmar la presencia y morfología de Evs en suspensiones frescas de ADEV no lisadas (4 μL). Vitrificar las muestras utilizando un congelador de inmersión comercial en rejillas de carbono Holey con los siguientes ajustes: 3,9 μL de muestra, tiempo de espera 10 s, tiempo de secado 2 s.
- Sumérjalo en etano-nitrógeno líquido en una estación de trabajo criogénica. Transfiera las rejillas a un criosoporte mantenido a -179 °C para el análisis de microscopio electrónico de transmisión. Examine los vehículos eléctricos con un microscopio electrónico de transmisión que funcione a una tensión de aceleración de 200 kV y esté equipado con una cámara CCD. Adquirir micrografías usando software.
- Análisis de seguimiento de nanopartículas
- Análisis de la co-precipitación de lipoproteínas
- Determine los niveles de ApoB humana en plasma sin diluir, muestras totales de EV lisadas y muestras de ADEV lisadas con un ensayo inmunoturbidimétrico utilizando un kit comercial adaptado para un autoanalizador comercial (consulte la Tabla de materiales para obtener más detalles).
- Análisis de marcadores inflamatorios en ADEVs
- Utilice un ensayo basado en perlas (consulte la tabla de materiales) para cuantificar la concentración de 25 marcadores inflamatorios: eotaxina, IFN Alfa2, IFN Gamma, IL-1 Alfa, IL-1 Beta, IL-3, IL-6, IL-8, IL-10, IL-12 (p40), IL-12 (p70), IL-15, IL-17A, IL-17E/IL-25, IL-17F, IL-18, IP-10, MCP-1, MCP-3, MDC, MIP-1 Alfa, MIP-1 Beta, TGF Alfa, TNF Alfa, TNF Beta.
- Utilice preparaciones de EV lisadas sin diluir (25 μL) e incube las muestras con las perlas durante la noche a 4 °C, siguiendo las instrucciones del fabricante. Lavar la placa, incubar con 25 μL de anticuerpos de detección e incubar durante 1 h con agitación a temperatura ambiente.
- Añadir 25 μL de estreptavidina-PE a cada pocillo e incubar durante 30 min a temperatura ambiente. Añadir 150 μL de líquido de la vaina e incubar durante 5 min bajo agitación. Lea la placa en el lector de placas conectado al sistema.
NOTA: Esta técnica se basa en inmunoensayos que utilizan anticuerpos que se unen a la superficie de microperlas magnéticas recubiertas de fluorescente. Esta tecnología codifica internamente las microesferas por su color con diferentes tintes. Cada tipo de microesfera está recubierta con un anticuerpo de captura específico, de modo que múltiples perlas conjugadas capturan los analitos incrustados en las muestras, lo que permite la detección cuantitativa múltiple de docenas de analitos simultáneamente. El sistema utiliza la plataforma de inmunoensayo multiplexado basada en perlas para la detección de señales43.
3. Análisis de datos
- Realizar análisis estadísticos con software comercial. Evaluar la normalidad de los datos con la prueba de Shapiro-Wilk. Pruebe comparaciones de dos grupos con la prueba U de Mann-Whitney y comparaciones de tres grupos con la prueba de Kruskal-Wallis y la corrección post-hoc de Dunn. Establezca la significación en p < 0,05.
Access restricted. Please log in or start a trial to view this content.
Resultados
El aislamiento de los ADEVs a partir de plasma recogido de donantes sanos se llevó a cabo con éxito. Se empleó un método de precipitación basado en polímeros para obtener la fracción total de EV, seguido de una inmunocaptura con microperlas magnéticas para obtener ADEVs.
El análisis de Western blot de la fracción total de EV antes de la etapa de inmunocaptura indicó la falta de calnexina (marcador de contaminación celular) y la presencia de Alix y ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Los vehículos eléctricos han ganado un gran interés en la investigación biomédica debido a su potencial diagnóstico y terapéutico. En la actualidad, uno de los principales hándicaps relacionados con los métodos de aislamiento de VE es la falta de consenso metodológico y de protocolos estandarizados. Este estudio proporciona un protocolo detallado para el enriquecimiento de astrocitos EV a partir de plasma humano a través de la precipitación basada en polímeros y la ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
El Dr. Belbin informó haber recibido honorarios personales de ADx NeuroSciences fuera del trabajo presentado. El Dr. Alcolea informó haber recibido honorarios personales por servicios de consejo asesor y/o honorarios de ponente de Fujirebio-Europe, Roche, Nurtricia, Krka Farmacéutica, Zambon S.A.U. y Esteve fuera del trabajo presentado. El Dr. Lleó ha trabajado como consultor o en consejos asesores de Fujirebio-Europe, Roche, Biogen, Grifols y Nutricia fuera de los trabajos presentados. El Dr. Fortea informó haber recibido honorarios personales por su servicio en los consejos asesores, comités de adjudicación u honorarios de orador de AC Immune, Novartis, Lundbeck, Roche, Fujirebio y Biogen fuera del trabajo presentado. Los Dres. Alcolea, Belbin, LLeó y Fortea informan de que son titulares de una patente de marcadores de sinaptopatía en enfermedades neurodegenerativas (licenciada a ADx, EPI8382175.0). No se reportaron otras revelaciones. Todos los demás autores no tienen nada más que revelar.
Agradecimientos
Los autores agradecen la ayuda de Soraya Torres, Shaimaa El Bounasri El Bennadi y Oriol Sánchez López en la manipulación y preparación de las muestras. También queremos agradecer la colaboración de José Amable Bernabé, de la ICTS "NANBIOSIS", unidad 6 (Unidad del CIBER en Bioingeniería, Biomateriales y Nanomedicina) del Barcelona Materials Science Institute, Martí de Cabo Jaume de la Unidad de Microscopía Electrónica de la Universitat Autònoma de Barcelona, la Dra. Marta Soler Castany y Lia Ros Blanco de la Plataforma de Citometría de Flujo del Instituto de Investigación Biomédica de Sant Pau (IIB-Sant Pau), así como al Dr. Joan Carles Escolà-Gil del grupo de Fisiopatología de las enfermedades relacionadas con lípidos del IIB-Sant Pau por su ayuda en las determinaciones de NTA, crio-EM, Luminex y ApoB, respectivamente.
Los autores agradecen el apoyo financiero de la Fundación Jérôme Lejeune (Proyecto #1941 y #1913 a MFI y MCI), el Instituto de Salud Carlos III (PI20/01473 a JF, PI20/01330 a AL, PI18/00435 a DA e INT19/00016 a DA), el Instituto Nacional de Salud (1R01AG056850-01A1, R21AG056974 y R01AG061566 a JF), la Alzheimer's Association y el Global Brain Health Institute (GBHI_ALZ-18-543740 a MCI), la Asociación para la Degeneración Frontotemporal (Beca Postdoctoral de Investigación Clínica, AFTD 2019-2021) a ODI, y la Societat Catalana de Neurologia (Premi Beca Fundació SCN 2020 a MCI). Este trabajo también fue apoyado por el programa CIBERNED (Programa 1, Enfermedad de Alzheimer a AL y estudio SIGNAL. SS es beneficiario de una beca postdoctoral "Juan de la Cierva-Incorporación" (IJC2019-038962-I) de la Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
Referencias
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71(2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931(2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278(2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452(2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618(2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511(2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913(2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65(2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados