Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Microtensómetro para microscopía confocal Visualización de interfaces dinámicas
En este artículo
Resumen
Este manuscrito describe el diseño y operación de un microscopio microtensómetro/confocal para realizar mediciones simultáneas de tensión interfacial y reología dilatacional superficial mientras visualiza la morfología interfacial. Esto proporciona la construcción en tiempo real de relaciones estructura-propiedad de interfaces importantes en tecnología y fisiología.
Resumen
La adsorción de moléculas tensoactivas a interfaces fluido-fluido es omnipresente en la naturaleza. La caracterización de estas interfaces requiere medir las tasas de adsorción de surfactante, evaluar las tensiones superficiales de equilibrio en función de la concentración de surfactante a granel y relacionar cómo cambia la tensión superficial con los cambios en el área interfacial después del equilibrio. La visualización simultánea de la interfaz mediante imágenes de fluorescencia con un microscopio confocal de alta velocidad permite la evaluación directa de las relaciones estructura-función. En el microtensiómetro de presión capilar (CPM), una burbuja de aire hemisférica se fija al final del capilar en un depósito líquido de 1 ml de volumen. La presión capilar a través de la interfaz de burbujas se controla a través de un controlador de flujo microfluídico comercial que permite el control de presión, curvatura de burbujas o área de burbujas basado en modelos basado en la ecuación de Laplace. En comparación con técnicas anteriores como el canal de Langmuir y la caída colgante, la precisión de medición y control y el tiempo de respuesta se mejoran considerablemente; Las variaciones de presión capilar se pueden aplicar y controlar en milisegundos. La respuesta dinámica de la interfaz de la burbuja se visualiza a través de una segunda lente óptica a medida que la burbuja se expande y se contrae. El contorno de burbuja se ajusta a un perfil circular para determinar el radio de curvatura de la burbuja, R, así como cualquier desviación de la circularidad que invalide los resultados. La ecuación de Laplace se utiliza para determinar la tensión superficial dinámica de la interfaz. Después del equilibrio, la bomba microfluídica controlada por computadora puede imponer pequeñas oscilaciones de presión para oscilar el radio de burbuja (frecuencias de 0.001-100 ciclos / min) para determinar el módulo dilatacional Las dimensiones generales del sistema son lo suficientemente pequeñas como para que el microtensómetro quepa bajo la lente de un microscopio confocal de alta velocidad que permite rastrear cuantitativamente las especies químicas marcadas fluorescentemente con resolución lateral submicrona.
Introducción
Las interfaces aire-agua cubiertas por películas de surfactante son omnipresentes en la vida diaria. Las inyecciones de agua de surfactante se utilizan para mejorar la recuperación de petróleo de campos agotados y se utilizan como soluciones de fracturación hidráulica para gas y petróleo de esquisto. Las espumas gas-líquido y las emulsiones líquido-líquido son comunes a muchos procesos industriales y científicos como lubricantes y agentes de limpieza y son comunes en los alimentos. Los surfactantes y las proteínas en las interfaces estabilizan las conformaciones de anticuerpos durante el envasado, almacenamiento y administración 1,2,3,4,5, la estabilidad de la película lagrimal en el ojo 6,7,8 y la mecánica pulmonar 9,10,11,12,13,14, 15.
El estudio de los agentes tensioactivos o tensioactivos que se adsorben a las interfaces y sus propiedades tiene una larga historia con muchas técnicas experimentales diferentes 16,17,18,19,20,21,22,23,24,25,26,27 . Un desarrollo reciente es el microtensómetro de presión capilar (CPM), que permite el examen de las propiedades interfaciales en interfaces altamente curvas, a escalas de longitud mucho más pequeñas, mientras que utiliza significativamente menos materiales que otros métodos comunes 9,23,24,25. La microscopía de fluorescencia confocal (CFM) se puede utilizar para estudiar la morfología de lípidos y proteínas en las interfaces aire-agua en la CPM22 o en los canales de Langmuir 20,26,27,28,29. Aquí se han combinado un CPM y un CFM para conectar fenómenos morfológicos con propiedades interfaciales dinámicas y de equilibrio para desarrollar relaciones estructura-función para interfaces biológicas y tecnológicas.
Existen numerosos parámetros de importancia en los sistemas de surfactantes interfaciales accesibles al CPM-CFM. En el CPM, una burbuja de aire de 30-200 μm de diámetro se fija a la punta de un tubo capilar de vidrio. En versiones anteriores del CPM, la diferencia de presión capilar entre el interior y el exterior de la burbuja se controlaba a través de una columna de agua y una bomba de jeringa oscilatoria 9,30 ; la nueva versión descrita aquí los reemplaza con una bomba microfluídica controlada por computadora de mayor precisión. La tensión superficial (γ) se determina a través de la ecuación de Laplace, ΔP = 2γ/R, a partir de la caída de presión a través de la interfaz establecida por la bomba, ΔP, y el análisis óptico del radio de curvatura de la burbuja, R. La tensión superficial dinámica de la interfaz se puede determinar con una resolución de tiempo de 10 ms después de la generación de una nueva burbuja en contacto con un líquido a granel que contiene un surfactante soluble. La dinámica de adsorción del surfactante se puede describir mediante la ecuación clásica de Ward-Tordai10,31 para determinar las propiedades esenciales del surfactante, incluida la difusividad, la cobertura superficial y la relación entre la concentración a granel y la tensión superficial de equilibrio. Una vez que se alcanza una tensión superficial de equilibrio, el área interfacial se puede oscilar para medir el módulo dilatacional, 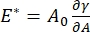 registrando los cambios en la tensión superficial, inducidos por pequeños cambios en el área de superficie de la burbuja, A32. Para interfaces más complejas que desarrollan sus propias estructuras internas como polímeros o proteínas entrelazadas, la tensión superficial, , se sustituye por una tensión superficial más general 4,33,
registrando los cambios en la tensión superficial, inducidos por pequeños cambios en el área de superficie de la burbuja, A32. Para interfaces más complejas que desarrollan sus propias estructuras internas como polímeros o proteínas entrelazadas, la tensión superficial, , se sustituye por una tensión superficial más general 4,33, 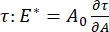 .
.
La estabilidad pulmonar durante la respiración puede estar directamente relacionada con el mantenimiento de una tensión superficial baja y un módulo dilatacional alto en la interfaz aire-líquido alveolar 9,10. Todas las superficies pulmonares internas están revestidas con una película continua de micras de espesor de líquido de revestimiento epitelial para mantener la hidratación del tejido34. Este líquido de revestimiento epitelial es principalmente agua, con sales y varias otras proteínas, enzimas, azúcares y surfactante pulmonar. Como es el caso de cualquier interfaz curva líquido-vapor, se induce una presión capilar con la presión más alta en el interior del alvéolo (o burbuja). Sin embargo, si la tensión superficial fuera constante en todas partes dentro de los pulmones, la ecuación de Laplace, ΔP = 2γ / R, muestra que los alvéolos más pequeños tendrían una presión interna más alta en relación con los alvéolos más grandes, lo que obligaría a los contenidos de gas de los alvéolos más pequeños a fluir a alvéolos más grandes y de menor presión. Esto se conoce como "Inestabilidad de Laplace"9,35. El resultado neto es que los alvéolos más pequeños colapsarían y se llenarían de líquido y se volverían difíciles de volver a inflar, lo que haría que parte del pulmón colapsara, y otras partes se inflarían en exceso, los cuales son síntomas típicos del síndrome de dificultad respiratoria aguda (SDRA). Sin embargo, en un pulmón que funciona correctamente, la tensión superficial cambia dinámicamente a medida que la interfaz aire-líquido epitelial en el área interfacial del alvéolo se expande y se contrae durante la respiración. Si 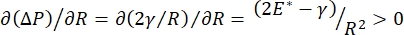 , o
, o 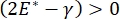 , la presión de Laplace disminuye con el radio decreciente y aumenta con el aumento del radio para eliminar la inestabilidad de Laplace, estabilizando así el pulmón9. Por lo tanto,
, la presión de Laplace disminuye con el radio decreciente y aumenta con el aumento del radio para eliminar la inestabilidad de Laplace, estabilizando así el pulmón9. Por lo tanto, 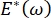 y cómo depende de la frecuencia, la morfología y composición monocapa, y la composición del líquido alveolar pueden ser esenciales para la estabilidad pulmonar. El CPM-CFM también ha proporcionado las primeras demostraciones de los efectos de la curvatura interfacial sobre la adsorción de surfactante25, la morfología monocapa22 y el módulo dilatacional9. El pequeño volumen (~1 ml) del reservorio en el CPM permite la rápida introducción, eliminación o intercambio de la fase líquida y minimiza la cantidad requerida de proteínas o surfactantes costosos10.
y cómo depende de la frecuencia, la morfología y composición monocapa, y la composición del líquido alveolar pueden ser esenciales para la estabilidad pulmonar. El CPM-CFM también ha proporcionado las primeras demostraciones de los efectos de la curvatura interfacial sobre la adsorción de surfactante25, la morfología monocapa22 y el módulo dilatacional9. El pequeño volumen (~1 ml) del reservorio en el CPM permite la rápida introducción, eliminación o intercambio de la fase líquida y minimiza la cantidad requerida de proteínas o surfactantes costosos10.
El contraste en una imagen CPM-CFM se debe a la distribución de pequeñas fracciones de lípidos o proteínas marcados fluorescentemente en la interfaz16,27. Las monocapas de surfactante bidimensional a menudo exhiben separación de fase lateral en función de la tensión superficial o la presión superficial, 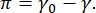 π es la diferencia entre la tensión superficial de una interfaz fluido-fluido limpia, γ0, y una interfaz cubierta de surfactante, γ. π puede pensarse como la "presión" 2-D causada por las interacciones de las moléculas de surfactante en la interfaz que actúa para reducir la tensión superficial del fluido puro. A bajas presiones superficiales, las monocapas lipídicas están en un estado desorganizado similar al líquido; esto se conoce como la fase de expansión líquida (LE). A medida que aumenta la presión superficial y disminuye el área por molécula lipídica, los lípidos se orientan entre sí y pueden sufrir una transición de fase de primer orden a la fase condensada líquida ordenada (LC) de largo alcance 16,20,27. Las fases LE y LC pueden coexistir a varias presiones superficiales y se pueden visualizar a medida que los lípidos marcados fluorescentemente se excluyen de la fase LC y se segregan a la fase LE. Por lo tanto, la fase LE es brillante y la fase LC es oscura cuando se visualiza con CFM16.
π es la diferencia entre la tensión superficial de una interfaz fluido-fluido limpia, γ0, y una interfaz cubierta de surfactante, γ. π puede pensarse como la "presión" 2-D causada por las interacciones de las moléculas de surfactante en la interfaz que actúa para reducir la tensión superficial del fluido puro. A bajas presiones superficiales, las monocapas lipídicas están en un estado desorganizado similar al líquido; esto se conoce como la fase de expansión líquida (LE). A medida que aumenta la presión superficial y disminuye el área por molécula lipídica, los lípidos se orientan entre sí y pueden sufrir una transición de fase de primer orden a la fase condensada líquida ordenada (LC) de largo alcance 16,20,27. Las fases LE y LC pueden coexistir a varias presiones superficiales y se pueden visualizar a medida que los lípidos marcados fluorescentemente se excluyen de la fase LC y se segregan a la fase LE. Por lo tanto, la fase LE es brillante y la fase LC es oscura cuando se visualiza con CFM16.
El objetivo de este manuscrito es describir los pasos necesarios para construir y operar el microtensómetro combinado de microscopio confocal. Esto permitirá al lector realizar estudios de adsorción, medir la tensión superficial, el comportamiento reológico y examinar la morfología interfacial simultáneamente en una interfaz aire/agua o aceite/agua a escala micrométrica. Esto incluye una discusión sobre cómo tirar, cortar e hidrofobizar los capilares requeridos, instrucciones para usar los modos de control de presión, curvatura y área de superficie, y transferencia interfacial de surfactante insoluble a la interfaz curva del microtensiómetro.
Protocolo
1. Preparación de tubos capilares
- Coloque el capilar en un extractor capilar y ejecute el programa de tracción deseado para hacer dos capilares cónicos con un diámetro exterior (OD) de ~ 1 μm en la punta.
NOTA: El OD del capilar antes de tirar debe ser el OD especificado para caber en el soporte capilar en la celda del microtensómetro. El diámetro interno (ID) del capilar puede variar, pero afectará el radio crítico del capilar después de tirar. Se elige un programa de tracción para que la contracción resultante reduzca inicialmente el OD capilar y el ID rápidamente, luego alcance un radio cerca del OD capilar y el ID deseados, y luego reduzca el diámetro más lentamente. Esto creará una mayor longitud capilar que se puede puntuar para producir un capilar utilizable de 30-100 μm en ID. - Puntúe la punta del capilar en el lugar deseado para obtener una identificación de 30-100 μm y romper la punta. El capilar ahora tendrá un OD e ID del radio deseado en la punta (Figura 1A). Los capilares se pueden almacenar hasta el paso 2.
NOTA: El borde cortado del capilar debe ser una rotura limpia de 90°. Cualquier defecto en el borde cortado conducirá a una mala fijación de la burbuja al capilar y a malas mediciones de la propiedad de la superficie. Las puntas capilares cónicas son muy delicadas. Se destruirán si entran en contacto con algo que no sean las soluciones (por ejemplo, paredes viales, boquilla de aire).
2. Hidrofobización de capilares
- Reúna los capilares de vidrio tirado, la solución de limpieza ácida, las pinzas de plástico, el agua desionizada (DI), la solución de hidrofobización (2% de silano en etanol), la bomba de vacío y la solución de etanol. Consulte la Tabla de materiales para obtener más información.
PRECAUCIÓN: La solución de limpieza ácida es extremadamente tóxica, causa corrosión / irritación de la piel y los ojos, es oxidante. La solución de hidrofobización es un irritante cutáneo/ocular/respiratorio. Use protección para los ojos, batas de laboratorio y guantes y trabaje con soluciones en una campana extractora de humos. - Limpiar con ácido el capilar
NOTA: La limpieza ácida del capilar elimina cualquier residuo orgánico dentro del capilar y prepara la superficie del vidrio para la reacción de silanización que hace que el capilar sea hidrófobo.- Agarra un capilar firmemente cerca de su extremo ancho con las pinzas.
- Sumerja la punta cónica en la solución de limpieza ácida mientras conecta la manguera de la bomba de vacío al extremo ancho del capilar. Esto succionará la solución en el capilar.
NOTA: Se puede unir una punta de pipeta al extremo de la manguera capilar para permitir un mejor ajuste con el extremo capilar. - Deténgase cuando la solución de limpieza ácida haya llenado aproximadamente la mitad del capilar.
NOTA: Después de retirar la punta capilar de la solución de limpieza ácida, la solución en el exterior del capilar a menudo forma una cuenta cerca de la punta capilar. Toque suavemente el capilar hasta el cuello del vial de solución para eliminar el exceso de solución. - Permita que la solución de limpieza ácida permanezca en los capilares durante al menos 30 minutos, asegurando que el tapón del líquido permanezca en el extremo cónico del capilar.
- Retire la solución de limpieza ácida del capilar sosteniendo firmemente el capilar con las pinzas y usando la manguera de vacío para extraer el líquido del extremo grande del capilar.
- Enjuague el capilar
- Sumerja el extremo cónico del capilar en agua DI asegurándose de que esté sumergido lo suficientemente profundo como para cubrir cualquier exterior que se haya sumergido en la solución de limpieza ácida. Mientras la punta está sumergida, use la manguera de vacío para tirar del agua DI a través del capilar. Retire el capilar del agua y retire el agua restante con la manguera de vacío.
- Repita el paso anterior al menos 4 veces.
- Realice el paso 2.3 nuevamente sustituyendo el etanol por agua DI.
- Aplicar succión continuamente hasta que el etanol se evapore completamente del interior del capilar. El capilar se volverá turbio y frío al tacto a medida que el etanol comience a evaporarse, pero se aclarará después de 30 a 45 s.
- Cubra el capilar con la solución de hidrofobización
- Sumerja brevemente el extremo ancho del capilar en el silano ~ 2% en solución de etanol. La acción capilar hará que la solución de recubrimiento se eleve dentro del capilar. Retire el capilar de la solución una vez que un tapón de ~ 1 cm de tamaño se haya elevado dentro del capilar.
- Oriente el capilar de modo que la punta cónica mire hacia abajo, permitiendo que la solución de recubrimiento caiga con gravedad hacia la punta cónica.
- Deje que la solución de recubrimiento permanezca en el capilar durante al menos 3 min.
NOTA: No debe haber burbujas de aire en el tapón de la solución de recubrimiento que esté en contacto con el interior de la punta cónica. Si hay una burbuja de aire, entonces el interior capilar probablemente no estaba lo suficientemente seco en el paso 2.5. Para remediar esto, repita los pasos 2.4-2.6 según sea necesario.
- Enjuague los capilares con etanol 1x de la misma manera que el paso 2.3.
- Coloque el recubrimiento hidrófobo en el capilar
- Coloque los viales de centelleo limpios y secos en un horno al vacío a 120 °C. Coloque los capilares recubiertos en los viales (idealmente un capilar por vial) con extremos anchos que descansan sobre la base del vial. Permita que los capilares permanezcan en el horno durante al menos 6 h (se prefiere durante la noche) para lograr la unión permanente de la capa de silano hidrófobo a los capilares. Los capilares se pueden almacenar hasta el paso 4.
3. Preparación y almacenamiento de muestras
- Mezcle y almacene las soluciones de surfactante y fluoróforo en viales limpios lavados con ácido para evitar la contaminación.
NOTA: Los lípidos disponibles comercialmente deben ser de la más alta pureza y almacenarse entre usos a - 20 °C. Los lípidos viejos o contaminados a menudo hacen que los resultados sean difíciles de reproducir.
4. Configuración del microtensómetro
- Ensamble la celda CPM como se describe en la Figura 2.
- Coloque el lado grande del capilar en la parte superior de la célula CPM hasta que empuje hacia la parte inferior de la célula.
- Apriete suavemente el tapón PEEK para asegurar el capilar y luego conecte el tubo de la bomba microfluídica al lado grande del capilar. Tenga cuidado de no tocar la punta capilar cónica.
- Según sea necesario, conecte las mangueras de intercambio de depósito y/o de control de temperatura a las entradas y salidas respectivas en la celda CPM (Figura 2); de lo contrario, enchufe las entradas y tomas de corriente no utilizadas.
- Conecte la célula CPM a la etapa del microscopio confocal, alineándola aproximadamente con el objetivo CFM, la cámara CPM y la fuente de luz CPM (Figura 3).
- Abra el flujo de gas a la bomba microfluídica a la presión de funcionamiento recomendada de la bomba (150 mbar para la bomba microfluídica utilizada aquí) y asegúrese de que el flujo hacia el capilar esté abierto.
- Comience a ejecutar la interfaz virtual CPM (Supplemental Coding File 1: Microtensiometer Virtual Interface.vi) en modo de control de presión con la frecuencia de oscilación y amplitud de la presión capilar establecidas en cero (Figura 4-7). La figura 4 muestra una captura de pantalla de la interfaz virtual. Para el agua DI y un radio capilar de ~ 35 μm, una presión de ~ 20 mbar asegura que no entre agua en el capilar.
- Llene la celda CPM con agua con una pipeta.
- Enfoque en la punta capilar con la cámara del microtensómetro.
- Concéntrese en la punta capilar con el CFM. Si hay dificultad para encontrar el capilar, use la cámara CPM para encontrar el objetivo CFM. Esto ayudará a aproximar la distancia entre el objetivo CFM y la burbuja, logrando la distancia de trabajo correcta.
- Después de que el anillo (proyección del sector verde) se centre en la burbuja, ajuste manualmente el enfoque para que el borde de la burbuja se pueda ver claramente (Figura 4-3).
NOTA: La posición, el ángulo de inicio y final, y los radios interno y externo del anillo se pueden ajustar a través del menú debajo de la ventana de vista. - Haga clic en Restablecer burbuja y asegúrese de que se forme una nueva burbuja (uno podrá escuchar el estallido de la burbuja anterior y la nueva burbuja será observable desde la ventana de visualización del panel de control; Figura 4-3). Si la burbuja no aparece, aumente la presión de restablecimiento o aumente el tiempo de retardo de restablecimiento en la pestaña Restablecimiento de burbuja debajo de la ventana de visualización. Compruebe si la tensión superficial es de alrededor de 73 mN/m (para burbujas salinas o de agua/aire) (Figura 4-9).
- Saque el agua a través de la jeringa directa a la célula (Figura 3-13), vacíela y vuelva a colocarla. La muestra está lista para cargarse para ejecutar el experimento.
5. Estudio de adsorción
- Llene la celda con la muestra deseada utilizando una pipeta en autoclave manteniendo el software CPM en modo de control de presión . Asegúrese de que la tensión superficial inicial sea de alrededor de 73 mN/m cuando se cree una nueva interfaz de burbujas.
- Determine el radio de la burbuja recién formada e introduzca ese valor en el control de área de la línea central (Figura 4-7) y cambie el tipo de control a control de área haciendo clic en la ficha Control de área (Figura 4-8).
NOTA: También se puede utilizar el control de presión constante, pero esto hace que el radio de la burbuja cambie continuamente a medida que cambia la tensión superficial de la interfaz. Esta área cambiante puede complicar el análisis de las tasas de adsorción de surfactante y hacer que la burbuja estalle durante el estudio. - Comience a grabar el video confocal.
- Haga clic en Restablecer burbuja (Figura 4-5) e inmediatamente haga clic en Recopilar datos (Figura 4-6). La luz de señalización en el botón se volverá verde.
- Ajuste la velocidad de registro de datos de acuerdo con la concentración de la muestra deslizando la barra que se muestra en la Figura 4-6. Para adsorciones más lentas, use una velocidad de grabación más lenta. Esto se puede ajustar en medio de una ejecución si se desea una velocidad de grabación más alta desde el principio, pero es preferible una tasa más lenta para estudios largos con el fin de reducir el tamaño del archivo.
- Después del final del experimento (cuando se haya alcanzado una meseta de tensión superficial final), guarde el archivo eligiendo la ruta correcta del archivo (Figura 4-1) y haciendo clic en el botón Guardar (Figura 4-2).
- Detenga y guarde la grabación en el CFM también.
6. Estudio de oscilación/relajación
- Llene la celda con la muestra utilizando una pipeta en autoclave manteniendo el software CPM en modo de control de presión . Asegúrese de que la tensión superficial sea de alrededor de 73 mN/ m cuando se cree una nueva interfaz de burbujas.
- Espere hasta que la muestra esté completamente adsorbida a la interfaz. Esto se puede realizar directamente después de un estudio de adsorción en lugar de comenzar de nuevo con una nueva interfaz de burbujas.
- Decida si la oscilación será una oscilación de presión, oscilación de área u oscilación de curvatura seleccionando la pestaña apropiada (Figura 4-8) e ingresando el valor de referencia deseado, el% de oscilación y la frecuencia de oscilación (Figura 4-7).
NOTA: También se puede acceder a las oscilaciones de área de onda triangular, cuadradas y de diente de sierra desde el menú desplegable de la pestaña Otra oscilación de área . - Inicie la grabación del video confocal y haga clic en Recopilar datos (Figura 4-6) en el software CPM.
- Inicie la oscilación. Asegúrese de registrar al menos siete ciclos para obtener los mejores resultados. Elija una tasa de adquisición de datos (Figura 4-6) para dar un número adecuado de puntos de datos para cada ciclo de oscilación.
- Si se desean otras amplitudes o frecuencias de oscilación, cambie los valores durante el experimento.
- Guarde los resultados como en los pasos 5.6 y 5.7.
7. Estudio de intercambio de disolventes
- Llene la celda con la muestra utilizando una pipeta en autoclave manteniendo el software CPM en modo de control de presión. Asegúrese de que la tensión superficial sea de alrededor de 73 mN / m, cuando se cree una nueva interfaz de burbujas.
NOTA: Los estudios de adsorción y/u oscilación se pueden realizar antes del estudio de intercambio de disolventes. - Conecte el tubo de entrada con la botella de solución de intercambio deseada (Figura 3-11) a la bomba peristáltica (Figura 3-10).
- Inicie la grabación del video en el software confocal y haga clic en Recopilar datos (Figura 4-6) en el software CPM.
- Ajuste la velocidad de la bomba peristáltica. Esto controlará la tasa de intercambio de fluidos y debe elegirse en función de los requisitos para el experimento, es decir, qué tan rápido se debe intercambiar el solvente.
- Si es necesario intercambiar varios fluidos, detenga la bomba peristáltica y conecte la entrada a otra solución de intercambio.
- Una vez finalizado el intercambio (~20 min), guarde los resultados como en los pasos 5.6 y 5.7.
8. Adsorción de surfactante insoluble
NOTA: Si el surfactante a adsorber no es soluble en el líquido reservorio, este método se puede utilizar para transferir una monocapa desde la interfaz aire/agua de la célula a la superficie de la burbuja. Muchos lípidos formadores de bicapa son casi insolubles en solución salina y no se absorben espontáneamente a la burbuja cuando están suspendidos en la solución reservorio.
- Llene la celda con la muestra utilizando una pipeta en autoclave manteniendo el software CPM en modo de control de presión . Asegúrese de que la tensión superficial sea de alrededor de 73 mN / m, cuando se cree una nueva interfaz de burbujas.
- Depositar una monocapa de surfactante insoluble en la interfaz aire-agua de la célula a partir de una solución en una solución orgánica volátil. Usando una jeringa, deposite pequeñas gotas en la interfaz y permita que el solvente se evapore dejando el lípido como una película delgada.
PRECAUCIÓN: El cloroformo se utiliza como disolvente para fosfolípidos como fosfatidilcolinas y ácidos grasos. Las soluciones para untar suelen ser 0.01-0.02 mg de lípido por ml del solvente. El cloroformo es extremadamente tóxico, puede causar irritación de la piel y los ojos, y es cancerígeno. Use protección ocular adecuada, bata de laboratorio y guantes y haga la solución en una campana extractora de humos. - Disminuya el área de superficie a través del control de presión de la línea central (Figura 4-7) de la burbuja hasta que esté casi plana. Esto evita que la burbuja estalle después de que el surfactante se haya adsorbido.
- Retire el líquido del depósito de la célula a través de la jeringa directa a la célula hasta que la interfaz aire/agua se mueva más allá de la punta del capilar. Si bien se puede usar una bomba de jeringa, este paso se puede lograr usando manualmente la jeringa.
- Aumente la altura del líquido del depósito a su nivel inicial.
NOTA: Después de que se vuelva a sumergir la punta, la burbuja será más grande debido al surfactante que ahora se adsorbe en la interfaz. La monocapa ahora estará lista para experimentos de oscilación o intercambio de solventes.
9. Limpiar
- Apague el CFM.
- Cambie al modo Control de presión .
- Retire la muestra de la celda con una pipeta. Cargue la celda con agua DI y aumente la presión a ~ 50 mbar para hacer que las burbujas escapen constantemente del capilar y limpien la punta capilar. Repita este proceso 2x.
- Cierre la válvula de seguridad y apague el CPM haciendo clic en el botón rojo en la esquina superior izquierda, apague el panel de control de presión de luz y azul y cierre la fuente de presión.
- Retire la célula de la etapa de microscopio confocal. Enjuague la celda con etanol y agua DI. Retire el tubo capilar de la célula CPM.
10. Limpieza de la celda
- Desmonta la celda. Cepille la pared interior con un cepillo de dientes mientras se enjuaga con agua DI. Sumerja las piezas en etanol y sonicarlo durante ~ 30 min.
- Enjuague todas las partes con agua DI varias veces. Seque las piezas soplándolas con gas nitrógeno o secándolas dentro de un horno al vacío.
11. Análisis de oscilación
- Ejecute el código Dilatational_Rheology_Analysis.m (Supplemental Coding File 2), eligiendo el archivo deseado guardado desde la interfaz virtual de CPM. Los datos de muestra se incluyen en los archivos complementarios.
- La gráfica presión vs. tiempo aparecerá como se muestra en la Figura Suplementaria 1. Haga clic con el botón izquierdo en el punto donde comienza la oscilación y vuelva a hacer clic con el botón izquierdo donde termina la oscilación. Si los datos contienen varias oscilaciones, repita este proceso para todas las oscilaciones.
- Cuando se haya hecho clic con el botón izquierdo en todos los puntos de inicio y finalización, haga clic con el botón derecho del ratón en cualquier lugar. Por ejemplo, como se muestra en la Figura suplementaria 1, se puede hacer clic con el botón izquierdo en los puntos 1, 2, 3 y 4, seguido de un clic con el botón derecho.
NOTA: El código calculará el módulo dilatacional y el ángulo de fase y los resultados se escribirán en un nuevo archivo .csv en la ubicación del archivo original. Los resultados de los datos de muestra se pueden ver en los resultados de código dados en el Archivo de codificación suplementario 2. MATLAB también generará varias representaciones gráficas de los datos, como se muestra en la Figura complementaria 2.
- Cuando se haya hecho clic con el botón izquierdo en todos los puntos de inicio y finalización, haga clic con el botón derecho del ratón en cualquier lugar. Por ejemplo, como se muestra en la Figura suplementaria 1, se puede hacer clic con el botón izquierdo en los puntos 1, 2, 3 y 4, seguido de un clic con el botón derecho.
Resultados
Una fuente importante de error de medición surge de los capilares que tienen defectos, ya sea del proceso de corte (Figura 5A, B) o del proceso de recubrimiento (Figura 5D). Ambos tipos de defectos conducen a errores en la determinación de la forma y el tamaño de la burbuja por el sistema de análisis óptico de imágenes, lo que lleva a valores de tensión superficial inexactos. Es importante examinar cuidadosamente cada nuevo capilar despu?...
Discusión
El CPM/CFM combinado es una herramienta poderosa para examinar la dinámica interfacial, los equilibrios y la morfología. Este protocolo describe los pasos necesarios para obtener datos con CPM/CFM.
La Figura 2 muestra el diseño de la célula con canales para el intercambio capilar, solvente y de calor indicado. La entrada para el intercambio de disolventes debe estar en la parte inferior de la celda, mientras que la salida debe estar en la parte superior, lo qu...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Todas las imágenes de microscopía confocal se obtuvieron utilizando el microscopio confocal vertical Nikon A1RHD Multiphoton. Agradecemos la orientación y asistencia del personal de apoyo, especialmente Guillermo Marques, en el Centro de Imágenes de la Universidad de Minnesota. Este trabajo fue apoyado por NIH Grant HL51177. SI fue apoyado por una Beca de Capacitación en Investigación Institucional Ruth L. Kirschstein NRSA F32 HL151128.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ - cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL - 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Referencias
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44 (2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al., Ramachadran, A., et al. . Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. , (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., Nag, K., et al. . Surfactant Progress. , (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604 (2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. . Physical Chemistry of Surfaces, Sixth ed. , 784 (1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14 (2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115 (2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados