Method Article
Uso de imágenes in vivo para detectar fenotipos de morfogénesis en cepas mutantes de Candida albicans durante la infección activa en un huésped mamífero
En este artículo
Resumen
Este manuscrito describe un método para examinar bibliotecas mutantes de Candida albicans de tamaño moderado para fenotipos de morfogénesis durante la infección activa en un huésped mamífero utilizando microscopía confocal no invasiva.
Resumen
Candida albicans es un patógeno humano importante. Su capacidad para cambiar entre formas morfológicas es fundamental para su patogénesis; Estos cambios morfológicos están regulados por una compleja red de señalización controlada en respuesta a estímulos ambientales. Estos componentes reguladores han sido muy estudiados, pero casi todos los estudios utilizan una variedad de estímulos in vitro para desencadenar la filamentación. Para determinar cómo se regula la morfogénesis durante el proceso de patogénesis, desarrollamos un sistema de microscopía in vivo para obtener imágenes de alta resolución espacial de organismos sometidos a formación hifal dentro del huésped mamífero. El protocolo presentado aquí describe el uso de este sistema para detectar pequeñas colecciones de cepas mutantes de C. albicans, lo que nos permite identificar reguladores clave de la morfogénesis a medida que ocurre en el sitio de la infección. Se presentan resultados representativos, que demuestran que algunos reguladores de la morfogénesis, como el regulador transcripcional Efg1, tienen fenotipos consistentes in vitro e in vivo, mientras que otros reguladores, como la adenilciclasa (Cyr1), tienen fenotipos significativamente diferentes in vivo en comparación con in vitro.
Introducción
Candida albicans es un patógeno fúngico humano común, que causa enfermedad mucocutánea, enfermedad diseminada e infecciones tisulares localizadas1. Una característica clave de la fisiología de C. albicans es su complejo crecimiento polimórfico, que está vinculado a su papel como comensal y patógeno 2,3,4. En condiciones ricas en nutrientes in vitro a 30 °C, típicamente crece como una levadura ovoide en ciernes. Una variedad de desencadenantes ambientales, incluida la privación de nutrientes, los cambios de pH, el crecimiento a 37 ° C, la exposición al suero y el crecimiento cuando se incrusta en el agar, dan como resultado la transición a un patrón de crecimiento polarizado, lo que resulta en la formación de verdaderas hifas y / o pseudohifas5. El inicio del crecimiento polarizado y el crecimiento resultante de organismos filamentosos se conoce como morfogénesis.
Debido a la importancia de la morfogénesis en la virulencia del organismo, la regulación de la formación hifal ha sido ampliamente estudiada 6,7. Existe una compleja red de vías de señalización y regulación transcripcional que desencadena la morfogénesis. A pesar de la relación de la morfogénesis de C. albicans con la patogénesis, la mayoría de los estudios que investigan la morfogénesis han utilizado estímulos in vitro para desencadenar la formación de hifos. Cada vez está más claro que los diversos modelos in vitro de filamentación no son idénticos en términos de las vías reguladoras individuales estimuladas. Además, ninguna condición de crecimiento in vitro se corresponde estrechamente con el complejo entorno del huésped. Dada la importancia de C. albicans como patógeno humano, el objetivo de este protocolo es investigar su morfogénesis durante la infección activa en un huésped mamífero utilizando un sistema con un rendimiento moderado, lo que permite a un investigador examinar las bibliotecas mutantes de C. albicans.
Para facilitar estas investigaciones, se desarrolló un sistema de imagen in vivo que permite obtener imágenes de alta resolución espacial de células de C. albicans durante la infección del pabellón auricular de un ratón anestesiado utilizando un microscopio confocal invertido 8,9,10. Debido a que la piel del pabellón auricular es bastante delgada, estas imágenes se pueden obtener sin la necesidad de disección de tejido. Por lo tanto, los datos cuantitativos del fenotipo se pueden medir en el sitio de las infecciones activas dentro del tejido del huésped. El protocolo descrito aquí implica la transformación de una cepa de referencia y una o más cepas mutantes con diferentes casetes de expresión de proteínas fluorescentes11,12. Las cepas fluorescentes que expresan proteínas se mezclan y se coinyectan por vía intradérmica. Después de que se establece la infección, las imágenes confocales se utilizan para cuantificar tanto la frecuencia de filamentación como la longitud de los filamentos formados. Los datos obtenidos de las cepas mutantes se normalizan a los obtenidos de la cepa de referencia, que está presente en la misma región tisular, proporcionando así un control interno. Este sistema nos ha permitido tamizar con éxito varias series de cepas mutantes de C. albicans, muchas de las cuales presentan defectos de morfogénesis in vitro 9,10. Muchas de estas cepas se filamentan fácilmente in vivo, destacando la importancia de los modelos in vivo para la investigación de la morfogénesis.
Protocolo
Los estudios en este protocolo fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Iowa (IACUC). Consulte las pautas de los CDC para equipos y procedimientos para trabajar con organismos BSL213.
1. Preparación de cepas de Candida albicans
- Identificar una cepa de referencia apropiada para su uso como control positivo. Asegúrese de que esta cepa coincida estrechamente con las cepas experimentales en términos de su linaje y manipulaciones genéticas.
NOTA: Para los experimentos representativos presentados aquí, los mutantes fueron creados a partir de las cepas descritas en Homann, et al.14, que fueron construidas a partir de SN152. Estos mutantes son Arg-. Por lo tanto, la cepa de referencia seleccionada fue SN250, que también se creó a partir de SN152 y también es Arg-. Los factores de estrés nutricional son críticos en la regulación del crecimiento polarizado en la levadura Saccharomyces cerevisiae15; también han sido implicados en la filamentación en C. albicans y otros hongos16,17,18. Por lo tanto, la cepa de referencia debe coincidir para las auxotrofias con las cepas experimentales siempre que sea posible para evitar posibles efectos de confusión del estrés nutricional. - Elija construcciones de expresión de proteínas fluorescentes. Al examinar una variedad de cepas experimentales, cree una cepa de referencia que exprese una proteína fluorescente y use otras proteínas fluorescentes para marcar las cepas mutantes.
NOTA: Los datos representativos presentados aquí utilizan NEON para la cepa de referencia e iRFP para las cepas mutantes. Cualquier proteína fluorescente se puede utilizar si está altamente expresada, es relativamente brillante y puede ser excitada / detectada por el microscopio que se está utilizando. Los experimentos de control que comparan cepas de referencia que expresan diferentes proteínas fluorescentes no han demostrado ningún impacto de la expresión de proteínas fluorescentes en la morfogénesis. - Transformar las cepas con construcciones de expresión de proteínas fluorescentes.
NOTA: Muchas instituciones requieren el uso de precauciones de Nivel 2 de Seguridad Biológica para trabajar con C. albicans. Todo el trabajo debe seguir las normas de seguridad locales. Independientemente de las regulaciones locales, los investigadores que trabajan con C. albicans deben estar capacitados en el manejo seguro del organismo.- Transformar las cepas de referencia y experimentales utilizando protocolos estándar de acetato de litio19.
NOTA: Los experimentos descritos aquí utilizan los plásmidos pENO1-NEON-NAT R y pENO1-iRFP-NATR, generosamente proporcionados por el Dr. Robert Wheeler 11,12. Los plásmidos se linealizaron usando NotI9. - Seleccione los transformadores en función del crecimiento en nourseotricina u otro medio de selección relevante.
- Identificar transformadores exitosos. Elija un pequeño toque de células de cada colonia con un palillo de dientes y luego mézclelas en una gota de agua de 2.5 μL en un portaobjetos de microscopio. Aplique un cubreobjetos y examine con un aumento de 10x-40x. Examine con un sistema de imágenes confocal (utilizado para el resto del protocolo) o cualquier microscopio de fluorescencia de campo amplio estándar. Los transformadores apropiados tendrán una señal brillante con longitudes de onda de excitación y emisión apropiadas.
NOTA: Para los resultados representativos, las cepas de expresión NEON se visualizaron utilizando un microscopio de fluorescencia vertical con un conjunto de filtros de paso largo con un filtro de excitación de paso de banda de 472/30 nm, un filtro de emisión de paso de banda de 520/35 nm y un divisor de haz dicroico de borde único de 495 nm. Debido a que iRFP no es visible a simple vista, las cepas de expresión de iRFP se visualizaron utilizando el sistema de microscopía confocal utilizado para imágenes in vivo , utilizando un láser de 638 nm para la excitación y la detección de luz de emisión de 655-755 nm.- Alternativamente, evalúe la fluorescencia de colonias macroscópicas utilizando microscopía estereoscópica de fluorescencia, sistemas de excitación de fluorescencia portátiles o sistemas de detección de fluorescencia típicamente utilizados para geles y manchas occidentales.
- Crear existencias congeladoras de transformadores seleccionados.
- Transformar las cepas de referencia y experimentales utilizando protocolos estándar de acetato de litio19.
- Inocular medios sólidos YPD (extracto de levadura peptona dextrosa) con una referencia fluorescente que exprese proteínas y cepas experimentales de congeladores 3 días antes de la inyección, utilizando un palillo de dientes para transferir un poco de organismos del material congelador al medio sólido YPD. Incubar a 30 °C durante 2 días.
- Para cada cepa, inocular un matraz que contenga 25 ml de YPD con células de C. albicans tomadas de varias colonias 1 día antes de la inyección. Haga esto usando un palillo de dientes para transferir un poco de organismos de una colonia al YPD; Repita varias veces para obtener células de varias colonias diferentes. Incubar durante la noche a 30 °C en una incubadora agitadora orbital a 175 rpm.
NOTA: Es importante utilizar múltiples colonias como fuente para el inóculo porque C. albicans tiene una alta frecuencia de alteraciones genéticas espontáneas. El uso de múltiples colonias al iniciar el cultivo del inóculo minimiza la posibilidad de que todos los organismos en el inóculo surjan de un padre con alteraciones espontáneas significativas. - El día de la inyección:
- Centrifugar 1 mL del cultivo durante 2 min a 500 x g.
- Lave el cultivo tres veces con 1 ml de solución salina tamponada con fosfato (dPBS) estéril de Dulbecco. Después del lavado final, resuspender el pellet en 1 mL de dPBS estéril.
- Diluir una muestra del cultivo lavado a 1:100 y contar con un hemocitómetro.
- Ajustar la densidad del cultivo lavado a 1 x 108 organismos por ml usando dPBS.
- Para cada conjunto de cepas a inyectar, crear el inóculo mezclando volúmenes iguales de la cepa de referencia y de la(s) cepa(s) experimental(es). Esto mantiene la densidad del inóculo en 1 x 108 organismos por ml.
NOTA: El número de cepas que se pueden evaluar por oído está limitado por la capacidad del sistema de microscopía utilizado para discriminar claramente la señal de cada proteína fluorescente. - Una vez preparado el inóculo, proceda directamente a las inyecciones del animal. No guarde el inóculo antes de usarlo.
2. Preparación animal
- Obtener la aprobación del Comité Institucional de Cuidado y Uso de Animales local o del órgano de gobierno local correspondiente.
- Obtenga ratones de 6 a 12 semanas de edad de un proveedor o programa de cría. Alojar ratones en la instalación en la que vivirán durante todo el experimento durante al menos 1 semana antes de la inoculación.
NOTA: Para los resultados representativos, se utilizaron ratones hembra DBA2/N de 6 semanas de edad. - Alimente a los animales con comida sin clorofila durante al menos 7 días antes de la inoculación.
3. Depilación e inoculación
- Inducir un plano quirúrgico de anestesia (Figura 1).
PRECAUCIÓN: Los agentes anestésicos inhalados son materiales peligrosos y pueden causar irritación de los ojos o la piel, así como toxicidad para el sistema nervioso. Se deben seguir todas las políticas y procedimientos institucionales y las prácticas generales de seguridad de laboratorio para el uso de anestésicos inhalados. Sólo los individuos entrenados en el uso de anestésicos inhalados pueden realizar estos pasos. Las prácticas estándar incluyen el uso de guantes, una bata de laboratorio, protección para los ojos, el uso de un sistema de eliminación de anestesia y el mantenimiento cuidadoso de registros según las pautas institucionales.- Coloque un ratón en una cámara de inducción de anestesia precalentada. Mantenga al animal en un ambiente cálido durante la anestesia general. Logre esto usando almohadillas de calentamiento diseñadas para este propósito y una etapa de microscopio calentado. No use una almohadilla térmica de venta libre, ya que puede sobrecalentarse y causar quemaduras.
- Proporcione 2% -3% de isoflurano a la cámara de inducción hasta que el ratón haya perdido su reflejo de enderezamiento y las respiraciones sean lentas y constantes. Purgar la cámara de inducción de la anestesia y transferir al animal a un cono nasal sin rebreather que proporcione 1% -2% de isoflurano.
- Validar el plano de anestesia utilizando el reflejo de pellizco del dedo del pie u otros mecanismos de verificación. A lo largo del experimento, monitoree el patrón respiratorio y el plano anestésico del animal, y ajuste la concentración anestésica según sea necesario.
- Aplique lubricante ocular para prevenir la desecación corneal.
- Depilación (Figura 1C,D)
- Aplique una crema depilatoria de venta libre generosamente en la superficie interna y externa de ambas orejas con un hisopo con punta de algodón.
- Después de 2-3 minutos (o según las instrucciones del fabricante), limpie suavemente la oreja con una gasa seca para eliminar toda la crema y el vello. Limpie dos veces más con gasas saturadas en agua estéril para eliminar completamente los residuos de crema depilatoria. Si no se retira toda la crema depilatoria, se producirá irritación / inflamación de la piel.
- Inyección (Figura 1E, F)
- Limpie la superficie de la oreja para inyectarla con una gasa saturada en etanol al 70% y deje secar al aire.
- Mezclar bien el inóculo invirtiendo varias veces o vórtice.
- Extraiga 20-30 μL de inóculo en una jeringa de insulina. Sosteniendo la aguja apuntando hacia arriba, golpee suavemente la jeringa para asegurarse de que el aire en el barril esté en la parte superior. Expulse cuidadosamente el aire y el exceso de inóculo de nuevo en el tubo de inóculo o en un tubo de descarga para que el émbolo esté en la marca de 10 μL.
- Usando un dedal en un dedo o pulgar de la mano no dominante, estabilice la oreja envolviéndola a través del dedal. Alternativamente, aplique cinta adhesiva de doble cara de venta libre (cinta de moda) a un pequeño tubo de plástico cónico o de fondo redondo y coloque la oreja sobre la cinta. Tenga cuidado de no desalojar el cono nasal de anestesia mientras hace esto. Puede ser útil pegar la nariz a la superficie de trabajo.
NOTA: Se puede inyectar el lado interno o externo del oído según la comodidad física del investigador. Para la microscopía, asegúrese de colocar el mouse de manera que el lado de la oreja inyectada esté orientado hacia la lente del objetivo. - Manteniendo la aguja de la jeringa casi completamente paralela a la piel y evitando las venas grandes, inserte la punta de la aguja en la capa más externa de la piel hasta que el bisel esté cubierto.
- Inyecte lentamente el inóculo por vía intradérmica. Una buena inyección intradérmica levantará una pequeña burbuja en la piel. Mantenga la aguja en su lugar durante 15-20 s antes de retirarla de la oreja para minimizar las fugas.
- Si la parte inferior de la oreja del animal se humedece, la aguja era demasiado profunda y pasaba por la oreja por completo. En ese caso, repita la inyección en un área diferente del oído.
- Repita el proceso usando la otra oreja del animal. Esto se puede hacer con las mismas cepas de C. albicans para una réplica o con un conjunto diferente de cepas de C. albicans.
- Si no se obtienen imágenes de inmediato, coloque al animal en una cámara de recuperación calentada. Observe al animal hasta que se haya recuperado de la anestesia y luego devuélvalo a su jaula de alojamiento.
- Siguiendo los protocolos institucionales, marque claramente la jaula con etiquetas de riesgo biológico e indique que los animales en la jaula están infectados con Candida albicans.
- Completar todos los registros requeridos relacionados con la anestesia animal y cualquier otra práctica institucional requerida.
- Aloje al animal en condiciones de instalaciones para animales utilizando las precauciones de Nivel 2 de Seguridad Biológica Animal.
4. Cuantificar la morfogénesis in vitro para compararla con los resultados in vivo
- Utilizando los mismos cultivos lavados que se utilizaron para preparar el inóculo, crear una dilución 1:50 de organismos en RPMI1640 + 10% de suero bovino fetal inactivado por calor e incubar a 37 °C con volteo durante 4 h. Alternativamente, se pueden utilizar otros medios que estimulan la morfogénesis in vitro .
- Centrifugar la muestra durante 5 min a 500 x g y resuspender en 0,5 mL de dPBS.
- Diluir la muestra en una proporción de 1:10, colocar 2,5 μL de la muestra diluida en un portaobjetos de microscopio y cubrirla con un cubreobjetos.
- Examine la muestra con un microscopio de fluorescencia. Contar al menos 100 células, registrando el número de levaduras y células filamentosas para cada cepa. En los resultados representativos presentados aquí, una célula filamentosa se define como cualquier célula con una longitud de más del doble de la longitud de la célula madre.
NOTA: La cuantificación de la morfogénesis in vitro puede realizarse el mismo día de la inoculación de los animales. Es posible iniciar el ensayo de morfogénesis in vitro mientras se prepara el inóculo para inyección y realizar la inoculación de los animales durante el período de incubación de 4 h. Si todos los procedimientos con animales se completan antes del final del período de incubación de 4 h, proceda directamente al examen de las células estimuladas in vitro . Alternativamente, las células pueden resuspenderse en formaldehído al 3,7% en dPBS (en el paso 4.2) y almacenarse a 4 °C durante varios días. Los organismos fijos se pueden cuantificar según lo permita el tiempo. La inoculación de los animales no deberá retrasarse para el ensayo de cuantificación in vitro .
5. Preparación para imágenes in vivo
- Prepare el microscopio (Figura 2A).
- Encienda todo el equipo de microscopía e inicie el software de imágenes.
- Si está disponible, cargue cualquier configuración de imagen predeterminada.
- Active los láseres y detectores necesarios para detectar las proteínas fluorescentes que se utilizan.
- Encienda la platina del microscopio calentado y deje que se caliente a 37 °C.
NOTA: Es posible utilizar un microscopio con una cámara ambiental completamente cerrada en lugar de una etapa calentada. - Establezca un punto de referencia del eje z con el plano de enfoque situado en la superficie superior del cubreobjetos. Esto se puede hacer pegando un cubreobjetos en su lugar sobre la abertura del escenario y poniendo una gota de agua en el cubreobjetos. Utilice un objetivo "seco" de menor aumento (10x) para enfocar el borde de la gota de agua y luego establezca el punto de referencia del eje z. Use un trozo de toallita para absorber el agua del cubreobjetos antes de retirarlo del escenario.
- Gire el objetivo de distancia de trabajo muy larga en su lugar y coloque una gota de líquido de inmersión en la lente. Baje la lente para evitar posibles daños al colocar el cubreobjetos.
- Coloque un cubreobjetos # 1.5 sobre la abertura del escenario y péguelo en su lugar. Asegúrese de que la cinta cubra completamente todos los bordes del cubreobjetos para evitar que cualquier fluido penetre debajo del cubreobjetos en el microscopio. Eleve el objetivo hasta el punto de referencia del eje z para que el fluido de inmersión esté en contacto tanto con la lente del objetivo como con el cubreobjetos.
- Prepare varias piezas de cinta sensible a la presión para que estén listas para usar al colocar la nariz y el mouse.
- Encienda todo el equipo de microscopía e inicie el software de imágenes.
- Inducir anestesia general en el ratón para obtener imágenes como se indica arriba (paso 3.1).
- Coloque el ratón (Figura 2B-D).
- Asegure un cono nasal de anestesia en la etapa del microscopio con la nariz colocada de modo que cubra completamente la nariz del animal cuando el animal esté en posición para obtener imágenes. Esto se puede lograr más fácilmente con dos investigadores. Haga que el primer investigador coloque la nariz del ratón anestesiado en la nariz y mueva al ratón a su posición para obtener imágenes mientras continúa sosteniendo la nariz sobre la nariz del animal. Haga que el otro investigador pegue la nariz y el tubo en su lugar para que se asiente de manera estable sobre la nariz del ratón. Una vez que la nariz esté pegada en su lugar, déjela allí durante el resto de la sesión de imágenes.
- Después de establecer el mejor lugar para colocar la nariz, observe su posición. Para sesiones de imágenes posteriores, la nariz se puede asegurar a la etapa antes de llevar a un animal al microscopio.
- Coloque una gota de agua estéril en el cubreobjetos sobre la lente del objetivo.
- Coloque el ratón en la platina del microscopio. Asegúrese de que la oreja esté encima de la gota de agua y plana contra el cubreobjetos.
- Use un segundo cubreobjetos (superior) para aplanar la oreja.
- Coloque el borde del cubreobjetos paralelo al cuerpo del ratón, con el borde tocando el ratón donde la oreja se encuentra con la cabeza.
- Baje el borde libre del cubreobjetos a la etapa del microscopio con un movimiento de bisagra. A medida que el cubreobjetos viene contra la etapa del microscopio, aplanará la oreja. Tenga cuidado de no crear pliegues o crestas en la oreja.
- Pegue el cubreobjetos superior en su lugar de forma segura para que mantenga la presión suficiente para mantener la oreja plana. Tenga cuidado de no atrapar el pelo o los bigotes del ratón en la cinta.
- A menos que se use un microscopio con una cámara ambiental, cubra holgadamente el cuerpo del ratón con una cortina estéril para mantener un ambiente normotérmico.
- Identificar un campo de interés.
- Asegúrese de que el objetivo está en el punto de referencia del eje z.
- Con imágenes de luz blanca/campo amplio, ajuste el plano de enfoque en el tejido del oído. Una buena estrategia es centrarse en los vasos sanguíneos: si uno puede ver los glóbulos rojos moviéndose en los vasos sanguíneos, el plano de enfoque está dentro del tejido.
- Si el microscopio está equipado con capacidad de fluorescencia de campo amplio, utilícelo para identificar un campo de interés. Si no es así, use imágenes confocales. En general, el uso de microscopía de campo amplio para identificar áreas de interés es más rápido y requiere menos irradiación del tejido del oído.
- Usando un cubo de filtro para la detección de la proteína fluorescente expresada en la cepa de referencia, identifique un campo de visión que tenga una señal fluorescente de la cepa de referencia. Tenga en cuenta que la luz desenfocada probablemente evitará la capacidad de enfocar organismos individuales. El objetivo de este paso es identificar un área de interés para las imágenes confocales.
- Cambie a un cubo de filtro que detectará la proteína fluorescente expresada por la(s) cepa(s) experimental(es) y verificará su presencia en el campo de visión seleccionado.
6. Imágenes
- Determine la configuración.
- Mientras el software de imágenes está en modo confocal en vivo, examine el campo de interés a medida que el plano focal se mueve a través del eje z. Elija un plano del eje z con una señal fuerte de todas las proteínas fluorescentes que se utilizan.
- Ajuste la potencia del láser y/o la velocidad de imagen para obtener una señal lo suficientemente fuerte como para que se pueda determinar la morfología de todas las células en el campo de visión. Para evitar daños en los tejidos, utilice la menor potencia láser posible.
NOTA: Al igual que con todas las imágenes, existe un equilibrio entre la potencia del láser, la velocidad de adquisición y la resolución. Identifique los ajustes que identifican claramente la morfología del organismo mientras equilibra la velocidad y la potencia del láser para minimizar la irradiación del tejido del oído. Debido a que las imágenes se producen a través de la dermis externa, se requiere una mayor potencia láser para la excitación de lo que normalmente es necesario para las imágenes confocales de muestras tradicionales montadas en portaobjetos. Afortunadamente, el nivel de resolución espacial requerido para el análisis de la morfología no es extremo. Por lo tanto, la obtención de imágenes con una señal suficiente para determinar la morfología del organismo sin causar daño tisular es fácilmente alcanzable. - Una vez establecidos estos parámetros, utilícelos durante toda la sesión de imágenes para que sirvan como punto de partida para las sesiones de imágenes posteriores. Por lo tanto, es útil guardar la configuración de imágenes.
NOTA: Las áreas individuales de infección pueden ser menos profundas o más profundas dentro del tejido. Las áreas más profundas pueden requerir un aumento en la potencia del láser. Debido a que este ensayo se basa en la distribución espacial de la señal en lugar de su intensidad, es aceptable cambiar la configuración de imagen entre campos según sea necesario.
- Obtén las imágenes.
- Elija un campo de visión que tenga una clara formación de filamentos en la cepa de referencia y donde la mayoría de los organismos estén lo suficientemente dispersos como para que se pueda determinar su morfología.
- Establezca los planos superior e inferior de enfoque para una pila z. No es necesario cubrir toda la profundidad del área infectada, pero tenga en cuenta que los organismos en la parte superior o inferior del volumen de la imagen generalmente se excluyen del análisis.
- Adquiera imágenes z-stack, pseudo color cada canal para distinguir cada cepa, y superponer los canales. Guarde las imágenes.
- Repita para otros campos de visión. La morfogénesis puede variar de un lugar a otro; Por lo tanto, adquirir y analizar al menos tres campos de cada oído es importante.
7. Análisis bidimensional manual: frecuencia de filamentación
- Utilice software de imágenes para realizar una proyección máxima de la pila z en una imagen bidimensional. Las instrucciones proporcionadas aquí son para FIJI/Imagen J.
- Abra imágenes de microscopía utilizando el software ImageJ.
- Si es necesario, aplique un pseudocolor a cada canal para permitir la identificación directa de cada cepa de C. albicans. Para ello, haga clic en Imagen > Tabla de búsqueda > LUT Color y seleccione el pseudocolor elegido.
- Convierta el archivo de pila en una imagen bidimensional de proyección de intensidad máxima:
- Seleccione el archivo z-stack. Haga clic en la imagen > pilas > proyección Z.
- Seleccione el plano superior e inferior y seleccione el tipo de proyección Intensidad máxima.
- Cuente cada organismo visto en las imágenes de proyección máxima por tipo de cepa (distinguida por el color del canal) y morfología.
- Los organismos que se superponen significativamente o las áreas con una densidad de organismos muy alta serán difíciles de contar con precisión. Excluya estos del conteo, pero tenga cuidado de no introducir sesgos contra las formas filamentosas, que tienen más probabilidades de superponerse.
- Las formas filamentosas que se proyectan directamente dentro o fuera de la pila z aparecerán como pequeños objetos redondos en una proyección máxima. Del mismo modo, los organismos que están cortados por el borde de la imagen pueden parecer levadura porque el filamento está fuera del campo de visión. Por lo tanto, el análisis bidimensional siempre sobreestimará el porcentaje de formas de levadura. Como esto ocurrirá por igual con la(s) cepa(s) de referencia y experimental(es), siempre compare los resultados experimentales con los de una cepa de referencia.
- Realizar comparaciones estadísticas de los resultados según lo dictado por el diseño experimental.
8. Análisis bidimensional manual: longitud del filamento
- Para C. albicans, la formación aberrante de filamentos puede ocurrir porque: a) menos células de levadura "madre" experimentan morfogénesis, b) los filamentos crecen a un ritmo más lento, o c) el crecimiento filamentoso se inicia pero no se mantiene. Para evaluar estas posibilidades, cuantifique la longitud de la trayectoria de la curva de cada filamento en la imagen de proyección máxima como sustituto de la verdadera longitud tridimensional (discutida a continuación).
- Cuando un brote se está desarrollando en una célula madre, no es posible saber si se convertirá en un filamento o una levadura. Para asegurarse de que solo se incluyan células filamentosas en este análisis, mida solo los organismos en los que la célula hija tenga al menos el doble de la longitud de la célula madre.
- Abra la imagen de proyección máxima creada en el paso 7.
- En el conjunto de herramientas ImageJ, haga clic con el botón derecho en la herramienta Línea recta/segmentada y elija la opción Línea segmentada. La opción de línea segmentada permite al usuario medir la longitud del filamento a lo largo de una trayectoria curva, una necesidad dada la plasticidad de los filamentos de C. albicans.
- Mide la longitud del filamento desde el cuello del cogollo hasta el extremo de crecimiento del filamento. Haga clic izquierdo en el cuello del brote; El puntero cambiará a un cuadrado pequeño. Traza el filamento a lo largo de su longitud, haciendo clic en el centro del filamento cada vez que haya una curva, giro o cambio del eje largo del filamento. Haga doble clic en la punta de crecimiento del filamento.
- Presione Control + M. Esto abrirá una ventana emergente que tabula las mediciones de Área, Media, Mín., Máx. y Longitud. Después de medir cada filamento, presione Control + M nuevamente para agregar la medición actual a la tabla de medidas.
- Cuando se hayan medido todos los filamentos, copie y pegue las medidas de longitud en un archivo de análisis de datos.
- Realizar análisis estadísticos para evaluar la distribución de longitudes de filamento en la cepa de referencia y la cepa mutante.
9. Análisis tridimensional manual
- Para obtener una medición más precisa de la morfogénesis que evite la sobreestimación de las formas de levadura y pueda permitir la discriminación entre pseudohifas e hifas, desplácese manualmente hacia arriba y hacia abajo a través de la pila z mientras evalúa la morfología de cada organismo en tres dimensiones.
- Alternativamente, cree una imagen tridimensional de cada pila z y analice la forma de cada organismo mientras gira la imagen.
10. Análisis automatizado
- Utilizando el software de imágenes, automatice la enumeración de organismos y su morfología en dos o tres dimensiones.
NOTA: Algunos algoritmos para la discriminación de tipos de morfología pueden introducir sesgos. Por lo tanto, las estrategias de automatización deben validarse cuidadosamente en relación con el diseño experimental. El análisis automatizado de imágenes bien diseñado y validado puede aumentar el rendimiento del paso de análisis.
Resultados
Los resultados presentados aquí se basan en informes publicados anteriormente 9,10. El objetivo de este análisis es evaluar cuantitativamente la capacidad de las cepas mutantes de C. albicans para sufrir morfogénesis durante infecciones activas. Los parámetros típicos que distinguen las pseudohifas de las hifas pueden ser difíciles de evaluar en organismos que crecen en tres dimensiones en un entorno complejo in vivo. Esto es particularmente cierto cuando se observan las secciones transversales bidimensionales creadas por imágenes confocales. Por lo tanto, este análisis de detección se centra en identificar organismos que crecen como filamentosos frente a levaduras. Para los estudios de seguimiento que utilizan un análisis más profundo, incluidas las reconstrucciones tridimensionales, este método podría adaptarse para discriminar levaduras, hifas y pseudohifas.
La expresión de una proteína fluorescente en una cepa de referencia o mutante de C. albicans permite la detección directa de la morfología de la cepa in vivo (Figura 3 y Figura 4). En general, el análisis cuantitativo de microscopía óptica se realiza mejor cuando pocos o ninguno de los píxeles de la imagen están saturados. Para este protocolo, sin embargo, una saturación de la imagen a menudo simplifica el análisis. La localización de proteínas fluorescentes no es uniforme en toda la célula y a menudo es mayor en la levadura madre que en los filamentos. Afortunadamente, para la investigación de la morfogénesis, la distribución espacial de la señal, en lugar de su intensidad, define el resultado. Por lo tanto, la obtención de imágenes en las que se saturan muchos píxeles mejora la capacidad de cuantificar la morfogénesis en este ensayo.
Para ilustrar la importancia de evaluar la morfogénesis in vivo, se presentan resultados representativos para la cepa de referencia (SN250) y dos mutantes: uno que carece del factor de transcripción Efg1 y el otro que carece de adenilil ciclasa Cyr1. In vitro, ninguna de estas cepas crece como filamentos20,21. Cuando se cultiva in vitro en medio RPMI suplementado con suero al 10%, la cepa de referencia forma rápidamente filamentos, mientras que las cepas efg1ΔΔ y cyr1ΔΔ no lo hacen (Figura 3 y Figura 4). En estas condiciones, el mutante efg1ΔΔ exhibe un crecimiento algo polarizado, con las células hijas ligeramente alargadas en comparación con las células madre. Esto enfatiza la importancia de usar una definición clara de filamentación. Cualquier definición de este tipo es arbitraria por defecto, pero es necesaria para una evaluación consistente del fenotipo. Para estos estudios, un patrón filamentoso de crecimiento se define como un organismo con la dimensión más larga de una célula hija más del doble que la de la célula madre. Usando esta definición, las células estigmatizadas efg1ΔΔ no son filamentosas.
De acuerdo con su fenotipo in vitro, el efg1 ΔΔ exhibe un defecto de filamentación significativo in vivo: aproximadamente el 9% de las células efg1ΔΔ crecieron como filamentos in vivo (Figura 3). En contraste, el 53% de las células mutantes cyr1ΔΔ crecieron como filamentos in vivo (Figura 4). Aunque el número de células mutantes cyr1 ΔΔ sometidas a filamentación in vivo fue significativamente menor que la cepa de referencia, la capacidad del mutante cyr1ΔΔ para formar filamentos in vivo representa un cambio sustancial de su completa falta de morfogénesis in vitro. Visualmente, los filamentos formados por el mutante cyr1ΔΔ parecían ser más cortos que la cepa de referencia. Para evaluar esto cuantitativamente, se midió la longitud de la trayectoria de la curva de las células filamentosas utilizando una proyección bidimensional de las imágenes in vivo (Figura 4E). La longitud media de los filamentos cyr1ΔΔ fue un 29% más corta que los filamentos de la cepa de referencia.
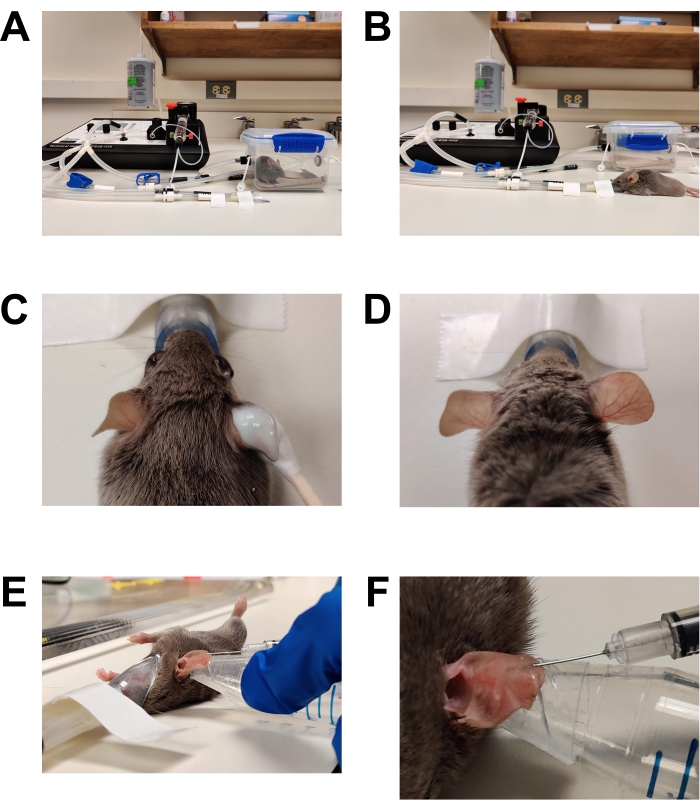
Figura 1: Anestesia e inoculación . (A) Inducción de la anestesia utilizando una cámara de inducción. (B) La anestesia se mantiene utilizando un cono nasal, lo que permite que el ratón se reposicione según sea necesario. (C) La crema depilatoria se aplica con un aplicador con punta de algodón. Se ha aplicado gel de lubricación ocular para proteger los ojos durante la anestesia. (D) Depilación efectiva de la oreja derecha. Compárese con el oído izquierdo no tratado. (E) Inyección intradérmica de C. albicans en el oído del ratón. La oreja se mantiene en su lugar usando la punta de un tubo cónico envuelto con cinta adhesiva de piel de doble cara (cinta de moda). (F) Primer plano de la inyección intradérmica. Se forma una burbuja pálida en la piel, que es un signo de una colocación intradérmica exitosa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Preparación para la obtención de imágenes. (A) Etapa de microscopio preparada para la obtención de imágenes. El cono nasal de anestesia está asegurado en su lugar. Se pega un cubreobjetos al escenario que cubre la abertura de la lente. Piezas adicionales de cinta están disponibles. La platina calentada se precalienta a 37 °C (no se muestra). (B) Colocación del ratón anestesiado en el cono nasal de anestesia. (C) El ratón se gira ligeramente de modo que el lado de la oreja que fue inoculado esté orientado hacia la cubierta inferior / lente del objetivo. Luego, la oreja se aplana contra el cubreobjetos inferior y se asegura en su lugar colocando un segundo cubreobjetos en la parte superior de la oreja. (D) El cubreobjetos superior se pega con cinta adhesiva a la plataforma para asegurar la oreja en su lugar en relación con la etapa del microscopio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Morfología in vitro e in vivo de la cepa mutante efg1ΔΔ. (A) Imagen de campo amplio de cepas mutantes WT y efg1ΔΔ después de la inducción in vitro de filamentación mediante el cultivo de células en suero RPMI + 10% a 37 °C durante 4 h. Las barras de escala representan 10 μm. El contraste de la imagen se ajustó utilizando un software de edición de fotos para facilitar la visualización. (B) Porcentaje de filamentación in vitro observado en las cepas mutantes WT y efg1ΔΔ. Und = indetectable (no se detectaron filamentos). La altura de la barra representa el porcentaje medio de células filamentosas de tres experimentos independientes en los que se cuantificaron al menos 100 células. Las barras de error indican desviación estándar (resultados comparados por la prueba t de Student, p < 0,001). (C) Micrografía confocal de WT (verde) y el mutante efg1ΔΔ (rojo) creciendo in vivo 24 h después de la inoculación. Las flechas indican ejemplos de células mutantes efg1ΔΔ que cumplen con nuestra definición de "filamentosas". La barra de escala representa 50 μm. (D) Porcentaje de filamentación in vivo observado en las cepas mutantes WT y efg1ΔΔ. La altura de la barra representa el porcentaje medio de células filamentosas de dos experimentos independientes. Las barras de error indican desviación estándar (resultados comparados por la prueba t de Student, p < 0,001). Haga clic aquí para ver una versión más grande de esta figura.
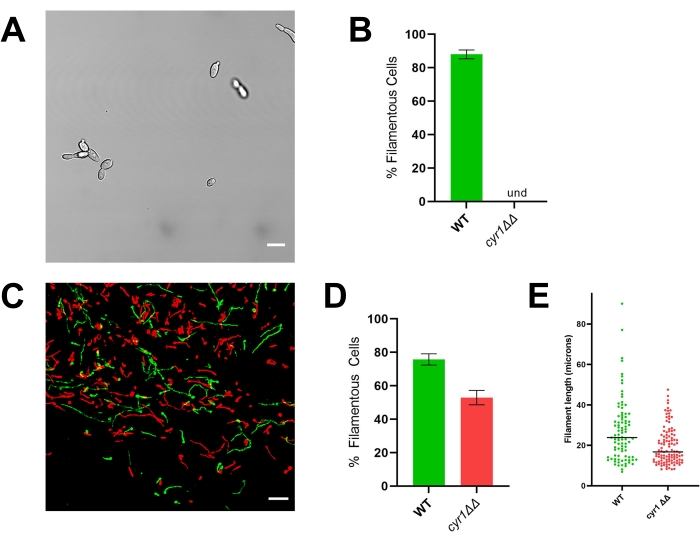
Figura 4: Morfología in vitro e in vivo de la cepa mutante cyr1 ΔΔ. (A) Imagen de campo amplio de la cepa mutante cyr1ΔΔ después de la inducción in vitro de filamentación mediante el cultivo de células en RPMI + 10% de suero a 37 °C durante 4 h. La barra de escala representa 10 μm. El contraste de la imagen se ajustó utilizando un software de edición de fotos para facilitar la visualización. (B) Porcentaje de filamentación in vitro observado en las cepas mutantes WT y cyr1ΔΔ. Und = indetectable (no se detectaron filamentos). La altura de la barra representa el porcentaje medio de células filamentosas de tres experimentos independientes en los que se cuantificaron al menos 100 células. Las barras de error indican desviación estándar (resultados comparados por la prueba t de Student, p < 0,001). (C) Micrografía confocal de WT (verde) y el mutante cyr1ΔΔ (rojo) creciendo in vivo 24 h después de la inoculación. La barra de escala representa 50 μm. (D) Porcentaje de filamentación in vivo observado en las cepas mutantes WT y cyr1ΔΔ. La altura de la barra representa el porcentaje medio de células filamentosas de dos experimentos independientes. Las barras de error indican desviación estándar (resultados comparados por la prueba t de Student, p < 0,001). (E) Distribución de la longitud del filamento in vivo, medida por la longitud de la trayectoria de la curva en una proyección bidimensional de la pila z. Cada punto representa la longitud de un filamento. Las células que crecen como levadura no se incluyeron en este análisis. La barra indica la longitud mediana del filamento. La distribución de longitudes es significativamente diferente cuando se analiza mediante una prueba U de Mann-Whitney (p < 0,001). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este modelo utiliza microscopía confocal para obtener imágenes de los organismos de C. albicans a medida que crecen dentro del tejido de un huésped mamífero, lo que nos permite evaluar los fenotipos de morfogénesis durante la infección activa. El proceso de morfogénesis es fundamental para la patogénesis de C. albicans y ha sido ampliamente estudiado utilizando una variedad de ensayos in vitro 2,3,4. Sin embargo, ningún ensayo in vitro puede modelar completamente el complejo entorno bioquímico y estructural del huésped.
El protocolo descrito aquí se centra en el uso de este sistema de imágenes in vivo para detectar una serie / biblioteca de mutantes de C. albicans para identificar los genes involucrados en la morfogénesis durante la infección. El uso de cepas de C. albicans que expresan diferentes proteínas fluorescentes nos permite cuantificar in vivo la morfogénesis de las cepas mutantes de C. albicans en comparación con la de una cepa de referencia. La comparación de la morfogénesis en el mutante con la cepa de referencia dentro de la misma área de infección asegura que los organismos estén expuestos a ambientes idénticos. Esto permite la medición cuantitativa del porcentaje de células sometidas a filamentación, así como el grado de filamentación. La normalización de las mediciones de la(s) cepa(s) mutante(s) a las de la cepa de referencia nos permite comparar mejor el rendimiento de un mutante con otro.
Los resultados representativos presentados aquí demuestran el potencial de una discrepancia significativa entre los fenotipos in vitro e in vivo . La cepa mutante C. albicans efg1ΔΔ se utiliza a menudo como control negativo para ensayos de morfogénesis, ya que no logra filamentar en casi todas las condiciones in vitro 20. Aunque los resultados in vivo fueron muy similares a los resultados in vitro , incluso esta cepa gravemente obstaculizada ocasionalmente formó filamentos en el entorno del tejido huésped (Figura 3). Esto enfatiza la fuerza del entorno del huésped para desencadenar la morfogénesis.
Por el contrario, la cepa mutante cyr1ΔΔ demuestra una discordancia sustancial entre el crecimiento in vitro e in vivo; aunque ninguna de las células mutantes sufre filamentación in vitro, aproximadamente la mitad de las células crecen como filamentos in vivo (Figura 4)10,21. Curiosamente, estos filamentos eran significativamente más cortos que los formados por la cepa de referencia, lo que sugiere que CYR1 contribuye a la tasa de crecimiento del filamento o a la capacidad de mantener un fenotipo filamentoso. Para facilitar el análisis de la longitud del filamento, se midió la longitud de la trayectoria de la curva de los filamentos mediante una proyección bidimensional de las imágenes. En proyecciones bidimensionales de filamentos que crecen en tres dimensiones, cualquier filamento que crezca en un eje que no sea paralelo al plano xy se proyectará como más corto que su longitud real. Como este escorzo también ocurre para la deformación de referencia, la evaluación de la distribución de longitudes de filamento en una proyección bidimensional aún permite una comparación cuantitativa entre las cepas de referencia y mutantes. El análisis de la longitud del filamento en dos dimensiones en lugar de tres requiere un análisis de imagen menos intensivo; Por lo tanto, se puede realizar relativamente rápido en una computadora de escritorio típica. El uso de este análisis más simple permite la inclusión de la distribución de la longitud del filamento como parte de un protocolo de selección, lo que brinda una comprensión más matizada de la capacidad de cada mutante para someterse a la morfogénesis sin causar retrasos sustanciales en el rendimiento.
Los estudios representativos presentados aquí fueron realizados con ratones DBA2/N, que tienen un defecto en su sistema del complemento que causa una falla en el reclutamiento de neutrófilos en el sitio de la infección por C. albicans 22. El objetivo de estos estudios fue investigar los mecanismos de regulación de la filamentación de C. albicans dentro del tejido huésped. Por lo tanto, se utilizaron ratones DBA2 / N para evitar confundir los resultados debido a la susceptibilidad o resistencia de una cepa individual a los neutrófilos. Como la respuesta anti-C. albicans de neutrófilos puede afectar la filamentación23, el reclutamiento de neutrófilos en el sitio de la infección podría afectar los resultados de un ensayo de morfogénesis. Si una cepa es capaz de filamentar in vivo pero está fuertemente inhibida de la filamentación cuando hay neutrófilos presentes, la filamentación se detectaría en ratones DBA2 / N, pero es poco probable que se vea cuando se usan ratones con quimiotaxis de neutrófilos intacta. Por lo tanto, la tensión del ratón utilizado como host es un factor importante cuando se utiliza este protocolo.
La observación de que la cepa mutante efg1ΔΔ no logra filamentar in vivo es poco probable que esté relacionada con las respuestas de los neutrófilos del huésped, porque esta cepa tampoco puede filamentar in vitro. La filamentación observada in vivo con la cepa cyr1ΔΔ es discordante con su fallo de filamentación in vitro. Los datos del modelo de pez cebra de la infección por C. albicans indican que los neutrófilos que responden son importantes en la prevención de la morfogénesis24. Por lo tanto, es poco probable que el uso de ratones DBA2/N, que carecen de respuestas de neutrófilos, explique el aumento de la filamentación del cyr1ΔΔ in vivo en comparación con in vitro. Sin embargo, el ambiente in vivo está afectando claramente la morfogénesis de la cepa cyr1ΔΔ; por lo tanto, la investigación adicional de esta cepa puede proporcionar información importante sobre la regulación de la morfogénesis de C. albicans durante las infecciones activas. El protocolo descrito aquí está diseñado como un ensayo de detección para identificar cepas como la cepa cyr1ΔΔ que se utilizará en estudios futuros.
El uso de un sistema de anestesia de gas de bajo flujo es muy útil para este protocolo (Figura 1A, B). Durante el desarrollo inicial de este protocolo, los ratones fueron anestesiados usando un cóctel anestésico inyectable de ketamina mezclada con xilazina. Si bien fue posible realizar imágenes limitadas con ese método anestésico, la duración de la anestesia fue impredecible, lo que requirió que las sesiones de imágenes terminaran rápidamente para evitar que el ratón se recuperara de la anestesia durante la imagen. Los sistemas anestésicos inhalados tradicionales son voluminosos y requieren altas tasas de flujo de gases anestésicos, lo que a menudo requiere que se utilicen dentro de una campana extractora. Por lo tanto, los sistemas anestésicos inhalados tradicionales serían muy difíciles de usar con las limitaciones de espacio de un microscopio confocal sin exponer inadvertidamente a los investigadores a los agentes anestésicos. El uso de un sistema anestésico inhalado de bajo flujo permite una anestesia constante del animal mientras se mantiene un ambiente seguro para el investigador. La nosecone de bajo flujo permite un fácil posicionamiento del animal tanto para la inoculación como para la microscopía. El tubo de administración de pequeño calibre y bajo volumen permite el uso de tubos relativamente largos, lo que permite que la máquina de anestesia se coloque a una distancia suficiente para no interferir con la microscopía.
La clorofila presente en la comida típica de ratón conduce a una autofluorescencia tisular significativa25. Esto crea un ruido sustancial en las imágenes, lo que dificulta la obtención de imágenes de alta calidad y alta resolución espacial. Cuando los animales fueron alimentados con comida libre de clorofila durante 7 días antes de la obtención de imágenes, el fondo de la autofluorescencia disminuyó sustancialmente en el tejido, pero la clorofila depositada en el cabello continuó siendo problemática. La eliminación del vello en las pinnas con una crema depilatoria química de venta libre es eficaz para minimizar la autofluorescencia en el cabello (Figura 1C, D). Por lo tanto, la combinación de comida libre de clorofila y depilación adecuada disminuyó sustancialmente la autofluorescencia y mejoró drásticamente la calidad de la imagen. Debido a que el pelo se elimina de la oreja antes de la imagen, el color del pelo del animal no afecta este sistema. Este protocolo se ha utilizado con éxito para estudiar las infecciones por C. albicans en ratones BALB/c (blanco), C57BL/6 (negro) y DBA2/N (marrón). El protocolo también se puede utilizar con ratones knockout C57BL/6 que son deficientes en varios genes del huésped; Esto permitirá futuras investigaciones sobre cómo el sistema inmune del huésped mamífero afecta la filamentación. Una característica de este modelo que no se discute en este protocolo es que, debido a que este sistema de imágenes no es invasivo, el mismo animal puede ser fotografiado repetidamente durante varios días, lo que permite seguir el progreso de la infección individual a lo largo del tiempo. Esta característica probablemente jugará un papel clave en futuros estudios sobre la interacción huésped-patógeno.
En resumen, este protocolo da como resultado imágenes de alta resolución espacial de C. albicans creciendo en el tejido de un huésped mamífero vivo, lo que permite una evaluación precisa de la morfogénesis en cepas mutantes 8,9,10. Los resultados presentados aquí demuestran cómo se puede usar este protocolo para detectar una biblioteca de mutantes de C. albicans. De los mutantes de C. albicans probados hasta la fecha, una gran parte de los mutantes con defectos conocidos en la morfogénesis in vitro se someten fácilmente a filamentación in vivo 9,10. Esto resalta la importancia de incluir un sistema in vivo como este en experimentos diseñados para dilucidar los mecanismos de la patogénesis de C. albicans.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo fue apoyado por la subvención 1R01AI33409 de los NIH y el Departamento de Pediatría, Carver College of Medicine, Universidad de Iowa.
Materiales
| Name | Company | Catalog Number | Comments |
| #1.5 coverslips | Thermo-Fisher | 20811 | large enough to cover the universal stage opening |
| 0.1 mL Insulin syringes | EXELint | 26018 | Can use syringes that are 5/16"–1/2" long and 29–32 G |
| 3.7% formaldehyde in dPBS | Sigma-Aldrich | SHBJ5734 | |
| 70% Ethanol/30% water | Decon Laboratories | A05061001A | |
| Alcohol prep pads | Covidien | 5110 | Alternative: gauze pads soaked in 70% isopropyl alcohol |
| C.albicans reference strain and experimental strains | SN250 | FGSC Online Catalog | The specific C. albicans strain varies with experiment and the investigators goals. We have used strains derived from SC5314 as well as other clinical isolates. |
| Chlorophyl free mouse chow | Envigo | 2920x | |
| Computer | Dell | Optiplex 7050 | Computer that can run imaging software for acquisition and for analysis of images. A variety of imaging software is available and varies with the specific microscope and user system. |
| Cotton tip applicator | Pro Advantage | 76200 | |
| DBA2/N (6-12 week old mice) | BALB/c and C57/BL6 mice can also be used. The latter allow for the use of widely available knockout mouse models as well as mouse models in which individual cell types, such as phagocytes, are identified by their expression of fluorescent proteins. | ||
| Double sided tape designed to hold fabric to skin (fashion tape) | local pharmacy or grocery store | Double sided adhesive tape designed for keeping clothing in place over human skin. This is typically available over the counter in pharmacies and variety stores. It is important to use this type of tape as it is designed for gentle adherence to skin. Examples: https://www.amazon.com/Womens-Fashion-Clothing-Transparent-Suitable/dp/B08S3TWR3H/ref=sr_1_40?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-40 https://www.amazon.com/Fearless-Tape-Sensitive-Clothing-Transparent/dp/B07QY8V5XT/ref=sr_1_26?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174320&sprefix= fashion+tape%2Caps%2C70&sr=8-26 https://www.amazon.com/Hollywood-Fashion-Secrets-Tape-Floral/dp/B009RX77MK/ref=sr_1_29?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-29 | |
| Dulbecco's phosphate buffered saline | Gibco / Thermo-Fisher | 14190-144 | Must be sterile; open a new container for every experiment |
| Fetal bovine serum | Gibco / Thermo-Fisher | 26140-079 | |
| Gauze pad | Pro Advantage | P157112 | |
| Gel eye lurbicant | local pharmacy or grocery store | ||
| ImageJ or FIJI analysis software | NIH | ImageJ (FIJI) | |
| Isoflurane | Akorn | J119005 | |
| Leica DMi8 (SP8 platform) with Leica 11506375 objective lens | Leica | DMi8 (SP8) | The objective lens (Leica 11506375) used here is a 25x water immersion lens to allow us to have a high NA (0.95) while approximating the refractive index of the ear tissue. The microscope (Leica DMi8 (SP8 platform) has 488 nm and 638 nm diode laser lines and is equipped with filter-free spectral detection with computer controlled adjustable bandwidth for detection of emission light. The stage must have enough clearance to allow the objective to reach the bottom coverslip without hitting the stage. |
| Low-flow anesthesia system or traditional anesthesia vaporizer | Kent Scientific International | SomnoSuite | |
| Nair hair remover lotion | local pharmacy or grocery store | Over the counter depilatory cream | |
| Nourseothricin | Jena Bioscience | AB-101L | |
| pENO1-NEON-NATR pENO1-iRFP-NATR plasmids | Fluorescent protein expression transformation constructs generously given to us by Dr. Robert Wheeler (Seman, et al., 2018, Infection and Immunity; Bergeron, et al., 2017, Infection and Immunity) | ||
| Pressure sensitive laboratory tape | Tape & Label Graphic Systems Inc | 1007910 | |
| RPMI1640 cell culture medium | Gibco / Thermo-Fisher | 11875-093 | |
| Thimble, plastic 15 mL conical tube, or Falcon 5 mL round bottom polystyrene tubes | Falcon | 352196 | To safely hold the animals ear during injectinos |
Referencias
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Saville, S. P., Lazzell, A. L., Monteagudo, C., Lopez-Ribot, J. L. Engineered control of cell morphology in vivo reveals distinct roles for yeast and filamentous forms of Candida albicans during infection. Eukaryotic Cell. 2 (5), 1053-1060 (2003).
- Arita, G. S., et al. Cell wall associated proteins involved in filamentation with impact on the virulence of Candida albicans. Microbiological Research. 258, 126996(2022).
- Rai, L. S., Wijlick, L. V., Bougnoux, M. E., Bachellier-Bassi, S., d'Enfert, C. Regulators of commensal and pathogenic life-styles of an opportunistic fungus-Candida albicans. Yeast. 38 (4), 243-250 (2021).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Basso, V., d'Enfert, C., Znaidi, S., Bachellier-Bassi, S. From genes to networks: The regulatory circuitry controlling candida albicans morphogenesis. Current Topics in Microbiology and Immunology. 422, 61-99 (2019).
- Mancera, E., et al. Evolution of the complex transcription network controlling biofilm formation in Candida species. Elife. 10, 64682(2021).
- Mitra, S., Dolan, K., Foster, T. H., Wellington, M. Imaging morphogenesis of Candida albicans during infection in a live animal. Journal of Biomedical Optics. 15 (1), 010504(2010).
- Wakade, R. S., Huang, M., Mitchell, A. P., Wellington, M., Krysan, D. J. Intravital imaging of Candida albicans identifies differential in vitro and in vivo filamentation phenotypes for transcription factor deletion mutants. mSphere. 6 (3), 0043621(2021).
- Wakade, R. S., Kramara, J., Wellington, M., Krysan, D. J. Candida albicans filamentation does not require the cAMP-PKA pathway in vivo. mBio. 13 (3), 0085122(2022).
- Bergeron, A. C., et al. Candida albicans and Pseudomonas aeruginosa interact to enhance virulence of mucosal infection in transparent zebrafish. Infection and Immunity. 85 (11), 00475(2017).
- Seman, B. G., et al. Yeast and filaments have specialized, independent activities in a zebrafish model of Candida albicans infection. Infection and Immunity. 86 (10), 00415-00418 (2018).
- Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories (BMBL). 6th edition. , Available from: https://www.cdc.gov/labs/BMBL.html (2020).
- Homann, O. R., Dea, J., Noble, S. M., Johnson, A. D. A phenotypic profile of the Candida albicans regulatory network. Plos Genetics. 5 (12), 1000783(2009).
- Cullen, P. J., Sprague, G. F. The regulation of filamentous growth in yeast. Genetics. 190 (1), 23-49 (2012).
- Herrero, A. B., et al. Control of filament formation in Candida albicans by polyamine levels. Infection and Immunity. 67 (9), 4870-4878 (1999).
- Ahmad Hussin, N., et al. Biotin auxotrophy and biotin enhanced germ tube formation in Candida albicans. Microorganisms. 4 (3), 37(2016).
- Nantel, A., et al. Transcription profiling of Candida albicans cells undergoing the yeast-to-hyphal transition. Molecular Biology of the Cell. 13 (10), 3452-3465 (2002).
- Noble, S. M., Johnson, A. D. Strains and strategies for large-scale gene deletion studies of the diploid human fungal pathogen Candida albicans. Eukaryotic Cell. 4 (2), 298-309 (2005).
- Glazier, V. E. EFG1, Everyone's favorite gene in Candida albicans: A comprehensive literature review. Frontiers in Cellular Infection and Microbiology. 12, 855229(2022).
- Huang, G., Huang, Q., Wei, Y., Wang, Y., Du, H. Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in Candida albicans. Molecular Microbiology. 111 (1), 6-16 (2019).
- Saville, S. P., Lazzell, A. L., Chaturvedi, A. K., Monteagudo, C., Lopez-Ribot, J. L. Use of a genetically engineered strain to evaluate the pathogenic potential of yeast cell and filamentous forms during Candida albicans systemic infection in immunodeficient mice. Infection and Immunity. 76 (1), 97-102 (2008).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryotic Cell. 10 (7), 932-944 (2011).
- Brothers, K. M., et al. NADPH oxidase-driven phagocyte recruitment controls Candida albicans filamentous growth and prevents mortality. PLoS Pathogens. 9 (10), 1003634(2013).
- Holmes, H., Kennedy, J. C., Pottier, R., Rossi, R., Weagle, G. A recipe for the preparation of a rodent food that eliminates chlorophyll-based tissue fluorescence. Journal of Photochemistry and Photobiology. B: Biology. 29 (2-3), 199(1995).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados