Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Colocación de electrodos estimulantes extracraneales y medición del flujo sanguíneo cerebral y campos eléctricos intracraneales en ratones anestesiados
En este artículo
Resumen
Describimos un protocolo para evaluar las curvas dosis-respuesta para la estimulación extracraneal en términos de medidas del campo eléctrico cerebral y un biomarcador relevante: flujo sanguíneo cerebral. Dado que este protocolo implica la colocación de electrodos invasivos en el cerebro, se necesita anestesia general, y se prefiere la respiración espontánea en lugar de la respiración controlada.
Resumen
La detección de las respuestas del flujo sanguíneo cerebral (CBF) a diversas formas de activación neuronal es fundamental para comprender la función cerebral dinámica y las variaciones en el suministro de sustrato al cerebro. En este artículo se describe un protocolo para medir las respuestas de CBF a la estimulación transcraneal de corriente alterna (tACS). Las curvas dosis-respuesta se estiman tanto a partir del cambio de CBF que se produce con tACS (mA) como del campo eléctrico intracraneal (mV/mm). Estimamos el campo eléctrico intracraneal en función de las diferentes amplitudes medidas por microelectrodos de vidrio dentro de cada lado del cerebro. En este artículo, describimos la configuración experimental, que implica el uso de sondas Doppler láser (LD) bilaterales o imágenes de moteado láser (LSI) para medir el CBF; Como resultado, esta configuración requiere anestesia para la colocación y estabilidad del electrodo. Presentamos una correlación entre la respuesta de CBF y la corriente en función de la edad, mostrando una respuesta significativamente mayor a corrientes más altas (1,5 mA y 2,0 mA) en animales control jóvenes (12-14 semanas) en comparación con animales mayores (28-32 semanas) (p < 0,005 de diferencia). También demostramos una respuesta significativa de CBF a intensidades de campo eléctrico <5 mV/mm, lo cual es una consideración importante para eventuales estudios en humanos. Estas respuestas de CBF también están fuertemente influenciadas por el uso de anestesia en comparación con los animales despiertos, el control de la respiración (es decir, respiración intubada vs. espontánea), factores sistémicos (es decir, CO2) y la conducción local dentro de los vasos sanguíneos, que está mediada por pericitos y células endoteliales. Del mismo modo, las técnicas de imagen/grabación más detalladas pueden limitar el tamaño del campo de todo el cerebro a solo una pequeña región. Describimos el uso de electrodos extracraneales para la aplicación de la estimulación con tACS, incluyendo diseños de electrodos caseros y comerciales para roedores, la medición concurrente del CBF y el campo eléctrico intracraneal utilizando electrodos bilaterales de registro de CC de vidrio, y los enfoques de imagen. Actualmente estamos aplicando estas técnicas para implementar un formato de circuito cerrado para aumentar el CBF en modelos animales de enfermedad de Alzheimer y accidente cerebrovascular.
Introducción
La estimulación eléctrica transcraneal (tES; con estimulación de onda sinusoidal, tACS) es un abordaje común, externo y no invasivo para la neuromodulación cerebral 1,2. Anteriormente, planteamos la hipótesis de que a ciertas dosis, la tES (y en particular la tACS) puede aumentar el flujo sanguíneo cerebral (CBF) en las regiones cerebrales subyacentes3. Además, puede existir una relación dosis-respuesta entre la corriente externa aplicada o el campo eléctrico intracraneal y las respuestas de CBF resultantes. Sin embargo, la mayoría de los protocolos de estimulación clínica se han centrado en un nivel máximo de estimulación de la piel cómoda (es decir, ~ 2 mA) durante períodos de tiempo programados (es decir, 30-45 min) como protocolo de tratamiento 4,5. En roedores, es posible utilizar electrodos cerebrales invasivos extracraneales aplicados directamente al cráneo para investigar los campos eléctricos en el cerebro inducidos por tES6. Por lo tanto, el objetivo de este enfoque es determinar los efectos de la intensidad de la tACS a frecuencias relevantes sobre los cambios en el CBF en términos de la relación dosis-respuesta. Esta curva dosis-respuesta se basa en un biomarcador fisiológico a corto plazo -medidas directas del CBF- en relación con el campo eléctrico impuesto al cerebro3. Hemos demostrado previamente que, a amplitudes más grandes, típicamente más allá del rango de campos eléctricos dentro del cerebro inducidos clínicamente por tACS, existe una correlación casi lineal entre el campo eléctrico inducido y el CBF en la corteza3. Sin embargo, la estimulación de campo más pequeño (es decir, intensidad de 1-5 mV/mm) puede ser más relevante y factible para su uso en humanos; por lo tanto, hemos modificado nuestras técnicas para detectar cambios más pequeños en el CBF.
En este artículo se describe un protocolo para analizar los efectos de las corrientes sinusoidales alternas (tACS) de tES de menor intensidad de campo sobre el CBF (es decir, corriente de 0,5-2,0 mA, campo eléctrico de 1-5 mV/mm), que pueden ser tolerados por roedores despiertos5. Este protocolo implica el uso de nuevas imágenes de moteado láser durante la tACS, así como dos electrodos de vidrio intracraneales, para determinar tanto la propagación de la tACS activa dentro del cerebro (según lo monitoreado por la CBF) como la intensidad del campo eléctrico intracraneal, que se muestra como un diagrama y una fotografía experimental real (Figura 1). Hay muchos efectos fisiológicos posibles de la tES dentro del cerebro, incluida la modulación neuronal directa, la plasticidad neuronal y la activación de los astrocitos 7,8. Aunque el CBF se ha medido con tDCS 9,10, estas mediciones fueron lentas, indirectas e insuficientes para evaluar la función dosis-respuesta en el cerebro. Por lo tanto, mediante el uso de biomarcadores apropiados a corto plazo (es decir, CBF, campos eléctricos) y secuencias rápidas de encendido/apagado de tACS, ahora podemos estimar la función dosis-respuesta con mayor precisión. Además, podemos aplicar diferentes técnicas para medir el CBF, incluyendo tanto sondas Doppler láser focales (LD) como imágenes de moteado láser (LSI) con regiones de interés definidas.
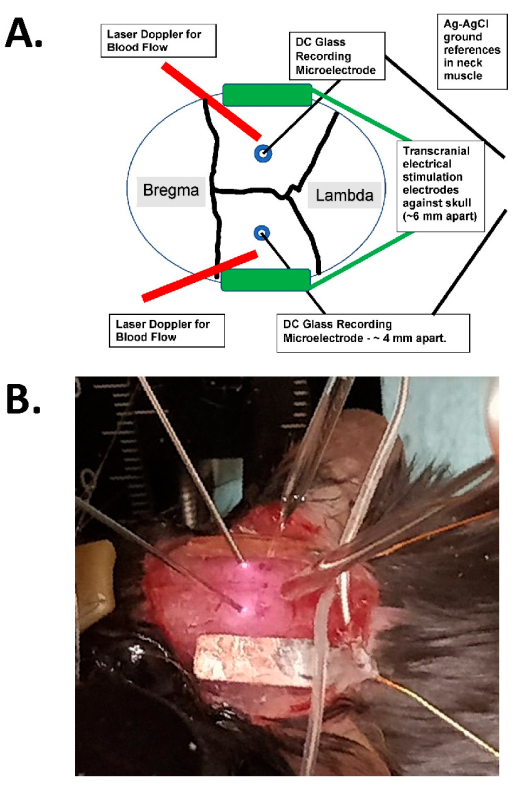
Figura 1: Diagrama de estimulación transcraneal y ejemplo fotográfico. (A) Diagrama de la configuración de la estimulación transcraneal. El diagrama muestra un cráneo de ratón con suturas coronales y sagitales. Los electrodos transcraneales se colocan lateral y simétricamente en el cráneo y se montan con pegamento quirúrgico y pasta conductora entre los electrodos y el cráneo. Estos electrodos están conectados a un dispositivo de estimulación de corriente constante compatible con humanos, que puede especificar la frecuencia, la amplitud y la duración de la estimulación. Para la evaluación de los campos eléctricos intracraneales, se colocan electrodos de vidrio bilaterales (~2 MΩ) en la corteza cerebral (es decir, a menos de 1 mm de la cara interna del cráneo a través de pequeños orificios de rebaba), y estos se sellan con aceite mineral y tienen molienda de AgCl en el músculo del cuello (que se muestra como cables más grandes en el centro enterrados en el tejido subcutáneo del cuello). Estos electrodos de vidrio están conectados a un amplificador de CC y sus salidas se registran a través de un digitalizador con al menos cuatro canales. También se colocan sondas láser Doppler bilaterales en el cráneo para realizar grabaciones. También se obtienen imágenes de todo el cráneo con un dispositivo de imágenes de moteado láser o una cámara refrigerada de alta resolución (al menos 1.024 x 1.024 píxeles, profundidad de píxeles de 12-14 bits) para la detección de señales ópticas intrínsecas. Por lo general, se elige la frecuencia isosbética de la hemoglobina (es decir, 562 nm) para la iluminación de las imágenes del flujo sanguíneo. (B) Una imagen en primer plano de un experimento real, que muestra las sondas Doppler láser bilaterales (a la izquierda), los microelectrodos de registro de vidrio intracraneal (bilaterales) colocados a través de los orificios de rebaba y con los electrodos de estimulación de tACS lateralmente. Abreviatura: tACS = estimulación transcraneal de corriente alterna. Haga clic aquí para ver una versión más grande de esta figura.
Como forma de evaluar los mecanismos, también podemos interrogar las interacciones con otros procesos fisiológicos que también alteran el CBF, como la despolarización de propagación inducida por K+ 11. Además, en lugar de sesiones programadas en horarios regulares, también es posible desarrollar un sistema de circuito cerrado basado en biomarcadores adicionales para una variedad de enfermedades, como se ha propuesto para el tratamiento de la epilepsia12 (es decir, dispositivos clínicos Neuropace). Por ejemplo, la estimulación cerebral de circuito cerrado para la enfermedad de Parkinson se basa comúnmente en los potenciales de campo local (LFP) intrínsecos y anormales intrínsecos a esta enfermedad en ausencia de suficiente dopamina (típicamente LFP de banda β)13.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los procedimientos con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Duke o la autoridad local equivalente que regula la investigación con animales. Consulte la Tabla de materiales para obtener detalles sobre todos los materiales, instrumentos y equipos utilizados en este protocolo.
1. Preparación del instrumento
- Asegúrese de que todos los elementos e instrumentos quirúrgicos necesarios estén en su lugar (Figura 2): solución de limpieza del cuero cabelludo (almohadillas con alcohol), cinta adhesiva, fórceps, tijeras y un taladro para colocar los orificios pequeños (0,5 mm).
- Prepare los electrodos de la superficie extracraneal para la aplicación en el cráneo y asegúrese de que se haya limpiado cualquier pegamento quirúrgico si se han utilizado anteriormente.
- Verifique la impedancia de estos electrodos tACS directamente antes de aplicarlos en el cráneo. Para ello, utilice la función de medición incorporada del estimulador tACS con ambos electrodos colocados en un baño salino.
NOTA: La impedancia preferida es de <5 KΩ por par de electrodos para permitir que pase suficiente corriente a través del cráneo. El dispositivo estimulador verifica la impedancia antes de entregar pulsos de corriente constante y da el valor directamente.
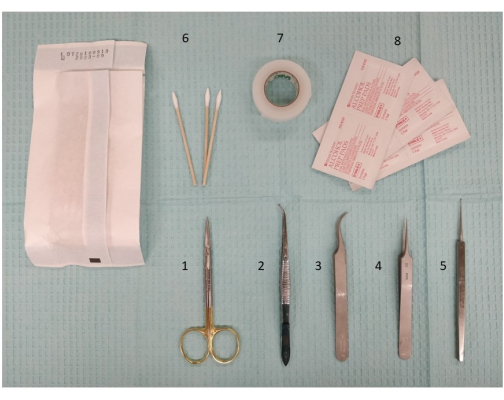
Figura 2: Fotografía de la instrumentación necesaria, incluidos los instrumentos de disección y las tijeras, para preparar la estimulación extracraneal. 1. Tijeras de microdisección, 11,5 cm; 2. Pinzas, 11,5 cm, ligeramente curvadas, aserradas; 3. Pinzas Dumont #7, curvas; 4. Pinzas Dumont #5; 5. Micro cureta, 13 cm; 6. Hisopos; 7. Cinta quirúrgica; 8. Almohadillas con alcohol. Haga clic aquí para ver una versión más grande de esta figura.
2. Preparación del animal para la cirugía
NOTA: Para estos experimentos, utilizamos 14 ratones control C57BL/6 de entre 12 y 33 semanas de edad, de los cuales cinco eran machos y nueve hembras.
- Anestesiar al animal en una cámara de inducción con isoflurano al 30% O2 a ~1,5 L/min, con ~4% inicialmente para inducir y ~1,25%-1,5% para mantener a un nivel de anestesia con respiración espontánea y suficiente para eliminar la respuesta de pellizco de la cola.
- Transfiera al animal al marco estereotáxico después de la inducción, y luego asegure la cabeza en el cono de la nariz y las barras de la oreja para la posterior aplicación del electrodo y el procedimiento del orificio de rebaba (Figura 1 y Figura 3).
- Conecte el cono de la nariz del marco estereotáxico al vaporizador a través de una entrada y a una salida para eliminar cualquier residuo de isoflurano a través de un sistema de eliminación (por ejemplo, carbón vegetal o una aspiradora). Asegúrese de que no haya fugas de aire por el cono de la nariz, tanto para mantener el nivel de anestesia con el isofluorano como para evitar fugas accidentales al aire de la habitación (Figura 3).
- Comprobar la posición del ratón en el marco estereotáxico, incluida la posición del cono de la nariz, para permitir la respiración espontánea sin intubación, así como la recuperación anestésica adecuada y la limpieza para proteger al personal investigador (Figura 3).
- Coloque las sondas para medir el pulso, la saturación de oxígeno del pulso (pulso OX), la presión arterial y la temperatura en el animal; Asegúrese de que la oxigenación mínima por pulsos sea del 90% y que el pulso sea de >450/min (el límite inferior de la alarma se muestra como 380 pulsos/min). Registre estos parámetros durante el procedimiento a intervalos regulares o de forma continua, dependiendo del sistema de registro (Figura 3).
- Antes de comenzar el procedimiento, verifique el nivel de sedación del animal usando (por ejemplo) un pellizco en el dedo del pie para verificar los reflejos. Si no hay reflejo, entonces el nivel de sedación es óptimo, siempre y cuando el animal mantenga la respiración espontánea y la oxigenación por pulsos adecuada. Si hay un reflejo, aumente el suministro de isoflurano para profundizar el nivel de anestesia y luego vuelva a verificar el reflejo. Observar y monitorear continuamente la frecuencia respiratoria del animal, y ajustar la administración de isoflurano en consecuencia.
- Afeitar el vello del cuero cabelludo o eliminar el vello con crema depilatoria (limpiar la crema residual con alcohol).
- Aplique ungüento para los ojos y luego limpie asépticamente el cuero cabelludo con tres conductos de yodo y alcohol antes de la escisión con unas tijeras.

Figura 3: Una imagen del animal en el marco estereotáxico, con el cráneo expuesto y solo los electrodos estimuladores de tACS en su lugar (antes de la colocación del orificio de rebaba). Observe el dispositivo de presión arterial alrededor de la cola y el oxímetro de pulso en la pata, con la lectura a la izquierda. Hay tubos de barrido para el isoflurano alrededor del cono de la nariz. Abreviatura: tACS = estimulación transcraneal de corriente alterna. Haga clic aquí para ver una versión más grande de esta figura.
3. Procedimiento quirúrgico: Aplicación de los electrodos estimulantes y realización de los agujeros de las rebabas
- Para un estudio terminal, retire el cuero cabelludo con unas tijeras quirúrgicas y exponga el cráneo a ~3 mm de la sutura lambdoidea caudalmente y ~3 mm frontal al bregma para exponer parte de la sutura frontal posterior. Extirpar el cuero cabelludo parietalmente para exponer la parte inicial del músculo temporal en ambos lados (Figura 3).
- Retire cualquier tejido conectivo subcutáneo residual para que el cráneo esté limpio y seco para la aplicación de los electrodos estimulantes.
- Aplique gel o pasta conductora en el lado de los electrodos que estará en contacto con el cráneo y asegure los electrodos con superpegamento quirúrgico alrededor del borde en los puntos intermitentes.
NOTA: No permita que el gel conductor interfiera con el superpegamento quirúrgico para permitir una mejor adhesión a la superficie del cráneo. La superficie exterior de los electrodos también se puede aislar (del cuero cabelludo si se cierra durante una cirugía de supervivencia) con superpegamento quirúrgico. - Utilice electrodos planos comerciales o cree electrodos internos utilizando alambre aislado con un diámetro de 100 μm (soldado a la placa) y una placa de cobre flexible y aislada (en una superficie) de 1 mm x 3 mm cortada de acuerdo con el tamaño del cráneo.
- Aplique pasta de lidocaína en el músculo temporal y el cuero cabelludo en ambos lados sin alterar los electrodos para reducir la activación muscular y de los nervios periféricos.
- Una vez colocados los electrodos estimuladores extracraneales a 4 mm lateralmente a cada lado del cráneo (entre el bregma y la lambda), taladre dos orificios de 0,5 mm para los electrodos de vidrio a 2 mm a cada lado de la línea media, separados 4 mm entre sí, ortogonales a la sutura sagital (Figura 1). Rellene estos orificios con aceite mineral estéril para evitar la entrada de corriente en el cráneo desde los electrodos extracraneales.
- Si se desea que un experimento en particular induzca la depresión de propagación (es decir, depresión de propagación inducida por potasio [K+-SD]), agregue, en el lado derecho del cráneo, un tercer orificio de fresa de 0,5 mm ~ 1,5 mm rostral a la sutura coronal y ~ 1 mm lateral a la sutura frontal posterior. Rellene este orificio de rebaba con solución salina para la posterior aplicación de KCl de 1 M para inducir K+-SD.
- Pruebe la impedancia de los electrodos de estimulación extracraneal antes de la colocación del orificio de rebaba (y en comparación con los mismos electrodos colocados en un baño salino) y después de la colocación del orificio de rebaba para verificar que los orificios de rebaba no interfieran con el flujo de corriente hacia el cerebro (es decir, asegúrese de que la resistencia no cambie).
NOTA: La medición de impedancia es proporcionada directamente por el dispositivo de estimulación. En general, hemos encontrado que la impedancia general del sistema (es decir, de los electrodos extracraneales a través de la vía cráneo/cerebro, típicamente ~ 3 KΩ) es relativamente constante independientemente de los orificios de rebaba y los microelectrodos de vidrio, lo que indica que hay una fuga mínima de corriente directamente en el cerebro a través de los orificios de rebabas. - Coloque los electrodos de estimulación transcraneal crónica para la estimulación crónica de manera similar. En este caso, aísle la superficie exterior de los electrodos, cierre el cuero cabelludo y haga un túnel de los cables aislados a través del cuero cabelludo o diríjalos a una etapa de cabeza fija montada en el cráneo.
4. Procedimiento fisiológico
- Comience con los aspectos fisiológicos del experimento, una vez que el animal esté completamente preparado para el experimento fisiológico de no supervivencia. Mantenga el nivel de anestesia suficiente tanto para la respiración espontánea como para los niveles adecuados de pulso oxímetro, respiratorio y pulso.
- Mida el CBF resultante de la estimulación extracraneal mediante uno de los dos métodos siguientes.
- Coloque el ratón debajo de un dispositivo de imágenes de moteado láser con o sin electrodos de registro intracraneal para medir el campo eléctrico intracraneal durante los episodios de estimulación (Figura 3).
- Trasladar al animal a una preparación fisiológica para la colocación de sondas Doppler láser bilaterales y electrodos intracraneales para medir el campo eléctrico intracraneal durante los episodios de estimulación (Figura 1).
5. Colocación de electrodos Doppler láser bilaterales y de vidrio
- Transferir al animal a una platina de microscopio para la aplicación de sondas Doppler láser bilaterales. Coloque las sondas en la parte superior de la superficie del cráneo, entre los orificios bilaterales y la sutura coronal (Figura 1).
- Llene los microelectrodos de vidrio estirado (~0,1 μM, impedancia de 2-6 MΩ) con NaCl 0,2 M y colóquelos con un micromanipulador en los dos orificios de rebaba colocados lateralmente a la sutura sagital 3,14 (Figura 1).
NOTA: Estos orificios de rebaba se encuentran entre los dos electrodos de estimulación extracraneal simétricos (Figura 1). - Una vez insertados en el cerebro, asegúrese de que estos microelectrodos de vidrio estén a ~ 1 mm dentro de la corteza cerebral. Realice perfiles de profundidad a varias profundidades simétricas. Rellene los orificios de las fresas con aceite mineral estéril para aislar esta vía para el flujo de corriente.
6. Procedimiento de estimulación y medición de la intensidad de la estimulación transcraneal de corriente alterna (tACS) o de la estimulación transcraneal de corriente continua (tDCS)
- Registre los datos continuos de las sondas Doppler láser duales en el cráneo y las dos salidas de microelectrodos intracraneales (grabadas con un amplificador de CC con cabeceras) utilizando un sistema de digitalización y un software con al menos cuatro canales (a una frecuencia de muestreo de 1 KHz). Una vez que se hayan registrado todos los valores durante una duración basal suficientemente estable (es decir, >10 min), pruebe la estimulación extracraneal.
NOTA: La Figura 4 muestra un ejemplo de los cuatro canales con los dos electrodos de registro intracraneal en los canales superiores y la respuesta CBF en los canales inferiores. - Aplique breves períodos de estimulación de encendido/apagado a varias amplitudes (es decir, 20-30 s, 0,5-2,0 mA, en el rango tolerable) para obtener una línea de base clara antes y después de la estimulación (Figura 4). Aplique la estimulación entre los dos electrodos tACS del cráneo a cada lado (Figura 1) utilizando un dispositivo de estimulación comercial compatible con humanos que administre una corriente constante.
- Observe de cerca al ratón en busca de espasmos musculares u otras respuestas al tACS, como un cambio en el pulso o la respiración, para crear un límite superior de tolerabilidad (generalmente ~ 2 mA).
- Continúe monitoreando la impedancia a través de los electrodos con épocas de estimulación para asegurarse de que sea constante.
- Añadir una pequeña cantidad (2-3 μL) de KCl 1 M al orificio de fresa anterior14 para inducir eventos espontáneos de K+-SD. Estos generan una gran respuesta de CBF e interacciones entre la respuesta de CBF inducida por K+-SD y la respuesta de CBF. Estimar la respuesta de la tACS CBF, aplicando la estimulación de tACS tanto antes como después de la aparición de la DE.
- Al final del experimento, realizar la eutanasia mediante una sobredosis de isoflurano (5%) y luego decapitar una vez que las respiraciones y los latidos del corazón hayan cesado.
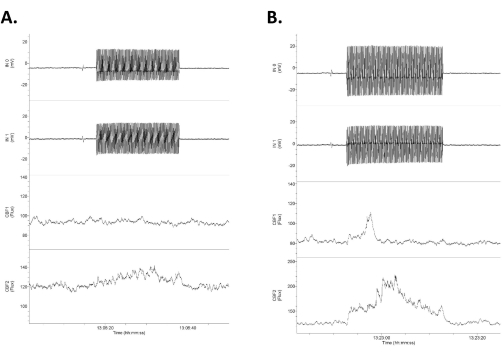
Figura 4: Datos que muestran cuatro canales de datos brutos en respuesta a tACS de baja intensidad. Los datos se organizan con las dos filas superiores como registros eléctricos de CC directos intracraneales (etiquetados como Entrada 1 [IN0] y entrada 2 [IN1]) y las dos filas inferiores como registros Doppler láser bilaterales del flujo sanguíneo cerebral. Tenga en cuenta que las respuestas son asimétricas entre las trazas de flujo sanguíneo eléctrico y cerebral derecho (superior) e izquierdo (inferior). (A) Una respuesta pequeña (aumento del 16% en el flujo sanguíneo) en respuesta a un estímulo de 1,2 mV/mm 20 s (0,75 mA). (B) Una respuesta mayor (aumento del 21% en el flujo sanguíneo) en respuesta a un estímulo de 1,4 mV/mm (1,0 mA). Abreviatura: tACS = estimulación transcraneal de corriente alterna. Haga clic aquí para ver una versión más grande de esta figura.
7. Cálculo del campo eléctrico
- Mida la diferencia en la salida de los dos electrodos intracraneales utilizando la diferencia en la media onda (un ciclo) de las dos ondas sinusoidales registradas (las dos trazas superiores en la Figura 4). Divida esta diferencia (mV) por la distancia entre los dos electrodos (mm, aquí ~ 4 mm pero medido directamente en cada caso) para llegar a la intensidad de campo (mV/mm)3,6.
Access restricted. Please log in or start a trial to view this content.
Resultados
Los resultados representativos se muestran en la Figura 4, la Figura 5 y la Figura 6. La Figura 4 muestra un ejemplo de los cuatro canales con los dos electrodos de registro intracraneal en los canales superiores y las respuestas CBF en los canales inferiores. El tACS es simétrico a lo largo del cráneo, pero en general, la respuesta del campo intracraneal es ligeramente asimétrica para las corrientes...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este protocolo se centra en la medición in vivo, anestesiada, de la respuesta de CBF como biomarcador para estimar la respuesta cerebral a tES14. Los biomarcadores a largo plazo de la respuesta a la TES incluyen los efectos histológicos del tratamiento, como la prevención o los cambios en la formación de placa amiloide (es decir, con estimulación gamma a 40 Hz en varios modelos de EA)16,17,18,19,<...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este estudio fue financiado por las siguientes subvenciones (a D.A.T.): NIA RO1 AG074999, NIA R21AG051103, VA I21RX002223 y VA I21 BX003023.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
Referencias
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483(2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214(2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564(2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer's mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer's and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer's disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer's disease mouse model. Nature Communications. 10 (1), 5322(2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer's-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados