Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Gastrectomía total robótica con preservación del vago para el tratamiento de la mutación del gen CDH1
En este artículo
Resumen
Este artículo se centra en la gastrectomía total robótica con preservación del vago. Se discuten las técnicas y los peligros de la preservación del vago, la esofagoyeyunostomía suturada, la formación de bolsa yeyunal y la reconstrucción en Y de Roux con una yeyuoneyunostomía grapada con grapas.
Resumen
El cáncer gástrico difuso hereditario (HDGC, por sus siglas en inglés) causado por la mutación del gen CDH1 es un síndrome de cáncer hereditario que aumenta el riesgo de cáncer gástrico difuso y es casi imposible de detectar mediante gastroscopia de detección. El tratamiento preventivo recomendado es la gastrectomía total. La cirugía robótica facilita el uso de técnicas quirúrgicas mínimamente invasivas (MIS) para la anastomosis y la preservación del vago posterior para reducir potencialmente los resultados funcionales adversos. Un varón asintomático de 24 años con la mutación del gen CDH1 comprobada mediante pruebas genéticas y antecedentes familiares de un hermano que se sometió a una gastrectomía total por HDGC fue tratado con esta técnica. Este informe de caso en video muestra las técnicas y las dificultades de la cirugía robótica en términos de la posición del paciente y la colocación del puerto, la disección posterior con preservación del vago, la esofagoyunostomía suturada, la formación de la bolsa yeyunal y la reconstrucción en Y de Roux con una yeyunoeyunostomía con grapas. Si bien estas técnicas están demostradas en el caso de la gastrectomía profiláctica, muchas de ellas se pueden aplicar a otros tipos de cirugía general y del intestino anterior benigna y bariátrica. La cirugía robótica puede facilitar la técnica de MIS del intestino anterior, como se describe en este caso de una gastrectomía total con preservación del vago.
Introducción
El cáncer gástrico difuso hereditario (HDGC) se caracteriza por una mutación genética en el gen supresor de tumores E-cadherina (CDH1), que tiene un patrón de herencia autosómico dominante1. Este síndrome de cáncer hereditario aumenta el riesgo de cáncer gástrico difuso y cáncer de mama lobulillar (LBC). Las directrices actuales recomiendan la realización de pruebas para detectar mutaciones en CDH1 en pacientes con grupos familiares de HDGC y LBC, especialmente en aquellos con inicio temprano (antes de los 40 años de edad)2. De acuerdo con la serie más grande notificada de portadores de mutaciones en CDH1, la incidencia acumulada de cáncer gástrico a lo largo de la vida es del 70 % (IC del 95 %, 59 % a 80 %) para los hombres y del 56 % (IC del 95 %, 44 % a 69 %) para las mujeres con esta mutación3. Sin embargo, estudios recientes han estimado que la penetrancia del cáncer gástrico con esta mutación está en el rango de 37%-42% para los hombres y 25%-33% para las mujeres1.
La vigilancia endoscópica con biopsias es el tipo de vigilancia recomendado para aquellos que optan por retrasar la gastrectomía profiláctica; Sin embargo, es casi imposible detectar el cáncer gástrico temprano en esta cohorte mediante gastroscopia de detección2. A un examen endoscópico extenso con luz blanca le siguen un mínimo de 30 biopsias gástricas no dirigidas de cinco áreas separadas del estómago. Sin embargo, este método de vigilancia tiene una alta tasa de falsos negativos y solo detecta entre el 20% y el 63% de los focos de células de anillo de sellooculto 4,5.
La gastrectomía total profiláctica (GPT) es el tratamiento preventivo recomendado para cualquier portador de la variante patógena o probablemente patógena de CDH1 a partir de los 20 años, pero no se recomienda más allá de los 70 años de edad 1,2. La metástasis en los ganglios linfáticos perigástricos es un hallazgo poco frecuente en pacientes asintomáticos, que suelen tener células T1a o células en anillo de sello in situ. La morbilidad perioperatoria es generalmente baja y la satisfacción del paciente es alta6. A pesar de que la calidad de vida general después de la cirugía es alta, la vagotomía troncal generalmente se realiza en una gastrectomía total 7,8. La resección del nervio vago por encima del nivel de las ramas celíaca y hepática conduce a la denervación parasimpática del árbol hepatobiliar y del intestino delgado y grueso. La diarrea post-vagotomía y el síndrome de evacuación gástrica rápida son complicaciones a largo plazo bien reconocidas después de la PTG8.
La cirugía robótica proporciona al cirujano una visión tridimensional y ampliada 10x del campo quirúrgico y ofrece un alto grado de libertad con los instrumentos quirúrgicos articulados9. El objetivo de esta técnica es reducir potencialmente los resultados funcionales adversos a través de la preservación del vago posterior, que se ve facilitada por las técnicas quirúrgicas mínimamente invasivas (MIS).
Protocolo
El paciente dio su consentimiento informado para la publicación de información anónima, imágenes y documentación en video. El profesor asociado Dr. Michael Talbot (coautor) es un cirujano gastrointestinal superior acreditado para realizar gastrectomías en su institución. Debido al riesgo insignificante de este informe de caso y protocolo, estaba exento de una revisión ética según las pautas de la junta de revisión institucional local. La solicitud de ética para informes de casos está exenta según las pautas de la junta de revisión institucional local.
1. Posicionamiento del paciente
- Coloque al paciente en la posición inversa de Trendelenburg después de que se haya administrado anestesia general.
- Asegure al paciente en su posición con una placa para los pies, una correa para el cuerpo colocada por encima de las rodillas y correas para los tobillos. Abducción (<90°) los brazos y venda con crepé a las tablas de los brazos. Coloque un soporte retractor de hígado Nathanson en la mesa de operaciones, craneal a la placa del brazo izquierdo.
2. Ubicación de los puertos (Figura 1)
- Realice una incisión cutánea de 12 mm a través del enfoque preferido del cirujano en la posición medioclavicular derecha a la altura del ombligo o por debajo de él. Realice una entrada óptica con un visor laparoscópico de 8 mm de 0° y con un puerto de 12 mm a través de esta incisión. Tenga en cuenta que el puerto de la cámara debe estar a 10-20 cm de la anatomía objetivo.
- Cambie el puerto por un puerto robótico de 12 mm (grapado) con un reductor de 12-8 mm y cambie el laparoscopio por un laparoscopio de 8 mm a 30°. Establecer neumoperitoneo de CO2 de 15 mmHg con flujo de 45 mmHg.
- Realice tres incisiones cutáneas adicionales de 8 mm en el plano transumbilical y coloque tres puertos robóticos de 8 mm. Coloque uno de los puertos robóticos en el ombligo y los otros dos puertos robóticos laterales en el lado izquierdo. Asegúrese de que haya una distancia de >8 cm entre los puertos y una distancia de 10-20 cm entre los puertos y la anatomía objetivo.
- Coloque otro puerto auxiliar de 12 mm (puerto A) en el cuadrante superior derecho. Inserte un retractor Nathanson en el epigastrio a través de una incisión de 5 mm y retraiga el lóbulo izquierdo del hígado.
- Coloque el carro robótico del paciente sobre el paciente desde el lado derecho del paciente, teniendo cuidado de evitar colisiones con el retractor hepático. Acople primero el brazo de la cámara utilizando la ubicación del puerto guiado por láser. Realice una incisura dirigida al estómago con un visor robótico de 8 mm y 30° utilizando el puerto 3.
- Acople y eructe los puertos robóticos restantes a los brazos del instrumento y, a continuación, inserte un instrumento bipolar de fuerza de 8 mm (puerto 1), una extensión de sellador de recipientes (puerto 2) y una pinza fenestrada abatible (olla 4). Establezca el corte automático monopolar y bipolar y la coagulación forzada en el efecto 3 y verifique la configuración del sistema.
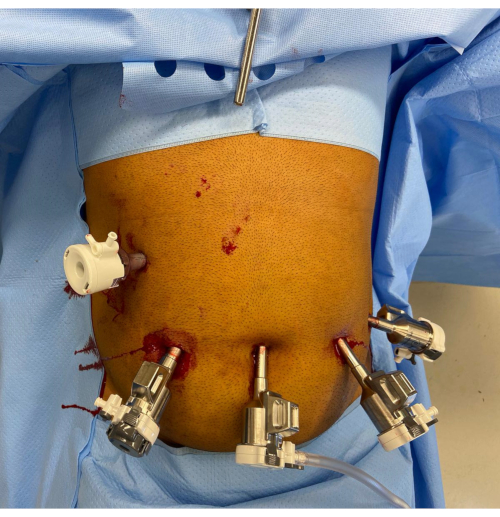
Figura 1: Colocación robótica de puertos. El mango del retractor de Nathanson se ve en el epigastrio. Hay un puerto auxiliar de 12 mm en el cuadrante superior derecho. Los puertos restantes de izquierda a derecha de la imagen son el puerto robótico de 12 mm con reductor, el puerto de cámara de 8 mm y dos puertos robóticos adicionales de 8 mm. Haga clic aquí para ver una versión más grande de esta figura.
3. Disección con preservación del vago
- Movilizar la curva mayor del estómago a través del ligamento gastrocólico desde el antro hasta el cardias y dividirla en cinco a siete vasos gástricos cortos laterales a la arcada del sellador de vasos que se extienden para incluir los ganglios N1. A continuación, movilizar el lado izquierdo del hiato esofágico.
- Entra en el ligamento frenoesofágico y moviliza el lado izquierdo del esófago distal. Realizar la disección distal con el sellador de vasos y continuar hasta la movilización de la primera parte del duodeno. Siga la ventana supraduodenal a través de la pars flaccida para completar la movilización esofágica del lado derecho, con el plano de disección colindante con el esófago.
- Transecto la primera parte del duodeno con la grapadora robótica utilizando una recarga verde de 60 mm x 4,3 mm con un refuerzo de contrafuerte. Divida los vasos gástricos izquierdos cerca de la pared del estómago con el sellador de vasos. Esto es para asegurar que el vago posterior quede sin dividir en el mesenterio alrededor del pedículo gástrico izquierdo.
- Retraiga el esófago y el estómago en la dirección superolateral e identifique el nervio vago posterior. Barre el nervio posteriormente y consérvalo.
4. Sutura de la esofagoyeyunostomía con bolsa yeyunal
- Reconstrucción del ligamento frenoesofágico
- Realizar la reconstrucción del ligamento frenoesofágico en sentido continuo en sentido contrario a las agujas del reloj desde la posición de las 5 hasta las 9 en punto utilizando una sutura de púas no absorbible 2-0 en una aguja de punta cónica de 26 mm 1/2 círculo. Transecte el esófago intraabdominal con la grapadora robótica utilizando una recarga verde de 60 mm x 4,3 mm. Mueva el estómago desprendido al cuadrante superior derecho.
- Anastomosis esofagoyeyunal
- Eleve el epiplón mayor cranealmente para identificar la flexión duodenoyeyuno y lleve un asa yeyunal de 50 cm (creando una extremidad biliopancreática de 40-60 cm después de la formación de la bolsa yeyunal) al esófago.
- Sutura una sutura de púas reabsorbible 3-0 de 23 cm de largo en una aguja de punta cónica de 26 mm 1/2 círculo como una exxia esofagoeyunal lateral a las 3 en punto. Retraiga lateralmente la sutura sin cortar. Cree una esofagostomía anterior a la línea de grapas utilizando un gancho de diatermia monopolar con una guía de sonda nasogástrica de 18Fr. Crear una yeyunostomía de un tamaño igual o ligeramente más pequeño que se hace para la esofagostomía.
- Suturar la pared posterior de la esofagoyeyunostomía con la sutura de púas de forma continua, en el sentido de las agujas del reloj, desde las 3 hasta las 9 horas, incorporando la línea de grapas. Suturar la porción anterior con otra de la misma sutura para completar la sutura de una sola capa de espesor completo para la anastomosis esofagoyeyunal. Coloque algunas suturas mediales más allá de la anastomosis como una exxia medial.
- Bolsa yeyunal
- Transectar el asa yeyunal proximal a 10 cm de la anastomosis con una grapadora robótica utilizando una recarga blanca de 60 mm x 2,5 mm. Crear enterostomías antimesentéricas de 10 cm proximales y distales a la anastomosis esofagoyeyunal.
- Realice dos disparos de la grapadora robótica utilizando recargas blancas de 60 mm x 2,5 mm para crear la bolsa yeyunal. Asegúrese de que el segundo disparo no llegue hasta el encuentro con la anastomosis esofagoyeyunal para preservar el suministro de sangre a las anastomosis. Cierre la enterotomía yeyunal de forma continua con una sutura de púas reabsorbible 3-0.
5. Yeyunoyeyunostomía grapada
- Mida una extremidad alimentaria de 70 cm y coloque una sutura interrumpida de seda 2-0 en este punto y la extremidad biliopancreática distal para marcar y retraer.
- Forme la yeyunoyuyunostomía mediante una técnica de grapas solamente, como se describe en la técnica de triple grapado para el bypass gástrico laparoscópico10,11. Utilice una recarga blanca de 60 mm x 2,5 mm para formar la anastomosis y cerrar la enterotomía.
- Cierre los defectos mesentéricos yeyunales y retro-Roux utilizando suturas de púas no absorbibles 2-0 para reducir el riesgo de complicaciones debidas a la hernia interna.
6. Extracción y cierre de muestras
- Retire los instrumentos, el retractor Nathanson y los puertos bajo visión robótica. Desacople el carro robótico del paciente.
- Crea una minilaparotomía de 5 cm a través de la extensión del puerto umbilical. Entregue la muestra a través de un pequeño retractor protector de heridas con junta tórica. Cierre la laparotomía de la manera habitual utilizando suturas conservadoras de músculo con cierre fascial continuo y con una relación de sutura a longitud de la herida de 1:4.
Resultados
El tiempo operatorio total fue de 2 h 50 min, y el paciente tuvo una evolución postoperatoria normal. El paciente fue sometido a una dieta de líquidos libres el día 1 después de la cirugía y fue dado de alta del hospital el día 4. Al mes y a los 3 meses de seguimiento, el paciente se encontraba bien y no refirió diarrea ni síntomas de evacuación gástrica.
El espécimen se envió para examen anatomopatológico y demostró cinco áreas de invasión sup...
Discusión
Se seleccionó un varón asintomático de 24 años con la mutación del gen CDH1 comprobada mediante pruebas genéticas y antecedentes familiares de un hermano que se sometió a una gastrectomía total por HDGC. La endoscopia preoperatoria no fue destacable. El caso se utiliza como plataforma para discutir las técnicas y las trampas de los aspectos clave de la misma. Esto incluye la colocación del paciente y la colocación del puerto, la disección posterior con preservación del vago,...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a la Fundación de Investigación Gastrointestinal y Metabólica Superior por financiar las tarifas de publicación de la revista. Los autores también reconocen al paciente en este caso por su consentimiento para la publicación de su información e imágenes anónimas.
Materiales
| Name | Company | Catalog Number | Comments |
| Laparoscopic instruments | |||
| 5 mm optical entry port | Applied Medical | CFF03 | Kii Fios First entry access system. |
| Laparoscopic 5mm 0° camera | Olympus | ENDOEYE HD II | 5 mm, 0° |
| Laparoscopic needle holder | KARL STORZ | Laparoscopic needle holder | |
| Nasogastric tube | Cardinal Health | 8888264960E | 16Fr |
| Nathanson liver retractor | COOK Medical | NLRS-1001/ NLRS-1002 | Large/ Extra-large |
| Robotic instruments | |||
| 12 mm port | Intuitive Surgical | 470375 | |
| 8 mm port | Intuitive Surgical | 470380 | |
| 8 mm reducer | Intuitive Surgical | 470381 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 0° | Intuitive Surgical | 470026 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 30° | Intuitive Surgical | 470027 | |
| Force Bipolar 8 mm | Intuitive Surgical | 470405 | |
| Mega SutureCut Needle Driver | Intuitive Surgical | 470309 | |
| Monopolar hook diathermy | Intuitive Surgical | 470183 | |
| SureForm 60mm stapler | Intuitive Surgical | 480460 | |
| Tip-up fenetrated grasper 8 mm | Intuitive Surgical | 470347 | |
| Vessel Sealer Extend 8 mm | Intuitive Surgical | 480422 | |
| Stapler reloads | |||
| Seamguard buttress 60 mm | GORE | 1BSGXI60GB/12BSGXI60GB | |
| SureForm 60 mm green reload | Intuitive Surgical | 48360G | |
| SureForm 60 mm white reload | Intuitive Surgical | 48360W | |
| Sutures | |||
| 2-0 nonabsorbable barbed suture | Medtronic | VLOCN0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle |
| 3-0 absorbable barbed suture | Medtronic/ Ethicon (J&J) | VLOCM0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle (preferred), STRATAFIX (alternate). Catalogue number |
| 2-0 monocryl suture | Ethicon (J&J) | JJW3463 | Cut to 15 cm, taper point needle |
| 2-0 silk suture | Ethicon (J&J) | JJ423H | Cut to 15 cm, taper point needle |
| 1 PDS suture | Ethicon (J&J) | JJ75414 | Fascial closure |
| 3-0 monocryl suture | Ethicon (J&J) | JJY227H | Skin closure |
| Topical Skin Adhesive | Ethicon (J&J) | JJ79025 | Skin closure/ wound dressing |
| Specimen extraction | |||
| Alexis O-ring wound retractor | Applied Medical | C8402 | Medium. For specimen extraction |
| Handheld diathermy | Covidien/ Valleylab | VLE2515 | For specimen extraction |
Referencias
- Gamble, L. A., Heller, T., Davis, J. L. Hereditary diffuse gastric cancer syndrome and the role of CDH1: A review. JAMA Surgery. 156 (4), 387-392 (2021).
- Shenoy, S. CDH1 (E-cadherin) mutation and gastric cancer: Genetics, molecular mechanisms and guidelines for management. Cancer Management and Research. 11, 10477-10486 (2019).
- Hansford, S., et al. Hereditary diffuse gastric cancer syndrome: CDH1 mutations and beyond. JAMA Oncology. 1 (1), 23-32 (2015).
- Friedman, M., et al. Surveillance endoscopy in the management of hereditary diffuse gastric cancer syndrome. Clincal Gastroenterology and Hepatology. 19 (1), 189-191 (2021).
- van der Post, R. S., et al. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers. Journal of Medical Genetics. 52 (6), 361-374 (2015).
- Kaurah, P., et al. Hereditary diffuse gastric cancer: Cancer risk and the personal cost of preventive surgery. Familal Cancer. 18 (4), 429-438 (2019).
- Hejazi, R. A., Patil, H., McCallum, R. W. Dumping syndrome: Establishing criteria for diagnosis and identifying new etiolo gies. Digestive Diseases and Sciences. 55 (1), 117-123 (2010).
- Johnston, D. Operative mortality and postoperative morbidity of highly selective vagotomy. British Medical Journal. 4 (5996), 545-547 (1975).
- Nakauchi, M., et al. Robotic surgery for the upper gastrointestinal tract: Current status and future perspectives. Asian Journal of Endoscopic Surgery. 10 (4), 354-363 (2017).
- Frantzides, C. T., et al. Laparoscopic Roux-en-Y gastric bypass utilizing the triple stapling technique. Journal of the Society of Laparoendoscopic Surgeons. 10 (2), 176-179 (2006).
- Madan, A. K., Frantzides, C. T. Triple-stapling technique for jejunojejunostomy in laparoscopic gastric bypass. Archives of Surgery. 138 (9), 1029-1032 (2003).
- Forrester, J. D., et al. Surgery for hereditary diffuse gastric cancer: Long-term outcomes. Cancers. 14 (3), 728 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados