Method Article
Transferencias diarias, archivo de poblaciones y medición de la aptitud física en el experimento de evolución a largo plazo con Escherichia coli
En este artículo
Resumen
Este protocolo describe cómo mantener el Experimento de Evolución a Largo Plazo (LTEE) de Escherichia coli realizando sus transferencias diarias y congelaciones periódicas y cómo realizar ensayos de competencia para medir las mejoras de aptitud física en bacterias evolucionadas. Estos procedimientos pueden servir como plantilla para los investigadores que comienzan sus propios experimentos de evolución microbiana.
Resumen
El Experimento de Evolución a Largo Plazo (LTEE) ha seguido a doce poblaciones de Escherichia coli a medida que se han adaptado a un entorno de laboratorio simple durante más de 35 años y 77,000 generaciones bacterianas. La configuración y los procedimientos utilizados en el LTEE personifican métodos confiables y reproducibles para estudiar la evolución microbiana. En este protocolo, primero describimos cómo las poblaciones de LTEE se transfieren a un medio fresco y se cultivan cada día. Luego, describimos cómo las poblaciones de LTEE se verifican regularmente para detectar posibles signos de contaminación y se archivan para proporcionar un "registro fósil" congelado permanente para su posterior estudio. Las múltiples salvaguardas incluidas en estos procedimientos están diseñadas para prevenir la contaminación, detectar varios problemas cuando ocurren y recuperarse de las interrupciones sin retrasar apreciablemente el progreso del experimento. Una forma en que el ritmo general y el carácter de los cambios evolutivos se monitorean en el LTEE es midiendo la aptitud competitiva de las poblaciones y cepas del experimento. Describimos cómo se llevan a cabo los ensayos de competencia de cocultura y proporcionamos una hoja de cálculo y un paquete R (fitnessR) para calcular la aptitud relativa a partir de los resultados. En el transcurso del LTEE, los comportamientos de algunas poblaciones han cambiado de maneras interesantes, y las nuevas tecnologías como la secuenciación del genoma completo han proporcionado vías adicionales para investigar cómo han evolucionado las poblaciones. Terminamos discutiendo cómo se han actualizado los procedimientos LTEE originales para acomodar o aprovechar estos cambios. Este protocolo será útil para los investigadores que utilizan el LTEE como un sistema modelo para estudiar las conexiones entre la evolución y la genética, la biología molecular, la biología de sistemas y la ecología. En términos más generales, el LTEE proporciona una plantilla probada y verdadera para aquellos que están comenzando sus propios experimentos de evolución con nuevos microbios, entornos y preguntas.
Introducción
En febrero de 1988, Richard Lenski inoculó doce frascos que contenían un medio de crecimiento definido limitado en glucosa con cultivos clonales de Escherichia coli en la Universidad de California, Irvine1. Al día siguiente, transfirió el 1% del cultivo de cada matraz a un conjunto de matraces nuevos que contenían medio de crecimiento fresco. Esta dilución 1:100 permitió que las poblaciones bacterianas se expandieran 100 veces antes de agotar la glucosa disponible, correspondiente a aproximadamente 62/3 generaciones de divisiones celulares. Este procedimiento se repitió al día siguiente y lo ha sido todos los días desde entonces, con algunas interrupciones. Estas transferencias diarias han continuado, incluso cuando el experimento fue reubicado, primero a la Universidad Estatal de Michigan en 1992, y luego a la Universidad de Texas en Austin en 2022. Mientras tanto, nuevas mutaciones han generado continuamente variación genética en estas poblaciones de E. coli y la selección natural ha llevado a células evolucionadas a superar a sus antepasados.
Lenski diseñó este experimento, ahora conocido como el Experimento de Evolución a Largo Plazo (LTEE), para investigar la dinámica y la repetibilidad de la evolución. Para responder a estas preguntas, incluyó varias características importantes en el diseño de la configuración experimental y sus protocolos2. Una de estas características fue la elección cuidadosa de un organismo modelo. Las doce poblaciones originales se iniciaron a partir de colonias individuales que compartían un ancestro común inmediato, Escherichia coli B cepa REL606. Esta cepa fue elegida porque ya había sido comúnmente utilizada en entornos de laboratorio, se reproducía completamente asexualmente y no contenía plásmidos ni profagos intactos 3,4, todo lo cual simplifica el estudio de su evolución. Otra opción que simplificó el experimento fue utilizar una concentración muy baja de glucosa en el medio de crecimiento para limitar la densidad de células en cada matraz después del crecimiento. El uso de una baja densidad celular tenía la intención de facilitar el análisis de los cambios en la aptitud de la población al reducir el potencial de evolución de las interacciones ecológicas dentro de las poblaciones (por ejemplo, mediante la alimentación cruzada)5.
REL606 no puede utilizar ʟ-arabinosa como fuente de carbono y energía (Ara−) debido a una mutación puntual en el gen araA . Antes de comenzar el LTEE, un mutante espontáneo con una secuencia araA restaurada, designado REL607, fue aislado de REL6066. REL607 es capaz de crecer en ʟ-arabinosa (Ara+). REL606 se utilizó para iniciar seis de las poblaciones LTEE, y REL607 se utilizó para iniciar las otras seis. La arabinosa no está presente en el medio de crecimiento utilizado durante el LTEE, por lo que REL607 se comporta igual que REL606 en estas condiciones. Sin embargo, cuando se colocan en agar tetrazolio arabinosa (TA), las células Ara− y Ara+ forman colonias rojas y blancas, respectivamente. Este método para discriminar entre las dos cepas ancestrales de E. coli y sus descendientes es bastante útil. Se puede utilizar para detectar la contaminación cruzada entre poblaciones LTEE. También ayuda a medir la aptitud de una cepa o población Ara− en relación con una Ara+ cuando compiten entre sí. La aptitud física se mide estableciendo una cocultura de competidores marcados opuestamente y luego monitoreando cómo cambian las frecuencias de las colonias rojas y blancas (obtenidas al esparcir diluciones del cultivo en placas TA) entre cuando los competidores se mezclan inicialmente y después de uno o más ciclos de crecimiento en las mismas condiciones que el LTEE. La representación del tipo de célula más apta aumentará durante cada ciclo de crecimiento.
Otra característica crítica del LTEE es que las muestras de las poblaciones en evolución se archivan periódicamente. Cuando se mezcla con un crioprotector como el glicerol, las células de E. coli pueden congelarse y luego revivirse7. Como parte del protocolo LTEE, cada día 75 (lo que equivale a aproximadamente 500 generaciones), una parte de cada población que no se transfirió a un nuevo matraz se mezcla con glicerol, se divide entre múltiples viales y se almacena en un congelador. Este "registro fósil" congelado permitió a los investigadores realizar los primeros estudios del LTEE, en los que revivieron las poblaciones evolucionadas de E. coli de varios puntos de tiempo y compitieron con ellas contra las cepas ancestrales para rastrear qué tan rápido aumentaba la aptitud1. La evolución de la aptitud física se ha vuelto a medir periódicamente a medida que se han conservado más "estratos" del "registro fósil" congelado. La conclusión general de estas mediciones es que la aptitud física continúa mejorando en el LTEE hasta el día de hoy, incluso después de tantas generaciones de evolución en el mismo entorno 8,9,10.
¿Qué ha permitido que el LTEE continúe durante tanto tiempo? Muchas de las mismas características que permitieron que se hicieran y respondieran sus preguntas originales también han servido como medidas de seguridad y a prueba de fallas contra interrupciones inevitables debidas a la mala suerte, el error humano y los eventos mundiales. Todos los días, cuando los cultivos se transfieren a un nuevo medio de crecimiento, el investigador que realiza las transferencias alterna entre las poblaciones Ara− y Ara+ . Luego, cuando las poblaciones están congeladas, se pueden colocar en agar selectivo e indicador para verificar si alguna población "vecina" ha sido accidentalmente contaminada o mezclada (por ejemplo, las colonias blancas están en una población que solo debería formar colonias rojas) o contaminada con microbios extraños (por ejemplo, morfologías inesperadas de colonias o densidades celulares). En el caso de que una población se haya visto comprometida, su progenitor puede ser revivido del congelador y llevado adelante en su lugar. Por lo tanto, los marcadores Ara y el archivo congelado tienen un doble propósito como recursos experimentales y medidas de seguridad.
Debido a que su historia está tan bien conservada y es de fácil acceso, las muestras LTEE se han estudiado utilizando tecnologías que no existían cuando comenzó el experimento. Por ejemplo, la secuenciación del genoma completo se ha utilizado para examinar la dinámica de las mutaciones en las poblaciones LTEE 11,12,13,14,15, y la transcriptómica y el perfil ribosómico se han utilizado para examinar los cambios en la expresión génica 16,17. Se han utilizado herramientas genéticas para reconstruir cepas que difieren por mutaciones individuales o combinaciones de varias mutaciones evolucionadas para comprender sus efectos sobre la aptitud y diversos fenotipos 18,19,20,21. Las muestras del "registro fósil" congelado se reponen fácilmente para que partes o copias completas de la historia del experimento puedan enviarse a otros laboratorios. Las muestras LTEE ahora existen en todos los continentes excepto en la Antártida, y están siendo estudiadas por investigadores que son más jóvenes que el experimento en sí. Los métodos robustos de las muestras y cepas de LTEE y E. coli evolucionadas de su registro histórico también han servido como puntos de partida para experimentos de evolución que examinan otras preguntas y entornos 22,23,24,25,26,27,28,29.
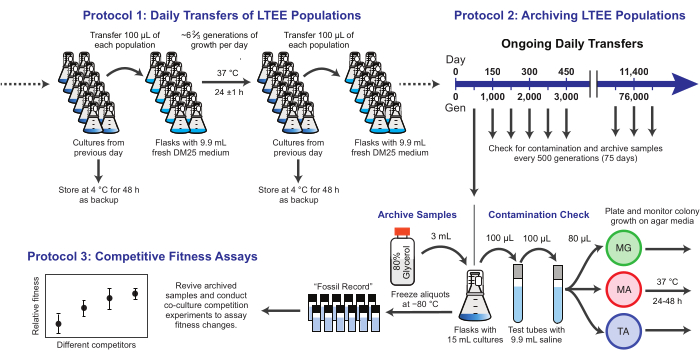
Figura 1: Descripción general de los procedimientos LTEE. Haga clic aquí para ver una versión más grande de esta figura.
Aquí, demostramos tres protocolos básicos utilizados en el Experimento de Evolución a Largo Plazo de E. coli (Figura 1). Describimos: (1) cómo realizar las transferencias diarias, (2) cómo archivar muestras de población y aislados clonales, y (3) cómo realizar y analizar ensayos de competencia de cocultivo para medir las diferencias de aptitud física. Nuestra esperanza es que estos protocolos fomenten el uso continuo de los recursos LTEE e informen el diseño de nuevos experimentos de evolución microbiana.
Protocolo
1. Transferencias diarias de poblaciones LTEE
NOTA: Las doce poblaciones de LTEE se transfieren diariamente inoculando medio fresco con el 1% de los cultivos de los matraces del día anterior. Los pasos de este proceso se resumen en la figura 1. Las seis poblaciones Ara− que comenzaron a partir de la cepa REL606 se designan A−1 a A-6, y las seis poblaciones Ara+ que comenzaron a partir de la cepa REL607 se designan A+1 a A+6. El estricto cumplimiento de la técnica aséptica y de un calendario y orden para el traslado de las poblaciones minimiza el riesgo de contaminación y otras perturbaciones.
- Desinfecte la superficie sobre la que se realizarán las transferencias de LTEE limpiándola con etanol al 70% o una solución de lejía al 10%. Encienda un mechero Bunsen para crear una corriente ascendente local y permitir la llama de la cristalería.
NOTA: Use guantes de laboratorio para evitar la contaminación. Para la seguridad alrededor de una llama abierta, es fundamental usar solo guantes que estén hechos de un material como el nitrilo que no sea inflamable. - Preparar trece matraces Erlenmeyer de borosilicato de 50 ml tapados con vasos de precipitados de borosilicato o polipropileno de 20 ml que hayan sido lavados y esterilizados en autoclave. Revise los frascos en busca de residuos visibles y reemplace los que no estén perfectamente limpios.
- Etiquete seis matraces A-1 a A-6 usando un marcador rojo y los otros seis matraces A+1 a A+6 usando un marcador negro. Etiquetar el último matraz restante, que estará en blanco, con la fecha en formato mes/día y el día de la semana.
- Llenar cada uno de los 13 matraces con 9,9 ml de medio DM25 utilizando una pipeta serológica estéril de 10 ml. Encender la boca de cada matraz después de retirar el vaso de precipitados que sirve de tapa y antes de reemplazar el vaso de precipitados. Encender la punta de la pipeta entre el llenado de cada matraz.
NOTA: Las instrucciones para hacer DM25 están disponibles en línea30. Si usa una pipeta serológica de plástico, evite quemar su punta o limite el tiempo en la llama para evitar que el plástico se derrita. - Retire los frascos LTEE del día anterior de la incubadora de agitación.
- Examine cada matraz sosteniéndolo hacia la luz para evaluar su turbidez y color, verifique la integridad del matraz y busque la presencia de materias extrañas.
NOTA: A simple vista, todas las culturas Ara− y Ara+ se verán ligeramente turbias en comparación con el espacio en blanco, excepto A−3, que será ~10 veces más turbio que las otras debido al crecimiento del citrato en el medio. Muchos contaminantes microbianos externos también pueden crecer en citrato, por lo que el aumento de la turbidez en poblaciones distintas de A-3 probablemente indica contaminación. Consulte la sección Resultados representativos para obtener imágenes de las referencias culturales LTEE antes de una transferencia. - OPCIONAL: Confirme que cada cultivo LTEE tiene la turbidez esperada pipeteando 1 ml del blanco y 1 ml de cada cultivo en cubetas de plástico de 1 cm y tomando lecturas de densidad óptica a 600 nm (OD600) usando un espectrofotómetro después de borrar el instrumento.
NOTA: Este paso adicional puede ser útil para los investigadores que son nuevos en el trabajo con el LTEE y no están seguros de juzgar la turbidez a simple vista, así como para documentar e investigar posibles anomalías. Tomar muestras para medir OD600 de los matraces del día anterior solo después de completar las transferencias normales del día a nuevos matraces (los siguientes pasos) para minimizar el riesgo de contaminación de las poblaciones celulares que continuarán propagándose si los valores de OD600 son los esperados. Consulte la sección Resultados representativos para conocer los valores típicos de OD600 para referencias culturales LTEE. - Con una micropipeta P200 con punta filtrante estéril, transferir 100 μL de cultivo de cada matraz LTEE al matraz correspondiente que contenga DM25 fresco. Comience con A-1, luego transfiera A + 1. Después de eso, continúe alternando entre las poblaciones − y +. Para realizar un seguimiento de qué culturas se han transferido, cambie los matraces hacia la izquierda después de pipetear desde o hacia ellos.
NOTA: El orden estricto de transferencias y alternancia entre las poblaciones Ara− y Ara+ ayuda a prevenir y detectar la contaminación cruzada y las confusiones. Observe una técnica aséptica estricta: use una punta de pipeta fresca para cada transferencia, encienda la boca de los frascos inmediatamente después de destapar y antes de recapitular, y limpie el barril y el eyector de la micropipeta con una toallita de papel sin pelusa humedecida con etanol al 70% entre cada transferencia. La lejía nunca debe usarse para desinfectar micropipetas, ya que incluso pequeñas cantidades pueden matar los cultivos. - Incubar los matraces recién inoculados a 37 °C durante 24 ± 1 h con agitación orbital de 120 rpm sobre un diámetro de 1 pulgada.
- Conservar los cultivos del día anterior a 4 °C. Conserve estas referencias culturales de copia de seguridad durante dos días. Deseche los cultivos más antiguos que se salvaron a 4 °C tres días antes en este momento.
NOTA: Los cultivos de los dos días anteriores proporcionan dos conjuntos completos de copias de seguridad con las que reiniciar el experimento, si es necesario, en caso de que ocurra algún problema o accidente, o si se descubre contaminación de los cultivos del día anterior antes de la transferencia (por ejemplo, coloración extraña o partículas inesperadas). - Ingrese la hora, la fecha, el número de transferencia, el nombre o las iniciales del investigador que realizó las transferencias, si las culturas estaban bien o no, y cualquier otra información relevante en el cuaderno del registro de transferencias. Continúe con los pasos 1.12-1.14 si ocurre alguna de las siguientes situaciones: (1) el blanco del día anterior está contaminado, (2) un matraz o su tapa está agrietada o rota, (3) un matraz contiene material extraño, (4) un matraz se vuelca o se cae durante las transferencias, o (5) hay cualquier otro evento u observación que hace que continuar con estos frascos sea cuestionable.
- Si hay algún problema, accidente o sospecha de contaminación con los cultivos LTEE del día anterior, no se transfiera de ellos. En su lugar, almacenar todo el conjunto de doce cultivos a 4 °C para su posterior examen y caracterización.
- Recuperar los matraces que contienen los cultivos de copia de seguridad que se transfirieron del día anterior y se almacenaron a 4 °C. Colóquelos en la mesa de trabajo para que se calienten a temperatura ambiente. Agitar suavemente cada matraz para resuspender las células.
- Transvasar de los matraces de reserva al nuevo conjunto de matraces que contengan medio fresco y continuar el experimento normalmente como se describe en los pasos 1.6-1.11. Anote en el registro de transferencia que se utilizaron las referencias culturales de copia de seguridad y registre el mismo número de transferencia que el día anterior.
NOTA: Incluso si se observa un problema en el matraz de una sola población, transfiera las doce poblaciones de los matraces de respaldo para que el número de generaciones que han transcurrido en todas las poblaciones permanezca en fase. Si se observa contaminación en los matraces de reserva almacenados a 4 °C, las poblaciones de LTEE afectadas deberán reiniciarse a partir de existencias congeladas utilizando el procedimiento descrito en los pasos 3.1-3.2 para las muestras de población. El número de transferencia para el LTEE no debe incrementarse hasta el crecimiento de los primeros cultivos en DM25 después del renacimiento.
2. Archivar las poblaciones LTEE
NOTA: Las muestras de las poblaciones LTEE se congelan cada 75 transferencias. Las poblaciones crecen ~ 6 2/3 generaciones cada día después de la dilución de transferencia de 100 veces, por lo que este período corresponde a ~ 500 generaciones. Durante el archivo, las poblaciones de LTEE también se colocan en diferentes tipos de medios de agar para verificar la contaminación. Opcionalmente, los clones representativos se pueden recoger de estas placas y archivar en este momento. Estos pasos se resumen en la figura 1.
- El día antes de la congelación planificada o unos días antes, prepare tres tipos de placas de agar: glucosa mínima (MG), arabinosa mínima (MA) y arabinosa de tetrazolio (TA). Haz doce platos de cada tipo de agar, más algunos extras. También prepare al menos 250 ml de solución salina estéril al 0,85% (p/v) y 50 ml de glicerol estéril al 80% (v/v).
NOTA: Las recetas para todos los medios y soluciones están disponibles en línea30. El día antes de que el LTEE alcance una generación que es un múltiplo de 500 para el programa de archivado regular esel día 74 desde la última congelación más los días que se agregaron debido a transferencias desde los matraces de copia de seguridad de 4 °C cuando se detectaron o sospecharon problemas. - OPCIONAL: Si archiva aislados clonales de las poblaciones LTEE, prepare suministros adicionales: aislar tres clones de cada población requiere 72 placas de MG, 80 ml de glicerol al 80% (v / v) y 370 ml de DM1000.
- Prepare un juego adicional de doce matraces cuando realice el paso 1.2 de las transferencias LTEE diarias el día anterior a la congelación planificada. Etiquete seis de los matraces adicionales xA−1 a xA−6 usando un marcador rojo, y los otros seis xA+1 a xA+6 usando un marcador negro.
NOTA: La "x" indica que el juego adicional de frascos se utilizará para archivar y los diferencia del otro conjunto de frascos que se utilizarán para continuar las transferencias diarias del LTEE en paralelo. - Llene cada uno de los matraces adicionales que se utilizarán para archivar con 14,85 ml de DM25 utilizando una pipeta serológica de 25 ml cuando realice el paso 1.4 de las transferencias diarias de LTEE.
- Complete la transferencia LTEE normal como se describe en los pasos 1.5-1.11. Luego, repita las instrucciones para el paso 1.8, pero esta vez transfiera 150 μL de cada uno de los cultivos LTEE del día anterior a los matraces adicionales de 14.85 ml de DM25 fresco que se utilizarán para archivar.
NOTA: En este y todos los pasos posteriores, evite la contaminación y las confusiones siguiendo estas pautas. Comience con la población A−1, luego transfiera A+1 y luego continúe alternando − y + poblaciones. Limpie el barril y el eyector de la micropipeta con una toallita de papel sin pelusa humedecida con etanol al 70% al cambiar de población. Cambie los matraces y los tubos de ensayo en sus bandejas o bastidores después de pipetear desde o hacia ellos para realizar un seguimiento de las transferencias que se han completado. - Incubar el conjunto de doce matraces para archivar a 37 °C durante 24 ± 1 h con agitación orbital de 120 rpm sobre un diámetro de 1 pulgada junto con los doce cultivos LTEE y el blanco como se describe en el paso 1.9.
- Prepare los suministros para el abastecimiento de las poblaciones de LTEE al menos una hora antes de que las transferencias de LTEE se realicen el día de la congelación.
- Seleccione doce placas de agar MG, doce MA y doce TA. Inspeccione visualmente cada uno para asegurarse de que no tenga ninguna contaminación obvia.
- Etiquete uno de cada tipo de placa para cada una de las doce poblaciones LTEE (A-1 a A+6).
NOTA: Al etiquetar placas, escriba en los lados de la parte inferior de la placa de Petri. Esto es importante para no oscurecer las colonias cuando uno quiere examinarlas o fotografiarlas desde debajo del agar. No escriba en las tapas, ya que pueden mezclarse. - Colocar las placas de agar en una incubadora a 37 °C durante al menos 20 minutos para calentarlas antes de utilizarlas en el paso 2.10.
- Prepare 24 tubos de ensayo que contengan 9.9 ml de solución salina. Colóquelos en doce juegos de dos tubos cada uno.
- Etiquete cada uno de los dos juegos de doce tubos de ensayo de la misma manera que las placas, agregando un "1" o un "2" debajo del identificador de población LTEE para designar el orden en que se utilizarán para hacer diluciones de esa población.
- Realice los pasos 1.1-1.11 utilizando los matraces que continuarán las transferencias diarias del LTEE como de costumbre. Durante el paso 1.5, retire también los doce matraces que contienen los cultivos adicionales para archivar de la incubadora de agitación.
- Pipetear 100 μL del cultivo de cada uno de los doce matraces adicionales para archivar en el primer tubo de ensayo de solución salina del par para esa población LTEE. Vórtice los tubos con estas diluciones de 100 veces a fondo. A continuación, pipetear 100 μL de cada uno al segundo tubo de solución salina correspondiente. Vortex las diluciones finales de cultivo de 10,000 veces a fondo.
- Pipetear 80 μL de cada uno de los tubos que contienen una dilución de cultivo de 10.000 veces a las placas etiquetadas TA, MG y MA para esa población. Extienda el líquido uniformemente a través de la superficie del agar usando una varilla de propagación estéril o perlas estériles, según se prefiera. Repita hasta que las doce poblaciones hayan sido plateadas en los tres tipos de medios.
- Si es necesario, deje que las placas se sequen hasta que no haya líquido visible en el agar. Coloque las placas boca abajo (con el agar hacia arriba) en una incubadora de convección por gravedad a 37 °C.
NOTA: La incubación de placas boca abajo evita que el agar se seque y evita que la condensación gotee sobre la superficie del agar. El movimiento de células en líquido en la superficie del agar durante la incubación puede manchar colonias y producir recuentos incorrectos de colonias. - Agregue 3 ml de glicerol estéril al 80% (v / v) a cada uno de los doce frascos adicionales destinados al archivo. Mezclar bien girando y vórtice suavemente.
- Distribuir la mezcla de cada matraz a crioviales estériles que hayan sido etiquetados con un identificador único para la muestra, la población LTEE a la que pertenece la muestra, la generación en la que se congeló, que es una muestra mixta (población) y la fecha. Pipetear 6 ml en un vial grande y 1,25 ml en cada uno de los seis viales pequeños.
NOTA: El vial grande es el material de trabajo. Un pequeño vial es una copia de seguridad en caso de que el material de trabajo se agote o se contamine. Los otros cinco viales pequeños son copias que se pueden enviar a otros laboratorios. - Congelar los viales llenos a -80 °C.
- Examinar y documentar el crecimiento y las morfologías de las colonias en las placas TA, MG y MA después de 24 h y 48 h de incubación.
NOTA: Consulte la sección Resultados representativos para obtener imágenes y descripciones de colonias formadas por los ancestros REL606 y REL607 y cada una de las doce poblaciones LTEE cuando se clasificaron en 76,000 generaciones. - OPCIONAL: Realice los siguientes pasos al archivar aislados clonales.
- Recoger tres aislados clonales (colonias) para cada población LTEE de las placas MG, rayar cada uno por separado en una nueva placa MG e incubar estas placas durante 16-24 h a 37 °C.
NOTA: Si hay colonias con diferentes morfologías, la práctica estándar en el LTEE es muestrear la máxima diversidad seleccionando primero el tipo más común y luego seleccionando más colonias de tipos minoritarios. También se puede usar una estrategia de muestreo aleatorio marcando puntos en la parte inferior de la parte inferior de la placa de Petri antes de esparcir las células y luego elegir la colonia aislada más cercana a cada marca después del crecimiento. - Al día siguiente, rayar una colonia representativa de cada placa en una nueva placa MG e incubar estas placas durante 16-24 h a 37 °C.
- Al día siguiente, inocular una colonia aislada de cada placa de MG en un matraz que contenga 10 ml de DM1000 fresco. Además, llene un matraz adicional con 10 ml de DM1000 para que sirva como un blanco no inoculado para detectar la contaminación del medio.
- Incubar los matraces a 37 °C durante 16-24 h con agitación orbital de 120 rpm sobre un diámetro de 1 pulgada.
- Después de la incubación, añadir 2 ml de glicerol estéril al 80% (v/v) a cada matraz y agitar para mezclar.
- Distribuir 1,25 ml de alícuotas de cada matraz en viales pequeños y estériles etiquetados con un identificador único para cada clon, su población LTEE y generación de origen, que es una muestra clonal, y la fecha.
- Congelar los viales llenos a -80 °C.
- Recoger tres aislados clonales (colonias) para cada población LTEE de las placas MG, rayar cada uno por separado en una nueva placa MG e incubar estas placas durante 16-24 h a 37 °C.
3. Ensayos de aptitud competitiva
NOTA: En el LTEE, la aptitud reproductiva se cuantifica en términos del número relativo de duplicaciones que diferentes bacterias logran durante uno o más ciclos de cultivo de 24 h en las mismas condiciones que las transferencias diarias. Específicamente, la aptitud relativa de un competidor a otro es la proporción de sus tasas de duplicación realizadas cuando compiten cara a cara en una cocultura. Cada competidor en un par puede ser una población completa o un aislado clonal que fue archivado previamente como parte del "registro fósil" congelado del LTEE. Alternativamente, uno o ambos competidores pueden ser un clon que ha sido modificado genéticamente para agregar o eliminar mutaciones específicas para probar sus efectos. Los dos competidores deben tener estados Ara+/Ara− opuestos porque este marcador genético se utiliza para diferenciarlos durante este ensayo. El flujo de trabajo general para un ensayo de competición se muestra en la figura 2. La duración de la fase de cocultivo se puede extender de uno a tres (o más) días para mejorar la precisión de las estimaciones de aptitud física al probar las diferencias entre competidores que están casi igualadas. Consulte la Disussión para otras consideraciones críticas y posibles modificaciones de este protocolo.
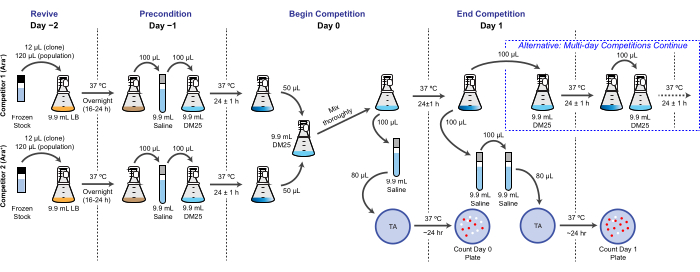
Figura 2: Diagrama de flujo del ensayo de competencia. Se muestra el procedimiento completo para un ensayo de competición de un día. El procedimiento de tres días continúa con la vía alternativa en el Día 1 y el Día 2 hasta el plateado en el Día 3 de la misma manera que se muestra para el Día 1 de la competencia de un día. Haga clic aquí para ver una versión más grande de esta figura.
- Preparar suministros
- Decida cuántas cepas y/o poblaciones LTEE competidoras se utilizarán y cuántos ensayos de competencia replicados se realizarán para cada par de competidores. Prepare los suministros necesarios como se describe en los siguientes pasos.
NOTA: Las recetas para todos los medios y soluciones están disponibles en línea30. Los matraces y tubos de ensayo necesarios para todos los días de un experimento de competición se pueden llenar de antemano o según sea necesario en los días en que se utilizarán. Si los matraces y tubos de ensayo se llenan con anticipación, guárdelos a temperatura ambiente en la oscuridad para minimizar la evaporación. Las placas de TA deben prepararse al menos dos días antes de cuándo se usarán para que puedan secarse lo suficiente después de verterlas para permitir la propagación de diluciones de cultivo. Siempre prepare algunos matraces adicionales, tubos de ensayo y placas TA para que un experimento pueda continuar si hay errores de pipeteo, placas contaminadas u otros percances menores. - Para el día de reactivación (Día −2), llene un matraz estéril de 50 ml de erlenmeyer tapado con un vaso de precipitados de 20 ml con 9,9 ml de DM1000 o caldo de lisogenia (LB) por cepa o población de E. coli que se utilizará como competidor. Llenar un matraz más con 9,9 ml del mismo medio para que sirva como blanco no inoculado.
- Para el día de preacondicionamiento (Día −1), llene un tubo de ensayo con 9,9 ml de solución salina estéril al 0,85% (p/v) por competidor, dos matraces con 9,9 ml de DM25 por ensayo de repetición entre un par de competidores, y un matraz más con 9,9 ml de DM25 para un espacio en blanco.
- Para el día en que comience la competición (Día 0), llene un matraz con 9,9 ml de DM25, llene un tubo de ensayo con 9,9 ml de solución salina estéril al 0,85% (p/v) y prepare una placa TA por ensayo de competición replicado. Llenar un matraz más con 9,9 ml de DM25 para que sirva como espacio en blanco.
- ALTERNATIVA: Por cada día de una competencia de varios días después del primero, llene un matraz con 9.9 ml de DM25 por réplica de competencia y llene un matraz más con 9.9 ml de DM25 para un espacio en blanco.
- Para el último día de la competencia (por ejemplo, el Día 1 o el Día 3), llene dos tubos de ensayo con 9.9 ml de solución salina estéril al 0.85% (p/v) y prepare una placa TA por réplica de la competencia.
- Decida cuántas cepas y/o poblaciones LTEE competidoras se utilizarán y cuántos ensayos de competencia replicados se realizarán para cada par de competidores. Prepare los suministros necesarios como se describe en los siguientes pasos.
- Día −2: Revive a los competidores por separado en DM1000 o LB
- Para cada uno de los competidores, etiquete un matraz lleno de 9,9 ml de DM1000 o LB. Etiquete un matraz adicional lleno de 9,9 ml del mismo lote de medio para que sirva como un blanco no inoculado para detectar contaminación.
NOTA: Las existencias congeladas se reactivan en LB o DM1000 para una recuperación más uniforme y predecible de células criopreservadas. El glicerol utilizado como crioprotector puede ser metabolizado por E. coli, lo que conducirá a densidades celulares más altas de lo esperado si las muestras se reviven en DM25. LB y DM1000 apoyan el crecimiento a densidades celulares tan altas que esta complicación se vuelve insignificante. - Sacar del congelador los crioviales que contienen las existencias congeladas de las cepas competidoras. Mantenga los viales fríos en un cubo de hielo mientras los usa.
- Después de que cada stock congelado se haya descongelado, vórtice completamente para resuspender las células de E. coli. Si va a revivir un clon, inocular el matraz que contiene medio fresco con 12 μL de la cepa congelada. Si se reactiva una población, inocular el matraz con 120 μL de la cepa congelada.
NOTA: El volumen de 120 μL del material congelado se utiliza para las poblaciones, de modo que el número de células que se reactivan es aproximadamente el mismo que el cuello de botella diario cuando el 1% de la población LTEE se transfiere a un nuevo matraz. Descongelar y vortex las existencias congeladas varias veces puede estresar las células y reducir la viabilidad de las poblaciones con el tiempo. Si una población o clon LTEE determinado se va a utilizar en competiciones varias veces, es una buena práctica volver a crecer y congelar varias copias del stock para que ninguna se descongele y vuelva a congelar muchas veces. - Incubar los matraces de reactivación y el blanco a 37 °C durante la noche (16-24 h) con agitación orbital de 120 rpm sobre un diámetro de 1 pulgada.
- Para cada uno de los competidores, etiquete un matraz lleno de 9,9 ml de DM1000 o LB. Etiquete un matraz adicional lleno de 9,9 ml del mismo lote de medio para que sirva como un blanco no inoculado para detectar contaminación.
- Día −1: Precondicionar a los competidores por separado en DM25
- Para cada competidor, etiquete un tubo de ensayo lleno de 9.9 ml de solución salina. Para cada ensayo de competición de réplica entre un par de competidores, etiquete dos matraces de 50 ml llenos de 9,9 ml de DM25, cada uno con el número de réplica y el nombre de uno de los competidores. Etiquete un matraz adicional lleno de 9,9 ml de DM25 para que sirva como espacio en blanco.
- Saque de la incubadora los frascos que contienen los cultivos de competidores revividos. Examine su turbidez a ojo para confirmar que crecieron y que no hay contaminación obvia.
- Pipetear 100 μL de cada matraz en el tubo de ensayo de solución salina para ese competidor.
NOTA: Este paso diluye el cultivo 100 veces, lo cual es necesario porque la densidad de células es mucho mayor en LB y DM1000 que en el entorno DM25 utilizado en el LTEE (ver Resultados representativos). - Mezclar minuciosamente cada tubo de dilución justo antes de pipetear 100 μL del cultivo diluido en un matraz con DM25 fresco. Inocular dos de estos matraces de preacondicionamiento para cada ensayo de réplica, uno para cada uno de los competidores.
- Incubar los matraces de preacondicionamiento y el blanco a 37 °C durante 24 ± 1 h con agitación orbital de 120 rpm sobre un diámetro de 1 pulgada.
- Día 0: Comience la competencia mezclando competidores y platos para los conteos iniciales
- Para cada ensayo de competición replicar, etiquete un matraz lleno de 9,9 ml de DM25 y un tubo de ensayo lleno de 9,9 ml de solución salina. Etiquete los matraces y tubos de una manera que identifique de manera única cada par de competidores y el número de réplica del ensayo de la competencia. Etiquete un matraz adicional lleno de 9,9 ml de DM25 para que sirva como espacio en blanco.
- Saque los frascos de preacondicionamiento de la incubadora. Examine su turbidez a ojo para confirmar que crecieron y que no hay contaminación obvia.
- Transfiera 50 μL del competidor Ara− al primer matraz de competición de réplica lleno de DM25 fresco. Inmediatamente, transfiera 50 μL del competidor Ara+ al mismo matraz de competición y mézclelo agitando suavemente.
- Repita el paso 3.4.3 para todas las réplicas de todos los pares de competidores.
NOTA: Los matraces de competición ahora tienen una dilución general de 100 veces de cultivos de E. coli cultivados en DM25, la misma condición que las células en la experiencia LTEE después de cada transferencia diaria. El orden de realización de transferencias y mezclas es importante. Agregue ambos competidores a cada matraz inmediatamente uno tras otro para que ninguno comience a crecer en el medio fresco. Por ejemplo, no agregue los cultivos Ara− a todos los matraces de competición y luego regrese y agregue todas las cepas Ara+ . - Pipetear 100 μL de cada matraz de competición recién inoculado en el tubo de ensayo de solución salina marcado para ese ensayo de competición replicar de modo que cada uno de estos tubos contenga una dilución global de 10.000 veces de los cultivos de DM25 preacondicionados que se combinaron.
- Coloque los matraces de competición y los espacios en blanco en la incubadora agitadora. Incubar los matraces de competición a 37 °C durante 24 ± 1 h con agitación orbital de 120 rpm sobre un diámetro de 1 pulgada.
- El mismo día, inmediatamente después de colocar los matraces de competición en la incubadora, aplique un vórtice minucioso a cada tubo de ensayo del paso 3.4.5 y extienda 80 μL de estas diluciones de 10.000 veces en placas de TA, como se describe en el paso 2.10. Etiqueta el lado de la parte inferior de cada placa con el par de cepas que se mezclaron, el número de réplica y "Día 0" para indicar que se utilizará para determinar la representación inicial de cada competidor.
- Incubar las placas TA boca abajo en una incubadora de convección por gravedad a 37 °C hasta que las colonias de los competidores Ara− y Ara+ sean visibles y distinguibles. Generalmente, esto ocurre dentro de las 16-24 h, pero puede tomar más tiempo para algunas cepas evolucionadas. Cuente el número de colonias Ara− (roja) y Ara+ (blanca) en cada placa yregistre los resultados.
NOTA: Las diferencias entre los colores de las colonias Ara- y Ara+ en las placas TA se vuelven menos claras con el tiempo, incluso cuando las placas se almacenan a 4 °C, por lo que deben contarse lo más rápido posible una vez que se retiran de la incubadora. Las imágenes de las placas de TA que muestran las apariencias típicas de las colonias formadas por células Ara− y Ara+ se incluyen en los Resultados Representativos. Esa sección también tiene imágenes de colonias comunes de "casos extremos" (por ejemplo, superposición o crecimiento de diferentes tipos de colonias), y explica cómo contarlas. Si las tasas de crecimiento y las morfologías de las colonias formadas en placas de TA por cualquiera de los competidores no se han caracterizado previamente, esparcir 80 μL de una dilución de 10.000 veces en solución salina de los matraces de preacondicionamiento el día 0, cuando los competidores todavía están separados entre sí. A continuación, examinar las colonias en estas placas de control después de la incubación a 37 °C durante 16-24 h o más.
- ALTERNATIVA: Días 1 y 2: Continuar la competencia de tres días
- Para cada réplica del ensayo de competición, etiquete un matraz lleno de 9,9 ml de DM25. Etiquete los frascos de una manera que identifique de manera única a cada par de competidores, el número de réplica y el día del ensayo de competencia. Etiquete un matraz adicional lleno de 9,9 ml de DM25 para que sirva como espacio en blanco.
- Saca de la incubadora los frascos de competición del día anterior. Examine su turbidez a simple vista para verificar el crecimiento esperado y detectar la contaminación.
- Transvasar 100 μL de cada matraz de competición al matraz de medio fresco correspondiente para el día siguiente de la competición.
- Coloque los nuevos frascos de competición y los espacios en blanco en la incubadora agitadora. Incubarlos a 37 °C durante 24 ± 1 h con agitación orbital de 120 rpm sobre un diámetro de 1 pulgada.
- Repita los pasos 3.5.1-3.5.4 el día 2 de la competición antes de continuar.
- Día 1 o 3: Terminar la competencia y el plato para los conteos finales
- Para cada matraz de competición, preparar dos tubos de ensayo llenos de 9,9 ml de solución salina. Etiquételos de una manera que identifique de manera única a cada par de competidores, el número de réplica y si son para la primera o segunda dilución.
- Saque los frascos de competición de la incubadora. Examine su turbidez a ojo para detectar que crecieron y no hubo contaminación obvia.
- Pipetear 100 μL de cada matraz de competición en el primer tubo de solución salina para que se repita. Los tubos resultantes contienen diluciones de 100 veces de los cultivos DM25.
- Vortex cada tubo de dilución de 100 veces para mezclarlo bien y pipetear 100 μL al segundo tubo de solución salina para que se repita. Los tubos resultantes contienen diluciones de 10.000 veces de los cultivos DM25.
- Mezclar completamente cada tubo de ensayo que contenga una dilución de 10.000 veces y esparcir 80 μL sobre una placa TA, tal como se describe en el paso 2.10. Etiquete el lado de la parte inferior de cada plato con el par de cepas que se mezclaron, el número de réplica y "Día 1" para una competencia de un día o "Día 3" para una competencia de tres días para indicar que se utilizará para determinar la representación final de cada competidor.
- Incubar las placas de TA a 37 °C y contar las colonias Ara− y Ara+ después del crecimiento, tal como se describe en el paso 3.4.8.
NOTA: Realice un seguimiento del número de réplica de cada ensayo de competencia a lo largo de todas las transferencias y pasos de enchapado. Confundir qué recuentos finales e iniciales corresponden entre diferentes ensayos replicados, incluso cuando los mismos dos competidores se mezclaron en cada uno, dará como resultado estimaciones de aptitud incorrectas.
- Cálculo y aptitud de la gráfica
- Si usa Excel para calcular y trazar la aptitud relativa, descargue la hoja de cálculo XLS (Archivo complementario 1). Si utiliza R, instale el paquete fitnessR31 y descargue la plantilla de valores separados por comas (CSV) (archivo complementario 2) o genere una nueva copia de este archivo siguiendo las instrucciones de su viñeta.
- Introduzca una "dilución de transferencia" de 100 para los ensayos de competencia realizados en la celda o columna designada en el archivo descargado. Ingrese el número total de ciclos de crecimiento diarios durante los cuales los competidores fueron cocultivados como el "número de transferencias" (por ejemplo, 3 para una competencia de tres días).
- Introduzca los nombres de cada par de competidores en las celdas o columnas designadas con la cepa de referencia como "competidor1" y la cepa o población de prueba como "competidor2".
- Para cada réplica de ensayo de competición, introduzca los respectivos recuentos de colonias iniciales y finales en las columnas designadas del archivo descargado.
- Si usa la hoja de cálculo de Excel, ahora mostrará el valor de aptitud relativa promedio y los límites de confianza del 95% en esta estimación. Copie los resultados de diferentes combinaciones de competidores a otra hoja y cree un gráfico que resuma los resultados. Si utiliza R para analizar los datos, siga las instrucciones de la viñeta del paquete fitnessR para realizar estos cálculos, genere un archivo CSV con los valores calculados y trace los resultados.
Resultados
Apariencia y turbidez de cultivos LTEE
Debido a la baja concentración de glucosa en DM25, la turbidez de las poblaciones LTEE completamente desarrolladas es apenas visible en once de los doce frascos. Al examinar los cultivos de LTEE a ojo para detectar un crecimiento normal y signos de contaminación (paso 1.6), cada matraz que contenga una población de LTEE debe compararse lado a lado con el blanco (Figura 3A). La excepción es la población A-3, que evolucionó para utilizar el citrato como fuente adicional de carbono y energía y, por lo tanto, alcanza una mayor densidad celular32. La turbidez de los cultivos DM25 de las cepas ancestrales REL606 y REL607 es similar a la de una población evolucionada típica (Figura 3B). Las cepas y poblaciones de LTEE crecen a una mayor densidad en DM1000 debido a la mayor concentración de glucosa, y una densidad mucho mayor en LB (Figura 3B). La densidad de cultivos DM25 de la población A-3 LTEE es intermedia entre las densidades de cultivos de REL606 en DM25 y DM1000 (Figura 3C).

Figura 3: Aparición de cultivos LTEE. (A) Los frascos que contienen las doce poblaciones de LTEE después de 24 h de crecimiento en DM25 el día en que el experimento alcanzó 76,253 1/3 generaciones se representan junto al espacio en blanco. (B) Los matraces que contienen cultivos de los ancestros REL606 y REL607 cultivados durante 24 h en DM25, DM1000 y LB se muestran junto a los espacios en blanco de los medios. (C) Imágenes ampliadas de los mismos matraces uno al lado del otro que muestran cómo la turbidez del matraz de población A-3 en DM25 se compara con el ancestro REL606 en DM25 y DM1000. Haga clic aquí para ver una versión más grande de esta figura.
Las lecturas del espectrofotómetro de las densidades ópticas a 600 nm (OD600) de cultivos cultivados en DM25 (paso 1.7) coinciden con estas observaciones visuales tanto para las poblaciones LTEE (Figura 4A) como para sus antepasados (Figura 4B). Estas lecturas se pueden utilizar para comparar cuantitativamente y documentar el crecimiento cuando se sospecha contaminación o un error. Para las mediciones de las poblaciones LTEE entre 76,000 y 76,500 generaciones, encontramos que el OD600 de A-3, la población que evolucionó para crecer con citrato, fue de 0.223 en promedio (0.218-0.227, intervalo de confianza del 95%). El OD600 de las otras once poblaciones fue de 0,0252 en promedio (0,0239-0,0265, intervalo de confianza del 95%). Hubo una ligera pero significativa variación en las lecturas de OD600 entre las once poblaciones normales (F 10,88 = 5,1035, p = 7,5×10−6). Las poblaciones de LTEE alcanzan la fase estacionaria después de aproximadamente 5-6 horas de incubación. Si se transfieren por la mañana, el crecimiento será visible a mediados o finales de la tarde del mismo día. Muchas especies de microbios son capaces de crecer aeróbicamente en citrato. Por lo tanto, el aumento de la turbidez en poblaciones distintas de A-3 es probablemente un signo de contaminación externa.
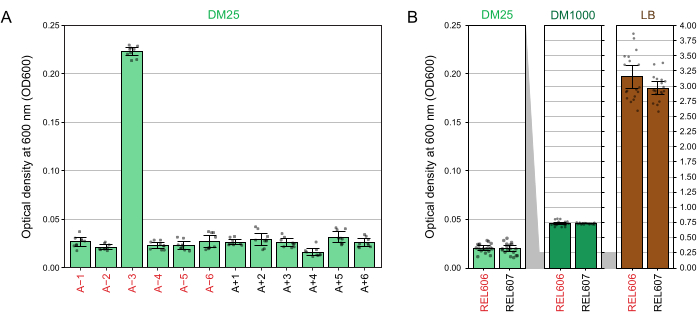
Figura 4: Turbidez de cultivos LTEE . (A) Densidad óptica a 600 nm (OD600) de las doce poblaciones LTEE después del ciclo de crecimiento de 24 h en tres días diferentes entre 76.000 y 76.500 generaciones del experimento. Los valores OD600 de tres alícuotas de 1 ml en cada uno de los tres días diferentes se representan como puntos. El valor OD600 medio de tres alícuotas diferentes del blanco del mismo día se restó de estos valores. Las barras llenas muestran promedios. Las barras de error son límites de confianza del 95%. (B) OD600 de cultivos de los ancestros REL606 y REL607 en DM25, DM1000 y LB. Los valores de OD600 de tres alícuotas de 1 ml en cada uno de los tres días diferentes de dos cultivos separados para cada condición y cepa se representan como puntos. El valor OD600 medio de tres alícuotas diferentes del blanco del mismo día se restó de estos valores. Las barras llenas muestran promedios y las barras de error son límites de confianza del 95%. Las áreas sombreadas en gris entre los paneles muestran cómo se reescala el eje OD600 entre el panel DM25 y los paneles DM1000 y LB. Haga clic aquí para ver una versión más grande de esta figura.
Crecimiento y morfología de las colonias LTEE
Al verificar la contaminación de las poblaciones colocándolas en diferentes medios (paso 2.15), los ancestros REL606 y REL607 y todas las poblaciones evolucionadas forman colonias blancas con bordes translúcidos y algo irregulares en placas de agar de glucosa mínima (MG) (Figura 5A). La composición del agar MG es la misma que la del DM25 utilizado en las transferencias diarias de LTEE, excepto con una mayor concentración de glucosa, por lo que las poblaciones de LTEE evolucionadas a menudo forman colonias más grandes en MG que los antepasados. Debido a su mayor densidad celular en DM25, la población A-3 tendrá varias veces más colonias si se le asigna el mismo volumen que para las otras poblaciones, y esto puede limitar el tamaño de las colonias. Los tipos más comunes de microbios contaminantes forman colonias blancas, opacas y perfectamente circulares en MG.
En el agar arabinosa mínima (MA), el ancestro REL607 y las poblaciones Ara+ típicamente forman colonias blancas ligeramente translúcidas. Este patrón de crecimiento típico ha persistido para las poblaciones de Ara+ a través de 76.000 generaciones, excepto A+6, que ha desarrollado un defecto en el crecimiento de la arabinosa y ya no forma colonias en la AM (Figura 5B). No hay selección para mantener el crecimiento de arabinosa durante las transferencias de LTEE en DM25, por lo que otras poblaciones de Ara+ también pueden eventualmente dejar de formar colonias en placas de agar MA a medida que continúa el experimento. Con la excepción de A-3, las poblaciones Ara− no forman colonias en agar MA, aunque un examen minucioso puede revelar microcolonias debido a trazas de nutrientes en el agar. La población A-3 forma numerosas colonias pequeñas en MA, ya que estas células pueden crecer en el citrato que también está presente en este medio. Las colonias de contaminantes en MA son raras.
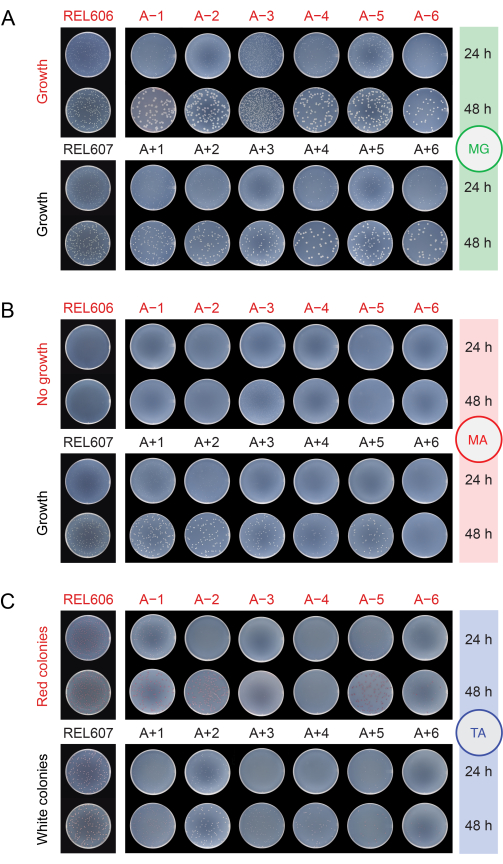
Figura 5: Recubrimiento de poblaciones LTEE para detectar contaminación. Las diluciones de los ancestros REL606 y REL607 y las doce poblaciones LTEE en el día en que el experimento alcanzó 76,026 2/3 generaciones se colocaron en placas de agar (A) MG, (B) MA y (C) TA y se fotografiaron después de 24 h y 48 h. Se hicieron las mismas diluciones para todos los cultivos, pero se plateó la mitad del volumen para los ancestros que se describe en el protocolo para las poblaciones LTEE, para explicar de alguna manera sus densidades celulares más altas. Haga clic aquí para ver una versión más grande de esta figura.
En el agar tetrazolio arabinosa (TA), se espera que el ancestro REL606 y todas las poblaciones Ara− formen colonias rojas, mientras que el ancestro REL607 y todas las poblaciones Ara+ generalmente deben formar colonias blancas (que pueden incluir tonos rosa claro o melocotón) (Figura 5C). Los ancestros LTEE forman colonias robustas, que son fácilmente identificables como Ara− y Ara+ en agar TA dentro de las 16-24 horas. Originalmente, esta diferencia podría usarse para detectar la contaminación cruzada entre las poblaciones Ara− y Ara+ . Sin embargo, el agar TA tiene una composición de nutrientes más compleja que el medio DM25 químicamente definido utilizado en las transferencias diarias, y no ha habido una presión evolutiva para que E. coli en el LTEE mantenga la capacidad de crecer robustamente en estas condiciones . En consecuencia, algunas poblaciones evolucionadas de LTEE ahora exhiben un crecimiento pobre en las placas de TA, tardando 48 horas en formar colonias o no creciendo de manera confiable en absoluto. Los colores y morfologías de las colonias formadas en TA por las poblaciones LTEE evolucionadas también han cambiado en relación con los ancestros y divergieron entre sí. La presencia de unas pocas colonias aberrantes no siempre es una indicación de contaminación. Pueden ocurrir mutaciones espontáneas que cambien el estado del marcador Ara de las cepas LTEE, especialmente de Ara+ a Ara− debido a la mayor probabilidad de mutaciones de pérdida de función que afecten la utilización de arabinosa frente a las mutaciones de reversión que restauran la actividad de araA. Las mutaciones que cambian los estados del marcador Ara son más comunes en poblaciones que han desarrollado hipermutación (A-1, A-2, A-3, A-4, A+3 y A+6)13. En el agar TA, los microbios contaminantes de otras especies a menudo (pero no siempre) forman colonias pequeñas y perfectamente circulares con centros rojos rodeados por límites blancos distintos que son diferentes a los formados por cualquier cepa o población LTEE.
Resultados del concurso de cocultura
Las competiciones entre todos los pares Ara− y Ara+ de los dos ancestros LTEE (REL606 y REL607, respectivamente) y las muestras de población A−5 y A+5 archivadas en 20.000 generaciones (REL8597 y REL8604, respectivamente) muestran cómo las colonias con diferentes estados marcadores Ara pueden diferenciarse y contarse en agar TA (pasos 3.4.8 y 3.6.6) (Figura 6). Las colonias se contaron para seis matraces de réplica para cada par de competidores antes y después de ensayos de un día y tres días que comenzaron con el renacimiento en DM1000 (Tabla 1). El número total de colonias observadas para la misma dilución y volumen plateado varía con qué competidores se mezclaron porque los cultivos de poblaciones LTEE evolucionadas alcanzan densidades celulares más bajas que los cultivos de las cepas ancestrales en DM25. Esta diferencia es consecuencia de la evolución del aumento del tamaño celular, que ocurrió en todas las poblaciones LTEE durante los primeros miles de generaciones del experimento 8,33.
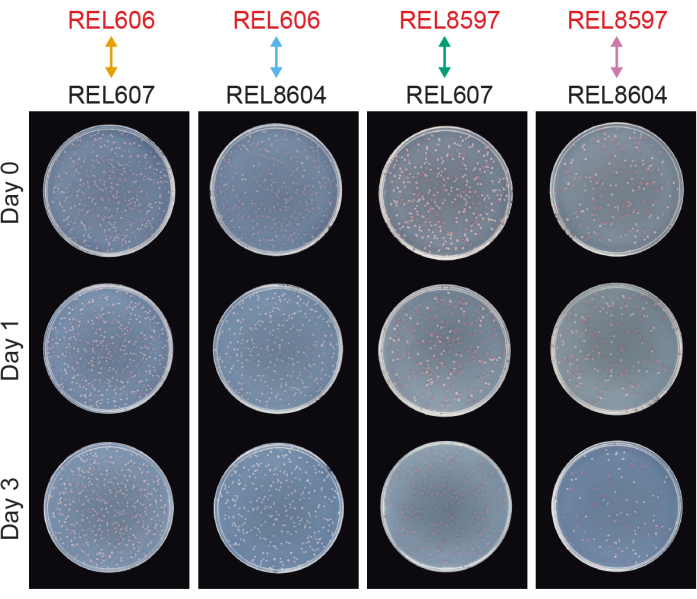
Figura 6: Ensayos de competencia chapados en placas de agar TA. Ejemplos de placas de agar TA de ensayos de competencia. REL606 y REL607 son los ancestros Ara− y Ara+ del LTEE, respectivamente. REL8597 y REL8604 son las 20.000 poblaciones de generación A-5 y A + 5, respectivamente, del "registro fósil" congelado del LTEE. Las placas TA correspondientes a un ensayo de réplica entre cada par de cepas se muestran para el Día 0, el Día 1 y el Día 3 de la competición. Las placas fueron fotografiadas después de 24 h de crecimiento a 37°C. Las células de los competidores REL606 y REL8597 son Ara− y forman colonias rojas. Las células de los competidores REL607 y REL8604 son Ara+ y forman colonias blancas. Haga clic aquí para ver una versión más grande de esta figura.
La mayoría de las colonias en una placa TA de competencia típica estarán bien separadas o se superpondrán de manera que sea fácil contar cuántas colonias inicialmente circulares de diferentes tipos crecieron juntas (Figura 7A). Sin embargo, pueden surgir algunas situaciones en las que no es obvio cómo contar una colonia atípica o un crecimiento que es una mezcla de los dos colores. Primero, cuando una colonia Ara+ blanca y una colonia Ara− roja se superponen, la colonia Ara+ tiende a crecer demasiado y envolver a la colonia Ara−. En esta situación, se debe contar una pequeña mancha roja o un "espacio" translúcido en la colonia Ara+ más grande como una colonia Ara− (Figura 7B). En segundo lugar, los mutantes Ara+ espontáneos surgirán ocasionalmente en las colonias Ara−. Estos mutantes suelen aparecer como sectores blancos (papilas) que se extienden más rápidamente fuera del interior de una colonia roja porque crecen más rápidamente una vez que obtienen acceso a la arabinosa como nutriente adicional (Figura 7C). Estas colonias de sector blanco se cuentan como una colonia Ara− y ninguna colonia Ara+. Esta situación se vuelve más común si las placas se incuban durante 48 h o más. En tercer lugar, a veces se observan colonias rosadas translúcidas (Figura 7D). Estos están formados por el competidor Ara-. Finalmente, un pequeño número de colonias circulares con interiores que son de un tono ligeramente diferente de rojo a veces crecen en placas TA cuando están contaminadas por unas pocas células microbianas externas durante la preparación del agar o cuando se extienden diluciones de cultivo en sus superficies (Figura 7E). Estas colonias contaminantes no deben ser contadas. Si se sospecha contaminación de un cultivo de competición porque hay muchas colonias atípicas en cualquiera de sus placas TA, debe excluirse esa réplica.
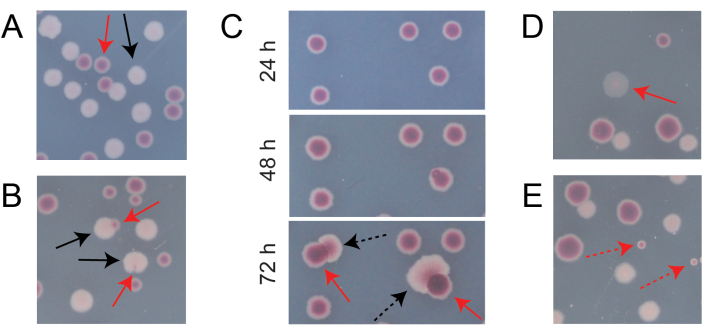
Figura 7: Casos extremos encontrados al contar las colonias Ara− y Ara+ en agar TA. En cada panel, algunas colonias Ara− y Ara+ que deben contarse están marcadas con flechas rojas y negras sólidas, respectivamente. Las colonias que no deben contarse se indican con flechas discontinuas correspondientes al tipo que parecen ser. Todas las fotos fueron tomadas después de 24 h de incubación, excepto en el panel C. (A) Ejemplos de colonias Ara− y Ara+ normales. (B) Ejemplos de colonias Ara+ que crecen demasiado cerca de las colonias Ara− , incluida una que apenas es visible como una brecha transparente en el exterior de la colonia blanca. Cuente cada uno de estos casos como dos colonias, una de cada tipo. (C) Ejemplos de colonias Ara− que dan lugar a sectores mutantes Ara+ . Cuente cada caso como una sola colonia Ara− . El sector blanco (papila) que surge se debe a un mutante Ara+ que surge dentro de la colonia. El mismo campo de colonias se muestra después de 24 h, 48 h y 72 h de crecimiento. (D) Ejemplo de una colonia rosa translúcida. Cuéntalo como Ara−. (E) Ejemplos de colonias formadas por contaminación externa por un microbio que no es E. coli. Estos son rojos pero más pequeños y perfectamente circulares con un límite blanco distinto. Haga clic aquí para ver una versión más grande de esta figura.
El análisis de los recuentos de colonias de estas competiciones utilizando la hoja de cálculo de Excel (Archivo suplementario 1) o ejecutando las funciones del paquete fitnessR en R en los recuentos de colonias ingresados en la plantilla CSV (Archivo suplementario 2) muestra que los dos antepasados son indistinguibles en términos de su aptitud dentro de la precisión del ensayo, que tanto las poblaciones A-5 de 20,000 generaciones como las A + 5 son significativamente más aptas que las ancestrales, y que ninguna población evolucionada es significativamente más apta que la otra (pruebas t de Welch, p > 0,05) (Figura 8). La precisión de la estimación de aptitud relativa mejora en las competiciones de tres días en comparación con las competiciones de un día para una de las parejas estrechamente emparejadas (REL606 vs. REL607). La precisión de estas mediciones podría incrementarse aún más mediante la realización de competiciones más largas con más ciclos de crecimiento, si así se desea. Sin embargo, los resultados de las competiciones de varios días no son informativos una vez que un competidor se vuelve tan abundante en relación con el otro después de los días adicionales de competencia que la proporción de las dos cepas no se puede determinar con precisión porque hay muy pocas o ninguna colonia del tipo menos apto para contar. Este es el caso de las competiciones de tres días de los ancestros contra las poblaciones evolucionadas de 20.000 generaciones (REL606 vs. REL8604 y REL607 vs. REL8597) (Figura 6 y Tabla 1).
Tabla 1: Conteos de colonias a partir de ensayos de aptitud competitiva. Se realizaron ensayos de competencia de un día y tres días con seis réplicas para todas las combinaciones por pares de dos competidores Ara− y los dos Ara+ . REL606 y REL607 son los ancestros Ara− y Ara+ del LTEE, respectivamente. REL8597 y REL8604 son las poblaciones de 20,000 generaciones A-5 y A + 5, respectivamente, del "registro fósil" congelado del LTEE. Haga clic aquí para descargar esta tabla.
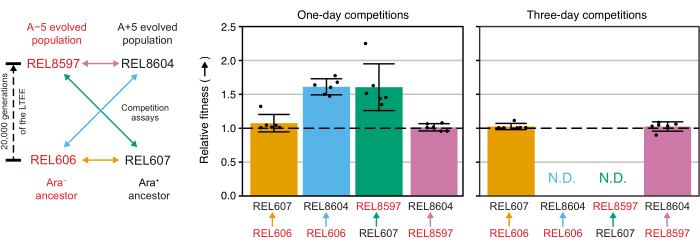
Figura 8: Aptitud relativa medida mediante ensayos de competición. Resultados de ensayos de competencia de uno y tres días entre ancestros LTEE y las 20,000 poblaciones LTEE de generación A-5 y A + 5. El diagrama de la izquierda muestra las cuatro competiciones por pares como flechas de doble punta codificadas por colores. Cada combinación de los dos competidores Ara− (etiquetas rojas) y los dos Ara+ (etiquetas negras) se probó con una replicación séxtuple. Los recuentos de colonias de la Tabla 1 se analizaron en R utilizando el paquete fitnessR31, y los resultados se graficaron utilizando el paquete ggplot2 (versión 3.4.0)34. La aptitud física se muestra como el competidor hacia el que va la flecha en la etiqueta en relación con el competidor del que proviene la flecha (por ejemplo, REL8604 en relación con REL606). Se muestran los valores de aptitud física relativos estimados a partir de los recuentos de colonias para cada ensayo de competición replicados (puntos), los valores medios de aptitud relativa para el par de competidores (barras llenas con el mismo código de colores que el diagrama) y los intervalos de confianza del 95% (barras de error). No se pudieron determinar los valores relativos de aptitud física (N.D.) para las competiciones de tres días entre los ancestros y las poblaciones evolucionadas porque había cero o muy pocas colonias de los ancestros en las placas del Día 3 (ver Tabla 1). Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1. Archivo de hoja de cálculo de Excel para calcular la aptitud relativa. Haga clic aquí para descargar este archivo.
Archivo complementario 2. Plantilla de archivo de entrada de valores separados por comas para calcular la aptitud relativa en R mediante el paquete fitnessR. Haga clic aquí para descargar este archivo.
Discusión
Resiliencia a largo plazo del LTEE y sus métodos
El Experimento de Evolución a Largo Plazo (LTEE) de E. coli está ahora en su cuarta década. Para un experimento de evolución microbiana de cualquier duración, es fundamental mantener un ambiente reproducible, evitar la contaminación, archivar muestras y medir con precisión la aptitud. El LTEE demuestra varias estrategias probadas en el tiempo para lograr estos objetivos, incluido el uso de matraces bien agitados que crean un ambiente homogéneo y un medio de crecimiento químicamente definido que admite una baja densidad celular. Además, el LTEE emplea cepas ancestrales que difieren en un marcador genético que da un fenotipo (color de colonia) que es fácil de cribar y selectivamente neutral en el entorno de evolución. Esta característica de diseño experimental proporciona un medio para identificar la contaminación interna y externa y facilita la medición de la aptitud. Sin embargo, no todos los procedimientos y salvaguardas que han sido utilizados por el LTEE desde 1988 han demostrado ser igualmente sólidos. Algunos métodos que eran confiables cuando comenzó el LTEE se han vuelto menos efectivos a medida que las poblaciones de E. coli han evolucionado. Afortunadamente, estos métodos problemáticos ahora pueden ser aumentados o reemplazados utilizando tecnologías desarrolladas desde el inicio del experimento.
Detección de contaminación
La detección de la contaminación es fundamental para el LTEE. La contaminación puede ser de dos tipos: entre poblaciones LTEE (contaminación cruzada) y con microbios del medio ambiente (contaminación externa). En su mayor parte, el uso cuidadoso de técnicas asépticas y la atención cercana durante la preparación de los medios y las transferencias diarias evitan ambos tipos de contaminación, pero ocurren. Al principio del experimento, el recubrimiento en agar TA podría usarse para detectar casos de contaminación cruzada porque las transferencias siempre se han alternado entre las poblaciones Ara− y Ara+. La huella digital de sensibilidad y resistencia de estas E. coli a ciertos bacteriófagos también pretendía ser una característica de diseño que pudiera diferenciar las poblaciones LTEE de las cepas de laboratorio de E. coli comúnmente utilizadas que podrían contaminarlas4. Sin embargo, estos marcadores genéticos se han vuelto poco confiables a medida que el experimento ha progresado (por ejemplo, algunas poblaciones ya no forman colonias en agar TA)10,35. Afortunadamente, las poblaciones han divergido genéticamente, ya que han experimentado historias evolutivas separadas durante el experimento, lo que ha creado nuevos marcadores genéticos que ahora se pueden usar para detectar la contaminación cruzada. Por ejemplo, cada población ha desarrollado una combinación única de mutaciones en los genes pykF y nadR 14,36,37. A veces amplificamos la PCR y Sanger secuenciamos estos dos genes para probar si las colonias con morfologías o colores inusuales se deben a la contaminación cruzada. A medida que los costos de la secuenciación del genoma completo y de toda la población continúan disminuyendo, la secuenciación rutinaria de las poblaciones LTEE pronto será posible, lo que presenta nuevas oportunidades para monitorearlas en busca de signos de contaminación.
Medición de la aptitud competitiva
Otro caso en el que el LTEE ha superado sus métodos originales es que la aptitud de la E. coli evolucionada ha aumentado en el entorno experimental hasta tal punto que ya no se puede medir directamente la aptitud de las poblaciones de hoy en relación con sus antepasados utilizando el protocolo descrito aquí. Las poblaciones evolucionadas superan a los ancestros hasta tal punto que quedan pocas o ninguna colonia de ancestros para contar después de una competencia de un día. Un enfoque para lidiar con esta gran diferencia de aptitud física es usar proporciones iniciales desiguales de las cepas, ponderando los volúmenes iniciales que se mezclan hacia el competidor menos apto (por ejemplo, un ancestro de 90 μL y un competidor evolucionado de 10 μL). Un segundo enfoque es identificar un clon Ara− evolucionado que tenga una aptitud más alta que el ancestro LTEE, aislar un mutante revertido Ara+ espontáneo de él por selección en agar MA, y luego verificar que la cepa revertida tiene la misma aptitud que su padre utilizando un ensayo de competencia 6,38. Este nuevo par Ara−/Ara+ se puede utilizar como un conjunto de cepas competidoras comunes en lugar de REL606/REL607. Idealmente, el clon Ara− evolucionado elegido como competidor común (y su revertant Ara+) tendrá una aptitud intermedia en relación con todas las cepas de interés en un experimento. Durante las primeras 50.000 generaciones del LTEE, estos dos enfoques (utilizando proporciones iniciales desiguales o un competidor común) no produjeron mediciones de aptitud significativamente diferentes en comparación con el enfoque típico39.
Estas modificaciones al protocolo de competencia hacen ciertas suposiciones simplificadoras que no siempre pueden ser ciertas. Una es que las mediciones de aptitud física son transitivas. Es decir, si competimos dos poblaciones cada una contra una cepa competidora común por separado, entonces podemos inferir la aptitud relativa de las dos poblaciones entre sí. Se ha encontrado que esta relación es cierta para el LTEE40, en su mayor parte, pero no lo es para otros experimentos41. Una razón para esta discrepancia puede ser la evolución de los efectos negativos de la aptitud física dependientes de la frecuencia. Esta situación ocurre cuando las cepas aisladas de dos linajes divergentes diferentes de la población A-2 del LTEE compiten entre sí 19,42. Cada uno tiene una ventaja cuando es raro, debido a la alimentación cruzada, lo que estabiliza su coexistencia. Los datos de secuenciación que muestran la coexistencia a largo plazo de linajes con diferentes conjuntos de mutaciones sugieren que interacciones similares también pueden haber surgido en otras poblaciones LTEE14,43, aunque no está claro si son lo suficientemente fuertes como para alterar notablemente las estimaciones de aptitud. Finalmente, la evolución del crecimiento aeróbico sobre citrato en la población A-3 del LTEE32 significa que la aptitud de estas células ahora incorpora el uso de un recurso "privado" cuando compiten contra células que no pueden usar citrato, lo que complica la interpretación de estos resultados. A pesar de estas excepciones, el uso de una baja concentración de glucosa y un ambiente bien agitado sin duda ha simplificado hacer comparaciones de aptitud física entre las cepas LTEE y las poblaciones.
En generaciones posteriores, algunas de las poblaciones LTEE ya no forman colonias en agar TA, lo que hace que realizar experimentos de competencia utilizando incluso protocolos modificados sea difícil o imposible10. Los métodos alternativos que no requieren el crecimiento de colonias pueden usarse potencialmente para determinar la representación relativa de dos competidores, como FREQ-seq que utiliza la secuenciación de próxima generación para contar la proporción de lecturas que contienen dos alelos alternativos en un amplicón44. Este método o uno similar podría usarse potencialmente con los alelos Ara o con mutaciones recién evolucionadas, como las de pykF y nadR, frente a la secuencia ancestral. La realización de modificaciones genéticas que introducen otros tipos de marcadores neutros también se puede utilizar para medir la aptitud relativa. Por ejemplo, se han insertado genes de proteínas fluorescentes en los cromosomas de las células en experimentos de derivación LTEE para que los competidores puedan contarse utilizando la citometría de flujo45. Otro enfoque, que abre la posibilidad de mezclar más de dos cepas en el mismo matraz de competición, es insertar códigos de barras que pueden ser amplificados por PCR y secuenciados en los genomas de diferentes competidores. Este enfoque se ha utilizado para el rastreo del linaje en experimentos de evolución46. Tanto la citometría de flujo como la secuenciación de códigos de barras pueden medir con precisión proporciones mucho más extremas de dos cepas versus conteo de colonias (porque pueden consultar > 10,000 células / genomas versus los < 500 que se pueden contar en una placa de agar), por lo que el uso de estos métodos también promete aumentar el rango dinámico en términos de diferencias de aptitud que se pueden medir en relación con un competidor común.
Diseños alternativos para experimentos de evolución microbiana a largo plazo
A pesar de todas sus virtudes, el LTEE no es perfecto. Ciertos aspectos de su diseño lo hacen laborioso y susceptible al error humano. Por ejemplo, cada día un investigador debe entrar en el laboratorio y pipetear entre frascos Erlenmeyer para continuar el experimento. Los experimentos de competencia también pueden plantear enormes obstáculos logísticos, dado que los requisitos para la cristalería estéril, los medios, el espacio de la incubadora y el conteo de colonias aumentan rápidamente cuando incluso un pequeño número de competidores están siendo probados con una réplica modesta. A menudo nos preguntan por qué no aprovechamos los sistemas de automatización de laboratorio, como los robots de pipeteo que operan en microplacas de 96 pocillos, o los sistemas de cultivo continuo, como quimiostatos o turbidostatos. La respuesta es simple: el LTEE es, en cierto sentido, un prisionero de su propia larga historia. No nos atrevemos a desviarnos de los cultivos de 10 ml que agitan a una velocidad específica en matraces Erlenmeyer de 50 ml porque esto correría el riesgo de cambiar fundamentalmente el experimento. Los aspectos sutiles del medio ambiente a los que estas poblaciones se han estado adaptando durante décadas (por ejemplo, la cantidad de aireación), se alterarían en microplacas o sistemas de cultivo continuo. El cuello de botella de la población en cada transferencia también puede ser diferente (más pequeño en microplacas, por ejemplo), cambiando la dinámica evolutiva. En resumen, desviarse de los métodos descritos aquí haría del LTEE un experimento diferente, o al menos correría el riesgo de introducir una discontinuidad que interrumpiría las trayectorias evolutivas.
Los investigadores que diseñan nuevos experimentos de evolución deben considerar estas otras formas de propagar poblaciones microbianas, al tiempo que son conscientes de sus posibles beneficios e inconvenientes. El uso de robots de pipeteo para transferir poblaciones en placas de micropocillos es logísticamente más simple en algunos aspectos y puede resultar bastante poderoso debido al alto número de poblaciones replicadas que se pueden propagar de esta manera47,48,49. Sin embargo, las transferencias automatizadas en la mayoría de las configuraciones actuales no se realizan en condiciones completamente estériles, lo que aumenta la probabilidad de contaminación externa. Para prevenir la contaminación, el medio de crecimiento a menudo se complementa con antibióticos, que se convierten en una característica del medio ambiente que afecta la evolución. Las transferencias en placas de micropocillos también son más propensas a eventos de contaminación cruzada. Finalmente, el entorno de las placas de micropocillos, particularmente si no se agitan, tiende a seleccionar el crecimiento de la pared, la agregación y otros fenómenos que pueden complicar la evolución al crear múltiples nichos en un pozo. El uso de medios ricos o altas concentraciones de nutrientes para mantener el tamaño de la población grande en pozos pequeños es probable que exacerbe estas complejidades. Si surgen tales interacciones, pueden hacer que medir e interpretar la aptitud física sea mucho más difícil.
Los sistemas de cultivo continuo para la evolución microbiana incluyen quimiostatos, en los que el medio fresco se bombea constantemente y se bombea el cultivo, y turbidostatos, en los que los cultivos se diluyen periódicamente a través de la detección y el bombeo automatizados para mantener las células en un estado de crecimiento constante. Estos sistemas son muy útiles cuando se quiere modelar la fisiología microbiana y la evolución porque evitan que los microbios hagan la transición entre el crecimiento y la inanición al mantenerlos en un ambiente que siempre tiene nutrientes50. Incluso se pueden agregar sensores que realizan mediciones en tiempo real de la densidad óptica, el consumo deO2, el pH y otros aspectos del entorno y el crecimiento de una cultura. Sin embargo, los sistemas actuales de cultivo continuo requieren costosas compras de equipos o experiencia especializada para construir configuraciones personalizadas51,52,53,54. Además, el crecimiento de la pared, en el que las células escapan a la dilución adhiriéndose a la cámara de cultivo, altera la dinámica evolutiva en los sistemas de cultivo continuo a menos que se esterilicen periódicamente. Debido a estas limitaciones, la mayoría de los experimentos de evolución de quimiostato y turbidostat hasta la fecha han sido de duración limitada y / o han involucrado relativamente pocas poblaciones en evolución independiente en comparación con los experimentos de evolución de transferencia en serie.
Conclusión
Los métodos que demostramos aquí para el LTEE son críticos para estudiar su registro histórico único y continuar la evolución abierta de estas poblaciones de E. coli . También proporcionan un punto de partida para otros que están considerando nuevos experimentos de evolución que pueden aprovechar la automatización de laboratorio o agregar varios elementos de la complejidad que se encuentran en entornos naturales que se omitieron deliberadamente del LTEE. Desde 1988, la evolución experimental ha florecido como campo. Durante este tiempo, los investigadores de laboratorios de todo el mundo han demostrado la inmensa flexibilidad de este enfoque para estudiar la evolución, innovar mediante la introducción de diseños experimentales creativos y el seguimiento de los resultados utilizando nuevas tecnologías. Los métodos del LTEE no representan un punto final, pero esperamos que continúen inspirando y proporcionando una base para el campo en el futuro.
Divulgaciones
No se han declarado conflictos de intereses.
Agradecimientos
Agradecemos a Richard Lenski y a los muchos investigadores que han estudiado y contribuido al mantenimiento del Experimento de Evolución a Largo Plazo con E. coli, incluyendo especialmente a Neerja Hajela. El LTEE cuenta actualmente con el apoyo de la National Science Foundation (DEB-1951307).
Materiales
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride (TTC) | Sigma-Aldrich | T8877 | |
| 20 mL Glass Beaker | Sigma-Aldrich | CLS100020 | |
| 50 mL Erlenmeyer Flasks | Sigma-Aldrich | CLS498050 | |
| Agar | Sigma-Aldrich | A1296 | |
| Ammonium Sulfate | Sigma-Aldrich | AX1385 | |
| Antifoam | Sigma-Aldrich | A5757 | |
| Arabinose | Sigma-Aldrich | A3256 | |
| Freezer Box (2") | VWR | 82007-142 | |
| Freezer Box (3") | VWR | 82007-144 | |
| Freezer Box Cell Divider (49-place) | VWR | 82007-150 | |
| Freezer Box Cell Divider (81-place) | VWR | 82007-154 | |
| Freezer Vials (1/2-Dram) | VWR | 66009-816 | |
| Freezer Vials (2-Dram) | VWR | 66010-560 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Glycerol | Fisher Scientific | G33 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Metal Tray | Winco | SPJP-202 | |
| Petri Dish | Fisher Scientific | FB0875712 | |
| Potassium Phosphate Dibasic Trihydrate | Sigma-Aldrich | P5504 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5379 | |
| Sodium Chloride | Sigma-Aldrich | M7506 | |
| Sodium Citrate Tribasic Dihydrate | Sigma-Aldrich | C7254 | |
| Test Tube Cap (18mm) | VWR | 10200-142 | |
| Test Tube Rack (18mm, steel) | Adamas-Beta | N/A | Test Tube Racks Stainless Steel Grid Arrangement 72 Holes (17-19 mm) |
| Test Tubes (18 x 150 mm) | VWR | 47729-583 | |
| Thiamine, Hydrochloride | Millipore | 5871 | |
| Tryptone | Gibco | 211705 | |
| Yeast Extract | Gibco | 212750 |
Referencias
- Lenski, R. E., Rose, M. R., Simpson, S. C., Tadler, S. C. Long-term experimental evolution in Escherichia coli. I. Adaptation and divergence during 2,000 generations. The American Naturalist. 138 (6), 1315-1341 (1991).
- Fox, J. W., Lenski, R. E. From here to eternity-the theory and practice of a really long experiment. PLoS Biology. 13 (6), e1002185(2015).
- Daegelen, P., Studier, F. W., Lenski, R. E., Cure, S., Kim, J. F. Tracing ancestors and relatives of Escherichia coli B, and the derivation of B strains REL606 and BL21(DE3). Journal of Molecular Biology. 394 (4), 634-643 (2009).
- Studier, F. W., Daegelen, P., Lenski, R. E., Maslov, S., Kim, J. F. Understanding the differences between genome sequences of Escherichia coli B strains REL606 and BL21(DE3) and comparison of the E. coli B and K-12 genomes. Journal of Molecular Biology. 394 (4), 653-680 (2009).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nature Reviews Genetics. 14 (12), 827-839 (2013).
- Lenski, R. E. Experimental studies of pleiotropy and epistasis in Escherichia coli. II. Compensation for maladaptive pleiotropic effects associated with resistance to virus T4. Evolution. 42 (3), 425-432 (1988).
- Calcott, P. H., Gargett, A. M. Mutagenicity of freezing and thawing. FEMS Microbiology Letters. 10 (2), 151-155 (1981).
- Lenski, R. E., Travisano, M. Dynamics of adaptation and diversification: a 10,000-generation experiment with bacterial populations. Proceedings of the National Academy of Sciences of the United States of America. 91 (15), 6808-6814 (1994).
- Wiser, M. J., Ribeck, N., Lenski, R. E. Long-term dynamics of adaptation in asexual populations. Science. 342 (6164), New York, N.Y. 1364-1367 (2013).
- Lenski, R. E., et al. Sustained fitness gains and variability in fitness trajectories in the long-term evolution experiment with Escherichia coli. Proceedings of the Royal Society B: Biological Sciences. 282 (1821), 20152292(2015).
- Barrick, J. E., et al. Genome evolution and adaptation in a long-term experiment with Escherichia coli. Nature. 461 (7268), 1243-1247 (2009).
- Blount, Z. D., Barrick, J. E., Davidson, C. J., Lenski, R. E. Genomic analysis of a key innovation in an experimental Escherichia coli population. Nature. 489 (7417), 513-518 (2012).
- Tenaillon, O., et al. Tempo and mode of genome evolution in a 50,000-generation experiment. Nature. 536 (7615), 165-170 (2016).
- Good, B. H., McDonald, M. J., Barrick, J. E., Lenski, R. E., Desai, M. M. The dynamics of molecular evolution over 60,000 generations. Nature. 551 (7678), 45-50 (2017).
- Consuegra, J., et al. Insertion-sequence-mediated mutations both promote and constrain evolvability during a long-term experiment with bacteria. Nature Communications. 12 (1), 980-980 (2021).
- Cooper, T. F., Rozen, D. E., Lenski, R. E. Parallel changes in gene expression after 20,000 generations of evolution in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 100 (3), 1072-1077 (2003).
- Favate, J. S., Liang, S., Cope, A. L., Yadavalli, S. S., Shah, P. The landscape of transcriptional and translational changes over 22 years of bacterial adaptation. eLife. 11, e81979(2022).
- Khan, A. I., Dinh, D. M., Schneider, D., Lenski, R. E., Cooper, T. F. Negative epistasis between beneficial mutations in an evolving bacterial population. Science. 332 (6034), 1193-1196 (2011).
- Plucain, J., et al. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli. Science. 343 (6177), 1366-1369 (2014).
- Quandt, E. M., Deatherage, D. E., Ellington, A. D., Georgiou, G., Barrick, J. E. Recursive genomewide recombination and sequencing reveals a key refinement step in the evolution of a metabolic innovation in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2217-2222 (2014).
- Leon, D., D'Alton, S., Quandt, E. M., Barrick, J. E. Innovation in an E. coli evolution experiment is contingent on maintaining adaptive potential until competition subsides. PLoS Genetics. 14 (4), e1007348(2018).
- Bennett, A. F., Lenski, R. E., Mittler, J. E. Evolutionary adaptation to temperature. I. Fitness responses of Escherichia coli to changes in its thermal environment. Evolution. 46 (1), 16-30 (1992).
- Kibota, T. T., Lynch, M. Estimate of the genomic mutation rate deleterious to overall fitness in E. coli. Nature. 381 (6584), 694-696 (1996).
- Friesen, M. L., Saxer, G., Travisano, M., Doebeli, M. Experimental evidence for sympatric ecological diversification due to frequency-dependent competition in Escherichia coli. Evolution. 58 (2), 245-260 (2004).
- Cooper, T. F. Recombination speeds adaptation by reducing competition between beneficial mutations in populations of Escherichia coli. PLoS Biology. 5 (9), e225(2007).
- Cooper, T. F., Lenski, R. E. Experimental evolution with E. coli in diverse resource environments. I. Fluctuating environments promote divergence of replicate populations. BMC Evolutionary Biology. 10, 11(2010).
- Quan, S., et al. Adaptive evolution of the lactose utilization network in experimentally evolved populations of Escherichia coli. PLoS Genetics. 8 (1), e1002444(2012).
- Deatherage, D. E., Kepner, J. L., Bennett, A. F., Lenski, R. E., Barrick, J. E. Specificity of genome evolution in experimental populations of Escherichia coli evolved at different temperatures. Proceedings of the National Academy of Sciences of the United States of America. 114 (10), E1904-E1912 (2017).
- Izutsu, M., Lake, D. M., Matson, Z. W. D., Dodson, J. P., Lenski, R. E. Effects of periodic bottlenecks on the dynamics of adaptive evolution in microbial populations. BioRixv. , 4457(2021).
- Chavarria-Palma, J. E., Blount, Z. D., Barrick, J. E. LTEE Media Recipes. , (2022).
- Barrick, J. E., Lake, D. M. fitnessR: fitnessR-v1.0.0. barricklab. , (2023).
- Blount, Z. D., Borland, C. Z., Lenski, R. E. Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 105 (23), 7899-7906 (2008).
- Grant, N. A., Magid, A. A., Franklin, J., Dufour, Y., Lenski, R. E. Changes in cell size and shape during 50,000 generations of experimental evolution with Escherichia coli. Journal of Bacteriology. 203 (10), 22(2021).
- Wickham, H. ggplot2: Elegant Graphics for Data Analysis. , Springer-Verlag. New York. (2016).
- Meyer, J. R., et al. Parallel changes in host resistance to viral infection during 45,000 generations of relaxed selection. Evolution. 64 (10), 3024-3034 (2010).
- Woods, R., Schneider, D., Winkworth, C. L., Riley, M. A., Lenski, R. E. Tests of parallel molecular evolution in a long-term experiment with Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 103 (24), 9107-9712 (2006).
- Barrick, J. E., Deatherage, D. E., D'Alton, S. LTEE-Ecoli: genomics resources for the Long-Term Evolution Experiment with Escherichia coli. , Available from: https://github.com/barricklab/LTEE-Ecoli (2022).
- Izutsu, M., Lenski, R. E. Experimental test of the contributions of initial variation and new mutations to adaptive evolution in a novel environment. Frontiers in Ecology and Evolution. 10, 958406(2022).
- Wiser, M. J., Lenski, R. E. A comparison of methods to measure fitness in Escherichia coli. PLoS One. 10 (5), 0126210(2015).
- de Visser, J. A. G. M., Lenski, R. E. Long-term experimental evolution in Escherichia coli. XI. Rejection of non-transitive interactions as cause of declining rate of adaptation. BMC Evolutionary Biology. 2 (1), 19(2002).
- Paquin, C. E., Adams, J. Relative fitness can decrease in evolving asexual populations of S. cerevisiae. Nature. 306 (5941), 368-371 (1983).
- Rozen, D. E., Lenski, R. E. Long-Term Experimental Evolution in Escherichia coli. VIII. Dynamics of a balanced polymorphism. The American Naturalist. 155 (1), 24-35 (2000).
- Quandt, E. M., Gollihar, J., Blount, Z. D., Ellington, A. D., Georgiou, G., Barrick, J. E. Fine-tuning citrate synthase flux potentiates and refines metabolic innovation in the Lenski evolution experiment. eLife. 4, e09696(2015).
- Chubiz, L. M., Lee, M. -C., Delaney, N. F., Marx, C. J. FREQ-Seq: a rapid, cost-effective, sequencing-based method to determine allele frequencies directly from mixed populations. PLoS One. 7 (10), e47959(2012).
- Gallet, R., Cooper, T. F., Elena, S. F., Lenormand, T. Measuring selection coefficients below 10-3: method, questions, and prospects. Genetics. 190 (1), 175-186 (2012).
- Levy, S. F., et al. Quantitative evolutionary dynamics using high-resolution lineage tracking. Nature. 519 (7542), 181-186 (2015).
- Lang, G. I., Botstein, D., Desai, M. M. Genetic variation and the fate of beneficial mutations in asexual populations. Genetics. 188 (3), 647-661 (2011).
- Frenkel, E. M., et al. Crowded growth leads to the spontaneous evolution of semistable coexistence in laboratory yeast populations. Proceedings of the National Academy of Sciences. 112 (36), 11306-11311 (2015).
- Jordt, H., et al. Coevolution of host-plasmid pairs facilitates the emergence of novel multidrug resistance. Nature Ecology and Evolution. 4 (6), 863-869 (2020).
- Gresham, D., Dunham, M. J. The enduring utility of continuous culturing in experimental evolution. Genomics. 104 (6), 399-405 (2014).
- Miller, A. W., Befort, C., Kerr, E. O., Dunham, M. J. Design and use of multiplexed chemostat arrays). Journal of Visualized Experiments. (72), e50262(2013).
- Toprak, E., et al. Building a morbidostat: an automated continuous-culture device for studying bacterial drug resistance under dynamically sustained drug inhibition. Nature Protocols. 8 (3), 555-567 (2013).
- Wong, B. G., Mancuso, C. P., Kiriakov, S., Bashor, C. J., Khalil, A. S. Precise, automated control of conditions for high-throughput growth of yeast and bacteria with eVOLVER. Nature Biotechnology. 36 (7), 614-623 (2018).
- Ekkers, D. M., Branco Dos Santos, F., Mallon, C. A., Bruggeman, F., Van Doorn, G. S. The omnistat: A flexible continuous-culture system for prolonged experimental evolution. Methods in Ecology and Evolution. 11 (8), 932-942 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados