Obtención de imágenes de mtHyPer7, un biosensor radiométrico para el peróxido mitocondrial, en células vivas de levadura
En este artículo
Resumen
El peróxido de hidrógeno (H2O2) es tanto una fuente de daño oxidativo como una molécula de señalización. Este protocolo describe cómo medir el H 2 O2mitocondrial utilizando HyPer7 dirigido a mitocondrias (mtHyPer7), un biosensor radiométrico codificado genéticamente, en levaduras vivas. Detalla cómo optimizar las condiciones de obtención de imágenes y realizar análisis cuantitativos celulares y subcelulares utilizando software de libre acceso.
Resumen
La disfunción mitocondrial, o alteración funcional, se encuentra en muchas enfermedades y afecciones, incluidos los trastornos neurodegenerativos y musculoesqueléticos, el cáncer y el envejecimiento normal. Aquí, se describe un enfoque para evaluar la función mitocondrial en células de levadura vivas a resoluciones celulares y subcelulares utilizando un biosensor radiométrico mínimamente invasivo codificado genéticamente. El biosensor, HyPer7 (mtHyPer7), detecta el peróxido de hidrógeno (H2O2) en las mitocondrias. Consiste en una secuencia de señales mitocondriales fusionada a una proteína fluorescente permutada circularmente y el dominio de respuestaH 2 O2 de una proteína bacteriana OxyR. El biosensor se genera e integra en el genoma de la levadura utilizando un sistema libre de marcadores CRISPR-Cas9, para una expresión más consistente en comparación con las construcciones transmitidas por plásmidos.
mtHyPer7 está dirigido cuantitativamente a las mitocondrias, no tiene ningún efecto detectable sobre la tasa de crecimiento de la levadura o la morfología mitocondrial, y proporciona una lectura cuantitativadel H 2 O2 mitocondrial en condiciones normales de crecimiento y tras la exposición al estrés oxidativo. Este protocolo explica cómo optimizar las condiciones de obtención de imágenes utilizando un sistema de microscopio confocal de disco giratorio y realizar análisis cuantitativos utilizando software de libre acceso. Estas herramientas permiten recopilar información espacio-temporal sobre las mitocondrias tanto dentro de las células como entre las células de una población. Además, el flujo de trabajo descrito aquí se puede utilizar para validar otros biosensores.
Introducción
Las mitocondrias son orgánulos celulares eucariotas esenciales que son bien conocidos por su función en la producción de ATP a través de la fosforilación oxidativa y el transporte de electrones1. Además, las mitocondrias son sitios para el almacenamiento de calcio, la síntesis de lípidos, aminoácidos, ácidos grasos y grupos de hierro-azufre, y la transducción de señales 2,3. Dentro de las células, las mitocondrias forman una red dinámica con morfología y distribución características, que varía según el tipo de célula y el estado metabólico. Además, aunque las mitocondrias pueden fusionarse y dividirse, no todas las mitocondrias de una célula son equivalentes. Numerosos estudios han documentado la heterogeneidad funcional de las mitocondrias dentro de las células individuales en atributos como el potencial de membrana y el estado oxidativo 4,5,6. Esta variación en la función mitocondrial se debe en parte al daño al orgánulo por mutaciones en el ADNmt (que ocurren a un ritmo mayor que en el ADN nuclear) y al daño oxidativo por especies reactivas de oxígeno (ROS) generadas tanto dentro como fuera del orgánulo 7,8,9. El daño al orgánulo se mitiga mediante mecanismos de control de calidad mitocondrial que reparan el daño o eliminan las mitocondrias que están dañadas sin posibilidad de reparación10.
El peróxido de hidrógeno (H2O2) es una especie reactiva de oxígeno que es una fuente de daño oxidativo a las proteínas celulares, ácidos nucleicos y lípidos. Sin embargo, elH2O2también sirve como una molécula de señalización que regula las actividades celulares a través de la oxidación reversible de los tioles en las proteínas diana11,12. ElH2O2se produce a partir de electrones que se escapan de la cadena de transporte de electrones mitocondrial y por enzimas específicas, como la NADPH oxidasa y las monoaminooxidasas 13,14,15,16,17,18,19,20. También es inactivado por los sistemas antioxidantes, incluidos los basados en tiorredoxina y glutatión21,22,23. Por lo tanto, el análisis de los niveles mitocondriales deH2O2es fundamental para comprender el papel de este metabolito en la función mitocondrial y celular normal y en condiciones de estrés oxidativo.
El objetivo general de este protocolo es detectar el H 2 O 2 mitocondrial utilizando un biosensor radiométrico H 2 O2 codificado genéticamente, HyPer7, que está dirigido al orgánulo (mtHyPer7). mtHyPer7 es una quimera que consiste en la secuencia de señal mitocondrial de ATP9 (la presecuencia Su9), una forma permutada circularmente de proteína verde fluorescente (GFP) y el dominio de unión H2 O2 de la proteína OxyR de Neisseria meningitidis24 (Figura 1). En la GFP permutada circularmente, los extremos N y C de la GFP nativa se fusionan y se forman nuevos terminales cerca del cromóforo, lo que confiere una mayor movilidad a la proteína y una mayor labilidad de sus características espectrales en comparación con la GFP25 nativa. La interacción del dominio OxyR de mtHyPer7 con H 2 O 2 es de alta afinidad, H 2 O 2-selectivo, yconduce a la oxidación reversible de los residuos de cisteína conservados y a la formación de puentes disulfuro. Los cambios conformacionales asociados con la oxidación de OxyR se transfieren a la GFP permutada circularmente en mtHyPer7, lo que da como resultado un cambio espectral en el máximo de excitación del cromóforo mtHyPer7 de 405 nm en el estado reducido a 488 nm en el estado H 2O 2-oxidado 26. Por lo tanto, la relación de fluorescencia de mtHyPer7 en respuesta a la excitación a 488 nm frente a 405 nm refleja la oxidación de la sonda porH2O2.
Idealmente, un biosensor debería proporcionar una lectura cuantitativa, absoluta y en tiempo real de su molécula objetivo. Sin embargo, desafortunadamente, esto no siempre es posible en las mediciones del mundo real. En el caso de los sensores de oxidación, como mtHyPer7, la lectura en tiempo real se ve afectada por la tasa de reducción del puente disulfuro. Los sistemas de reducción utilizados por los biosensores ROS difieren, y estos pueden alterar drásticamente la dinámica de respuesta de la sonda, como lo demuestra la comparación de HyPer7, reducido por el sistema de tiorredoxina, y roGFP2-Tsa2ΔCR, reducido por glutatión, en el citosolde levadura 27. Por lo tanto, para sacar una conclusión sobre la concentraciónrelativa de H2O2 a partir de las proporciones mtHyPer7, se debe suponer que el sistema de reducción mantiene una capacidad constante durante el experimento. A pesar de estas consideraciones, HyPer7 y las sondas relacionadas se han utilizado en diversos contextos para obtener información sobre H2O2en células vivas25,28,29.
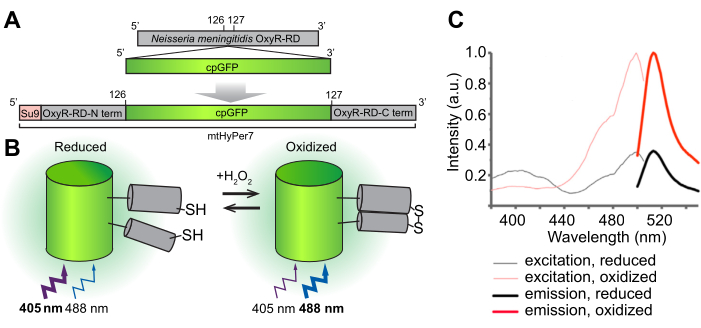
Figura 1: Diseño, mecanismo molecular y espectros de excitación/emisión del biosensor H 2 O2 mtHyPer7. (A) La sonda mtHyPer7 se obtiene insertando GFP permutada circularmente en el dominio OxyR-RD de Neisseria meningitidis. Contiene la secuencia de diana mitocondrial de la subunidad 9 de la ATP sintasa de Neurospora crassa (Su9). (B) Ilustración del mecanismo de detección de H 2 O2de mtHyPer7. La oxidación de cisteínas en el dominio RD aumenta la emisión de fluorescencia tras la excitación a 488 nm y disminuye la emisión producida por la excitación a 405 nm. (C) Espectros de excitación y emisión de HyPer7 en formas oxidadas y reducidas. Esta figura se reproduce con permiso de Pak et al.24. Abreviaturas: GFP = proteína verde fluorescente; cpGFP = GFP permutada circularmente. Haga clic aquí para ver una versión más grande de esta figura.
Esta imagen radiométrica de mtHyPer7 ofrece importantes beneficiospara la cuantificación mitocondrial de H2O2 24,27; Proporciona un control interno para la concentración de la sonda. Además, el cambio en el pico de excitación producido por laexposición a H2O2 no es completo, incluso en concentraciones saturadas deH2O2. Por lo tanto, las imágenes de relación pueden aumentar la sensibilidad mediante la incorporación de dos puntos espectrales en el análisis.
La sonda mtHyPer7 utilizada aquí tiene una afinidad muy alta por elH2O2y una sensibilidad relativamente baja al pH24, y se ha dirigido con éxito a las mitocondrias30 de Caenorhabditis elegans. Esta proteína también se ha utilizado en levaduras 27,31. Sin embargo, estudios anteriores se basaron en la expresión transmitida por plásmidos de mtHyPer7, lo que da lugar a una variabilidad de célula a célula en la expresión de la sonda27. Además, el constructo descrito en este protocolo se integró en una región conservada y libre de genes en el cromosoma X32 utilizando un enfoque basado en CRISPR para la integración sin marcadores. La expresión del gen biosensor integrado también está controlada por el promotor constitutivo fuerte de TEF1 (Figura 2). Como resultado, hay una expresión más estable y consistente del biosensor en las poblaciones de células de levadura en comparación con la observada utilizando la expresión del biosensor transmitido por plásmidos, y las células que llevan el biosensor se pueden propagar sin la necesidad de medios selectivos.
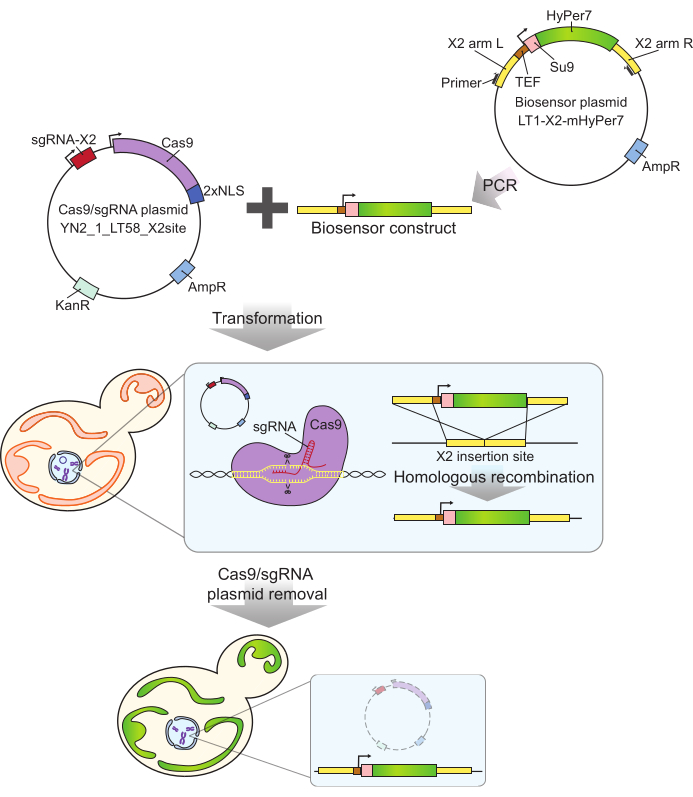
Figura 2: Generación de células que expresan mtHyPer7 mediante CRISPR. La construcción del biosensor que contiene Cas9 y sgRNA (YN2_1_LT58_X2site) y la construcción del biosensor que contiene mtHyPer7 amplificada por PCR se introducen en células de levadura en ciernes mediante transformación de acetato de litio. El sitio de inserción libre de genes en el cromosoma X (X2) es reconocido y cortado por la proteína Cas9 con el sgRNA, y el biosensor se integra en el genoma por recombinación homóloga. Después de la identificación de los transformantes exitosos mediante cribado microscópico, PCR de colonias y secuenciación, el plásmido Cas9 se elimina (se cura) mediante el crecimiento en medios no selectivos. Abreviaturas: sgRNA = ARN guía simple; TEF = factor potenciador de la transcripción. Haga clic aquí para ver una versión más grande de esta figura.
Por último, mtHyPer7 ofrece ventajas sobre otros biosensores ROS. Por ejemplo, los colorantes orgánicos utilizados para detectar ROS (por ejemplo, dihidroetidio [DHE]2 y MitoSOX3) pueden producir tinciones desiguales o inespecíficas y, a menudo, se administran en disolventes como el etanol o el dimetilsulfóxido, que requieren controles adicionales para los efectos de los disolventes. Otra clase de biosensores ROS son los biosensores basados en la transferencia de energía por resonancia de fluorescencia (FRET) (por ejemplo, Redoxfluor para el estado redoxcelular 4 y los sensores de peróxido HSP-FRET5, OxyFRET 6 y PerFRET6). Estas sondas están codificadas genéticamente y son altamente sensibles en principio y pueden dirigirse cuantitativamente a las mitocondrias utilizando secuencias de señales mitocondriales bien caracterizadas. Sin embargo, existen desafíos en el uso de sondas basadas en FRET, incluido el fondo debido a la excitación cruzada y el sangrado, y los estrictos requisitos para la proximidad y orientación de los fluoróforos para que ocurra FRET33,34. Además, las sondas FRET consisten en dos proteínas fluorescentes que requieren construcciones más grandes para su expresión en células de interés en comparación con las sondas de cambio de espectro. El protocolo descrito aquí se desarrolló para aprovechar las fortalezas del biosensor basado en HyPer7 y para utilizar esta sonda compacta, ratiométrica, de alta afinidad y codificada genéticamente para obtener imágenes cuantitativas del peróxido en las mitocondrias en levaduras vivas.
Protocolo
1. Generación del plásmido biosensor, integración en el genoma de la levadura y evaluación de la orientación de mtHyPer7 a las mitocondrias y efectos sobre la morfología mitocondrial, las tasas de crecimiento celular o la sensibilidad al estrés oxidativo
NOTA: Consulte el Archivo Suplementario 1, la Tabla Suplementaria S1, la Tabla Suplementaria S2 y la Tabla Suplementaria S3 para la construcción de plásmidos de biosensores, cepas, plásmidos y cebadores, respectivamente, utilizados para la construcción y caracterización de biosensores. Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, reactivos e instrumentos utilizados en este protocolo.
- Amplifique la construcción del biosensor a partir del plásmido del biosensor utilizando los cebadores Y290 e Y291 (Figura 2) mediante reacción en cadena de la polimerasa (PCR).
- Mezclar 500 ng del plásmido Cas9/ARN guía (YN2_1_LT58_X2site32) con 50 μL del producto de PCR del paso 1.1 (la construcción del biosensor). Transforme la mezcla en levadura en ciernes utilizando el método de acetato de litio35 y seleccione transformantes en placas YPD que contengan 200 mg/mL G418.
- Cribado de transformadores candidatos mediante amplificación por PCR de ADN genómico utilizando los cebadores Y292 e Y293. En el caso de los transformadores que llevan una inserción del tamaño esperado (positivo: 3,5 kb; negativo: 0,3 kb), secuenciar la región insertada para una mayor validación.
- Evaluar el efecto del biosensor sobre el crecimiento y la función mitocondrial (Figura 3). Si el biosensor parece afectar la función de las células o mitocondrias, intente minimizar el efecto cambiando el promotor, el sitio de integración o la cepa parental.
- Determinar el efecto de la construcción del biosensor sobre la tasa de crecimiento en presencia y ausencia de un estresor oxidativo (por ejemplo, paraquat), como se describió anteriormente36.
- Diluir las células de fase logarítmica media a una densidad óptica de 600 nm (OD 600) de 0,0035 en200 μl de los medios correspondientes con y sin tratamiento en cada pocillo de una placa de fondo plano de 96 pocillos. Mida la densidad óptica del cultivo cada 20 min durante 72 h utilizando un lector de placas. Calcule la tasa máxima de crecimiento (pendiente) como el cambio máximo en el OD durante un intervalo de 240 minutos durante el curso de 72 h.
- Visualizar las células mediante microscopía de fluorescencia y evaluar el brillo y la morfología mitocondrial como se ha descrito anteriormente37.
- Cultive las células hasta la fase logarítmica media, tiña las mitocondrias con MitoTracker Red de 250 nM durante 30 minutos y lávelas dos veces antes de obtener imágenes. Capture pilas Z de 6 μm de profundidad a intervalos de 0,3 μm en un microscopio de fluorescencia confocal o de campo amplio e inspeccione visualmente. Busca mitocondrias que formen estructuras tubulares alargadas.
- Determinar el efecto de la construcción del biosensor sobre la tasa de crecimiento en presencia y ausencia de un estresor oxidativo (por ejemplo, paraquat), como se describió anteriormente36.
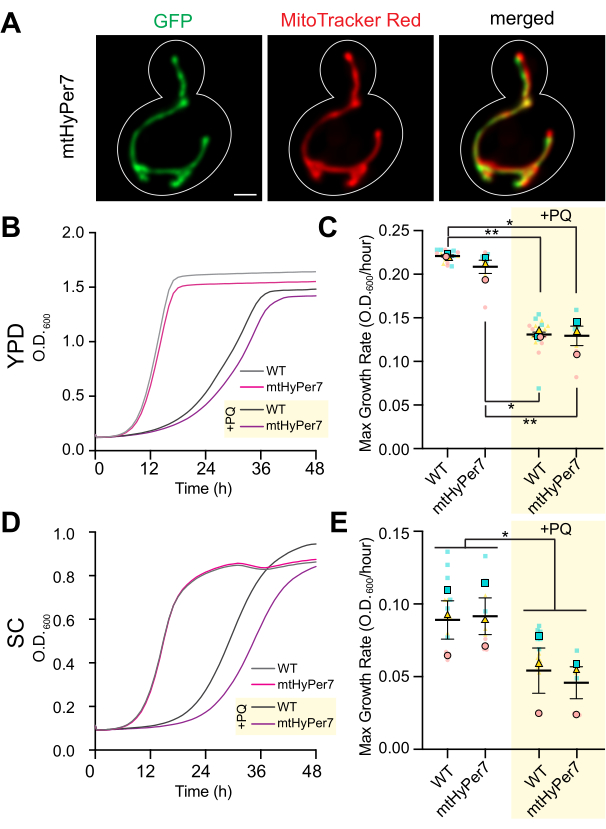
Figura 3: mtHyPer7 está dirigido a las mitocondrias y no afecta a la morfología mitocondrial, al crecimiento celular ni a la sensibilidad al estrés oxidativo. (A) Morfología mitocondrial en células de levadura vivas que expresan mtHyPer7. Panel izquierdo: mtHyPer7 visualizado con una excitación de 488 nm. Panel central: mitocondrias marcadas con MitoTracker Red de 250 nM. Panel derecho: imágenes combinadas. Se muestran proyecciones de intensidad máxima. El contorno de la celda se muestra en blanco. Barra de escala = 1 μm. (B,C) Curvas de crecimiento y tasa máxima de crecimiento de células de tipo salvaje y células que expresan mtHyPer7 cultivadas en presencia (+PQ) o ausencia de 2,5 mM de paraquat en medios YPD. (D,E) Curvas de crecimiento y tasa máxima de crecimiento de células de tipo salvaje y que expresan mtHyPer7 cultivadas en presencia (+PQ) o ausencia de 2,5 mM de paraquat en medios SC. Todas las curvas de crecimiento son la media de tres réplicas independientes. Las tasas máximas de crecimiento se representan como media ± error estándar de la media (SEM). El análisis de la curva de crecimiento se realizó diluyendo las células de la fase logarítmica media a un OD 600 de 0,0035 en200 μL de medio correspondiente en cada pocillo de una placa de fondo plano de 96 pocillos. La DO del cultivo se midió cada 20 min durante 72 h utilizando un lector de placas. Cada cepa/condición se sembró por triplicado y se graficó la tasa de crecimiento promedio. La tasa máxima de crecimiento (pendiente) se calculó utilizando los cambios en el DO durante un intervalo de 240 min en el transcurso de 72 h. Abreviaturas: WT = tipo salvaje; PQ = paraquat. Haga clic aquí para ver una versión más grande de esta figura.
2. Cultivo celular y preparación para la obtención de imágenes (Figura 4)
- Propagar las células en medio sintético a la fase logarítmica media para la obtención de imágenes. Un cultivo de fase media de 5 mL proporciona suficientes células para cuatro o cinco portaobjetos y un total de >100 células gemadas para el análisis.
- Por la mañana del día anterior al experimento, prepare precultivos líquidos inoculando 5 mL de medio sintético completo (SC) en un tubo de fondo cónico de 50 mL con una sola colonia de células de levadura.
- Incubar el precultivo en un agitador orbital a 200 rpm y 30 °C durante 6-8 h. Mida el DO 600 del precultivo, que debe estar en la fase media del logaritmo: ~ 0,5-1 × 107 células/mL, DO600 ~ 0,1-0,3.
- Prepare un cultivo de fase logarítmica media utilizando el precultivo para obtener imágenes al día siguiente. Calcule la cantidad de precultivo necesaria para un cultivo de fase logarítmica media después del crecimiento nocturno (8-16 h). Cuando las células se cultivan en medio SC, el tiempo de duplicación es de ~ 2 h. Por lo tanto, el volumen (V) de precultivo para la inoculación de un cultivo nocturno de 5 mL se calcula mediante la ecuación (1):
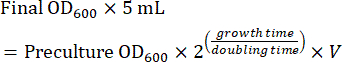 (1)
(1) - Inocular 5 mL de medio SC en un tubo de fondo cónico de 50 mL con la cantidad de precultivo calculada en el paso 2.1.3. Cultivar en un agitador orbital a 200 rpm y 30 °C durante 8-16 h.
- El día de la obtención de imágenes, confirme que el cultivo generado en el paso 2.1.4 se encuentra en la fase logarítmica media (DO600 ~0,1-0,3). Concentrar las células de 1 mL del cultivo de fase logarítmica media por centrifugación a 6.000 × g durante 30 s. Retire el sobrenadante, dejando 10-20 μL del sobrenadante en el tubo. Vuelva a suspender el gránulo celular mezclándolo suavemente con los medios residuales con una micropipeta.
- Utilice un soplador de aire o un pañuelo sin pelusa para eliminar el polvo de un portaobjetos de microscopio de vidrio y añada 1,8 μl de la suspensión celular al portaobjetos. Cubra las celdas con un cubreobjetos de vidrio #1,5 (170 μm de grosor), bajando el cubreobjetos lentamente en ángulo para evitar la introducción de burbujas.
- Tome una imagen inmediatamente y deseche el portaobjetos después de 10 minutos de toma de imágenes.
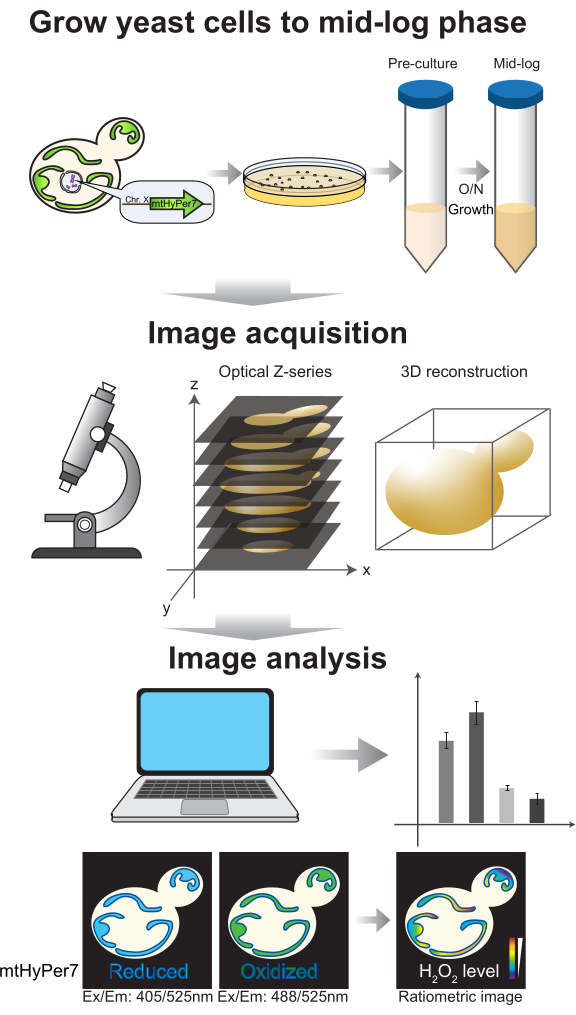
Figura 4: Crecimiento celular e imágenes. Las células de levadura en ciernes que expresan mtHyPer7 se cultivan hasta la fase logarítmica media. Las imágenes de la serie Z se recogen mediante microscopía confocal de disco giratorio y luego se someten a reconstrucción y análisis en 3D. Consulte las secciones 2 y 3 del protocolo. Haga clic aquí para ver una versión más grande de esta figura.
3. Optimización de las condiciones de imagen y de la recogida de imágenes (Figura 5)
- Seleccione un modo de imagen. Para el corte óptico sin posprocesamiento, se prefiere un instrumento confocal de disco giratorio. Sin embargo, si la señal es baja o si este instrumento no está disponible, utilice imágenes de campo amplio, asegurándose de que las imágenes de campo amplio estén desconvolucionadas para eliminar el desenfoque desenfocado, como se describió anteriormente38.
- Seleccione la óptica. Utilice un objetivo de inmersión en aceite de gran apertura numérica, como el apocromático plano de 100x/1,45.
- Seleccione las longitudes de onda de excitación y emisión. Para la obtención de imágenes confocales de disco giratorio, utilice una excitación láser a 405 nm y 488 nm y un filtro de emisión GFP estándar. Para obtener imágenes de campo amplio, utilice un diodo emisor de luz (LED) o una excitación de lámpara, pero asegúrese de que la configuración del filtro permita la variación de la excitación mientras pasa la emisión a través del filtro GFP estándar.
NOTA: Esto se puede lograr, por ejemplo, quitando el filtro de excitación de un cubo GFP y usando un LED o una rueda de filtros para seleccionar la excitación. - Seleccione el tiempo de exposición y la intensidad de la iluminación.
- Establecer condiciones de adquisición que produzcan una señal fácilmente detectable y una resolución aceptable en cada canal de fluorescencia. Por ejemplo, en un microscopio confocal de disco giratorio con una cámara sCMOS, utilice una agrupación de 2 x 2, una potencia láser del 20-40 % y una exposición de 200-600 ms.
- Examine el histograma de la imagen. En una imagen de 12 bits (4.096 niveles de gris posibles), asegúrese de que el rango dinámico total de los valores de píxel sea de al menos varios cientos de niveles de gris, sin saturación (Figura 5A). Además, asegúrese de que el rango sea un orden de magnitud más alto que el nivel de ruido. Calcule el nivel de ruido como la desviación estándar de los valores de píxel en un área sin celdas de una imagen, medido como se describe en el paso 4.1.3.1.
- Realice pruebas de fotoblanqueo o estrés mitocondrial inducido por imágenes en las condiciones de imagen seleccionadas. Si se observa un fotoblanqueo excesivo o un aumento del H 2 O2mitocondrial, se reduce la potencia del láser y se aumenta la exposición o el binning.
- Recopile una serie de imágenes de lapso de tiempo, sin demora entre adquisiciones, para evaluar los efectos de las condiciones de imagen en la estabilidad de la señal y el estrés oxidativo en las mitocondrias. Utilizando el software de adquisición del microscopio o ImageJ, mida el valor promedio de píxel en cada canal de fluorescencia para confirmar la estabilidad de la señal (cambio del <5%; Figura 5B). Si el experimento no incluye imágenes de lapso de tiempo, asegúrese de que la fluorescencia sea estable en dos o tres pilas Z repetidas (25-35 exposiciones).
NOTA: Una disminución en la fluorescencia de ambos canales puede indicar fotoblanqueo; sin embargo, una disminución en la fluorescencia excitada por 405 nm acompañada de un aumento en el canal excitado por 488 nm puede indicar un aumento delH2O2mitocondrial y estrés oxidativo inducido por imágenes en el orgánulo.
- Recopile una serie de imágenes de lapso de tiempo, sin demora entre adquisiciones, para evaluar los efectos de las condiciones de imagen en la estabilidad de la señal y el estrés oxidativo en las mitocondrias. Utilizando el software de adquisición del microscopio o ImageJ, mida el valor promedio de píxel en cada canal de fluorescencia para confirmar la estabilidad de la señal (cambio del <5%; Figura 5B). Si el experimento no incluye imágenes de lapso de tiempo, asegúrese de que la fluorescencia sea estable en dos o tres pilas Z repetidas (25-35 exposiciones).
- Adquirir imágenes. Si recopila pilas Z, asegúrese de que el intervalo Z sea el mismo para todas las imágenes del conjunto de datos e incluya toda la celda. Para levadura en ciernes, imagen con un intervalo Z de 0,5 μm y una profundidad total de pila de 6 μm. Adquiera imágenes de luz transmitida para documentar los límites de las celdas.
- Analice las imágenes de forma manual o semiautomática a través de los scripts disponibles en el Archivo Suplementario 2 y en https://github.com/theresaswayne/biosensor, utilizando la distribución Fiji de ImageJ39 y el software estadístico R (Figura 6). En las instrucciones del software, los comandos de menú jerárquicos se muestran en negrita con "|", lo que indica una secuencia de selecciones de menú. Las opciones y los botones se muestran en negrita.
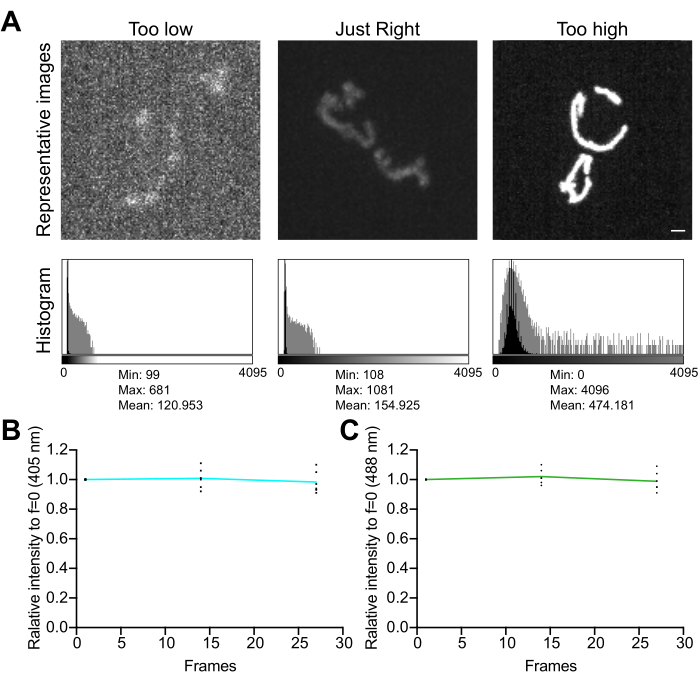
Figura 5: Optimización de las imágenes. (A) Evaluación de imágenes e histogramas para el rango de intensidad correcto. Se muestran proyecciones de máxima intensidad de imágenes confocales de disco giratorio. Los histogramas se muestran con un eje Y lineal (negro) y un eje Y a escala logarítmica (gris) para ilustrar el rango dinámico de la imagen. Paneles izquierdos: una imagen ruidosa con baja intensidad y rango dinámico. Paneles centrales: una imagen con un rango dinámico aceptable (~1.000 niveles de gris) e intensidad. Paneles derechos: una imagen con contraste mejorado incorrectamente para producir una saturación excesiva. Barra de escala = 1 μm. (B,C) Análisis del fotoblanqueo de mtHyPer7. Las pilas Z sucesivas se recolectaron sin demora, se sumaron las pilas Z y se midió la intensidad media de las mitocondrias y se normalizó hasta el primer punto de tiempo. Se muestran los resultados de los tres primeros puntos de tiempo (27 exposiciones). (B) Longitud de onda de excitación: 405 nm. (C) Longitud de onda de excitación: 488 nm. Los valores mostrados son los promedios de tres celdas de cada uno de los tres ensayos independientes. Haga clic aquí para ver una versión más grande de esta figura.
4. Análisis semiautomatizado con scripts
- Genere y mida imágenes de proporción utilizando un script de análisis de biosensores (por ejemplo, biosensor.ijm o biosensor-image-subtraction.ijm).
- Seleccione el script que desea utilizar. El protocolo para usar cada script es similar; Cualquier diferencia se especificará en el texto.
- biosensor.ijm: En este script, el fondo y el ruido se corrigen utilizando áreas de imagen seleccionadas por el usuario, valores fijos o sin sustracción. Seleccione métodos para la corrección de ruido y fondo de forma independiente.
- biosensor-image-subtraction.ijm: En este script, el fondo y el ruido se manejan mediante el mismo método seleccionado por el usuario, que puede ser uno de los siguientes: imagen en blanco, área seleccionada por el usuario dentro de la imagen, valor fijo o sin corrección.
- En Fiji, abra una imagen de pila Z multicanal adquirida en el paso 3.5. Abra el archivo de script de análisis de biosensor deseado. Para ejecutar la secuencia de comandos, haga clic en Ejecutar en la ventana Editor de secuencias de comandos . En la ventana de diálogo que aparece, introduzca la información solicitada.
- Seleccione los números de canal del numerador y el denominador para el cálculo de la relación. Para mtHyPer7, el numerador es el canal excitado a 488 nm, y el denominador es el canal excitado a 405 nm. Seleccione el número de canal de la imagen de luz transmitida, si está presente, o 0 si no hay ninguno.
- Seleccione el método de sustracción de fondo deseado de las siguientes cuatro opciones. Si el fondo es relativamente uniforme, elija Seleccionar un área de imagen, que mide directamente el nivel de fondo de la imagen. Si el fondo varía sustancialmente a lo largo del campo, utilice el script biosensor-image-subtraction.ijm y seleccione Imagen en blanco (para recopilar una imagen en blanco para su corrección, capture una pila Z multicanal con condiciones de adquisición idénticas en un campo de visión libre de células, o a partir de una diapositiva hecha con medio de crecimiento libre de células). El valor fijo permite la entrada de un valor de fondo previamente medido. Ninguno deja el fondo sin corregir, pero puede reducir la precisión de la medición.
- Seleccione el método de sustracción de ruido deseado. El valor de ruido se utiliza como un umbral inferior en las imágenes de canal enmascarado sustraído al fondo para reducir el efecto de la variación aleatoria en la lectura del detector. Opte por Seleccionar un área de imagen o Valor fijo para permitir la entrada de un nivel de ruido medido previamente, lo que generalmente funciona bien ya que los niveles de ruido son constantes si las condiciones de imagen se mantienen constantes. Como alternativa, elija Ninguno y utilice un valor de 1 como umbral inferior, lo que puede aumentar la variabilidad de las mediciones.
- Seleccionar un algoritmo de umbral para detectar mitocondrias de forma precisa y coherente; Se recomienda Otsu o MaxEntropy . Lo ideal es utilizar el mismo algoritmo para todas las imágenes de un experimento, pero garantizar el reconocimiento preciso de las mitocondrias. Utilice un método de umbral diferente si hay cambios en la morfología durante un experimento.
- Seleccione el número de regiones de interés (ROI) por celda. Por ejemplo, si mide las diferencias entre la madre y el capullo, seleccione 2.
- Seleccione la carpeta de salida donde se guardarán las mediciones y las imágenes de proporción.
- Siga las indicaciones para la corrección de ruido y fondo.
- Selección de área (si corresponde): Si se eligió Seleccionar un área de imagen para la medición de fondo o ruido, siga las indicaciones para dibujar un área de fondo (fuera de cualquier celda o artefacto fluorescente) con la herramienta ROI de rectángulo. Después de dibujar el área, haga clic en Aceptar.
- Entrada de valor fijo (si corresponde): Si se eligió Valor fijo para la medición de fondo o ruido, siga las indicaciones para ingresar valores de fondo y/o ruido para cada canal de fluorescencia.
- Imagen de referencia en blanco (si corresponde): En el script biosensor-image-subtraction.ijm, si se eligió Imagen en blanco para la corrección de fondo o ruido, siga las indicaciones para seleccionar un archivo de imagen en blanco.
- Marque el ROI para su medición. En cultivos de fase logarítmica media, restrinja el análisis a las células en gema.
- Dibuje ROI correspondientes a células individuales o regiones subcelulares en función de la imagen de campo claro. El ROI no tiene que coincidir exactamente con el contorno de la célula, ya que solo se medirán las mitocondrias umbralizadas dentro del ROI. También puede abrir un conjunto de ROI guardado anteriormente: en el Administrador de ROI, haga clic en Más y, a continuación, seleccione el archivo ROI.
- Presione T después de crear cada ROI para agregar el ROI seleccionado al Administrador de ROI. En el Administrador de ROI, marque Mostrar todo para documentar las celdas que se marcaron. Cada región agregada aparecerá como un elemento numerado en la lista del Administrador de ROI. Si analiza más de un ROI por celda (por ejemplo, madre y yema), marque los ROI en el mismo orden para cada celda analizada.
- Una vez que se hayan agregado todos los ROI deseados al Administrador de ROI, haga clic en Aceptar en la ventana de diálogo Marcar celdas .
- Elija el formato de la tabla de medidas. En la ventana de diálogo Multimedida que aparece, marque Medir todos los sectores. Marque la opción Una fila por sector para producir una tabla con el formato deseado. Utilice el process_multiROI_tables. Script de R para procesar tablas creadas con la opción Una fila por sector ; no marque Anexar resultados. Repita este paso 3 veces (para medir las imágenes del numerador [488], el denominador [405] y la relación [488/405]).
- El script guardará los archivos de salida en la carpeta seleccionada en el paso 4.1.2.6.
- Seleccione el script que desea utilizar. El protocolo para usar cada script es similar; Cualquier diferencia se especificará en el texto.
- Cálculo de las relaciones medias ponderadas para cada región o celda
- A partir de los resultados obtenidos en el paso anterior, calcule las proporciones medias ponderadas para cada región o celda utilizando la ecuación (2). Calcule las proporciones "por píxeles" o "por regiones" (consulte la discusión para obtener más detalles).
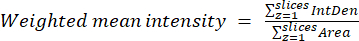 (2)
(2)
NOTA: Los valores de área y densidad integrada (IntDen) incluyen solo los píxeles dentro de las mitocondrias umbralizadas. Este cálculo se puede automatizar utilizando el process_multiROI_tables. Script R y software estadístico R.
- A partir de los resultados obtenidos en el paso anterior, calcule las proporciones medias ponderadas para cada región o celda utilizando la ecuación (2). Calcule las proporciones "por píxeles" o "por regiones" (consulte la discusión para obtener más detalles).
- Genere una imagen de proporción coloreada. Como los cambios en el tono (color) son más obvios para el ojo humano que los cambios en la intensidad, convierta el valor de la relación en una escala de colores para facilitar la interpretación visual. El script colorize_ratio_image.ijm coloreará una imagen de proporción enmascarada.
- En Fiji, abra una imagen de pila de relación Z generada en el paso 4.1.6. Abra el archivo de script colorize_ratio_image.ijm. Para ejecutar la secuencia de comandos, haga clic en Ejecutar en la ventana Editor de secuencias de comandos . En la ventana de diálogo que aparece, introduzca la información solicitada.
- Método de coloración: En la opción Sin modulación , todos los píxeles mitocondriales aparecen con el mismo brillo. Sin embargo, algunas imágenes pueden parecer ruidosas, ya que tanto los píxeles tenues como los brillantes contribuyen a la proporción de la imagen. Para reducir este efecto, utilice la opción Intensidad modulada .
- Valor mínimo y máximo mostrado: Estos valores controlan el rango de valores de relación que se colorearán. Elija valores cercanos a los valores mínimos y máximos promedio observados en un experimento (en función de las proporciones medias ponderadas calculadas en el paso 4.2.1). Dentro de un experimento, asegúrese de adquirir todas las imágenes con condiciones de imagen idénticas y mostrar todas las imágenes con valores mínimos y máximos idénticos.
- Modo de proyección: las pilas Z se muestran como proyecciones para mostrar toda la población mitocondrial. La proyección se crea antes de la coloración. Seleccione Máx . para una proyección de intensidad máxima (conservando los valores de relación e intensidad máximos) o Promedio para una proyección de intensidad media.
- Carpeta de salida: seleccione la carpeta en la que desea guardar las imágenes coloreadas.
- Si se seleccionó la opción Sin módulo, seleccione un esquema de color (tabla de búsqueda; LUT) en la ventana de diálogo que aparece. Utiliza las LUT RGB Fire o Rainbow integradas en Fiji, o cualquier LUT deseada en el formato .lut de ImageJ (Importar desde un archivo LUT). Se recomienda la LUT Rainbow Smooth40 (incluida en el archivo complementario 2 y en GitHub).
- El script guarda los archivos de salida en la carpeta seleccionada en el paso 4.3.1.4. Estos incluyen la imagen de proporción coloreada (Color_RGB.tif) y la imagen de proporción coloreada con una barra de calibración que muestra la correspondencia entre los valores de relación y el color de la imagen (Color_with_bar.tif).
- En Fiji, abra una imagen de pila de relación Z generada en el paso 4.1.6. Abra el archivo de script colorize_ratio_image.ijm. Para ejecutar la secuencia de comandos, haga clic en Ejecutar en la ventana Editor de secuencias de comandos . En la ventana de diálogo que aparece, introduzca la información solicitada.
5. Análisis manual
NOTA: Este enfoque lleva más tiempo, pero permite flexibilidad en el preprocesamiento y el establecimiento del umbral.
- Corregir para el fondo.
- Establecer opciones en Fiyi.
- Haga clic en Analizar | Establecer medidas. En la ventana de diálogo que aparece, active las casillas Área, Valor medio, StdDev, InTden y Etiqueta de visualización. Establezca los decimales en 3.
- Haga clic en Editar | Opciones | Entrada/Salida. En la ventana de diálogo que aparece, marque las casillas Guardar números de fila y Guardar encabezados de columna.
- Para aumentar la sensibilidad del cálculo de la relación, reste el fondo de cada canal de fluorescencia. Si el fondo es relativamente uniforme, mida la intensidad media de un área libre de celdas en una imagen y reste este valor de toda la imagen (paso 5.1.2.1). Alternativamente, si el fondo varía sustancialmente a lo largo del campo, use una imagen en blanco para la corrección (paso 5.1.2.2.).
- Para restar una región seleccionada por el usuario, haga clic en Imagen | Color | Divida los canales y mantenga abiertas todas las imágenes de los canales, ya que se necesitarán más adelante. Para cada canal de fluorescencia, dibuje un ROI en el fondo (fuera de las celdas) y haga clic en Analizar | Medir, o para pilas, haga clic en Imagen | Pilas | Pila de medidas. Observe el valor medio del ROI que aparece en la tabla Resultados . Haga clic en Editar | Seleccione Ninguno y, a continuación, Procesar | Matemáticas | Restar. En la ventana de diálogo que aparece, introduzca el valor medio de fondo medido, redondeado al entero más cercano.
NOTA: El redondeo evita errores con operaciones binarias más adelante. - Para restar una imagen en blanco de un archivo de datos, recopile una imagen en blanco de un campo de visión completamente libre de células o de una diapositiva preparada con medio de crecimiento libre de células. Haga clic en Proceso | Calculadora de imágenes. En la ventana de diálogo que aparece, establezca la operación en Restar y establezca Imagen1 e Imagen2 en la imagen de celda y la imagen en blanco, respectivamente. Marque Crear nueva ventana y resultado de 32 bits.
- Para restar una región seleccionada por el usuario, haga clic en Imagen | Color | Divida los canales y mantenga abiertas todas las imágenes de los canales, ya que se necesitarán más adelante. Para cada canal de fluorescencia, dibuje un ROI en el fondo (fuera de las celdas) y haga clic en Analizar | Medir, o para pilas, haga clic en Imagen | Pilas | Pila de medidas. Observe el valor medio del ROI que aparece en la tabla Resultados . Haga clic en Editar | Seleccione Ninguno y, a continuación, Procesar | Matemáticas | Restar. En la ventana de diálogo que aparece, introduzca el valor medio de fondo medido, redondeado al entero más cercano.
- Establecer opciones en Fiyi.
- Para limitar el análisis a las mitocondrias, realice la segmentación. Debido a que cada canal puede cambiar de intensidad dependiendo del estado del biosensor, use la suma de los dos canales para definir el área de las mitocondrias de manera consistente.
- Para crear una imagen de suma, haga clic en Proceso | Calculadora de imágenes. En la ventana de diálogo que aparece, establezca la operación en Agregar y establezca Imagen1 e Imagen2 en los dos canales fluorescentes sustraídos por el fondo en cualquier orden. Marque Crear nueva ventana y Resultado de 32 bits y espere a que aparezca una imagen de suma.
- Establezca el umbral para definir las mitocondrias en la imagen de suma.
- Haga clic en la imagen | Ajustar | Umbral. En la ventana Umbral que aparece, marque Fondo oscuro e Histograma de pila. Establezca Method en el algoritmo deseado (por ejemplo, Otsu o MaxEntropy). Emplee umbrales automatizados para la reproducibilidad, pero si no es adecuado ningún método automático, ajuste manualmente el umbral.
NOTA: Idealmente, se debe usar el mismo algoritmo para todas las imágenes de un experimento, pero los cambios en la morfología durante un experimento pueden requerir un método de umbral diferente en algunas condiciones. - Cuando el umbral sea satisfactorio, haga clic en Aplicar. En la ventana de diálogo que aparece, elija Convertir en máscara. En la ventana de diálogo que aparece, marque Fondo negro y deje las otras casillas sin marcar. Guarde la imagen de máscara resultante para evaluar la precisión de la segmentación.
- Haga clic en la imagen | Ajustar | Umbral. En la ventana Umbral que aparece, marque Fondo oscuro e Histograma de pila. Establezca Method en el algoritmo deseado (por ejemplo, Otsu o MaxEntropy). Emplee umbrales automatizados para la reproducibilidad, pero si no es adecuado ningún método automático, ajuste manualmente el umbral.
- Convierta los valores de máscara de 0 y 255 a 0 y 1, respectivamente, haciendo clic en Procesar | Matemáticas | Dividir. Establezca el valor en 255 y, cuando se le solicite, seleccione la opción para procesar todas las imágenes.
- Aplique la máscara a los canales de fluorescencia sustraídos por el fondo haciendo clic en Procesar | Calculadora de imágenes. En la ventana de diálogo que aparece, establezca la operación en Multiplicar. Establezca Imagen1 e Imagen2 en el canal del numerador y la máscara, respectivamente. Marque Crear nueva ventana y resultado de 32 bits; Repite la multiplicación de la máscara con el canal del denominador.
- Prepare cada canal enmascarado para el cálculo de la relación estableciendo los píxeles de fondo en NaN ("no es un número").
- Seleccione el canal del numerador enmascarado y haga clic en Imagen | Ajustar | Umbral. En la ventana Umbral , haga clic en Establecer y, en la ventana de diálogo que aparece, establezca el mínimo en el nivel de ruido calculado o en 1 y deje el máximo como está.
- En la ventana Umbral , haga clic en Aplicar. En el siguiente cuadro de diálogo, elija Establecer en NaN. Repita el procedimiento para el canal de denominador enmascarado.
- Genere la imagen de proporción.
- Haga clic en Proceso | Calculadora de imágenes. En la ventana de diálogo que aparece, establezca operación en Dividir. Establezca Image1 e Image2 en los canales de numerador y denominador enmascarados sustraídos por el fondo, respectivamente. Para mtHyPer7, el numerador es la forma oxidada excitada a 488 nm, y el denominador es la forma reducida excitada a 405 nm. Por lo tanto, las proporciones más altas indican un mayorH2O2.
- Marque Crear nueva ventana y resultado de 32 bits. Guarde la imagen de proporción para su análisis.
- Marque y cuantifique las áreas de interés. Cada célula o región subcelular se selecciona y almacena como un ROI en el Administrador de ROI. Los ROI no tienen que coincidir perfectamente con los contornos celulares, ya que solo se medirán las regiones mitocondriales enmascaradas.
- Utilizando la imagen de luz transmitida para evitar sesgos, cree ROI correspondientes a células individuales (o regiones subcelulares). En los cultivos de fase logarítmica media, restrinja el análisis a las células de levadura que producen yemas, que participan activamente en la división celular. Presione T después de crear cada ROI para agregarlo al Administrador de ROI. Marque Mostrar todo para documentar las celdas que se marcaron.
- Haga clic en la imagen de proporción creada arriba y, en el Administrador de ROI, haga clic en Más ... | MultiMedida. En la ventana de diálogo que aparece, marque Medir todos los sectores. No marque Anexar resultados. Marque la opción Una fila por sector para producir una tabla con el formato deseado. El process_multiROI_tables. El script de R procesará las tablas creadas con la opción Una fila por sector en el software estadístico de R.
- Guarde los resultados. Haga clic en la ventana Resultados , luego en Archivo | Guarde y guarde la tabla de resultados en formato .csv o .xls. Establezca el nombre del archivo para que coincida con el nombre de la imagen.
- Guarde los ROI. En el Administrador de ROI, primero asegúrese de que no haya ROI seleccionado: haga clic en Anular selección y, a continuación, en Más | Guardar. Abra los ROI guardados junto con la imagen original en Fiji para hacer una referencia cruzada de las mediciones con la imagen.
- Calcule las relaciones medias ponderadas por celda o región utilizando los resultados obtenidos en el paso anterior y la ecuación (3). Calcule las proporciones "por píxeles" o "por regiones" (consulte la discusión para obtener más detalles).
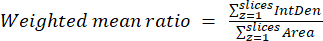 (3)
(3)
NOTA: Los valores de área y densidad integrada incluyen solo los píxeles dentro de las mitocondrias umbralizadas. Este cálculo se puede automatizar utilizando el process_multiROI_tables. R en el software estadístico R. - Genere una imagen de proporción coloreada.
NOTA: Las imágenes coloreadas pueden ser no moduladas, donde todos los píxeles mitocondriales aparecen con el mismo brillo, o moduladas por intensidad, donde la intensidad de píxeles en la imagen original se usa para establecer intensidades en la imagen coloreada.- Para producir una imagen coloreada no modulada:
- Abra la imagen de proporción generada arriba. Haga clic en la imagen | Duplique para generar una copia de la imagen y, a continuación, cierre la imagen original.
- Si la imagen es una pila Z, seleccione un solo corte o genere una proyección Z para ver todas las mitocondrias. Utilice una intensidad máxima (conservando los valores máximos de relación e intensidad en cada coordenada de píxel XY) o una proyección de intensidad media.
- Haga clic en la imagen | Tablas de búsqueda y ajuste la LUT al esquema de color deseado (por ejemplo, Rainbow RGB o Fire [disponible de forma predeterminada en ImageJ]). Alternativamente, haga clic en Archivo | Importa LUT y selecciona cualquier LUT que desees en el formato .lut de ImageJ, como Rainbow Smooth40 (incluido en el Archivo Suplementario 2 y en GitHub). Asegúrate de que la LUT tenga un color oscuro asignado al valor 0.
- Establezca el contraste de la pantalla haciendo clic en Imagen | Ajustar | Brillo/Contraste. En la ventana Brillo/Contraste, haga clic en Establecer y, en la ventana de diálogo que aparece, introduzca los valores deseados para los valores Mínimo y Máximo mostrados. Para maximizar las diferencias de color observadas, ajústelas aproximadamente al mínimo y al máximo obtenidos en todas las imágenes. Establezca todas las imágenes de un experimento en los mismos niveles de contraste.
NOTA : No haga clic en Aplicar, ya que esto cambiará los valores de píxel y evitará la generación de una barra de calibración precisa en el siguiente paso. - Agregue una barra de calibración de color haciendo clic en Analizar | Herramientas | Barra de calibración. En la ventana de diálogo que aparece, marque la opción Superposición para eliminar la barra, si lo desea, haciendo clic en Imagen | Superposición | Eliminar superposición.
- Si lo desea, agregue una barra de escala haciendo clic en Analizar | Herramientas | Barra de escala. En la ventana de diálogo que aparece, defina el tamaño, la ubicación y el color deseados para la barra. Marca la opción Superposición para mantener el color de la barra independientemente de la LUT utilizada.
- Genere una imagen RGB para su publicación haciendo clic en Imagen | Superposición | Aplanar. Guarde la imagen resultante.
NOTA: Esta imagen es solo para presentación o publicación. Los valores de intensidad están alterados, por lo que no se puede medir. Las barras también se graban permanentemente en la imagen.
- Para crear una imagen de intensidad modulada:
- Haga clic en la imagen | Duplique para generar una copia de la imagen y, a continuación, cierre el original.
- Si la imagen es una pila Z, seleccione un solo corte o genere una proyección Z para ver todas las mitocondrias.
- Establezca el contraste de visualización de la imagen de proporción haciendo clic en Imagen | Ajustar | Brillo/Contraste y, en la ventana Brillo/Contraste, haga clic en Establecer. En la ventana de diálogo que aparece, introduzca los valores deseados para los valores mostrados Mínimo y Máximo . Para maximizar las diferencias de color observadas, establézcalas aproximadamente en el mínimo y el máximo obtenidos en todas las imágenes, y establezca todas las imágenes de un experimento en los mismos niveles de contraste. Haga clic en Aplicar para cambiar la escala de los valores de píxel.
- Para crear una barra de calibración, duplique esta imagen mejorada y genere una barra navegando a Analizar | Herramientas | Barra de calibración. Convierta la imagen y la superposición a formato RGB haciendo clic en Imagen | Superposición | Aplanar. Si lo desea, pegue esta barra en la imagen RGB de intensidad modulada obtenida en el paso 5.6.2.12 para su presentación o publicación.
- Crea una nueva imagen con el mismo ancho y alto que la imagen haciendo clic en Archivo | Nuevo | Imagen.... En la ventana de diálogo que se abre, establezca los parámetros de la siguiente manera: Tipo: RGB; Rellenar con: Negro; Ancho y alto: 9ancho y alto de la imagen); Rebanadas: 1.
- Convierta la nueva pila en una pila de imágenes HSB (tono, saturación, brillo) haciendo clic en Imagen | Tipo | Pila HSB.
- Haga clic en la imagen de relación ajustada al contraste navegando a Editar | Seleccione Todo y, a continuación, Editar | Copiar. A continuación, haga clic en la pila HSB, seleccione el primer sector (Tono) y haga clic en Editar | Pegue para transferir los valores de proporción.
- Seleccione el segmento 2 (Saturación) de la pila HSB. Establezca el color de primer plano en blanco navegando a Editar | Opciones | Colores. Haga clic en Editar | Seleccione Todo y, a continuación, Editar | Relleno y, en la ventana de diálogo que se abre, seleccione No para rellenar solo el sector actual con blanco.
- Abra la imagen de datos sin procesar y divida los canales haciendo clic en Imagen | Color | Canales divididos.
- Genere el promedio de los dos canales de relación usando la Calculadora de Imágenes y haciendo clic en Proceso | Calculadora de imágenes. En la ventana de diálogo que aparece, establezca la operación en Promedio y establezca Imagen1 e Imagen2 en las imágenes del numerador y del denominador, respectivamente. Marque Crear nueva ventana.
- Haga clic en la imagen promedio creada arriba navegando a Editar | Seleccione Todo y, a continuación, Editar | Copiar. A continuación, haga clic en la pila HSB, seleccione el tercer segmento (Valor) y haga clic en Editar | Pegar para transferir los valores de intensidad.
- Convierta la pila HSB en el espacio de color RGB haciendo clic en Imagen | Tipo | Color RGB. Guarde la imagen resultante.
- Para producir una imagen coloreada no modulada:
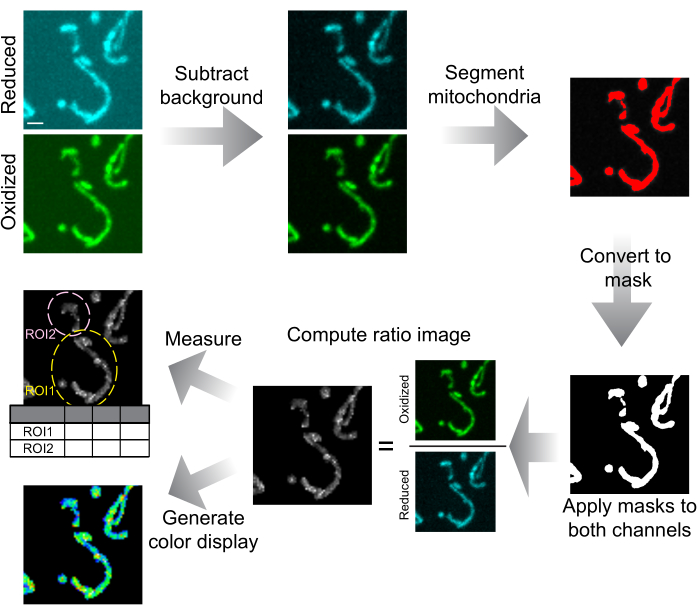
Figura 6: Esquema de análisis y presentación de imágenes. Las imágenes confocales de disco giratorio se restan primero del fondo. Las mitocondrias se segmentan por umbral y se convierten en máscaras para cada corte. Estas máscaras se aplican a ambos canales y las imágenes enmascaradas se utilizan para calcular la proporción de la imagen. Los ROI se extraen para medir la relación mtHyPer7 en células o regiones subcelulares. También se pueden generar imágenes de proporción coloreada para la presentación de datos. Barra de escala = 1 μm. Abreviatura: ROI = región de interés. Haga clic aquí para ver una versión más grande de esta figura.
Resultados Representativos
Para confirmar que mtHyPer7 es una sonda adecuada para evaluar el H 2 O2mitocondrial, se evaluó la localización de mtHyPer7 y su efecto sobre las mitocondrias de la levadura y la salud celular. Para evaluar la orientación de mtHyPer7, las mitocondrias se tiñeron con el colorante vital específico de las mitocondrias MitoTracker Red en células de levadura de control y levaduras que expresan mtHyPer7. Utilizando la tinción MitoTracker Red, las mitocondrias se resolvieron como estructuras tubulares largas que se alinearon a lo largo del eje madre-yema y se acumularon en la punta de la yema y la punta de la célula madre distal a la yema41. La morfología mitocondrial fue similar en las células control y en las células que expresan mtHyPer7. Además, mtHyPer7 se colocalizó con las mitocondrias teñidas con rojo de MitoTracker (Figura 3A). Por lo tanto, mtHyPer7 se dirigió de manera eficiente y cuantitativa a las mitocondrias sin afectar la morfología o distribución mitocondrial normal.
A continuación, se realizaron experimentos de validación adicionales para evaluar el efecto de mtHyPer7 sobre la aptitud celular y la sensibilidad al estrés oxidativo en las mitocondrias. Las tasas de crecimiento de las células que expresan mtHyPer7 en medios ricos o sintéticos a base de glucosa (YPD o SC, respectivamente) son similares a las de las células de tipo salvaje no transformadas (Figura 3B, D). Para evaluar los posibles efectos sobre el estrés oxidativo en las mitocondrias, la levadura control y la levadura que expresa mtHyPer7 fueron tratadas con bajos niveles de paraquat, una pequeña molécula redox-activa que se acumula en las mitocondrias y da lugar a niveles elevados de superóxido en el orgánulo24,27. Si la expresión de mtHyPer7 induce estrés oxidativo en las mitocondrias o protege a las mitocondrias del estrés oxidativo, entonces las células que expresan mtHyPer7 deberían exhibir una mayor o menor sensibilidad al tratamiento con paraquat, respectivamente. El tratamiento con niveles bajos de paraquat resultó en una disminución en las tasas de crecimiento de la levadura. Además, las tasas de crecimiento de las células de tipo salvaje y de las células que expresan mtHyPer7 en presencia de paraquat fueron similares (Figura 3C,E). Por lo tanto, la expresión del biosensor no creó tensiones celulares significativas en las células de levadura en ciernes ni alteró la sensibilidad de la levadura al estrés oxidativo mitocondrial.
Dada la evidencia de que mtHyPer7 es adecuado para estudiar el H 2 O 2 mitocondrial en levaduras en ciernes, se probó si mtHyPer7 podría detectar H 2 O 2 mitocondrial en levadura de tipo salvaje en fase logarítmica media y cambios en el H 2 O 2 mitocondrial inducidos por H 2 O 2 agregado externamente. Se realizó un experimento de titulación de H2O2y se midió la relación media oxidada:reducida (O/R) mtHyPer7 en mitocondrias.
Los scripts de análisis automatizados produjeron varios archivos de salida.
La imagen de relación (ratio.tif): Una pila Z que consiste en la relación de las pilas de 488 nm y 405 nm con umbral de fondo corregido. Esta pila se puede ver en Fiji sin procesamiento adicional; Sin embargo, se recomienda mejorar el contraste y/o colorear la imagen como se describe en el paso 4.3 o 5.6 del protocolo antes de visualizarla.
La imagen de la máscara (mask.tif): Una pila Z que consiste en las áreas mitocondriales umbralizadas utilizadas para el análisis. Esta imagen debe utilizarse para evaluar la precisión del umbral.
Los ROI utilizados para el análisis (ROIs.zip): Cuando este archivo se abre en Fiji, junto con la imagen de origen, los ROI se superponen a la imagen para hacer referencia cruzada a la tabla de resultados y a la imagen de origen. Cada ROI se renombra con un número de celda y un número de ROI.
Tablas de medición (NumResults.csv, DenomResults.csv, Results.csv) que contienen el área, la media y la densidad integrada de las mitocondrias umbralizadas para cada corte en las imágenes del numerador, el denominador y la proporción, respectivamente. En cortes donde las mitocondrias estaban ausentes o desenfocadas, se registra NaN.
Un archivo de registro (Log.txt) que documenta las opciones utilizadas para la corrección de fondo y ruido, el umbral y el cálculo de la proporción.
La relación O/R de mtHyPer7 mostró una respuesta dependiente de la dosis a la concentración de H2O2, que alcanzó una meseta a 1-2 mM deH2O2adicionado externamente(Figura 7). Sorprendentemente, la relación HyPer7 fue menor en las células expuestas a 0,1 mMH2O2 que en las células control, aunque esta diferencia no fue estadísticamente significativa. Una explicación para este fenómeno puede ser una respuesta de hormesis, en la que la exposición a un bajo nivel de factor estresante puede inducir respuestas de estrés, como mecanismos antioxidantes, que a su vez reducen la cantidad de ROS detectable por la sonda. Los niveles más altos de factores estresantes, por el contrario, pueden abrumar las respuestas internas al estrés y dar lugar a una lectura más alta de HyPer7.
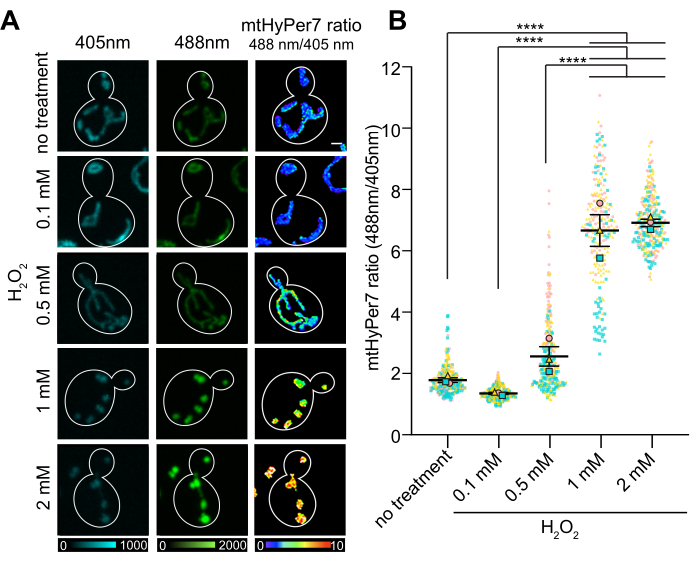
Figura 7: Respuesta de mtHyPer7 a H 2 O2 añadido externamente. (A) Proyección máxima de imágenes excitadas de 405 nm y 488 nm y proyección de intensidad media de imágenes radiométricas de mtHyPer7 en células de fase logarítmica media expuestas a diferentes concentraciones deH2O2. El pseudocolor indica la relación oxidado:reducido mtHyPer7 (escala en la parte inferior). Barra de escala = 1 μm. El contorno de la celda se muestra en blanco; n > 100 células por condición. (B) Cuantificación de la relación mtHyPer7 oxidada:reducida en células de levadura en ciernes tratadas con diferentes concentraciones deH2O2. Se muestran las medias de cinco ensayos independientes, con símbolos de diferentes formas y colores para cada ensayo. Media ± SEM de la relación de mtHyPer oxidado:reducido7: 1,794 ± 0,07627 (sin tratamiento), 1,357 ± 0,03295 (0,1 mM), 2,571 ± 0,3186 (0,5 mM), 6,693 ± 0,5194 (1 mM), 7,017 ± 0,1197 (2 mM). p < 0,0001 (ANOVA de un factor con la prueba de comparaciones múltiples de Tukey). Los valores de p se denotan como: ****p < 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
Finalmente, estudios previos revelaron que las mitocondrias más aptas, que son más reducidas y contienen menos superóxido, son heredadas preferentemente por las células hijas de levadura4, y que las catalasas citosólicas son transportadas y activadas en las células hijas de levadura42,43,44,45. Estos estudios documentan la herencia asimétrica de las mitocondrias durante la división de células de levadura y el papel de este proceso en la aptitud y la esperanza de vida de las células hijas, así como en la asimetría de la edad madre-hija. Para probar si existen diferencias en H2O2entre las yemas y las yemas, se midió mtHyPer7 en yemas y células madre. Se observaron diferencias en el H 2 O 2mitocondrial dentro de las células de levadura, y se detectó una disminución sutil pero estadísticamente significativa en la lectura del biosensor H 2 O 2 en las mitocondrias de la yema en comparación con las de la célula madre (Figura 8). Estos hallazgos son consistentes con hallazgos previos de que las mitocondrias en la yema están mejor protegidas del estrés oxidativo. También proporcionan documentación de que mtHyPer7 puede proporcionar una lectura cuantitativa de H 2 O2mitocondrial con resolución celular y subcelular en levaduras en ciernes.
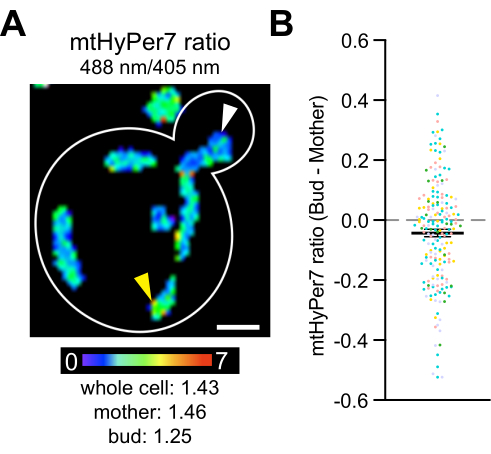
Figura 8: El nivel mitocondrial de H2O2es más bajo en la célula hija. (A) Proyección máxima de una imagen radiométrica de mtHyPer7 en una célula representativa. El pseudocolor indica la relación oxidado:reducido mtHyPer7 (escala en la parte inferior). Las diferencias subcelulares en la proporción son evidentes (puntas de flecha). Barra de escala = 1 μm. Contorno de la celda: blanco. (B) Diferencia entre la relación mtHyPer7 en la yema y la célula madre. Para cada celda individual, el valor de la proporción madre se restó del valor de la proporción de yemas y se graficó como un punto. n = 193 células agrupadas de cinco experimentos independientes, que se muestran con símbolos de diferentes colores para cada experimento. Media ± SEM de la diferencia entre la relación mtHyPer7 en las células madre y yema: -0,04297 ± 0,01266. p = 0.0008 (prueba t pareada) Haga clic aquí para ver una versión más grande de esta figura.
Tabla suplementaria S1: Cepas utilizadas en este estudio. Lista de cepas de levadura utilizadas. Haga clic aquí para descargar este archivo.
Tabla suplementaria S2: Plásmidos utilizados en este estudio. Lista de plásmidos utilizados. Haga clic aquí para descargar este archivo.
Tabla suplementaria S3: Imprimaciones utilizadas en este estudio. Lista de imprimaciones utilizadas. Haga clic aquí para descargar este archivo.
Archivo Suplementario 1: Protocolo para la construcción de plásmidos biosensores. Haga clic aquí para descargar este archivo.
Archivo complementario 2: Scripts para análisis automatizado. Para cada script, se proporcionan archivos de entrada y archivos de salida de ejemplo. Haga clic aquí para descargar este archivo.
Discusión
En este protocolo, se describe un método para usar mtHyPer7 como biosensor para evaluar el H 2 O2mitocondrial en células de levadura vivas en ciernes. El biosensor se construye utilizando un método basado en CRISPR y se introduce en una región libre de genes conservada en el genoma de la levadura sin el uso de marcadores seleccionables. En comparación con los biosensores transmitidos por plásmidos, los integrados se expresan en todas las células y a niveles consistentes, lo que proporciona resultados de cuantificación más fiables. No se utilizan marcadores seleccionables para generar células que expresen mtHyPer7, lo que permite el uso de una gama más amplia de antecedentes de cepas y facilita la modificación genética de las células que expresan biosensores. La proteína mtHyPer7 se dirige correctamente a las mitocondrias sin efectos notables en la morfología, función, distribución o tasas de crecimiento celular mitocondriales. mtHyPer7 muestra una respuesta dependiente de la dosis alH2O22 añadido externamente. Además, mtHyPer7 es capaz de informar sobre la heterogeneidad de la calidad mitocondrial con resolución subcelular. Por último, el uso de un microscopio confocal de disco giratorio en lugar de una microscopía de campo amplio para obtener imágenes de biosensores dirigidos a mitocondrias provoca menos fotoblanqueo en los fluoróforos y genera imágenes de alta resolución para analizar las diferencias subcelulares.
Limitaciones y enfoques alternativos
Este método no es adecuado para obtener imágenes de células durante más de 10 minutos, ya que las células se secarán debajo del cubreobjetos. Para obtener imágenes a largo plazo, es mejor utilizar el método de la almohadilla de agar46 o inmovilizar las células en una placa de cultivo con fondo de vidrio llena de medio SC.
La elección del biosensor debe guiarse por la concentración de la diana en condiciones experimentales. Si la sensibilidad de HyPer7 es demasiado alta, se recomienda una versión diferente de HyPer, como HyPer3 o HyPerRed47,48. Sin embargo, hay que tener en cuenta que otras sondas HyPer son más sensibles al pH. Para una mayor sensibilidad, podría ser más apropiado el roGFP basado en peroxirredoxina (roGFP2Tsa2ΔCR)27.
El estado estacionario de oxidación del sensorH 2 O2 está vinculado tanto a las tasas de oxidación como a las de reducción. La tasa de oxidación de los biosensores es causada principalmente porH2O2, pero la tasa de reducción depende de los sistemas de reducción antioxidante activos en la célula y el orgánulo. Se ha demostrado que HyPer7 es predominantemente reducido por el sistema de tiorredoxina en el citosol de levadura, y su reducción es más rápida que la de roGFP2Tsa2ΔCR27. Por lo tanto, los diferentes mecanismos de reducción y dinámica de respuesta de la sonda deben tenerse en cuenta al interpretar las mediciones de los biosensores deH2O2. En particular, para inferir los nivelesde H 2 O2 a partir de la lectura del biosensor, se debe suponer que el sistema de reducción mantiene una capacidad constante durante el experimento. Como alternativa a los scripts aquí descritos, se ha puesto a disposición una variedad de otros programas informáticos para el análisis de sensores redox49.
Pasos críticos
Con cualquier biosensor, es fundamental demostrar que el biosensor en sí mismo no afecta el proceso que se está midiendo. Por lo tanto, es importante comparar el crecimiento y la morfología mitocondrial de las cepas en cada condición experimental. Aquí, la morfología mitocondrial se evalúa utilizando MitoTracker Red, que tiñe las mitocondrias de una manera dependiente del potencial de membrana. Sin embargo, la comparación de las mitocondrias en células no transformadas y transformadas por biosensores se puede lograr mediante la tinción con éster metílico de tetrametilrodamina (TMRM), un colorante vital mitocondrial alternativo que detecta el potencial de membrana, o MitoTracker Green, que tiñe las mitocondrias independientemente del potencial de membrana. Si se sospecha de efectos nocivos, puede ser útil reducir el nivel de expresión o cambiar el sitio de integración.
La validación del comportamiento dosis-respuesta de la sonda y la relación señal-ruido de la técnica de imagen también son esenciales para obtener resultados sólidos. Si la variabilidad dentro de un grupo excede la variabilidad entre grupos, las diferencias se vuelven difíciles de detectar. La variabilidad intragrupo puede ser el resultado de una variación poblacional real o de ruido en el proceso de detección. Los pasos clave para aumentar la relación señal:ruido son la adquisición de imágenes (rango de valores de píxeles y ruido), la sustracción de fondo y el umbral.
Los efectos de ruido también se pueden reducir durante los pasos de cálculo. El enfoque más sencillo es calcular la intensidad media ponderada a partir de las mediciones de la imagen de relación (Resultados.csv), donde cada píxel representa la relación local entre las eficiencias de excitación. Esto produce una relación "píxel". Sin embargo, si la relación señal:ruido de la imagen es baja, se pueden obtener resultados más robustos calculando la intensidad media ponderada para un ROI tanto en el numerador como en los canales del denominador, y luego calculando la relación entre estas dos medias ponderadas (relación "por región").
Para seleccionar un método de umbral, el comando Fiji Imagen | Ajustar | El umbral automático se puede utilizar para probar automáticamente todos los métodos de Fiji incorporados. Para evaluar la segmentación (umbral), una máscara guardada se convierte en una selección haciendo clic en Editar | Selección | Crear selección, agregada al Administrador de ROI (presionando T) y luego activada en el archivo de imagen sin procesar. Si las mitocondrias no se detectan adecuadamente, se debe intentar un método de segmentación diferente.
Al comparar imágenes, es esencial adquirir todas las imágenes con condiciones de imagen idénticas, así como mostrar todas las imágenes con una mejora de contraste idéntica.
El movimiento mitocondrial debe tenerse en cuenta a la hora de optimizar las condiciones de obtención de imágenes. Si las mitocondrias se mueven significativamente entre la excitación a 405 y 488 nm, la imagen de relación no será precisa. Se recomienda mantener el tiempo de exposición <500 ms y cambiar la excitación por el método más rápido disponible (por ejemplo, un pulso de disparo o un filtro sintonizable acústico-óptico). Al capturar una pila Z, ambas excitaciones deben realizarse para cada paso Z antes de pasar al siguiente paso Z.
Para la visualización de los resultados, los cambios en el tono (color) son más obvios para el ojo humano que los cambios en la intensidad. Por lo tanto, el valor de la relación se convierte en una escala de colores para facilitar la interpretación visual. Las imágenes coloreadas pueden ser no moduladas, en las que todos los píxeles mitocondriales aparecen con el mismo brillo, o moduladas por intensidad, en las que la intensidad de píxeles de la imagen original se utiliza para establecer intensidades en la imagen coloreada.
Modificación y solución de problemas
Como alternativa a la confirmación de la función mitocondrial mediante provocación con paraquat, las células pueden ser replicadas o inoculadas en fuentes de carbono fermentables y no fermentables.
Para la sustracción de fondo, la resta de bolas rodantes (navegando a Proceso | Restar fondo...) También se puede utilizar para eliminar la falta de uniformidad de la iluminación. Debe asegurarse de que la presencia de celdas no altere el fondo que se está restando (marcando la opción Crear fondo y examinando el resultado).
En resumen, la sonda mtHyPer7 proporciona un método consistente y mínimamente invasivo para relacionar el estado morfológico y funcional de las mitocondrias de levadura en células vivas, y permite el estudio de un importante factor de estrés celular y molécula de señalización en un sistema modelo genéticamente tratable y de fácil acceso.
Divulgaciones
Los autores declaran que no tienen conflictos de intereses.
Agradecimientos
Los autores agradecen a Katherine Filpo López por su asistencia técnica experta. Este trabajo fue apoyado por subvenciones de los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) (GM122589 y AG051047) a LP.
En estos estudios se utilizó el recurso compartido de microscopía confocal y especializada del Centro Oncológico Integral Herbert Irving de la Universidad de Columbia, financiado en parte a través de la Subvención de Apoyo al Centro Oncológico de los NIH/NCI P30CA013696.
Materiales
| Name | Company | Catalog Number | Comments |
| 100x/1.45 Plan Apo Lambda objective lens | Nikon | MRD01905 | |
| Adenine sulfate | Sigma-Aldrich | #A9126 | |
| Bacto Agar | BD Difco | #DF0145170 | |
| Bacto Peptone | BD Difco | #DF0118170 | |
| Bacto Tryptone | BD Difco | #DF211705 | |
| Bacto Yeast Extract | BD Difco | #DF0127179 | |
| BamHI | New England Biolabs | R0136S | |
| BglII | New England Biolabs | R0144S | |
| Carbenicilin | Sigma-Aldrich | C1389 | |
| Carl Zeiss Immersol Immersion Oil | Carl Zeiss | 444960 | |
| Dextrose (D-(+)-Glucose) | Sigma-Aldrich | #G8270 | |
| E. cloni 10G chemical competent cell | Bioserch Technologies | 60108 | |
| FIJI | NIH | Schindelin et al 2012 | |
| G418 (Geneticin) | Sigma-Aldrich | A1720 | |
| GFP emission filter | Chroma | 525/50 | |
| Gibson assembly | New England Biolabs | E2611 | |
| Graphpad Prism 7 | GraphPad | https://www.graphpad.com/scientific-software/prism/ | |
| H2O2 (stable) | Sigma-Aldrich | H1009 | |
| HO-pGPD-mito-roGFP-KanMX6-HO | Pon Lab | JYE057/EP41 | Liao et al 20201 |
| Incubator Shaker | New Brunswick Scientific | E24 | |
| KAPA HiFi PCR kit | Roche Sequencing and Life Science, Kapa Biosystems, Wilmington, MA | KK1006 | |
| L-arginine hydrochloride | Sigma-Aldrich | #A8094 | |
| laser | Agilent | 405 and 488 nm | |
| L-histidine hydrochloride | Sigma-Aldrich | #H5659 | |
| L-leucine | Sigma-Aldrich | #L8912 | |
| L-lysine hydrochloride | Sigma-Aldrich | #L8662 | |
| L-methionine | Sigma-Aldrich | #M9625 | |
| L-phenylalanine | Sigma-Aldrich | #P5482 | |
| L-tryptophan | Sigma-Aldrich | #T8941 | |
| L-tyrosine | Sigma-Aldrich | #T8566 | |
| mHyPer7 plasmid | This study | JYE116 | |
| Microscope coverslips | ThermoScientific | 3406 | #1.5 (170 µm thickness) |
| Microscope slides | ThermoScientific | 3050 | |
| MitoTracker Red CM-H2Xros | ThermoFisherScientific | M7513 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NEBuilder HiFi Assembly Master Mix | New England Biolabs | E2621 | |
| Nikon Elements | Nikon | Microscope acquisition software | |
| Nikon Ti Eclipse inverted microscope | Nikon | ||
| Paraquat (Methyl viologen dichloride hydrate) | Sigma-Aldrich | Cat. #856177 | |
| RStudio | Posit.co | Free desktop version | |
| Spectrophotometer | Beckman | BU530 | |
| Stagetop incubator | Tokai Hit | INU | |
| Uracil | Sigma-Aldrich | #U1128 | |
| Yeast nitrogen base (YNB) containing ammonium sulfate without amino acids | BD Difco | #DF0919073 | |
| YN2_1_LT58_X2site | Addgene | 177705 | Pianale et al 2021 |
| Zyla 4.2 sCMOS camera | Andor |
Referencias
- vander Bliek, A. M., Sedensky, M. M., Morgan, P. G. Cell biology of the mitochondrion. Genetics. 207 (3), 843-871 (2017).
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: more than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Shi, R., Hou, W., Wang, Z. -. Q., Xu, X. Biogenesis of iron-sulfur clusters and their role in DNA metabolism. Frontiers in Cell and Developmental Biology. 9, 735678 (2021).
- McFaline-Figueroa, J. R., et al. Mitochondrial quality control during inheritance is associated with lifespan and mother-daughter age asymmetry in budding yeast. Aging Cell. 10 (5), 885-895 (2011).
- Higuchi-Sanabria, R., et al. Mitochondrial anchorage and fusion contribute to mitochondrial inheritance and quality control in the budding yeast Saccharomyces cerevisiae. Molecular Biology of the Cell. 27 (5), 776-787 (2016).
- Higuchi-Sanabria, R., et al. Role of asymmetric cell division in lifespan control in Saccharomyces cerevisiae. FEMS Yeast Research. 14 (8), 1133-1146 (2014).
- Lam, Y. T., Aung-Htut, M. T., Lim, Y. L., Yang, H., Dawes, I. W. Changes in reactive oxygen species begin early during replicative aging of Saccharomyces cerevisiae cells. Free Radical Biology & Medicine. 50 (8), 963-970 (2011).
- Laun, P., et al. Aged mother cells of Saccharomyces cerevisiae show markers of oxidative stress and apoptosis. Molecular Microbiology. 39 (5), 1166-1173 (2001).
- Doudican, N. A., Song, B., Shadel, G. S., Doetsch, P. W. Oxidative DNA damage causes mitochondrial genomic instability in Saccharomyces cerevisiae. Molecular and Cellular Biology. 25 (12), 5196-5204 (2005).
- Roca-Portoles, A., Tait, S. W. G. Mitochondrial quality control: from molecule to organelle. Cellular and Molecular Life Sciences. 78 (8), 3853-3866 (2021).
- Sies, H., Berndt, C., Jones, D. P. Oxidative stress. Annual Review of Biochemistry. 86, 715-748 (2017).
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Imlay, J. A., Fridovich, I. Assay of metabolic superoxide production in Escherichia coli. The Journal of Biological Chemistry. 266 (11), 6957-6965 (1991).
- Fridovich, I. Mitochondria: are they the seat of senescence. Aging Cell. 3 (1), 13-16 (2004).
- Quinlan, C. L., Perevoshchikova, I. V., Hey-Mogensen, M., Orr, A. L., Brand, M. D. Sites of reactive oxygen species generation by mitochondria oxidizing different substrates. Redox Biology. 1 (1), 304-312 (2013).
- Griendling, K. K., Minieri, C. A., Ollerenshaw, J. D., Alexander, R. W. Angiotensin II stimulates NADH and NADPH oxidase activity in cultured vascular smooth muscle cells. Circulation Research. 74 (6), 1141-1148 (1994).
- Griendling, K. K., Sorescu, D., Ushio-Fukai, M. NAD(P)H oxidase: role in cardiovascular biology and disease. Circulation Research. 86 (5), 494-501 (2000).
- Edmondson, D. E., Binda, C., Wang, J., Upadhyay, A. K., Mattevi, A. Molecular and mechanistic properties of the membrane-bound mitochondrial monoamine oxidases. Biochemistry. 48 (20), 4220-4230 (2009).
- Ramsay, R. R., Singer, T. P. The kinetic mechanisms of monoamine oxidases A and B. Biochemical Society Transactions. 19 (1), 219-223 (1991).
- Ramsay, R. R. Kinetic mechanism of monoamine oxidase A. Biochemistry. 30 (18), 4624-4629 (1991).
- Handy, D. E., Loscalzo, J. Redox regulation of mitochondrial function. Antioxidants & Redox Signaling. 16 (11), 1323-1367 (2012).
- Wood, Z. A., Schröder, E., Robin Harris, J., Poole, L. B. Structure, mechanism and regulation of peroxiredoxins. Trends in Biochemical Sciences. 28 (1), 32-40 (2003).
- Slade, L., et al. Examination of the superoxide/hydrogen peroxide forming and quenching potential of mouse liver mitochondria. Biochimica et Biophysica Acta. General Subjects. 1861 (8), 1960-1969 (2017).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Topell, S., Hennecke, J., Glockshuber, R. Circularly permuted variants of the green fluorescent protein. FEBS Letters. 457 (2), 283-289 (1999).
- Belousov, V. V., et al. Genetically encoded fluorescent indicator for intracellular hydrogen peroxide. Nature Methods. 3 (4), 281-286 (2006).
- Kritsiligkou, P., Shen, T. K., Dick, T. P. A comparison of Prx- and OxyR-based H2O2 probes expressed in S. cerevisiae. The Journal of Biological Chemistry. 297 (1), 100866 (2021).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Circular permutation and receptor insertion within green fluorescent proteins. Proceedings of the National Academy of Sciences. 96 (20), 11241-11246 (1999).
- Abedi, M. R., Caponigro, G., Kamb, A. Green fluorescent protein as a scaffold for intracellular presentation of peptides. Nucleic Acids Research. 26 (2), 623-630 (1998).
- Onukwufor, J. O., et al. A reversible mitochondrial complex I thiol switch mediates hypoxic avoidance behavior in C. elegans. Nature Communications. 13 (1), 2403 (2022).
- Vega, M., et al. Antagonistic effects of mitochondrial matrix and intermembrane space proteases on yeast aging. BMC Biology. 20 (1), 160 (2022).
- Torello Pianale, L., Rugbjerg, P., Olsson, L. Real-time monitoring of the yeast intracellular state during bioprocesses with a toolbox of biosensors. Frontiers in Microbiology. 12, 802169 (2022).
- Imani, M., Mohajeri, N., Rastegar, M., Zarghami, N. Recent advances in FRET-based biosensors for biomedical applications. Analytical Biochemistry. 630, 114323 (2021).
- Zadran, S., et al. Fluorescence resonance energy transfer (FRET)-based biosensors: visualizing cellular dynamics and bioenergetics. Applied Microbiology and Biotechnology. 96 (4), 895-902 (2012).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Liao, P. -. C., Wolken, D. M. A., Serrano, E., Srivastava, P., Pon, L. A. Mitochondria-associated degradation pathway (MAD) function beyond the outer membrane. Cell Reports. 32 (2), 107902 (2020).
- Higuchi-Sanabria, R., Swayne, T. C., Boldogh, I. R., Pon, L. A. Live-cell imaging of mitochondria and the actin cytoskeleton in budding yeast. Methods in Molecular Biology. 1365, 25-62 (2016).
- Liao, P. -. C., Yang, E. J., Pon, L. A. Live-cell imaging of mitochondrial redox state in yeast cells. STAR Protocols. 1 (3), 100160 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
- Chazotte, B. Labeling mitochondria with MitoTracker dyes. Cold Spring Harbor Protocols. 2011 (8), 990-992 (2011).
- Aguilaniu, H., Gustafsson, L., Rigoulet, M., Nyström, T. Asymmetric inheritance of oxidatively damaged proteins during cytokinesis. Science. 299 (5613), 1751-1753 (2003).
- Erjavec, N., Larsson, L., Grantham, J., Nyström, T. Accelerated aging and failure to segregate damaged proteins in Sir2 mutants can be suppressed by overproducing the protein aggregation-remodeling factor Hsp104p. Genes & Development. 21 (19), 2410-2421 (2007).
- Erjavec, N., Cvijovic, M., Klipp, E., Nyström, T. Selective benefits of damage partitioning in unicellular systems and its effects on aging. Proceedings of the National Academy of Sciences. 105 (48), 18764-18769 (2008).
- Erjavec, N., Nyström, T. Sir2p-dependent protein segregation gives rise to a superior reactive oxygen species management in the progeny of Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 104 (26), 10877-10881 (2007).
- Davidson, R., Liu, Y., Gerien, K. S., Wu, J. Q. Real-time visualization and quantification of contractile ring proteins in single living cells. Methods in Molecular Biology. 1369, 9-23 (2016).
- Bilan, D. S., et al. HyPer-3: a genetically encoded H2O2 probe with improved performance for ratiometric and fluorescence lifetime imaging. ACS Chemical Biology. 8 (3), 535-542 (2013).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5 (1), 5222 (2014).
- Fricker, M. D. Quantitative redox imaging software. Antioxidants & Redox Signaling. 24 (13), 752-762 (2016).
- Yang, E. J., Pernice, W. M., Pon, L. A. A role for cell polarity in lifespan and mitochondrial quality control in the budding yeast Saccharomyces cerevisiae. iSCIENCE. 25 (3), 103957 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados