Examen histológico de la morfología mitocondrial en un modelo de enfermedad de Parkinson
* Estos autores han contribuido por igual
En este artículo
Resumen
Este estudio presenta un método para analizar la morfología de las mitocondrias basado en inmunotinción y análisis de imágenes en tejido cerebral de ratón in situ. También describe cómo esto permite detectar cambios en la morfología mitocondrial inducidos por la agregación de proteínas en modelos de enfermedad de Parkinson.
Resumen
Las mitocondrias juegan un papel central en el metabolismo energético de las células, y su función es especialmente importante para las neuronas debido a su alta demanda de energía. Por lo tanto, la disfunción mitocondrial es un sello patológico de varios trastornos neurológicos, incluida la enfermedad de Parkinson. La forma y organización de la red mitocondrial es altamente plástica, lo que permite que la célula responda a las señales y necesidades ambientales, y la estructura de las mitocondrias también está estrechamente relacionada con su salud. En este trabajo se presenta un protocolo para estudiar la morfología mitocondrial in situ basado en la inmunotinción de la proteína mitocondrial VDAC1 y su posterior análisis de imagen. Esta herramienta podría ser particularmente útil para el estudio de trastornos neurodegenerativos porque puede detectar diferencias sutiles en los recuentos mitocondriales y la forma inducida por agregados de α-sinucleína, una proteína propensa a la agregación fuertemente involucrada en la patología de la enfermedad de Parkinson. Este método permite informar que las neuronas dopaminérgicas de la sustancia negra pars compacta que albergan lesiones pS129 muestran fragmentación mitocondrial (como sugiere su relación de aspecto reducida, AR) en comparación con sus neuronas vecinas sanas en un modelo de Parkinson de inyección intracraneal de fibrillas preformado.
Introducción
El sistema nervioso central tiene una intensa demanda de ATP: las neuronas utilizan ATP para apoyar los gradientes iónicos, la síntesis de neurotransmisores, la movilización, liberación y reciclaje de vesículas sinápticas, y para permitir la traducción y degradación local de proteínas. Más del 95% del ATP utilizado por el cerebro es producido por las mitocondrias1. Por lo tanto, no es sorprendente que la disfunción mitocondrial sea particularmente dañina para las neuronas. De hecho, las alteraciones de la función mitocondrial juegan un papel importante en varias enfermedades neurológicas, incluidas las enfermedades neurodegenerativas, como la enfermedad de Parkinson (EP) y la enfermedad de Alzheimer (EA)2,3.
Múltiples genes están inequívocamente vinculados a proteínas que codifican para PD que son relevantes para la función mitocondrial y la homeostasis, como Parkin 4,5,6, quinasa 1 inducida por PTEN (PINK1)7,8 y DJ-19. Otra evidencia de un papel de la disfunción mitocondrial en la EP es que los tratamientos con inhibidores del Complejo I de la cadena de transporte de electrones mitocondriales (como Rotenona y MPTP) recapitulan varios aspectos de la EP in vitro e in vivo10. Sin embargo, es importante señalar que muchos procesos patológicos pueden conducir a la pérdida neuronal en la EP, junto con los déficits mitocondriales: el estrés oxidativo, la homeostasis del calcio alterada, el fallo de los sistemas ubiquitina-proteasoma y de autofagia-lisosomal, y la agregación proteica se encuentran entre los más estudiados (revisados en 11,12,13 y).
Las mitocondrias tienen una forma heterogénea: además de las unidades individuales, se encuentran comúnmente como redes reticulares y tubulares extendidas. La estructura y la ubicación celular de las mitocondrias son fundamentales para su función14; De hecho, las redes mitocondriales son extremadamente dinámicas, pasando por frecuentes procesos de fisión, fusión y mitofagia para satisfacer las necesidades de las células y responder a las señales ambientales15,16. Además, la morfología de las mitocondrias está íntimamente ligada a su estado de salud. Por ejemplo, en la atrofia óptica humana, las mutaciones genéticas que reducen la actividad mitocondrial conducen a mitocondrias anormales, delgadas e hiperfusionadas17. Por otro lado, una variedad de enfermedades humanas presentan una morfología mitocondrial aberrante, incluyendo la fragmentación mitocondrial o la fusión mitocondrial excesiva, que tienen efectos nocivos sobre la función mitocondrial (revisado en18). En el contexto de la EP, nosotros y otros hemos demostrado previamente que la forma mitocondrial anormal se correlaciona con la disfunción en respuesta a los agregados de α-sinucleína19. Si bien la morfología mitocondrial ha sido ampliamente estudiada in vitro tanto en el contexto de la EP como en otras enfermedades 20,21,22, faltan protocolos para la evaluación de la morfología mitocondrial a partir de cortes in vivo. Esto hace que el estudio in vivo de las mitocondrias en el contexto de enfermedades como la EP dependa en gran medida de animales transgénicos23 o la evaluación de extractos del mesencéfalo que no pueden proporcionar resolución celular.
En este trabajo se presenta un protocolo para estudiar la morfología mitocondrial in situ como indicador de su estado funcional y salud, basado en la inmunotinción de la proteína mitocondrial VDAC124 seguida de un análisis de imagen en cortes de tejido embebido en parafina. También mostramos los resultados de este protocolo en modelos de EP in vitro e in vivo : células de neuroblastoma que sobreexpresan SNCA (Sinucleína Alfa) y tejido cerebral de ratones sometidos a inyección intracraneal de fibrillas preformadas de α-sinucleína (PFF). La coinmunotinción con un anticuerpo contra α-sinucleína (en células) o fosfoSer129- α-sinucleína pS129 (en cerebros de ratón) nos permitió identificar células con patología de proteínas agregadas (fibrillas sobreexpresadas de α-sinucleína y α-sinucleína, respectivamente) en las muestras, mientras que las células negativas sirvieron como control no patológico dentro de las mismas muestras. A través de este análisis y de los datos aquí descritos, se observó una relación de aspecto reducida, lo que indica la fragmentación de las mitocondrias en células que sobreexpresan SNCA o presentan lesiones de pS129.
Protocolo
Todos los procedimientos descritos en este apartado se han realizado de acuerdo con el marco ético proporcionado por la Universidad del País Vasco Referencia M20/2022/212, el Gobierno del País Vasco, el Gobierno de España y la Unión Europea.
1. Análisis de la morfología mitocondrial en células SH-SY5Y que sobreexpresan SNCA
NOTA: A continuación, se proporciona una breve descripción de la generación del material in vitro para el estudio, que servirá de comparación para los resultados obtenidos in situ . Se recomienda que este tipo de análisis se realice antes de iniciar un experimento in vivo para la morfología mitocondrial, ya que garantizará que se implementen todas las configuraciones de imagen y análisis adecuadas.
- Para aumentar la adhesión celular y facilitar la adhesión celular en placas de 96 pocillos de fondo óptico plano, agregue 25 μL/pocillo de matriz de recubrimiento 1:1000 en DMEM F12 mediante pipeteo (consulte la Tabla de materiales). Incubar las placas durante 1 h a 37 °C y 5% de CO2.
- Cuente SH-SY5Y usando la cámara de Neubauer. Retire la matriz de recubrimiento pipeteando y siembre 10.000 células/pocillo en la placa recubierta de 96 pocillos en 50 μL/pocillo de DMEM F-12 suplementado con 10% de FBS, 2 mM de glutamina y penicilina/estreptomicina (ver Tabla de materiales).
- Incubar las células a 37 °C y 5% de CO2durante 24 h.
- Prepare una mezcla de 250 ng de pcDNA3.1 portador de SNCA de tipo salvaje humano, 0,250 μL del reactivo de transfección, 0,250 L de adyuvante de transfección y medio de transfección de hasta 50 μL para cada pocillo (ver Tabla de Materiales). Prepare una solución maestra teniendo en cuenta el número total de pocillos en el experimento.
- Retirar el medio de cultivo mediante pipeteo manual y añadir 50 μL/pocillo de la solución preparada en el paso 1.4 mediante pipeteo. Incubar a 37 °C, 5% CO2.
- h después de la transfección, extraer el medio de transfección mediante pipeteo y añadir 25 μL/pocillo de paraformaldehído (PFA) al 4% en PBS.
PRECAUCIÓN: El paraformaldehído es un fijador tóxico; utilizar el equipo de protección personal adecuado. - Incubar durante 5 min a temperatura ambiente (R.T). Retire la solución de fijación pipeteando y lave una vez añadiendo 50 μL/pocillo de PBS. Elimine el PBS pipeteando.
- Pipetear 25 μL/pocillo de TBS con 0,05% de Tween (TBS-T) y 10% de suero de burro normal (NDS, ver Tabla de Materiales). Incubar durante 1 h en R.T. para bloquear cualquier señal inespecífica.
- Preparar una solución de anticuerpo anti-α-sinucleína MJFR1 1:1000 junto con anticuerpo anti-TOMM20 1:100 en TBS-T (ver Tabla de Materiales) según el número de pocillos a analizar.
- Retirar la solución de bloqueo del paso 1.8 pipeteando y añadir 25 μL/pocillo de la mezcla de anticuerpos primarios preparada en el paso 1.9. Incubar durante la noche a 4 °C.
- Retire la solución de anticuerpos primarios y lave tres veces añadiendo y quitando 50 μL/pocillo de TBS-T mediante pipeteo.
- Preparar una solución de anticuerpo secundario verde anti-Ratón 1:1000 junto con anticuerpo secundario rojo anti-Conejo 1:1000 en TBS-T (ver Tabla de Materiales) según el número de pocillos a analizar.
- Después de aspirar el PBS del último lavado descrito en el paso 1.11, añadir 25 μL/pocillo de la mezcla de anticuerpos secundarios con una pipeta e incubar la placa durante 1 h a R.T.
- Extraer la solución de anticuerpos secundarios mediante pipeteo y añadir 25 μL/pocillo de 2 g/ml de DAPI en TBS-T. Incubar la placa durante 5 min en R.T.
- Retire la solución de DAPI con una pipeta y lave tres veces añadiendo y quitando 50 μL/pocillo de TBS-T con una pipeta.
- Pipetear 80 μL/pocillo de PBS con azida sódica al 0,02% y almacenar la placa a 4 °C.
PRECAUCIÓN: La azida sódica es tóxica; utilizar el equipo de protección personal adecuado. - Capture imágenes utilizando un microscopio de fluorescencia automatizado de alto contenido o un sistema de imágenes confocal equivalente equipado con un objetivo de 60x (consulte la Tabla de materiales).
- Realice el análisis de la señal TOMM20 de células individuales utilizando Fiji siguiendo los pasos 3.15-3.21. Evite cualquier célula que sufra apoptosis, necrosis o mitosis.
NOTA: Para ello, excluimos del análisis las células que muestran aquellas características morfológicas de apoptosis, necrosis o mitosis que son visibles bajo el microscopio, como la contracción celular, la formación de ampollas en la membrana, el desprendimiento celular, la condensación nuclear, la fragmentación del ADN y la cromatina nuclear condensada organizada en hebras gruesas alineadas en un solo plano.
2. La generación de PFFs e inyecciones intracraneales de PFF en ratones
NOTA: Aquí se presenta la generación de material de inyección y el proceso de inyección intracraneal. Este protocolo es una adaptación de Luk et al.25.
- Para obtener PFF, coloque un tubo/matraz que contenga 0,5 ml de α-Syn (5 mg/ml; Péptido, ver Tabla de Materiales) en un agitador a 37 °C y 250 r.p.m. durante 7 días para inducir la agregación de α-sinucleína.
- Sonicar la α-sinucleína agregada al 20% de amplitud y 0,25 ciclos de trabajo hasta lograr una fragmentación óptima y observada mediante tinción negativa de las muestras con microscopía electrónica de transmisión.
- Para preparar ratones machos y hembras de tipo salvaje C57Bl/6 (3 meses de edad) para inyecciones de PFF estriatal, administre Meloxicam/Metacam (5 mg/kg) en solución salina por vía subcutánea. Administrar también 1 ml de solución salina estéril mediante dos inyecciones subcutáneas de 0,5 ml por animal. Estos tratamientos previenen la deshidratación, la inflamación y el dolor.
- Inducir la anestesia con isoflurano al 4% y 0,7 L/minO2 en cámara de inducción. Compruebe la profundidad de la anestesia por la falta de respuesta del pedal.
- Afeitar la parte superior de la cabeza del ratón e insertar suavemente al animal en el marco del aparato estereotáxico sobre una estera térmica.
- Mantener el plano anestésico administrando anestesia por inhalación animal (1%-2% de isoflurano en 0,7 L/minØ2) a través de una mascarilla durante todo el proceso de inyección.
- Coloque al animal en el marco estereotáctico. Desinfecte el área de operación con tres rondas alternas de exfoliante de clorhexidina y etanol al 70%. Aplicar Marcaína/Bupivacaína localmente (alrededor de 100 μL) como una infiltración subcutánea del 0,25%.
- Realice una incisión de 0,5 cm de la piel para exponer el cráneo y taladre un orificio de 1 mm de diámetro en el cráneo para exponer la superficie del cerebro, en las siguientes coordenadas de Bregma: - 0,5 mm anteroposterior, +/− 2,5 mm mediolateral.
- Inyectar 1,5 L de PFF obtenidos en el paso 2.2 mediante administración estereotáctica a las coordenadas indicadas en el paso 2.8 desde Bregma y -2,7 mm dorsoventral (desde la parte superior del cerebro) a un caudal de 100 nl/min con una jeringa Hamilton de 32 G. Retire la jeringa 5 minutos después de la inyección.
- Suturar (tamaño: 4-0, 45 cm, ver Tabla de Materiales) la herida con tres a cinco puntos según sea necesario, y unir cada uno de ellos con 2 nudos dobles y luego un nudo simple. Detenga la inhalación de anestésico y retire el ratón del marco.
- Deje que el ratón se recupere en una jaula de recuperación adecuada antes de devolverlo a su jaula de origen.
- Durante la semana siguiente, realizar controles postoperatorios diarios. El dolor, la angustia o la incomodidad de cualquier animal deben dosificarse con Meloxicam/Metacam como se indica en el paso 2.3 cada 24 h.
- Tres meses después, inyectar 300 μl de 200 mg/ml de pentobarbital sódico en solución salina mediante inyección intraperitoneal. Una vez perdido el reflejo del dolor, haga una incisión (2-3 cm) en el pecho y levante las costillas para exponer el corazón.
- Perfundir por vía transcardíaca con 10 mL de PBS y 35 mL de paraformaldehído al 4% en PBS uno tras otro a 5 mL/min utilizando una jeringa de 50 mL conectada a una aguja de mariposa de 23 G.
- Retirar el cerebro y ponerlo en PFA al 4% durante 24 h adicionales a 4 °C. Almacenarlo en etanol al 70% a 4 °C después del tratamiento con PFA.
- Coloque el cerebro en cajas de plástico apropiadas (ver Tabla de Materiales) e incube en etanol al 95% durante 1 h en R.T. Repita el paso en etanol fresco al 95% e incube nuevamente durante 1 h.
- Transfiera los cerebros a etanol al 100% durante 1 h en R.T. Repita el paso en etanol fresco al 100% e incube nuevamente durante 1 h.
- Transfiera los cerebros a xileno o sustituto de xileno durante 1 h en R.T. Repita en solución fresca e incube nuevamente durante 1 h.
- Retirar el xileno o sustituto del xileno e incubar la muestra en parafina tibia durante 1 h. Reemplace la parafina e incube por una hora más.
- Monta el cerebro en las cajas de inclusión con parafina tibia y déjalo secar durante la noche. Prepare secciones de 5 μm con un micrótomo (consulte la tabla de materiales) y móntelas en portaobjetos de vidrio.
3. Análisis de la morfología mitocondrial mediante inmunohistoquímica en cortes de cerebro embebidos en parafina de ratones inyectados con PFF
- Desparafina los portaobjetos sumergiéndolos en sustituto de xileno diez veces. Incubar los portaobjetos durante 2 min en sustituto de xileno. Vuelva a sumergir diez veces en sustituto de xileno.
NOTA: Este paso es necesario para retirar la parafina y permitir la rehidratación de las muestras. - Rehidratación: repita el procedimiento descrito en el paso 3.1 con las siguientes soluciones: 100% EtOH, 95% EtOH, 70% EtOH y dos veces con ddH2O en orden.
- Realice la recuperación de antígenos y la inmunotinción siguiendo los pasos que se indican a continuación.
- Comience transfiriendo las muestras a un recipiente apto para microondas con ddH2O.
- Calentar 100x tampón de citrato pH 6 (ver Tabla de Materiales) almacenado a 4 °C (los detergentes pueden haber precipitado) y preparar 350 mL de tampón de citrato 1x fresco. A continuación, vierta el tampón de citrato en un práctico recipiente de plástico con tapa.
- Coloque los portaobjetos en el recipiente del tampón de citrato (CRÍTICO: compruebe que los portaobjetos estén por debajo del nivel del tampón) y coloque la tapa.
PRECAUCIÓN: Asegúrese de que la tapa NO esté completamente cerrada, de lo contrario, el recipiente puede reventar en el microondas. - Microondas a 700 W: 4 min + 5 min de descanso, 1,5 min + 5 min de descanso. Rellene el tampón de citrato y vuelva a calentar en el microondas 1,5 min + 5 min de descanso, 1,5 min + 5 min de descanso, 1,5 min + 5 min de descanso.
- Enfriar las muestras en tampón de citrato sobre hielo durante 20 min. Lavar la muestra con ddH2O.
NOTA: La recuperación del antígeno puede variar según los requisitos específicos de anticuerpos.
- Seque los portaobjetos de muestra con una toalla de papel sin tocar el pañuelo. Dibuja rectángulos con un bolígrafo (consulta la Tabla de materiales) alrededor de los pedazos de pañuelo.
- Transfiera todos los portaobjetos a una caja de inmunotinción de portaobjetos y lávelos un par de veces suavemente con TBS + 0,05 % TWEEN (TBS-T). Verifique que las gotas de TBS-T permanezcan dentro de los rectángulos del bolígrafo pap.
- Retire el TBS-T de las muestras dando golpecitos sobre una toalla de papel. Añadir 50 μL de una solución de bloqueo (10% NDS en TBS-T) en cada rectángulo (sin tocar el tejido) e incubar durante 1 h a RT.
NOTA: Los volúmenes pueden variar según el tamaño del tejido; Trate de asegurarse de que: (1) el área de Papanicolaou sea similar en todas las muestras, y (2) el área esté completamente cubierta por el volumen de tampón elegido. - Retire la solución de bloqueo de las muestras golpeando una toalla de papel. Pipetear suavemente 50 μL/rectángulo de la siguiente mezcla de anticuerpos primarios en TBS-T: anti-tirosina hidroxilasa 1:250 junto con anti-VDAC1 1:100 y anti-pSer129 α-sinucleína EP1536Y 1:2000 (ver Tabla de materiales).
- Incubar durante la noche a 4 °C.
- Lavar pipeteando TBS-T en los portaobjetos y retirarlo golpeando una toalla de papel. Repita tres veces.
- Añadir pipeteando 50 μL/rectángulo de la mezcla de anticuerpos secundarios: anti-Pollo secundario verde, anti-Ratón secundario rojo y anti-Conejo secundario rojo lejano 1:1000 en TBS-T (ver Tabla de Materiales). Incubar a 37 °C durante 1 h en la oscuridad.
- Lavar tres veces con TBS-T como se describe en el paso 3.13.
- Incubar con DAPI 2 μg/mL en TBS-T durante 1 min. Retire la solución DAPI golpeando una toalla de papel. Lavar tres veces con TBS-T como se describe en el paso 3.13.
- Monte un cubreobjetos de vidrio en las muestras utilizando 2 gotas/portaobjetos de reactivo de montaje (consulte la Tabla de materiales). Presione suavemente el cubreobjetos para eliminar las burbujas y deje secar las muestras durante 1 h a R.T. Después, almacene a 4 °C en la oscuridad.
- Obtenga imágenes de al menos 50 células en diferentes campos utilizando un sistema de imágenes de fluorescencia de iluminación estructurada equipado con un objetivo de aceite de 60x o tecnología confocal.
- Realice el análisis de la señal VDAC1 de células individuales utilizando Fiji como se indica en los siguientes pasos.
- Primero, seleccione y aísle la región de interés (ROI) dibujando un contorno alrededor de la celda positiva o negativa (según corresponda) y usando la función "Recortar". Para evitar sesgos en la selección del ROI, elíjalo teniendo en cuenta la señal de fluorescencia de un marcador no relacionado con el análisis (es decir, no un marcador mitocondrial).
- Opcional: si la imagen está excesivamente pixelada, utilice la función "suavizar" para obtener una mayor definición de los bordes.
NOTA: Si se aplica la función de suavizado a una imagen, aplíquela a todas las imágenes posteriores. - Opcional: utilice la función "Convolucie" (modo Kernel, en Process > Filters) para reducir el fondo.
NOTA: Esto es opcional y, por lo general, no es necesario cuando se utilizan secciones de 5 m debido a la naturaleza más delgada de las secciones. - Active los descriptores de forma y limite las opciones de umbral en la función "Establecer medida" (asegúrese de que estén activados a través del análisis).
- En el menú "Ajustar", seleccione la función de umbral y ajuste el nivel de umbral. La configuración del umbral debe mantenerse para todas las celdas de la misma muestra.
- Trate de asegurar una visualización adecuada de la red mitocondrial, como se muestra en las imágenes representativas de este artículo, mientras descarta los píxeles de fondo.
- Utilice la herramienta Analizar partículas en la pestaña Analizar. Establezca un tamaño adecuado para capturar las mitocondrias. En este ejemplo, tamaño: 25-Infinito, active: Unidades de píxeles y seleccione: Mostrar: Se utilizaron los comandos Máscaras para visualizar el resultado. Fiji calculará y mostrará los recuentos, la relación de aspecto (AR) y otros parámetros de forma en un nuevo panel.
- Realizar análisis estadísticos de los datos según corresponda. En este experimento, se utilizó la prueba t para analizar la diferencia en la relación de aspecto (AR) promedio y los recuentos calculados por Fiji entre los grupos experimentales después de las pruebas de normalidad con las pruebas de normalidad de D'Agostino y Pearson.
Resultados Representativos
Con el fin de garantizar que se dan las condiciones adecuadas de imagen y análisis para la evaluación in situ de la morfología mitocondrial en el tejido, se recomienda una exploración in vitro de la morfología mitocondrial en respuesta a un modulador conocido de la morfología mitocondrial (Sección 1). A modo de ejemplo, el SNCA se sobreexpresó genéticamente en las células SH-SY5Y para inducir cambios en la morfología mitocondrial como se describió anteriormente26. Otros insultos que podrían utilizarse como control para empeorar la morfología mitocondrial serían la inanición o el uso de inhibidores de la actividad mitocondrial como MPP+. Las células se transfectaron y se tiñeron para α-sinucleína (AS) para separar las células SNCA+ (AS+) y SNCA- (AS-). También se tiñeron con TOMM2027 para visualizar la red mitocondrial de células. Para que este análisis fuera lo más similar posible al de una sección de tejido de 5 μm, se analizó un plano confocal en lugar de una proyección máxima de múltiples planos. El análisis morfológico de un plano confocal de TOMM20 reveló que tanto el número total de mitocondrias como su relación de aspecto o AR (que se correlaciona con la elongación del orgánulo) se redujeron en respuesta a la sobreexpresión de SNCA (Figura 1).
La inmunotinción se realizó para la proteína mitocondrial VDAC1 en secciones de cerebro de ratón de 5 μm incluidas en parafina de animales inyectados con PFF, como se describe en la sección del protocolo anterior. Las neuronas dopaminérgicas de la sustancia negra pars compacta (SNc), que sufren degeneración en la EP, se revelaron mediante coinmunotinción con antitirosina hidroxilasa (TH) y se separaron regionalmente del área tegmental ventral y de la sustancia negra pars lateralis. Por otro lado, la tinción antifosfosser129-α-sinucleína (pS129) nos permitió discriminar las células que albergaban lesiones de pS129 de las células sanas (pS129+ frente a pS129-). Se tomaron imágenes SNc de tres animales diferentes, y el análisis posterior de imágenes de la tinción de VDAC1 de neuronas TH-positivas reveló una reducción tanto del número mitocondrial como de la relación de aspecto entre las neuronas portadoras de lesiones pS129 y las neuronas que carecían de ellas (Figura 2). Estos resultados indican que la morfología mitocondrial de las neuronas que albergan lesiones de pS129 está alterada en comparación con la de las células que carecen de lesiones de pS129.
Si bien este experimento en particular muestra una reducción en el AR, lo que pone de manifiesto una reducción en la elongación de las mitocondrias junto con una reducción en los recuentos globales, lo que indica un empeoramiento de la morfología mitocondrial, la interpretación de los datos debe depender del experimento. Por ejemplo, una reducción en el AR y los recuentos puede apuntar a una reducción global en el contenido mitocondrial, así como a la fragmentación, mientras que una reducción en el AR pero un aumento en los recuentos globales apuntaría a un fenotipo de fragmentación mitocondrial. Por lo tanto, es importante interpretar los datos en el contexto de ambas medidas.
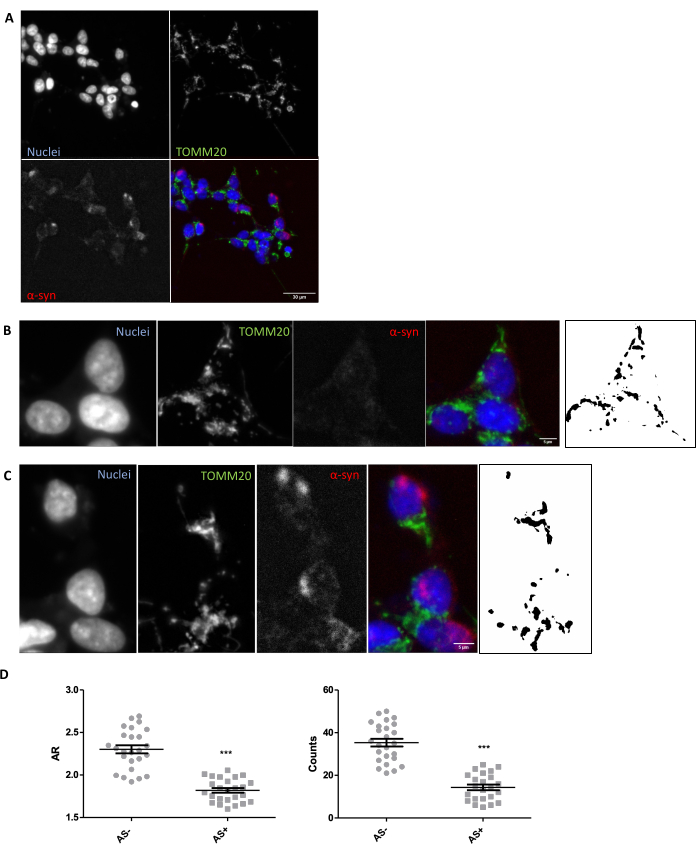
Figura 1: Morfología mitocondrial en un modelo in vitro con sobreexpresión de SNCA. Coinmunotinción para TOMM20 (verde), α-sinucleína (AS, rojo) y DAPI (azul) en células con sobreexpresión y no sobreexpresión de SNCA (AS+ y AS-, respectivamente) (A). Detalle de una célula AS- (B) y una célula AS+ (C). Las imágenes en blanco y negro de los paneles (B) y (C) representan las máscaras de la señal TOMM20 después de aplicar la función Fiji descrita en la sección Protocolo. Esta máscara permite cuantificar la forma de las estructuras resultantes. Los recuentos mitocondriales y los valores de relación de aspecto (AR) de las células AS- y AS+ (N = 25 células por condición) se cuantificaron y representaron como valores individuales, así como el promedio ± SEM; ** Valor p < prueba t de 0,05 (D). La normalidad se evaluó a través de las pruebas de normalidad de D'Agostino y Pearson. Barras de escala: A, 30 μm; B,C, 5 μm. Haga clic aquí para ver una versión más grande de esta figura.
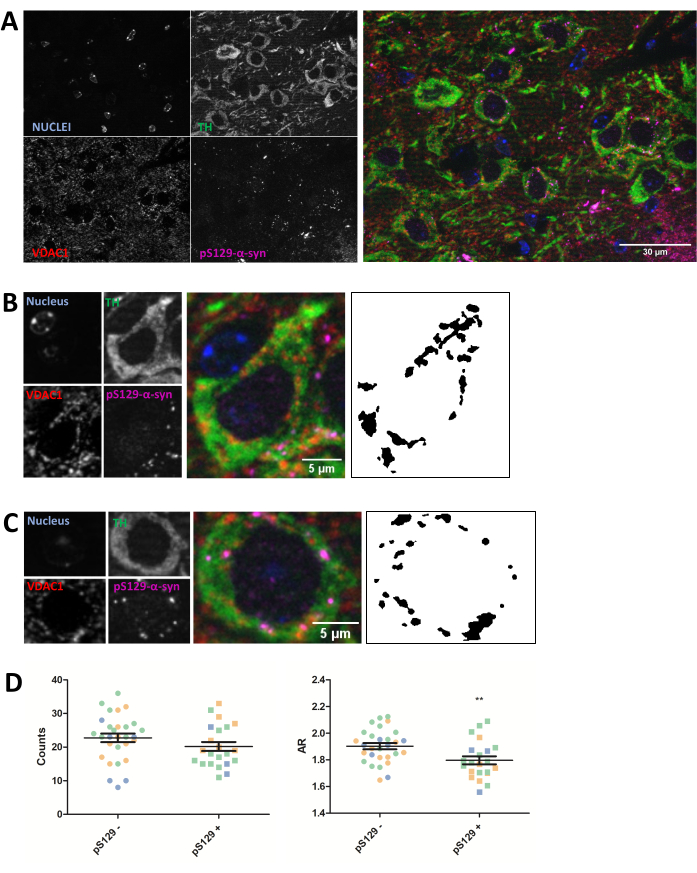
Figura 2: La morfología mitocondrial se ve afectada en las neuronas que albergan lesiones de pS129. Coinmunotinción para TH (verde), VDAC1 (rojo), fosfoS129-α-sinucleína (magenta) y DAPI (azul) de la SNc de ratones inyectados con PFF (A). El detalle de una neurona dopaminérgica (B) fosfoS129-α-sinucleína negativa (pS129-) y de una neurona dopaminérgica (C) fosfoS129-α-sinucleína positiva (pS129+). Las imágenes en blanco y negro de los paneles (B) y (C) representan las máscaras de la señal TOMM20 después de aplicar la función Fiji descrita en la sección Protocolo. Esta máscara permite cuantificar la forma de las estructuras resultantes. Se contaron células negativas y positivas en muestras de tres animales diferentes, como lo ilustran los diferentes colores de los valores gráficos individuales (azul, verde y naranja). Los recuentos mitocondriales y la cuantificación de RA de pS129- (N = 29) frente a pS129+ (N = 22) en neuronas dopaminérgicas se representaron como valores promedio ± SEM, así como valores celulares individuales; ** Valor de p < prueba t de 0,05 (D). La normalidad se evaluó a través de las pruebas de normalidad de D'Agostino y Pearson. Barras de escala: A, 30 μm; B,C, 5 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En general, este estudio muestra que la inmunotinción combinada con el análisis de imágenes es un método fiable para analizar la morfología mitocondrial. De hecho, permite cuantificar el número de mitocondrias así como algunos parámetros morfológicos como la relación de aspecto tanto en cultivo celular como en tejido. El número de mitocondrias está directamente relacionado con el estado funcional de los mecanismos de fisión y fusión de las muestras, mientras que el valor de AR se basa en la elongación del orgánulo. Este método puede ser particularmente valioso para la evaluación rápida de las anomalías mitocondriales en modelos de EP en los que la morfología, dinámica y funciones mitocondriales alteradas son mecanismos patológicos bien conocidos 28,29. La α-sinucleína también juega un papel relevante en la EP: de hecho, la α-sinucleína es uno de los componentes de los Cuerpos de Lewy, los agregados fibrilares citoplasmáticos que se utilizan para el diagnóstico post-mortem de los pacientes con EP30. Además, se encontraron mutaciones en el gen SNCA en pacientes con EP tanto familiar como esporádica (revisado en31). Se ha demostrado ampliamente que la fosforilación de la α-sinucleína en Ser129 marca una patología similar a la del cuerpo de Lewy, que surge después de la agresión a PFF y provoca varios efectos tóxicos 32,26.
Utilizando la herramienta que aquí se presenta, pudimos detectar una reducción en el número mitocondrial y en los valores de AR en presencia de α-sinucleína sobreexpresada y agregada (células con tinción de α-sinucleína y neuronas portadoras de lesiones positivas para fosfoSer129α-sinucleína, respectivamente) en comparación con las células que carecen de dichas lesiones (células α-sinucleína y fosfoS129α-sinucleína negativas). Estos resultados concuerdan con informes previos que muestran cómo las interacciones directas α-sinucleína-mitocondrias producen efectos tóxicos sobre la función mitocondrial y la homeostasis en la EP26,33, 34. De hecho, se informó que los ratones con mutaciones en la α-sinucleína exhiben un aumento del daño en el ADN mitocondrial35 y la mitofagia 36,37. Además, se describió que el aumento de los niveles de α-sinucleína promueve la fisión/fragmentación mitocondrial, induce especies reactivas de oxígeno dentro de las mitocondrias y desregula la expresión de proteínas mitocondriales en líneas celulares y modelos de ratón que sobreexpresan α-sinucleína 26,38,39.
Es importante destacar que esta herramienta depende en gran medida de los anticuerpos utilizados para el estudio; La evaluación morfológica cuidadosa de la tinción de anticuerpos utilizada es imprescindible para detectar el compartimento subcelular apropiado. Dado que esta técnica se basa en secciones de 5 μm y, por lo tanto, requiere planos focales únicos para el análisis de las estructuras mitocondriales, la ausencia de un fenotipo no descartará la existencia de un fenotipo, ya que es posible que las diferencias sutiles en la morfología mitocondrial no sean detectadas por este método.
Si bien este trabajo y otros han utilizado previamente enfoques similares para evaluar la morfología mitocondrial in vivo40, existe la necesidad de que la comunidad investigadora ponga a disposición de la comunidad investigadora un protocolo detallado para esta evaluación. La importancia de este estudio radica en que es posible aplicar este método a varios modelos de enfermedad in vivo para evaluar las anomalías morfológicas mitocondriales e identificar posibles patologías, lo que eventualmente puede facilitar el cribado de compuestos principales para el tratamiento de dichos trastornos. Si bien este análisis se limita actualmente al tejido incluido en parafina, la ventaja del método es que se puede aplicar a cualquier modelo de enfermedad después de la recolección de tejido terminal, lo que lo convierte en una herramienta muy versátil.
Divulgaciones
No queremos informar de ningún conflicto de intereses.
Agradecimientos
Queremos reconocer a los financiadores de este estudio, concretamente a Ikerbasque, al Ministerio de Ciencia e Innovación, a la Fundación Michael J Fox, IBRO y al Centro Vasco de Neurociencia Achucarro.
Materiales
| Name | Company | Catalog Number | Comments |
| 32 G Hamilton syringe | Hamilton | 7632-01 | |
| 4',6-diamidino-2-fenilindol, dihidrocloruro (DAPI) | Invitrogen | D1306 | |
| 4/0 USP 45 cm suture | SSa90 pga | 32345n-36u | |
| Alexa fluor 488/594-Donkey anti-Mouse | Invitrogen | A21202; A21203 | green/red dye-Donkey anti-Mouse |
| Alexa fluor 594/647-Donkey anti-Rabbit | Invitrogen | A21207 A31573 | red/far red dye-Donkey anti-Rabbit |
| AlexaFluor 488-Donkey anti-Chicken | Jackson ImmunoResearch | 703-545-155 | green dye-Donkey anti-Chicken |
| Anti-PSer129 α-synuclein EP1536Y (Rabbit) antibody | Abcam | ab51253 | |
| Anti-TOM 20 (Mouse) antibody | Santa Cruz | sc-17764 | |
| Anti-Tyrosine Hydroxylase (Chicken) antibody | Abcam | ab76442 | |
| Anti-VDAC1 (Mouse) antibody | Santa Cruz | sc-390996 | |
| Anti-α-synuclein antibody MJFR1 (Rabbit) | Abcam | ab138501 | |
| Citrate buffer 100X stock: 120mM citrate buffer, 5% Tween in water (pH 6) | Home-made | ||
| Disposable base mold for tissue embedding | Fisher | 22-363-553 | Plastic embedding boxes |
| D-MEM F12 | Gibco | A321331020 | |
| EVOS M7000 Imaging System | ThermoFisher Scientific | High-content automated fluorescence microscope | |
| Fetal Bovine Serum | Gibco | 10270106 | |
| Flat optical bottom 96 well plates | Greiner | 675090 | |
| FluorSave Reagent | Millipore | 345789-20ML | Mounting reagent |
| Glutamine 200 mM | Gibco | 25030-024 | |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratories | H-4000 | PAP-pen |
| Lipofectamine and Plus Reagent | Invitrogen | 11668-019; 11514-015 | Transfection reagent and transfection adjuvant |
| Matrigel | Corning | 354230 | Coating matrix |
| Microtome | ThermoFisher Scientific | ||
| Normal Donkey Serum | Gibco | PCN5000 | |
| Opti-MEM | Gibco | 31985070 | Transfection medium |
| PCDNA4 plasmid (backbone) | Addgene | 41036 | |
| Penicillin/Streptomycin solution | Gibco | 15140-122 | |
| SH-SY5Y cells/well | ATCC | HTB-11 | |
| Xylene substitute | Labbox | 22L36504 | |
| Zeiss Axio Imager Apotome 2 | Carl Zeiss | Structured illumination fluorescence imaging system | |
| α-synuclein peptide | rpeptide | S-1010-2 |
Referencias
- Yang, Y., Lu, B. Mitochondrial morphogenesis, distribution, and parkinson disease. Journal of Neuropathology and Experimental Neurology. 68 (9), 953-963 (2009).
- Schapira, A. H. Mitochondria in the aetiology and pathogenesis of Parkinson's disease. The Lancet Neurology. 7 (1), 97-109 (2008).
- Swerdlow, R. H. Mitochondria and mitochondrial cascades in alzheimer's disease. Journal of Alzheimer's Disease. 62 (3), 1403-1416 (2018).
- Hedrich, K., et al. type, and origin of Parkin mutations: Review and case studies. Movement Disorders. 19 (10), 1146-1157 (2004).
- Kahle, P. J., Haass, C. How does parkin ligate ubiquitin to Parkinson's disease. EMBO reports. 5 (7), 681-685 (2004).
- Dawson, T. M., Dawson, V. L. The role of parkin in familial and sporadic Parkinson's disease. Movement Disorders. 25, S32-S39 (2010).
- Pickrell, A. M., Youle, R. J. The Roles of PINK1, Parkin, and Mitochondrial Fidelity in Parkinson's Disease. Neuron. 85 (2), 257-273 (2015).
- Zhi, L., et al. Loss of PINK1 causes age-dependent decrease of dopamine release and mitochondrial dysfunction. Neurobiology of Aging. 75, 1-10 (2019).
- Bonifati, V., et al. DJ-1(PARK7), a novel gene for autosomal recessive, early onset parkinsonism. Neurological Sciences. 24 (3), 159-160 (2003).
- Chia, S. J., Tan, E. -. K., Chao, Y. -. X. Historical Perspective: Models of Parkinson's Disease. International Journal of Molecular Sciences. 21 (7), 2464 (2020).
- Wilson, D. M., Cookson, M. R., Den Bosch, L. V. a. n., Zetterberg, H., Holtzman, D. M., Dewachter, I. Hallmarks of neurodegenerative diseases. Cell. 186 (4), 693-714 (2023).
- Moore, D. J., West, A. B., Dawson, V. L., Dawson, T. M. Molecular pathophysiology of Parkinson's disease. Annual Review of Neuroscience. 28 (1), 57-87 (2005).
- Olanow, C. W., Tatton, W. G. Etiology and pathogenesis of Parkinson's disease. Annual Review of Neuroscience. 22 (1), 123-144 (1999).
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Okamoto, K., Shaw, J. M. Mitochondrial Morphology and Dynamics in Yeast and Multicellular Eukaryotes. Annual Review of Genetics. 39 (1), 503-536 (2005).
- Malpartida, A. B., Williamson, M., Narendra, D. P., Wade-Martins, R., Ryan, B. J. Mitochondrial Dysfunction and Mitophagy in Parkinson's Disease: From Mechanism to Therapy. Trends in Biochemical Sciences. 46 (4), 329-343 (2021).
- Zou, W., et al. Nanoscopic quantification of sub-mitochondrial morphology, mitophagy and mitochondrial dynamics in living cells derived from patients with mitochondrial diseases. Journal of Nanobiotechnology. 19 (1), 136 (2021).
- Navaratnarajah, T., Anand, R., Reichert, A. S., Distelmaier, F. The relevance of mitochondrial morphology for human disease. The International Journal of Biochemistry & Cell Biology. 134, 105951 (2021).
- Zambon, F., et al. Cellular α-synuclein pathology is associated with bioenergetic dysfunction in Parkinson's iPSC-derived dopamine neurons. Human Molecular Genetics. 28 (12), 2001-2013 (2019).
- Cherubini, M., Lopez-Molina, L., Gines, S. Mitochondrial fission in Huntington's disease mouse striatum disrupts ER-mitochondria contacts leading to disturbances in Ca2+ efflux and Reactive Oxygen Species (ROS) homeostasis. Neurobiology of Disease. 136, 104741 (2020).
- Parihar, M. S., Parihar, A., Fujita, M., Hashimoto, M., Ghafourifar, P. Alpha-synuclein overexpression and aggregation exacerbates impairment of mitochondrial functions by augmenting oxidative stress in human neuroblastoma cells. The International Journal of Biochemistry & Cell Biology. 41 (10), 2015-2024 (2009).
- Wiemerslage, L., Lee, D. Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters. Journal of Neuroscience Methods. 262, 56-65 (2016).
- Liu, Y. -. T., et al. Mt-Keima detects PINK1-PRKN mitophagy in vivo with greater sensitivity than mito-QC. Autophagy. 17 (11), 3753-3762 (2021).
- Shoshan-Barmatz, V., Shteinfer-Kuzmine, A., Verma, A. VDAC1 at the intersection of cell metabolism, apoptosis, and diseases. Biomolecules. 10 (11), 1485 (2020).
- Luk, K. C., et al. Pathological α-Synuclein transmission initiates parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Ryan, B. J., et al. REST protects dopaminergic neurons from mitochondrial and α-synuclein oligomer pathology in an alpha synuclein overexpressing BAC-transgenic mouse model. The Journal of Neuroscience. 41 (16), 3731-3746 (2021).
- Yamamoto, H., et al. Dual role of the receptor Tom20 in specificity and efficiency of protein import into mitochondria. Proceedings of the National Academy of Sciences. 108 (1), 91-96 (2011).
- Exner, N., Lutz, A. K., Haass, C., Winklhofer, K. F. Mitochondrial dysfunction in Parkinson's disease: molecular mechanisms and pathophysiological consequences. The EMBO Journal. 31 (14), 3038-3062 (2012).
- Grünewald, A., Kumar, K. R., Sue, C. M. New insights into the complex role of mitochondria in Parkinson's disease. Progress in Neurobiology. 177, 73-93 (2019).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. The American journal of pathology. 152 (4), 879-884 (1998).
- Vázquez-Vélez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44 (1), 87-108 (2021).
- Mahul-Mellier, A. -. L., et al. The process of Lewy body formation, rather than simply α-synuclein fibrillization, is one of the major drivers of neurodegeneration. Proceedings of the National Academy of Sciences. 117 (9), 4971-4982 (2020).
- Ganguly, U., et al. Interaction of α-synuclein and Parkin in iron toxicity on SH-SY5Y cells: implications in the pathogenesis of Parkinson's disease. Biochemical Journal. 477 (6), 1109-1122 (2020).
- Ganjam, G. K., et al. Mitochondrial damage by α-synuclein causes cell death in human dopaminergic neurons. Cell Death & Disease. 10 (11), 865 (2019).
- Martin, L. J., et al. Parkinson's Disease α-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. The Journal of Neuroscience. 26 (1), 41-50 (2006).
- Choubey, V., et al. Mutant A53T α-Synuclein induces neuronal death by increasing mitochondrial autophagy. Journal of Biological Chemistry. 286 (12), 10814-10824 (2011).
- Chen, L., Xie, Z., Turkson, S., Zhuang, X. A53T Human α-synuclein overexpression in transgenic mice induces pervasive mitochondria macroautophagy defects preceding dopamine neuron degeneration. The Journal of Neuroscience. 35 (3), 890-905 (2015).
- Kamp, F., et al. Inhibition of mitochondrial fusion by α-synuclein is rescued by PINK1, Parkin and DJ-1. The EMBO Journal. 29 (20), 3571-3589 (2010).
- Nakamura, K., et al. Direct membrane association drives mitochondrial fission by the parkinson disease-associated protein α-synuclein. Journal of Biological Chemistry. 286 (23), 20710-20726 (2011).
- Park, J., et al. Abnormal mitochondria in a non-human primate model of MPTP-induced Parkinson's disease: Drp1 and CDK5/p25 signaling. Experimental Neurobiology. 28 (3), 414-424 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados