Análisis de flujo de doble reportero basado en perlas fluorescentes magnéticas del bloqueo de anticuerpos inducidos por la vacuna del péptido PDL1-Vaxx de la interacción PD-1/PD-L1
En este artículo
Resumen
Los inhibidores de puntos de control son objetivos importantes en el desarrollo de terapias para la batalla contra el cáncer. Este informe presenta una nueva vacuna contra el cáncer basada en péptidos PDL1, PDL1-Vaxx, que induce la producción de anticuerpos policlonales neutralizantes que bloquean la formación del complejo PD-1/PDL1. Este trabajo también detalla el desarrollo y prueba de un ensayo basado en perlas fluorescentes para analizar esta actividad.
Resumen
La inhibición de los receptores de puntos de control (PD-1, PD-L1 y CTLA-4) con anticuerpos monoclonales ha mostrado un gran beneficio en ensayos clínicos para el tratamiento de pacientes con cáncer y se ha convertido en un enfoque fundamental en la inmunoterapia moderna contra el cáncer. Sin embargo, solo un subgrupo de pacientes responde a la inmunoterapia con anticuerpos monoclonales de punto de control. Por lo tanto, es urgente desarrollar nuevas estrategias terapéuticas contra el cáncer. Se ha desarrollado una nueva vacuna contra el cáncer con el epítopo peptídico de células B PDL1 (ligando de muerte programada 1), con los aminoácidos 130-147 unidos al péptido MVF (proteína de fusión del virus del sarampión de células T "promiscuas") a través de un enlazador GPSL. Las pruebas preclínicas han indicado que esta vacuna PDL1 (PDL1-Vaxx) estimula eficazmente los anticuerpos altamente inmunogénicos en animales. Los animales inmunizados con PDL1-Vaxx muestran una carga tumoral reducida y tasas de supervivencia extendidas en varios modelos de cáncer animal. Los mecanismos de acción indican que los anticuerpos provocados por la vacuna inhiben la proliferación de células tumorales, inducen la apoptosis y bloquean la interacción PD-1/PD-L1. Este manuscrito presenta un ensayo basado en perlas magnéticas que utiliza un sistema de análisis de flujo de doble reportero para evaluar la interacción PD-1/PD-L1 y su bloqueo por los anticuerpos anti-PDL1 levantados contra PDL1-Vaxx.
Introducción
En las células T, las células B y los puntos de control intracelulares del sistema inmunitario, las vías de señalización regulan las actividades inmunitarias. Algunas células cancerosas se protegen del ataque inmunitario estimulando los objetivos de los puntos de control, que inhiben la función inmunitaria y promueven la supervivencia y proliferación neoplásica. La inmunoterapia oncológica por inhibición de puntos de control utiliza anticuerpos para atacar y bloquear los puntos de control de señalización y, por lo tanto, restaurar las funciones antineoplásicas del sistema inmune 1,2,3. En la actualidad, las terapias anticancerígenas altamente efectivas incluyen los anticuerpos monoclonales nivolumab, que se dirige a la proteína de muerte programada 1 (PD-1)4, y el atezolizumab, que se dirige al ligando de muerte programada 1 (PD-L1)5. Este enfoque ha demostrado un gran éxito clínico en el tratamiento de pacientes con cáncer. Sin embargo, la utilidad clínica de las estrategias actuales de inhibición de puntos de control se ve mitigada por los eventos adversos y la resistencia al tratamiento, especialmente en la terapia con un solo agente6. Se necesita urgentemente una combinación de inmunoterapia y estrategias terapéuticas más efectivas con menor toxicidad en el tratamiento del cáncer 1,3,6.
Durante los últimos 30 años, el laboratorio del Dr. Kaumaya ha desarrollado vacunas contra el cáncer de péptidos y agentes relacionados con la imitación de péptidos para la terapia del cáncer, algunos de los cuales se encuentran en ensayos clínicos en curso 1,2,7,8,9,10,11,12,13,14 . Por ejemplo, B-Vaxx con inmunoterapia combinada HER-2 ha demostrado beneficios para los pacientes contra tumores sólidos metastásicos y/o recurrentes en ensayos clínicos12. Las últimas vacunas contra el cáncer del laboratorio son PD1-Vaxx 2,13 y PDL1-Vaxx14, que han mostrado grandes ventajas en estudios preclínicos, especialmente en tratamientos combinados. El PD1-Vaxx ha completado ensayos clínicos de aumento de dosis en EE. UU. y Australia. El PD1-Vaxx se combinará con atezolizumab en el ensayo de fase 1b que comenzará en mayo de 2023. Este informe se centra en la evaluación de la capacidad de los anticuerpos inducidos por PDL1-Vaxx para bloquear la interacción PD-1/PD-L1.
La vacuna contra el cáncer PDL1-Vaxx es una nueva vacuna epítopo peptídica de células B con aminoácidos PD-L1 130-147 unidos al péptido promiscuo de fusión del virus del sarampión (MVF) de células T a través de un enlazador de péptidos GPSL. Los estudios preclínicos han demostrado que PDL1-Vaxx es altamente inmunogénico para estimular la producción de anticuerpos anticancerígenos en varios modelos animales, prolongar la supervivencia y reducir la carga tumoral14. Estos anticuerpos generados contra el péptido PD-L1 pueden bloquear con éxito la interacción PD1/PD-L1, lo que resulta en actividad antineoplásica. Este informe presenta un ensayo que analiza el bloqueo de la formación del complejo PD1/PD-L1 por anticuerpos inducidos por PDL1-Vapex utilizando un formato basado en perlas magnéticas con una lectura de doble reportero en un instrumento de citometría de flujo.
Protocolo
1. Preparación experimental
NOTA: Los detalles de todos los reactivos/equipos mencionados en este paso se enumeran en la Tabla de Materiales.
- Obtener PD-1 humana recombinante (rhPD-1; marcada con polihistidina). Reconstituya rhPD1 liofilizado con solución salina tamponada con fosfato (PBS) filtrada estérilmente, pH 7,4, antes de su uso.
- Obtener PD-L1 humana recombinante biotinilada (rhPD-L1). Reconstituya rhPD-L1 liofilizado con agua desionizada estéril antes de su uso.
- Obtener el reactivo de detección de R-ficoeritrina conjugada con estreptavidina (SAPE). Guarde todas las soluciones SAPE protegidas de la luz a temperaturas frigoríficas (es decir, 2-8 °C).
- Obtenga microesferas magnéticas teñidas con fluorescencia (6,5 μm de diámetro, poliestireno con magnetita incrustada) y el kit de acoplamiento de cordones15 (si se utiliza, consulte la tabla de materiales). El acoplamiento covalente a las microesferas requiere sulfo-NHS (sulfo-N-hidrosuccinimida) y EDC (clorhidrato de N-[3-dimetilaminopropil]-N′-etilcarbodiimida).
NOTA: Los juegos de cuentas magnéticas están disponibles con cualquiera de las 500 etiquetas fluorescentes únicas, lo que permite la identificación y diferenciación de diferentes juegos de cuentas16. Las perlas se ofrecen en concentraciones de 2,5 × 106 perlas/ml y 12,5 × 106 perlas/ml. Guarde las perlas protegidas de la luz a temperaturas frigoríficas (es decir, 2-8 °C). No congele las suspensiones de cuentas. - Obtenga anticuerpos de control positivos y negativos y anticuerpos de detección secundaria marcados con Brilliant Violet 421 (BV421). Almacene todas las moléculas conjugadas fluorescentes protegidas de la luz.
- Realice todas las reacciones de acoplamiento en tubos de unión a proteínas bajas y todas las reacciones de ensayo en placas de microtitulación de 96 pocillos, de fondo redondo y de unión a proteínas bajas. Selle las placas con una lámina adhesiva desechable o cubiertas de microplacas de plástico de 96 pocillos para los pasos de incubación del ensayo. Utilice un separador de placas magnéticas para inmovilizar las perlas durante los pasos de lavado del ensayo.
NOTA: El sistema de análisis de flujo de doble reportero tiene tres láseres: (1) uno que identifica y cuantifica la fluorescencia específica del conjunto de perlas (canal de clasificación); (2) uno que detecte y cuantifique la fluorescencia de ficoeritrina (PE) específica del objetivo (Canal Reportero 1; excitación de 532 nm, emisión "naranja" de 565-585 nm); y (3) uno que detecta y cuantifica la fluorescencia BV421 específica de un segundo analito objetivo (Reporter Channel 2; excitación de 405 nm, emisión "azul" de 421-441 nm).
2. Acoplamiento rhPD-1 a perlas magnéticas
NOTA: La proteína a acoplar debe estar libre de albúmina sérica bovina (BSA), azida sódica, glicina, glicerol, tris(hidroxi-metil)aminometano (Tris) o aditivos que contengan aminas y debe suspenderse en PBS a pH 7.4. Existe un kit de acoplamiento comercial que incluye todos los reactivos y tampones necesarios que se describen en este documento (consulte la Tabla de materiales).
- Retire todos los reactivos de acoplamiento del refrigerador y déjelos equilibrar a temperatura ambiente (RT, 18-22 °C) durante 20-30 min.
- Vuelva a suspender las microesferas originales mediante vórtice, sonicación o rotación (15 minutos a 15-30 rpm), de acuerdo con la hoja de información del producto.
- Transfiera 1 × 106 perlas magnéticas a un tubo de microcentrífuga de unión a proteínas de 1,5 ml (consulte la Tabla de materiales).
- Lavar las perlas con 100 μL de tampón de activación15: 0,1 M NaH2PO4 (monobásico), pH 6,2.
NOTA: El acoplamiento también se puede realizar utilizando un kit de acoplamiento preconfigurado, que incluye ácido 2-morfolinoetanosulfónico (MES) 0,1 M, pH 6,0, como tampón alternativo de activación y acoplamiento (consulte la Tabla de materiales).- Coloque el tubo que contiene las perlas en un separador magnético durante 1-2 minutos.
NOTA: Alternativamente, las perlas se pueden separar por microcentrifugación a ≥8.000 × g durante 1-2 min. - Aspire el sobrenadante con una pipeta de las perlas inmovilizadas o granuladas con el tubo aún colocado en el separador magnético.
- Retire el tubo de microcentrífuga del imán y agregue 80 μL de tampón de acoplamiento (consulte la Tabla de materiales).
- Agite suavemente el tubo de reacción y sonique durante 20 s para dispersar las perlas.
- Coloque el tubo que contiene las perlas en un separador magnético durante 1-2 minutos.
- Activar las perlas con sulfo-NHS y EDC.
NOTA: La solución madre de sulfo-NHS es de 50 mg/ml disueltos en tampón de activación. La solución madre de EDC también es 50 mg/ml disuelta en tampón de activación. Tanto el tampón de activación como la humedad de la atmósfera provocan la degradación de los EDC. No es aconsejable utilizar una solución EDC almacenada. Prepare la suficiente solución EDC fresca antes del paso y úsela inmediatamente cuando la solución esté lista. Deseche el exceso de solución EDC.
PRECAUCIÓN: El EDC causa irritación ocular severa y es un irritante de las vías respiratorias y de la piel.- Añadir 10 μL de sulfo-NHS al tubo de microfuga que contiene las perlas lavadas y activadas.
- Añadir 10 μL de solución madre de EDC al tubo de microfuga que contiene las perlas y el sulfo-NHS.
- Proteja las microesferas fotosensibles de la luz y gire sobre el rotador durante 20 minutos a 15-30 rpm, a RT (18-22 °C). Alternativamente, el tubo puede permanecer estacionario durante el paso de activación si se agita suavemente en vórtice para redistribuir las perlas a intervalos de 10 minutos.
- Lave el exceso de reactivos de acoplamiento de las perlas.
- Coloque el tubo que contiene las perlas activadas en un separador magnético durante 1-2 minutos.
- Aspire el sobrenadante con una pipeta de perlas inmovilizadas por imanes o granuladas con el tubo aún colocado en el separador magnético.
- Retire el tubo de microcentrífuga del imán y agregue 100 μL de tampón de activación.
- Agite suavemente el tubo de reacción para dispersar las perlas.
- Repita los pasos 2.6.1-2.6.4 dos veces más para un total de tres lavados. Al final del lavado, las perlas se suspenderán en 100 μL de tampón de activación a una concentración aproximada de 10 × 106 perlas/mL.
- Acople el péptido rhPD-1 a las perlas activadas.
- Agregue 390 μL de tampón de activación al tubo que contiene las perlas activadas para aumentar el volumen total de suspensión de perlas hasta 490 μL.
- Añadir 1 μg de péptido PD-1 a la suspensión de perlas activadas añadiendo 10 μL de solución peptídica PD-1 (1 mg/ml disuelto en PBS) al tubo que contiene las perlas activadas.
- Agite brevemente el tubo de la microcentrífuga para distribuir uniformemente el PD-1 y las perlas activadas.
- Incubar las perlas con PD-1 durante 2 h en la oscuridad a RT (18-22 °C) con rotación (15-30 rpm).
- Lave las perlas dos veces (2x) con tampón de ensayo/lavado (PBS-TBN: 1x PBS, pH 7,4 + 0,1% BSA + 0,05% Tween-20 + 0,05% NaN315).
- Coloque el tubo que contiene las perlas activadas en un separador magnético durante 1-2 minutos.
- Aspire el sobrenadante con una pipeta de las perlas inmovilizadas o granuladas con el tubo aún colocado en el separador magnético.
- Retire el tubo de microcentrífuga del imán y agregue 100 μL de tampón de activación.
- Agite suavemente el tubo de reacción para dispersar las perlas.
- Repita los pasos 2.8.1 a 2.8.4 una vez más para un total de dos lavados. Al final del lavado, las perlas se suspenderán en 100 μL de tampón de activación a una concentración de 10 × 106 perlas/ml.
NOTA: El tampón de ensayo/lavado se puede hacer sin azida de sodio (conservante) si el tampón no se usa también como medio de almacenamiento. - Guarde las perlas acopladas a rhPD-1 en la oscuridad en el refrigerador a 2-8 °C si no se usa inmediatamente. Las perlas acopladas a proteínas son estables hasta por 18 meses.
3. Evaluación del acoplamiento exitoso de rhPD-1 a los cordones
NOTA: Las microesferas acopladas a rhPD-1 reaccionan con rhPD-L1 biotinilada, la última de las cuales se detecta mediante incubación con SAPE seguida de una evaluación en el citómetro de flujo. Esto verifica tanto el acoplamiento exitoso de PD-1 a las perlas magnéticas como la interacción funcional entre las proteínas rhPD-1 y rhPD-L1.
- Cree una serie de diluciones en serie dobles de rhPD-L1 biotinilado en PBS-TBN (la solución original de rhPD-L1 es de 1 mg/ml). El rango final de concentración de rhPD-L1 que se va a probar es una solución de 8 μg/mL hasta una solución de 313 pg/mL. Cree volúmenes de 150 μl de cada dilución rhPD-L1: 50 μl para cada reacción y dos reacciones por condición, más un exceso suficiente para acomodar las pérdidas de pipeteo.
- Etiquete los tubos de microfuga de dilución rhPD-L1 como 8 μg/ml, 4 μg/ml, 2 μg/ml, 1 μg/ml, 0,5 μg/ml, 0,25 μg/ml, 0,125 μg/ml, 0,063 μg/ml y 0,031 μg/ml. Un tubo de 0 μg/ml (solo PBS-TBN) sirve como control no-PD-L1.
- Precargue 150 μL de PBS-TBN en todos los tubos de dilución rhPD-L1 marcados.
NOTA: La concentración final más alta de rhPD-L1 que se debe probar es de 8 μg/mL, y el rhPD-L1 se diluirá 1:1 al agregarlo a la mezcla de reacción, por lo que el tubo de dilución etiquetado como "8 μg/mL" se refiere a la concentración final y en realidad contiene 16 μg/mL rhPD-L1. Las etiquetas de todos los tubos de dilución indican la concentración final de rhPD-L1 después de la adición a la reacción. - Cree la dilución de rhPD-L1 de mayor concentración (16 μg/ml real). Se trata de una dilución de 62,5 veces en dos pasos de la solución madre rhPD-L1 de 1 mg/ml (1.000 μg/16 μg = 62,5).
- Combine 84 μL de PBS-TBN con 16 μL de solución madre rhPD-L1 (1 mg/mL, es decir, 1.000 μL) en un tubo de microcentrífuga. Se trata de una dilución de 6,25 veces y la concentración resultante es de 160 μg/ml de rhPD-L1.
- En el tubo marcado como "8 μg/mL", combine 270 μL de PBS-TBN con 30 μL de la dilución rhPD-L1 creada en el paso anterior (160 μg/mL). Se trata de una dilución de 10 veces, y la concentración resultante es en realidad de 16 μg/mL. La etiqueta del tubo "8 μg/mL" se refiere a su concentración final después de la adición a la reacción.
- Transfiera 150 μL de la dilución rhPD-L1 creada en el paso 3.1.3 ("8 μg/mL") al tubo "4 μg/mL", cierre la tapa del tubo de microcentrífuga y haga un vórtice breve para mezclar la solución.
- Repita el paso 3.1.4 secuencialmente hasta completar la serie de dilución rhPD-L1. Después de la creación, todos los tubos entre "8 μg/mL" y "0,063 μg/mL", así como el control de 0 μg/mL, deben contener 150 μL de solución, y el último tubo, "0,031 μg/mL", debe contener 300 μL de solución. Esto crea un volumen suficiente de cada dilución para probar 50 μL de cada dilución biotinilada de rhPD-L1 en reacciones duplicadas, con suficiente exceso restante para acomodar las pérdidas de pipeteo.
- Cuente las cuentas acopladas a rhPD-1 con un hemocitómetro17.
- Diluir las perlas acopladas con rhPD-1 a 5 × 104 perlas/ml, con un volumen suficiente para 2.500 perlas/50 μl/reacción.
- Agite la suspensión de perlas acopladas a 5 × 104 perlas/ml rhPD-1 y pipetee 50 μL de la suspensión en cada pocillo marcado/mapeado de una placa de microtitulación de fondo redondo de 96 pocillos para que se creen pocillos duplicados para cada dilución rhPD-L1 que se esté probando.
- Añadir 50 μL de cada tubo de dilución biotinilado rhPD-L1 creado en el paso 3.1 a los pocillos apropiados de la placa de microtitulación.
- Cubra la placa de microtitulación con una lámina desechable o un sellador de placas adhesivas de plástico e incube la placa durante 1 h en la oscuridad a RT (18-22 °C) en un agitador orbital (600 rpm).
- Lave el exceso de rhPD-L1 biotinilado de las perlas.
- Transfiera la placa sellada del agitador orbital al separador de placas magnéticas durante 2 minutos para inmovilizar las perlas.
- Retire con cuidado el sellador de placas adhesivas, confirme que el imán y la placa de microtitulación estén bien unidos, invierta la placa y vierta los sobrenadantes en un fregadero o contenedor de desechos líquidos de riesgo biológico, según corresponda. Golpee suave pero enérgicamente la placa invertida sobre un cojín de papel absorbente para eliminar el sobrenadante restante.
- Retire la placa de microtitulación del separador de placas magnéticas y pipetee 150 μL de PBS-TBN en cada pocillo.
- Coloque la placa sin sellar en el separador magnético durante 2 minutos para inmovilizar las cuentas.
- Confirme que el imán y la placa de microtitulación estén bien unidos, e invierta la placa y vierta los sobrenadantes en un fregadero o contenedor de desechos líquidos de riesgo biológico, según corresponda. Golpee suave pero enérgicamente la placa invertida sobre un cojín de papel absorbente para eliminar el sobrenadante restante.
- Repita los pasos de lavado de placas 3.7.3-3.7.5 dos veces para un total de tres lavados con 150 μL de PBS-TBN cada uno. Asegúrese de que no quede sobrenadante en los pocillos al final del último paso de lavado. Trabaje constantemente para evitar que se sequen las perlas inmovilizadas en el fondo de los pozos.
- Agregue el reactivo de detección SAPE.
- Diluir la solución madre de SAPE en PBS-TBN hasta una concentración de trabajo de 6 μg/mL. Prepare un volumen suficiente de solución de trabajo SAPE para que todos los pocillos de reacción puedan recibir 100 μL/pocillo, con suficiente extra para acomodar las pérdidas de pipeteo.
- Retire la placa de microtitulación del separador de placas magnéticas.
- Agregue 100 μL de solución de trabajo SAPE en cada pocillo de reacción y vuelva a suspender las perlas lavadas mediante pipeteo.
- Selle la placa de microtitulación de 96 pocillos con un sellador de placas adhesivas de aluminio o plástico e incube durante 1 h en la oscuridad a RT (18-22 °C) en un agitador orbital a 600 rpm.
- Retire la placa de microtitulación de la incubadora, transfiérala al separador de placas magnéticas para inmovilizar las perlas, retire el sellador de placas adhesivas y lave las perlas tres veces con 150 μL PBS-TBN, como se describe en los pasos 3.7.3-3.7.5.
- Después de retirar el lavado final, retire la placa del separador de placas magnéticas y vuelva a suspender las perlas en 100 μL de PBS-TBN por pocillo.
- Analiza los resultados.
- Lea la placa en el instrumento de análisis de flujo (consulte la Tabla de materiales) para determinar la intensidad de fluorescencia media (MFI) de cada reacción utilizando los siguientes ajustes del instrumento: volumen de aspiración = 50 μL; número mínimo de cuentas = 100 cuentas; ajuste de tiempo de espera = 40 s; compuerta = 7.000-17.000; modo de funcionamiento = Reportero único. Se ejecutan pozos duplicados para cada condición y se promedian los dos valores de MFI de salida para cada condición antes de realizar más cálculos y gráficos de datos.
NOTA: El valor MFI de cada dilución debe mostrar una unión dependiente de la concentración, lo que indica una eficiencia aceptable de acoplamiento de rhPD-1 a las perlas y confirma una buena interacción de las proteínas recombinantes PD-1/PD-L1.
- Lea la placa en el instrumento de análisis de flujo (consulte la Tabla de materiales) para determinar la intensidad de fluorescencia media (MFI) de cada reacción utilizando los siguientes ajustes del instrumento: volumen de aspiración = 50 μL; número mínimo de cuentas = 100 cuentas; ajuste de tiempo de espera = 40 s; compuerta = 7.000-17.000; modo de funcionamiento = Reportero único. Se ejecutan pozos duplicados para cada condición y se promedian los dos valores de MFI de salida para cada condición antes de realizar más cálculos y gráficos de datos.
4. Ensayo de bloqueo PD-1/PD-L1 basado en perlas magnéticas PD-L1
NOTA: Este ensayo evalúa la actividad de bloqueo de mediadores solubles (p. ej., anticuerpos anti-péptido PDL1) en las interacciones recombinantes PD1/PD-L1. Brevemente, el rhPD-L1 biotinilado se preincuba con anticuerpos generados en conejos después de diferentes inoculaciones con el péptido PDL1-Vaxx. A continuación, se captura la mezcla de anticuerpos rhPD-L1 + anti-PDL1 utilizando perlas magnéticas acopladas a rhPD-1, y la unión de rhPD-L1 a las perlas acopladas a rhPD-1 se cuantifica mediante la adición de estreptavidina-PE. La señal de fluorescencia de PE se correlaciona inversamente con la actividad de bloqueo de los anticuerpos/inhibidores anti-PDL1 probados. La unión de anticuerpos anti-péptido PDL1 se evalúa simultáneamente mediante la unión de un anticuerpo secundario anti-conejo acoplado a BV421 (para anticuerpos anti-péptido PDL1) o anti-humano (para anticuerpos de control) y mediante la evaluación de la fluorescencia BV421 en el segundo canal del instrumento. Los pasos del ensayo se detallan gráficamente en la Figura 1.
- Preparar una serie de diluciones en serie de dos veces de los anticuerpos de prueba, incluidos los candidatos a anticuerpos policlonales inducidos por PDL1-Vaxx, un anticuerpo de control negativo (trastuzumab, Herceptin, anticuerpo monoclonal anti-HER2 humanizado) y un anticuerpo de control positivo (atezolizumab; anticuerpo monoclonal humanizado anti-PDL1 IgG1). Cada reacción utilizará 25 μL de la dilución de anticuerpos asignada, por lo que los volúmenes mostrados son suficientes para realizar cada reacción en pocillos duplicados por condición (es decir, 50 μL por condición), quedando algo de exceso para acomodar las pérdidas de pipeteo.
- Para cada anticuerpo anti-péptido PDL1 inducido por la vacuna y anticuerpo de control, asegúrese de que el rango de las concentraciones finales de anticuerpos analizadas sea de 1.000 μg/ml a 8 μg/ml. Preparar soluciones madre de todos los anticuerpos a 2.000 μg/mL.
- Para cada anticuerpo, etiquete los tubos de dilución como 1.000 μg/ml, 500 μg/ml, 250 μg/ml, 125 μg/ml, 63 μg/ml, 31 μg/ml, 16 μg/ml y 8 μg/ml, e incluya el nombre del anticuerpo. Para cada anticuerpo, agregue también un tubo de "0 μg/mL", que será el control solo del vehículo (PBS-TBN).
NOTA: Cuando se agrega a la mezcla de reacción, la concentración de anticuerpos se diluirá 1:1. Los tubos de dilución de anticuerpos están etiquetados como la concentración final de anticuerpos después de la adición a la reacción y, de hecho, contienen el doble de la cantidad de anticuerpos que la indicada en la etiqueta. - Agregue 75 μL de PBS-TBN a todos los tubos de dilución de anticuerpos etiquetados como "500 μg/mL" e inferiores, incluidos los tubos de control "0 μg/mL" solo para vehículos.
- Para cada anticuerpo, pipetear 150 μL de la solución madre de 2.000 μg/mL en el tubo respectivo marcado como "1.000 μg/mL". Esto se utilizará para hacer todas las diluciones posteriores para cada anticuerpo.
- Para cada anticuerpo, cree una serie completa de diluciones transfiriendo con pipeta 75 μL del tubo "1.000 μg/mL" al tubo con la siguiente dilución más baja de la serie (es decir, "500 μg/mL"). Cierre el tubo de dilución recién terminado, vérticelo brevemente y continúe la construcción de la serie de dilución transfiriendo 75 μL del tubo de "500 μg/mL" al tubo de "250 μg/mL". Repita este patrón hasta que se haya realizado la última dilución, "8 μg/mL", para todos los anticuerpos.
NOTA: En la serie de dilución completa para cada anticuerpo, debe haber un volumen de 75 μL para todos los tubos, excepto la dilución más baja, 8 μg/mL, que debe contener un volumen de 150 μL. Cada reacción utilizará 25 μL de dilución de anticuerpos, por lo que estos volúmenes son suficientes para realizar cada reacción en pocillos duplicados por condición (es decir, 50 μL por condición), con extra para acomodar las pérdidas de pipeteo.
- Coloque 25 μL de los anticuerpos diluidos en los pocillos designados de una placa de microtitulación de 96 pocillos.
- Diluir rhPD-L1 biotinilado a una concentración de trabajo de 4 μg/ml en PBS-TBN a un volumen suficiente para incluir 25 μl en pocillos duplicados por afección (es decir, 50 μl por afección), con un extra para acomodar las pérdidas de pipeteo.
NOTA: En este trabajo, el rhPD-L1 biotinilado a 4 μg/mL dio como resultado aproximadamente el 50% de la señal máxima de MFI medida en la evaluación de acoplamiento anterior y se utilizó para el análisis de bloqueo de PD-1/PD-L1. - Añadir 25 μL de rhPD-L1 biotinilado (4 μg/mL) a cada pocillo de reacción, cubrir la placa de microtitulación con una lámina o un sello adhesivo de plástico e incubar a RT (18-22 °C) durante 1 h agitando en un agitador de placas orbital a 600 rpm.
- Diluya las perlas acopladas a rhPD-1 a 50.000 perlas/ml, con un volumen suficiente para 50 μl/pocillo (2.500 perlas/pocillo) más extra para acomodar las pérdidas de pipeteo.
- Retire la placa de reacción de microtitulación de 96 pocillos del agitador y retire el sello de la placa adhesiva.
- Agregue 50 μL de la mezcla de perlas acopladas a rhPD-1 a cada pocillo.
- Sellar la placa e incubar durante 1 h en la oscuridad a RT (18-22 °C) en un agitador orbital a 600 rpm.
- Transfiera la placa sellada del agitador orbital al separador de placas magnéticas durante 2 minutos para inmovilizar las perlas.
- Retire con cuidado el sellador de placas adhesivas, confirme que el imán y la placa de microtitulación estén bien unidos, invierta la placa y vierta los sobrenadantes. Golpee suavemente la placa invertida sobre una almohadilla de papel absorbente para eliminar el exceso de sobrenadante.
- Lave el exceso de reactivos de reacción de las perlas.
- Retire la placa de microtitulación del separador de placas magnéticas y agregue 150 μL de PBS-TBN a cada pocillo.
- Coloque la placa de microtitulación en el separador de placas magnéticas durante 2 minutos para inmovilizar las perlas.
- Confirme que el imán y la placa de microtitulación estén bien unidos, invierta la placa y vierta los sobrenadantes. Golpee suavemente la placa invertida sobre una almohadilla de papel absorbente para eliminar el exceso de sobrenadante.
- Repita los pasos de lavado de placas 4.11.1-4.11.3 dos veces, para un total de tres lavados con PBS-TBN. Asegúrese de que el reactivo SAPE esté preparado (abajo) antes de retirar la solución de lavado final (tercera).
- Agregue el reactivo de detección SAPE.
- Diluir la solución madre SAPE a una concentración de trabajo de 6 μg/ml en PBS-TBN; hacer un volumen suficiente para 100 μL/pocillo, más extra para acomodar las pérdidas de pipeteo.
- Agregue 100 μL/pocillo de solución de trabajo SAPE en cada pocillo de reacción y vuelva a suspender las perlas mediante pipeteo.
- Sellar la placa e incubar durante 1 h en la oscuridad a RT (18-22 °C) en un agitador orbital a 600 rpm.
- Decantar el exceso de SAPE de la reacción.
- Transfiera la placa sellada del agitador orbital al separador de placas magnéticas durante 2 minutos para inmovilizar las perlas.
- Retire con cuidado el sellador de placas adhesivas, confirme que el imán y la placa de microtitulación estén bien unidos, invierta la placa y vierta el sobrenadante. Golpee suavemente la placa invertida sobre una almohadilla de papel absorbente para eliminar el sobrenadante que contiene el exceso de SAPE.
- Lave el exceso de SAPE de las cuentas.
- Retire la placa de microtitulación del soporte magnético de la placa.
- Agregue 150 μL de PBS-TBN a cada pocillo para resuspender las perlas.
- Coloque la placa de microtitulación en el separador de placas magnéticas durante 2 minutos para inmovilizar las perlas.
- Confirme que el imán y la placa de microtitulación estén bien unidos, invierta la placa y vierta el sobrenadante. Golpee suavemente la placa invertida sobre una almohadilla de papel absorbente para eliminar el exceso de sobrenadante.
- Realice dos pasos de lavado adicionales con PBS-TBN para un total de tres lavados repitiendo los pasos 4.15.1-4.15.4. Tenga preparados los anticuerpos de detección secundaria conjugados con BV421 (siguiente paso) antes de retirar la (tercera) solución de lavado final.
- Agregue los anticuerpos secundarios congominados con BV421.
- Diluir la IgG antihumana congugada con BV421 (para detectar anticuerpos de control humanizados) y la IgG anticonejo congugada con BV421 (para detectar anticuerpos policlonales inducidos por PDL1-Vaxx) (consulte la Tabla de materiales) 1:400 en tampón de lavado/ensayo a volúmenes suficientes para usar 100 μL/pocillo de cada uno, con un extra para acomodar las pérdidas de pipeteo.
- Añadir 100 μL de IgG antihumana conjugada con BV421 diluida o IgG anticonejo conjugada con BV421 a los pocillos apropiados.
- Sellar la placa e incubar durante 1 h en la oscuridad a RT (18-22 °C) en un agitador orbital a 600 rpm.
- Decantar el exceso de anticuerpos secundarios conjugados con BV421 de las perlas.
- Transfiera la placa sellada del agitador orbital al separador de placas magnéticas durante 2 minutos para inmovilizar las perlas.
- Retire con cuidado el sellador de placas adhesivas, confirme que el imán y la placa de microtitulación estén bien unidos, invierta la placa y vierta el sobrenadante. Golpee suavemente la placa invertida sobre una almohadilla de papel absorbente para eliminar el sobrenadante que contiene el exceso de anticuerpos secundarios conjugados con BV421.
- Lave el exceso de anticuerpos secundarios conjugados con BV421 de las perlas.
- Agregue 150 μL de PBS-TBN a cada pocillo para resuspender las perlas.
- Coloque la placa de microtitulación en el separador de placas magnéticas durante 2 minutos para inmovilizar las perlas.
- Confirme que el imán y la placa de microtitulación estén bien unidos, invierta la placa y vierta el sobrenadante. Golpee suavemente la placa invertida sobre una almohadilla de papel absorbente para eliminar el exceso de sobrenadante.
- Realice tres pasos de lavado adicionales con PBS-TBN para un total de cuatro lavados repitiendo los pasos 4.19.1-4.19.3.
- Después de retirar el último (cuarto) tampón de lavado, retire la placa de microtitulación del separador de placas magnéticas y vuelva a suspender las perlas en 100 μL PBS-TBN/pocillo con una pipeta.
- Analiza los resultados.
- Lea la placa en el sistema de análisis de flujo de doble reportero para determinar el MFI de cada reacción utilizando los siguientes ajustes del instrumento: volumen de aspiración = 50 μL; número mínimo de cuentas = 100 cuentas; ajuste de tiempo de espera = 40 s; Gate: 7.000-17.000; modo de funcionamiento = Dual Reporter.
- Con el sistema de doble reportero, asegúrese de que el canal reportero 1 mida la fluorescencia PE naranja (cantidad de rhPD-L1 unida a perlas conjugadas rhPD-1) y el canal reportero 2 mida la fluorescencia azul BV421 (cantidad de anticuerpo de bloqueo unido a rhPD-L1).
- Ejecute pozos duplicados para cada condición y promedie los dos valores de MFI de salida para cada condición antes de realizar más cálculos y gráficos de datos.
- Estandarice el valor de MFI de cada muestra al control negativo y calcule el porcentaje de inhibición para cada muestra:
% de inhibición = (100 × [IMF de control negativo − MFI de muestra])/MFI de control negativo
NOTA: Los valores de MFI de control negativo (sin inhibición) son los valores más altos; la MFI de la señal PD-L1 unida es del 100%, y la inhibición de la unión de rhPD-L1 a rhPD-1 se define como 0%.
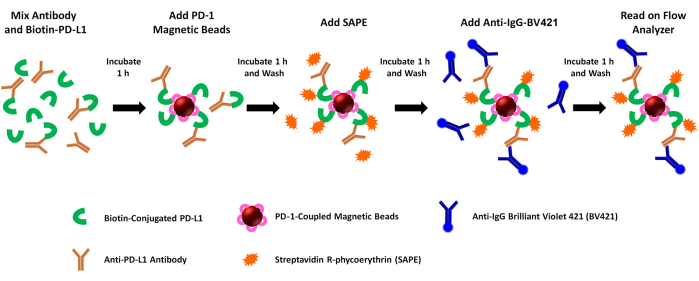
Figura 1: Esquema del ensayo de bloqueo PD-1/PD-L1 de doble reportero. La PD-L1 humana recombinante biotinilada (rhPD-L1) se preincuba con anticuerpos anti-PDL1 inducidos por PDL1-Vaxx seleccionados antes de combinarse con perlas magnéticas acopladas a rhPD-1 para permitir la formación del complejo de puntos de control PD-1/PD-L1. A continuación, se detecta el complejo rhPD-L1 y se marca mediante la adición de ficoeritrina acoplada a estreptavidina (SAPE, fluoróforo naranja). Los anticuerpos contra los epítopos de PDL1-Vaxx se dirigen a rhPD-L1 que se ha acomplejado con rhPD-1 preacoplado a las perlas magnéticas, y se iluminan utilizando un anticuerpo secundario conjugado con violeta brillante 421 (BV421, fluoróforo azul). Tanto los anticuerpos biotinilados rhPD-L1 que forman complejos con PD-1 (señal PE) como los anticuerpos anti-PDL1 que reconocen y se unen a rhPD-L1 (señal BV421) se analizan simultáneamente utilizando un instrumento citométrico de flujo reportero dual que interroga muestras de ambos fluoróforos en dos canales reporteros separados. Los valores de salida de cada muestra son la intensidad media de fluorescencia de cada fluoróforo. A continuación, se extrapola la inhibición de la formación del complejo PD1/PD-L1 por diferentes anticuerpos inducidos por PDL1-Vaxx comparando las señales experimentales con las generadas utilizando un anticuerpo monoclonal de control negativo que no se une a rhPD-L1 (0% de inhibición). Haga clic aquí para ver una versión más grande de esta figura.
Resultados
El ensayo fue capaz de cuantificar con precisión la inhibición de la interacción PD-1/PD-L1 por cuatro anticuerpos policlonales únicos, generados contra los péptidos de la vacuna rhPD-L1, que se están explorando como posibles agentes terapéuticos contra el cáncer. El esquema de este ensayo se proporciona en la Figura 1. La cantidad de rhPD-L1 biotinilada que se unió a las perlas conjugadas con rhPD-1 y la inhibición de esta unión por los cuatro candidatos a anticuerpos inducidos por PLD1-Vaxx se midió en Reporter Channel 1 utilizando un reactivo de detección de estreptavidina-PE que se unió directamente a rhPD-L1 (Figura 2).
Los cuatro anticuerpos policlonales anti-péptido PDL1 bloquearon la interacción de rhPD-L1 con PD-1 que había sido inmovilizada en microesferas en grados variables. El porcentaje de inhibición de los diferentes anticuerpos anti-péptidos PDL1 osciló entre el 48% y el 74% a la concentración máxima ensayada de 1.000 μg/mL. El anticuerpo monoclonal de control positivo atezolizumab logró un bloqueo del 92% de la interacción PD-1/PD-L1 a la concentración máxima probada14 de 4 μg/mL (Figura 2). Todos los anticuerpos experimentales PDL1-Vaxx mostraron una inhibición dependiente de la concentración de la unión de rhPD-L1 a las perlas conjugadas de rhPD-1 en comparación con trastuzumab, el anticuerpo de control negativo que no se esperaba que interactuara con el sistema PD-1/PD-L1.
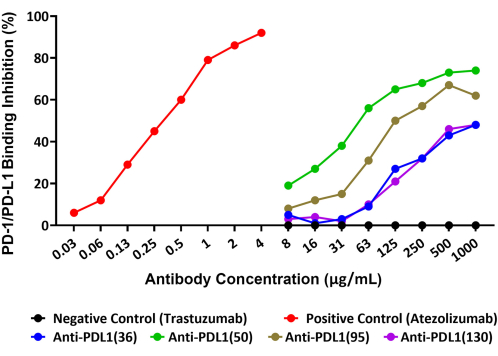
Figura 2: Bloqueo de la interacción de rhPD-L1 con rhPD-1 acoplado a perlas magnéticas por anticuerpos anti-péptido PDL1, como se muestra en un nuevo inmunoensayo basado en perlas fluorescentes. La PD-1 humana recombinante se acopló a microesferas magnéticas, y las perlas se incubaron con rhPD-L1 biotinilado que había sido preincubado con diferentes anticuerpos anti-péptido PDL1. Se utilizó un reactivo de detección de estreptavidina-ficoeritrina para unir la biotina y, por lo tanto, evaluar la cantidad relativa de rhPD-L1 que estaba disponible para unirse a PD-1. Se probaron anticuerpos policlonales criados en conejos contra las vacunas peptídicas PDL1 (anti-PDL1[36], anti-PDL1[50], anti-PDL1[95] y anti-PDL1[130]) para determinar su actividad inhibitoria y mostraron un bloqueo del 48%-74% de las interacciones recombinantes PD-1/PD-L1 en la concentración más alta probada. Se utilizó atezolizumab (un anticuerpo monoclonal anti-PDL1 diferente) como control positivo. El anticuerpo monoclonal comercial trastuzumab (anti-HER2) no relacionado se utilizó como control negativo. Esta figura es una adaptación de Guo et al.14. Haga clic aquí para ver una versión más grande de esta figura.
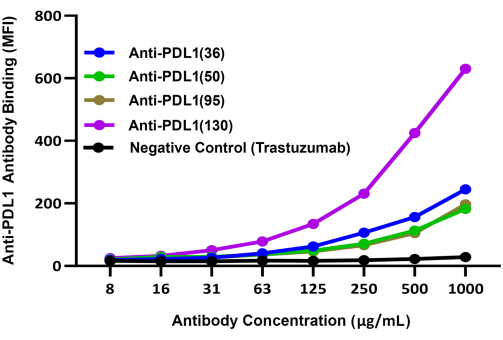
Figura 3: Comparativa de la unión de diferentes anticuerpos inducidos por PDL1-Vaxx a rhPD-L1 complejados con perlas magnéticas recubiertas de rhPD1. Se utilizó un anticuerpo de detección secundaria conjugado con 421 violeta brillante para comparar la unión de diferentes anticuerpos policlonales anti-péptido PDL1 de conejo a rhPD-L1 a través de perlas recubiertas de rhPD-1. La señal de fluorescencia azul BV421 se registró en el canal 2 del instrumento de doble reportero; esta señal se correlaciona con la eficiencia de unión relativa de los anticuerpos experimentales anti-péptido PDL1. Trastezumab (anti-HER2), un anticuerpo monoclonal que se dirige a un punto de control diferente al de PD-1/PD-L1, se utilizó como control negativo. MFI representa la intensidad media media de fluorescencia de las perlas, que se midió en pocillos de reacción duplicados por condición. Esta figura es una adaptación de Guo et al.14. Haga clic aquí para ver una versión más grande de esta figura.
Se compararon las capacidades relativas de los cuatro anticuerpos candidatos experimentales inducidos por PDL1-Vaxx para unirse a rhPD-L1 utilizando un sistema de detección separado (IgG anti-conejo conjugada BV421) que se evaluó en el segundo canal reportero del instrumento. Estos resultados indicaron que los cuatro anticuerpos policlonales anti-péptido PDL1 se unieron a rhPD-L1 de una manera dependiente de la concentración14 (Figura 3). El anticuerpo anti-PDL1(130) mostró la señal de unión a rhPDL1 más alta de los cuatro candidatos a anticuerpos inducidos por PDL1-Vaxx.
Discusión
El propósito de la inmunoterapia contra el cáncer relacionada con puntos de control es interrumpir la interacción entre las proteínas de puntos de control y sus ligandos importantes en la supervivencia y progresión del tumor2. Este grupo de investigación está desarrollando activamente nuevas vacunas PD-1 y PD-L1 que provocan una respuesta de anticuerpos que se dirige e interrumpe el punto de control PD-1/PD-L1 3,8,13,14. Anteriormente, se realizaron dos variaciones de ensayos de inmunoabsorción enzimática (ELISA) para evaluar los efectos de los anticuerpos anti-péptido PDL1 en la inhibición de la interacción recombinante PD1/PD-L114. (1) En la primera variante, rhPD-L1 se recubrió en una placa de microtitulación y, a continuación, la placa se incubó con anticuerpos diluidos inducidos por el candidato a vacuna anti-PDL1. A continuación, se evaluó la inhibición de la interacción PD-1/PD-L1 recombinante por parte de los anticuerpos mediante la adición de rhPD-1 biotinilado y la cuantificación de la unión al rhPD-L1 inmovilizado utilizando un conjugado estreptavidina-peroxidasa de rábano picante y un sustrato colorimétrico. Lo definimos como el ensayo de bloqueo directo. (2) En la segunda variante, PD-1 se recubrió en la placa de microtitulación. La rhPD-L1 biotinilada se preincubó con cada uno de los anticuerpos policlonales inducidos por el candidato anti-PLD1 en tubos de reacción separados. A continuación, se añadieron las mezclas rhPDL1/anti-PDL1 a los pocillos de placa que contenían rhPD-1 inmovilizado y se les permitió reaccionar. Cualquier rhPDL1 que reaccionara con el rhPD-1 inmovilizado en presencia de los anticuerpos inducidos por PDL1-Vaxx potencialmente bloqueantes se detectó con la posterior incubación de estreptavidina-HRP y sustrato colorimétrico. Lo definimos como el ensayo de bloqueo inverso.
El bloqueo inverso de la interacción recombinante PD-1/PD-L1 por anticuerpos anti-péptido PDL1 mostró inhibición de la señal (es decir, bloqueo de PD-1/PD-L1) de forma dependiente de la concentración de anticuerpos14, mientras que el enfoque de bloqueo directo no proporcionó resultados consistentes (no mostrado). El ensayo de bloqueo de doble reportero basado en perlas se desarrolló para verificar los resultados de ELISA e investigar el bloqueo de la interacción PD-1/PD-L1 en una fase fluida, lo que elimina los posibles problemas de disponibilidad de epítopos de unión / obstáculo estérico asociados con la inmovilización de proteínas recombinantes en fondos de pozos. El análisis de microesferas se correlacionó directamente con los resultados de bloqueo de ELISA mediante el ensayo de bloqueo inverso (Figura 2). Además, los inmunoensayos basados en fluorescencia pueden proporcionar una sensibilidad mejorada del ensayo y un rango dinámico ampliado en comparación con los ELISA colorimétricos18 y, además, el ensayo basado en perlas multiplexadas permite la realización simultánea de dos inmunoensayos independientes dentro de una sola reacción. El sulfo-NHS y el EDC utilizados para el acoplamiento covalente de las microesferas a rhPD-1 podrían haber dado lugar a las diferencias de rendimiento observadas entre los ensayos de bloqueo directo y bloqueo inverso y las diferencias observadas en la sensibilidad entre los ensayos de interacción PD-1/PD-L1 recombinante basados en perlas de ELISA y Luminex. Se justifica una mayor investigación a nivel químico y molecular para estudiar los posibles mecanismos responsables de estas diferencias.
Tanto el ELISA14 como los ensayos basados en perlas demuestran que los anticuerpos anti-PDL1 inducidos por PDL1-Vaxx pueden inhibir la formación del complejo de puntos de control PD1/PD-L1. El PDL1-Vaxx basado en péptidos induce con éxito anticuerpos anti-PDL1 que pueden bloquear la interacción PD-1/PD-L1. Este enfoque puede servir como una estrategia terapéutica novedosa para el tratamiento del cáncer, como lo respaldan los estudios preclínicos en animales 3,13,14. Los ensayos clínicos planificados determinarán la eficacia de la PDL1-Vaxx para la inmunoterapia de puntos de control y el control de la enfermedad en pacientes con cáncer.
Divulgaciones
Pravin T.P. Kaumaya es consultor de Imugene, Ltd.
Agradecimientos
Los autores agradecen a Sherry Dunbar PhD, MBA de Luminex Corporation (Austin, TX) por su apoyo a la investigación y a Matthew Silverman PhD de Biomedical Publishing Solutions (Ciudad de Panamá, FL; mattsilver@yahoo.com) por su asistencia científica y de redacción. Este trabajo fue apoyado por premios a Pravin T. P. Kaumaya de los Institutos Nacionales de Salud (R21 CA13508 y R01 CA84356) e Imugene Ltd, Sydney, Australia (OSU 900600, GR110567 y GR124326).
Materiales
| Name | Company | Catalog Number | Comments |
| Buffers | |||
| Activation Buffer: 0.1 M NaH2PO4, pH 6.2 | Millipore/Sigma | S3139 | |
| Assay/Wash Buffer: PBS-TBN (1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3) | Millipore/Sigma | P3563 (PBS+Tween20), A7888 (Bovine serum albumin), S8032 (sodium azide) | |
| Coupling Buffer: 50 mM 2-morpholinoethanesulfonic acid (MES), pH 5.0 | MilliporeSigma | M2933 | |
| Coupling Reagents | |||
| 1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC) | ThermoFisher Scientific (Waltham, MA) | 77149 | |
| xMAP Antibody Coupling Kit (if desired), includes: | Luminex Corp. (Austin, TX) | 40-50016 | |
| EDC, 10 mg | |||
| sNHS solution, 250 µL | |||
| Activation/Coupling Buffer: 0.1 M 2-morpholinoethanesulfonic acid (MES), pH 6.0 | |||
| Wash Buffer: 1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3 (PBS-TBN) | |||
| Sulfo-NHS (N-hydroxysulfosuccinimide) | ThermoFisher Scientific (Waltham, MA) | 24510 | |
| Instrumentation and Ancillary Lab Supplies | |||
| xMAP INTELLIFLEX (dual-reporter instrument) | Luminex Corp. (Austin, TX) | INTELLIFLEX-DRSE-RUO | |
| Low protein-binding round bottom 96-well plate | ThermoFisher Scientific (Waltham, MA) | 07-200-761 | |
| Luminex Magnetic Plate Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0269-01 | |
| Luminex Magnetic Tube Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0288-01 | |
| MagPlex Microspheres (magnetic, fluorescent, 6.5-µm-diameter beads) | Luminex Corp. (Austin, TX) | MC-1**** (varies by bead label) | |
| Protein LoBind microcentrifuge tubes | ThermoFisher Scientific (Waltham, MA) | 022431081 | |
| Peptides, Antibodies, & Detection Reagents | |||
| Atezolizumab (humanized anti-PDL1 IgG1 monoclonal antibody), positive control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) | |
| Biotinylated recombinant human PDL1 | Sino Biological (Wayne, PA) | 10084-H49H-B | |
| Brilliant Violet 421-congugated donkey anti-human IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 709-675-149 | |
| Brilliant Violet 421-congugated donkey anti-rabbit IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 711-675-152 | |
| Recombinant human PD-1 (poly-histidine tagged) | Acro Biosystems (Newark, DE) | PD1-H5256 | |
| Streptavidin-conjugated R-phycoerythrin (SAPE) | Agilent (Santa Clara, CA) | PJRS34-1 | |
| Trastuzumab (Herceptin, humanized anti-HER2 monoclonal antibody), negative control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) |
Referencias
- Kaumaya, P. T. B-cell epitope peptide cancer vaccines: a new paradigm for combination immunotherapies with novel checkpoint peptide vaccine. Future Oncology. 16 (23), 1767-1791 (2020).
- Pandey, P., et al. Revolutionization in cancer therapeutics via targeting major immune checkpoints PD-1, PD-L1 and CTLA-4. Pharmaceuticals. 15 (3), 335 (2022).
- Guo, L., Overholser, J., Good, A. J., Ede, N. J., Kaumaya, P. T. P. Preclinical studies of a novel human PD-1 B-cell peptide cancer vaccine PD1-Vaxx from BALB/c mice to beagle dogs and to non-human primates (cynomolgus monkeys). Frontiers in Oncology. 12, 826566 (2022).
- Brahmer, J. R., Hammers, H., Lipson, E. J. Nivolumab: Targeting PD-1 to bolster antitumor immunity. Future Oncology. 11 (9), 1307-1326 (2015).
- Shah, N. J., Kelly, W. J., Liu, S. V., Choquette, K., Spira, A. Product review on the Anti-PD-L1 antibody atezolizumab. Human Vaccines & Immunotherapeutics. 14 (2), 269-276 (2018).
- Postow, M. A., Sidlow, R., Hellmann, M. D. Immune-related adverse events associated with immune checkpoint blockade. The New England Journal of Medicine. 378 (2), 158-168 (2018).
- Kaumaya, P. T. A paradigm shift: Cancer therapy with peptide-based B-cell epitopes and peptide immunotherapeutics targeting multiple solid tumor types: Emerging concepts and validation of combination immunotherapy. Human Vaccines & Immunotherapeutics. 11 (6), 1368-1386 (2015).
- Guo, L., Kaumaya, P. T. P. First prototype checkpoint inhibitor B-cell epitope vaccine (PD1-Vaxx) en route to human Phase 1 clinical trial in Australia and USA: Exploiting future novel synergistic vaccine combinations. British Journal of Cancer. 125 (2), 152-154 (2021).
- Dakappagari, N. K., Douglas, D. B., Triozzi, P. L., Stevens, V. C., Kaumaya, P. T. Prevention of mammary tumors with a chimeric HER-2 B-cell epitope peptide vaccine. Cancer Research. 60 (14), 3782-3789 (2000).
- Dakappagari, N. K., et al. Conformational HER-2/neu B-cell epitope peptide vaccine designed to incorporate two native disulfide bonds enhances tumor cell binding and antitumor activities. The Journal of Biological Chemistry. 280 (1), 54-63 (2005).
- Kaumaya, P. T., et al. Phase I active immunotherapy with combination of two chimeric, human epidermal growth factor receptor 2, B-cell epitopes fused to a promiscuous Tcell epitope in patients with metastatic and/or recurrent solid tumors. Journal of Clinical Oncology. 27 (31), 5270-5277 (2009).
- Bekaii-Saab, T., et al. Phase I immunotherapy trial with two chimeric HER-2 B-cell peptide vaccines emulsified in montanide ISA 720VG and Nor-MDP adjuvant in patients with advanced solid tumors. Clinical Cancer Research. 25 (12), 3495-3507 (2019).
- Kaumaya, P. T. P., Guo, L., Overholser, J., Penichet, M. L., Bekaii-Saab, T. Immunogenicity and antitumor efficacy of a novel human PD-1 B-cell vaccine (PD1-Vaxx) and combination immunotherapy with dual trastuzumab/pertuzumab-like HER-2 B-cell epitope vaccines (B-Vaxx) in a syngeneic mouse model. Oncoimmunology. 9 (1), 1818437 (2020).
- Guo, L., Overholser, J., Darby, H., Ede, N. J., Kaumaya, P. T. P. A newly discovered PD-L1 B_cell epitope peptide vaccine (PDL1-Vaxx) exhibits potent immune responses and effective anti-tumor immunity in multiple syngeneic mice models and (synergizes) in combination with a dual HER-2 B-cell vaccine (B-Vaxx). Oncoimmunology. 11 (1), 2127691 (2022).
- . Luminex Corporation. The xMAP® Cookbook, 5th edition Available from: https://info.luminexcorp.com/en-us/research/download-the-xmap-cookbook?utm_referrr=https%3A%2F%2Fwww.luminexcorp.com%2F (2022)
- MagPlex® Microspheres Documentation. Product information sheet. Luminex Corporation Available from: https://www.luminexcorp.com/magplex-microspheres/#overview (2014)
- Green, M. R., Sambrook, J. . Estimation of cell number by hemocytometry counting. 2019 (11), (2019).
- Selecting the Detection System - Colorimetric, Fluorescent, Luminescent Methods for ELISA Assays. Corning Inc Available from: https://www.corning.com/catalog/cls/documents/application-notes/CLS-DD-AN-458.pdf (2019)
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados