In vitro Modelo de vaso humano fetal en chip para estudiar la mecanobiología del desarrollo
En este artículo
Resumen
Aquí se describe un flujo de trabajo simple para diferenciar las células endoteliales de las células madre pluripotentes humanas, seguido de un protocolo detallado para su estimulación mecánica. Esto permite el estudio de la mecanobiología del desarrollo de las células endoteliales. Este enfoque es compatible con los ensayos posteriores de células vivas recogidas del chip de cultivo después de la estimulación mecánica.
Resumen
El corazón es el primer órgano que se establece funcionalmente durante el desarrollo, iniciando así la circulación sanguínea muy temprano en la gestación. Además de transportar oxígeno y nutrientes para asegurar el crecimiento fetal, la circulación fetal controla muchos eventos cruciales del desarrollo que tienen lugar dentro de la capa endotelial a través de señales mecánicas. Las señales biomecánicas inducen cambios estructurales en los vasos sanguíneos, establecen la especificación arteriovenosa y controlan el desarrollo de células madre hematopoyéticas. La inaccesibilidad de los tejidos en desarrollo limita la comprensión del papel de la circulación en el desarrollo humano temprano; Por lo tanto, los modelos in vitro son herramientas fundamentales para el estudio de la mecanobiología de los vasos. En este trabajo se describe un protocolo para diferenciar células endoteliales de células madre pluripotentes inducidas humanas y su posterior siembra en un dispositivo fluídico para estudiar su respuesta a señales mecánicas. Este enfoque permite el cultivo a largo plazo de células endoteliales bajo estimulación mecánica, seguido de la recuperación de las células endoteliales para su caracterización fenotípica y funcional. El modelo in vitro establecido aquí será fundamental para dilucidar los mecanismos moleculares intracelulares que transducen la señalización mediada por señales mecánicas, que en última instancia orquestan el desarrollo de los vasos durante la vida fetal humana.
Introducción
Durante el desarrollo embrionario, el corazón es el primer órgano en establecer la funcionalidad1, con contracciones detectables desde la etapa más temprana de la formación del tubo endocárdico2. La circulación, junto con las señales mecánicas mediadas por el flujo de sangre dentro del vaso, controla muchos aspectos cruciales del desarrollo temprano. Antes del establecimiento de la circulación fetal, la vasculatura se organiza en un plexo capilar primario; Al funcionar cardíacamente, este plexo se reorganiza en vasculatura venosa y arterial3. El papel de las señales mecánicas en la especificación arteriovenosa se refleja en la expresión panendotelial de los marcadores arteriales y venosos antes del inicio del flujo sanguíneo4.
Las fuerzas hemodinámicas no solo controlan el desarrollo de la vasculatura en sí, sino que también juegan un papel fundamental en el control de la formación de células sanguíneas. Las células madre y progenitoras hematopoyéticas (HSPC) emergen de células endoteliales especializadas llamadas endotelio hemogénico 5,6,7,8, presentes en diferentes regiones anatómicas de los embriones exclusivamente en la etapa temprana del desarrollo. Los modelos con deficiencia cardíaca, junto con los modelos in vitro, han demostrado que las señales mecánicas instruyen y aumentan la producción de HSPC del endotelio hemogénico 9,10,11,12,13,14.
Se ha demostrado que diferentes tipos de dinámica de flujo controlan diferencialmente el ciclo celular 15, lo que se sabe que es importante tanto en el endotelio hemogénico16,17 como en la especificación de células arteriales18. En conjunto, las señales mecánicas son determinantes críticos de la identidad y función celular durante el desarrollo. Los nuevos dispositivos fluídicos in vitro nos permiten superar las limitaciones que conlleva el estudio de la mecanobiología del desarrollo durante el desarrollo de la sangre humana in vivo.
El objetivo general del protocolo en este manuscrito es describir, paso a paso, la línea experimental para estudiar el efecto del estrés cortante en las células endoteliales humanas derivadas in vitro de células madre pluripotentes inducidas humanas (hiPSC). Este protocolo contiene instrucciones detalladas sobre la diferenciación de las hiPSC en células endoteliales y su posterior siembra en chips fluídicos para el protocolo de estimulación. Con esto, se puede probar la capacidad de diferentes células endoteliales derivadas in vitro para detectar el esfuerzo cortante mediante el análisis de su orientación en respuesta al flujo. Esto permitirá a otros laboratorios abordar preguntas sobre la respuesta al estrés de cizallamiento y sus consecuencias funcionales en diferentes identidades de células endoteliales.
Protocolo
NOTA: Todas las técnicas de cultivo celular deben realizarse en condiciones estériles en una campana de flujo laminar y las células deben incubarse a 37 °C en una atmósfera humificada con 5% de CO2. Las instrucciones para toda la preparación de citocinas tanto para el mantenimiento (rhbFGF) como para el protocolo de diferenciación (rhBMP4, rhVEGF, rhbFGF, rhIL6, rhFLT3L, rhIGF1, rhIL11, rhSCF, rhEPO, rhTPO, rhIL3) se encuentran en la Tabla Suplementaria S1.
1. Cultivo de hiPSCs: descongelación, mantenimiento y congelación de células
- Preparación de medios de mantenimiento, factores de crecimiento y otros reactivos
- Prepare el medio de cultivo añadiendo el suplemento de medio libre de suero de hESCs entero, 36 mL de 25% de albúmina sérica bovina (BSA) y 1 mL de 55 mM de β-mercaptoetanol al medio basal Modified Eagle Medium/F12 (DMEM/F-12) de Dulbecco (ver Tabla de Materiales).
- Resuspender 1 mg de inhibidor de la Rho quinasa (iRock) en 1 mL de DMSO, hacer alícuotas de 50 μL y almacenarlas a -20 °C.
NOTA: Estas alícuotas pueden mantenerse a -20 °C durante 1 año. Una vez descongelados, se pueden mantener a 4 °C durante 1 semana. - Descongelar la solución de vitronectina (VTN-N) en hielo y alícuota 60 μL por vial antes de almacenarla a -80 °C. Justo antes de recubrir las placas, diluir el caldo de 60 μL en 6 ml de solución salina tamponada con fosfato (DPBS) de Dulbecco; la concentración final de 5 μg/mL.
- Descongelación de líneas celulares hiPSC
NOTA: La línea de células madre pluripotentes humanas SFCi55 se derivó previamente internamente y se utilizó ampliamente para la diferenciación en varios tipos de células y diferentes linajes embrionarios 19,20,21,22.- Cubrir un pocillo de una placa de 6 pocillos con 1 ml de solución de VTN-N durante 1 h a 37 °C.
NOTA: Después de la incubación, las placas recubiertas pueden almacenarse a 4 °C durante un máximo de 1 semana. - Aspirar la solución de VTN-N con una pipeta de aspiración y añadir 1 mL de medio de cultivo precalentado suplementado con 20 ng/mL de rhbFGF (Tabla suplementaria S1).
- Descongele rápidamente el vial que contiene las hiPSC en un baño de agua y transfiera la célula a 5 ml de medio de cultivo precalentado.
- Girar las celdas hacia abajo durante 3 minutos a 300 × g a temperatura ambiente.
- Resuspender el gránulo celular en 0,5 mL de medio de cultivo suplementado con 20 ng/mL de rhbFGF.
- Transfiera las células a un pocillo recubierto que contenga ya 1 ml de medio.
- Añadir 5 μL de iRock en los pocillos que contienen las células en un total de 1,5 mL de medio.
- Cultive las células en la incubadora, cambie el medio diariamente durante la semana y alimente dos veces las células, agregando el doble del volumen normal de medio a las células para garantizar la alimentación durante el fin de semana.
NOTA: Las células se cultivan en presencia de iRock solo durante 24 h.
- Cubrir un pocillo de una placa de 6 pocillos con 1 ml de solución de VTN-N durante 1 h a 37 °C.
- Mantenimiento y paso de hiPSCs
- Cambie el medio diariamente con medio de cultivo fresco precalentado suplementado con 20 ng/ml de rhbFGF.
- Pasar las células cuando alcancen aproximadamente el 80% de confluencia, generalmente dos veces por semana.
- Para pasar las células, recubra una placa con VTN-N como se describió anteriormente en los pasos 1.2.1 y 1.2.2.
- Aspire el medio de los pocillos con celdas y lávelos con DPBS.
- Aspirar el DPBS y añadir 1 mL de reactivo de disociación (ver Tabla de Materiales) e incubar durante 1 min.
- Aspirar el reactivo de disociación e incubar durante 3 minutos más. Golpee firmemente el plato 10 veces en cada lado.
NOTA: El paso de disociación puede necesitar una optimización específica del tipo de célula en el tiempo de incubación y el procedimiento de roscado. - Añadir 1 mL de medio de cultivo a las células y con una pipeta Pasteur, lavar una vez con el medio para asegurar que se recogen la mayor parte de las colonias.
- Agregue 150 μL de la suspensión celular a cada pocillo para proporcionar una relación de paso de 1 pocillo a 6.
NOTA: Inmediatamente después de descongelar un nuevo vial, es mejor pasar las células en una proporción más baja, como 1:1 o 1:2 durante uno o dos pases para permitirles alcanzar una fase de crecimiento constante antes de pasar a una proporción de 1:6. - Cultive las células en la incubadora, cambie el medio diariamente durante la semana y alimente dos veces las células una vez durante el fin de semana.
- Congelación de líneas celulares hiPSCs
NOTA: Congele las células dentro de sus dos primeros pasos después de la descongelación para asegurarse de mantener un lote constante de viales congelados de bajo paso para comenzar el cultivo. Congelar las células cuando alcancen una confluencia de aproximadamente el 80%.- Cambie el medio por medio de cultivo fresco precalentado suplementado con 20 ng/ml de rhbFGF y 5 μl de iRock e incube durante al menos 1 h.
- Separe las celdas como se describe en los pasos 1.3.2.2-1.3.2.5.
- Recoja las células desprendidas en un tubo de centrífuga de 15 ml que contenga 5 ml de medio de cultivo.
- Centrifugar durante 3 min a 300 × g a temperatura ambiente.
- Aspirar el sobrenadante y añadir 1 mL de solución de criopreservación (ver Tabla de Materiales).
- Con una pipeta Pasteur, pipetee suavemente las células hacia arriba y hacia abajo para mezclarlas en la solución de criopreservación.
NOTA: Evite el pipeteo excesivo, que podría dar lugar a la disociación de los grupos de células. - Divida la suspensión celular en dos viales de criopreservación de 0,5 ml cada uno.
- Transfiera los viales de criopreservación a un recipiente de criopreservación preenfriado a 4 °C.
- Transfiera el recipiente con las celdas a un congelador a -80 °C durante 24 h antes de transferir los viales a nitrógeno líquido para su almacenamiento a largo plazo.
2. Diferenciación de las hiPSCs en células endoteliales
- Preparación del medio de diferenciación, citocinas y factores de crecimiento
- Preparar medio de diferenciación libre de suero (SFD) de acuerdo con la Tabla 1. Utilice este medio desde el día 0 hasta el día 5 de diferenciación.
- Prepare un medio libre de suero para células CD34+ (SFM-34) agregando 34 suplementos de nutrientes y 5 mL de suplemento de L-glutamina al medio basal 34 SFM (ver Tabla de Materiales). Utilice este medio a partir del día 6 de diferenciación.
- Resuspender 1 mg de CHIR99021 en 716 μL de DMSO para obtener una solución de 3 mM. Incubar a temperatura ambiente hasta que se vuelva a suspender por completo; si es necesario, calentar rápidamente a 37 °C. Prepare alícuotas de 20 μL y guárdelas a -20 °C durante un máximo de 6 meses. Úselo inmediatamente después de descongelarlo y no vuelva a congelarlo ni lo almacene.
- Vuelva a suspender las citocinas de acuerdo con las instrucciones de la Tabla Suplementaria S1. Almacenar todas las alícuotas de las citocinas a -80 °C.
- Diferenciación de células endoteliales
NOTA: Para cada día de diferenciación, prepare 18 mL (3 mL de medio/pocillo) de medio SFD precalentado, de acuerdo con las mezclas de citocinas descritas en el Cuadro 2.- Día 0 - formación de cuerpos embrioides (EBs)
- Prepare 18 mL de medio SFD con la citocina Mix 1 de acuerdo con la Tabla 2, para cada placa de 6 pocillos (3 mL/pocillo).
- Agregue 2 ml de medio SFD precalentado con citocina Mix 1 en cada pocillo de una placa de 6 pocillos repelente de células (consulte la Tabla de materiales).
- Para formar EB, siga los pasos descritos en los pasos 1.3.2.2-1.3.2.4.
NOTA: Asegúrese de que las hiPSC sean 70-80% confluentes para iniciar la diferenciación. - Agregue 1 mL de medio SFD precalentado con citocinas Mix 1 a cada pocillo de grupos de células separadas.
- Utilice una pipeta Pasteur para transferir suavemente los grupos celulares a un solo pocillo de pocillo repelente celular para la formación de EB en una proporción de 1:1.
- Después de colocar la placa en la incubadora, muévala hacia adelante y hacia atrás, hacia la derecha y hacia la izquierda, para dispersar los EB de manera uniforme en el pozo.
- Día 1 - cambio medio en los EB
NOTA: Este paso solo es necesario si, para el día 1 de diferenciación, hay muchas células individuales en suspensión junto con los EB.- Prepare 18 mL de medio SFD con la citocina Mix 1 de acuerdo con la Tabla 2, para cada placa de 6 pocillos (3 mL/pocillo).
- Agite la placa con los EB para moverlos hacia el centro y recójalos con una pipeta Pasteur en un tubo de centrífuga de 15 ml.
NOTA: Si los EB se ven agrupados como en cadenas, sepárelos pipeteándolos hacia arriba y hacia abajo con un P1000 antes de recogerlos en el tubo de centrífuga de 15 ml. - Espere de 5 a 10 minutos para que los EB se asienten en el fondo del tubo.
NOTA: Si los EB son demasiado pequeños, centrifugérelos durante 5 minutos a 100 × g para ayudarlos a asentarse. - Lave las placas repelentes de células con agua estéril o DPBS para eliminar cualquier célula individual o residuo.
- Aspire cuidadosa y lentamente el sobrenadante de los EB sin desalojarlos.
- Agregue 2 ml de SFD con citocinas Mix 1 a cada pocillo de las placas repelentes celulares.
- Vuelva a suspender los EB usando 1 ml de medio SFD con citocinas Mix 1 para cada pocillo inicial: para una placa de 6 pocillos, agregue 6 ml de medio.
- Transfiera los EB a las placas repelentes de células en un volumen de 1 mL por pocillo, que ya contiene 2 mL de medio SFD.
- Después de colocar la placa en la incubadora, muévala hacia adelante y hacia atrás, hacia la derecha y hacia la izquierda, para dispersar los EB de manera uniforme en el pozo.
- Día 2 - adición de CHIR99021
- Gire los EB en el centro de la placa y agregue CHIR99021 de acuerdo con la Tabla 2 en el costado del pocillo para evitar el contacto directo con las celdas.
NOTA: Si el medio no se cambió en el día 1, reemplace todo el medio en lugar de agregar CHIR solo. Prepare 18 mL de medio SFD con la Mezcla 2 de acuerdo con la Tabla 2, para cada placa de 6 pocillos (3 mL/pocillo). - Después de colocar la placa en la incubadora, muévala hacia adelante y hacia atrás, hacia la derecha y hacia la izquierda, para dispersar los EB de manera uniforme en el pozo.
- Gire los EB en el centro de la placa y agregue CHIR99021 de acuerdo con la Tabla 2 en el costado del pocillo para evitar el contacto directo con las celdas.
- Día 3 - cambio medio en los EB y adición de citocinas Mix 3
- Prepare 18 mL de medio SFD con Mezcle 3 citocinas de acuerdo con la Tabla 2, para cada placa de 6 pocillos (3 mL/pocillo).
- Recoja los EB como se describe en los pasos 2.2.2.2-2.2.2.4.
- Agregue 2 ml precalentados de medio SFD con citocinas Mix 3 a las placas repelentes celulares.
- Aspire con cuidado el sobrenadante de los EB. Agregue 1 mL/pocillo de SFD con Mix 3 citocinas.
- Distribuya los EB entre los pocillos como se describe en los pasos 2.2.2.8-2.2.2.9.
- Día 6 - cambio medio para SFM-34 y adición de citocinas Mix 4
- Prepare 18 mL de medio SFD con Mezcle 4 citocinas de acuerdo con la Tabla 2, para cada placa de 6 pocillos (3 mL/pocillo).
- Recoja los EB como se describe en los pasos 2.2.2.2-2.2.2.4.
- Agregue 2 ml de medio SFM-34 precalentado con citocinas Mix 4 a las placas repelentes celulares.
- Aspire con cuidado el sobrenadante de los EB. Agregue 1 mL/pocillo de SFM-34 con la mezcla de 4 citocinas.
- Distribuya los EB entre los pocillos como se describe en los pasos 2.2.2.8-2.2.2.9.
- Día 0 - formación de cuerpos embrioides (EBs)
3. Aislamiento de células CD34+ y siembra en el chip
NOTA: Las células CD34+ se aíslan mediante un enfoque de aislamiento positivo con un kit de microesferas CD34 (consulte la Tabla de materiales), que contiene microesferas CD34 conjugadas con anticuerpos monoclonales de ratón, anticuerpos anti-CD34 humanos y reactivo de bloqueo de FcR (IgG humana). Es importante validar la eficiencia del aislamiento de la columna mediante la tinción de células antes y después del aislamiento para el análisis de citometría de flujo, a continuación se indica cuándo es necesario tomar células para este análisis.
- Preparar materiales y reactivos.
- Prepare el tampón de lavado agregando 5 ml de solución de BSA al 5% y 200 μl de EDTA 0,5 M a 45 ml de DPBS para obtener PBS + 0,5% BSA + 2 mM EDTA. Prepárese fresco para cada aislamiento, esterilie con filtro y manténgalo refrigerado hasta su uso.
- Recubra las virutas fluídicas con una solución de laminina preparada diluyendo la rhLaminin 521 1:50 en DPBS Ca 2+ Mg2+. Cubra cada viruta con el volumen adecuado para la viruta en uso e incube en la incubadora durante 2 h antes de la siembra.
NOTA: Se pueden emplear otras matrices para el recubrimiento y deben probarse para el tipo de célula / experimento específico. - Prepare el medio Mix 4 SFM-34 suplementando 18 mL de medio SFM-34 con citocinas Mix 4 de acuerdo con la Tabla 2 y coloque la mezcla en un tubo de 50 mL en la incubadora con la tapa ligeramente desenroscada para facilitar el intercambio de gases.
- Coloque los equipos de perfusión seleccionados y cualquier otro tubo que se vaya a utilizar en la incubadora para desgasificar.
- Día 8 - disociación de EBs y aislamiento de CD34+
- Recopile los EB como se describe en los pasos 2.2.2.2-2.2.2.5.
- Agregue 1 mL de reactivo de disociación celular por cada pocillo inicial de EB recolectados (si se recolectaron 6 pocillos, agregue 6 mL).
- Transfiera de nuevo 1 ml de la suspensión de EB en el reactivo de disociación celular a cada pocillo de la placa repelente celular.
- Incubar durante 10 minutos en la incubadora.
- Pipetee suavemente los EB hacia arriba y hacia abajo contra el pocillo con un P1000, no más de 10 veces.
- Repita los pasos 3.2.4-3.2.5.para un total de 3 veces.
NOTA: Si los EB son difíciles de disociar, repita los pasos anteriores 4 veces en total. - Agregue 5 ml de tampón de lavado por cada pocillo de EB disociados.
- Recoja las células en un tubo de centrífuga de 50 ml pasándolas por un colador de 40 μm. Tome 10 μL de la suspensión celular para contar las células.
NOTA: Para probar la eficiencia del aislamiento, transfiera 105 células/tubo a dos tubos diferentes (control sin tinción y muestra de prueba preclasificada) que se utilizarán posteriormente para la citometría de flujo (como se describe en los pasos 4.3.9-4.3.13). Para una placa de 6 pocillos, se deben recolectar ~ 106 celdas después de la filtración. - Girar las celdas hacia abajo durante 10 minutos a 300 × g.
- Vuelva a suspender las células en 300 μL de tampón de lavado, pipeteando suavemente unas cuantas veces para asegurarse de que no haya grumos. Continúe siguiendo el protocolo del fabricante (consulte la Tabla de materiales).
- Siembra de células CD34+ en chips fluídicos
NOTA: El chip fluídico utilizado en el protocolo tiene una altura de canal de 0,6 mm y una longitud de 50 mm, para un área de crecimiento total de 2,5cm2 (Figura suplementaria S1). Este tipo de chip se siembra con un volumen total de suspensión celular de 150 μL. Se pueden utilizar diferentes chips, y el volumen de siembra y la densidad celular deben adaptarse de acuerdo con el área de crecimiento. Es posible que se necesite una optimización adicional dependiendo de la línea celular utilizada y su crecimiento.- Resuspender las células CD34+ aisladas en 300 μL de medio SFM-34 precalentado con citocinas Mix 4.
- Tome 10 μL de la suspensión celular y cuente las células.
- Resuspender 2,5 × 105 células en un volumen final de 150 μL suplementado con SFM-34; añadir 0,5 μL de iRock.
NOTA: Para probar la eficiencia del aislamiento, transfiera 105 células/tubo a un tubo (muestra de prueba clasificada posteriormente) que se utilizará posteriormente para la citometría de flujo (como se describe en los pasos 4.3.9-4.3.13). - Aspire lentamente la laminina de las virutas fluídicas colocando la punta de un P200 dentro del depósito en el borde del canal.
NOTA: Si el líquido es difícil de recolectar, levante lentamente un lado de la viruta para ayudar a que el líquido se mueva hacia el depósito opuesto. - Agregue la suspensión celular de manera constante en el canal para asegurarse de que no se formen burbujas.
NOTA: Realice los pasos 3.3.4-3.3.5 de forma rápida pero suave para evitar que la laminina se seque y se formen burbujas en los canales de la viruta. Si se forman burbujas, levante un lado del chip y golpee suavemente el portaobjetos para movilizar las burbujas; Cuando lleguen al embalse, subirán a la interfaz aérea y no deberían poder volver a entrar en el canal. - Transfiera el chip a la incubadora y déjelos toda la noche para que las células estén completamente unidas al canal y se vean alargadas.
- Cuando las células estén completamente adheridas, aspire el medio como en el paso 3.3.4 y reemplácelo con 200 μL de SFM-34 suplementado con citocinas.
- A partir de ahora, reemplace el medio diariamente hasta que las células hayan alcanzado el 90%-100% de confluencia.
4. Aplicación de flujo continuo a las células endoteliales - Aorta-on-a-chip
- Preparar materiales y reactivos.
- Prepare el medio Mix 4 SFM-34 suplementando 18 mL de medio SFM-34 con citocinas Mix 4 de acuerdo con la Tabla 2 y colóquelo en un tubo de 50 mL en la incubadora con la tapa ligeramente desenroscada para facilitar el intercambio de gases.
- Coloque los equipos de perfusión seleccionados y cualquier tubo que se utilizará para la configuración fluídica en la incubadora para desgasificar.
- Montaje del sistema fluídico
- Instale el equipo de perfusión en la unidad de acuerdo con el protocolo del fabricante.
NOTA: Recuerde utilizar abrazaderas en el sistema. Si se utilizan abrazaderas deslizantes para este paso, deben deslizarse sobre el tubo antes de conectarlas al chip. - Coloque un nuevo chip fluídico y agregue el medio SFM-34 suplementado con citocinas, asegurándose de llenar ambos depósitos en condiciones estériles en la campana.
- Realice el programa de eliminación de burbujas y el paso de calibración.
- Retire la unidad fluídica con el conjunto conectado de la incubadora y transfiérala a la campana; Tome también las fichas que contienen las células de la incubadora.
- Sujete el tubo a ambos lados del chip de prueba.
- Retire el tubo del chip de prueba.
NOTA: Verifique que no haya burbujas en el conector Luer en el extremo de la tubería. Si hay burbujas visibles, aspire con cuidado con una pipeta P200 y, si es necesario, agregue más medio para asegurarse de que el conector esté lleno de medio. - Conecte el chip que contiene las celdas con el tubo.
- Retire o abra las abrazaderas.
- Transfiera el sistema a la incubadora y conecte la bomba de aire a la unidad de fluídicos.
- Inicie el programa preseleccionado utilizando el software dedicado a la bomba (Figura complementaria S2) con el aumento gradual del esfuerzo cortante descrito en la Tabla 3.
NOTA: Dependiendo del experimento específico que se necesite, es posible que sea necesario optimizar el programa de estimulación. Aquí se describe un aumento gradual de la tensión cortante que conduce al valor final de 5 dyn/cm2, que imita la tensión cortante calculada que experimenta la pared de la aorta dorsal al inicio de la circulación fetal 9. Independientemente del esfuerzo cortante final que se empleará, es necesario aumentar gradualmente con el tiempo para permitir que las celdas se adapten a la fuerza sin hacer que las celdas se desprendan del chip. Si el protocolo de estimulación seleccionado dura más de 3 días, las citocinas deben recargarse en el sistema añadiendo 1 ml de SFM-34 que contenga las citocinas Mix 4 que normalmente se añadirían a 18 ml. Para ello, el programa de la bomba se detiene rápidamente y se añaden 500 μL de medio suplementado a cada una de las dos jeringas del conjunto de fluidos.
- Instale el equipo de perfusión en la unidad de acuerdo con el protocolo del fabricante.
- Recolección de células para análisis
- Precalentar el tampón de disociación en un baño de agua.
- Retire la unidad fluídica de la incubadora y colóquela en la campana.
- Sujete el tubo que flanquea la viruta en ambos lados y retire el tubo de los depósitos de la viruta.
- Retire suavemente el medio del chip y reemplácelo con DPBS Ca 2+ Mg2+ para lavar las células.
NOTA: Este paso de lavado con PBS se puede omitir si las células comienzan a desprenderse. - Añadir suavemente 150 μL de tampón de disociación e incubar durante 3 min a 37 °C.
NOTA: Verifique bajo el microscopio si las células son individuales y separadas; de lo contrario, incube durante 2 minutos más. Es esencial que las células se separen completamente del canal antes de aspirar el medio, ya que el chip no permite ayudar al desprendimiento celular mediante pipeteo. Se pueden emplear otras soluciones para separar las células, como tampones basados en tripsina o EDTA. - Recoja el tampón de disociación que contiene las células de un depósito y transfiéralo a un tubo de centrífuga de 15 ml y lave el canal una vez con DPBS para recoger todas las células desprendidas.
- Agregue 1 ml de tampón de lavado al tubo de 15 ml con las células y tome 10 μl para contar las células.
- Divida la suspensión celular en tubos de citometría de flujo para tener de 10a 5 células por tubo de ensayo.
- Girar los tubos durante 5 min a 300 × g.
- Prepare la solución de tinción para tener 50 μL por cada tubo de ensayo para teñir. Añadir el CD34 PerCP-efluor710 o CD34-PE a 1:100 y 1:200 de dilución, respectivamente.
- Resuspender las células en 50 μL de solución de tinción e incubar durante 30 min a 4 °C.
- Lavar las células añadiendo 2 ml de tampón de lavado y centrifugar durante 5 min a 300 × g.
- Vuelva a suspender los gránulos en 100 μL de solución de tinción y adquiera los datos con un citómetro de flujo.
NOTA: Las células también pueden lisarse directamente en el chip para la extracción de ARN utilizando 150 μL de tampón de lisis de ARN o fijarse para la obtención de imágenes utilizando paraformaldehído al 4% en DPBS durante 10 minutos a temperatura ambiente.
- Análisis de la orientación de las células
- Analice las imágenes para cuantificar los cambios en la orientación de las celdas utilizando FIJI23 (Figura suplementaria S3).
- Abra el administrador de regiones de interés (ROI) desde el menú Analizar | Herramientas | Menú del gestor de ROI .
- Dibuje los contornos de celda manualmente con la herramienta de selección de polígonos y agréguelos al administrador de ROI haciendo clic en Agregar o usando el acceso directo CTRL+T .
- Mida la orientación de cada ROI eligiendo la medida Ajustar elipse en el menú Analizar | Menú Establecer medidas .
- Aplique la medición a todos los ROI a través de la Más... Comando de medición múltiple en el administrador de ROI.
NOTA: Este paso ajustará una elipse a cada ROI y generará una tabla que contiene la longitud de los ejes de elipse mayor y menor, así como el ángulo. - Exporte la tabla a un archivo CSV para importarla a otro software para trazarla.
NOTA: El script utilizado para los gráficos está disponible en https://gist.github.com/nicolaromano/708b3231d730ee7f70763a7cf885
0DDC.
- Analice las imágenes para cuantificar los cambios en la orientación de las celdas utilizando FIJI23 (Figura suplementaria S3).
Resultados Representativos
Describimos aquí un protocolo para la diferenciación y mecanoestimulación de células endoteliales derivadas de hiPSCs que permite el estudio de su respuesta a señales mecánicas (Figura 1). Este protocolo da como resultado la producción de células endoteliales funcionalmente mecanosensibles. Proporcionamos aquí resultados representativos y describimos el fenotipo esperado para evaluar cómo responden las células a la estimulación de citoquinas durante la diferenciación.
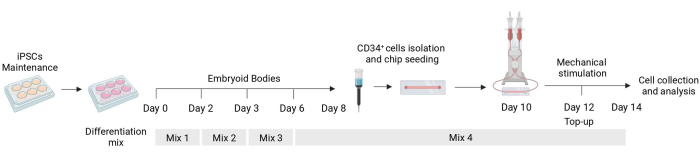
Figura 1: Esquema del protocolo de diferenciación y estimulación mecánica. Esquema del protocolo de diferenciación que muestra el momento de las diferentes mezclas de citoquinas, el aislamiento celular CD34+ , la siembra de chips fluídicos y el análisis final de las células estimuladas mecánicamente. Haga clic aquí para ver una versión más grande de esta figura.
Cultivo de las hiPSC
Es importante iniciar el protocolo a partir de hiPSCs que estén creciendo correctamente en condiciones de autorrenovación. Un buen indicador de la calidad del cultivo es la velocidad de su crecimiento. Después de la descongelación, las células pueden necesitar de 2 a 3 semanas para alcanzar la fase correcta de crecimiento que asegurará una buena diferenciación. Cuando las células pueden ser pasadas dos veces por semana en una proporción de 1:6 alcanzando una confluencia casi completa, este es el momento en que están listas para ser diferenciadas el mismo día en que necesitan ser pasadas.
Diferenciación de las hiPSCs en células endoteliales
El primer paso de la diferenciación, que consiste en la formación de cuerpos embrioides (EB), depende de la línea celular y puede necesitar cierta optimización para la línea celular específica en uso. La disociación descrita en los pasos del protocolo 1.3.2.2-1.3.2.4 puede modificarse reduciendo o ampliando la incubación con el reactivo de disociación y la posterior disociación con la pipeta de Pasteur. Además, se pueden utilizar otros reactivos de disociación para este paso, además de la disociación física de las colonias con una herramienta de corte o una punta de pipeta P100. Los EB de buena calidad muestran un borde definido en el día 2 de la diferenciación y aparecen claros y brillantes cuando se observan con un microscopio; las áreas más oscuras podrían indicar la muerte celular dentro de los EB (Figura 2).
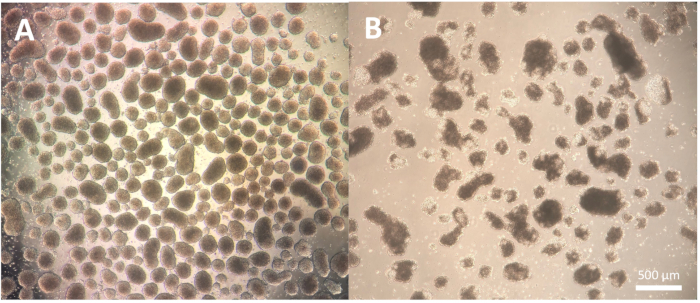
Figura 2: Morfología de los cuerpos embrioides. (A) Cuerpos embrioides del día 2 que muestran bordes externos bien definidos y tamaño constante. (B) Cuerpos embrioides de día 2 de mala calidad que muestran una muerte celular extensa que conduce a la desagregación de la estructura. Barra de escala = 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
En el día 2, la adición de CHIR99021 a los EB inhibe la proteína GSK-3, lo que resulta en la activación de la vía Wnt. Las diferentes líneas celulares tienen diferentes respuestas al tratamiento con CHIR, y esto debe probarse cuantificando el número de células CD34+ obtenidas en el día 8 mediante el uso de diferentes concentraciones (Figura 3).
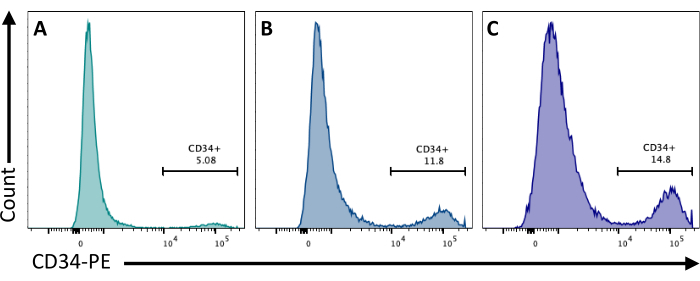
Figura 3: Diferenciación de células endoteliales con diferentes tratamientos CHIR. Compromiso de las células endoteliales cuantificado por citometría de flujo en el día 8 de diferenciación por la expresión de la membrana CD34, después del tratamiento con CHIR en el día 2 a (A) 3 μM, (B) 5 μM y (C) 7 μM. Los datos de citometría de flujo se obtuvieron utilizando citómetros de cinco láseres y un software específico (ver Tabla de materiales). Haga clic aquí para ver una versión más grande de esta figura.
Aislamiento de células CD34+
Es importante validar que el enriquecimiento de CD34+ utilizando las perlas magnéticas proporciona al menos un 80% de CD34+ después de la elución de la columna. Para garantizar una pureza suficiente, se puede analizar una alícuota de células obtenidas del aislamiento magnético mediante citometría de flujo, asegurándose de utilizar un clon de anticuerpo diferente al utilizado para el enriquecimiento magnético. En este caso, se utilizó el clon 4H11 y se logró una pureza de ~85% después del enriquecimiento (Figura 4).
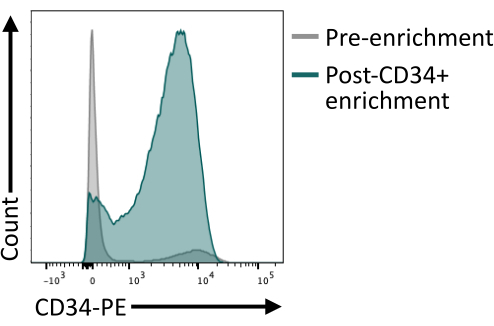
Figura 4: Expresión de CD34 en la membrana antes y después del enriquecimiento por clasificación magnética. Los cuerpos embrioides disociados del día 8 (gris) y las células después del enriquecimiento magnético (verde) se tiñeron para la expresión de CD34 y se analizaron mediante citometría de flujo, mostrando un enriquecimiento exitoso después de la clasificación. Los datos de citometría de flujo se obtuvieron utilizando citómetros de cinco láseres y un software específico (ver Tabla de materiales). Haga clic aquí para ver una versión más grande de esta figura.
Siembra de células en el canal fluídico
Al sembrar las células en el canal fluídico, es crucial realizar un seguimiento de la adhesión y proliferación de las células endoteliales. Después de la siembra, las células tardan ~5 h en adherirse completamente al canal (Figura 5A). También se puede probar una solución de recubrimiento alternativa para mejorar la adherencia en esta etapa. Para confirmar que las células analizadas son mecanosensibles y, por lo tanto, capaces de responder a la estimulación mecánica, se puede probar la orientación de las células a lo largo del tiempo. Las células antes de la estimulación muestran una orientación aleatoria (Figura 5A y Figura 5C) y se reorientan paralelamente a la dirección del flujo (Figura 5B, C). El protocolo aquí descrito permite la recolección de las células del canal para realizar análisis posteriores, por ejemplo, citometría de flujo, para el estudio de su inmunofenotipo de membrana, proporcionando la identidad endotelial de las células estimuladas (Figura 5D,E).
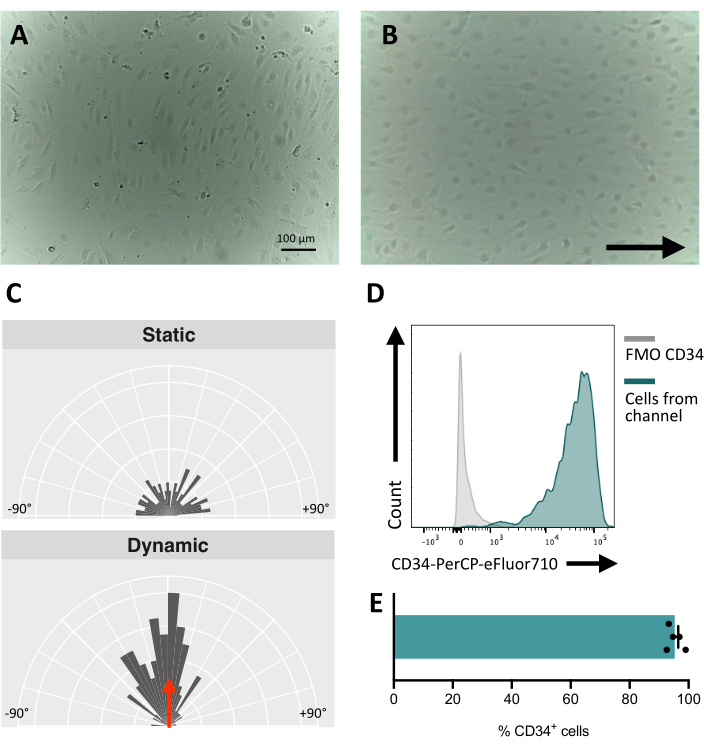
Figura 5: Mecanosorreactividad de las células endoteliales derivadas de hiPSCs . (A) Capa confluente de células CD34+ aisladas 48 h después de la siembra. (B) Capa reorientada de células endoteliales 3 días bajo cultivo dinámico. (C) Análisis de orientación de las células endoteliales después de 5 días de cultivo dinámico. (D) Perfil de expresión de CD34 de células cultivadas bajo flujo durante 5 días. (E) Porcentaje de células CD34+ de la población celular recuperadas del canal fluídico. Las imágenes se tomaron con un microscopio invertido en la incubadora; Los datos de citometría de flujo se obtuvieron utilizando citómetros de cinco láseres y un software específico (ver Tabla de materiales). Barras de escala = 100 μm (A,B). Haga clic aquí para ver una versión más grande de esta figura.
| Reactivos | Concentración de existencias | Volumen añadido | Concentración final |
| Medio de Dulbecco modificado de Iscove (IMDM) | - | 333 mL | - |
| Mezcla de nutrientes F-12 para jamón (F-12) | - | 167 mL | - |
| Suplemento N-2 (100x) | 100 x | 5 mL | 1 vez |
| Suplemento B-27 (50x) | 50 x | 10 mL | 1 vez |
| Ácido ascórbico | 10 mg/mL | 1,25 ml | 25 μg/mL |
| α-monotioglicerol (MTG) | 11,5 M | 19,5 μL | 448,5 μM |
| Albúmina sérica humana | 100 mg/mL | 2,5 ml | 0,5 mg/ml |
| Holo-Transferrina | 100 mg/mL | 0,75 ml | 150 μg/mL |
Tabla 1: Composición y receta de 500 mL de medio de diferenciación libre de suero (SFD).
| Días de diferenciación | Mezcla de citoquinas | Citoquina | Concentración final |
| Día 0 - 2 | Mezcla 1 | BMP4 | 20 ng/mL |
| Día 2 | Mezcla 2 | CHIR99021 | 7 μM |
| A partir del día 3 | Mezcla 3 y 4 | VEGF | 15 ng/mL |
| bFGF | 5 ng/mL | ||
| A partir del día 6 | Mezcla 4 | IL6 | 10 ng/mL |
| FLT3L | 10 ng/mL | ||
| IGF1 | 25 ng/mL | ||
| IL11 | 5 ng/mL | ||
| SCF | 50 ng/mL | ||
| EPO | 3 U/mL | ||
| TPO | 30 ng/mL | ||
| IL3 | 30 ng/mL |
Tabla 2: Mezclas de citocinas utilizadas para la diferenciación de células endoteliales, días en los que se añaden al medio SFD y concentración final.
| Esfuerzo cortante (dyn/cm2) | Tiempo (h) |
| 0.5 | 1 |
| 1 | 1 |
| 1.5 | 1 |
| 2 | 1 |
| 2.5 | 1 |
| 3 | 1 |
| 3.5 | 1 |
| 4 | 1 |
| 4.5 | 1 |
| 5 | Hasta el final del experimento |
Tabla 3: Valores de esfuerzo cortante para el cultivo dinámico y la duración de su aplicación.
Figura suplementaria S1: Geometría y dimensiones del chip y la tubería utilizados para este protocolo. Haga clic aquí para descargar este archivo.
Figura complementaria S2: Guía paso a paso para el software que controla la bomba de aire con una descripción de cada paso. Haga clic aquí para descargar este archivo.
Figura suplementaria S3: Guía para el análisis de orientación utilizando FIJI que muestra el dibujo de la forma de la celda, el ajuste elíptico y la medición final. Haga clic aquí para descargar este archivo.
Tabla suplementaria S1: Tamaño de la unidad, volumen de resuspensión y concentraciones de existencias para las citocinas utilizadas en el protocolo de diferenciación. Haga clic aquí para descargar este archivo.
Discusión
El protocolo que aquí describimos permite la generación de células endoteliales mecanosensibles a partir de células madre pluripotentes humanas y el estudio de su respuesta a la estimulación mecánica mediada por un esfuerzo de cizallamiento controlado. Este protocolo está totalmente basado en citoquinas y es totalmente compatible con los reactivos GMP para su posible traducción en la producción de células para la terapia celular.
La derivación de las hiPSCs proporciona a los científicos un modelo instrumental para las primeras etapas del desarrollo embrionario que permite el estudio de procesos que de otro modo serían difíciles de estudiar in vivo24. De hecho, los tejidos embrionarios humanos disponibles para la investigación se recolectan de embriones que carecen de circulación, y esto podría tener un impacto significativo en la firma molecular controlada por señales mecánicas. El enfoque descrito aquí permite obtener imágenes en vivo y estudiar en tiempo real la respuesta celular al esfuerzo cortante. La combinación de hiPSCs con fluídica proporciona un modelo de estudio que supera la limitada disponibilidad y la inaccesibilidad de los tejidos fetales en desarrollo cuando el inicio de la circulación remodela y controla el establecimiento del sistema cardiovascular y sanguíneo 3,9,10,25.
Una limitación del protocolo es que las células endoteliales derivadas de este protocolo podrían no reflejar las diversas identidades de las diferentes células endoteliales presentes en los tejidos en desarrollo. Para superar esta limitación, podría ser necesaria una combinación específica de citocinas durante el proceso de diferenciación que precede a la estimulación fluídica para obtener la identidad deseada o el fenotipo específico del tejido26. El aislamiento de los subconjuntos endoteliales se puede obtener utilizando un inmunofenotipo más refinado durante la etapa de aislamiento. Este protocolo aísla las células endoteliales basándose únicamente en la expresión de CD34, lo que permite el aislamiento de la columna en lugar de la clasificación celular activada por fluorescencia (FACS); Esto reduce la muerte celular y el riesgo de contaminación. Además, este protocolo está diseñado específicamente para estudiar el papel del esfuerzo cortante mediado por el flujo laminar. Habrá que emplear enfoques fluídicos alternativos para estudiar el efecto de otras señales mecánicas, como el estiramiento o la compresión, u otros tipos de flujo, como el flujo perturbado o perturbado.
Hemos demostrado previamente que las células endoteliales derivadas de iPSC imitan las identidades celulares arteriovenosas heterogéneas27 similares a las observadas en la aorta dorsal fetal28,29,30. Esto es de particular importancia en el contexto del desarrollo de los vasos y la especificación celular, que se sabe que está controlada por la circulación sanguínea. Estudios en diferentes modelos demostraron que la falta de circulación resulta en una alteración de la especificación arteriovenosa11,14,31. Todavía se desconocen los mecanismos que conectan las señales mecánicas con la especificación de la célula y la línea descrita aquí permite estudios funcionales refinados que no podrían probarse in vivo.
Esta línea describe la producción y la estimulación de células endoteliales derivadas de hiPSCs utilizando canales fluídicos disponibles comercialmente, evitando la necesidad de fundir los dispositivos como para los dispositivos de polidimetilsiloxano (PDMS) ampliamente utilizados12. Además, el uso de chips PDMS hace que la recolección de las células estimuladas sea particularmente desafiante, mientras que con este protocolo, las células se pueden recuperar fácilmente del canal. Esto mejora significativamente la potencia analítica, lo que permite realizar análisis posteriores, como análisis proteómicos y transcriptómicos, citometría de flujo y ensayos funcionales, que podrían necesitar más cultivos o ensayos in vivo .
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo contó con el apoyo de la Beca de Investigación Avanzada 2021 de la Asociación Europea de Hematología, el Premio Global de Investigación 2021 de la Sociedad Americana de Hematología y el Fondo de Apoyo a la Estrategia Interna ISSF3 financiado por el Welcome Trust y la Universidad de Edimburgo. Agradecemos a Fiona Rossi, del Centro de Citometría de Flujo, por su apoyo en el análisis de citometría de flujo. A los efectos del acceso abierto, el autor ha aplicado una licencia Creative Commons Attribution (CC BY) a cualquier versión del Manuscrito Aceptado por el Autor que surja de este envío.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.6 Luer uncoated slide | ibidi | IB-80186 | |
| 25% BSA | Life Technologies | A10008-01 | |
| 6-well plates | Greiner Bio-one | 657160 | |
| Accutase | Life Technologies | A1110501 | Cited as Dissociation reagent |
| Ascorbic acid | Merck | A4544-100G | |
| Aspiration pipette | Sardtedt | 86.1252.011 | |
| B27 supplement | Life Technologies | 17504044 | Cited as Neuronal cell culture supplement (50x) |
| BD FACS DIVA | BD Biosciences | Version 8.0.1 | Cited as flow cytometry software |
| BD LSR Fortessa 5 Laser | BD Biosciences | ||
| bFGF | Life Technologies | PHG0021 | |
| CD34 Microbead kit | Miltenyil Biotec | 30-046-702 | |
| CD34 PE clone 4H11 | Invitrogen | 12-0349-42 | |
| CD34 PerCP-eFluor 710 clone 4H11 | Invitrogen | 44-0349-42 | |
| Cellstar cell-repellent surface 6-well plates | Greiner Bio-one | 657970 | Cited as cell-repellent plate |
| CHIR99021 | Cayman Chemicals | 13122-1mg-CAY | |
| Cryostor CS10 cell cryopreservation | Merck | C2874-100ML | Cited as Cryopreservation solution |
| Dimethyl Sulfoxide | VWR | 200-664-3 | Cited as DMSO |
| DMEM/F-12 | Life Technologies | 10565-018 | |
| DPB Ca2+ Mg2+ | Life Technologies | 14080055 | |
| DPBS | Life Technologies | 14200075 | |
| EASY Strainer 40 μm | Greiner Bio-one | 542040 | |
| EDTA | Life technologies | 15575020 | |
| FcR Blocking Reagent | Miltenyil Biotec | 130-059-901 | |
| Fiji | Version 1.53c | ||
| Flow Jo | Version 10.7.1 | Cited as flow cytometry sanalysis oftware | |
| FLT3L | Peprotech | 300-19-10uG | |
| Fluidic unit | ibidi | 10903 | |
| GlutaMax | Life Technologies | 35050038 | Cited as L-glutamine supplement |
| Ham F-12 | Life Technologies | 11765054 | |
| Holo-transferrin | Merk | T0665-500MG | |
| Human Serum Albumin | Fujifilm UK LTD | 9988 | |
| Ibidi Pump system | ibidi | 10902 | Cited as Pump system |
| IMDM | Life Technologies | 12440053 | |
| Inverted microscope | ioLight/Thisle Scientific | IOL-IO-INVERT | Cited as inverted in-incubator microscope |
| Lyophilised BSA | Merck | A2153-100G | |
| MiniMACS Separator | Miltenyil Biotec | 130-042-102 | Cited as Magnetic separator |
| MS Columns | Miltenyil Biotec | 130-042-201 | Cited as Magnetic column |
| MTG | Merck | M6145-25ML | |
| N2 supplement | Life Technologies | 17502048 | |
| Notebook for pump system | ibidi | 10908 | |
| Paraformaldehyde 37-41% | Fisher Chemicals | F/1501/PB15 | |
| Pastette | Greiner Bio-one | 612398 | |
| Pen/Strep | Gibco | 15070063 | |
| Perfusion Set YELLOW/GREEN: 50 cm, ID 1.6 mm, 10 mL reservoirs | Ibidi | IB-10964 | Cited as Perfusion set |
| Polystyrene Round Bottom Tubes | Falcon | 352008 | Cited as Flow cytometry tubes |
| Prism 9 | Verison 9.4.0 | ||
| Pump control software | ibidi | version 1.6.1 | Cited as Pump software |
| ReLeSR | Stem cell tecchonologies | 5872 | Cited as Detaching solution |
| rhBMP4 | R&D | 314-BP-010 | |
| rhEPO | R&D | 287-TC-500 | |
| rhIGF1 | Peprotech | 100-11-100uG | |
| rhIL11 | Peprotech | 200-11-10uG | |
| rhIL3 | Peprotech | 200-03-10uG | |
| rhIL6 | R&D | 206-IL-010 | |
| rhLaminin-521 | Life technologies | A29248 | Cited as Laminin |
| rhSCF | Life Technologies | PHC2111 | |
| rhTPO | R&D | 288-TPN-025 | |
| rhVEGF | R&D | 293-VE-010 | |
| RLT Lysis Buffer | Qiagen | 79216 | |
| Serial Connector for µ-Slides: Sterile, Sterile | ibidi | IB-10830 | |
| StemPro-CD34 SFM media | Life Technologies | 10639011 | Cited as Serum-Free media for CD34+ cells (SFM-34) |
| StemPro-CD34 Nutrient Supplement | Life Technologies | 10641-025 | Cited as 34 nutrient supplement |
| StemPro hESC SFM | Life Technologies | A1000701 | Cited as Culture media |
| StemPro supplement | Life Technologies | A10006-01 | |
| Vitronectin (VTN-N) recombinant human protein, truncated | Invitrogen | A31804 | |
| Y-27632 dihydrochloride | Tocris | 1254 | Cited as iRock |
| β-Mercaptoethanol | Gibco | 21985023 |
Referencias
- Copp, A. J. Death before birth: clues from gene knockouts and mutations. Trends in Genetics. 11 (3), 87-93 (1995).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation Research. 92 (2), 133-135 (2003).
- Peacock, H. M., Daems, M., Jones, E. A. V. Hemodynamic control of endothelial cell fates in development. Cardiac and Vascular Biology. 8, 127-166 (2021).
- Chong, D. C., Koo, Y., Xu, K., Fu, S., Cleaver, O. Stepwise arteriovenous fate acquisition during mammalian vasculogenesis. Developmental Dynamics. 240 (9), 2153-2165 (2011).
- Jaffredo, T., Gautier, R., Eichmann, A., Dieterlen-Lièvre, F. Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny. Development. 125 (22), 4575-4583 (1998).
- Zovein, A. C., et al. Fate Tracing reveals the endothelial origin of hematopoietic stem cells. Cell Stem Cell. 3 (6), 625-636 (2008).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Boisset, J. C., et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Adamo, L., et al. Biomechanical forces promote embryonic haematopoiesis. Nature. 459 (7250), 1131-1135 (2009).
- Diaz, M. F., et al. Biomechanical forces promote blood development through prostaglandin E2 and the cAMP-PKA signaling axis. Journal of Experimental Medicine. 212 (5), 665-680 (2015).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Lundin, V., et al. YAP regulates hematopoietic stem cell formation in response to the biomechanical forces of blood flow. Developmental Cell. 52 (4), 446.e5-460.e5 (2020).
- Li, J., et al. Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development. Cell Reports. 40 (11), 111339 (2022).
- Azzoni, E., et al. The onset of circulation triggers a metabolic switch required for endothelial to hematopoietic transition. Cell Reports. 37 (11), 110103 (2021).
- Li, Y. S. J., Haga, J. H., Chien, S. Molecular basis of the effects of shear stress on vascular endothelial cells. Journal of Biomechanics. 38 (10), 1949-1971 (2005).
- Batsivari, A., et al. Understanding hematopoietic stem cell development through functional correlation of their proliferative status with the intra-aortic cluster architecture. Stem Cell Reports. 8 (6), 1549-1562 (2017).
- Canu, G., et al. Analysis of endothelial-to-haematopoietic transition at the single cell level identifies cell cycle regulation as a driver of differentiation. Genome Biology. 21 (1), 157 (2020).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2020).
- Yang, C. -. T., et al. Activation of KLF1 enhances the differentiation and maturation of red blood cells from human pluripotent stem cells. Stem Cells. 35 (4), 886-897 (2017).
- Lopez-Yrigoyen, M., et al. A human iPSC line capable of differentiating into functional macrophages expressing ZsGreen: A tool for the study and in vivo tracking of therapeutic cells. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1750), 20170219 (2018).
- Lopez-Yrigoyen, M., et al. Production and characterization of human macrophages from pluripotent stem cells. Journal of Visualized Experiments. 2020 (158), (2020).
- Fidanza, A., et al. Single cell analyses and machine learning define hematopoietic progenitor and HSC-like cells derived from human PSCs. Blood. 136 (25), 2893-2904 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Nguyen, J., Lin, Y. Y., Gerecht, S. The next generation of endothelial differentiation: Tissue-specific ECs. Cell Stem Cell. 28 (7), 1188-1204 (2021).
- Petazzi, P., et al. Arterial cells support the development of human hematopoietic progenitors in vitro via secretion of IGFBP2. bioRxiv. , (2022).
- Crosse, E. I., et al. Multi-layered spatial transcriptomics identify secretory factors promoting human hematopoietic stem cell development. Cell Stem Cell. 27 (5), 822 (2020).
- Calvanese, V., et al. Mapping human haematopoietic stem cells from haemogenic endothelium to birth. Nature. 604 (7906), 534-540 (2022).
- Zeng, Y., et al. Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing. Cell Research. 29 (11), 881-894 (2019).
- Hwa, J. J., et al. Abnormal arterial-venous fusions and fate specification in mouse embryos lacking blood flow. Scientific Reports. 7 (1), 11965 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados