Fabricación de rejillas monocapa recubiertas de grafeno para criomicroscopía electrónica
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, describimos un protocolo para aplicar una sola monocapa de grafeno a rejillas de microscopía electrónica y cómo prepararlas para su uso en la determinación de la estructura crioEM.
Resumen
La microscopía electrónica criogénica (crioEM) se ha convertido en una técnica poderosa para sondear la estructura atómica de los complejos macromoleculares. La preparación de muestras para crioEM requiere la conservación de las muestras en una capa delgada de hielo vítreo, generalmente suspendida dentro de los orificios de una película de soporte fenestrada. Sin embargo, todos los enfoques de preparación de muestras comúnmente utilizados para los estudios de crioEM exponen la muestra a la interfaz aire-agua, lo que introduce un fuerte efecto hidrofóbico en la muestra que a menudo resulta en desnaturalización, agregación y disociación compleja. Además, las interacciones hidrofóbicas preferidas entre las regiones de la muestra y la interfaz aire-agua afectan a las orientaciones adoptadas por las macromoléculas, lo que da lugar a reconstrucciones 3D con resolución direccional anisotrópica.
Se ha demostrado que la adsorción de muestras crioEM a una monocapa de grafeno ayuda a mitigar las interacciones con la interfaz aire-agua, al tiempo que minimiza la introducción de ruido de fondo. Los soportes de grafeno también ofrecen la ventaja de reducir sustancialmente la concentración requerida de proteínas requeridas para la obtención de imágenes crioEM. A pesar de las ventajas de estos soportes, las rejillas recubiertas de grafeno no son ampliamente utilizadas por la comunidad crioEM debido al costo prohibitivo de las opciones comerciales y los desafíos asociados con la producción interna a gran escala. Este artículo describe un método eficiente para preparar lotes de rejillas crioEM que tienen una cobertura casi total de grafeno monocapa.
Introducción
La microscopía electrónica criogénica de una sola partícula (crioEM) es una tecnología cada vez más aplicable que se utiliza para investigar las estructuras 3D de las biomacromoléculas. Los avances tecnológicos en la óptica del microscopio electrónico, la detección directa de electrones1 y los algoritmos informáticos 2,3,4 durante la última década han permitido a los usuarios de crioEM determinar las estructuras de complejos macromoleculares bioquímicamente estables con una resolución casi atómica 5,6,7,8 . A pesar de estos avances, siguen existiendo barreras notables para la preservación de muestras para la obtención de imágenes crioEM, que impiden que la mayoría de las muestras biológicas se resuelvan a resoluciones tan altas.
La preparación de muestras para el análisis crioEM de alta resolución implica atrapar macromoléculas que se distribuyen uniformemente en una amplia gama de orientaciones dentro de una fina capa de hielo vitrificado. Los métodos de congelación "blot and plunge" son los métodos más utilizados para generar películas delgadas de muestras biológicas en cuadrículas para estudios de crioEM 9,10. Estos métodos consisten en aplicar unos pocos microlitros de solución de muestra a una rejilla EM que contiene una película fenestrada que se ha hecho hidrófila y, posteriormente, borrar la mayor parte de la muestra con papel de filtro antes de sumergir rápidamente la rejilla en un criógeno de etano líquido o mezcla de etano y propano9.
Si bien este método se ha utilizado con éxito para determinar las estructuras de una amplia gama de especímenes biológicos, todos los métodos de preparación de especímenes crioEM comúnmente utilizados exponen los especímenes a la interfaz hidrofóbica aire-agua (AWI), que a menudo presenta problemas que limitan la determinación de estructuras de alta resolución. Se ha establecido que los especímenes biológicos tienen una alta propensión a la desnaturalización cuando se exponen al AWI, lo que puede conducir a una agregación y desensamblaje complejos11,12,13,14. Además, los parches hidrofóbicos en las superficies de los especímenes biológicos hacen que las partículas adopten las orientaciones preferidas en el hielo12. En muchos escenarios, una sola región hidrofóbica de la muestra obliga a todas las partículas a adoptar una orientación singular en el hielo, aboliendo así la capacidad de generar una reconstrucción fiable. Además de los problemas con el AWI, los especímenes pueden demostrar una afinidad por la superficie de la capa de película fenestrada, lo que limita el número de partículas suspendidas en el hielo dentro de los agujeros15.
Se han desarrollado varias soluciones metodológicas y tecnológicas para disminuir estos problemas que surgen de las interacciones con el AWI o las películas16,17. Un enfoque popular es recubrir la película fenestrada de las rejillas EM con una capa delgada (decenas de nanómetros) de carbono amorfo. Este recubrimiento proporciona una superficie continua a través de los orificios a la que las partículas pueden adsorberse, con el beneficio de proteger parcialmente la muestra de las interacciones con el AWI15,18,19,20. Sin embargo, la capa adicional de carbono eleva la cantidad de señal de fondo en las regiones fotografiadas, introduciendo ruido que puede comprometer la resolución alcanzable, particularmente para muestras pequeñas (<150 kDa). En los últimos años, se ha demostrado que el uso de escamas de óxido de grafeno (GO) para producir películas de soporte en rejillas crioEM tiene ventajas sobre el carbono amorfo tradicional. Las escamas de GO se producen a través de la oxidación de las capas de grafito, lo que da como resultado láminas pseudocristalinas de grafito monocapa que son hidrófilas debido a su contenido sustancial de oxígeno en forma de grupos carboxilo, hidroxilo y epoxi en las superficies y bordes. Las escamas comerciales de GO en suspensiones acuosas son baratas, y existen numerosos métodos publicados para aplicar escamas de GO a las rejillas EM18,21. Sin embargo, estos métodos a menudo dan como resultado cuadrículas que solo están parcialmente cubiertas con copos de GO, así como regiones que contienen varias capas de copos de GO. Además, las escamas de GO contribuyen con una señal de fondo notable a las imágenes crioEM que es cercana a la observada con el carbono amorfo delgado22,23.
El grafeno monocapa prístino, que consiste en una sola matriz cristalina 2D de átomos de carbono, se distingue del GO en que no produce contraste de fase en el microscopio electrónico. Por lo tanto, el grafeno monocapa se puede utilizar para generar una capa de soporte invisible para obtener imágenes de muestras biológicas. El grafeno monocapa también es más fuerte que el GO y se puede aplicar como una sola monocapa en una rejilla EM, y los avances recientes en la fabricación de rejillas EM recubiertas de grafeno han hecho posible preparar rejillas de grafeno monocapa de alta cobertura internamente 24,25,26,27,28,29,30 . Sin embargo, a pesar de los beneficios del uso de rejillas recubiertas de grafeno para la determinación de la estructura crioEM, no se utilizan ampliamente debido al costo prohibitivo de las opciones comerciales y la complejidad de la producción interna. Aquí, describimos una guía paso a paso para producir de manera efectiva rejillas EM cubiertas con una monocapa de grafeno para la determinación de la estructura crioEM de muestras biológicas (Figura 1). Siguiendo este protocolo detallado, los investigadores de cryoEM pueden preparar de forma reproducible docenas de rejillas de soporte de grafeno de alta calidad en un solo día. La calidad de las rejillas recubiertas de grafeno se puede examinar fácilmente utilizando un microscopio electrónico de transmisión (TEM) de gama baja equipado con un filamento LaB6.
Protocolo
1. Preparación de materiales y accesorios necesarios para la fabricación de rejillas de grafeno
NOTA: El grafeno contamina fácilmente, lo que reduce la eficiencia del recubrimiento de grafeno y la calidad de las rejillas de grafeno; Por lo tanto, es importante limpiar a fondo todos los materiales que entran en contacto con el grafeno. La preparación de los materiales y todos los pasos deben realizarse en una campana extractora.
- Reúna los materiales necesarios que se utilizarán para recubrir las rejillas con grafeno (Figura 2A).
- Enjuague la cristalería varias veces con agua desionizada (DI) para eliminar el polvo, las pelusas y los residuos aceitosos.
- Use toallitas desechables para limpiar los cubreobjetos de vidrio con etanol al 75% y use un plumero de aire para eliminar cualquier contaminante.
NOTA: El bloque portarejillas TEM de sujeción utilizado en este protocolo puede contener hasta 45 rejillas. Para una producción de grandes lotes de rejillas de grafeno, se pueden preparar 45 rejillas o menos a la vez. Sin embargo, se recomienda comenzar con una producción de lotes pequeños (de cuatro a seis cuadrículas) hasta que se establezca el método en el laboratorio.
2. Preparación de persulfato de amonio (APS) 0,2 M en agua
NOTA: Esta solución APS se utiliza como grabador para eliminar el soporte de cobre (Cu) de la lámina de grafeno/Cu en un paso posterior. Prepare siempre una solución APS fresca. Las soluciones reutilizadas o viejas no grabarán el cobre de manera efectiva y pueden dejar residuos de cobre en el grafeno en los pasos posteriores.
- Enjuague un matraz de 500 ml con agua desionizada (DI), luego agregue 200 ml de agua desionizada y cocine en el microondas usando la configuración máxima durante aproximadamente 1 minuto para desgasificar el agua.
- Añadir 9 g de persulfato de amonio a 200 ml de agua desionizada para producir una solución de 0,2 M de SAF.
PRECAUCIÓN: El APS es tóxico, se recomienda usar equipo de protección personal (EPP) cuando se manipule el APS. Deseche los residuos de APS en una planta de eliminación de residuos aprobada. - Agite la solución con una barra agitadora en un agitador magnético mientras conecta el matraz a una fuente de vacío debajo de una campana extractora.
NOTA: La desgasificación de la solución APS ayudará a prevenir la formación de burbujas, lo que puede reducir la eficiencia del grabado de Cu en el paso 6.
3. Transfiera el grafeno/cobre a un cubreobjetos limpio con un trozo de papel secante
NOTA: Utilizamos una película de grafeno de deposición química de vapor (CVD) de 15 x 15 cm sobre Cu de un proveedor de grafeno. Las láminas monocapa de grafeno/Cu compradas comercialmente deben almacenarse al vacío. Como el grafeno se cultiva en ambos lados del Cu mediante el método CVD, los proveedores de grafeno generalmente realizan controles de calidad y recomiendan el mejor lado para su uso. Nos referimos a este lado recomendado del grafeno como el lado "superior", mientras que el otro lado es el lado "posterior" en este protocolo.
- Corta un trozo de papel secante en forma rectangular de aproximadamente 20 mm x 40 mm. Este papel secante se utiliza como relleno para la lámina de grafeno/Cu y absorberá el exceso de metacrilato de metilo (MMA (8,5) MMA EL6) utilizado para recubrir la lámina de grafeno/Cu; por lo tanto, asegúrese de cortarlo en un tamaño que sea más grande que la lámina de grafeno/Cu que se va a utilizar.
- Use cinta adhesiva de poliimida para pegar las cuatro esquinas del papel secante a la parte superior de un cubreobjetos limpio que quepa en una máquina de recubrimiento casera.
NOTA: La cinta de poliimida se utiliza porque es delgada y se puede quitar fácilmente, lo que facilita el manejo. - Retire una pieza de la lámina de grafeno/Cu del almacenamiento al vacío.
- Utiliza unas tijeras limpias y libres de polvo para cortar con cuidado un pequeño cuadrado de la lámina de Cu-grafeno que será suficiente para cubrir completamente el número de rejillas a preparar. Para 25 cuadrículas dispuestas en una matriz de 5 x 5, por ejemplo, corte una pieza de 18 mm x 18 mm. Coloque la hoja de grafeno/Cu encima del papel secante con unas pinzas limpias y secas. Asegúrese de que la parte posterior de la lámina de grafeno/Cu esté hacia abajo y tenga cuidado de no voltear accidentalmente la lámina de grafeno/Cu, ya que es difícil distinguir la parte superior de la parte posterior.
- Pega con cinta adhesiva las cuatro esquinas de la lámina de grafeno/Cu al papel secante/cubreobjetos, minimizando la cantidad de contacto entre la cinta y la lámina de grafeno/Cu, ya que las regiones cubiertas con cinta adhesiva no se cubrirán con MMA en el siguiente paso.
NOTA: La descarga estática puede dañar las películas de grafeno y, por lo tanto, es recomendable permanecer conectado a tierra eléctricamente y minimizar la acumulación de carga estática cuando se manipulan grafeno o rejillas de grafeno. Esto se puede lograr usando una correa de conexión a tierra para la muñeca o tocando un objeto metálico conectado a tierra inmediatamente antes de manipular grafeno o rejillas de grafeno.
4. Cubra la lámina de grafeno / Cu de una sola capa con una capa delgada de MMA (8.5) MMA EL6 (MMA)
NOTA: Después de que se grabe el Cu, esta capa de MMA soportará la monocapa de grafeno para permitir el manejo de la lámina de grafeno en pasos futuros. El recubrimiento MMA también permite la visualización de la película de grafeno, ya que una monocapa de grafeno por sí sola sería transparente.
- Coloque el cubreobjetos con la lámina de grafeno/Cu pegada con cinta adhesiva en un barniz giratorio casero (que se puede ensamblar con un ventilador de computadora) dentro de una campana extractora (Figura 2B), como lo describieron previamente Han et al.25.
- Con gafas de seguridad, agregue dos gotas de MMA con una pipeta de vidrio en la lámina de grafeno e inmediatamente comience a girar a máxima velocidad.
- Mientras giras, agrega dos gotas más en el centro. Centrifugar durante 1 min.
NOTA: Asegúrese de que se haya aplicado suficiente MMA para cubrir completamente el grafeno. Si no está seguro, agregue algunas gotas más. Si el grafeno no está completamente recubierto, aparecen "agujeros" en la película después de que se graba el Cu. - Deje secar al aire durante 10 minutos dentro de una campana extractora.
5. Retire el grafeno de la parte posterior de la lámina de grafeno/Cu
NOTA: El grafeno cultivado en la parte posterior del cobre (el lado no recubierto con MMA) debe eliminarse antes de continuar con los pasos posteriores porque este exceso de grafeno reducirá la efectividad del grabado con Cu. Eliminamos este grafeno exponiendo el grafeno al plasma, lo que se puede lograr utilizando cualquier dispositivo de descarga incandescente que se usa normalmente para preparar rejillas EM para la preparación de muestras biológicas.
- Retire con cuidado la cinta y levante la lámina de grafeno/Cu recubierta de MMA del cubreobjetos con unas pinzas limpias y secas.
- Pega con cinta adhesiva el trozo de la lámina de MMA/grafeno/Cu con el lado de MMA hacia abajo en un cubreobjetos de vidrio limpio y libre de polvo.
- Coloque el cubreobjetos con la lámina de MMA/grafeno/Cu en el dispositivo de descarga incandescente y aplique los ajustes que normalmente se utilizarían al preparar rejillas para la tinción negativa o la preparación de muestras crioEM.
NOTA: Se debe evitar la descarga incandescente prolongada para evitar la oxidación del Cu en la parte posterior, lo que puede resultar en la contaminación de (nano) partículas de óxido de cobre (CuO) en la película de grafeno.
6. Grabe el Cu de la lámina de MMA / grafeno / Cu en una solución APS
- En una campana extractora, vierta 200 ml de la solución APS recién hecha en un plato de cristalización limpio y sin polvo (150 x 75 mm).
- Retire la lámina de MMA/grafeno/Cu del portaobjetos de vidrio. Lleva un registro de qué lado contiene la MMA.
- Para comenzar el grabado, coloque la lámina de MMA/grafeno/Cu con el lado de Cu tratado con plasma hacia abajo sobre la superficie de la solución APS. Cubra el vaso de vidrio ancho con un trozo de papel de aluminio o una tapa para evitar que entre polvo.
- Incubar durante 3 h. Si la mayor parte del Cu no está grabado después de 1 h, repita los pasos de las secciones 2-6 y luego continúe con el paso siguiente.
NOTA: Si la mayor parte del Cu no se graba después de 1 h, es probable que el lado de MMA/grafeno de la película se haya colocado sobre la superficie de la solución APS en lugar del lado de Cu. El Cu debe grabarse completamente después de 3 h, y la película de MMA/grafeno es incolora si el Cu se graba por completo. El grafeno contamina fácilmente, así que asegúrese de cubrir los recipientes para evitar la acumulación de pelusas o residuos grasos en las superficies, ya que esto afectará negativamente la calidad del grafeno.
7. Enjuague la película de MMA/grafeno en agua desionizada
- En una campana extractora, llene un plato de cristalización limpio y sin polvo con agua desionizada.
- Recoja suavemente la película de grafeno-MMA con un cubreobjetos de vidrio limpio y libre de polvo colocado en un ángulo de ~ 45 ° en relación con la superficie de la solución APS.
- Coloque el portaobjetos de vidrio en un ángulo de casi 90° con respecto al agua y baje suavemente el cubreobjetos de vidrio en el agua para que el MMA/grafeno se deslice lentamente fuera del portaobjetos y flote en la superficie del agua.
- Deje la película de MMA/grafeno en la superficie del agua durante 1 h para eliminar cualquier APS.
8. Limpiar las rejillas a recubrir con una monocapa de grafeno
NOTA: Las rejillas a las que se transferirá el grafeno deben estar lo más limpias posible para maximizar la adhesión del grafeno a la superficie de la lámina de la rejilla. Las rejillas compradas comercialmente a menudo contienen contaminantes residuales que deben eliminarse antes de la transferencia de grafeno.
- Limpiar y secar tres platos cristalizantes para que queden libres de polvo.
- En una campana extractora, vierta 200 ml de cloroformo, acetona y alcohol isopropílico (IPA) en cada uno de los tres platos de cristalización. Cubra los platos de cristalización con papel de aluminio para minimizar la evaporación de los disolventes orgánicos.
PRECAUCIÓN: El cloroformo y la acetona causan irritación de la piel y pueden ser tóxicos si se inhalan. Limite la exposición a estos solventes orgánicos y use EPP. - Coloque la base del bloque portarejillas TEM de sujeción en la parte inferior de la primera placa de cristalización que contiene 200 ml de cloroformo.
- Transfiera cada rejilla individualmente desde la caja de rejilla a un pozo en el bloque de soporte de rejilla, asegurándose de que el lado de la película fenestrada esté hacia arriba. Cubra el plato de cristalización con papel de aluminio, colóquelo en una coctelera orbital y agite suavemente durante 30 minutos.
- Coloque la tapa de metal en el bloque portarejillas, que asegurará las rejillas durante la transferencia al siguiente plato de cristalización. Levante con cuidado el bloque portarejillas del plato de cristalización con un tenedor doblado y unas pinzas largas y colóquelo en el fondo del segundo plato de cristalización que contiene 200 ml de acetona. Retire la tapa del bloque portarejillas y agite suavemente un agitador orbital durante 30 minutos.
- Coloque la tapa en el bloque portarejillas y transfiérala a un plato de cristalización que contenga 200 ml de solución de alcohol isopropílico para limpiar los residuos de acetona. Retire la tapa del bloque portarejillas y agite suavemente durante 20 minutos.
- Transfiera individualmente las rejillas con el lado de la película fenestrada hacia arriba desde el bloque de soporte de rejilla a una placa de Petri de vidrio cubierta con papel secante.
- Seque las rejillas durante al menos 30 minutos debajo de la campana extractora, asegurándose de que las rejillas estén cubiertas para evitar que el polvo caiga sobre ella.
9. Transfiera las rejillas limpias a papel secante colocado en una malla de alambre de acero inoxidable o en una bandeja perforada bajo agua desionizada
NOTA: Las rejillas deben sumergirse bajo agua desionizada en una superficie plana para que el grafeno pueda flotar sobre el agua y bajarse sobre las rejillas. Esto se puede realizar utilizando un canal de recubrimiento de rejilla comercial o con una placa de Petri y una bomba peristáltica, como se utiliza para generar rejillas de óxido de grafeno, como lo describen Palovcak et al.18.
- Coloque la malla o bandeja de acero inoxidable en un canal de recubrimiento de rejilla y enjuague con agua desionizada.
- Corta el papel secante que sea un poco más pequeño que la malla/bandeja de acero inoxidable y colócalo encima de la plataforma, sumergido en el agua desionizada.
NOTA: El papel secante es un poco más pequeño que la plataforma para permitir el movimiento y la manipulación. - Transfiera suavemente las rejillas limpias con el lado de la película fenestrada hacia arriba sobre el papel secante. Es probable que las rejillas sean hidrofóbicas, así que sumérjalas en el agua verticalmente o pueden doblarse debido a la tensión del agua. Coloque las cuadrículas en una matriz cuadrada de modo que estén lo más cerca posible unas de otras, pero sin superponerse (Figura 2C).
- Las rejillas ya están listas para ser recubiertas con una monocapa de grafeno. Llene el canal de recubrimiento de la rejilla con más agua desionizada para que la superficie del agua esté al menos 5 mm por encima de las rejillas.
10. Transfiere grafeno a las rejillas
- Saque con cuidado la película de MMA/grafeno de la placa de cristalización con un cubreobjetos limpio bajando lentamente el cubreobjetos en el canal en ángulo, a cierta distancia de la película de grafeno. Coloque el cubreobjetos debajo de la lámina de grafeno-MMA de modo que los bordes de la lámina y el cubreobjetos sean paralelos, y luego levante el cubreobjetos verticalmente fuera del agua, llevando consigo la película de MMA/grafeno.
- Transfiera la película de MMA/grafeno al comedero bajando el cubreobjetos al agua en un ángulo de ~45°, de modo que la película de MMA/grafeno se desprenda del cubreobjetos y flote en la superficie del agua.
- Coloque la película de MMA/grafeno directamente sobre las rejillas antes de que baje el nivel del agua. Utilice una pipeta Pasteur de vidrio cuya punta se haya derretido para sellar la abertura y manipular cuidadosamente la posición de la película de MMA/grafeno.
- Baje lentamente el nivel del agua con la jeringa, a aproximadamente 1,25 ml/min, de modo que la película de MMA/grafeno cubra completamente las superficies de la rejilla a medida que cae sobre el papel de filtro
NOTA: Puede ser necesaria una mayor manipulación de la lámina de grafeno-MMA para mantener su posición por encima de las rejillas a medida que desciende el nivel del agua. - Use un par de pinzas limpias y secas para levantar el papel secante que sujeta las rejillas a una placa de Petri limpia, seca y libre de polvo, o transfiera toda la plataforma de acero inoxidable.
- Seque al aire las rejillas de MMA/grafeno durante al menos 30 minutos debajo de la campana extractora. Mantenga las rejillas cubiertas con papel de aluminio o una tapa para evitar la contaminación por partículas de polvo.
- Transfiera las rejillas a una incubadora y hornee las rejillas en una incubadora a 65 °C durante 30 min.
- Retire las rejillas de la incubadora y déjelas tapadas durante 5 minutos a temperatura ambiente para enfriar las rejillas a temperatura ambiente.
11. Eliminación de MMA y limpieza de las rejillas
NOTA: El MMA debe lavarse a fondo con acetona para evitar cualquier residuo de MMA en las rejillas recubiertas de grafeno.
- En una campana extractora, prepare dos platos de cristalización que contengan 200 ml de acetona y un plato de cristalización que contenga 200 ml de isopropanol (IPA) a temperatura ambiente. Cubra los platos de cristalización con papel de aluminio para minimizar la evaporación de los disolventes orgánicos.
PRECAUCIÓN: Use EPP cuando manipule acetona, ya que puede causar irritación de la piel y puede ser perjudicial si se inhala. - Coloque la base del bloque portarejillas TEM de sujeción en la parte inferior de la primera placa de cristalización que contenga 200 ml de acetona fresca.
- Transfiera cada rejilla individualmente del papel secante a un hueco en el bloque de soporte de rejilla, asegurándose de que el lado de MMA esté hacia arriba. Cubra el plato de cristalización con papel de aluminio, colóquelo en una coctelera orbital y agite suavemente durante 30 minutos.
- Coloque la tapa de metal en el bloque portarejillas, que asegurará las rejillas durante la transferencia al siguiente plato de cristalización. Levante con cuidado el bloque portarejillas de la placa de cristalización con un tenedor doblado y unas pinzas largas y colóquelo en el fondo de la segunda placa de cristalización que contiene 200 ml de acetona fresca. Retire la tapa del bloque portarejillas y agite suavemente un agitador orbital durante 30 minutos.
- Coloque la tapa en el bloque portarejillas y transfiérala a la placa de cristalización que contiene 200 ml de solución de alcohol isopropílico para limpiar los residuos de acetona. Retire la tapa del bloque portarejillas y agite suavemente durante 20 minutos.
- Transfiera las rejillas a una pequeña placa de Petri de vidrio cubierta con papel secante y seque al aire las rejillas durante al menos 10 minutos. Mantenga las rejillas cubiertas con una tapa para evitar cualquier contaminación por partículas de polvo.
- Las rejillas están listas para ser utilizadas o transferidas a una caja de rejilla envuelta con papel de aluminio dentro de un desecador al vacío.
NOTA: El almacenamiento de rejillas de grafeno dentro de un desecador de vacío puede evitar la contaminación de partículas hidrofóbicas por las condiciones ambientales. Estas rejillas pueden almacenarse hasta varios meses antes de su uso27.
12. Hacer que las rejillas de grafeno sean hidrófilas con tratamiento UV / Ozono
NOTA: El grafeno es extremadamente hidrofóbico, lo que no es compatible con la preparación de muestras crioEM, ya que los enfoques de inmersión en transferencia requieren una superficie hidrofílica sobre la cual una gota de muestra pueda extenderse uniformemente. Mientras que los dispositivos tradicionales de descarga incandescente se pueden configurar para pulsar suavemente el plasma para hacer que la superficie del grafeno sea hidrófila, estos dispositivos tienden a destruir la delgada monocapa de grafeno. Anteriormente se demostró que se puede utilizar un limpiador UV/ozono para oxigenar parcialmente la superficie del grafeno25, haciéndolo hidrófilo para la preparación de muestras crioEM sin dañar la monocapa.
- Si utiliza un sistema UV/Ozono que requiere cebado, encienda el sistema y cebe la lámpara durante 10 minutos (en este paso, asegúrese de que no haya rejillas expuestas). Mientras se imprime el limpiador UV/ozono, retire las rejillas del desecador de la aspiradora y transfiérelas a un cubreobjetos limpio.
- Cuando el sistema UV/Ozono esté listo, coloque el cubreobjetos que contiene las rejillas con el lado del grafeno hacia arriba en el limpiador UV/ozono, y exponga las rejillas al gas ozono durante 4 min.
- Después de la exposición al ozono, utilice las rejillas inmediatamente para la preparación de muestras crioEM.
NOTA: Si se utiliza un sistema UV/Ozono que requiere cebado, las rejillas deben colocarse en el limpiador inmediatamente después de que la lámpara se haya cebado durante 10 minutos, o estará demasiado frío para producir suficiente gas ozono para oxigenar el grafeno para la preparación de la muestra. No exponga las rejillas al gas ozono durante más de 6 minutos, ya que destruirá la capa de grafeno.
Resultados Representativos
La ejecución exitosa del protocolo de fabricación de rejillas de grafeno descrito aquí dará como resultado rejillas EM que están completamente recubiertas con una sola monocapa de grafeno. La cobertura de grafeno de las rejillas se puede comprobar utilizando cualquier TEM. Dado que una monocapa de grafeno limpio es casi invisible en el TEM, se debe examinar utilizando el modo de difracción del microscopio y observar los puntos de Bragg correspondientes a la organización hexagonal de los átomos de carbono que componen el grafeno (Figura 3A). Es normal observar ocasionalmente algunas arrugas de grafeno monocapa, que se introducen durante el recubrimiento de MMA (Figura 3B). También se puede comprobar el nivel de contaminación presente en el grafeno adquiriendo una imagen de gran aumento en el centro de uno de los agujeros cubiertos de grafeno (Figura 3C). Si se adquiere con un detector de alta resolución, una transformada de Fourier de esta imagen debería contener manchas de Bragg correspondientes al espaciamiento carbono-carbono a 2,14 Å (Figura 4C). Una monocapa de átomos de carbono no produce suficiente dispersión de electrones para generar contraste de fase y, por lo tanto, una imagen de grafeno limpio no presentará anillos de Thon asociados con la función de transferencia de contraste en una transformada de Fourier de la imagen. Sin embargo, es muy difícil prevenir la contaminación de las rejillas de grafeno después de su producción, y el lavado insuficiente de las rejillas EM o la eliminación de MMA después del recubrimiento de grafeno darán como resultado contaminantes notables en las rejillas que son visibles en las imágenes del espacio real (Figura 3C). Como se muestra en la Figura 4, las rejillas de grafeno tienen un efecto concentrador en una muestra, como se observa cuando se comparan 0,5 mg/mL de apoferritina aplicada a rejillas de oro agujereadas con (Figura 4A) y sin el soporte de grafeno (Figura 4B). Previamente se han descrito protocolos similares de fabricación de grafeno para resolver estructuras crioEM de proteínas como la apoferritina a alta resolución25,27.
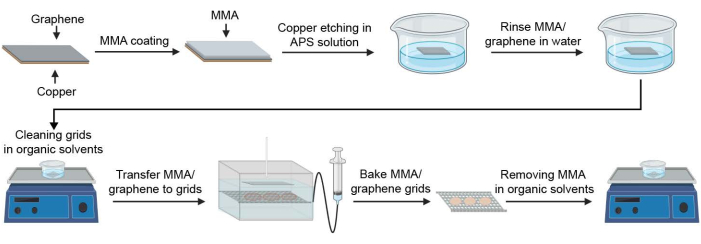
Figura 1: Esquema para la preparación de rejillas crioEM recubiertas de grafeno. Se ilustran los pasos clave en el proceso de fabricación de rejillas de grafeno. Abreviaturas: cryoEM = microscopía electrónica criogénica; MMA = metacrilato de metilo; APS = persulfato de amonio. Haga clic aquí para ver una versión más grande de esta figura.
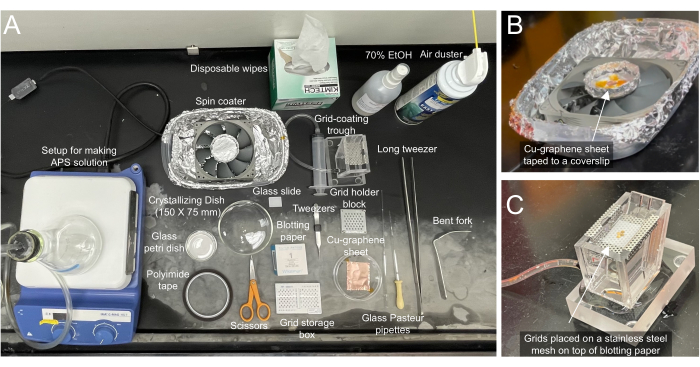
Figura 2: Materiales necesarios para la fabricación de rejillas de grafeno . (A) Los materiales necesarios para recubrir las rejillas crio-EM se etiquetan en consecuencia. (B) Vista de primer plano de la recubridora con una lámina de grafeno/Cu pegada con cinta adhesiva en un papel secante en un portaobjetos de vidrio. La máquina de recubrimiento giratorio se puede ensamblar comprando piezas en una tienda local de computadoras/hardware. (C) Vista de cerca del canal de recubrimiento de rejilla conectado a una jeringa que se puede usar para controlar el nivel del agua. Las cuadrículas se colocan encima de un papel secante sobre una malla de acero inoxidable. El papel secante ayuda a maniobrar la ubicación de las cuadrículas para que la hoja de grafeno pueda coincidir con ella. Haga clic aquí para ver una versión más grande de esta figura.
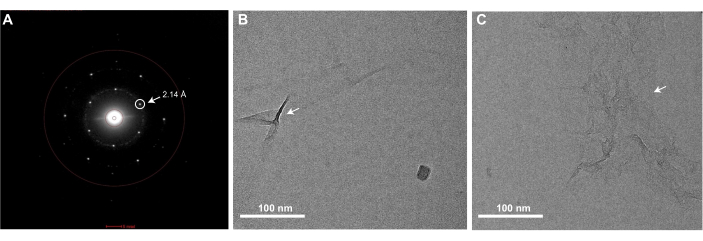
Figura 3: Una imagen representativa del patrón de difracción e imágenes de campo claro de una cuadrícula de grafeno que muestra arrugas o contaminación por MMA . (A) Las rejillas EM cubiertas con una monocapa de grafeno mostrarán picos de Bragg correspondientes a la red hexagonal del grafeno cuando se visualicen en un TEM en modo de difracción. El pico de Bragg correspondiente al espaciado carbono-carbono de 2,14 Å está encerrado en un círculo y se indica con una flecha. (B) Una imagen de campo claro de una cuadrícula de grafeno monocapa con algunas arrugas (marcadas con una flecha) en la monocapa de grafeno. (C) Una imagen de campo claro de grafeno monocapa con contaminación por MMA (indicada con una flecha). Barras de escala = 100 nm (B,C). Abreviaturas: EM = microscopía electrónica; MMA = metacrilato de metilo. Haga clic aquí para ver una versión más grande de esta figura.
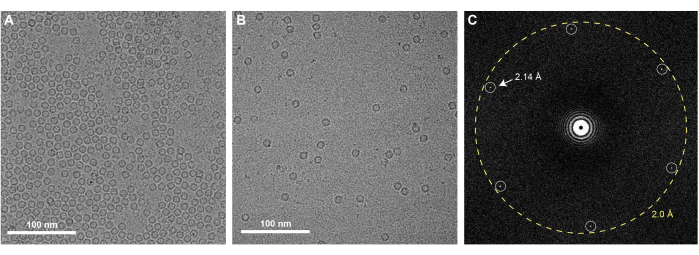
Figura 4: Apoferritina en rejillas de oro cubiertas de grafeno: (A) Micrografía crioEM de 0,5 mg/ml de apoferritina en rejillas de oro recubiertas de grafeno. (B) La apoferritina obtenida a la misma concentración es visible a una concentración sustancialmente más baja cuando se prepara utilizando rejillas de oro agujereadas sin grafeno. (C) FFT de la micrografía crioEM de 0,5 mg/mL de apoferritina en rejillas de oro recubiertas de grafeno, con los picos de Bragg correspondientes a la red hexagonal de grafeno denotada. Barras de escala = 100 nm (A,B). Abreviaturas: cryoEM = microscopía electrónica criogénica; FFT = transformada rápida de Fourier. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La conservación de muestras biológicas en una fina capa de hielo vítreo es un paso de importancia crítica para la determinación de la estructura crioEM de alta resolución. Sin embargo, los investigadores a menudo se encuentran con problemas derivados de las interacciones con el AWI, que introduce la orientación preferida, el desmontaje complejo, la desnaturalización y la agregación. Además, las muestras no siempre pueden concentrarse lo suficiente como para poblar el hielo delgado suspendido a través de los agujeros de una película fenestrada. Varios grupos de investigación han desarrollado métodos para recubrir las rejillas EM con una monocapa de grafeno para ayudar a superar algunas de estas limitaciones 24,25,26,27,28,29,30, y las rejillas de grafeno se han utilizado con gran éxito. Aquí, proporcionamos instrucciones paso a paso para preparar de manera efectiva lotes de rejillas de grafeno internamente y examinar la calidad de las rejillas de grafeno por TEM. Hacemos hincapié en que se debe tener especial cuidado durante algunos de los pasos críticos, que describimos a continuación.
El grafeno tiene una fuerte tendencia a atraer contaminantes en el aire. Por lo tanto, durante el proceso de fabricación de la rejilla de grafeno, es importante asegurarse de que todas las herramientas que entran en contacto con la lámina de grafeno/Cu o las rejillas estén limpias y libres de polvo. Los cubreobjetos de vidrio utilizados para transferir grafeno se pueden limpiar enjuagándolos con etanol y agua desionizada o usando un plumero de aire. También se recomienda trabajar bajo una campana extractora y mantener las láminas y rejillas de grafeno cubiertas con papel de aluminio o una placa de vidrio limpia en todo momento. El polvo o los contaminantes en las rejillas pueden impedir que el grafeno se adhiera completamente a las rejillas EM. Cuando se manipulan rejillas de grafeno o recubiertas de grafeno, es importante estar conectado a tierra eléctricamente para evitar daños a la película de grafeno por descarga estática. La descarga estática puede evitarse utilizando una correa de conexión a tierra para la muñeca, tocando un objeto metálico conectado a tierra cada vez que se manipulan grafeno o rejillas de grafeno y/o no usando un guante en la mano que sostiene las pinzas24.
Dado que una monocapa de grafeno es muy delgada (del ancho de un átomo de carbono), es importante apoyar el grafeno con una capa orgánica como MMA o poli-MMA (PMMA) durante la transferencia de grafeno a las rejillas. El PMMA es el material más utilizado para la transferencia de grafeno. Sin embargo, el PMMA tiene una fuerte afinidad con el grafeno y, a menudo, puede provocar la contaminación del polímero en la película de grafeno. En este protocolo se utiliza MMA, ya que deja menos contaminación residual25. Sin embargo, tanto el PMMA como el MMA tienen la desventaja de formar arrugas y grietas que se pueden observar en algunas áreas de la película de grafeno (Figura 3B). Puede ser un desafío evitar estas arrugas, ya que ocurren comúnmente durante el crecimiento del grafeno por el método CVD31. Recientemente se ha desarrollado un método para cultivar grafeno ultraplano sin arrugas, en el que la lámina de cobre se sustituye por una oblea de Cu(111)/zafiro como sustrato de crecimiento32.
Según nuestra experiencia, es mejor comprar láminas de grafeno/Cu y respaldar el grafeno con MMA internamente que comprar láminas de Cu-grafeno cubiertas de polímero de los fabricantes, que se vuelven quebradizas después del grabado de cobre y son difíciles de manejar en los pasos posteriores. El barnizador giratorio que utilizamos para el recubrimiento de MMA se puede construir de forma económica utilizando piezas de una tienda local de computadoras/hardware, como se describió anteriormente25.
Durante el paso del recubrimiento de MMA, es importante cubrir la totalidad de la superficie de grafeno en la lámina de Cu-grafeno con MMA. Después de que el Cu haya sido grabado, el grafeno MMA se volverá semitransparente, y las áreas que carecen de cobertura MMA se verán como agujeros vacíos. Para evitar el recubrimiento de MMA en el lado de cobre, es importante colocar un pequeño trozo de papel secante debajo de él durante el recubrimiento para que absorba cualquier exceso de MMA que salga de la película CVD.
Después del grabado y el enjuague, la lámina de MMA/grafeno está lista para ser transferida a las rejillas EM mediante el uso de un sistema de canal comercial o casero con una jeringa o bomba peristáltica para controlar el nivel del agua. Antes del paso de transferencia, es importante enjuagar bien las rejillas en baños sucesivos de cloroformo, acetona e IPA. Hornear rejillas recubiertas de grafeno a 65 °C ayuda a preservar la integridad del grafeno y promueve la adsorción de grafeno a las rejillas. Por último, para evitar la contaminación por MMA en las rejillas, es importante eliminar completamente la MMA en un baño de acetona y limpiar las rejillas en IPA. Cualquier residuo de MMA sin lavar se observará en las rejillas EM y disminuirá la relación señal-ruido de las imágenes (Figura 3C). El proceso de lavado con acetona-IPA se puede repetir para limpiar aún más las superficies de grafeno.
Para hacer que las cuadrículas de grafeno sean hidrófilas, expusimos las cuadrículas a UV/Ozono. Los diferentes modelos de limpiadores UV/ozono pueden requerir optimización para oxigenar suficientemente la capa de grafeno para la preparación de muestras crioEM sin dañar el grafeno. Independientemente del sistema, es fundamental utilizar estas rejillas para la aplicación de muestras crioEM inmediatamente después del tratamiento UV/Ozono. En otros estudios se describen métodos alternativos para hacer hidrofílicas las mallas de grafeno33,34.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos al Dr. Xiao Fan por sus útiles discusiones al establecer estos métodos en Scripps Research. B.B. recibió el apoyo de una beca de investigación postdoctoral de la Fundación Hewitt para la Investigación Médica. W.C. cuenta con el apoyo de una beca predoctoral de la Fundación Nacional de Ciencias. D.E.P cuenta con el apoyo de la subvención de los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) NS095892 a G.C.L. Este proyecto también contó con el apoyo de subvenciones de los NIH GM142196, GM143805 y S10OD032467 a G.C.L.
Materiales
| Name | Company | Catalog Number | Comments |
| 70% EtOH | Pharmco (190 pf EtOH) | 241000190CSGL | |
| Acetone | Sigma Aldrich | 650501-4L | |
| Ammonium persulfate (APS) | Sigma Aldrich | 215589-500g | Hazardous; use extreme caution |
| Chloroform | Sigma Aldrich | C2432-1L | |
| Clamping TEM Grid Holder Block for 45 Grids | PELCO | 16830-45 | |
| Computer fan | Amazon (Noctua) | B07CG2PGY6 | |
| Cover slip | Bellco Glass | 1203J71 | Standard cover slips |
| Crystallizing dish | Pyrex | 3140-100 | |
| Electronics duster | Falcon Safety Products | 75-37-6 | |
| Falcon Dust-off Air Duster | Staples | N/A | |
| Filter papers | Whatman | 1001-055 | |
| Fine tip tweezer | Dumont | 0508-L4-PO | |
| Flask | Pyrex | 4980-500 | |
| Fork | Supermarket | N/A | |
| Glass pasteur pipette | VWR | 14672-608 | |
| Graphene/Cu | Graphenea | N/A | CVD monolayer graphene cu |
| Grid Coating Trough | Ladd Research Industries | 10840 | Fragile |
| Isopropanol | Fisher Scientific | 67-63-0 | |
| Kapton Tape | Amazon (MYJOR) | MY-RZY001 | Polyimide tape |
| Kimwipes | Fisher Scientific | 06-666 | |
| Long twzeer | Cole Parmer Essentials | UX-07387-15 | |
| Metal grid holder | Ted Pella | 16820-81 | |
| MMA(8.5)MMA EL 6 | KAYAKU Advanced Materials | M31006 0500L 1GL | Flammable |
| Model 10 Lab Oven | Quincy Lab, Inc. | FO19013 | |
| Petri dish | Pyrex | 3610-102 | |
| Plasma cleaner (Solarus 950) | Gatan, Inc. | N/A | |
| Scissors | Fiskars | 194813-1010 | |
| Standard Analog Orbital Shaker | VWR | 89032-088 | |
| UltrAuFoil R1.2/1.3 - Au300 | Quantifoil | N/A | Holey gold grids |
| Ultraviolet Ozone Cleaning Systems | UVOCS | model T10X10/OES |
Referencias
- Li, X., Zheng, S. Q., Egami, K., Agard, D. A., Cheng, Y. Influence of electron dose rate on electron counting images recorded with the K2 camera. Journal of Structural Biology. 184 (2), 251-260 (2013).
- Tang, G., et al. EMAN2: An extensible image processing suite for electron microscopy. Journal of Structural Biology. 157 (1), 38-46 (2007).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 1-22 (2018).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. CryoSPARC: Algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. 14 (3), 290-296 (2017).
- Grigorieff, N., Harrison, S. C. Near-atomic resolution reconstructions of icosahedral viruses from electron cryo-microscopy. Current Opinion in Structural Biology. 21 (2), 265-273 (2011).
- Nakane, T., et al. Single-particle cryo-EM at atomic resolution. Nature. 587 (7832), 152-156 (2020).
- Zhang, K., Pintilie, G. D., Li, S., Schmid, M. F., Chiu, W. Resolving individual atoms of protein complex by cryo-electron microscopy. Cell Research. 30 (12), 1136-1139 (2020).
- Yip, K. M., Fischer, N., Paknia, E., Chari, A., Stark, H. Atomic-resolution protein structure determination by cryo-EM. Nature. 587 (7832), 157-161 (2020).
- Schultz, P. Cryo-electron microscopy of vitrified specimens. Quarterly Reviews of Biophysics. 21 (2), 129-228 (1988).
- Nguyen, H. P. M., McGuire, K. L., Cook, B. D., Herzik, M. A. Manual blot-and-plunge freezing of biological specimens for single-particle cryogenic electron microscopy. Journal of Visualized Experiments. 2022 (180), 1-16 (2022).
- Glaeser, R. M. Proteins, interfaces, and cryo-em grids. Current Opinion in Colloid & Interface Science. 25 (3), 289-313 (2016).
- Glaeser, R. M., Han, B. -. G. Opinion: hazards faced by macromolecules when confined to thin aqueous films. Biophysics Reports. 3 (1-3), 1-7 (2017).
- Han, B. G., Watson, Z., Cate, J. H. D., Glaeser, R. M. Monolayer-crystal streptavidin support films provide an internal standard of cryo-EM image quality. Journal of Structural Biology. 200 (3), 307-313 (2017).
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, 1-42 (2018).
- Drulyte, I., et al. Approaches to altering particle distributions in cryo-electron microscopy sample preparation. Acta Crystallographica Section D: Structural Biology. 74 (6), 560-571 (2018).
- Liu, N., Wang, H. W. Better cryo-EM specimen preparation: how to deal with the air-water interface. Journal of Molecular Biology. 435 (9), 167926 (2022).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15 (10), 793-795 (2018).
- Palovcak, E., et al. A simple and robust procedure for preparing graphene-oxide cryo-EM grids. Journal of Structural Biology. 204 (1), 80-84 (2018).
- Patel, A., Toso, D., Litvak, A., Nogales, E. Efficient graphene oxide coating improves cryo-EM sample preparation and data collection from tilted grids. bioRxiv. , (2021).
- Marr, C. R., Benlekbir, S., Rubinstein, J. L. Fabrication of carbon films with ~500nm holes for cryo-EM with a direct detector device. Journal of Structural Biology. 185 (1), 42-47 (2014).
- Pantelic, R. S., Meyer, J. C., Kaiser, U., Baumeister, W., Plitzko, J. M. Graphene oxide: A substrate for optimizing preparations of frozen-hydrated samples. Journal of Structural Biology. 170 (1), 152-156 (2010).
- Pantelic, R. S., et al. Graphene: substrate preparation and introduction. Journal of Structural Biology. 174 (1), 234-238 (2011).
- Russo, C. J., Passmore, L. A. Progress towards an optimal specimen support for electron cryomicroscopy. Current Opinion in Structural Biology. 37, 81-89 (2016).
- Passmore, L. A., Russo, C. J. Specimen preparation for high-resolution cryo-EM. Methods in Enzymology. 579, 51-86 (2016).
- Han, Y., et al. High-yield monolayer graphene grids for near-atomic resolution cryoelectron microscopy. Proceedings of the National Academy of Sciences of the United States of America. 117 (2), 1009-1014 (2020).
- Zheng, L., et al. Robust ultraclean atomically thin membranes for atomic-resolution electron microscopy. Nature Communications. 11 (1), 541 (2020).
- Ahn, E., Kim, B., Cho, U. -. S. Batch production of high-quality graphene grids for cryo-EM: cryo-EM structure of Methylococcus capsulatus soluble methane monooxygenase hydroxylase. bioRxiv. (Cvd), (2021).
- Naydenova, K., Peet, M. J., Russo, C. J. Multifunctional graphene supports for electron cryomicroscopy. Proceedings of the National Academy of Sciences of the United States of America. 116 (24), 11718-11724 (2019).
- Fan, H., Sun, F. Developing graphene grids for cryoelectron microscopy. Frontiers in Molecular Biosciences. 9, 937253 (2022).
- D'Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. eLife. 8, e42747 (2019).
- Zhang, X., et al. Evolution of copper step beams during graphene growth by CVD method. Applied Surface Science. 610, 155518 (2023).
- Zheng, L., et al. Uniform thin ice on ultraflat graphene for high-resolution cryo-EM. Nature Methods. 20 (1), 123-130 (2023).
- Fujita, J., et al. Epoxidized graphene grid for highly efficient high-resolution cryoEM structural analysis. Scientific Reports. 13, 2279 (2023).
- Lu, Y., et al. Functionalized graphene grids with various charges for single-particle cryo-EM. Nature Communications. 13, 6718 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados