Imágenes de calcio en retinas planas estimuladas eléctricamente
En este artículo
Resumen
Las prótesis de retina tienen la capacidad de generar percepciones visuales. Para avanzar en el desarrollo de nuevas prótesis, se necesitan métodos ex vivo para probar los dispositivos antes de su implantación. Este artículo proporciona un protocolo completo para estudiar la actividad del calcio en la capa de células ganglionares de la retina cuando se somete a estimulación eléctrica.
Resumen
Las distrofias de retina son una de las principales causas de ceguera en todo el mundo. Se están realizando grandes esfuerzos para desarrollar prótesis retinianas avanzadas que puedan eludir las células fotorreceptoras sensibles a la luz deterioradas en la retina degenerada, con el objetivo de restaurar parcialmente la visión mediante la inducción de percepciones visuales. Una vía común de investigación consiste en el diseño y la producción de dispositivos implantables con una estructura física flexible, que albergan un gran número de electrodos. Esto permite la generación eficiente y precisa de percepciones visuales. Sin embargo, con cada avance tecnológico, surge la necesidad de un método ex vivo fiable y manejable para verificar la funcionalidad del dispositivo antes de pasar a experimentos in vivo , en los que entran en juego factores que van más allá del rendimiento del dispositivo. Este artículo presenta un protocolo completo para estudiar la actividad del calcio en la capa de células ganglionares de la retina (LCG) después de la estimulación eléctrica. Específicamente, se describen los siguientes pasos: (1) marcar fluorescentemente la retina de la rata utilizando indicadores de calcio codificados genéticamente, (2) capturar la señal de fluorescencia usando un microscopio de fluorescencia invertida mientras se aplican distintos patrones de estimulación eléctrica, y (3) extraer y analizar los rastros de calcio de las células individuales dentro del GCL. Siguiendo este procedimiento, los investigadores pueden probar de manera eficiente nuevos protocolos de estimulación antes de realizar experimentos in vivo .
Introducción
La retina contiene fotorreceptores, que son células encargadas de detectar la luz. Capturan fotones y los convierten en impulsos nerviosos. Estos impulsos se procesan dentro de la retina y se transmiten a la corteza visual, lo que da lugar a la formación deuna imagen visual. La Retinosis Pigmentaria (RP) y la Degeneración Macular Asociada a la Edad (DMAE) son enfermedades degenerativas caracterizadas por la pérdida progresiva de fotorreceptores. Estas retinopatías se encuentran entre las principales causas de cegueraen todo el mundo1, afectan a millones de personas y tienen importantes consecuencias médicas, personales y socioeconómicas para los pacientes, los sistemas sanitarios y la sociedad en su conjunto. Además, con el envejecimiento de la población, se prevé que los casos de DMAE aumenten un 15% para 20502.
En la actualidad, se están llevando a cabo numerosos esfuerzos de investigación para restaurar la visión en pacientes afectados por estas afecciones3. Un abordaje prometedor es el uso de prótesis retinianas, que han demostrado eficacia en la restauración parcial de la visión 4,5. Estos dispositivos captan la luz de la escena visual y la convierten en pulsos eléctricos. Estos pulsos se administran a través de electrodos dentro de una matriz de microelectrodos (MEA) implantada en el ojo, estimulando las neuronas supervivientes y evitando la función de los fotorreceptores perdidos. Las células ganglionares de la retina activadas (CGR) transmiten la salida al cerebro, donde se interpreta como percepción visual. Sin embargo, las principales limitaciones de los implantes actuales radican en la resolución de la interfase electrodo-tejido6 y la estimulación no selectiva de diferentes tipos celulares. Por lo tanto, para optimizar el diseño de nuevos dispositivos implantables para una restauración de la visión más eficiente, es crucial comprender cómo se pueden desarrollar paradigmas de estimulación para activar selectivamente las células en las proximidades de los electrodos.
La imagen de calcio es una técnica ampliamente empleada para estudiar la actividad neuronal, ofreciendo varias ventajas sobre los métodos no ópticos 7,8. En primer lugar, proporciona resolución celular y subcelular. En segundo lugar, los marcadores de calcio pueden dirigirse a tipos específicos de células. En tercer lugar, permite el seguimiento a largo plazo y, en cuarto lugar, permite la observación de poblaciones celulares enteras al tiempo que distingue entre células activas e inactivas. Este método proporciona evidencia indirecta de la actividad celular con una resolución temporal en el rango de cientos de milisegundos. Los indicadores de calcio fluorescentes codificados genéticamente, como los sensores GCaMP, sufren un cambio conformacional al unirse al calcio, lo que resulta en un aumento de la fluorescencia9. Los vectores virales adenoasociados (AAV) recombinantes son un medio eficaz para transducir células de la retina con GCaMP10.
Este protocolo presenta un método eficiente que utiliza imágenes de calcio para probar los protocolos de estimulación de los implantes de retina. Específicamente, nos enfocamos en el tejido retiniano de rata ex vivo y proporcionamos instrucciones detalladas paso a paso, desde la adquisición de muestras hasta el análisis de datos. Al ofrecer esta guía completa, los investigadores de diversos orígenes pueden embarcarse en la experimentación de estimulación eléctrica con confianza.
Protocolo
Todos los procedimientos con animales se llevaron a cabo de acuerdo con las directrices estándar de ética animal (Directiva 86/609/UE de las Comunidades Europeas) y fueron aprobados por los comités locales de ética animal. Para el presente estudio se utilizaron ratas Long Evans de 8 semanas de edad. Los animales se obtuvieron de una fuente comercial (ver Tabla de Materiales).
1. Preparación de medios y montaje plano
- Medio de Ames (1 L)
- En un frasco de vidrio de 1 L, combine el polvo medio de Ames, 1,9 g/L de NaHCO3, 10 ml de penicilina/estreptomicina 100x y 1 litro de agua desionizada (consulte la tabla de materiales). Ajustar el pH a 7,4 y la osmolaridad a 280 mOsm con agua desionizada o NaHCO3. Esterilice la solución filtrándola a través de un filtro de tamaño de poro de 0,2 μm debajo de una campana.
NOTA: Almacenar el medio esterilizado a 4 °C. Esta solución permanece estable y se puede utilizar hasta por 1 mes.
- En un frasco de vidrio de 1 L, combine el polvo medio de Ames, 1,9 g/L de NaHCO3, 10 ml de penicilina/estreptomicina 100x y 1 litro de agua desionizada (consulte la tabla de materiales). Ajustar el pH a 7,4 y la osmolaridad a 280 mOsm con agua desionizada o NaHCO3. Esterilice la solución filtrándola a través de un filtro de tamaño de poro de 0,2 μm debajo de una campana.
- Membranas de montaje
- Fije una membrana porosa de PTFE (consulte la Tabla de materiales) a una arandela con pequeñas gotas de pegamento. Deja que se seque durante al menos 15 minutos.
- Para lograr la translucidez, sumerja las membranas en etanol al 70% durante 1 min.
- Enjuague las membranas dos veces con agua desionizada para eliminar completamente el etanol. Guárdalos en agua desionizada para evitar la opacidad.
2. Etiquetado GCL y montaje plano de retina de rata
NOTA: Este método de marcaje no diferencia las CGR de las células amacrinas desplazadas. Si se desea el marcaje selectivo de las CGR, se debe considerar el uso de AAV con promotores específicos de CGR11 y/o marcaje retrógrado a través del nervio óptico12. Para discriminar entre clases de CGR ON y OFF-center, clasifique las CGR en función de su respuesta a la luz13,14 y utilice versiones más recientes de indicadores de calcio codificados genéticamente que ofrecen una mayor sensibilidad y la capacidad de medir potenciales de acción individuales15.
- Inyección intravítrea
- Anestesiar a la rata Long Evans de 8 semanas de edad con isoflurano al 2%/1%O2 hasta que no haya reflejo pedale, y mantener la anestesia con una máscara nasal para ratas (ver Tabla de Materiales).
NOTA: Durante la anestesia, coloque al animal sobre una almohadilla térmica para mantener la temperatura corporal. - Administre una gota de gotas oftálmicas disponibles en el mercado (ver Tabla de Materiales) para dilatar la pupila.
- Antes de proceder con la cirugía, examine el ojo en busca de anomalías mediante fundoscopia y tomografía de coherencia óptica (OCT) con un sistema de imágenes de la retina in vivo . Aplicar una gota de Methocel al 2% para facilitar el contacto córnea-objetivo (ver Tabla de Materiales).
NOTA: Si se detecta alguna anomalía, no continúe con los pasos posteriores para ese ojo. - Aplique una gota de Prescaine como anestésico local. Fije el párpado y la conjuntiva limbal con un filamento de sutura disponible en el mercado (consulte la tabla de materiales). Realice una esclerotomía de 1 mm a 4 mm del limbo con una aguja de 30 G.
- Coloque una aguja roma de 36 G en una jeringa de precisión e inyecte las partículas AAV que transportan el indicador de calcio codificado genéticamente en el vítreo durante 30 s, en un ángulo de 45°. En este estudio, se utilizó AAV2-CAG-GCaMP5G (7,5 x 1011 GC/mL en HBSS) (ver Tabla de Materiales).
NOTA: Las construcciones de AAV que no codifican productos genéticos potencialmente cancerígenos o moléculas de toxinas y que se producen sin un virus auxiliar se pueden manipular en instalaciones de nivel de bioseguridad 1 (BSL-1). De lo contrario, si se considera material biopeligroso bajo la contención de BSL-2, se deben tomar las precauciones adecuadas16. Los AAV que codifican para GCaMP se consideran BSL-1 y no requieren manipulación en cabinas de bioseguridad.
- Coloque una aguja roma de 36 G en una jeringa de precisión e inyecte las partículas AAV que transportan el indicador de calcio codificado genéticamente en el vítreo durante 30 s, en un ángulo de 45°. En este estudio, se utilizó AAV2-CAG-GCaMP5G (7,5 x 1011 GC/mL en HBSS) (ver Tabla de Materiales).
- Aplique una gota de Tobradex (ver Tabla de Materiales) para prevenir la inflamación y como profilaxis antibiótica.
- Si lo desea, repita los pasos 2, 3 y 4 con el otro ojo.
NOTA: Revise a los animales 12-24 h después de la cirugía para asegurarse de que no haya reacciones adversas. - Tres días después de la inyección, examinar la estructura de la retina mediante fundoscopia y OCT con un sistema de imágenes de la retina in vivo (ver Tabla de materiales).
- Dos semanas después de la inyección, el GCL debe emitir fluorescencia. Evaluar la estructura de la retina y la expresión de AAV mediante fundoscopia de fluorescencia utilizando un sistema de imágenes de la retina in vivo .
NOTA: De acuerdo con Weitz et al.12, la fluorescencia de AAV2-CAG-GCaMP5G se hace perceptible a la semana siguiente a la inyección y se intensifica a las 2 semanas. A partir de la cuarta semana, la sobreexpresión de GCaMP induce citomorbilidad. Las células moribundas exhiben una alta señal de fluorescencia basal en el núcleo y el citoplasma que no fluctúa en respuesta a la estimulación. En las células sanas, la expresión de GCaMP está confinada al citoplasma y excluida del núcleo 7,8,12,17,18. Estas características pueden observarse ex vivo durante la obtención de imágenes microscópicas. La ventana de expresión génica puede variar según el vector viral y el promotor elegido.
- Anestesiar a la rata Long Evans de 8 semanas de edad con isoflurano al 2%/1%O2 hasta que no haya reflejo pedale, y mantener la anestesia con una máscara nasal para ratas (ver Tabla de Materiales).
- Escisión de retina y montaje plano
NOTA: Dos o tres semanas después de la inyección, las ratas inyectadas intravítreamente son sacrificadas inmediatamente antes de que comience el protocolo de electrofisiología, de acuerdo con las pautas éticas estándar (Directiva 86/609/UE de las Comunidades Europeas) y aprobadas por los comités éticos locales. La inhalación de dióxido de carbono (CO2) se utiliza como método de eutanasia en este protocolo.- Enucleación ocular
- Presione suavemente el exterior de la órbita con un par de pinzas curvas para sobresalir ligeramente el ojo de la cuenca del ojo.
- Use un par de tijeras de resorte para cortar los músculos que sostienen el ojo y enuclearlo, teniendo cuidado de no perforar el globo ocular.
NOTA: A partir de este paso, diseccione la retina bajo un microscopio estereoscópico en medio de Ames oxigenado (95% O2 / 5% CO2).
- Escisión de retina
- Use un par de pinzas curvas pequeñas y unas tijeras de resorte finas para quitar todo el tejido circundante del globo ocular.
- Coge un trozo de papel de filtro de aproximadamente 3 cm x 3 cm y colócalo sobre la tapa de un plato de 3,5 cm. Remoja el papel con el medio de Ames.
- Coloque el globo ocular encima del papel, con el segmento anterior mirando hacia el operador. Use un par de pinzas rectas para sujetar el globo ocular, colocándolas en la parte superior de la ora serrata en un ángulo de aproximadamente 45° con respecto a la superficie del plato. Haz un pequeño corte con una cuchilla, tomando como referencia el espacio entre las pinzas rectas.
- Devuelve el globo ocular al medio de Ames. Use un par de pinzas rectas y unas tijeras de resorte finas para separar los segmentos anterior y posterior del ojo.
- Retire con cuidado la lente con dos pares de pinzas rectas. Luego, separa la retina de la esclerótica.
- Corte la esclerótica hacia el nervio óptico con unas tijeras de resorte finas hasta que la retina quede aislada de la copa ocular.
- Utilice un microscopio estereoscópico de fluorescencia para identificar la región de la retina con la mejor expresión del indicador de calcio.
NOTA: El grado de propagación viral depende del éxito de la inyección intravítrea. Lograr la fluorescencia en grandes porciones de la retina puede requerir práctica. La experiencia del investigador juega un papel crucial en la obtención de resultados óptimos. - Con una pipeta de plástico de punta cortada, transfiera la pieza seleccionada de la retina a la membrana de montaje (pasos de membranas de montaje). Use un par de pinzas rectas para montar la retina plana con el GCL hacia arriba.
- Con una pipeta de plástico unida a una punta de pipeta de 100 μL, retire el medio para permitir que la pieza de retina se adhiera a la membrana porosa. Voltee el conjunto sobre el MEA para que el GCL descanse sobre los electrodos.
- Llene el baño de muestra con medio de Ames oxigenado.
- Enucleación ocular
3. Obtención de imágenes de calcio ex vivo tras estimulación eléctrica
NOTA: En este trabajo, se utilizó un MEA de prueba de concepto para la experimentación ex vivo . Los MEAs personalizados se fabricaron con electrodos porosos a base de grafeno de 25 μm de diámetro sobre vidrio de borosilicato de 500 μm de espesor con trazas de Ti/Au y posteriormente se aislaron con nitruro de silicio y fotorresistencia SU-812. Sin embargo, los métodos de obtención de imágenes de calcio son válidos independientemente del material del electrodo utilizado para la estimulación.
- Ajuste el sistema de perfusión de modo que el medio de Ames oxigenado perfunda constantemente el baño de muestras a 33 °C con un caudal constante de 5 ml/min.
- Usando un microscopio de fluorescencia invertida equipado con una lámpara fluorescente, un cubo de filtro FITC y una cámara CMOS, inspeccione la retina en busca de un área donde los electrodos estimulantes y la fluorescencia de las células que expresan GCaMP sean visibles. Para este estudio se utilizó un objetivo de aire 20x NA 0,75.
NOTA: Para estimular (y registrar) eficazmente las células con los electrodos, la retina y el electrodo deben estar en estrecho contacto. Por lo tanto, las células están visiblemente en el mismo plano focal que los electrodos. Si no es el caso, repita los pasos de la extirpación de la retina a partir del paso 8. Cuando se utilizan retinas de modelos animales sanos (con fotorreceptores en funcionamiento), hay que tener en cuenta que cada vez que se enciende la lámpara fluorescente, se producirán algunas respuestas evocadas generadas por la luz, ya que la retina es sensible a la luz a la longitud de onda utilizada para excitar el sensor GCaMP. Estos cambios de calcio inducidos por la luz se pueden utilizar para evaluar el estado de salud del tejido. Para evitar que la luz se mezcle con respuestas evocadas eléctricamente, encienda la lámpara fluorescente al menos 1 minuto antes de iniciar la adquisición de imágenes. - Para obtener respuestas evocadas eléctricamente en el GCL, seleccione un electrodo para enviar pulsos controlados por corriente. Configure los parámetros de estimulación eléctrica en el software del dispositivo generador de pulsos, tales como: forma, amplitud, duración, retardo de fase y frecuencia de los pulsos que se aplicarán.
NOTA: Los parámetros de estímulo efectivos pueden variar ampliamente desde anchos de pulso de 50 μs a 100 ms, con amplitudes que van desde 0,1 μA a 10 μA. Estos parámetros, junto con la frecuencia del estímulo, la polaridad del estímulo, el número de pulsos y los retrasos entre fases, pueden influir en la respuesta espaciotemporal observada por las imágenes de calcio 19,20,21,22. Un tren de 40 pulsos bifásicos que administran una estimulación de 1 ms y 2 μA a menudo genera una respuesta visible en las neuronas marcadas. - Para sincronizar la adquisición de imágenes con la administración de estimulación, utilice el generador de pulsos como disparador externo para controlar el inicio de la adquisición de imágenes. Conecte la cámara (consulte la Tabla de materiales) con el generador de impulsos utilizando la señal de disparo de salida y ajuste el "Modo de captura" del software de la cámara en "Disparador de inicio externo". Presione Inicio en el software de la cámara para que espere un disparador externo para comenzar. Inicie la adquisición de imágenes con el software generador de pulsos.
NOTA: Es posible que el control de disparo externo esté configurado de forma diferente para diferentes cámaras. Este estudio normalmente adquirió imágenes (512 x 512 píxeles, escala de grises de 16 bits) a 10 fotogramas por segundo durante 1 minuto, al tiempo que proporcionaba ráfagas de trenes de pulsos bifásicos cada 10 segundos. La entrega de pulsos comienza después de 10 s, por lo que los primeros fotogramas en todos los experimentos corresponden a la actividad espontánea. Dependiendo del sensor GCaMP y del análisis que se vaya a realizar, es posible que sea necesario ajustar la velocidad de grabación de acuerdo con los tiempos de subida y bajada de su indicador de calcio8. Considere la sensibilidad para detectar potenciales de acción individuales del indicador de calcio15. - Guarde las imágenes con un nombre de archivo que incluya los parámetros de estimulación eléctrica aplicados, como [Número de electrodo]_[Amplitud de impulso]_[Duración del impulso]_[Frecuencia de impulso]_Image001.
4. Análisis de datos
- ImageJ/FIJI para extraer el perfil de intensidad de fluorescencia a lo largo del tiempo y las coordenadas espaciales de los somas celulares
- Segmente la región de interés (ROI) con las "Herramientas de selección de área" y agréguela al Administrador de ROI (Herramientas de análisis > > Administrador de ROI > Agregar). En el menú Administrador de ROI, guárdelo como una carpeta .zip (Más > Guardar).
NOTA: Normalmente, se pueden aplicar los mismos ROI a todos los experimentos de estimulación, ya que corresponden al mismo campo de visión. - Seleccione el "Valor medio de gris" como parámetro a extraer (Analizar > Establecer mediciones).
- Extraiga el "Valor medio de gris" de los somas de la celda haciendo clic en Más > Multi Measure. Aparecerá un cuadro de diálogo. Habilite las opciones Medir los 600 sectores y Una fila por sector para obtener una sola tabla en la que las columnas correspondan a los ROI y las filas correspondan a los períodos de tiempo. Guarde la tabla generada como una hoja de cálculo .xls.
- Seleccione el "Centroide" como parámetro a extraer (Analizar > Establecer medidas).
- Extraiga el "Centroide" de los ROI haciendo clic en Medir. La tabla generada corresponde a las coordenadas (X,Y) de los ROIs. Guárdalo como una hoja de cálculo .xls.
- Segmente la región de interés (ROI) con las "Herramientas de selección de área" y agréguela al Administrador de ROI (Herramientas de análisis > > Administrador de ROI > Agregar). En el menú Administrador de ROI, guárdelo como una carpeta .zip (Más > Guardar).
- Script personalizado para identificar las células que responden a los estímulos
NOTA: Aquí se utilizó MATLAB (consulte la Tabla de materiales), pero los pasos descritos se pueden realizar en cualquier lenguaje de programación. Los usuarios pueden obtener nuestro script personalizado solicitando el autor correspondiente.- Corrección del efecto de fotoblanqueo: Para mitigar el efecto de fondo y fotoblanqueo, tome de 15 a 20 fotogramas de los períodos no estimulantes antes de cada ráfaga y ajústelos a una curva lineal [ajuste (poly1)].
NOTA: En este caso, para una película total de 600 fotogramas en la que se enviaron ráfagas periódicas de trenes de impulsos cada 10 s, los fotogramas 1:90, 170:190, 270:290, 370:390, 470:490, 570:590 se consideraron períodos no estimulantes. - Normalizar usando la fórmula: (X-min) / (max-min)
- Identificación de las células que responden
- Calcule la raíz cuadrática media (RMS) de los períodos no estimulantes a partir de los datos normalizados. Esto se considerará como la señal de referencia.
- Calcule el máximo de los períodos estimulantes (marcos entre los períodos no estimulantes). En este caso, para una película total de 600 fotogramas en la que se enviaron ráfagas periódicas de trenes de pulsos cada 10 s, los fotogramas 91:169, 191:269, 291:369, 391:469, 491:569 se consideraron como los períodos de estimulación.
- Si el valor máximo supera la señal de referencia en 2,5 veces para un ROI específico, etiquete la celda como respondiendo a ese período de estimulación. Si la célula responde a tres de los cinco períodos de estimulación, clasifíquela como una célula que responde.
- Corrección del efecto de fotoblanqueo: Para mitigar el efecto de fondo y fotoblanqueo, tome de 15 a 20 fotogramas de los períodos no estimulantes antes de cada ráfaga y ajústelos a una curva lineal [ajuste (poly1)].
Resultados Representativos
El protocolo descrito en este estudio se basa en los estudios de fluorescencia y estimulación eléctrica realizados por Weitz et al.12. El protocolo consta de tres partes principales: (1) marcaje fluorescente de la LCG y montaje plano de la retina en la MEA (Figura 1 a la izquierda), (2) visualización de la actividad del calcio en la LCG durante la estimulación eléctrica (Figura 1 al centro) y (3) extracción, procesamiento e interpretación de los datos de imagen (Figura 1 a la derecha).
En primer lugar, como se muestra en la Figura 1 a la izquierda, a las ratas Long Evans se les inyecta intravítreamente AAV2-CAG-GCaMP5G antes de la sesión de imágenes. La expresión viral óptima para este vector ocurre de 2 a 3 semanas después de la inyección12,18. Después de anestesiar completamente al animal, se hace un orificio piloto con una aguja de 30 G, y luego se inyectan lentamente 5 μL de AAV2-CAG-GCaMP5G en el vítreo usando una aguja roma de 36 G unida a una jeringa de precisión para prevenir el reflujo. Durante la expresión viral, se utiliza un sistema de imágenes de la retina in vivo para evaluar el estado de la retina después de la cirugía, con imágenes de OCT que proporcionan una visualización detallada de las capas de la retina. Una vez que se logra la expresión génica, la retina se extrae cuidadosamente del ocular utilizando un microscopio estereoscópico y herramientas de disección de alta precisión. A partir de este momento, el tejido se manipula en medios oxigenados para preservar la muestra. A continuación, la retina extirpada, con el LCG hacia arriba, se monta en una plataforma diseñada para montaje plano con el fin de garantizar la estabilidad y evitar que la muestra flote. La muestra se monta en la superficie MEA con el GCL orientado hacia los electrodos.
A continuación, el MEA se monta en su placa de interfaz en un microscopio fluorescente invertido (Figura 1-centro). La muestra de retina se perfunde con medios oxigenados a 33 °C mediante un sistema de perfusión. La muestra se puede mantener en esta configuración durante varias horas. Se programa el esquema de estimulación deseado y las imágenes se adquieren a una velocidad de 10 fotogramas por segundo. Se recomienda nombrar las películas de acuerdo con los parámetros de estimulación eléctrica aplicados. La adquisición de imágenes debe comenzar antes del inicio de la estimulación para obtener algunos fotogramas basales sin estimulación, que servirán como control negativo.
Finalmente, como se ilustra en la Figura 1 a la derecha, los datos se extraen de las imágenes de lapso de tiempo segmentando los somas celulares. Los efectos del fotoblanqueo se corrigen ajustando los datos y se identifican las células que responden. Las células sensibles se definen como aquellas con picos de fluorescencia durante la estimulación que superan su línea de base en 2,5 veces. Si una célula responde a tres de las cinco ráfagas de estimulación, se considera que responde a ese tren específico de estimulación.
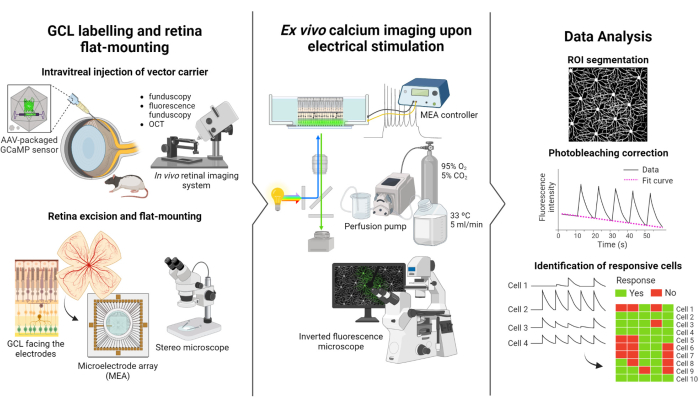
Figura 1: Resumen del estudio. Ilustración esquemática del protocolo para (izquierda) marcar fluorescentemente el GCL de la retina y el montaje de la muestra (centro), preparar la preparación para los registros ex vivo con estimulación eléctrica proporcionada por un MEA, y (derecha) analizar los datos de imágenes de calcio para clasificar las células que responden. Haga clic aquí para ver una versión más grande de esta figura.
Retina inyectada por vía intravítrea
La incidencia de complicaciones asociadas con las inyecciones intravítreas es muy baja. Sin embargo, existen algunas complicaciones que pueden surgir de la cirugía en sí, independientemente del componente inyectado. Estas complicaciones incluyen formación de cataratas, hemorragia vítrea, elevación de la presión intraocular y endoftalmitis23. Para determinar si estas complicaciones son causadas por la cirugía, el animal debe someterse a una evaluación antes del procedimiento mediante fondo de ojo y OCT. Tres días después de la inyección, se debe realizar un seguimiento de los animales. En la Figura 2A-D, se muestra la retina de un animal sano inyectado. Después de dos semanas de inyección, los RGC comienzan a expresar fluorescencia, que se puede visualizar mediante fundoscopia de fluorescencia (Figura 2B, C). Las imágenes de OCT proporcionan una visualización detallada de la disposición y el grosor de las capas de la retina (Figura 2D), lo que ofrece una mayor resolución en comparación con la funduscopia, especialmente cuando se evalúa el desprendimiento de retina. Una vez que la retina se monta en plano y se obtienen imágenes con un microscopio de fluorescencia invertida, es posible distinguir las células y los haces de axones. A diferencia de otros indicadores de calcio, el indicador GCaMP está restringido al citoplasma7 y la fluorescencia está excluida del núcleo (Figura 2E).
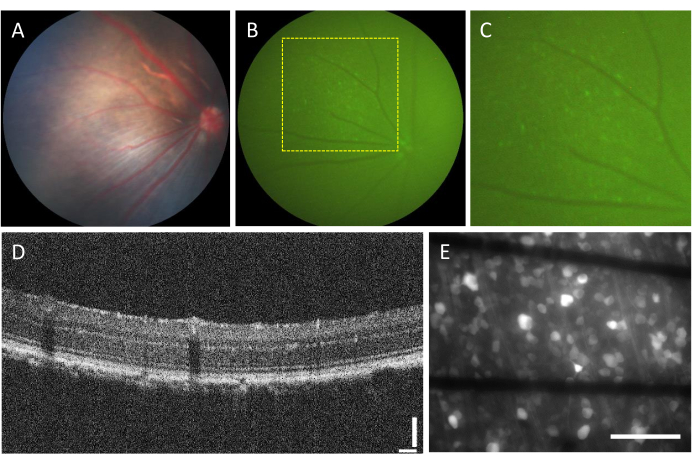
Figura 2: Imágenes representativas de la retina inyectada intravítrea. (A) Fundoscopia, (B) fundoscopia de fluorescencia, (C) zoom de la fundoscopia de fluorescencia, (D) imagen OCT y (E) imagen de epifluorescencia de la retina extirpada montada en un MEA personalizado con electrodos basados en grafeno sobre vidrio de borosilicato de 500 μm de espesor. En (E), las líneas negras corresponden a trazas de Ti/Au. Barras de escala: 115 μm (D) y 100 μm (E). Haga clic aquí para ver una versión más grande de esta figura.
Electrodos y contacto GCL
Para evocar respuestas neuronales de manera efectiva, es crucial asegurarse de que la retina de montaje plano esté en estrecho contacto con la superficie de la MEA. Una forma sencilla de verificar esto es confirmando visualmente si las celdas y los electrodos están ubicados en el mismo plano focal (Figura 3A). Si las células no están en el mismo plano focal que los electrodos (Figura 3B), indica que el contacto no es óptimo, lo que dará lugar a una estimulación menos efectiva.
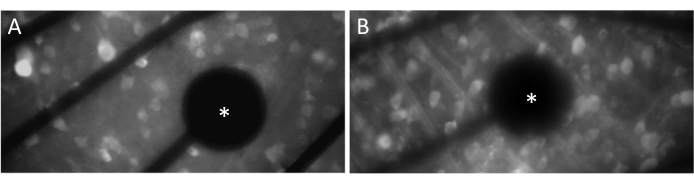
Figura 3: Electrodos y contacto GCL. (A) Celdas y el electrodo (asterisco) en el mismo plano focal. (B) Celdas y electrodos que no están en el mismo plano focal, lo que indica un contacto subóptimo para la estimulación eléctrica en esa área. Haga clic aquí para ver una versión más grande de esta figura.
Obtención de imágenes de calcio ex vivo tras estimulación eléctrica proporcionada por un MEA
Los datos resultantes de las imágenes de calcio consisten en imágenes de lapso de tiempo que monitorean la actividad neuronal de cientos de células en respuesta a la estimulación eléctrica. Los estímulos supraumbrales provocan una entrada de calcio en los somas celulares, lo que resulta en un cambio repentino en la intensidad de la fluorescencia (Video 1). Este protocolo permite determinar si un electrodo, MEA y/o algoritmo de estimulación provoca la respuesta deseada en el tejido neural. El tamaño y el paso de los electrodos en el MEA, así como la proporción de tejido que se está estudiando, determinarán el aumento objetivo apropiado a elegir. Normalmente, para estudios de estimulación con un solo electrodo con diámetros que oscilan entre 5 μm y 100 μm, es adecuado un aumento objetivo de 20-25x (Figura 4A), que proporciona un campo de visión de aproximadamente 600 μm x 600 μm. Para experimentos que impliquen estimulación con múltiples electrodos, puede ser necesario un aumento objetivo de 4-10x para evaluar un área más amplia de alrededor de 2 mm x 2 mm. Las celdas interactivas se pueden identificar fácilmente generando una proyección de imagen de desviación estándar de la película time-lapse (Figura 4B y vídeo 1).
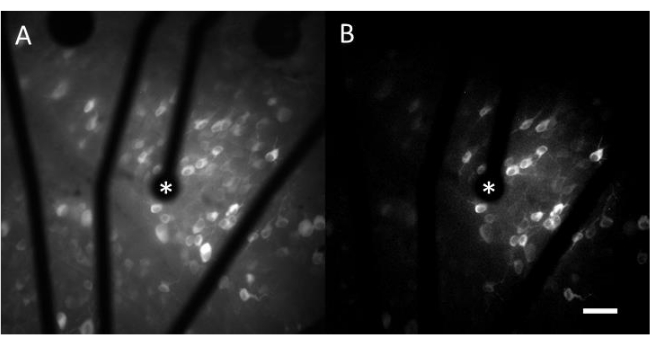
Figura 4: Imagen de calcio del LCG con estimulación eléctrica proporcionada por un electrodo de 25 μm de diámetro. (A) Proyección máxima de una película time-lapse de 60 s y (B) proyección de desviación estándar que muestra claramente las células que responden a los estímulos eléctricos de un electrodo poroso basado en grafeno de 25 μm de diámetro. El electrodo estimulante se indica con un asterisco. Barra de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Análisis de la dinámica del calcio a lo largo del tiempo tras la estimulación controlada
Para cada soma celular identificado, se extrajeron los valores medios de intensidad a lo largo del tiempo. La Figura 5A muestra las trazas de calcio corregidas por fotoblanqueo de las células que responden. En este ejemplo, se entregaron cinco ráfagas de trenes de impulsos bifásicos (primero catódico, 40 ciclos, 1 ms de duración, 2 μA de amplitud) cada 10 s (indicados por líneas negras) durante una adquisición de imágenes de 60 s. Dentro de un experimento dado, se aplican los mismos cinco trenes de pulsos para probar la consistencia de la respuesta. Los fotogramas capturados durante los períodos no estimulantes (resaltados en rojo) se utilizan para realizar un ajuste lineal, corrigiendo el efecto de fotodecoloración.
Una vez que se identifican las células que responden y se conocen sus coordenadas (x,y) en relación con el electrodo de estimulación, se puede examinar la relación entre la corriente requerida para activar las células y la distancia desde el electrodo de estimulación (Figura 5B). Como era de esperar, las celdas ubicadas más cerca del electrodo estimulante requieren valores de corriente más bajos para evocar una respuesta.
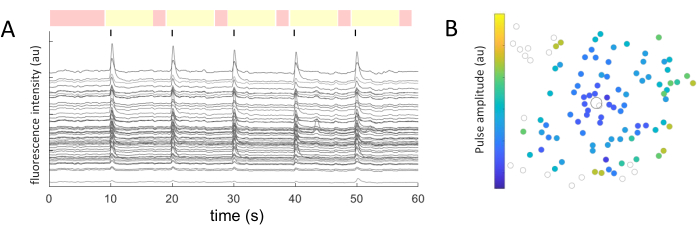
Figura 5: Representación de las respuestas evocadas eléctricamente. (A) Trazas de calcio de somas celulares tras 5 ráfagas de trenes de pulsos (bifásicos, catódicos primero, 40 ciclos, 1 ms de duración, 2 μA de amplitud) cada 10 s (líneas negras) durante una adquisición de imágenes de 60 s. Se muestran los períodos no estimulantes (fotogramas resaltados en rojo) y estimulantes (fotogramas resaltados en amarillo). Las trazas que superan la señal basal (raíz cuadrada media de los períodos no estimulantes) en 2,5 veces se consideran respuestas evocadas. Las células que responden en tres de los cinco períodos de estimulación se clasifican como células que responden. (B) Mapa de distribución de la actividad del calcio que muestra el electrodo estimulante (círculo delineado en negro) y las células (círculo delineado en gris). El código de colores representa la amplitud de pulso mínima necesaria para evocar una respuesta celular. Haga clic aquí para ver una versión más grande de esta figura.
Vídeo 1: Imagen de calcio del LCG con estimulación eléctrica proporcionada por un electrodo de 25 μm de diámetro. El vídeo muestra las diferencias en la intensidad de la fluorescencia debidas a la estimulación eléctrica de un electrodo poroso basado en grafeno de 25 μm de diámetro. El lado izquierdo muestra la película original y el lado derecho muestra la proyección de la desviación estándar donde se pueden identificar fácilmente las celdas que responden. Barra de escala: 50 μm. Haga clic aquí para descargar este video.
Discusión
El protocolo aquí descrito sirve para estudiar la dinámica del calcio que se produce en el LCG de la retina de la rata tras la estimulación eléctrica proporcionada con un MEA. Es un método fiable y manejable, pero requiere algo de entrenamiento, sobre todo para etiquetar uniformemente el LCG de forma eficiente y para montar la retina correctamente para garantizar un contacto óptimo entre el tejido y el electrodo. Este protocolo es específico para roedores y debe adaptarse si se aplica a una especie de laboratorio diferente. Se presentan en detalle los puntos críticos, modificaciones y limitaciones de la metodología.
Inyecciones intravítreas
Las inyecciones se utilizan ampliamente para la administración de genes oculares, siendo las inyecciones intravítreas el procedimiento preferido. Se ha demostrado que son más seguras y menos invasivas en comparación con las inyecciones subretinianas, que introducen las moléculas de interés directamente entre los fotorreceptores y el epitelio pigmentario de la retina (EPR), con riesgo de desprendimiento de retina10. Sin embargo, existen limitaciones, especialmente cuando se realizan estas inyecciones en modelos de roedores. El humor vítreo es gelatinoso, lo que dificulta la difusión viral. Además, el cristalino de los ojos de los roedores es grande, por lo que no es trivial insertar la aguja sin rayarla. Las agujas de jeringa de precisión son delicadas y deben reemplazarse con frecuencia. Para evitar obstrucciones, lávelos con agua desionizada antes y después de cada uso y reemplácelos regularmente. Además, inyecte el contenido lentamente para evitar el reflujo de la solución y los cambios en la presión intraocular. Lograr una fluorescencia grande y uniforme a través de la retina puede requerir práctica.
Transducción de células retinianas
Los vectores virales son un método excelente para la administración de genes in vivo, y los AAV se han utilizado ampliamente para la transducción de células de la retina10. Han sido aprobados como tratamiento para algunas retinopatías causantes de ceguera humana24. Sin embargo, su capacidad de portador está limitada a 5 kb, incluyendo los elementos regulatorios requeridos (por ejemplo, el promotor)10,25. Hay múltiples serotipos disponibles, cada uno con un tropismo diferente. Elegir el AAV más adecuado en función de los genes que se van a entregar y de las células que se van a transducir26. Para el etiquetado de los RGC, se recomienda utilizar AAV227.
Ventana de expresión génica
La expresión viral óptima para AAV2-CAG-GCaMP5G es de 2 a 3 semanas después de la inyección 12,18. Más allá de ese período de tiempo, los núcleos de las células transfectadas se vuelven fluorescentes, las células dejan de responder a los estímulos y, finalmente, mueren 7,28,29. Esto se debe a la sobreexpresión del indicador GCaMP, que se transloca al núcleo. La ventana de tiempo para la expresión génica óptima variará según el vector viral y el promotor elegido30 y debe determinarse experimentalmente antes de continuar con este protocolo.
Contacto tejido-electrodo
Para obtener resultados óptimos y reproducibles, es crucial lograr un buen contacto tejido-electrodo. La falta de contacto suele deberse a la curvatura natural de la retina. Un enfoque consiste en cortar la retina en cuartos, montarla y obtener imágenes de una sección a la vez. Las pequeñas porciones de la retina se pueden aplanar mejor, lo que resulta en un contacto más efectivo con la superficie de la MEA. Otra posible razón para el mal contacto es la presencia de humor vítreo. Al realizar experimentos de estimulación simulando un implante epirretiniano, es importante eliminar cuidadosamente el humor vítreo durante la escisión de la retina, ya que puede actuar como aislante de la corriente. Aquí, se describe un método simple para verificar si el contacto es suficiente visualizando el electrodo y las celdas en el mismo plano focal.
Una alternativa a las mediciones retinianas ex vivo es cultivar neuronas directamente en la superficie de los electrodos. El cultivo primario de neuronas, como las neuronas del hipocampo31, puede ser útil para las pruebas iniciales para evaluar la funcionalidad del nuevo dispositivo estimulante. Sin embargo, este enfoque todavía requiere el uso de animales de laboratorio y no representa la complejidad de la red retiniana, que es importante para evaluar las respuestas sinápticas a la estimulación.
Para visualizar las celdas debajo del electrodo y las trazas de electrodos, se pueden utilizar MEA fabricados con materiales transparentes como el óxido de indio y estaño (ITO) 19,20,32. Además de las mediciones ópticas, la actividad de GCL tras la estimulación eléctrica se puede evaluar a través de registros eléctricos. El MEA se puede utilizar para registrar el potencial de campo local (LFP) del tejido. Sin embargo, esto compromete la resolución espacial, ya que cada electrodo captura la actividad de varias celdas simultáneamente (dependiendo de las dimensiones del electrodo). La grabación óptica supera esta limitación y ofrece un mapeo de mayor resolución espacial. Su principal ventaja es la capacidad de distinguir entre células activas e inactivas mientras se mide un gran campo de visión con resolución de una sola célula. Entre todos los indicadores de actividad celular, los indicadores de calcio están bien descritos y son los más utilizados33.
Divulgaciones
Los autores no tienen revelaciones que añadir al manuscrito.
Agradecimientos
Agradecemos a Merche Rivas, Angel Sandoval, Jesús Planagumà, Jordi Cortés, Sandra Ortonobés Lara y Alina Hirschmann (ICFO-Institut de Ciències Fotòniques) por su apoyo técnico, a Anna Duarri (VHIR, Vall d'Hebron Instituto de Investigación) del grupo de Investigación en Oftalmología por su apoyo con las inyecciones intravítreas y la imagen de retina in vivo .
Las entidades financiadoras que apoyaron este trabajo son: Fundació CELLEX; Fundació Mir-Puig; Ministerio de Economía y Competitividad - Programa Severo Ochoa de Centros de Excelencia en Investigación y Desarrollo (CEX2019-000910-S, [MCIN/AEI/10.13039/501100011033]); Generalitat de Catalunya a través del programa CERCA; Laserlab-Europe (EU-H2020 GA n.º 871124); Fundación La Caixa (LCF/HR19/52160003); y Fondo Social Europeo (PRE2020-095721, M.C.).
Materiales
| Name | Company | Catalog Number | Comments |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | - |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | - |
| 30 G needle | VWR | 613-5373 | - |
| 36 G blunt needle | World Precision Instruments | NF36BL-2 | - |
| 6 cm Cell culture dish | Nunc | 12-565-94 | - |
| AAV2-CAG-GCaMP5G | Vector Biolabs | - | - |
| Ames' Medium | Sigma Aldrich | A1420 | - |
| Blade | Swann-morton | 0308 | - |
| Camera | Hamamatsu | ORCA Flash v4.0 | - |
| Carbogen | Air liquide | - | - |
| Curved-forceps | - | - | - |
| Fine spring-scissors | FST | 91501-09 | - |
| FITC filter cube | Nikon | Standard series | - |
| Fluorescent lamp | Nikon | C-HGFI | - |
| Fluorescent stereomicroscope | Nikon | SMZ25 | - |
| HBSS | Capricorn | HBSS-1A | - |
| ImageJ/FIJI | NIH | v1.50i | - |
| In vivo retinal imaging system | Phoenix Research Laboratories | Micron III | - |
| Inverted fluorescence microscope | Nikon | Eclipse Ti | - |
| Isofluorane | Arrane Baxter Laboratories | - | - |
| Long-Evans rat | Janvier | - | - |
| MATLAB (Version R2021b) | Mathworks | - | - |
| Media filters | Merckmillipore | SCGPS02RE | - |
| Methocel 2% | Omni Vision | - | - |
| Microelectrode array (MEA) | - | Custom-made | |
| NaHCO3 | Thermofisher | 42427 | - |
| Penicillin/Streptomycin 100x | Thermofisher | 15140122 | - |
| Phenylephrine | Alcon Cusí Laboratories | 653437.3 | 100 mg/mL |
| Plastic pipette | VWR | 612-1793 | - |
| Porous membrane | Merckmillipore | #JVWP01300 | - |
| Precision syringe | World Precision Instruments | 10 µl Nanofil | - |
| Prescaina | Llorens | - | Oxybuprocaine chlorhydrate (2 mg/mL), local anesthetic |
| Rat nasal mask | Xenotec | XRK-RA | - |
| Small curved-forceps | Bbraun | AESCBD311R | - |
| Spring-scissors | FST | 15040-11 | - |
| Stereo microscope | Zeiss | Stemi 2000 | - |
| Straight forceps | FST | 11252-20 | - |
| Suture filament | Vitrex Medical | 4328 | Nilon monofilament, 7/0, DS12 |
| Tobradex | Alcon Cusí Laboratories | - | Tobramycin (3 mg/mL) and dexamethasone (1 mg/mL) |
| Tropicamide | Alcon Cusí Laboratories | 653486 | 10 mg/mL |
| Washer | Thorlabs | W8S038 | - |
Referencias
- Bourne, R. R. A., et al. Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: Magnitude, temporal trends and projections. British Journal of Ophthalmology. 102 (5), 575-585 (2018).
- Li, J. Q., et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. British Journal of Ophthalmology. 104 (8), 1077-1084 (2020).
- Roska, B., Sahel, J. A. Restoring vision. Nature. 557 (7705), 359-367 (2018).
- Hornig, R., Velikay-Parel, M. Retina implants. Implantable Sensor Systems for Medical Applications. , 469-496 (2013).
- Lewis, P. M., et al. Advances in implantable bionic devices for blindness: a review. ANZ Journal of Surgery. 86 (9), 654-659 (2016).
- Weiland, J. D., Walston, S. T., Humayun, M. S. Electrical stimulation of the retina to produce artificial vision. Annual Review of Vision Science. 2, 273-294 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Sahu, B., Chug, I., Khanna, H. The ocular gene delivery landscape. Biomolecules. 11 (8), 1135 (2021).
- Hanlon, K. S., et al. A novel retinal ganglion cell promoter for utility in AAV vectors. Frontiers in Neuroscience. 11, (2017).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. Journal of Neurophysiology. 9 (7), 1979-1988 (2013).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. Journal of Neurophysiology. 105 (5), 2601-2609 (2011).
- Baden, T., Berens, P., Franke, K., Román Rosón, M., Euler, T. The functional diversity of retinal ganglion cells in the mouse. Nature. 529, 345-350 (2016).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615, 884-891 (2023).
- Meyer, E. L., Jenkins, C., Rengarajan, K. NIH Guidelines April 2019. Applied Biosafety. 24, (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chang, Y. -. C., Walston, S. T., Chow, R. H., Weiland, J. D. GCaMP expression in retinal ganglion cells characterized using a low-cost fundus imaging system. Journal of Neural Engineering. 14 (5), 056018 (2017).
- Weitz, A. C., et al. Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Science Translational Medicine. 7 (318), 1-12 (2015).
- Chang, Y. C., Ghaffari, D. H., Chow, R. H., Weiland, J. D. Stimulation strategies for selective activation of retinal ganglion cell soma and threshold reduction. Journal of Neural Engineering. 16 (2), 026017 (2019).
- Im, M., Fried, S. I. Temporal properties of network-mediated responses to repetitive stimuli are dependent upon retinal ganglion cell type. Journal of Neural Engineering. 13 (2), 025002 (2016).
- Jensen, R. J., Ziv, O. R., Rizzo, J. F. Thresholds for activation of rabbit retinal ganglion cells with relatively large, extracellular microelectrodes. Investigative Ophthalmology & Visual Science. 46 (4), 1486-1496 (2005).
- Ramos, M. S., et al. Patient-reported complications after intravitreal injection and their predictive factors. Ophthalmology Retina. 5 (7), 625-632 (2021).
- Vandenberghe, L. H., Auricchio, A. Novel adeno-associated viral vectors for retinal gene therapy. Gene Therapy. 19 (2), 162-168 (2012).
- Zin, E. A., Ozturk, B. E., Dalkara, D., Byrne, L. C. Developing new vectors for retinal gene therapy. Cold Spring Harbor Perspectives in Medicine. , a041291 (2023).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy-Methods & Clinical Development. 17, 69-82 (2020).
- Hellström, M., et al. Cellular tropism and transduction properties of seven adeno-associated viral vector serotypes in adult retina after intravitreal injection. Gene Therapy. 16 (4), 521-532 (2009).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11, 566-597 (2016).
- Yang, Y., et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications. 9, 1504 (2018).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: comparison of five promoters. Gene Therapy. 30, 503-519 (2023).
- Cunquero, M., Aguilar, E., Loza-Alvarez, P., Planagumà, J. Hippocampal neuronal cultures to detect and study new pathogenic antibodies involved in autoimmune encephalitis. Journal of Visualized Experiments. 184, e63829 (2022).
- Behrend, M. R., Ahuja, A. K., Humayun, M. S., Chow, R. H., Weiland, J. D. Resolution of the epiretinal prosthesis is not limited by electrode size. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 19 (4), 436-442 (2011).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados