Aislamiento simultáneo de los principales tipos de células residentes en el sistema nervioso central de ratones adultos con encefalomielitis autoinmune
* Estos autores han contribuido por igual
En este artículo
Resumen
Hasta la fecha, los protocolos para el aislamiento simultáneo de todos los principales tipos de células residentes en el sistema nervioso central del mismo ratón son una demanda insatisfecha. El protocolo muestra un procedimiento aplicable en ratones con encefalomielitis autoinmune naïve y experimental para investigar redes celulares complejas durante la neuroinflamación y, al mismo tiempo, reducir el número de ratones requerido.
Resumen
La encefalomielitis autoinmune experimental (EAE) es el modelo murino más común para la esclerosis múltiple (EM) y se utiliza con frecuencia para dilucidar aún más la etiología aún desconocida de la EM con el fin de desarrollar nuevas estrategias de tratamiento. El modelo EAE del péptido glicoproteico de oligodendrocitos de mielina 35-55 (MOG35-55) reproduce un curso monofásico autolimitado de la enfermedad con parálisis ascendente dentro de los 10 días posteriores a la inmunización. Los ratones son examinados diariamente utilizando un sistema de puntuación clínica. La EM está impulsada por diferentes mecanismos patológicos con un patrón temporal específico, por lo que la investigación del papel de los tipos de células residentes en el sistema nervioso central (SNC) durante la progresión de la enfermedad es de gran interés. La característica única de este protocolo es el aislamiento simultáneo de todos los principales tipos de células residentes en el SNC (microglía, oligodendrocitos, astrocitos y neuronas) aplicables en EAE adultos y ratones sanos. La disociación del cerebro y la médula espinal de los ratones adultos es seguida por la clasificación de células activadas magnéticamente (MACS) para aislar la microglía, los oligodendrocitos, los astrocitos y las neuronas. Se utilizó citometría de flujo para realizar análisis de calidad de las suspensiones unicelulares purificadas, confirmando la viabilidad después del aislamiento celular e indicando la pureza de cada tipo celular de aproximadamente el 90%. En conclusión, este protocolo ofrece una forma precisa y completa de analizar redes celulares complejas en ratones sanos y EAE. Además, el número de ratones requerido puede reducirse sustancialmente, ya que los cuatro tipos de células se aíslan de los mismos ratones.
Introducción
La esclerosis múltiple (EM) es una enfermedad autoinmune inflamatoria crónica del sistema nervioso central (SNC) caracterizada por desmielinización, daño axonal, gliosis y neurodegeneración. A pesar de los numerosos enfoques de investigación en este campo, la fisiopatología de la EM aún no se comprende completamente 1,2,3,4. El modelo animal más común para investigar la EM es la encefalomielitis autoinmune experimental (EAE) inducida por el péptido glicoproteico de oligodendrocitos de mielina 35-55 (MOG35-55), que comparte muchas de sus características clínicas y fisiopatológicas 5,6,7,8,9 . Se basa en la respuesta del sistema inmunitario contra los antígenos específicos del SNC que conducen a la inflamación, la desmielinización y la degeneración neuroaxonal. La encefalomielitis autoinmune experimental (EAE) es un modelo adecuado para la investigación de las vías neuroinflamatorias y las cascadas de señalización que se encuentran en la EM.
Las opciones terapéuticas actuales para la EM son solo parcialmente efectivas y se centran principalmente en la fase inflamatoria inicial de la enfermedad. Sin embargo, el componente neurodegenerativo de la EM parece ser el principal desafío para los enfoques terapéuticos a largo plazo. Por lo tanto, se requieren protocolos de aislamiento celular reproducibles y precisos para investigar los mecanismos moleculares y celulares en las enfermedades autoinmunes de manera integral. Aunque existen algunos protocolos para el aislamiento de un solo tipo de célula 10,11,12,13,14,15, existe una necesidad insatisfecha para el aislamiento simultáneo de varias poblaciones celulares residentes en el SNC a la vez. Los protocolos previos para el aislamiento de células residentes en el SNC carecen de preservación de la funcionalidad y pureza celular, lo que resulta en el cocultivo con células vecinas 16,17,18 o la inadecuación para análisis complejos de redes intracelulares ex vivo 19,20,21,22.
El objetivo de este protocolo fue establecer un método reproducible y completo para el aislamiento simultáneo de suspensiones unicelulares viables puras de todos los principales tipos de células residentes en el SNC, aplicable en ratones adultos sanos y EAE. Los diferentes tipos celulares se aislaron mediante clasificación celular activada magnéticamente (MACS)23. La separación celular puede lograrse mediante selección positiva, es decir, marcaje magnético de marcadores de superficie específicos del tipo celular, o mediante selección negativa a través de la biotinilación y el agotamiento de todas las células no deseadas. Se aplicó citometría de flujo para asegurar una pureza superior al 90% y una viabilidad de al menos el 80% de las suspensiones unicelulares aisladas.
En conclusión, el objetivo principal fue establecer un protocolo para el aislamiento simultáneo de todos los principales tipos de células residentes en el SNC como una herramienta versátil para la investigación de vías neuroinflamatorias que ofrezca un análisis completo y preciso de redes celulares complejas y cascadas de señalización bioquímica en ratones sanos y EAE.
Protocolo
Todos los experimentos de EAE fueron inducidos en ratones hembra C57BL/6J a la edad de 10-12 semanas y aprobados por las autoridades locales (Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen). También se garantizó el cumplimiento de la legislación alemana y de la UE en materia de protección animal en todo momento de los experimentos. Todos los ratones se mantuvieron en jaulas ventiladas individualmente en condiciones de alojamiento de animales.
NOTA: Los siguientes volúmenes de reactivos se refieren a un cerebro murino adulto y a la médula espinal, que se denominan suspensión de células del SNC en el siguiente documento y pesan aproximadamente entre 20 mg y 500 mg. Si se planea la disociación de más de una suspensión de células del SNC, todos los volúmenes de reactivos y materiales deben ampliarse en consecuencia. Se recomienda almacenar la solución salina tamponada con fosfato de Dulbecco (D-PBS; 1x) con calcio y magnesio, suplementada con 1 g/L de glucosa y 36 mg/L de piruvato de sodio) de forma continua en hielo durante todo el experimento. Si el cultivo de células se planifica después, realice todos los pasos en condiciones estériles mediante el uso de campanas. De lo contrario, no es necesario realizar ninguna de las siguientes secciones del protocolo bajo capó. Guarde los tampones en hielo. Utilice solo soluciones preenfriadas y evite el vórtice durante todo el experimento. Consulte la figura 1 para ver el flujo de trabajo general.
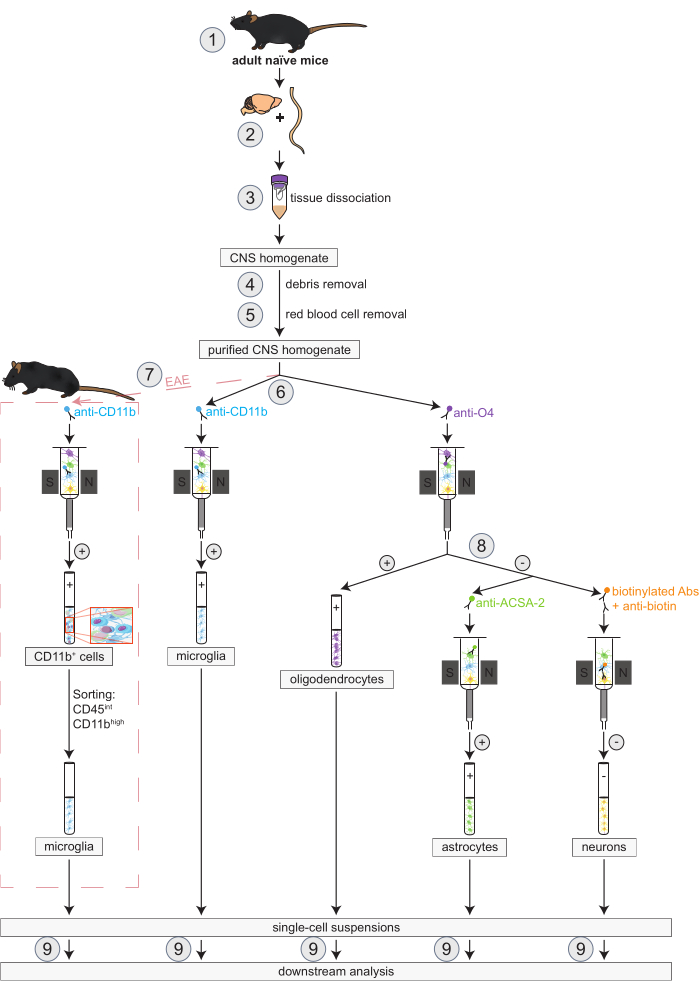
Figura 1: Flujo de trabajo para el aislamiento simultáneo de oligodendrocitos, microglía, astrocitos y neuronas en ratones naïve y EAE. Los primeros pasos del flujo de trabajo son los mismos tanto para los ratones naïve como para los EAE. Si se desea trabajar con una réplica de EAE, se debe realizar previamente la inducción de EAE (1). En resumen, el protocolo comienza con la disección (2) y disociación (3) del cerebro y la médula espinal murinos, seguida de la eliminación de restos (4) y glóbulos rojos (5). Posteriormente, la suspensión de células del SNC purificada resultante se divide en dos fracciones para el aislamiento simultáneo de oligodendrocitos y microglía a través de MACS (6). La microglía se detecta a través de microesferas anti-CD11b, mientras que los oligodendrocitos se aíslan mediante microesferas anti-O4 (selecciones positivas). A partir del flujo negativo de los oligodendrocitos (8), los astrocitos se aíslan a través de microesferas anti-ACSA-2 (selección positiva) y las neuronas mediante el marcaje de biotina y el agotamiento de todas las células no neuronales (selección negativa). En ratones EAE, el aislamiento de las células CD11b+ es seguido por la clasificación celular activada por fluorescenciade las células altas CD45intCD11b para eliminar otras células inmunitarias CD11b+ como macrófagos, células dendríticas, monocitos, granulocitos y células asesinas naturales que se sabe que participan en procesos de neuroinflamación durante el curso de EAE (7)27,28,48. Tras el aislamiento de los diferentes tipos de células residentes en el SNC, se pueden realizar análisis de pureza (9). Abreviaturas: Abs = anticuerpos; ACSA-2 = antígeno 2 de la superficie de la célula de astrocitos; CD11b = quinasa 11B dependiente de ciclina; CD45 = tirosina y proteína fosfatasa C de tipo receptor; SNC = sistema nervioso central; EAE = encefalomielitis autoinmune experimental; MACS = clasificación de células activadas magnéticamente; O4 = marcador de oligodendrocitos O4. Esta cifra ha sido modificada de49. Haga clic aquí para ver una versión más grande de esta figura.
1. Inducción de EAE activa
- Preparación de reactivos
- Para la separación celular: Prepare el tampón PB y guárdelo a 2-8 °C durante un máximo de 1 semana. Para preparar la solución madre, añadir 475 mL de 1x PBS sin suplementos (pH 7,2) + 25 mL de albúmina sérica bovina (BSA) al 0,5%. Utilice una dilución 1:20 preparada en BSA.
- Para citometría de flujo y clasificación celular activada por fluorescencia (FACS): Prepare el tampón FACS, PBS con suero fetal de ternero (FCS) al 2% y EDTA 2 mM y guárdelo a 2-8 °C. Para prepararlo, añadir 500 mL de 1x PBS sin suplementos y 10 mL de FCS + 2 mL de EDTA (a partir de 0,5 M de EDTA stock)
- Realizar la inmunización de acuerdo con el protocolo de Bittner et al. 5. En resumen, inducir EAE mediante inyección subcutánea de una emulsión que contenga 200 μg de péptido MOG35-55 y 200 μL de adyuvante completo de Freud incluyendo 200 μg de Mycobacterium tuberculosis.
- Anestesiar al ratón con isoflurano al 2% mediante el uso de una cámara de anestesia con un vaporizador de isoflurano. Use ungüento veterinario en los ojos del animal para evitar la sequedad mientras está bajo anestesia.
- Después de 2 h, inyectar una inyección intraperitoneal de 100 ng de toxina de la tos ferina (PTx) disuelta en 100 μL de 1x PBS según el protocolo de Huntemann et al.24. Repita la inyección de PTx el día 2 después de la inmunización.
PRECAUCIÓN: Observe a cada animal hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal. Los ratones que se han sometido a los procedimientos de inyección no se devuelven a la compañía de los otros ratones hasta que se hayan recuperado por completo. Para Mycobacterium tuberculosis y PTx: Evite la inhalación, ingestión y contacto con la piel y los ojos. Mycobacterium tuberculosis es un activador del sistema inmune innato. El PTx tiene muchos efectos biológicos. - Monitorizar diariamente la progresión de la EAE, realizada por dos investigadores ciegos que controlan el peso y examinan clínicamente a los ratones.
- Para ello, se utilizó el siguiente sistema de puntuación: grado 0-sin signos clínicos de EAE, grado 1- paresia parcial de la cola, grado 2-paresia completa de la cola, grado 3-debilidad moderada de las extremidades posteriores, grado 4-completa debilidad de las extremidades posteriores y marcha atáxica, grado 5-paraparesia leve, paraparesia de grado 6, paraplejia de grado 7, tetraparesia de grado 8, grado 9-cuadriplejia, y grado 10-muerte.
- Utilice los siguientes criterios de exclusión para una mayor participación en el experimento: puntuación clínica > 7 o una pérdida de peso superior al 20% del peso corporal inicial.
- Para la disección del cerebro y la médula espinal, se practica la eutanasia a los ratones EAE el día 16 después de la inducción de EAE, lo que representa el máximo de la enfermedad.
2. Preparación del tejido del SNC (Duración: aproximadamente 10 min por ratón)
- Después de sacrificar ratones con dióxido de carbono, comience con la perfusión transcárdica de cada ratón con 20 mL de 1x PBS. Repita la perfusión nuevamente con 20 ml de 1x PBS.
- Coloque el ratón en posición supina y fije las extremidades con cánulas. Aplicar etanol al 75% en la parte frontal del cuerpo del animal. En ese momento, no son necesarias más medidas de esterilidad.
- Abre el abdomen y el tórax haciendo un corte longitudinal a través de la piel y la fascia con la ayuda de una tijera.
- Corta las costillas lateralmente y dobla el tórax hacia arriba para tener libre acceso al corazón. Fijar el tórax doblado hacia arriba con cánulas.
- Abra la aurícula derecha con unas tijeras. Aplique 20 ml de 1x PBS en el ventrículo izquierdo con una cánula para eliminar la sangre a través de la aurícula derecha incisa.
- Exponga el cráneo cortando la piel en la parte superior de la cabeza murina a través de una sección longitudinal y mueva la piel alrededor de la cabeza con una pinza. Incidir el cráneo con ayuda de una tijera a lo largo de la sutura sagital.
- Inserte la punta de una pinza a lo largo de la línea de incisión para abrir la calota. Retire las partes restantes de la calota con fórceps para que el cerebro quede completamente expuesto.
- Retire el cerebro con cuidado y colóquelo en una matriz cerebral murina. Corta el cerebro en rodajas sagitales de 1 mm de grosor con una cuchilla de afeitar.
- Cortar la columna vertebral con ayuda de unas tijeras justo por encima de la cresta ilíaca para que la jeringa pueda introducirse en el canal espinal.
NOTA: La forma más fácil de extirpar la médula espinal es sacarla del canal espinal con PBS. De lo contrario, los arcos vertebrales deben abrirse individualmente con unas tijeras y luego se puede extirpar la médula espinal. - Enjuague la médula espinal del canal espinal desde la caudal hasta la craneal utilizando una jeringa de 20 ml con una aguja de 20 g que contenga 1x PBS. Corta la médula espinal en segmentos de 0,5 cm de largo con un bisturí.
- Almacene cada suspensión de células del SNC que consiste en el cerebro y la médula espinal correspondiente en una placa de Petri separada por ratón llena de aproximadamente 3 ml de D-PBS frío. Guarde los platos en hielo hasta su posterior procesamiento.
3. Disociación tisular del SNC (Duración: aproximadamente 1-1,5 h dependiendo del número de suspensiones celulares del SNC)
NOTA: El tejido neural de ratones adultos se disocia combinando la disociación mecánica con la degradación enzimática de la matriz extracelular. De este modo, la integridad estructural se mantiene y la suspensión celular se puede utilizar para otros procedimientos de aislamiento celular.
- Preparar el volumen adecuado de la mezcla enzimática 1 que consiste en 50 μL de enzima P y 1.900 μL de tampón Z por suspensión celular del SNC. Ambos reactivos pertenecen al kit de disociación cerebral adulta.
- Preparar el volumen adecuado de mezcla de enzimas 2 que consiste en 10 μl de enzima A y 20 μl de tampón Y por suspensión celular del SNC. Ambos reactivos pertenecen al kit de disociación cerebral adulta.
- Transfiera 1.950 μL de mezcla enzimática 1 en el tubo C y agregue los trozos de tejido de una suspensión de células del SNC después. Utilice un tubo C por ratón.
- Agregue 30 μL de mezcla de enzimas 2 a cada tubo C. Cierre bien los tubos C y fíjelos boca abajo en el manguito del disociador de celdas con calentadores.
- Ejecute el programa apropiado llamado 37C_ABDK_01 (tarda 30 minutos). Observe al menos los primeros 5 minutos del programa para asegurarse de que todos los tubos giren a la misma velocidad. Es posible que se produzcan errores durante la ejecución. A continuación, continúe con el paso 6.
- En los últimos 2 minutos del programa, coloque un colador de 70 μm en un tubo de 50 ml por cada suspensión de células disociadas del SNC. Humedece previamente estos coladores con 2 ml de D-PBS.
- Después de finalizar el programa, conecte los tubos C del disociador y colóquelos en una centrífuga. Centrifugar las muestras a 300 x g y 4 °C durante 1 min para recoger la muestra en el fondo del tubo.
- Vuelva a suspender la muestra y aplíquela al colador previamente humedecido. Agregue 10 ml de D-PBS frío al tubo C vacío y ciérrelo. Agítalo suavemente y aplica la suspensión sobre el colador correspondiente.
- Deseche los filtros y cierre los tubos de 50 ml. Centrifugar de nuevo la suspensión celular a 300 x g y 4 °C durante 10 min. Después, aspire todo el sobrenadante con mucho cuidado.
4. Eliminación de residuos (Duración: Aproximadamente 1,5-2 h dependiendo del número de suspensiones de células del SNC)
NOTA: La disociación tisular a menudo conduce a mielina y restos celulares que pueden afectar el análisis posterior. Al agregar una solución de eliminación de escombros, estos desechos se pueden eliminar de manera eficiente de la suspensión de la celda del SNC.
- Vuelva a suspender el gránulo celular con cuidado con 3.100 μL de D-PBS para cada suspensión de células del SNC. No haga vórtices.
- Si trabaja con más de una suspensión de células del SNC, agrupe un máximo de dos suspensiones de células del SNC derivadas de una afección o grupo experimental en un tubo de 15 ml.
- Agregue 900 μL de la solución de eliminación de residuos del kit de disociación cerebral adulta a una suspensión de células del SNC o 1.800 μL de solución de eliminación de residuos a dos suspensiones de células del SNC combinadas.
- Invierte el tubo y mezcla la suspensión. Después, cúbrelo muy suavemente con 4 ml de D-PBS frío. Un gradiente claro debe ser visible (Figura 2A).
- Centrifugar los tubos durante 10 minutos a 3000 x g y 4 °C con aceleración máxima y sin freno.
- Si la separación se produce según lo previsto, se forman tres fases (Figura 2C). Aspire las dos fases superiores por completo (Figura 2C-1,2) y deséchelas. Es importante que no queden residuos de mielina (Figura 2E).
NOTA: Si el gradiente no funcionó y las celdas se necesitan con urgencia, no succionar las dos fases superiores. En su lugar, llene el tubo de 15 ml con D-PBS frío hasta 15 ml e inviértalo varias veces. Centrifugar de nuevo a 1000 x g durante 10 min a 4 °C con aceleración máxima y sin freno. Chupe el sobrenadante y repita los pasos 4.1 a 4.4. - Llene el tubo con D-PBS frío hasta 14 ml y ciérrelo. Invierta el tubo con fuerza en el banco de trabajo hasta que el gránulo de la celda se desprenda del fondo del tubo. No haga vórtices.
- Centrifugar la muestra de nuevo a 1000 x g y 4 °C durante 10 min. Ajuste la aceleración máxima y el freno completo. Aspire el sobrenadante con cuidado y por completo.

Figura 2: Lo que se debe y no se debe hacer durante la remoción de escombros. (A) Ejemplo positivo para el gradiente después de superponerlo con 4 mL de PBS. La fase superior que consiste en 4 ml de PBS se distingue claramente de la fase inferior que consiste en la suspensión de la célula del SNC con la solución de eliminación de residuos. (B) Ejemplo negativo para el gradiente después de superponerlo con 4 mL de PBS. El gradiente carece de una separación clara entre el PBS y la suspensión de la celda que se encuentra debajo. Un poco del PBS se difunde en la suspensión celular. (C) Ejemplo positivo para el gradiente después de la centrifugación. Se pueden distinguir fácilmente tres fases separadas. No hay residuos de mielina visibles en la fase superior (1) o inferior (3) del gradiente. La fase media contiene toda la mielina (2). El gránulo celular es visible en la parte inferior del tubo de 15 ml. (D) Ejemplo negativo para el gradiente después de la centrifugación. No es posible una separación precisa entre las tres fases. Algunos residuos de mielina son visibles en la fase superior (1) e inferior (3) del gradiente. (E) Ejemplo positivo para el gradiente después de aspirar las dos fases superiores. La muestra resultante contiene solo el gránulo de la célula y un sobrenadante transparente arriba. No quedan residuos de mielina. (F) Ejemplo negativo para el gradiente después de aspirar las dos fases superiores. La muestra todavía contiene algunos residuos de mielina (flecha negra). Abreviaturas: SNC = sistema nervioso central; PBS = solución salina tamponada con fosfato Haga clic aquí para ver una versión más grande de esta figura.
5. Extracción de glóbulos rojos (Duración: Aproximadamente 1 h dependiendo del número de suspensiones de células del SNC)
NOTA: Este paso evita la contaminación posterior por los glóbulos rojos y asegura una lisis óptima de los eritrocitos con un efecto mínimo sobre los otros tipos de células aisladas del tejido del SNC. Los siguientes volúmenes están indicados para suspensiones celulares derivadas de 100 mg a 1 g de tejido neuronal correspondiente a dos cerebros y médula espinal de ratones adultos. Si trabaja con más de dos suspensiones de células del SNC, amplíe todos los reactivos y los volúmenes totales en consecuencia.
- Comience con la preparación de la solución de extracción de glóbulos rojos (RBCRS): por dos suspensiones de células del SNC combinadas. Diluir 100 μL de solución madre de extracción de glóbulos rojos (10x) del kit de disociación cerebral adulto en 900 μL de ddH2O para alcanzar una dilución final de 1:10.
- Guarde el RBCRS a 2-8 °C hasta su uso. Deseche los restos no utilizados al final del día.
- Resuspenda el gránulo celular de hasta dos suspensiones celulares del SNC en 1 ml de RBCRS. Evite el vórtice. Incubar la solución durante 10 min a 4 °C.
- Agregue 10 ml de tampón de PB frío a dos suspensiones celulares combinadas. Centrifugar la muestra a 300 x g y 4 °C durante 10 min y aspirar el sobrenadante completamente después.
- Vuelva a suspender cada gránulo de célula de una suspensión de células del SNC en 80 μl de tampón PB pipeteando lentamente hacia arriba y hacia abajo. En consecuencia, utilice 160 μL para resuspender los gránulos celulares derivados de dos suspensiones celulares del SNC.
- Cuando se trabaja con varias suspensiones celulares del SNC de la misma condición experimental, se agrupan todas estas suspensiones celulares.
- Determine el recuento de células, por ejemplo, utilizando una cámara de recuento mejorada. Las suspensiones celulares se diluyeron generalmente 1:50 en tampón PB, seguido de una dilución adicional de 1:10 en una solución de azul de tripano al 0,4%.
6. Protocolo de perlas magnéticas en ratones naïve y EAE (Duración: Aproximadamente 1 h)
- Etiquetar magnéticamente los diferentes tipos de células del SNC con MicroBeads específicas para su antígeno de superficie. A continuación, coloque la suspensión de la célula en la columna y separe magnéticamente las células etiquetadas retenidas dentro de la columna y las células no etiquetadas que la atraviesan.
- Después de retirar la columna del campo magnético, elimine las células marcadas magnéticamente de la columna en un tubo como la fracción de célula seleccionada positivamente.
NOTA: Los volúmenes para el proceso de etiquetado magnético se calculan para un máximo de 1 x 107 celdas en total. Si se obtienen más células, amplíe todos los volúmenes totales y de reactivos en consecuencia. Se recomienda trabajar rápido y utilizar únicamente soluciones preenfriadas para evitar el taponamiento de anticuerpos en la superficie celular y el marcaje celular inespecífico, así como para garantizar una alta viabilidad de las poblaciones celulares aisladas. También es importante realizar los pasos de lavado tan pronto como el depósito de la columna esté vacío agregando el tampón de PB para que las columnas no se sequen. - Divida la suspensión purificada de células del SNC sin diluir en dos fracciones para los siguientes aislamientos de microglía y oligodendrocitos. La proporción de ambas fracciones depende del recuento de células deseado de cada tipo de célula.
NOTA: En la Tabla 1 se indican más detalles (duración de la incubación, pasos detallados del protocolo, volúmenes, reactivos y método de recuento de células).
Tabla 1: Flujo de trabajo para el marcaje magnético simultáneo y aislamiento de oligodendrocitos y microglía de ratones naïve y EAE. Ambos tipos de células se aíslan a través de una selección positiva. Se indica que los pasos que se enumeran en la misma fila se deben realizar a la vez. Abreviaturas: CD11b = quinasa 11B dependiente de ciclina; EAE = encefalomielitis autoinmune experimental; FcR = proteína similar al receptor Fc; O4 = marcador de oligodendrocitos O4. Haga clic aquí para descargar esta tabla.
7. Modificación del protocolo: clasificación adicional para el aislamiento de microglía en ratones EAE (Duración: Aproximadamente 1,5-2 h)
NOTA: Cuando se trabaja con ratones EAE, es necesario complementar el protocolo de aislamiento celular basado en MACS mediante FACS para eliminar las poblaciones de células CD11b+ distintas de la microglía (por ejemplo, monocitos, macrófagos, células asesinas naturales, granulocitos o células dendríticas) de la fracción de células CD11b+ . De lo contrario, se puede omitir este paso.
- Prepare la mezcla maestra de tinción que contiene 1x PBS complementado con CD11b FITC (clon M1/70, 1:50) y CD45 APC/Cy7 (clon 30-F11, 1:200). Utilice 100 μL de la mezcla maestra de tinción por cada 5 x 106 células. Evite todos los anticuerpos antes de su uso.
- Centrifugar la suspensión celular de la microglía a 300 x g y 4 °C durante 10 min y aspirar el sobrenadante con cuidado.
- Vuelva a suspender el gránulo celular con 100 μL de la mezcla maestra de tinción preparada por 5 x 106 células. Incubar durante 15 minutos en la oscuridad a temperatura ambiente (RT).
- Detenga la reacción añadiendo 500 μL de PBS y centrifugue la muestra de nuevo a 300 x g y 4 °C durante 10 min.
- Aspirar el sobrenadante con cuidado y resuspender el gránulo celular con 1x PBS suplementado con 10 μg/mL de ADNasa para alcanzar una concentración final de 1 x 107 células por mL. Almacene las celdas a 4 °C hasta que comience la clasificación.
- Aplique la suspensión celular en un colador de 100 μm colocado en un nuevo tubo FACS inmediatamente antes de comenzar con la clasificación.
- Ajuste el caudal a 1000 eventos por segundo y utilice la boquilla de 100 μm. Clasifique la población celular deseadade células altas CD45intCD11b en un nuevo tubo de 15 ml preparado con 1x PBS en RT.
8. Preparación del flujo negativo de oligodendrocitos para el aislamiento de neuronas y astrocitos (Duración: Aproximadamente 1 h)
NOTA: El flujo negativo de oligodendrocitos del paso 6 se recoge para su posterior aislamiento de neuronas y astrocitos. Para ello, la suspensión celular se divide en dos partes. Debido al aislamiento previo de oligodendrocitos de la suspensión celular del SNC, se minimiza la contaminación por células O4+ que de otro modo se observaría.
- Centrifugar el flujo negativo de los oligodendrocitos a 300 x g y 4 °C durante 10 min y aspirar el sobrenadante con cuidado.
- Resuspender el gránulo celular en 80 μL de tampón PB por suspensión de células del SNC agrupada previamente utilizada para el aislamiento de la fracción positiva de oligodendrocitos.
- Cuenta las celdas. Realice el recuento de las células que se supone que son O4- utilizando una cámara de recuento mejorada después de diluir la suspensión celular 1:50 en tampón PB seguido de una dilución adicional 1:10 en azul de tripano al 0,4%.
- Divida la suspensión celular purificada sin diluir en dos fracciones para el siguiente aislamiento simultáneo de neuronas y astrocitos. La proporción de ambas fracciones depende de la cantidad preferida de cada tipo de célula.
NOTA: En la Tabla 2 se indican más detalles (duración de la incubación, pasos detallados del protocolo, volúmenes, reactivos y método de recuento de células).
Tabla 2: Flujo de trabajo para el marcaje magnético simultáneo y aislamiento de neuronas y astrocitos de ratones naïve y EAE. Ambos tipos de células se aíslan del flujo negativo de oligodendrocitos. Los astrocitos se separan como una selección positiva a través de microesferas anti-ACSA-2, mientras que las neuronas se purifican a través de la biotinilación y el agotamiento de todas las células no neuronales como una selección negativa. Se indica que los pasos que se enumeran en la misma fila se deben realizar a la vez. Abreviaturas: Anti-ACSA-2 = antígeno 2 de la superficie de la célula de astrocitos; EAE = encefalomielitis autoinmune experimental; FcR = proteína similar al receptor Fc; MACS = clasificación de células activadas magnéticamente. Haga clic aquí para descargar esta tabla.
9. Análisis de pureza de los tipos de células residentes aisladas en el SNC (Duración: Aproximadamente 2 h)
NOTA: Se recomienda realizar citometría de flujo de las cuatro poblaciones de células aisladas residentes en el SNC para medir y comparar sus purezas y viabilidad. Por lo tanto, es necesario teñir todos los tipos de células con un anticuerpo marcado con fluoróforo. La tinción de células vivas/muertas se implementa utilizando un colorante de viabilidad fijable (1:10.000).
- Panel de pureza - protocolo de tinción extracelular
- Utilice 1 x 105 células disueltas en 50 μL de PBS por tinción.
- Prepare la mezcla maestra de tinción disuelta en PBS con 2 % de FCS/2 mM de EDTA que consta de los siguientes anticuerpos monoclonales conjugados con fluorocromo dirigidos a marcadores de superficie específicos del tipo de célula: CD11b FITC (clon 1/70, 1:100)25,26,27,28, Biotina-PE (clon Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (clon REA-969, 1:200)33,34,35, O4 APC (clon REA-576, 1:400) y CD45 BV510 (clon 30-F11, 1:150)36,37. Añadir 1 μg de anti-CD16/32 por cada 1 x 106 células para bloquear el receptor Fc3 8,39. Vortex todos los anticuerpos antes de su uso.
- Centrifugar la suspensión celular durante 5 min a 540 x g y 4 °C y aspirar el sobrenadante con cuidado.
- Vuelva a suspender el gránulo celular en 100 μL de la mezcla maestra respectiva e incube la muestra durante 15 min a RT en la oscuridad.
- Lavar las células con 500 μL de 1x PBS con 2% FCS/2 mM EDTA y centrifugar la muestra durante 5 min a 540 x g y 4 °C.
- Aspirar el sobrenadante y resuspender el gránulo celular con 70 μL de PBS 1x con FCS al 2%/EDTA mM.
- Agite la muestra para disociar completamente el gránulo celular. Posteriormente, la muestra está lista para el análisis por citometría de flujo.
- Panel de pureza - protocolo de tinción intracelular con NeuN
- Utilice 1 x 105 células de cada población celular para la tinción intracelular de NeuN, que es un marcador nuclear específico de la neurona 40,41. Esta es una forma adicional de teñir neuronas viables.
- Transfiera 1 x 105 células de cada población celular a un tubo FACS. Agregue 1 ml de PBS con 2% de FCS/2 mM de EDTA por tubo. Centrifugar los tubos a 540 x g y 4 °C durante 5 min.
- Mientras tanto, prepare la mezcla maestra disuelta en PBS con 2% de FCS/2 mM de EDTA que consiste en los siguientes anticuerpos monoclonales conjugados con fluorocromo dirigidos a marcadores de superficie específicos del tipo celular: CD11b FITC (clon M1/70, 1:100)25,26,27,28, Biotina-PE (clon Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (clon REA-969, 1:200)33,34,35 y CD45 BV510 (clon 30-F11, 1:150)36,37.
- Aspirar el sobrenadante y resuspender las células en 100 μL de la mezcla maestra preparada e incubar la muestra durante 10 min a RT en la oscuridad.
- Lavar las células con 100 μL de PBS con 2% FCS/2 mM EDTA y centrifugarlas de nuevo a 540 x g y 4 °C durante 5 min.
- Mientras tanto, prepare 200 μL de la solución de fijación/permeabilización: Añadir 50 μL del stock concentrado de concentrado de fijación/permeabilización a 150 μL de diluyente de fijación/permeabilización para alcanzar una dilución final de 1:4.
- Aspirar el sobrenadante y resuspender las células en 100 μL de solución de fijación/permeabilización 1x. Incubar la muestra durante 30 min a 4 °C.
- Mientras tanto, prepare 1 ml de tampón de permeabilización/lavado 1x añadiendo 100 μl de material tampón de permeabilización a 900 μl de ddH2O para alcanzar una dilución final de 1:10.
- Lavar las células 1 vez con 100 μL de 1 tampón de permeabilización/lavado y centrifugar la muestra a 540 x g y 4 °C durante 5 min.
- Mientras tanto, prepare otra mezcla maestra en 1x tampón de permeabilización/lavado que consista solo en NeuN (NeuN AF647, clon EPR12763, 1:200) y 1 μg de anti-CD16/32 por cada 106 células para bloquear el receptor Fc.
- Aspirar el sobrenadante. Resuspender las células fijadas y permeabilizadas en 50 μL de la segunda mezcla maestra e incubar durante 30 min a 4 °C.
- Lavar la muestra con 100 μL de tampón de permeabilización/lavado 1x y centrifugar a 540 x g y 4 °C durante 5 min.
- Deseche el sobrenadante y vuelva a suspender el gránulo celular en 70 μL de PBS con FCS al 2%/2 mM de EDTA. Posteriormente, la muestra está lista para el análisis citométrico de flujo.
- Después de configurar el panel en el citómetro de flujo, adquiera celdas para el análisis de pureza utilizando un software de análisis de citometría de flujo.
10. Análisis estadístico
- Realizar análisis estadísticos y diseñar gráficos con un programa de análisis gráfico. Los datos se presentan como media ± SEM.
Resultados Representativos
El protocolo actual ofrece la posibilidad de aislar simultáneamente todas las principales células residentes en el SNC, es decir, la microglía, los oligodendrocitos, los astrocitos y las neuronas de una sola réplica del SNC. Esto es importante para la reducción del número de ratones necesarios para este tipo de experimentos y para garantizar la comparabilidad de los análisis moleculares y bioquímicos a nivel celular. Si los tipos de células individuales se aíslan de diferentes réplicas del SNC, las interacciones celulares no se pueden mapear con veracidad y las posibles desviaciones técnicas durante los procesos de aislamiento podrían sesgar los análisis posteriores. Además, los hallazgos moleculares y bioquímicos de cada tipo de célula no serían comparables entre sí, ya que no se derivan del mismo contexto de EAE. Se adaptó un protocolo MACS preexistente utilizando un sistema/kit comercial para permitir el aislamiento simultáneo de los tipos de células mencionados anteriormente.
El aislamiento de la microglía se realizó mediante microesferas anti-CD11b, los oligodendrocitos se aislaron mediante microesferas anti-O4 (Tabla 1) y las microesferas anti-ACSA-2 se utilizaron para aislar astrocitos (Tabla 2). Por el contrario, el aislamiento de las neuronas representa una selección negativa y se logró mediante biotinilación y marcaje magnético de todas las células no neuronales (Tabla 2). Todas las células no neuronales (p. ej., oligodendrocitos, microglía, astrocitos, células endoteliales y fibroblastos), excepto las células sanguíneas, pueden marcarse magnéticamente mediante el uso de un anticuerpo conjugado con biotina, dirigido específicamente contra un antígeno de superficie expresado en estas células no neuronales (Tabla 2). Mediante el agotamiento de estas células no neuronales marcadas magnéticamente, se pueden generar poblaciones de células neuronales altamente puras y viables 30,42,43.
Se diseñaron dos nuevos paneles de citometría de flujo para los análisis de pureza de las suspensiones unicelulares generadas. En este caso, se utilizaron marcadores nucleares y de superficie específicos del tipo de célula combinados con la discriminación de células vivas/muertas.
Se analizaron los rendimientos de células resultantes por ratón y tipo de célula (Figura 3A) y se obtuvo un promedio de 8. 4 x 105 ± 3 x 104 microglías, 3,23 x 106 ± 1 x 105 oligodendrocitos, 8,6 x 105 ± 2 x 104 astrocitos y 4,5 x 105 ± 1 x 104 neuronas por ratón ingenuo.
En el contexto del objetivo de investigar modelos de enfermedad de neuroinflamación, el protocolo también se aplicó a un modelo murino de EAE. Los ratones fueron sacrificados el día 16 después de la inducción de EAE, lo que representa el máximo de la enfermedad. En este contexto de EAE, se aislaron aproximadamente 2,9 x 106 ± 6,7 x 105 oligodendrocitos, 5,2 x 105 ± 9 x 104 astrocitos y 4,4 x 105 ± 4 x 104 neuronas . El rendimiento de células de microglía se redujo a aproximadamente 1,7 x 105 ± 4 x 104 microglía por ratón EAE debido a la clasificación celular adicional después de los pasos MACS (Figura 3A).
Tras el aislamiento, las caracterizaciones fenotípicas de las diferentes poblaciones celulares mediante citometría de flujo demostraron que se podían conseguir suspensiones unicelulares viables con una pureza de aproximadamente el 90% para todos los principales tipos de células residentes en el SNC (Figura 3B). Las microglías se clasificaron como CD45intCD11balto según se define en la literatura 44,45,46,47.
En EAE, la microglía tuvo que ser separada de todas las células CD11b+ para diferenciarlas de otras células inmunes CD11b+ como monocitos, neutrófilos, células asesinas naturales, granulocitos y macrófagos que emigran al SNC durante la neuroinflamación 27,28,48. Por lo tanto, la microglía se clasificó como célulasaltas CD45intCD11 a partir de la suspensión celular CD11b+. Toda la estrategia de clasificación de la microglía se muestra en la Figura 4. En ratones naïve, la población de microglía fue el 91,16% de todas las células individuales vivas (96% de la población total de CD11b+) (Figura 4A). En ratones EAE, la población de microglía fue el 46,85% de todas las células individuales vivas (55% del total de la población CD11b+) (Figura 4B). Aunque tanto los procedimientos MACS como FACS aplican estrés mecánico a las células individuales, el 75,41% ± el 8,63% de la microglía purificada clasificada eran viables (Figura 3B).
Los astrocitos y las neuronas que se aislaron directamente de la suspensión celular inicial del SNC mostraron una contaminación relevante con oligodendrocitos, lo que llevó a suponer que el aislamiento simultáneo de neuronas y astrocitos del flujo negativo de oligodendrocitos podría prevenir esta contaminación. Los análisis de citometría de flujo confirmaron que los astrocitos aislados del flujo negativo de oligodendrocitos tenían una pureza del 89,23% ± 2,78% y demostraron una viabilidad del 80,56% ± 1,41%. Similar a estos resultados, la pureza de las neuronas aisladas de la fracción de células O4 fue de 81,25% ± 3,31% y la viabilidad fue de 83,90% ± 2,61% (Figura 3B). Estos hallazgos también confirman que el aislamiento simultáneo de estos dos tipos celulares solo después del aislamiento de oligodendrocitos no tiene ningún impacto en la cantidad de células funcionales viables.
Los resultados en cuanto a la viabilidad y pureza de las suspensiones unicelulares aisladas fueron muy similares en ratones EAE en comparación con los recibidos en ratones naïve, lo que confirma que este protocolo es adecuado tanto para ratones sanos como en el contexto de EAE (Figura 3B).
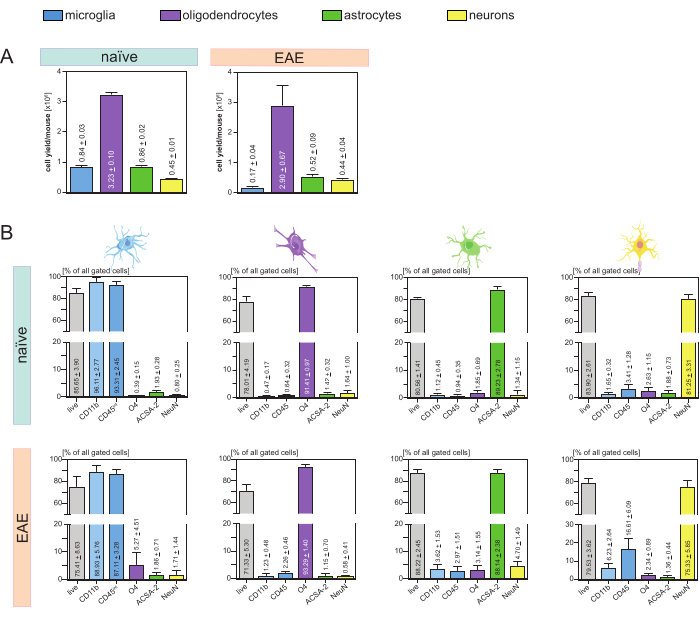
Figura 3: Rendimientos celulares y validación basada en citometría de flujo de células aisladas residentes en el SNC. (A) Rendimientos celulares por ratón y tipo de célula después del aislamiento de células residentes en el SNC en ratones naïve y EAE. Los gráficos de barras visualizan la cantidad de rendimientos de celda por ratón y tipo de celda después de la implementación del protocolo presentado. Se procesaron cinco réplicas biológicas para los resultados en ratones naïve y cuatro réplicas biológicas en ratones EAE. Se representan los medios respectivos ± SEM. (B) Análisis correspondientes de pureza y viabilidad de las fracciones celulares purificadas. Los gráficos de barras indican la viabilidad y pureza de las suspensiones unicelulares resultantes en función de su expresión de marcadores específicos del tipo de célula. NeuN se utilizó como marcador nuclear específico de tipo celular para las neuronas. Se adquirieron cinco réplicas biológicas y se compararon para cada tipo de célula tanto en ratones sanos como en ratones EAE. Se indican los medios respectivos ± SEM. Abreviaturas: Anti-ACSA-2 = antígeno 2 de la superficie de la célula de astrocitos; CD11b = quinasa 11B dependiente de ciclina; CD45 = tirosina y proteína fosfatasa C de tipo receptor; SNC = sistema nervioso central; EAE = encefalomielitis autoinmune experimental; MACS = clasificación de células activadas magnéticamente; NeuN = proteína de unión al ARN fox-1 homóloga 3; O4 = marcador de oligodendrocitos O4; SEM = error estándar de la media. Esta cifra ha sido modificada de49. Haga clic aquí para ver una versión más grande de esta figura.
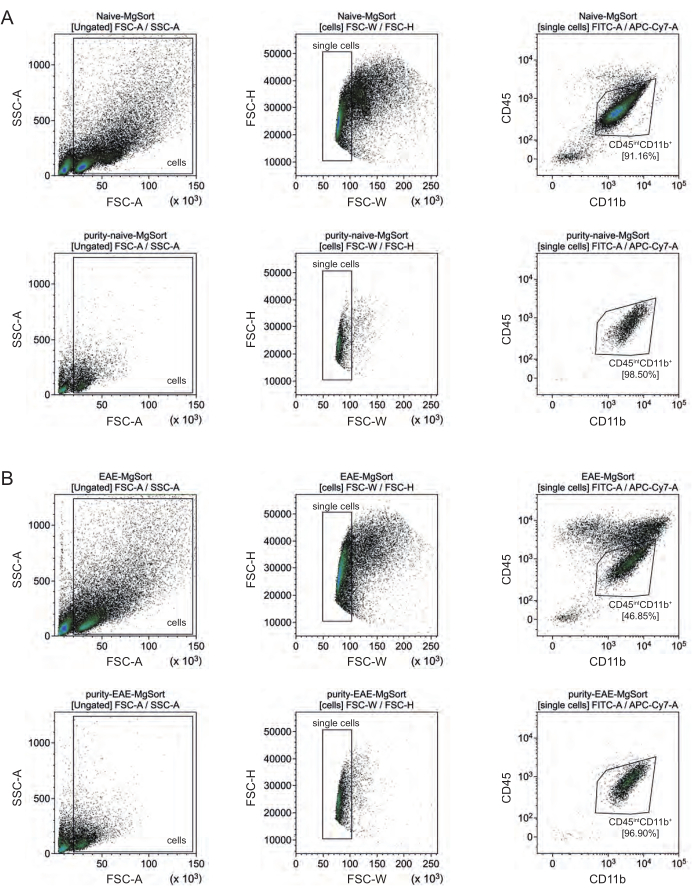
Figura 4: Estrategia de activación para la clasificación celular de la microglía después del aislamiento de células CD11b+. (A) Estrategia de compuerta en ratones naïve y (B) EAE. La fila superior de cada panel muestra diagramas de puntos antes de ordenar y la fila inferior después de ordenar. Después de la selección de células vivas (SSC-A / FSC-A) y células individuales (FCS-H / FSC-W), la población de células CD45intCD11b+ se clasificó como población de microglía. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hasta ahora, los métodos para mapear células residentes en el SNC ex vivo mediante la combinación de espectrometría de masas y secuenciación de ARN ofrecen un perfil celular muy preciso en salud y enfermedad, pero requieren un conocimiento técnico ambicioso y experiencia en este campo50,51. Además, no permiten análisis funcionales y son muy caros. Además de eso, los sistemas microfluídicos de cerebro en un chip proporcionan una detección rápida y asequible de los mecanismos de la enfermedad y la prueba de nuevos enfoques terapéuticos con la restricción del crecimiento y la migración celular 52,53,54,55. Los organoides del SNC también podrían representar una alternativa equivalente en el futuro para la investigación del modelado celular, las conexiones intercelulares y las interacciones durante el curso de la enfermedad 56,57,58,59. Sin embargo, la clasificación celular activada por fluorescencia y magnética son actualmente los métodos más efectivos para generar suspensiones unicelulares puras y viables ex vivo 35,60,61. Aunque otros protocolos de fabricación establecidos para el aislamiento de tipos de células residentes en el SNC son similares en cuanto a los pasos individuales del aislamiento magnético y la disociación celular previa, están destinados a realizarse para cada tipo de célula por separado. Por el contrario, el protocolo actual integra diferentes métodos de aislamiento para cada tipo de célula residente en el SNC en un contexto lógico, de modo que se pueden realizar simultáneamente a la vez y a partir de una sola suspensión de células del SNC (Tabla 1, Tabla 2). Por lo tanto, permite análisis multiómicos a partir de una sola suspensión celular del SNC y, eventualmente, la exploración de redes neuronales complejas. Incluso si no es necesario agrupar varios tejidos de varios animales para realizar este protocolo, esta agrupación garantiza un número adecuado de células aisladas para su posterior análisis. El uso de diferentes ratones para el aislamiento de los tipos de células individuales excluiría la posibilidad de analizar las posibles interacciones celulares. Además, la combinación de métodos de aislamiento individuales para los diferentes tipos de células del SNC, que siguen una disociación previa del SNC, ahorra costes de material mediante el uso de una suspensión de células del SNC disociada para todos los pasos de aislamiento magnético siguientes. Además, se minimiza un posible sesgo técnico causado por el uso de diferentes ratones.
Una limitación del protocolo podría ser el uso casi exclusivo de ratones hembra C57BL/6J. El protocolo de inmunización EAE ha sido diseñado y establecido para ratones hembra, por lo que este protocolo de aislamiento celular se implementó también en ratones hembra C57BL/6J. Sin embargo, durante el desarrollo de este protocolo también se utilizaron ratones machos naïf, sin que se reconociera ningún efecto sobre el número de células o las purezas resultantes. Otra restricción afecta al aislamiento celular magnético de las neuronas, ya que no existen microperlas específicas para el aislamiento de las neuronas en términos de una selección positiva. Se asumió que se podía obtener una suspensión unicelular pura mediante el marcaje de biotina y el agotamiento de todas las células no neuronales (Tabla 2). Esta hipótesis se verificó mediante el uso de NeuN como marcador nuclear específico para neuronas, integrado en el panel de pureza de citometría de flujo mencionado. Otra limitación se refiere al aislamiento de microglía en ratones EAE. Aquí, los rendimientos de celdas resultantes disminuyen en comparación con los otros tipos de celdas debido al paso de clasificación adicional después del protocolo MACS. Además, se podría argumentar que la clasificación aumenta el estrés mecánico de la microglía en comparación con las otras poblaciones celulares. Las estrategias de clasificación individuales pueden conducir a diferentes cantidades de rendimientos celulares. Si el número de células aisladas es menor de lo esperado o deseado, se recomienda ajustar la configuración de la compuerta y/o mejorar la discriminación entre vivos y muertos.
Un paso crítico en el protocolo representa la remoción de escombros. El degradado debe superponerse muy lenta y suavemente para crear las tres fases separadas deseadas (Figura 2A). Solo si la mielina y otros residuos de desechos en las dos fases superiores se eliminan por completo (Figura 2E), se pueden generar suspensiones unicelulares puras y se puede reducir una mayor contaminación. Si las suspensiones celulares resultantes carecen de pureza, esta es probablemente la sección del protocolo que debe mejorarse primero junto con la garantía del uso correcto de todas las microperlas.
Recibir altos niveles de pureza y viabilidad puede ser un desafío en este tipo de experimento. Algunas recomendaciones para la resolución de problemas son:
-Trabajar en condiciones estériles es obligatorio para evitar la contaminación de las diferentes microperlas y permitir su uso repetido, especialmente para su posterior cultivo.
-Se recomienda encarecidamente etiquetar cada tubo para evitar confusiones.
-Evite el uso de reactivos/tampones no refrigerados. Almacene todas las suspensiones celulares en hielo durante todo el experimento para garantizar una alta viabilidad.
-Mantenga el tiempo entre los diferentes pasos de trabajo lo más corto posible. No hay ninguna parte específica en el protocolo en la que se recomiende pausar el experimento.
-Es muy relevante cumplir con los períodos de incubación especificados.
En conclusión, este protocolo actual para el aislamiento simultáneo de todos los principales tipos de células residentes en el SNC a partir de una réplica del SNC ofrece la posibilidad de analizar redes neuronales complejas y vías neuroinflamatorias ex vivo a partir de una suspensión celular del SNC. Así, las células residentes en el SNC pueden ser investigadas durante diferentes etapas del curso de la enfermedad, por ejemplo, durante la neuroinflamación, la neurodegeneración y/o la remisión en EAE. Además, las interacciones célula-célula y las vías bioquímicas pueden estudiarse a nivel individual y se puede reducir la variabilidad dentro de los grupos experimentales. También existe la oportunidad de cultivar fracciones de las células aisladas del SNC en monocultivos para realizar más ensayos funcionales y validaciones. Todo en uno, este protocolo ofrece avances significativos que pueden afectar los enfoques de investigación preclínica y clínica.
Divulgaciones
Todos los autores declaran no tener conflictos de intereses.
Agradecimientos
Las figuras se crearon con Adobe Illustrator (versión 2023) y Servier Medical Art (https://smart.servier.com). Antonia Henes contó con el apoyo de Jürgen Manchot Stiftung.
Materiales
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
Referencias
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados