Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Criobiopsia pulmonar transbronquial para el diagnóstico de enfermedades pulmonares intersticiales y lesiones pulmonares periféricas: un enfoque escalonado
En este artículo
Resumen
La criobiopsia pulmonar transbronquial (TBLC) para el diagnóstico de la enfermedad pulmonar intersticial y las lesiones pulmonares periféricas es un procedimiento diagnóstico seguro y de alto rendimiento. Describimos un enfoque escalonado para realizar el TBLC para las diferentes indicaciones mencionadas con un broncoscopio flexible, que podría ser útil para los broncoscopistas novatos que realizan TBLC.
Resumen
La criobiopsia pulmonar transbronquial (TBLC) es un procedimiento invasivo cada vez más implementado durante la última década como alternativa a la biopsia pulmonar (SLB) de cirugía torácica asistida por video para el diagnóstico de enfermedades pulmonares intersticiales (EPI). La indicación para el TBLC ha sido principalmente subclasificar un subtipo específico de EPI cuando esto no se puede lograr sobre la base de una discusión previa en un equipo multidisciplinario. A pesar de que el SLB se considera el estándar de oro para establecer un diagnóstico histológico, el TBLC se ha sugerido gradualmente como la modalidad diagnóstica histológica de primera elección en pacientes con EPI no clasificadas debido a un rendimiento diagnóstico comparable con el SLB, pero superior al SLB en términos de complicaciones, incluida la mortalidad. Durante los últimos años, la ecografía endobronquial radial (R-EBUS) y el TBLC guiado por broncoscopia de navegación electromagnética (ENB) para lesiones pulmonares periféricas también se han descrito como procedimientos seguros, que pueden mejorar el rendimiento diagnóstico en comparación con las biopsias con fórceps. Aun así, las propiedades diagnósticas del TBLC dependen de la calidad del rendimiento del procedimiento. Este artículo tiene como objetivo describir el enfoque escalonado para la realización de TBLC con un broncoscopio flexible para las diferentes indicaciones mencionadas, lo que podría ser útil para los broncoscopistas novatos que realizan TBLC.
Introducción
Las enfermedades pulmonares intersticiales (EPI) constituyen un grupo de enfermedades pulmonares agudas y crónicas que afectan a uno o más de todos los componentes del parénquima pulmonar que forman el intersticio, como los bronquios, los alvéolos, el tejido conectivo y los vasos sanguíneos y linfáticos. A pesar de ser enfermedades raras, los más de 200 subtipos diferentes de EPI representan una categoría de enfermedad heterogénea con diferentes características clínicas, radiológicas y citohistológicas. Las EPI suelen manifestarse como inflamación, fibrosis o una combinación de ambas, que son las causas subyacentes de los síntomas habituales percibidos por los pacientes, como tos seca, disnea de esfuerzo y fatiga 1,2.
Las EPI se clasifican como neumonía intersticial idiopática (PII), neumonía intersticial de etiología conocida (p. ej., enfermedad del tejido conectivo, enfermedad pulmonar intersticial, EPI inducida por fármacos y neumoconiosis relacionada con el trabajo), afección intersticial granulomatosa (p. ej., sarcoidosis y neumonía por hipersensibilidad) y EPI huérfanas (p. ej., enfermedades pulmonares quísticas múltiples y neumonía eosinofílica)1. Esta categorización y la subtipificación diagnóstica posterior son fundamentales para determinar el tratamiento y el seguimiento óptimos, y permiten el pronóstico. Sin embargo, dado que el rompecabezas diagnóstico puede ser difícil, se recomienda la interpretación de la información clínica (incluida la anamnesis, la disposición y las exposiciones potenciales) y paraclínica disponible como la tomografía computarizada de alta resolución (TCAR) de tórax, la fisiología pulmonar y la autoinmunología obtenidas sobre la base de una discusión en equipo multidisciplinario (MDD) 3,4,5. Si no es posible obtener un diagnóstico seguro de TDM 6,7, el uso de criobiopsia pulmonar transbronquial (TBLC) indica el muestreo histológico para aumentar la probabilidad de un diagnóstico definitivo de subtipo de EPI mediante el uso de criobiopsia pulmonar transbronquial (TBLC)8,9. En pacientes bien seleccionados, el TBLC se considera un procedimiento invasivo seguro con una precisión diagnóstica cercana a la de la biopsia pulmonar (SLB) con cirugía torácica asistida por video, que todavía se considera el estándar de oro histológico para el diagnóstico histológico de EPI 10,11,12,13,14. El procedimiento de TBLC se realiza como una broncoscopia sistemática, aplicando criosondas especiales para el muestreo histológico y con la orientación fluoroscópica recomendada. Se recomienda que el TBLC se realice en centros terciarios de EPI utilizando un entorno de TDM y por neumólogos intervencionistas familiarizados con el manejo de las complicaciones del TBLC, que hayan recibido capacitación en un centro dedicado con experiencia en TBLC 9,10,11,15,16,17.
El TBLC también ha ganado recientemente atención como un procedimiento que se combina con la ecografía endobronquial radial (R-EBUS) para el diagnóstico de EPI18,19. Además, el TBLC se ha combinado tanto con R-EBUS como con broncoscopia de navegación electromagnética (ENB) para el diagnóstico de lesiones pulmonares periféricas (PPL) para mejorar el rendimiento diagnóstico en comparación con las biopsias convencionales con pinzas transbronquiales20,21. Sin embargo, este enfoque relativamente novedoso para el diagnóstico de PPL aún no se ha implementado como un procedimiento estándar y, por lo tanto, justifica más evidencia en esta área específica. El objetivo del presente informe es describir un enfoque escalonado para la realización de TBLC con un broncoscopio flexible en un entorno clínico para las indicaciones mencionadas.
Protocolo
Los autores proceden de dos centros daneses de TBLC (el Hospital Universitario de Odense y el Hospital Universitario de Aarhus) que llevan a cabo investigaciones de acuerdo con los principios de la Declaración de Helsinki. No fue necesaria la aprobación ética, ya que el estudio era de naturaleza observacional. Todos los pacientes incluidos con fines de investigación dieron su consentimiento informado por escrito. Es importante enfatizar que el enfoque escalonado descrito para la conductancia del TBLC se relaciona con el uso de un broncoscopio flexible y se basa en una combinación de recomendaciones de guías internacionales, declaraciones de expertos, revisiones del estado del arte y experiencias de los dos centros de TBLC 9,10,11,15,16,17,22,23,24 ,25.
1. Consideraciones previas al TBLC
- Asegurarse de que el TBLC esté indicado, lo que se justifica en pacientes en los que la integración de la información de la TCAR, la bioquímica y la autoinmunología en un TDM previo en el que participaron neumólogos y radiólogos no ha sido capaz de establecer un diagnóstico fiable de EPI.
- Seleccionar a los pacientes adecuados evitando las contraindicaciones descritas en la Tabla 1.
| Contraindicaciones relativas | Contraindicaciones absolutas |
| La capacidad vital forzada (FVC) < el 50% del valor previsto | Trombocitopenia < 50 x 109/L o INR > 1,5 |
| La capacidad de difusión del monóxido de carbono para el pulmón (DLCO) < del 35% del valor previsto | Diátesis hemorrágica no corregida |
| Presión arterial pulmonar sistólica > 50 mmHg (p. ej., estimación basada en una ecocardiografía) | Deterioro progresivo y clínico debido a un mayor riesgo de complicaciones en pacientes con función pulmonar comprometida |
| Índice de masa corporal > 35 kg/m2 |
Tabla 1: Contraindicaciones para el TBLC. Contraindicaciones relativas y absolutas para la conductancia TBLC. Abreviatura: TBLC = criobiopsia pulmonar transbronquial.
2. Preparación previa al TBLC
- Revisar la TCAR y las sugerencias del radiólogo torácico para planificar a partir de qué muestras histológicas de segmentos bronquiales (SB) es mejor acceder según la manifestación radiológica de la enfermedad.
- Pruebe que el sistema funciona antes del rendimiento de TBLC.
- Presione el botón de capacidad del tanque de gas (dióxido de carbono (CO2) u óxido nitroso (NO)) en el panel de configuración para verificar el volumen del gas en el cilindro.
- Coloque la criosonda en una bandeja y observe la sonda mientras presiona el pedal durante 5-10 segundos. Busque una bola de hielo en la punta de la sonda que indique que está funcionando correctamente (Figura 1).
- Use anestesia general (AG) o sedación profunda bajo TBLC y considere la premedicación con ácido tranexámico de 0,5-1 g para reducir el riesgo de sangrado.
- Coloque un tubo endotraqueal (TET) luminal doble especial de 7,5-8,5 mm de tamaño en la tráquea.
NOTA: El ETT tiene un canal principal que permite el acceso para el broncoscopio mientras el paciente está ventilado y tiene un canal lateral menor que sirve como canal de trabajo para el catéter bloqueador bronquial.- Rocíe continuamente con anestesia local (por ejemplo, spray de lidocaína al 10%) para reducir la tos. Consulte también el paso 3.5.
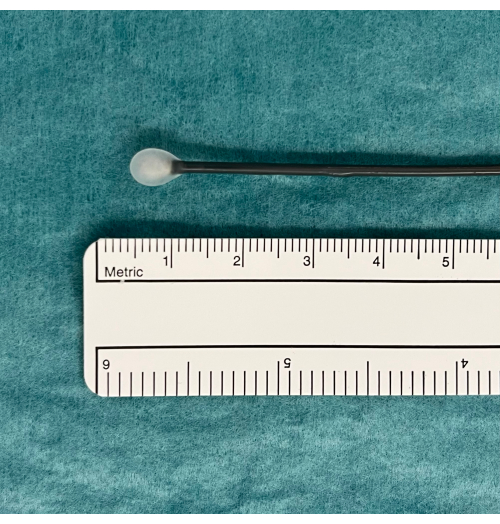
Figura 1: Una bola de hielo como indicación del equipo TBLC utilizable. Un pedal activa la difusión de gas CO2 desde el tanque y la congelación inducida. Esto se prueba en agua, donde aparecerá una bola de hielo en la punta de la criosonda si funciona correctamente. Abreviatura: TBLC = criobiopsia pulmonar transbronquial. Haga clic aquí para ver una versión más grande de esta figura.
3. Conductancia TBLC
- Introducir un broncoscopio flexible a través del TET y realizar el procedimiento de broncoscopia.
NOTA: En algunos centros de TBLC se utiliza un broncoscopio rígido para intubar la tráquea. Si la tráquea es intubada por un broncoscopio rígido, se puede pasar un broncoscopio flexible a través del rígido.- Introduzca la criosonda flexible a través del canal de trabajo del broncoscopio y en el BS seleccionado.
NOTA: Las criosondas se presentan como sondas de un solo uso (1,1, 1,7 y 2,4 mm) y reutilizables (1,9 y 2,4 mm). - Utilice la fluoroscopia para asegurarse de que la colocación de la punta de la criosonda esté aproximadamente a 10 mm de la pared del tórax correspondiente a la SB seleccionada (Figura 2).
- Introducir un catéter bloqueador bronquial (p. ej., un balón Fogarty) en el canal lateral del TET luminal doble y colocarlo en el ostium BS seleccionado (Figura 3).
- Inflar el catéter bloqueador bronquial para evaluar la idoneidad de la colocación y el bloqueo ante un posible sangrado que se produzca distalmente con respecto al balón (Figura 4).
- Desinfle el catéter bloqueador bronquial si el balón está bien colocado.
- Asegure la colocación del balón fijando el catéter bloqueador bronquial con una guian.
- Utilice pequeñas cantidades de lidocaína en aerosol o solución salina en el TET respectivo y su canal lateral para reducir cualquier fricción experimentada debido a la introducción de la criosonda en el TET y el catéter con balón en el canal lateral del TET.
- Cuando los pasos 3.1.1-3.1.3 se hayan realizado satisfactoriamente, pise el pedal de congelación durante 3-6 s, dependiendo del tamaño de la criosonda, para aprovechar la ley de Joule-Thompson para congelar el tejido del parénquima pulmonar a aproximadamente -45-79 °C para CO2 y -89 °C para NO.
- Retraiga el broncoscopio flexible que contiene la criosonda con un movimiento rápido mientras mantiene presionado el pedal de congelación para continuar congelando y evitar que la biopsia se caiga durante la retracción.
- Durante la maniobra descrita en el paso 3.1.5, pídale a una persona que no sea el broncoscopista que mantenga el balón inflado para bloquear el sitio de la biopsia distal del ostium BS seleccionado para controlar el posible sangrado.
- Introduzca la criosonda flexible a través del canal de trabajo del broncoscopio y en el BS seleccionado.
- Continúe con el paso 3.1.6 hasta que se obtengan al menos dos biopsias de dos SB del mismo lóbulo.
- Colocar las biopsias en solución salina, y cuando se hayan obtenido todas las biopsias, fijarlas en formaldehído (4%) (Figura 5).
- Enviar las biopsias para su examen patológico antes del TDM.
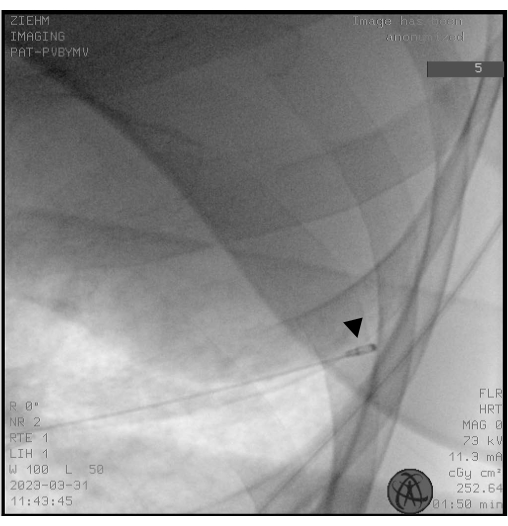
Figura 2: Fluoroscopia. La fluoroscopia se utiliza para asegurar la colocación correcta de la criosonda antes de la congelación. La punta de la criosonda aparece como la cabeza de una baqueta (punta de flecha negra). Haga clic aquí para ver una versión más grande de esta figura.
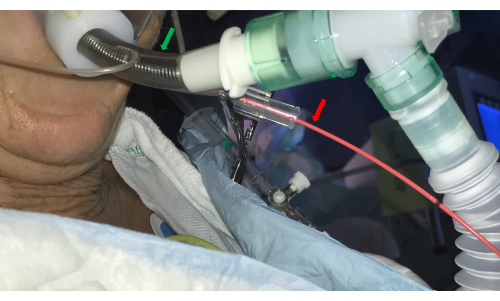
Figura 3: Tubo endotraqueal. Un tubo endotraqueal doble luminal (flecha verde) permite el acceso a las vías respiratorias por el broncoscopio y, al mismo tiempo, controla el sangrado mediante la introducción de un catéter balón en el canal lateral (flecha roja). Haga clic aquí para ver una versión más grande de esta figura.
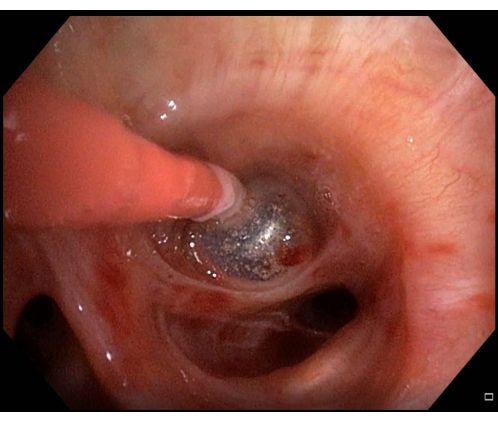
Figura 4: Inflado del catéter balón. Inflado del catéter balón para asegurar la obstrucción y evitar un posible sangrado distal del balón que se distribuya a otras partes del lóbulo después de haber realizado una criobiopsia pulmonar transbronquial. Haga clic aquí para ver una versión más grande de esta figura.
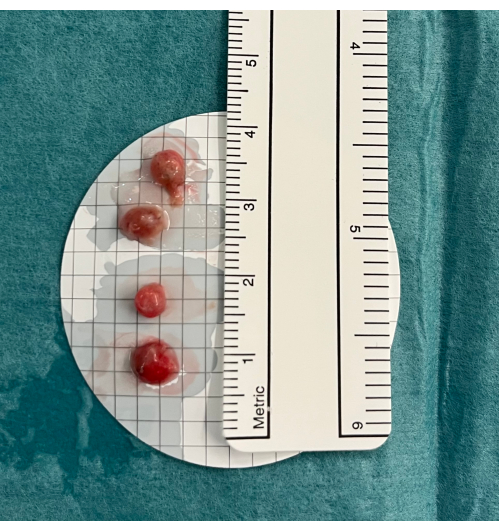
Figura 5: Biopsias. Las criobiopsias pulmonares transbronquiales se colocan en solución salina fría antes de la fijación en formaldehído. Haga clic aquí para ver una versión más grande de esta figura.
4. Procedimientos posteriores a la TBLC
- Después de cada biopsia, vuelva a introducir el broncoscopio en el SB y desinfle el balón para observar si se produce sangrado.
- Vuelva a inflar el globo si se observa sangrado (Figura 6). Si el balón está en la posición correcta y bloquea el BS, espere unos minutos para que se detenga el sangrado y luego continúe con el procedimiento de TBLC.
- Si se sigue observando sangrado después del paso 4.1.1., instale solución salina helada distalmente en el balón.
- En caso de sangrado continuo después del paso 4.1.2. o falla del balón donde la sangre se derrama en otros SB, use una combinación de succión, solución salina helada administrada endobronquialmente con o sin adrenalina y ácido tranexámico.
- Si la sangre coagulada bloquea las vías respiratorias, use la criosonda para abrir las vías respiratorias nuevamente congelando la punta de la criosonda en el coágulo de sangre y retrayéndola a través del TET.
- Si la hemorragia sigue sin controlarse, cambie el TET por uno que permita tanto la ventilación del pulmón no biopsiado como la obstrucción del bronquio principal en el pulmón sangrante, y transfiera al paciente a una unidad de cuidados intensivos.
- Realizar una ecografía pulmonar focalizada (FLUS) después del TBLC, mientras el paciente aún está sedado para identificar los indicativos de un neumotórax iatrogénico (PTX).
- Considerar la inserción de un drenaje pleural guiado por FLUS con un catéter pigtail (Fr 7-16) si las observaciones de FLUS indican una alta probabilidad de PTX. El drenaje pleural está indicado si el FLUS indica un rápido aumento del tamaño del PTX, y especialmente si el estado clínico del paciente se está deteriorando.
- Posponga la extubación entre 5 y 10 minutos si la FLUS revela un pequeño PTX y el paciente está clínicamente estable. Si el tamaño de la PTX progresa a partir de entonces o el paciente se vuelve clínicamente inestable, se debe insertar un drenaje pleural antes de la extubación.
- Extubar al paciente después del paso 4.2 o del paso 4.2.2 si no hay indicación de PTX o progreso del tamaño del PTX y el paciente permanece clínicamente estable.
- Observar al paciente en una sala de recuperación después de un TBLC. Justo antes de que el paciente clínicamente estable se vaya a casa, asegúrese de que la PTX de inicio tardío no esté presente ni por la FLUS repetida ni por una radiografía de tórax.
- Discutir la presentación de las características histológicas de las biopsias en un MDD siguiente con neumólogos, radiólogos y patólogos junto con otros detalles para concluir un subtipo de EPI con alta probabilidad diagnóstica.
- Informar al paciente de la conclusión del TDM del paso 4.5 en la clínica ambulatoria, y planificar el posible tratamiento y seguimiento.
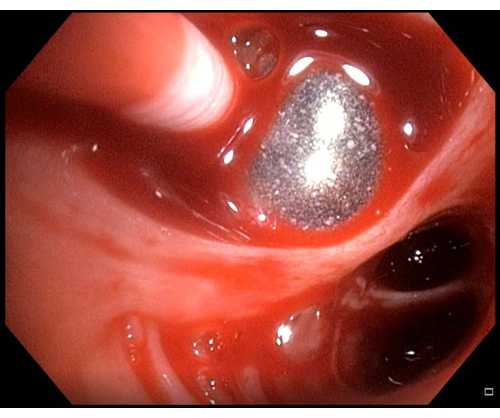
Figura 6: Sangrado leve. Si se observa sangrado después de haber realizado una criobiopsia pulmonar transbronquial, en este caso, sangrado leve, el catéter balón debe mantenerse inflado unos minutos antes de volver a intentar el desinflado. Haga clic aquí para ver una versión más grande de esta figura.
5. TBLC en conjunto con R-EBUS y ENB para diagnósticos PPL
- Navegar y confirmar la ubicación de la lesión pulmonar periférica.
- Inserte la criosonda de 1,1 mm en el canal de trabajo extendido bajo la guía de la fluoroscopia.
- Haga coincidir la punta de la sonda de congelación con la posición de la sonda EBUS radial.
- Pise el pedal de congelación durante 4-8 s.
- Retraiga la criosonda a través del canal de trabajo extendido con un movimiento rápido mientras mantiene presionado el pedal de congelación para continuar congelando y evitar que la biopsia se caiga durante la retracción.
- Mantenga el broncoscopio y el canal de trabajo extendido en su posición mientras la criosonda está retraída.
- Repita los pasos 5.2-5.4 hasta obtener un número suficiente de biopsias.
- Manipule las biopsias como se describe en los pasos 3.3 y 3.4.
Resultados
Sobre la base de las observaciones de los autores de dos centros de TBLC, el procedimiento escalonado descrito para el TBLC con un broncoscopio flexible permitió la toma de muestras histológicas en pacientes daneses bien seleccionados con subtipos de EPI aún no diagnosticados a pesar de los TDM anteriores. Las observaciones detalladas de estas cohortes se reportan en dos estudios recientemente publicados23,25 y para el centro ...
Discusión
Independientemente de la indicación de TBLC, sus propiedades diagnósticas dependen de la calidad del rendimiento del procedimiento y de los criterios seleccionados para someterse al procedimiento. Esto enfatiza la recomendación de implementar un programa de capacitación formal y certificado para adquirir las competencias requeridas para realizar un procedimiento TBLC estandarizado. A pesar de que en la actualidad no se puede obtener una formación oficial sobre el TBLC, la reciente g...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores desean agradecer al personal de los Servicios de Cirugía Torácica y Anestesiología de la Sala de Broncoscopia del Hospital Universitario de Odense, Dinamarca, por su ayuda en la preparación de las figuras para este artículo.
Materiales
| Name | Company | Catalog Number | Comments |
| "Chimney" for tube | |||
| CO2 gas bottle adapter | |||
| CO2 gas tank | Erbe | ||
| Endoscopy column | |||
| Endotracheal tube, size 7.5-8.5 mm | Erbe | ||
| Erbecryo pedal footswitch | Erbe | ||
| Erbecryo2 workstation | Erbe | ||
| Flexible bronchoscope | |||
| Flexible gas hose | Mediland | ||
| Flexible single use cryoprobe, OD 1.1 mm | Erbe | ||
| Flexible single use cryoprobe, OD 1.7 mm | Erbe | ||
| Flexible single use cryoprobe, OD 2.4 mm | |||
| Fluoroscope | |||
| Fogarty balloon catheter | |||
| Formalin glasses in closed system | |||
| NaCl incl. cold NaCl | |||
| Pean for fixating Fogarty balloon | |||
| Sterile disposable cup | |||
| Sterile suction tube | |||
| Sterile tweesers | |||
| Syringe for Fogarty balloon inflation/deflation | |||
| Table bag for flouroscope | |||
| Three way tap for Fogarty balloon syringe | |||
| Tracheal suction | |||
| Ultrasound machine | Erbe | ||
| Valve for biopsy chanel | |||
| Valve to suction duct |
Referencias
- Travis, W. D., et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. American Journal of Respiratory and Critical Care Medicine. 188 (6), 733-748 (2013).
- Ruaro, B., et al. Editorial: Pulmonary fibrosis: One manifestation, various diseases. Frontiers in Pharmacology. 13, 1027332 (2022).
- Lamas, D. J., et al. Delayed access and survival in idiopathic pulmonary fibrosis: a cohort study. American Journal of Respiratory and Critical Care Medicine. 184 (7), 842-847 (2011).
- Tomassetti, S., Piciucchi, S., Tantalocco, P., Dubini, A., Poletti, V. The multidisciplinary approach in the diagnosis of idiopathic pulmonary fibrosis: a patient case-based review. European Respiratory Review. 24 (135), 69-77 (2015).
- Walsh, S. L. F., et al. Multicentre evaluation of multidisciplinary team meeting agreement on diagnosis in diffuse parenchymal lung disease: a case-cohort study. Lancet Respiratory Medicine. 4 (7), 557-565 (2016).
- Ryerson, C. J., et al. A standardized diagnostic ontology for fibrotic interstitial lung disease. An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 196 (10), 1249-1254 (2017).
- Cottin, V., et al. Integrating clinical probability into the diagnostic approach to idiopathic pulmonary fibrosis: An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 206 (3), 247-259 (2022).
- Rodrigues, I., et al. Diagnostic yield and safety of transbronchial lung cryobiopsy and surgical lung biopsy in interstitial lung diseases: a systematic review and meta-analysis. European Respiratory Review. 31 (166), 210280 (2022).
- Korevaar, D. A., et al. European Respiratory Society guidelines on transbronchial lung cryobiopsy in the diagnosis of interstitial lung diseases. European Respiratory Journal. 60 (5), 2200425 (2022).
- Colella, S., Haentschel, M., Shah, P., Poletti, V., Hetzel, J. Transbronchial lung cryobiopsy in interstitial lung diseases: best practice. Respiration. 95 (6), 383-391 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsies for the diagnosis of diffuse parenchymal lung diseases: expert statement from the Cryobiopsy Working Group on safety and utility and a call for standardization of the procedure. Respiration. 95 (3), 188-200 (2018).
- Ravaglia, C., Poletti, V. Transbronchial lung cryobiopsy for the diagnosis of interstitial lung diseases. Current Opinion in Pulmonary Medicine. 28 (1), 9-16 (2022).
- Troy, L. K., et al. Diagnostic accuracy of transbronchial lung cryobiopsy for interstitial lung disease diagnosis (COLDICE): a prospective, comparative study. Lancet Respiratory Medicine. 8 (2), 171-181 (2020).
- Ruaro, B., et al. Transbronchial lung cryobiopsy and pulmonary fibrosis: A never-ending story. Heliyon. 9 (4), e14768 (2023).
- Lentz, R. J., Argento, A. C., Colby, T. V., Rickman, O. B., Maldonado, F. Transbronchial cryobiopsy for diffuse parenchymal lung disease: a state-of-the-art review of procedural techniques, current evidence, and future challenges. Journal of Thoracis Disease. 9 (7), 2186-2203 (2017).
- Maldonado, F., et al. Transbronchial cryobiopsy for the diagnosis of interstitial lung diseases: CHEST Guideline and Expert Panel Report. Chest. 157 (4), 1030-1042 (2020).
- Avasarala, S. K., Wells, A. U., Colby, T. V., Maldonado, F. Transbronchial cryobiopsy in interstitial lung diseases: State-of-the-art review for the interventional pulmonologist. Journal of Bronchology Interventional Pulmonology. 28 (1), 81-92 (2021).
- Abdelghani, R., Thakore, S., Kaphle, U., Lasky, J. A., Kheir, F. Radial Endobronchial Ultrasound-guided Transbronchial Cryobiopsy. Journal of Bronchology Interventional Pulmonology. 26 (4), 245-249 (2019).
- Inomata, M., et al. Utility of radial endobronchial ultrasonography combined with transbronchial lung cryobiopsy in patients with diffuse parenchymal lung diseases: a multicentre prospective study. BMJ Open Respiratory Research. 8 (1), e000826 (2021).
- Benn, B. S., Gmehlin, C. G., Kurman, J. S., Doan, J. Does transbronchial lung cryobiopsy improve diagnostic yield of digital tomosynthesis-assisted electromagnetic navigation guided bronchoscopic biopsy of pulmonary nodules? A pilot study. Respiratory Medicine. 202, 106966 (2022).
- Ankudavicius, V., Miliauskas, S., Poskiene, L., Vajauskas, D., Zemaitis, M. Diagnostic yield of transbronchial cryobiopsy guided by radial endobronchial ultrasound and fluoroscopy in the radiologically suspected lung cancer: A single institution prospective study. Cancers. 14 (6), 1563 (2022).
- Ravaglia, C., et al. Transbronchial lung cryobiopsy in diffuse parenchymal lung disease: Comparison between biopsy from 1 segment and biopsy from 2 segments - diagnostic yield and complications. Respiration. 93 (4), 285-292 (2017).
- Davidsen, J. R., Skov, I. R., Louw, I. G., Laursen, C. B. Implementation of transbronchial lung cryobiopsy in a tertiary referral center for interstitial lung diseases: a cohort study on diagnostic yield, complications, and learning curves. BMC Pulmonary Medicine. 21 (1), 67 (2021).
- Laursen, C. B., et al. Lung ultrasound assessment for pneumothorax following transbronchial lung cryobiopsy. ERJ Open Research. 7 (3), 00045-2021 (2021).
- Kronborg-White, S., et al. Integration of cryobiopsies for interstitial lung disease diagnosis is a valid and safe diagnostic strategy-experiences based on 250 biopsy procedures. Journal of Thoracic Disease. 13 (3), 1455-1465 (2021).
- Barisione, E., et al. Competence in transbronchial cryobiopsy. Panminerva Medica. 61 (3), 290-297 (2019).
- Raghu, G., et al. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 205 (9), e18-e47 (2022).
- Ravaglia, C., et al. Diagnostic yield and risk/benefit analysis of trans-bronchial lung cryobiopsy in diffuse parenchymal lung diseases: a large cohort of 699 patients. BMC Pulmonary Medicine. 19 (1), 16 (2019).
- Hernandez-Gonzalez, F., et al. Cryobiopsy in the diagnosis of diffuse interstitial lung disease: yield and cost-effectiveness analysis. Archivos de Bronconeumología. 51 (6), 261-267 (2015).
- Cooley, J., et al. Safety of performing transbronchial lung cryobiopsy on hospitalized patients with interstitial lung disease. Respiratory Medicine. 140, 71-76 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsy increases diagnostic confidence in interstitial lung disease: a prospective multicenter trial. European Respiratory Journal. 56 (6), 1901520 (2020).
- Kheir, F., et al. Transbronchial lung cryobiopsy in patients with interstitial lung disease: a systematic review. Annals of the American Thoracic Society. 19 (7), 1193-1202 (2022).
- Walscher, J., et al. Transbronchial cryobiopsies for diagnosing interstitial lung disease: real-life experience from a tertiary referral center for interstitial lung disease. Respiration. 97 (4), 348-354 (2019).
- Gnass, M., et al. Transbronchial lung cryobiopsy guided by radial mini-probe endobronchial ultrasound in interstitial lung diseases - a multicenter prospective study. Advances in Respiratory Medicine. 88 (2), 123-128 (2020).
- Ma, X., et al. Global and regional burden of interstitial lung disease and pulmonary sarcoidosis from 1990 to 2019: results from the Global Burden of Disease study 2019. Thorax. 77 (6), 596-605 (2022).
- Kronborg-White, S., et al. A pilot study on the use of the super dimension navigation system for optimal cryobiopsy location in interstitial lung disease diagnostics. Pulmonology. 29 (2), 119-123 (2021).
- Wijmans, L., et al. Confocal laser endomicroscopy as a guidance tool for transbronchial lung cryobiopsies in interstitial lung disorder. Respiration. 97 (3), 259-263 (2019).
- Kheir, F., et al. Using bronchoscopic lung cryobiopsy and a genomic classifier in the multidisciplinary diagnosis of diffuse interstitial lung diseases. Chest. 158 (5), 2015-2025 (2020).
- Renzoni, E. A., Poletti, V., Mackintosh, J. A. Disease pathology in fibrotic interstitial lung disease: is it all about usual interstitial pneumonia. Lancet. 398 (10309), 1437-1449 (2021).
- Chaudhary, S., et al. Interstitial lung disease progression after genomic usual interstitial pneumonia testing. European Respiratory Journal. 61 (4), 2201245 (2023).
- Raghu, G., et al. Use of a molecular classifier to identify usual interstitial pneumonia in conventional transbronchial lung biopsy samples: a prospective validation study. Lancet Respiratory Medicine. 7 (6), 487-496 (2019).
- Kheir, F., et al. Use of a genomic classifier in patients with interstitial lung disease: a systematic review and meta-analysis. Annals of American Thoracic Society. 19 (5), 827-832 (2022).
- Glenn, L. M., Troy, L. K., Corte, T. J. Novel diagnostic techniques in interstitial lung disease. Frontiers in Medicine. 10, 1174443 (2023).
- Kim, S. H., et al. The additive impact of transbronchial cryobiopsy using a 1.1-mm diameter cryoprobe on conventional biopsy for peripheral lung nodules. Cancer Research and Treatment. 55 (2), 506-512 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados