Cristalización ABCG5/G8 en un entorno de bicelas lipídicas para cristalografía de rayos X
En este artículo
Resumen
Este protocolo describe una configuración para la cristalización del transportador de esteroles ABCG5/G8. ABCG5/G8 se reconstituye en biceles para la cristalización en gotas colgantes. El protocolo no requiere materiales ni sustratos especializados, por lo que es accesible y fácil de adaptar en cualquier laboratorio para la determinación de la estructura de la proteína mediante cristalografía de rayos X.
Resumen
Los transportadores de casetes de unión a ATP (ABC) constituyen proteínas de membrana incluidas en lípidos. La extracción de estas proteínas de membrana de la bicapa lipídica a un ambiente acuoso se logra típicamente mediante el empleo de detergentes. Estos detergentes desintegran la bicapa lipídica y solubilizan las proteínas. El hábitat intrínseco de las proteínas de membrana dentro de la bicapa lipídica plantea un desafío para mantener su estabilidad y uniformidad en solución para la caracterización estructural. Las bicelas, que comprenden una mezcla de fosfolípidos y detergentes de cadena larga y corta, replican la estructura lipídica natural. La utilización de bicelas lipídicas y detergentes sirve como un sistema modelo adecuado para obtener cristales de difracción de alta calidad, específicamente para determinar la estructura de alta resolución de las proteínas de membrana. A través de estos microambientes sintéticos, las proteínas de membrana conservan su conformación y funcionalidad nativas, facilitando la formación de cristales tridimensionales. En este enfoque, el heterodimérico solubimérico ABCG5/G8 con detergente se reintegró en las bicelas de DMPC/CHAPSO, suplementadas con colesterol. Esta configuración se empleó en el procedimiento experimental de difusión de vapor para la cristalización de proteínas.
Introducción
Los transportadores de casetes de unión a ATP (ABC) constituyen una superfamilia de proteínas de membrana responsables de diversos procesos de transporte dependientes de ATP a través de membranas biológicas 1,2,3,4,5. Estas proteínas transportadoras están implicadas en las enfermedades cardiovasculares y desempeñan un papel importante en la facilitación del flujo de colesterol a la bilis para su posterior excreción en el hígado. En consecuencia, el metabolismo y el equilibrio del colesterol han despertado un interés considerable a lo largo de los años6. Un mecanismo específico implicado en la eliminación del colesterol y otros esteroles del organismo afecta a miembros de la subfamilia humana ABCG, en particular el heterodimérico ABCG5/G8 7,8,9,10. Las mutaciones en cualquiera de estos genes alteran el heterodímero, lo que lleva a la pérdida de la función y causa sitosterolemia, un trastorno que afecta el tráfico de esteroles11,12,13. Dada la relevancia de la enfermedad y su papel en la promoción del flujo de colesterol, los transportadores de esteroles han atraído una atención significativa. Sin embargo, los intrincados detalles de su mecanismo molecular y selectividad de sustrato permanecen en gran medida sin revelar. Por lo tanto, la elucidación de la estructura cristalina de ABCG5/G8 es un paso crucial hacia la comprensión de los mecanismos y las funciones posteriores en el transporte de colesterol.
Las proteínas de membrana requieren anclaje dentro de las membranas para plegarse y funcionar correctamente. En consecuencia, la extracción de proteínas de membrana de su entorno natural a menudo resulta en inestabilidad proteica, plegamiento incorrecto y pérdida de función14,15. Estos desafíos subrayan los principales obstáculos a los que se enfrenta la cristalización de proteínas de membrana. Sin embargo, la reconstitución de proteínas en bicapas de detergente sintético, como las bicelas, ha surgido como una solución a esta situación, permitiendo el mantenimiento de proteínas de membrana dentro de un entorno bicapa similar al nativo16. Las bicelas son conjuntos de fosfolípidos y detergentes sintéticos suspendidos y solubilizados en agua. En particular, adoptan una estructura bicapa que imita las membranas biológicas16,17,18. Las bicelas pueden pasar entre fases líquidas y de gel en función de la temperatura y la viscosidad. La cristalización de la bicela aprovecha los pequeños discos bicapa y la baja viscosidad a temperaturas reducidas, lo que facilita la mezcla completa de proteínas y soluciones de bicelle. El tamaño de las bicelas depende de la relación detergente/lípidos durante la preparación 19,20. Los detergentes prevalentes para la formación de bicelas incluyen 3-[(3-cholamidopropil)dimetilammonio]-2-hidroxi-1-propanosulfonato (CHAPSO), junto con 3-[(3-colamidopropil)dimetilammonio]-1-propanosulfonato (CHAPS) y 1,2-ditridecanoil-sn-glicerol-3-fosfocolina (DHPC)21. Estos detergentes se utilizan junto con lípidos como la di-miristoil-fosfatidilcolina (DMPC) y la 1-palmitoil-2-oleoil-fosfatidilcolina (POPC). Además, estudios recientes han demostrado la plena funcionalidad de las proteínas de membrana dentro de las bicelas en condiciones fisiológicas. Por ejemplo, Lee y sus colegas cristalizaron con éxito e informaron de la estructura cristalina de ABCG5/ABCG8 basándose en una bicapa lipídica22,23. En el proceso de cristalización, las mezclas de proteínas y bicelas pueden acomodarse utilizando equipos estándar, incluidos los robots de cristalización de alto rendimiento24. Sin embargo, la viabilidad de utilizar bicelas depende de la termoestabilidad de las proteínas debido a las condiciones de cristalización a temperaturas más altas. Sin embargo, en comparación con otras técnicas, las condiciones de cristalización requeridas para las proteínas de membrana generalmente siguen siendo suaves, involucrando bajas concentraciones de precipitante, sal y tampón. Esto hace que tanto las mezclas de proteínas y bicelas como la difusión de vapor sean herramientas efectivas y fáciles de implementar para estudios estructurales de proteínas de membrana.
Este protocolo describe los pasos esenciales en la preparación de proteínas y la cristalización de bicelas para determinar la estructura cristalina de rayos X de ABCG5/G8 a alta resolución (Figura 1).
Protocolo
1. Clonación y expresión de proteínas
- Clonar el gen humano ABCG5/G8 en la levadura Pichia pastoris siguiendo protocolos previos 25,26. Brevemente, derive los vectores de expresión pSGP18 y pLIC de pPICZB. Agregue una etiqueta que codifique un sitio de proteasa 3C del rinovirus seguido de un péptido de unión a la calmodulina (CBP) en el extremo C-terminal del ADNc ABCG8 (pSGP18-G8-3C-CBP).
- Agregue una etiqueta de seis histidina separada por una glicina (His 6 GlyHis6) al extremo C-terminal del ADNc ABCG5 (pLIC-G5-H12). Co-transformar los plásmidos en la cepa KM71H de Pichia mediante electroporación.
NOTA: Consulte la Tabla de materiales para obtener los detalles de los plásmidos, medios y tampones utilizados. - Cultive células de levadura transformadas en placas de agar MD a 28 °C.
- Agregue una etiqueta de seis histidina separada por una glicina (His 6 GlyHis6) al extremo C-terminal del ADNc ABCG5 (pLIC-G5-H12). Co-transformar los plásmidos en la cepa KM71H de Pichia mediante electroporación.
- Después de 1-2 días, seleccione 10-12 colonias e inoculelas en 10 ml de medio base de nitrógeno de levadura (MGY) de glicerol mínimo utilizando tubos de centrífuga de 50 ml para cultivo a pequeña escala.
- Haga tres pequeños agujeros en la tapa del tubo de centrífuga para una mejor aireación. Deje que las células crezcan a 28 °C con agitación constante a 250 rpm hasta que la densidad óptica a 600 nm (OD600) alcance 10, generalmente tomando 1-2 noches.
NOTA: El crecimiento celular suele tardar entre 12-24 h.
- Haga tres pequeños agujeros en la tapa del tubo de centrífuga para una mejor aireación. Deje que las células crezcan a 28 °C con agitación constante a 250 rpm hasta que la densidad óptica a 600 nm (OD600) alcance 10, generalmente tomando 1-2 noches.
- Al día siguiente, tomar 1 L de medio MGY estéril e inocularlo con el cultivo primario en un matraz de 2,4 L. Incubar el matraz a 28 °C en una incubadora agitadora a 250 rpm durante 24 h.
- Para mantener el pH entre 5-6, agregue un 10% de hidróxido de amonio (NH4OH) hasta que el pH se estabilice.
- Ajustar el pH e inducir la expresión de proteínas añadiendo 1 mL de metanol puro por 1 L de cultivo (0,1 % (v/v) de metanol).
NOTA: Alimentar las células posteriormente con 5 ml de metanol puro por litro de cultivo (metanol al 0,5 % (v/v)) cada 12 h durante un total de 36-48 h. - Recolectar las células centrifugando a 15.000 x g durante 30 min a 4 °C.
- Recoja los gránulos celulares y vuelva a suspenderlos en tampón de lisis (0,33 M de sacarosa, 0,3 M de Tris-Cl pH 7,5, 0,1 M de ácido aminohexanoico, 1 mM de EDTA y 1 mM de EGTA) a una concentración de 0,5 g/mL. Conservar la suspensión a -80 °C. Normalmente, se pueden recuperar 30 ± 5 g de masa celular a partir de 1 L de células cultivadas.
NOTA: Almacene los gránulos celulares directamente en el congelador o realice una resuspensión inmediata en tampón de lisis para preparaciones de membrana.
2. Preparación de la membrana microsomal
- Descongele las células y agregue inhibidores de la proteasa (2 μg/ml de leupeptina, 2 μg/ml de pepstatina A, 2 mM de PMSF, consulte la tabla de materiales).
- Para lisar aún más las células, use un emulsionante o microfluidificante enfriado con hielo (consulte la Tabla de materiales) a 25,000-30,000 psi. Repite este proceso 3-4 veces.
- Centrifugar para eliminar los restos celulares: centrifugar a 3.500-4.000 x g durante 15 min, seguido de un segundo centrifugado a 15.000 x g durante 30 min. Mantenga ambos giros a 4 °C.
- Para aislar vesículas de membrana microsomal, transferir el sobrenadante a tubos de ultracentrífuga y someterlo a ultracentrifugación a 2,00,000 x g durante 1,5 h a 4 °C.
- Vuelva a suspender el gránulo de membrana en 50 ml de tampón A (50 mM de Tris-Cl pH 8,0, 100 mM de NaCl y 10% de glicerol) utilizando un homogeneizador de onza. Conservar la suspensión a -80 °C.
3. Preparación-purificación proteica de heterodímeros
- Descongele las membranas microsomales congeladas y ajuste la concentración a 4-6 mg/ml utilizando tampón de solubilización. El tampón debe contener 50 mM de Tris-HCl, pH 8,0, 100 mM de NaCl, 10% de glicerol, 1% (p/v) de maltósido de β-dodecil (β-DDM), 0,5% (p/v) de colato, 0,1% (p/v) de hemisuccinato de colesterol (CHS), 5 mM de imidazol, 5 mM de β-mercaptoetanol (β-ME), 2 μg/ml de leupeptina, 2 μg/ml de pepstatina A y 2 mM de PMSF (ver Tabla de materiales).
NOTA: Se pueden mezclar volúmenes iguales de la preparación de la membrana y el tampón de solubilización, o usar un tampón de solubilización 2x sin inhibidores de proteasa ni agentes reductores. La ebullición corta del tampón ayuda a disolver CHS de manera eficiente. Para la purificación, utilice únicamente el tampón enfriado a 4 °C.- Remover la mezcla a velocidad media durante 1 h a 4 °C. A continuación, revuelva a temperatura ambiente (RT) durante 20-30 minutos.
- Centrifugar la mezcla a 1,00,000 x g durante 30 min a 4 °C para eliminar las membranas insolubles. Recoja el sobrenadante solubilizado y agregue 20 mM de imidazol y 0,1 mM de TCEP.
- Realizar cromatografía en columna de afinidad26: unir el sobrenadante solubilizado a perlas de Ni-NTA preequilibradas (10-15 mL) (ver Tabla de Materiales) en el tampón A (paso 2.2.1) durante la noche.
NOTA: Evite el uso de glicerol en los tampones de funcionamiento a partir de este momento.- Lave la columna dos veces con 10 volúmenes de columna de tampón B (50 mM de HEPES, pH 7,5, 100 mM de NaCl, 0,1 % (p/v) de β-DDM, 0,05 % (p/v) de colato, 0,01 % (p/v) de CHS, 0,1 mM de TCEP) que contengan 25 mM de imidazol.
- Lave la columna con 10 volúmenes de columna de tampón B que contengan 50 mM de imidazol.
- Eluir la proteína usando el tampón C (tampón B con 200 mM de imidazol).
- Añadir 1 mM de TCEP (ver Tabla de Materiales) y 10 mM de MgCl2 a las proteínas eluidas.
- Valide las fracciones eluidas en un gel SDS-PAGE para confirmar el tamaño correcto de la proteína26.
NOTA: Rendimiento proteico típico (1º Ni-NTA): 10-20 mg de proteína por cultivo de 6 L. Utilice DDM a 10 o 5 veces su concentración micelar crítica (CMC), aproximadamente 0,01 %. Este protocolo emplea un 0,1% de DDM. - Diluir las fracciones pico de la elución de Ni-NTA con un volumen igual de tampón D1 (tampón B con 1 mM de CaCl 2, 1 mM de MgCl2), mezclar y cargar las fracciones de proteína en una columna de CBP (3-5 mL) (ver Tabla de materiales) que haya sido preequilibrada con el tampón de lavado CBP D1.
- Realizar lavados secuenciales en la columna CBP para intercambiar detergentes utilizando tampón D1 y D2 (tampón B con 1 mM de CaCl 2, 1 mM de MgCl2, 0,1% (p/v) de decil-maltosa neopentilglicol (DMNG), sin β-DDM): primero, lavar con 3 volúmenes de columna de D1; en segundo lugar, lavar con 3 volúmenes de columna de D1:D2 (3:1, v/v); tercero, lavar con 3 volúmenes de columna de D1:D2 (1:1, v/v); cuarto paso, lavar con 3 volúmenes de columna de D1:D2 (1:3, v/v), seguido de 6-10 volúmenes de columna de D2.
- Eluir la proteína utilizando el tampón de lavado CBP D2 con 300 mM de NaCl en fracciones de 1 mL de la columna de CBP (total 10 mL). Concentrar las fracciones eluidas en 1-2 mL.
NOTA: El rendimiento típico de proteína (1ª CBP) es de 5-15 mg de proteína por cultivo de 6 L. Los detergentes de maltosa neopentilglicol (MNG) mejoran el almacenamiento de proteínas purificadas a 4 °C. Se utilizaron tanto DMNG como Lauryl MNG (LMNG), y el DMNG produjo mejores cristales de difracción de rayos X. Use DMNG a 10-20 veces su concentración micelar crítica (CMC), aproximadamente 0.003%. Este protocolo utilizó DMNG al 0,1%. Una fracción del eluido de CBP se puede purificar aún más mediante cromatografía de filtración en gel (paso 4.4.) para analizar la actividad de la ATPasa de las proteínas o evaluar la monodispersidad a través de la microscopía electrónica de transmisión (TEM).
4. Preparación de proteínas-tratamiento de precristalización
- Escindar los glicanos ligados a N y las etiquetas CBP utilizando endoglicosidasa H (Endo H, ~0,2 mg por 10-15 mg de proteína purificada) y proteasa HRV-3C (~2 mg por 10-15 mg de proteína purificada), respectivamente (ver Tabla de materiales). Incubar durante la noche a 4 °C.
- Durante la incubación de las proteasas Endo H y 3C, realice la alquilación reductora en las proteínas agrupadas. Comience incubando con 20 mM de yodoacetamida (ver Tabla de Materiales) durante la noche a 4 °C. A continuación, realice una incubación de 1 h con 2 mM adicionales de yodoacetamida en hielo.
NOTA: Este paso estabiliza aún más el almacenamiento de proteínas hasta por un mes a 4 °C. - Emplee una segunda columna de CBP (1-2 ml) para separar la etiqueta de CBP cortada. Utilice el búfer D2 para este proceso.
NOTA: El rendimiento típico de proteína (2ª CBP) es de 5-10 mg de proteína por cultivo de 6 L. - Purifique la proteína libre de etiquetas CBP mediante cromatografía de filtración en gel. El tampón debe contener 10 mM de HEPES, pH 7,5, 100 mM de NaCl, 0,1 % (p/v) de DMNG, 0,05 % (p/v) de colato y 0,01 % (p/v) de CHS.
NOTA: El rendimiento típico de proteína (filtración en gel) es de 2-8 mg de proteína por cultivo de 6 L. Durante este paso, la ausencia de un pico de DDM (~65 kD) durante la filtración del gel indica un intercambio exitoso de detergente a DMNG. - Modificar las fracciones proteicas agrupadas mediante metilación reductora: añadir 20 mM de dimetilamina borano (DMAB, ver Tabla de Materiales) y 40 mM de formaldehído a la proteína. Incubar durante 2 h a 4 °C en un agitador oscilatorio. Agregue 10 mM de DMAB.
- Repita el paso 4.5, incluida la adición de 10 mM de DMAB, e incube durante la noche (12-18 h) a 4 °C.
- Detenga la reacción añadiendo 100 mM de Tris-Cl, pH 7,5.
- Cargue la proteína metilada en una columna de Ni-NTA de 2 mL preequilibrada con 100 mM de Tris-Cl, pH 8.0 y 100 mM de NaCl.
- Lave la columna con 10 volúmenes de columna de tampón de lavado (10 mM de HEPES, pH 7,5, 100 mM de NaCl, con 0,5 mg/ml de DOPC: dope (3:1, p/p), 0,1% (p/v) de DMNG, 0,05% (p/v) de colato, 0,01% (p/v) de CHS).
- Eluir la proteína relipidada utilizando tampón de elución (10 mM de HEPES, pH 7,5, 100 mM de NaCl, 200 mM de imidazol, 0,5 mg/mL DE DOPC: DOPE (1:1, p/p), 0,1% (p/v) de DMNG, 0,05% (p/v) de colato, 0,01% (p/v) de CHS).
NOTA: El rendimiento típico de proteína (2º Ni-NTA) es de 1-5 mg de proteína por cultivo de 6 L. - Pasar el eluido de la proteína a través de una columna de desalinización de PD-10 preequilibrada con el tampón utilizado en el paso 4.4.
- Incubar la proteína desalinizada y relipidada durante la noche con colesterol (preparado en isopropanol o etanol) hasta una concentración final de ~20 μM.
- A la mañana siguiente, eliminar el precipitante por ultracentrifugación a 1,50.000 x g durante 10 min a 4 °C. Recoge el sobrenadante.
- Concentrar la proteína hasta una concentración final de 30-50 mg/mL utilizando un concentrador centrífugo de corte de 100 kDa.
- Retire el precipitante con una centrífuga refrigerada de sobremesa a la velocidad máxima durante 30 minutos a 4 °C.
- Mantener el sobrenadante en hielo a 4 °C y establecer condiciones de cristalización en las bicelos.
NOTA: Las proteínas concentradas deben usarse para el crecimiento de cristales dentro de una semana. No congele las proteínas.
5. Cristalización de proteínas en biceles
- Prepare una solución madre de bicelle al 10% con lípidos DMPC y detergente CHAPSO en una proporción de 3:1 (p/p) (ver Tabla de Materiales).
NOTA: Use CHAPSO a 5 veces su concentración micelar crítica (CMC), aproximadamente 0.5%. Esto mantiene la concentración de detergente alrededor de su CMC en la mezcla de proteína y bicelle (paso 5.2).- Añadir detergente disuelto en H2O desionizado (CHAPSO) a los lípidos presecados (mezcla de 5 % mol de colesterol y 95 mol % DMPC).
NOTA: Prepare varias composiciones de lípidos en cloroformo y séquelas en un tubo de ensayo de vidrio utilizando una corriente de gas nitrógeno en RT. Elimine los solventes residuales colocándolos en una cámara de vacío durante la noche, formando una fina capa de lípidos. - Vuelva a suspender los lípidos y el detergente con un sonicador de baño de agua.
- Sonicar la mezcla de bicelle en agua helada con energía continua hasta que la solución se vuelva transparente.
NOTA: Use protección auditiva y asegúrese de tener suficiente suministro de hielo para mantener la mezcla en fase líquida. - Elimine los componentes no disueltos con un filtro centrífugo de 0,2 μm (consulte la tabla de materiales).
NOTA: Almacenar la solución de bicelle alícuota a -80 °C.
- Añadir detergente disuelto en H2O desionizado (CHAPSO) a los lípidos presecados (mezcla de 5 % mol de colesterol y 95 mol % DMPC).
- Cree una mezcla de proteínas y bicelas en hielo combinando suavemente un 10% de bicelas (paso 5.1.4) y proteínas (paso 4.7.4) en una proporción de 1:4 (v/v), logrando una concentración final de proteínas entre 5-10 mg/mL.
- Incuba la mezcla de proteína y bicelle en hielo durante 30 min.
- Configure las condiciones de cristalización en un formato de difusión de vapor de gota colgante utilizando placas de 48 pocillos.
- Mezcle volúmenes iguales (0,5 o 1 μL) de la mezcla de proteína/bicela y la solución del depósito de cristalización que contiene 1,6 M-2,0 M de sulfato de amonio, 100 mM MES (pH 6,5), 0%-4% PEG 400 y 1 mM de TCEP (ver Tabla de Materiales).
NOTA: Cree una matriz de la solución reservorio antes de cada experimento, ajustando el sulfato de amonio (1,6-2,0 M) y el PEG 400 (0%-4%). - Incubar para cristalización a 20 °C.
- Revise las bandejas de cristalización al día siguiente para asegurarse de que la cubierta de vidrio esté sellada correctamente.
- Controle el crecimiento de los cristales al menos una vez al día. Los cristales de alta calidad suelen aparecer en 1-2 semanas, midiendo 50-150 μm x 20-50 μm x 2-5 μm.
NOTA: Los cristales pueden tardar más en formarse a concentraciones de proteínas más bajas. Los cristales maduros deben cosecharse en el plazo de un mes. - Remojar los cristales de proteína en malonato de sodio 0,2 M y congelarlos rápidamente en nitrógeno líquido utilizando criobucles de 50 o 100 μm.
NOTA: Si se dispone de un difractómetro de rayos X, pruebe algunos cristales con una exposición al haz de rayos X de 15-30 minutos para revelar una difracción de hasta 5 Å. La difracción de mayor resolución requiere una fuente de luz de sincrotrón. Utilizando malonato de sodio 0,2 M como crioprotector, un cristal de 100 μm x 50 μm x 2 μm puede proporcionar alrededor de 90 fotogramas de imagen de difracción con rayos X de sincrotrón.
- Mezcle volúmenes iguales (0,5 o 1 μL) de la mezcla de proteína/bicela y la solución del depósito de cristalización que contiene 1,6 M-2,0 M de sulfato de amonio, 100 mM MES (pH 6,5), 0%-4% PEG 400 y 1 mM de TCEP (ver Tabla de Materiales).
Resultados
Los medios transportadores ABC recombinantes, ABCG5 y ABCG8 humanos, se coexpresan en la levadura Pichia pastoris . A continuación, la fracción de membrana de levadura se fracciona mediante centrifugación. Como se describe en este protocolo, las proteínas heterodiméricas se extraen mediante cromatografía en columna en tándem. Posteriormente, las proteínas pretratadas químicamente se cristalizan incubándolas con bicelas de fosfolípidos/colesterol. En la Figura 1 se proporcionan resúmenes esquemáticos de los procesos de purificación y cristalización.
Para evaluar la monodispersidad de las proteínas purificadas, las muestras que contienen 0,01-0,05 mg/mL de proteínas se tiñen con acetato de uranilo al 1%-2%. A continuación, estas muestras se examinan mediante TEM de tinción negativa (Figura 2A). Con el fin de evaluar la estabilidad de las proteínas sin someterse a ciclos de congelación-descongelación, se emplea la cromatografía analítica de filtración en gel. Este análisis implica el monitoreo del almacenamiento en el curso del tiempo de las proteínas purificadas mediante el uso de pequeñas alícuotas de igual volumen de las proteínas (Figura 2B). Puede haber una ligera pérdida de proteínas en las fracciones máximas después de una semana de incubación a 4 °C, posiblemente debido a agregados de proteínas solubles residuales. No obstante, el rendimiento total de proteínas sigue siendo suficiente para el crecimiento de cristales. El uso de TEM de tinción negativa y cromatografía analítica de filtración en gel es una práctica estándar para evaluar la idoneidad de las proteínas para la cristalización, particularmente de diferentes construcciones de ingeniería.
Para la evaluación de la calidad de la proteína en cada paso del proceso de cromatografía en columna, así como después del tratamiento químico previo a la cristalización, se cargan alícuotas de fracciones correspondientes a dos columnas de Ni-NTA, dos columnas de CBP, una filtración en gel y alquilación reductora en un gel SDS-PAGE al 10% (Figura 3). Además, se puede aplicar el mismo entorno de reacción utilizado para la alquilación para el marcado de mercurio con mercurio etílico (EMTS), aunque esto está fuera del alcance del presente estudio.
El crecimiento de los cristales se monitorea diariamente utilizando un microscopio estereoscópico de mesa equipado con un polarizador. Los cristales maduros y adecuados para la recolección de datos generalmente alcanzan dimensiones de 50 μm x 100 μm x 2 μm (Figura 4). Durante el proceso de recolección de cristales, se evitan deliberadamente los cristales o racimos más pequeños.
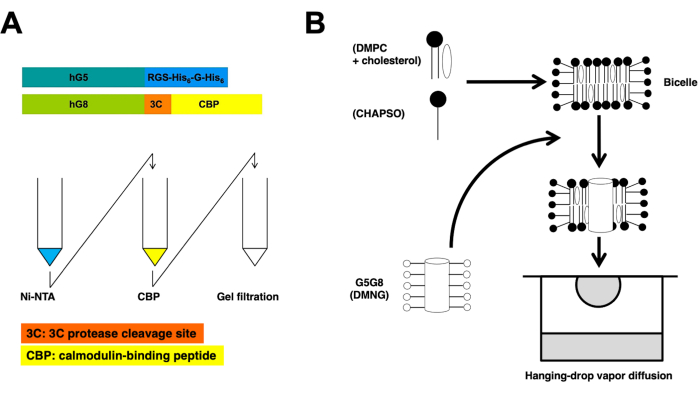
Figura 1: Resúmenes esquemáticos para la purificación (A) y la cristalización de bielas (B) de ABCG5/G8 heterodimérico. Las construcciones de ABCG5 (hG5) y ABCG8 (hG8) humanas recombinantes llevan las etiquetas RGS-H 6-G-H6 y 3C-CBP, respectivamente (A, arriba). Cromatografía en columna de afinidad en tándem, seguida de cromatografía de filtración en gel para lograr una purificación heterodimérica (A, abajo). Haga clic aquí para ver una versión más grande de esta figura.
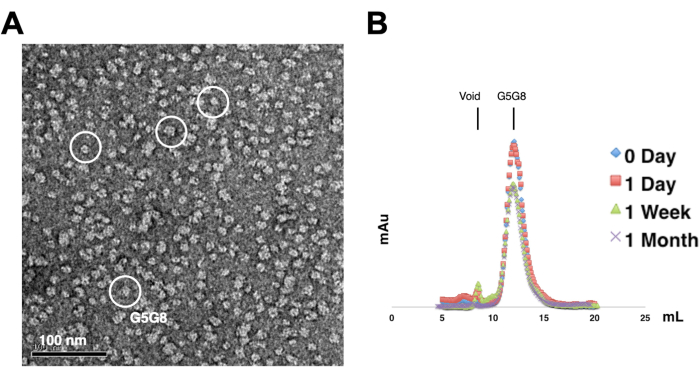
Figura 2: Evaluación de la monodispersidad (A) y estabilidad (B) de proteínas purificadas . (A) Micrografía electrónica de heterodímeros ABCG5/G8 (G5G8) teñidos negativamente mediante TEM. Las partículas representativas se resaltan en círculos blancos sólidos. Barra de escala = 100 nm. (B) Proteínas alquiladas almacenadas a 4 °C analizadas por cromatografía analítica de filtración en gel en el transcurso de un mes con una ligera pérdida de proteínas después de una semana. Haga clic aquí para ver una versión más grande de esta figura.
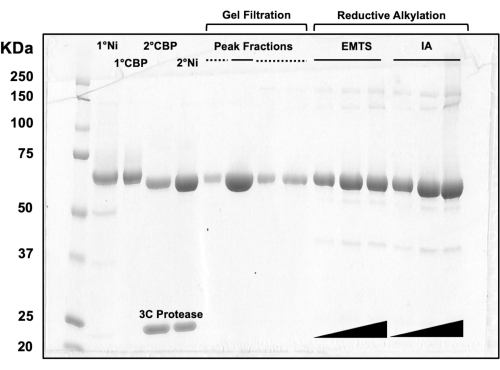
Figura 3: Análisis SDS-PAGE de eluidos proteicos de cromatografía en columna y alquilación reductora. Se cargaron varios volúmenes (1-10 μL) de fracciones proteicas en un gel de Tris/Glicina al 10% y se ejecutaron durante 45 minutos a un voltaje constante de 200 V. El gel se tiñó con azul de Coomassie, se tiñó, se secó al aire y se escaneó con un escáner de mesa. 1° y 2° Ni: primera y segunda columnas de Ni-NTA; 1° y 2° CBP: primera y segunda columnas CBP; Línea continua de fracciones de pico: fracciones agrupadas para cristalización; Línea discontinua de fracciones de pico: fracciones de hombro; EMTS: tiosalicinato de etil mercurio; IA: yodoacedamida. Haga clic aquí para ver una versión más grande de esta figura.
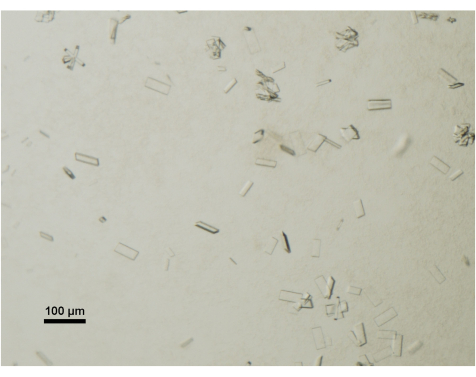
Figura 4: Evaluación de la maduración de cristales de proteínas mediante microscopía óptica. Los cristales maduros de ABCG5/G8 de una gota de cristalización se visualizaron bajo un microscopio estereoscópico de mesa y equipado con polarizador. Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los desafíos asociados con la cristalización de proteínas de membrana han impulsado el desarrollo de métodos de cristalización impulsados por bicapas lipídicas, como los enfoques de la bicela27 o la fase cúbica lipídica (LCP)14 . Sin embargo, lograr una cristalización exitosa de las proteínas de membrana todavía depende del paso crítico y a veces atascado de la preparación de proteínas. En particular, los transportadores ABC presentan un obstáculo formidable en el crecimiento de cristales adecuados para la cristalografía de rayos X. Este protocolo proporciona una guía práctica completa para agilizar la preparación del transportador de esteroles ABCG5 / G8 humano y fomentar el crecimiento de cristales a través del enfoque de cristalización de bicela.
Una consideración clave en el diseño de este protocolo fue el imperativo de un rendimiento proteico sustancial en las fases iniciales de la purificación de proteínas, lo que permite un cierto grado de pérdida de proteínas durante el tratamiento previo a la cristalización (Figura 3). Las estrategias comunes para abordar este desafío incluyen una extensa ingeniería de proteínas, la utilización de diversos hospedadores de expresión y la exploración de ortólogos u homólogos, entre otros enfoques. Sin embargo, con este procedimiento aparentemente intrincado, se han identificado una serie de pasos fundamentales que sustentan el éxito del protocolo y también proporcionan información sobre las posibles limitaciones que pueden surgir al estudiar otros transportadores ABC o proteínas de membrana en general.
En primer lugar, este protocolo emplea una centrifugación exhaustiva en cada paso para minimizar la agregación de proteínas. Además, el monitoreo continuo de la termoestabilidad de las proteínas purificadas es crucial. La microscopía electrónica se utiliza para verificar la monodispersidad de proteínas, mientras que la filtración analítica en gel rastrea la estabilidad de las proteínas a lo largo del tiempo (Figura 2). También podrían incorporarse técnicas alternativas como el dicroísmo circular (CD) o la calorimetría diferencial de barrido (DSC). Además, la incorporación de lípidos en etapas específicas es esencial para maximizar tanto la actividad como la cristalogénesis del ABCG5/G8 purificado. Por ejemplo, el colato y el CHS son necesarios para exhibir hidrólisis medible de ATP; los fosfolípidos son indispensables para mantener la estabilidad de las proteínas metiladas; y el colesterol es un componente necesario de la solución de bicelle, que fomenta el crecimiento de cristales adecuados para la difracción de rayos X de alta resolución (Figura 4).
En esencia, todo el procedimiento se puede lograr en una semana de esfuerzo. A diferencia del LCP, la recuperación de cristales de las bandejas de cristalización de gotas colgantes es sencilla. De cara al futuro, con un rendimiento proteico sustancial (aproximadamente 10 mg), este protocolo es fácilmente adaptable para el desarrollo de investigaciones cristalográficas que involucren mutantes ABCG5/G8 u otras proteínas transportadoras. Esto es particularmente pertinente para los casos que actualmente evaden la visualización a través de la microscopía electrónica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo cuenta con el apoyo de una Beca de Descubrimiento del Consejo de Investigación de Ciencias Naturales e Ingeniería (RGPIN 2018-04070) y una Beca de Proyecto de Investigación de los Institutos Canadienses de Salud (PJT-180640) para JYL. Este protocolo se basa en los reportes originales en estructuras cristalinas ABCG5/G8 reportados anteriormente por Farhat et al.22 y Lee et al.23.
Materiales
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | MilliporeSigma | A4915 | |
| ABCG5 | National Institute of Health collection | NCBI accession number NM_022436 | |
| ABCG8 | National Institute of Health collection | NCBI accession number NM_022437 | |
| ÄKTA FPLC system | Cytiva (formerly GE Healthcare Life Sciences) | ||
| CaCl2 | Wisent | 600-024-CG | Anhydrous |
| CBP | Agilent | 214303 | Calmodulin binding peptide affinity resin |
| Centrifugal concentrators (Vivaspin) | Sartorius | ||
| CHAPSO | Anatrace | C317 | Anagrade |
| Cholesterol | Anatrace | CH200 | |
| CHS | Steraloids | C6823-000 | |
| DMAB | MilliporeSigma | 180238 | 97% |
| DMNG | Anatrace | NG322 | |
| DMPC | Anatrace | D514 | |
| DOPC | Avanti | 850375 | |
| DOPC | Anatrace | D518 | |
| DOPE | Avanti | 850725 | |
| DTT | Fisher | BP172 | |
| Dual Thickness MicroLoops | MiTeGen | ||
| EDTA | BioShop | EDT003 | Disodium salt, dihydrate |
| EGTA | MilliporeSigma | 324626 | |
| Emulsifier (EmulsiFex-C3) | Avestin | ||
| Endo H | New England Biolabs | P0702 | |
| Ethanol | Greenfield | P016EAAN | Ethyl Alcohol Anhydrous |
| Formaldehyde | MilliporeSigma | 252549 | ACS Reagent |
| Glycerol | BioShop | GLY004 | |
| HEPES | BioShop | HEP001 | |
| HRV-3C protease | Homemade | ||
| Imidazole | BioShop | IMD510 | Reagent grade |
| Iodoacetamide | MilliporeSigma | I1149 | BioUltra |
| Isopropanol | Fisher | BP2618212 | |
| Leupeptin | BioShop | LEU001 | |
| MES | MilliporeSigma | 69892 | BioUltra |
| Methanol | Fisher | A412P | |
| MgCl2 | Wisent | 800-070-CG | Hydrated |
| microfluidizer (LM 20) | Microfluidics | ||
| NaCl | BioShop | SOD002 | |
| NH4OH | Fisher | A669-212 | ACS Reagent |
| Ni-NTA superflow | Qiagen | 30430 | Nickel-charged resins |
| PEG 400 | MilliporeSigma | 202398 | |
| Pepstatin | BioShop | PEP605 | |
| PMSF | MilliporeSigma | P7626 | |
| pSGP18 and pLIC | Homemade (derived from pPICZ, Invitrogen) | ||
| SDS | BioShop | SDS003 | |
| Sodium cholate | Fisher | 229101 | |
| Sodium malonate | MilliporeSigma | 63409 | |
| Sucrose | Wisent | 800-081-WG | Ultra pure |
| Superdex 200 30/100 GL | Cytiva (formerly GE Healthcare Life Sciences) | 28990944 | Prepacked gel-filtration column |
| TCEP | |||
| TEM | FEI, Technai | ||
| Tris Base | Fisher | BP152 | |
| β-DDM | Anatrace | D310S | Sol Grade |
| β-mercaptoethanol | MilliporeSigma | ||
| ε-aminocaproic acid | Fisher | AAA1471936 |
Referencias
- Hamada, H., Tsuruo, T. Purification of the 170- to 180-kilodalton membrane glycoprotein associated with multidrug resistance. 170- to 180-kilodalton membrane glycoprotein is an ATPase. Journal of Biological Chemistry. 263 (3), 1454-1458 (1988).
- Higgins, F., Hiles, D., Whalley, K., Jamieson, J. Nucleotide binding by membrane components of bacterial periplasmic binding protein-dependent transport systems. The EMBO Journal. 4 (4), 1033-1039 (1985).
- Higgins, F., et al. A family of related ATP-binding subunits coupled to many distinct biological processes in bacteria. Nature. 323 (6087), 448-450 (1986).
- Horio, M., Gottesman, M., Pastan, I. ATP-dependent transport of vinblastine in vesicles from human multidrug-resistant cells. Proceedings of the National Academy of Sciences of the United States of America. 85 (10), 3580-3584 (1988).
- Mimmack, L., et al. Energy coupling to periplasmic binding protein-dependent transport systems: stoichiometry of ATP hydrolysis during transport in vivo. Proceedings of the National Academy of Sciences of the United States of America. 86 (21), 8257-8261 (1989).
- Grundy, M. Absorption and Metabolism of Dietary Cholesterol. Annual Review of Nutrition. 3 (1), 71-96 (1983).
- Berge, E., et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science. 290 (5497), 1771-1775 (2000).
- Repa, J., et al. Regulation of ATP-binding cassette sterol transporters ABCG5 and ABCG8 by the Liver X receptors α and β. Journal of Biological Chemistry. 277 (21), 18793-18800 (2002).
- Yu, L., et al. Stimulation of cholesterol excretion by the Liver X receptor agonist requires ATP-binding cassette transporters G5 and G8. Journal of Biological Chemistry. 278 (18), 15565-15570 (2003).
- Yu, L., et al. Expression of ABCG5 and ABCG8 is required for regulation of biliary cholesterol secretion. Journal of Biological Chemistry. 280 (10), 8742-8747 (2005).
- Lütjohann, D., Björkhem, I., Beil, F., von Bergmann, K. Sterol absorption and sterol balance in phytosterolemia evaluated by deuterium-labeled sterols: effect of sitostanol treatment. Journal of Lipid Research. 36 (8), 1763-1773 (1995).
- Miettinen, A. Phytosterolaemia, xanthomatosis and premature atherosclerotic arterial disease: a case with high plant sterol absorption, impaired sterol elimination and low cholesterol synthesis. European Journal of Clinical Investigation. 10 (1), 27-35 (1980).
- Salen, G., et al. Sitosterolemia. Journal of Lipid Research. 33 (7), 945-955 (1992).
- Caffrey, M. Membrane protein crystallization. Journal of Structural Biology. 142 (1), 108-132 (2003).
- Michel, H. Crystallization of membrane proteins. Trends in Biochemical Sciences. 8 (2), 56-59 (1983).
- Dürr, N., Gildenberg, M., Ramamoorthy, A. The magic of bicelleslights up membrane protein structure. Chemical Reviews. 112 (11), 6054 (2012).
- Dürr, N., Soong, R., Ramamoorthy, A. When detergent meets bilayer: Birth and coming of age of lipid bicelles. Progress in nuclear magnetic resonance spectroscopy. 69 (1), 1-22 (2013).
- Dufourc, J. Bicelles and nanodiscs for biophysical chemistry. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1863 (1), 183478 (2021).
- Beaugrand, M., et al. Lipid concentration and molar ratio boundaries for the use of isotropic bicelles. Langmuir. 30 (21), 6162-6170 (2014).
- Sanders, R., Schwonek, P. Characterization of magnetically orientable bilayers in mixtures of dihexanoylphosphatidylcholine and dimyristoylphosphatidylcholine by solid-state NMR. Biochemistry. 31 (37), 8898-8905 (1992).
- Seddon, M., Curnow, P., Booth, J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1666 (1-2), 105-117 (2004).
- Farhat, D., et al. Structural analysis of cholesterol binding and sterol selectivity by ABCG5/G8. Journal of Molecular Biology. 434 (20), 167795 (2022).
- Lee, J. Y., et al. Crystal structure of the human sterol transporter ABCG5/ABCG8. Nature. 533 (7604), 561-564 (2016).
- Ujwal, R., Bowie, U. Crystallizing membrane proteins using lipidic bicelles. Methods. 55 (4), 337-341 (2011).
- Johnson, H., Lee, J. Y., Pickert, A., Urbatsch, L. Bile acids stimulate ATP hydrolysis in the purified cholesterol transporter ABCG5/G8. Biochemistry. 49 (16), 3403-3411 (2010).
- Wang, Z., et al. Purification and ATP hydrolysis of the putative cholesterol transporters ABCG5 and ABCG8. Biochemistry. 45 (32), 9929-9939 (2006).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14 (3), 836-840 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados