Activación neuronal remota junto con muestreo de sangre automatizado para inducir y medir la hormona luteinizante circulante en ratones
En este artículo
Resumen
La pulsatilidad de la hormona luteinizante (LH) es un sello distintivo de la función reproductiva. Describimos un protocolo para la activación remota de poblaciones neuronales específicas vinculadas a la extracción automatizada de sangre en serie. Esta técnica permite la modulación hormonal cronometrada, la multiplexación y la minimización de los efectos de manipulación sobre los niveles de LH en animales conscientes que se mueven libremente y no son molestados.
Resumen
Los niveles circulantes de hormona luteinizante (LH) son un índice esencial del funcionamiento del control hipotálamo-hipofisario de la reproducción. Todavía se desconoce el papel de numerosas entradas y poblaciones neuronales en la modulación de la liberación de LH. Medir los cambios en los niveles de LH en ratones es a menudo un desafío, ya que se alteran fácilmente por el estrés ambiental. Las técnicas actuales para medir la liberación de LH y la pulsatilidad requieren un entrenamiento a largo plazo para que los ratones se adapten al estrés de manipulación, cierta restricción, la presencia del investigador y el trabajo con animales individuales, lo que reduce su utilidad para muchas preguntas de investigación.
Este artículo presenta una técnica para activar de forma remota poblaciones neuronales específicas utilizando la tecnología Designer Receptor Activado Exclusivamente por Drogas de Diseño (DREADDs) junto con la toma de muestras de sangre secuenciales automatizadas en ratones conscientes, que se mueven libremente y no son molestados. En primer lugar, describimos el protocolo de cirugía estereotáxica para administrar vectores de virus adenoasociados (AAV) que expresan DREADDs a poblaciones neuronales específicas. A continuación, describimos el protocolo para la canulación de la arteria carótida y la vena yugular y la conexión postquirúrgica al sistema automatizado de toma de muestras de sangre CULEX. Finalmente, describimos el protocolo para la inyección intravenosa de clozapina-N-óxido para la activación neuronal remota y la extracción automatizada de sangre. Esta técnica permite la toma de muestras automatizadas programadas cada 5 minutos o más durante un período determinado, junto con la inyección intravenosa de sustancias en un momento o duración deseada. En general, encontramos que esta técnica es un enfoque poderoso para la investigación sobre el control neuroendocrino.
Introducción
El eje hipotálamo-hipófisis-gonadal (HPG) está regulado centralmente por la liberación pulsátil de la hormona liberadora de gonadotropina (GnRH) en el sistema portal hipofisario. En la glándula pituitaria, la GnRH controla la liberación pulsátil de gonadotropinas, hormona luteinizante (LH) y hormona foliculoestimulante (FSH) al sistema circulatorio. La liberación pulsátil de LH sirve como sello distintivo para el funcionamiento del eje central HPG 1,2,3,4. Por ejemplo, muestra los efectos de alteraciones genéticas o cambios en factores hormonales o ambientales en la parte neural del eje 5,6,7. Hasta hace poco, la medición del patrón pulsátil de LH se limitaba a los grandes mamíferos8 y ratas9, dada la alta frecuencia de muestreo y los grandes volúmenes de sangre necesarios para identificar los pulsos.
La detección de pulsos de LH en ratones es deseable, ya que esta especie tiene amplios modelos genéticos disponibles y puede manipularse fácilmente utilizando tecnologías de ingeniería genómica para estudiar más a fondo genes específicos y poblaciones celulares. En la última década, un gran avance en el análisis de las concentraciones de LH en ratones mediante un ensayo de inmunoadsorción enzimática (ELISA) de LH sándwich ha permitido detectar LH en una cantidad minúscula de sangre10. El desarrollo de la técnica de muestreo frecuente de sangre en la punta de la cola ha hecho posible el muestreo frecuente necesario para detectar la frecuencia y amplitud de los pulsos de LH en ratones10,11. Sin embargo, la toma de muestras de sangre en la punta de la cola se limita a su uso en animales despiertos conscientes; Exige un largo período de entrenamiento para que los ratones se adapten a la manipulación y a la presencia de un investigador designado durante el muestreo. Su éxito es altamente susceptible a los factores estresantes ambientales y puede no ser adecuado para su uso en cepas de ratones que muestran altos niveles de ansiedad. La canulación intraauricular también se ha utilizado para la toma frecuente de muestras de sangre en ratones conscientes que se mueven libremente12. Sin embargo, esa configuración aún requiere muestras de sangre manuales repetidas y restringe el espacio de movimiento de los animales, mientras que la canulación auricular puede conducir a cambios dinámicos en la función cardíaca. Por lo tanto, es deseable establecer un método para la extracción de sangre en condiciones libres de estrés en ratones conscientes, que se mueven libremente y no son molestados, sin necesidad de entrenamiento previo o manipulación o presencia humana.
La toma automatizada de muestras de sangre o dializado se ha utilizado anteriormente para medir diferentes niveles hormonales (p. ej., melatonina13,14) y su secreción pulsátil (p. ej., hormona del crecimiento)15 en roedores sin restricciones. En este trabajo presentamos un protocolo para la toma de muestras de sangre frecuentes y automatizadas a largo plazo en animales conscientes y sin restricciones, junto con una activación remota oportuna de poblaciones neuronales específicas utilizando tecnologías quimiogenéticas: los receptores de diseño activados exclusivamente por drogas de diseño (DREADDs). Describiremos la administración estereotáxica de un vector de virus adenoasociado (AAV) y la activación remota mediante una administración intravenosa (IV) automatizada de clozapina-N-óxido (CNO)16,17. Este protocolo permite la detección secuencial de los niveles basales y los cambios inducidos en la pulsatilidad de la LH en múltiples animales al mismo tiempo. Tanto la toma de muestras de sangre como la administración intravenosa del compuesto se llevan a cabo de forma controlada en el tiempo a través de un programa informático, lo que elimina la presencia física del investigador o la necesidad de un entrenamiento previo en ratones. Este método supera las principales limitaciones de la toma manual de muestras de sangre. Permite la toma de muestras de sangre en condiciones libres de estrés y la administración simultánea de compuestos intravenosos junto con el control remoto de la actividad neuronal. Mostramos resultados representativos del uso de la toma de muestras de sangre automatizadas solas o combinadas con activación neuronal remota y discutimos sus ventajas, limitaciones y usos adicionales.
Protocolo
Todos los procedimientos con animales se realizan de acuerdo con la Guía del Consejo Nacional de Investigación para el Cuidado y Uso de Animales de Laboratorio18 , así como con las leyes federales, estatales y locales. Para esta demostración del protocolo se utilizaron ratones hembra adultos (de 3 a 6 meses de edad), incluidas cuatro hembras C57BL/6J y cuatro Kiss1-Cre; ChR2-eYFP (Kiss1-eYFP) hembras. Los ratones se mantuvieron bajo un ciclo de luz-oscuridad de 12:12, con temperatura controlada a 22 °C, y se alimentaron ad libitum con una dieta baja en fitoestrógenos. Los procedimientos y protocolos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Michigan (IACUC, Protocolos Animales: PRO00010420 y PRO00010138).
1. Entrega estereotáxica de AAVs a una población celular específica
- Preparación para la cirugía
- Esterilice todas las herramientas. Prepare varios paquetes de herramientas quirúrgicas para asegurarse de que cada paquete se use en no más de cinco animales. Preparar guantes estériles, un mínimo de un par para cada animal.
- Tire de las micropipetas de vidrio para inyecciones utilizando los siguientes ajustes (consulte la Tabla de materiales) para micropipetas largas y delgadas que inyectan lenta y constantemente y no se obstruyen fácilmente: Calor 1: 915, Calor 2: 630, Tiro: 630. Optimice estos ajustes para cada extractor.
- Realizar cirugías en un espacio quirúrgico designado. Desinfectar las superficies quirúrgicas con etanol al 70%.
- Utilice paños estériles para mantener la esterilidad del campo quirúrgico. Use una bata de laboratorio limpia o una bata desechable y una mascarilla.
- Prepare el sistema de anestesia inhalatoria. Abra el suministro de oxígeno y regule el caudal a 0,8 L/min.
- Cirugía
- Coloque el ratón en una caja de anestesia y abra el isoflurano al 2,5%. Reducir el flujo de isoflurano al 2% después de la inducción inicial; Mantenga el flujo durante todo el procedimiento. Para conocer los métodos alternativos de anestesia, consulte el protocolo con animales y las pautas del comité de ética local.
- Inyecte analgésico preventivo (carprofeno 5 mg/kg s.c.) siguiendo las recomendaciones del comité de uso de animales y las regulaciones locales.
- Afeita la cabeza del ratón con una maquinilla.
- Instale al animal en una mesa estereotáxica, coloque barras en las orejas y asegúrese de que la cabeza esté correctamente fijada y estable. Fija la boca del ratón a la boquilla, asegurándote de colocar la lengua a un lado fuera de la boca para evitar la asfixia.
- Verifique que el animal esté profundamente anestesiado con un pellizco en el dedo del pie antes de comenzar la cirugía y controle el aliento y el color del ratón durante todo el procedimiento.
- Coloque el soporte de elevación debajo del mouse para mantener el cuerpo y la cabeza nivelados en posición horizontal. Mantenga al animal caliente con una almohadilla tibia cubierta de papel. Aplique ungüento para los ojos en ambos ojos para evitar que se sequen.
- Mantenga el área quirúrgica lo más limpia posible. Use guantes estériles. Desinfecta la cabeza del ratón con yodo y alcohol antes de abrir la piel. Con un bisturí, corte la piel de la cabeza a lo largo de la línea media, aproximadamente desde detrás de los ojos hasta detrás de la sutura lambda. Mantenga el cráneo expuesto y límpielo con un bastoncillo de algodón incrustado en NaCl estéril al 0,9%.
- Busca la vena rinal rostral (RRV) y márcala con un lápiz estéril. Utilice el estereoscopio durante el resto del procedimiento.
NOTA: Obtenemos mejores resultados utilizando el VRR como referencia anteroposterior, pero lo estándar es utilizar bregma como referencia. - Usando una aguja estéril como referencia, asegúrese de que la orientación del cerebro sea correcta antes de proceder a las mediciones estereotáxicas. Asegúrese también de que las alturas de la superficie del cráneo en el VRR y la lambda, así como la inclinación lateral, sean las mismas (± 0,02 mm).
NOTA: La inclinación lateral se vuelve más relevante para la inyección en estructuras cerebrales más laterales. - Cargue una pipeta de vidrio estéril con la solución viral que se va a inyectar. Llévelo a la referencia RRV para la referencia 0 anteroposterior (AP). Avanza a lo largo de la sutura sagital hasta la coordenada AP de tu elección. Marque esta posición con un lápiz estéril, levante la aguja y proceda a la craneotomía.
- Taladre con cuidado un pequeño círculo alrededor de la posición marcada para evitar romper el seno sagital superior. Coloque el taladro en una posición inclinada en lugar de perpendicular para reducir la presión durante la perforación. Retire el pedazo del cráneo con unas pinzas pequeñas.
- Una vez expuesta la vasculatura, utilizar la parte media del seno sagital superior para utilizarla como referencia mediolateral (ML) (punto 0); Esto es más preciso que usar la sutura sagital. Muévase a la posición de ML de su elección. Baje la pipeta para tocar la duramadre como referencia dorsoventral (DV) (punto 0). Rompa ligeramente la duramadre y descienda la pipeta a la posición DV elegida.
- Inyecte la cantidad deseada de AAV (50-200 nL) y deje la cánula en su lugar durante 3 minutos para permitir una dispersión adecuada del líquido. Retire la pipeta con cuidado del cerebro.
- Suelte el mouse de las barras de los oídos. Cierre la piel con pinzas quirúrgicas o cualquier método de su elección. Coloque al animal en una jaula separada y calentada para que se recupere. Supervise la recuperación, la reactividad y la actividad después de que el mouse esté activo. Cuando esté completamente recuperado, mueva el ratón de regreso a su jaula original.
- Espere un mínimo de 3-4 semanas para la expresión viral antes de continuar con la segunda parte del procedimiento.
2. Canulación de la vena yugular y de la arteria carótida
- Preparación para la cirugía
- Realizar cirugías en un espacio quirúrgico designado. Desinfectar las superficies quirúrgicas con etanol al 70% antes de iniciar los procedimientos. Prepare varios paquetes de herramientas quirúrgicas para asegurarse de que cada paquete se use en no más de cinco animales.
- Autoclave de todos los instrumentos quirúrgicos. Luego, limpie con agua estéril o solución salina y desinfecte las herramientas con un esterilizador de perlas caliente durante al menos 15 s (según las instrucciones del fabricante) entre cirugías.
- Utilice paños estériles para mantener la esterilidad del campo quirúrgico. Use una bata de laboratorio limpia o una bata desechable y una mascarilla.
- Preparar microcatéteres para canulaciones en la arteria carótida y la vena yugular. Construya el catéter arterial uniendo un pequeño segmento de tubo de microrrenathane (estirado desde 0.025 pulgadas de diámetro exterior [OD] x 0.012 pulgadas de diámetro interior [ID]) con un tubo de silástica (0.025 pulgadas de diámetro exterior x 0.012 pulgadas de diámetro interior). Construya el catéter venoso solo con un tubo de silicona (0.025 pulgadas de diámetro exterior x 0.012 pulgadas de diámetro interior). Remoje todos los catéteres en etanol al 70% durante la noche antes de la cirugía.
- Biselar las puntas de corte de ambos catéteres a 45° para preestimar longitudes basadas en el peso corporal y la longitud del animal.
- Procedimientos quirúrgicos
- Anestesiar a los animales con menos de isoflurano al 2% con un sistema de isoflurano de bajo flujo de mesa para controlar con precisión la etapa y el plano de la anestesia durante la cirugía.
- Inyectar la dosis preventiva de analgésico (carprofeno 5 mg/kg s.c.) y aplicar pomada oftálmica para prevenir la desecación y lesiones corneales.
- Afeitar las zonas ventrales y posteriores del cuello y limpiar la piel con tres exfoliantes de yodo alternados con etanol al 70%. Realice una incisión vertical en la piel (12 mm) entre los omóplatos y cúbrala con una gasa quirúrgica para su uso posterior. Coloque al animal en decúbito supino con la cabeza hacia el cirujano.
- Utilice un endoscopio de disección estereoscópica para la mayoría de los procedimientos que se describen a continuación.
- Realice una pequeña incisión vertical (~10 mm) en el lado derecho del cuello, superior a la clavícula para exponer la arteria carótida derecha y la vena yugular. Cortar la piel con unas tijeras y realizar una disección roma para separar los tejidos subcutáneos utilizando micropinzas no dentadas con puntas finas, exponiendo la vena yugular externa derecha y la arteria carótida común derecha.
- Ata el extremo distal de la vena yugular para detener el flujo sanguíneo y corta un pequeño orificio en la vena colapsada con micropinzas y tijeras. Inserte el catéter venoso biselado hacia abajo y proximalmente usando un par de micro pinzas para hacerlo avanzar a través de la vena cava superior hasta alcanzar el nivel de la aurícula derecha. La longitud insertada es de ~10-12 mm para un ratón magro de 30 g. Ate el catéter para fijarlo con el vaso con suturas de seda 7-0.
NOTA: Con el catéter en el lugar correcto, la sangre se puede extraer fácilmente; De lo contrario, el catéter puede estar mal colocado en la vena torácica lateral y debe volver a insertarse. - Diseccionar cuidadosamente los tejidos conectivos para exponer la arteria carótida común derecha ubicada en un área triangular rodeada por el músculo esternohioideo, el músculo esternomastoideo y el músculo digástrico. Use un retractor de alambre para separar estos músculos si es necesario. Atar la arteria a nivel de la bifurcación de las arterias carótidas internas y externas mediante suturas de seda 7-0. Coloque proximalmente dos asas de sutura desatadas.
- Detenga temporalmente el flujo sanguíneo tirando de un asa de sutura precolocada y corte o perfore un pequeño orificio en la pared del vaso con microtijeras o una aguja de 27 G. Inserte el catéter arterial biselado hacia abajo y proximalmente hasta una longitud preestimada que llegue al arco de la aorta pero sin tocar la válvula aórtica. La longitud insertada es de ~9-10 mm para un ratón magro de 30 g. Amarre el catéter para fijarlo con el vaso usando las dos suturas precolocadas.
- Tunelice todos los catéteres por vía subcutánea y exteriorícelos en la parte posterior del cuello a través de la incisión precortada y únalos a los puertos venosos o arteriales de un conector de tubo recubierto de silicona hecho de tubo de aguja de 25 G: MASA19 modificado con dos tubos de aguja de 25 G y dos tubos de PE-20 de 4,0 cm, enfundados con 2,0 cm de tubo de silastic de 0,062 pulgadas de diámetro interior unidos con un pequeño anillo metálico hecho de alambre. El volumen lumínico total de cada catéter, incluido el conector, es de 6-8 μL (Figura 1A).
- Cierre la incisión ventral y fije el conector subcutáneamente sobre el cierre de la piel posterior con suturas. Llene ambos catéteres con solución salina heparinizada (200 U/mL) y conéctelos firmemente en el extremo con alambres quirúrgicos de acero inoxidable.
- Los ratones se recuperan de la anestesia con isoflurano en cuestión de minutos y se recuperan completamente de la cirugía en 5 días. Coloque a los animales en la cámara automatizada de extracción de sangre 24 h después de la cirugía y conéctelos al sistema uniendo el gancho de sujeción del sistema al anillo metálico unido al conector del tubo implantado en la parte posterior del cuello. Conectar los catéteres arteriales y venosos a las líneas de inyección y muestreo, respectivamente, 24 h antes de que comience la toma de muestras (Figura 1B). La longitud total de la línea de muestreo es de 55 cm de longitud o 40 μL por volumen de lúmenes.
NOTA: Se han descrito en detalle las configuraciones de las líneas de inyección y muestreo, la programación del método de recolección y los mecanismos de equilibrio de la jaula del sistema automatizado de muestreo de sangre20,21. El sistema mantiene el catéter abierto mediante la administración automática de 10 μL de solución salina heparinizada cada 20 minutos. - Ajuste el tiempo y la frecuencia de muestreo previo a la inyección, inyección y posinyección a través del programa informático del sistema. Consulte el paso 3.1 a continuación para conocer la configuración actual.
- El sistema permite que el animal se mueva libremente sin enredar las líneas de muestreo y/o infusión al detectar el movimiento del ratón mientras gira la cámara de alojamiento en una dirección opuesta al movimiento del ratón21 (Figura 1).
- Vuelva a llenar la línea de infusión o inyección con el compuesto y vuelva a conectarlo al catéter venoso al menos 2 horas antes de que comience la infusión o inyección.
NOTA: Pueden ocurrir complicaciones de la cirugía, y los animales deben ser monitoreados de cerca para su recuperación y en los días posteriores a la cirugía. Consulte el protocolo con animales para conocer el monitoreo, los requisitos de terminación y los procedimientos correctos.
3. Extracción de sangre automatizada e inyección intravenosa
- Extracción de sangre automatizada
- Para seguir este protocolo, utilice un volumen de muestreo de 20,0 μL y establezca un intervalo (es decir, 7,0 min) entre cada muestreo para tener una frecuencia de muestreo de cada 10,0 min por muestra. La velocidad máxima es muestrear continuamente a 3,0 min/muestra; el volumen mínimo de muestreo posible es de 5,0 μL. El sistema devuelve automáticamente una cantidad igual de solución salina para reemplazar la sangre muestreada y mantener el equilibrio de líquidos corporales.
- Establezca el tiempo total de muestreo en 30 (t = -30 - 0) min antes y 30 (t = 0 - 30) min después de la inyección intravenosa de CNO (0,5 mg/kg, Figura 2).
- Cada muestra de sangre recolectada (20,0 μL) se diluye automáticamente en 50 μL de solución salina (que contiene heparina a 10 U/mL) y se almacena individualmente en un microtubo sostenido en un carrusel de muestras refrigerado por el sistema.
- Inyección intravenosa automatizada
- Desconecte la vía venosa del catéter venoso para rellenar el CNO (dosis calculada individualmente por volumen de ~50-60 μL a 0,5 mg/kg) al menos 2 h antes de que comience la toma de muestras de sangre.
- Retirar manualmente la solución (un poco más que el volumen calculado) de la vía de forma retrógrada con la jeringa de inyección, dejando una pequeña burbuja de aire entre la solución y la solución salina existente en la vía.
- Vuelva a conectar la línea de inyección al catéter venoso y ajuste la velocidad de inyección a 500 μL/min y el tiempo de inicio de la inyección a 2 min después de que finalice la toma de muestras t = 0. El tiempo total de inyección para cada animal es de 5-6 s.
NOTA: Si es necesario, el compuesto también se puede administrar mediante una inyección intraperitoneal manual (IP), pero esto requerirá molestar al animal durante o antes del protocolo de extracción de sangre. También mostramos esta alternativa en los resultados.
4. Perfusión animal y recolección de cerebro (OPCIONAL)
NOTA: Este procedimiento debe seguirse solo si se requiere que el cerebro analice el sitio cerebral de activación neuronal o las respuestas posteriores.
- Desconecte el ratón del sistema de extracción de sangre al final del protocolo de recolección. Dos horas después de la inyección intravenosa, se procederá a perfundir al animal con formol tamponado neutro (NBF) al 10%, utilizando el método preferido o como se describe en otra parte22.
- Diseccionar el cerebro y conservarlo en sacarosa al 20% en NBF al 10% durante 3 h para continuar con la fijación.
- Después de 3 h, transfiera el cerebro fijo a sacarosa al 20% en PBS y conserve a 4 °C hasta que esté listo para el corte.
NOTA: Evite la sobrefijación, ya que esto enmascarará los antígenos cFOS. En la solución de sacarosa al 20%, el cerebro debe hundirse hasta el fondo del recipiente. - Haga secciones usando un micrótomo de congelación o criostato y use el método preferido para observar la activación neuronal (p. ej., se muestra la inmunohistoquímica cFOS).
NOTA: Los anticuerpos utilizados para los resultados actuales se describen en la Tabla de Materiales.
5. Procesamiento y análisis de muestras
- Retire las muestras de sangre del muestreador automático inmediatamente después del final del experimento y colóquelas en hielo.
- Centrifugar las muestras a 14.000 × g durante 30 s.
- Recoge el plasma. Guárdelo a -80 °C hasta el análisis.
- Analizar las muestras de sangre mediante ELISA LH como se describió anteriormente 10,23.
Resultados Representativos
Las neuronas que expresan kisspeptina (gen Kiss1) localizadas en el núcleo arqueado del hipotálamo son un potente estimulador de la GnRH y, por tanto, de la liberación de LH de la glándula pituitaria24,25. En esta demostración de protocolo, hemos utilizado la secreción de LH inducida por kisspeptina para ilustrar el funcionamiento de la técnica automatizada de toma de muestras de sangre. La Figura 2 muestra patrones representativos de LH en hembras adultas con Kiss1-eYFP que previamente recibieron una inyección estereotáxica unilateral de AAV-hM3Dq-mCherry en el núcleo arqueado (AP: -4.95, ML: -0.35, DV: -5.7). El ChR2-eYFP se utilizó como reportero fluorescente para las células Kiss1. Un mes después de la cirugía estereotáxica, los ratones se sometieron a la canulación de la arteria carótida y la vena yugular y se conectaron al muestreador automático de sangre 4 días después de la cirugía. Las colectas de sangre para determinar los niveles basales de LH se iniciaron al día siguiente con una frecuencia de muestreo de 10 minutos (intervalo de 7 minutos entre muestras y 3 minutos/muestreo), seguidas de una inyección intravenosa automatizada de CNO y una muestra de sangre continua cada 10 minutos durante 30 minutos. Los niveles de LH diestro son generalmente bajos (Figura 2A), pero generalmente se observan variaciones debido a su liberación pulsátil (Figura 2B). Después de la inyección de CNO (y la activación de las neuronas de kisspeptina), el aumento de la LH fue brusco (en 10 minutos). El nivel de aumento y la duración del pico dependen de numerosos factores, como el lugar de la inyección, el número de neuronas activadas o la población a la que se dirige.
La Figura 3 muestra el sitio cerebral de la inyección en el núcleo arqueado del ratón hembra representado en la Figura 2A. Las neuronas Kiss1-eYFP están marcadas en verde, mientras que la inmunorreactividad mCherry muestra el sitio de inyección y activación de AAV después de CNO. Las neuronas activadas se detectaron mediante inmunorreactividad cFOS, marcadas con DAB. La mayoría de las neuronas mCherry colocalizaron con Kiss1-eYFP, y muchas mostraron inmunorreactividad cFOS, lo que demuestra que la activación viral y neuronal era específica de la población objetivo.
En la Figura 4 se muestra un patrón representativo de liberación pulsátil de LH en ratones diestrous wildtype (C57BL/6J) seguido de la respuesta a una inyección IP de kisspeptina-10. El ratón se sometió a una canulación de la arteria carótida y se conectó al sistema automático de toma de muestras de sangre 4 días después de la cirugía. A la mañana siguiente, se revisaron los ciclos estrales y se realizó la extracción de sangre y la inyección de kisspeptina-10 en el día26. Se recogieron muestras de sangre cada 7 min durante 2 h (intervalo de 4 min, más 3 min/muestreo durante 120 min antes de la inyección) para determinar los niveles basales y la pulsatilidad de la LH, seguido de una inyección IP de kisspeptina-10 (65 μg/kg) y una continuación de la extracción de sangre cada 7 min durante 30 min adicionales. Se observaron pulsos claros de LH típicos de una hembra en distruos, mostrando bajos niveles basales de LH, frecuencia de pulso de ~2 pulsos/h y amplitud de pulso ~1 ng/mL27. Se detectó un aumento inmediato y robusto de la LH en respuesta a la administración de kisspeptina28. Los patrones de secreción de LH y los cambios después de la estimulación concuerdan con otros estudios que utilizan la extracción manual de sangre 10,27,29,30. Estos resultados demuestran que el método automatizado de muestreo de sangre captura la secreción típica y estimulada de LH en condiciones libres de estrés.
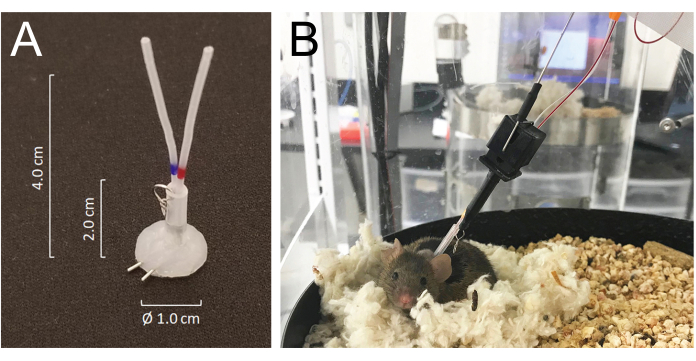
Figura 1: Detalles del sistema de conectores y conexiones del mouse a la tubería del sistema de infusión y muestreo. (A) Un conector de tubería recubierto de silicona (MASA) construido con dos tubos de aguja de 25G y dos tubos de PE-20, enfundados en un tubo de silástica unido con un pequeño anillo de metal. (B) Un ratón conectado al tubo de infusión y muestreo en la jaula de muestreo, descansando en su nido durante la toma de muestras de sangre. Haga clic aquí para ver una versión más grande de esta figura.
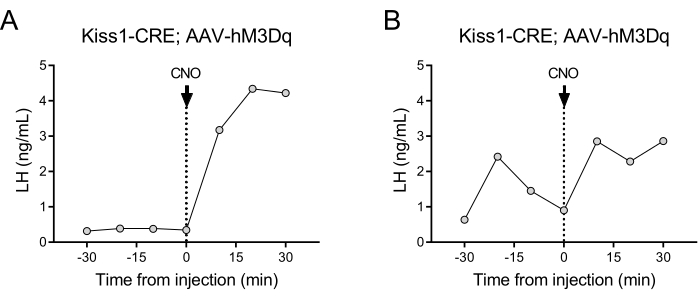
Figura 2: Resultados representativos de los pulsos de LH en ratones hembra Kiss1-Cre inyectados con AAV-hM3Dq en el núcleo arqueado y activados remotamente con CNO. Los niveles basales de LH se midieron cada 10 min durante media hora. En el momento 0 después de la extracción de sangre, la hembra recibió una inyección intravenosa de clozapina-N-óxido (0,5 mg/kg) y se continuó recolectando sangre de la arteria carótida cada 10 minutos durante media hora adicional. (A) Muestra una hembra con niveles bajos de LH basal. (B) Muestra a una mujer mostrando una preinyección de pulso de LH. Abreviaturas: Kiss1 = Kisspeptina; AAV = virus adenoasociado; CNO = N-óxido de clozapina; LH = hormona luteinizante. Haga clic aquí para ver una versión más grande de esta figura.
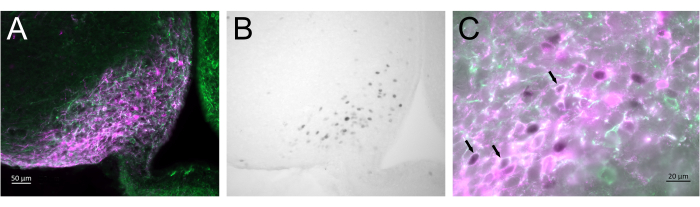
Figura 3: Activación cerebral en el núcleo arqueado del Kiss1-Cre; Chr2-eYFP (Kiss1-eYFP) hembra representada en la Figura 2A. ChR2-eYFP solo se utilizó como gen reportero para etiquetar las neuronas kiss1 . (A) Imagen de fluorescencia de bajo aumento que muestra el sitio de la inyección de AAV en el núcleo arqueado. Verde: inmunorreactividad eYFP, Magenta: inmunorreactividad mCherry. (B) Imagen de campo claro de bajo aumento del área correspondiente a la Figura 3A, que muestra la inmunorreactividad de cFOS (negro) en el sitio de la inyección de AAV en el núcleo arqueado. (C) Fluorescencia de gran aumento e imagen de campo claro combinadas que muestran una mirada más cercana de las neuronas en la Figura 3A, B. Las neuronas Kiss1-eYFP que coexpresan AAV-mCherry que han sido activadas son aquellas con citoplasma blanco y núcleo negro (flechas). Barras de escala = 50 μm (A,B), 20 μm (C). Abreviaturas: Kiss1 = Kisspeptina; AAV = virus adenoasociado; eYFP = proteína fluorescente amarilla mejorada. Haga clic aquí para ver una versión más grande de esta figura.
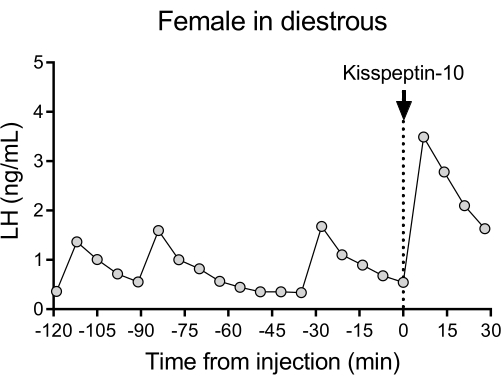
Figura 4: Pulsatilidad basal de LH en una hembra de tipo salvaje diestrada medida cada 7 min durante 2 h. A continuación, la mujer recibió una inyección intraperitoneal de kisspeptina-10 (65 μg/kg) en el momento 0, y se recogieron muestras de sangre de forma continua cada 7 minutos durante media hora. Abreviatura: LH = hormona luteinizante. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Utilizando este protocolo, pudimos mostrar la pulsatilidad basal de la LH y la secreción de LH después de la estimulación de una población neuronal. Las grandes ventajas del sistema son el entorno libre de estrés en el que se realiza la toma de muestras, sin presencia ni manipulación humana durante la toma de muestras de sangre. Además, no se requirió un laborioso entrenamiento previo de los animales ni adaptación a la presencia o manipulación humana durante el experimento. Los experimentos anteriores que utilizaban muestras manuales de sangre requerían una gran cantidad de tiempo y esfuerzo para minimizar los factores estresantes 7,31,32. Sin embargo, cortar la cola por sí solo es un factor estresante33. La implementación de un entorno no estresante y un paradigma de entrenamiento en instalaciones de animales compartidos, donde las interrupciones son impredecibles, también puede ser una limitación. En algunos laboratorios, los animales a menudo necesitan ser transportados a salas de procedimientos alternativas para la toma de muestras de sangre. Estas limitaciones pueden hacer que el método manual sea inapropiado para la detección de cambios sutiles en los niveles de LH y, por lo tanto, un enfoque de no intervención puede ser útil en estas situaciones. El muestreo automatizado se realiza en una habitación tranquila donde los ratones se colocan con varios días de anticipación para que se aclimaten al nuevo entorno. Nuestra experiencia previa con este protocolo proporcionó una detección precisa de los patrones de secreción de corticosterona y hormona de crecimiento pulsátil en ratones, sin mostrar niveles elevados de corticosterona durante el muestreo automatizado15. En los experimentos actuales, todos los animales estaban bien adaptados al sistema de muestreo, mostrando la construcción del nido en la cámara de muestreo después de ~ 24 h y un color de pelo brillante, lo que indica una falta de estrés y un buen estado de salud general (Figura 1).
La principal dificultad que conduce a resultados negativos es probablemente la orientación inadecuada del AAV a la población neuronal requerida. La precisión en las inyecciones estereotáxicas es esencial y se debe realizar un entrenamiento previo para verificar las coordenadas y los volúmenes de inyección. El entrenamiento se puede realizar inyectando una pequeña cantidad de Evans Blue al 0,5-1% en el lugar deseado en la cirugía sin recuperación y luego tomando una rebanada del cerebro recién diseccionado utilizando una matriz cerebral de ratón (por ejemplo, Ted Pella) para comprobar el sitio y el tamaño de la inyección utilizando un estereoscopio.
También es importante tener en cuenta que la sangre y el plasma recogidos del sistema automatizado de toma de muestras de sangre se diluirán en solución salina heparinizada (p. ej., 20 μL de sangre en 50 μL de solución salina en nuestros resultados)20, y puede ser necesario ajustar la relación de dilución para la sensibilidad del método analítico seleccionado. Analizamos los niveles de LH en sangre total diluida en BSA-PBS (como se recomienda para el ELISA de LH ultrasensible)10 o solución salina y no encontramos diferencias en los valores de LH. Tween no se puede utilizar en el diluyente, ya que este circulará por el sistema sanguíneo para extraer las muestras reemplazando los fluidos de la muestra20. En nuestra experiencia, las diluciones inferiores a 1:10 dieron buenos resultados de LH, pero subestimaron ligeramente los niveles de LH en comparación con 1:3,5. Esto indica que la dilución puede ajustarse aún más para reducir la cantidad de sangre recolectada, si es necesario.
Una alternativa a la administración automatizada de compuestos es realizar inyecciones manuales a través del catéter venoso. En este caso, el investigador está brevemente presente en la habitación para administrar la inyección. Sin embargo, no hay contacto directo con los animales ni con su alojamiento y entorno y, a diferencia de las inyecciones intraperitoneales o subcutáneas, todo el procedimiento suele pasar desapercibido para el animal. Las ventajas de una inyección manual son que no es necesario configurar la dilución del compuesto de antemano, lo que puede ser crítico para los compuestos que son demasiado caros para usar en volúmenes más grandes o que son sensibles a la degradación con el tiempo; ya que el volumen operativo es menor que en la administración automatizada, donde la línea de infusión y el catéter deben llenarse previamente con más solución compuesta.
La toma automática de muestras de sangre ofrece una oportunidad única para estudiar las variaciones de la LH durante el sueño, por ejemplo. Hemos observado regularmente animales durmiendo en sus nidos durante el tiempo de muestreo. Es posible vincular este muestreo con registros de EEG para generar un análisis más detallado de la relación entre la actividad neuronal y el patrón de LH34. Como se muestra aquí, las posibilidades para utilizar la toma de muestras de sangre automatizadas son muchas: desde la toma de muestras basales de LH hasta la prueba de la respuesta de LH a compuestos endógenos o exógenos, o hasta la activación o supresión de poblaciones neuronales. Las manipulaciones neuronales pueden ser implementadas de forma aguda con quimiogenética u optogenética, o de forma permanente utilizando modelos de ratón transgénicos y herramientas apoptóticas o de silenciamiento neuronal. La toma automatizada de muestras de sangre también permite la medición de otras hormonas con patrones secretores altamente pulsátiles (por ejemplo, la hormonadel crecimiento 15). En ratones hembra, si se requiere una fase específica del ciclo estral, los frotis vaginales pueden recogerse cuidadosamente horas antes de iniciar el protocolo26 sin interrumpir las líneas de infusión y muestreo. Los animales pueden estar conectados al sistema de toma de muestras durante 7-10 días y el riesgo de coagulación de la línea arterial aumenta con el tiempo.
Esta técnica, sin embargo, está limitada a su uso en animales de un solo hogar y, por lo tanto, puede no ser adecuada para estudiar las interacciones sociales. También es invasivo y requiere una cirugía técnicamente desafiante, por lo que es posible que no sea posible implementarlo con animales juveniles o ciertos modelos de enfermedad. Por último, dado que el coste de compra del sistema puede ser demasiado elevado para un solo laboratorio de investigación, sería aconsejable instalarlo en un laboratorio central que proporcione los servicios mencionados como protocolo experimental.
En conclusión, este protocolo muestra cómo realizar la administración estereotáxica de VAA combinada con la toma de muestras de sangre automatizadas. El preciso control espacial y temporal conseguido con esta técnica, junto con su flexibilidad de aplicación a diferentes modelos, protocolos de medición y hormonas, la convierte en un potente método para el estudio de la regulación hormonal en roedores. Lo más importante es que el método proporciona un entorno libre de estrés al eliminar la presencia humana y la manipulación durante la inyección y/o el muestreo, y el entrenamiento previo de los animales. Estas ventajas, junto con la posibilidad de multiplexación, hacen de este método una herramienta única para estudiar el control neuronal de los cambios hormonales en ratones conscientes, que se mueven libremente y no son molestados.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos al Dr. Daniel Haisenleder por su ayuda en la prueba de diferentes métodos de dilución de sangre. Los ensayos de hormonas séricas se realizaron en el Centro de Investigación en Ensayo y Análisis de Ligandos de Reproducción de la Universidad de Virginia, con el apoyo de la Subvención R24 del NICHD Eunice Kennedy Shriver HD102061. El Centro de Fenotipado Metabólico de Ratones de Michigan-Live cuenta con el apoyo de NIH Center Grant U2C DK135066. JF y NQ cuentan con el apoyo de subvenciones DK020572 (MDRC) y DK089503 (MNORC). La CFE y el CSM cuentan con el apoyo de la subvención R21 HD109485 y la R01 HD096324 del NICHD.
Materiales
| Name | Company | Catalog Number | Comments |
| AAV8-hSyn-hM3D(Gq)-mCherry | Addgene | 44361 | Not necessarily this virus but this was the one used for representative results |
| Alcohol | Disinfection | ||
| Anesthesia Induction box | Vetequip | ||
| Anesthesia induction machine | Kent Scientific Equipment | SomnoSuite | |
| Anesthesia masks for mice | Kent Scientific Equipment | SOMNO-0801 | |
| Autoclip applier 9 mm | Clay Adams | 427630 | |
| Autoclip remover 9 mm | Clay Adams | 427637 | |
| Autoclips 9 mm | Clay Adams | 427631 | |
| BASi Culex Controller | Culex | SN: 2151, 2152, 2156, 2158 | 4 stations |
| BASi Honey Comb Fraction Collector | Honey Comb | SN: 2105, 2106, 2107, 2108 | 4 stations |
| BASi Ratrun Rotation Control | RATURN 2 | SN: 5680, 5681, 5682, 5683 | 4 stations |
| C57BL/6J mice | JAX # 000664 | ||
| Carprofen | Zoetis | Rimadyl | Analgesic |
| Clippers | Braun | ||
| Clozapine-N-oxide | ENZO | BLM-NS105-0005 | |
| Cotton tipped applicators | |||
| CULEX Automated In Vivo Sampling System | BASi | DS000627 | with CX-4000S Replacement Tubing Sets |
| Curved forceps serrated | FST | 11151-10 | |
| Drill | Dremel | 61100 | |
| Empis control Module | EMPIS CM | SN: 174 | |
| Empis Programmable Infusion System | EMPIS | SN: 2125 , 2126, 2127, 2128 | With CX-7010S 4 BAS-2 Infusion Sets; 4 stations |
| Envigo 2016 diet | low-phytoestrogen diet | ||
| Eye ointment | Dechra | Puralube Vet Ointment | Petrolatum Ophtalmic oinment |
| Glass pipettes | World Precision Instruments | MIB100-6 | |
| Hemostats | Roboz Surgical | RS-7101 | |
| Iodine | Betadine Surgical scrub | ||
| Isoflurane | VetOne | Fluriso | Anesthetic |
| Isoflurane Vaporizer or SomnoSuite Low-Flow Anesthesia System | Surgivet or Kent Scientific Corp | SS-01 | Anesthesia Machine |
| Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) mice | JAX # 023436 and #024109 | ||
| Kisspeptin-10 | Phoenix Pharmaceuticals | 048-56 | |
| Micro-renathane tubing | Braintree Scientific | MRE025 | Surgical catheterization |
| Micro-Scissors | Roboz Surgical | RS-5606 | |
| Needle Holder | Roboz Surgical | RS-7842 | |
| Picoliter injector | Warner Instruments | PLI-100A | |
| Pipette puller | Sutter Instruments | P30 | |
| Rodent Warmer X2 | Stoelting | 53850 | |
| Scalpel | FST | 10003-12 | |
| Scissors | Roboz Surgical | RS-6808 | |
| Silicon tubing | Liveo Laboratory Tubing | NO.508-001 | 0.012 in I.D x 0.025 in O.D. |
| Stereotaxic table | RWD | E06208 | |
| Sterile 0.9% saline | Baxter | 2F7124 | |
| Sterile towel drapes | Dynarex | 4410 | |
| Surgical blades | SKLAR | 06-3011 | |
| Surgical stereoscope | Zeiss | f-160 | |
| Tweezers | Roboz Surgical | RS-4960 | |
| Tweezers | Roboz Surgical | RS-4972 | |
| Tweezers | Roboz Surgical | RS-5058 | |
| Antibodies | |||
| Anti-cFos | Millipore | ABE457 | Antigen target: N-terminus cFos; Host organism: Rabbit; Dilution used: 1:5,000; RRID: AB_2631318 |
| Anti-GFP | Aves Labs | GFP-1010 | Antigen target: recombinant GFP null; Host organism: Chicken; Dilution used: 1:10,000; RRID: AB_2307313 |
| Biotin-SP-conjugated AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Labs | 711-065-152 | Antigen target: Rabbit IgG (H+L); Host organism: Donkey; Dilution used: 1:1,000; RRID: AB_2340593 |
| Donkey anti-Rat IgG, AlexaFluor 594 | Thermo Fisher Scientific | A-21209 | Antigen target: Rat IgG (H+L); Host organism: Donkey; Dilution used: 1:500; RRID: AB_2535795 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A-11039 | Antigen target: Chicken, IgY (H+L); Host organism: Goat; Dilution used: 1:500; RRID: AB_2534096 |
| mCherry monoclonal (16D7) | Thermo Fisher Scientific | M11217 | Antigen target: mCherry tag; Host organism: Rat; Dilution used: 1:5,000; RRID: AB_2536611 |
Referencias
- Kokoris, G. J., Lam, N. Y., Ferin, M., Silverman, A. J., Gibson, M. J. Transplanted gonadotropin-releasing hormone neurons promote pulsatile luteinizing hormone secretion in congenitally hypogonadal (hpg) male mice. Neuroendocrinology. 48 (1), 45-52 (1988).
- Coquelin, A., Desjardins, C. Luteinizing hormone and testosterone in young and old male mice. American Journal of Physiology - Endocrinology and Metabolism. 243 (3), E257-E263 (1982).
- Carmel, P. W., Araki, S., Ferin, M. Pituitary stalk portal blood collection in rhesus monkeys: Evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Endocrinology. 99 (1), 243-248 (1976).
- Schuiling, G., Gnodde, H. Site of origin of the pulsatile secretion of luteinizing hormone in long-term ovariectomized rats. Journal of Endocrinology. 70 (1), 97-104 (1976).
- Hackwell, E. C. R., Ladyman, S. R., Brown, R. S. E., Grattan, D. R. Mechanisms of lactation-induced infertility in female mice. Endocrinology. 164 (5), 1-12 (2023).
- Bahougne, T., Kretz, M., Angelopoulou, E., Jeandidier, N., Simonneaux, V. Impact of circadian disruption on female mice reproductive function. Endocrinology. 161 (4), (2020).
- Kreisman, M. J., McCosh, R. B., Tian, K., Song, C. I., Breen, K. M. Estradiol Enables Chronic Corticosterone to Inhibit Pulsatile Luteinizing Hormone Secretion and Suppress Kiss1 Neuronal Activation in Female Mice. Neuroendocrinology. 110 (6), 501-516 (2020).
- Moenter, S. M., Evans, N. P. Gonadotropin-releasing hormone GnRH measurements in pituitary portal blood. Journal of Neuroendocrinology. 34 (5), 13065 (2022).
- Maeda, K. I., et al. The LHRH pulse generator: A mediobasal hypothalamic location. Neuroscience and Biobehavioral Reviews. 19 (3), 427-437 (1995).
- Steyn, F. J., et al. Development of a methodology for and assessment of pulsatile luteinizing hormone secretion in juvenile and adult male mice. Endocrinology. 154 (12), 4939-4945 (2013).
- Steyn, F. J., et al. Development of a method for the determination of pulsatile growth hormone secretion in mice. Endocrinology. 152 (8), 3165-3171 (2011).
- Minabe, S., Uenoyama, Y., Tsukamura, H., Maeda, K. Analysis of pulsatile and surge-like luteinizing hormone secretion with frequent blood sampling in female mice. Journal of Reproduction and Development. 57 (5), 660-664 (2011).
- Perreau-Lenz, S., Kalsbeek, A., Pévet, P., Buijs, R. M. Glutamatergic clock output stimulates melatonin synthesis at night. European Journal of Neuroscience. 19 (2), 318-324 (2004).
- Herwig, A., Pévet, P., Bothorel, B., Steinlechner, S., Saboureau, M. Trans-pineal microdialysis in the Djungarian hamster (Phodopus sungorus): A tool to study seasonal changes of circadian clock activities. Journal of Pineal Research. 40 (2), 177-183 (2006).
- Adams, J. M., Otero-Corchon, V., Hammond, G. L., Veldhuis, J. D., Qi, N., Low, M. J. Somatostatin is essential for the sexual dimorphism of GH secretion, corticosteroid-binding globulin production, and corticosterone levels in mice. Endocrinology. 156 (3), 1052-1065 (2015).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Krashes, M. J., et al. reversible activation of AgRP neurons drives feeding behavior in mice. Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- National Research Council. Guide for the Care and Use of Laboratory Animals. Eighth edition. National Research Council. , (2011).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Peters, S., et al. Culex ABS Part I: Introduction to automated blood sampling. Current Separations. 18 (4), 139-145 (2000).
- Bohs, C., Cregor, M., Gunaratna, G., Kissinger, C. Culex Automated blood sampler part II Managing freely-moving animals and monitoring their activity. Current Separations. 18 (4), 147-151 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kreisman, M. J., Mccosh, R. B., Breen, K. M. A Modified ultra-sensitive ELISA for measurement of LH in mice. Endocrinology. 163 (9), (2022).
- Pielecka-Fortuna, J., Chu, Z., Moenter, S. M. Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol. Endocrinology. 149 (4), 1979-1986 (2008).
- Kumar, D., et al. Specialized subpopulations of kisspeptin neurons communicate with GnRH neurons in female mice. Endocrinology. 156 (1), 32-38 (2015).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , 1-8 (2009).
- Czieselsky, K., et al. Pulse and surge profiles of luteinizing hormone secretion in the mouse. Endocrinology. 157 (12), 4794-4802 (2016).
- Wang, L., et al. Genetic dissection of the different roles of hypothalamic kisspeptin neurons in regulating female reproduction. eLife. 8, 43999 (2019).
- McCosh, R. B., Kreisman, M. J., Breen, K. M. Frequent tail-tip blood sampling in mice for the assessment of pulsatile luteinizing hormone secretion. Journal of Visualized Experiments. (137), e57894 (2018).
- Vanacker, C., Defazio, R. A., Sykes, C. M., Moenter, S. M. A role for glial fibrillary acidic protein (Gfap)-expressing cells in the regulation of gonadotropin-releasing hormone (GnRH) but not arcuate kisspeptin neuron output in male mice. eLife. 10, e68205 (2021).
- Dulka, E. A., Defazio, R. A., Moenter, S. M. Chemogenetic suppression of GnRH neurons during pubertal development can alter adult GnRH neuron firing rate and reproductive parameters in female mice. eNeuro. 7 (3), 0223 (2020).
- Talbi, R., et al. Characterization of the Action of Tachykinin Signaling on Pulsatile LH Secretion in Male Mice. Endocrinology. 162 (8), 1-9 (2021).
- Tuli, J., Smith, J., Morton, D. Corticosterone, adrenal and spleen weight in mice after tail bleeding, and its effect on nearby animals. Laboratory Animals. 29 (1), 90-95 (1995).
- Lucien, J. N., Ortega, M. T., Shaw, N. D. Sleep and puberty. Current Opinion in Endocrine and Metabolic Research. 17, 1-7 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados