Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Visualización in vivo de la actividad espontánea en la corteza sensorial del ratón neonatal con una resolución de una sola neurona
* Estos autores han contribuido por igual
En este artículo
Resumen
Las áreas sensoriales primarias en el neocórtex exhiben actividades espontáneas únicas durante el desarrollo. Este artículo describe cómo visualizar las actividades neuronales individuales y las áreas sensoriales primarias para analizar las actividades sincrónicas específicas del área en ratones neonatos in vivo.
Resumen
El cerebro de los mamíferos experimenta cambios dinámicos en el desarrollo tanto a nivel celular como de circuitos a lo largo de los períodos prenatales y postnatales. Tras el descubrimiento de numerosos genes que contribuyen a estos cambios en el desarrollo, ahora se sabe que la actividad neuronal también modula sustancialmente estos procesos. En la corteza cerebral en desarrollo, las neuronas exhiben patrones de actividad sincronizados que se especializan en cada área sensorial primaria. Estos patrones difieren marcadamente de los observados en la corteza madura, enfatizando su papel en la regulación de los procesos de desarrollo específicos del área. Las deficiencias en la actividad neuronal durante el desarrollo pueden conducir a diversas enfermedades cerebrales. Estos hallazgos ponen de manifiesto la necesidad de examinar los mecanismos reguladores que subyacen a los patrones de actividad en el desarrollo neuronal. Este artículo resume una serie de protocolos para visualizar las áreas sensoriales primarias y la actividad neuronal en ratones neonatos, para obtener imágenes de la actividad de las neuronas individuales dentro de los subcampos corticales utilizando microscopía de dos fotones in vivo, y para analizar las correlaciones de actividad relacionadas con los subcampos. Mostramos resultados representativos de la actividad sincrónica tipo patchwork dentro de barriles individuales en la corteza somatosensorial. También discutimos varias aplicaciones potenciales y algunas limitaciones de este protocolo.
Introducción
La corteza cerebral contiene varias áreas sensoriales con distintas funciones. Las áreas reciben entradas que se originan en sus órganos sensoriales correspondientes, en su mayoría transmitidas a través de la médula espinal o el tronco encefálico y transmitidas a través del tálamo 1,2. En particular, las neuronas en cada área sensorial primaria exhiben una actividad sincronizada única durante las primeras etapas del desarrollo, que también se originan en los órganos sensoriales o en los centros nerviosos inferiores, pero esencialmente difieren de las actividades observadas en la cortezamadura.
En los roedores neonatos, por ejemplo, el área visual primaria (V1) muestra una actividad ondulatoria, que se origina en la retina (onda retiniana) y se propaga a través de toda la vía visual mientras conserva la retinotopía4. El área auditiva primaria (A1) exhibe actividad sincrónica organizada en subregiones en forma de banda que corresponden a las bandas de isofrecuencia en el cerebro maduro. La actividad emana de las células ciliadas internas de la cóclea 5,6. La corteza de barril en el área somatosensorial primaria (S1) muestra un patrón de actividad similar a un mosaico en el que las neuronas de la capa 4 dentro de barriles individuales, es decir, las neuronas que responden a los bigotes individuales, se activan sincrónicamente7. Aunque se ha propuesto su origen en el ganglio del trigémino, la fuente de la actividad sigue siendo desconocida7. En consecuencia, los patrones de actividad neonatal están especializados tanto dentro de cada área sensorial primaria como dentro de los subcampos intraaéreos. La visualización simultánea de la actividad neuronal y la estructura de las áreas sensoriales primarias puede facilitar una investigación sobre la contribución de estos patrones de actividad al desarrollo de los sistemas sensoriales.
En este artículo, resumimos una serie de protocolos: (1) para visualizar las actividades neuronales individuales utilizando el marcaje disperso de GCaMP y áreas sensoriales primarias utilizando ratones TCA-RFP que expresan la proteína fluorescente roja en los axones talamocorticales7, (2) para obtener imágenes de la actividad a nivel de una sola célula en ratones neonatos utilizando microscopía de dos fotones in vivoy (3) analizar las correlaciones de actividad dentro de la corteza de barril S1. Los resultados representativos muestran una actividad sincronizada similar a un mosaico dentro de barriles individuales de un ratón (P)6 del día postnatal. A pesar de algunas limitaciones, esta técnica se puede utilizar para la obtención de imágenes crónicas, la obtención de imágenes de campo amplio en múltiples áreas sensoriales y diversos experimentos de manipulación. El análisis multifacético de la actividad neuronal durante el desarrollo enriquecerá nuestra comprensión de los mecanismos de formación de circuitos cerebrales.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los experimentos se llevaron a cabo de acuerdo con las directrices para la experimentación animal de la Universidad de Kumamoto y el Instituto Nacional de Genética y fueron aprobados por los comités de experimentación animal.
1. Electroporación intrauterina (IUE)
- Aparear ratones machos TCA-RFP de origen ICR con ratones ICR hembras de tipo salvaje. Observe el tapón vaginal para verificar si se aparea temprano en la mañana del día siguiente. Observe el abdomen para verificar si está embarazada 2 semanas después.
- Prepare una solución de plásmido que contenga 5 ng/μL de TRE-nCre, 1 μg/μL de CAG-loxP-stop-loxP-GCaMP6s-ires-tTA-WPRE y 0,02 % de azul de tripán en ddH2O para marcar escasamente las neuronas mediante GCaMP utilizando el sistema Supernova8.
- Prepare una solución analgésica que contenga 0,5 mg/ml de carprofeno y 0,01 mg/ml de buprenorfina. Protégelo de la luz y mantenlo a temperatura ambiente.
- En el día embrionario (E)14, realice la IUE de la siguiente manera. Los métodos de IUE son esencialmente los mismos que los informes anteriores 9,10,11.
- Limpie la mesa de laboratorio con una solución de etanol o glutaraldehído al 70%. Esterilice todos los instrumentos quirúrgicos mediante autoclave. Use una mascarilla y una bata de laboratorio para reducir el riesgo de infección del ratón.
- Prepare las micropipetas de vidrio con un extractor de micropipetas. Introduzca la solución de mezcla de plásmidos en la micropipeta de vidrio mediante un tubo aspirador.
- Inducir la anestesia a las ratas preñadas en E14 utilizando isoflurano (2,0% en aire). Mantener a los ratones anestesiados durante el procedimiento con isoflurano (1,2% en el aire). Apriete el dedo del pie para asegurarse de que la anestesia sea lo suficientemente profunda. Use ungüento oftálmico para prevenir la sequedad ocular.
- Desinfecte el área abdominal al menos tres veces con rondas alternas de exfoliante a base de yodo y etanol al 70%. Coloque un paño estéril para cubrir el área quirúrgica. Haga una incisión en la línea media y exponga el útero en el paño.
- Repita el goteo de solución salina tibia sobre el útero para evitar que se seque o se enfríe hasta el cierre del abdomen (Paso 1.4.8).
- Inyecte la solución de plásmido en un lado del ventrículo lateral de los embriones, uno por uno, utilizando una micropipeta y un tubo aspirador.
- Utilice un electrodo tipo pinza para pellizcar las cabezas de los embriones y administrar pulsos eléctricos cuadrados (40 V, 50 ms) cinco veces a intervalos de 1 s utilizando un electroporador.
- Regrese el útero a la cavidad abdominal. Aplique ~ 3 mL de solución salina tibia en la cavidad. Suturar la membrana peritoneal y la piel abdominal. Administrar la solución analgésica a 10 μL/g de peso (carprofeno a 5 μg/g de peso y buprenorfina a 0,1 μg/g de peso) debajo de la piel en la nuca.
- Coloque el ratón en una jaula de recuperación sobre una almohadilla térmica (37 °C) para recuperarse de la anestesia. Coloca al ratón boca abajo para evitar que su lengua y saliva ahoguen la garganta. Mantenga el ratón alejado de otros ratones y vigílelo hasta que se recupere para moverse normalmente. Regresa el ratón a la jaula.
- Después del nacimiento, realice el genotipado para verificar el alelo RFP y eutanasiar a los cachorros sin el alelo. Este paso se recomienda, especialmente si las imágenes se realizan durante la segunda semana postnatal, cuando la señal de TCA-RFP es débil y difícil de verificar en el paso 2.2.7.
2. Cirugía de ventana craneal
- Prepare el tampón de la corteza que contiene 125 mM de NaCl, 5 mM de KCl, 10 mM de glucosa, 10 mM de HEPES, 2 mM de CaCl2 y 2 mM de MgSO4 en ddH2O (pH ajustado a 7,4 con 1 M de NaOH)12 antes del día de la cirugía. Estéril el tampón con un filtro de vacío.
NOTA: El tampón puede mantenerse a 4 °C durante un máximo de 3 meses. El volumen requerido es de 5-10 mL por cachorro. - Realice los siguientes pasos en P3-12. Véanse también los informes anteriores en los que se ha descrito este procedimiento13,14.
- Mezclar 50 mg de agarosa con 5 mL de tampón de corteza y disolver completamente la agarosa calentándola. Tome un poco de la solución en un tubo de 1,5 ml y manténgalo a 42 °C.
- Tome un poco de tampón de corteza en un tubo cónico de 50 ml y manténgalo a temperatura ambiente. Coloque un poco de solución salina en un recipiente (por ejemplo, una tapa de un tubo cónico de 50 ml) y manténgalo a temperatura ambiente.
- Prepare una solución analgésica que contenga 0,01 mg/ml de buprenorfina. Protégelo de la luz y mantenlo a temperatura ambiente.
- Esterilice todos los instrumentos quirúrgicos mediante autoclave. Desinfecte el microscopio estereoscópico de fluorescencia con etanol al 70%.
- Utilice un vaporizador de isoflurano para inducir la anestesia en el cachorro con isoflurano (2,0% en el aire). Presta atención al cachorro y sácalo cuando su respiración se ralentice ligeramente.
NOTA: Si la anestesia es prolongada, la respiración del cachorro puede cesar durante unos segundos. Incluso si se reanuda la respiración del cachorro, la anestesia prolongada puede disminuir el flujo sanguíneo cerebral del cachorro y causar daño cerebral irreversible. - Desinfecte la cabeza del cachorro al menos tres veces con rondas alternas de exfoliante a base de yodo y etanol al 70%. Coloque el cachorro en la almohadilla térmica (35 ° C) bajo un microscopio estereoscópico de fluorescencia. Mantenga siempre al cachorro anestesiado con isoflurano (1,5%-2,5% en el aire).
- Seleccione las crías que expresan TCA-RFP y GCaMP observando la fluorescencia a través del cráneo. Aplicar la eutanasia a los cachorros que no expresan ambas cosas.
- Retire el cuero cabelludo por encima de los hemisferios cerebrales lo más ampliamente posible con cuidado para no causar sangrado. Frote el cráneo con un hisopo de algodón estéril empapado en solución salina para eliminar el tejido conectivo.
- Después de que el cráneo se seque, adhiera la superficie incisa del cuero cabelludo al cráneo con un adhesivo de tejido.
- Transfiera al cachorro a una almohadilla térmica a 37 °C para recuperarse de la anestesia. Espere al menos 15 minutos para que el adhesivo se solidifique.
NOTA: Haga una pausa de hasta 1 hora antes de continuar con el siguiente paso. Prepare a otros cachorros de manera similar si es necesario durante este tiempo. - Anestesiar al cachorro con isoflurano. Coloque el cachorro en la almohadilla térmica (37 °C) bajo un microscopio estereoscópico de fluorescencia mientras está anestesiado (1,5%-2,5% de isoflurano en el aire).
NOTA: Si la anestesia se prolonga más del tiempo para el punto final (60 min), eutanasiar al cachorro por decapitación durante la anestesia con isoflurano. - Marque la ubicación de expresión de GCaMP en el cráneo con un marcador permanente estéril. Aplique el tampón de corteza en la ubicación.
- Inserta la esquina de una hoja de afeitar en el cráneo. Empuja la hoja lentamente para afeitar el cráneo y hacer un agujero. Pellizca el cráneo agrietado con unas pinzas y retíralo.
- Verifique que el orificio craneal se haya hecho con éxito observando los vasos sanguíneos en el orificio. Si se produce sangrado, enjuague rápidamente el orificio con tampón de corteza con una micropipeta. Repita el enjuague hasta que el sangrado se detenga por completo.
- Aplique una gota de tampón de corteza en el orificio craneal y colóquelo en un cubreobjetos redondo estéril de 3 mm de diámetro sobre el orificio. Limpie el exceso de tampón con tela no tejida. Espere hasta que el área alrededor del vaso se seque.
- Aplique una solución tibia de agarosa alrededor del borde del vidrio con una micropipeta. Debido a que demasiada agarosa puede reducir las señales fluorescentes, retire el exceso de solución debajo del vidrio empujando suavemente el vidrio desde arriba.
- Retire la agarosa del vidrio o aléjela del borde del vidrio con unas pinzas. Deje la agarosa solo alrededor del perímetro exterior del vidrio.
- Espere hasta que la agarosa se solidifique. Si la contracción de la agarosa hace un espacio debajo del vidrio, agregue la solución de agarosa desde el costado para cubrir todo el borde del vidrio. Retire cualquier líquido de la superficie del cráneo con tela no tejida.
- Mezcle el polvo y el líquido de resina acrílica en un recipiente de goma. Aspirar la mezcla con una micropipeta y verterla para cubrir con resina la agarosa que rodea el borde del vidrio.
NOTA: Debido a que la resina se solidifica poco después de mezclar el polvo y el líquido, deben mezclarse repetidamente antes de aplicarla. Las cantidades necesarias en cada mezcla son ~500 μL para líquido y ~0,15 g para polvo. - Fije una barra de titanio con resina en el hemisferio contralateral. Mantenga el ángulo de la barra paralelo al cubreobjetos. Fija toda la superficie del cráneo con resina.
- Administrar la solución analgésica a 10 μL/g de peso (buprenorfina a 0,1 μg/g de peso) debajo de la piel en la parte posterior del cuello. Vuelva a colocar al cachorro en una almohadilla térmica a 37 °C para la recuperación de la anestesia. Espere >60 minutos para que la resina se solidifique antes de tomar imágenes.
NOTA: Haga una pausa de 1 a 5 horas antes de tomar imágenes. Realice la cirugía en otros cachorros de manera similar durante este tiempo.
3. Imágenes de calcio de dos fotones
- Conecte un goniómetro de dos ejes con una placa de titanio a una placa de etapa con posición XY debajo del microscopio. Coloca una almohadilla térmica (35 °C) en el escenario.
- Encienda el software de escaneo con las siguientes condiciones: Píxeles, 512 x 512; Bidireccional, ON; Promedio, ninguno; Área de imagen, 600 x 600 μm con un objetivo de 20x. Configure la configuración para que la velocidad de escaneo sea más rápida que 1 Hz.
- Coloque el cachorro en la almohadilla térmica y fije la barra de titanio de montaje en la cabeza a la placa de titanio con tornillos. Mantenga al cachorro anestesiado colocando un puerto de tubo para isoflurano (1.5-2.0% en el aire).
- Ajuste el ángulo de la ventana horizontalmente con el goniómetro. Encienda la luz de fondo y observe la superficie del cerebro con una lente de objetivo 5x, y seleccione el área de imagen mediante el posicionamiento XY.
- Coloque gotas para los ojos en la ventana craneal. Cambia el objetivo a una lente de inmersión en agua de 20x. Observe la superficie cortical para confirmar que se observa flujo sanguíneo en la superficie del cerebro.
- Apague la luz de fondo y escanee la superficie del cerebro usando el modo de un fotón. Aumente la potencia del láser para hacer visible la autofluorescencia verde del vidrio y la superficie del cerebro.
- Reducir la concentración de isoflurano a 1,0%-1,5%. Cubra el microscopio para evitar fugas de luz. Cambie el software de escaneo al modo de dos fotones.
- Ajuste la potencia del láser y la ganancia del detector apropiada para escanear señales GCaMP y RFP. Encuentre la profundidad donde se ven las señales TCA-RFP. Asegúrese de que la profundidad sea la capa 4, ~ 300 μm más baja que la superficie del cerebro en P6. Seleccione el área de imagen donde se observan muchas neuronas que expresan GCaMP.
- Inicie la generación de imágenes de lapso de tiempo de las señales GCaMP y RFP. Si el escaneo simultáneo de dos canales no es aplicable, capture imágenes GCaMP y TCA-RFP antes de la obtención de imágenes.
- Detenga el isoflurano para debilitar la anestesia y observe actividades espontáneas durante ~ 20 min. Monitoree los movimientos del cachorro durante la toma de imágenes con una cámara infrarroja. Reanude la anestesia con isoflurano (2% en el aire) inmediatamente si se observa alguna respuesta que indique angustia.
- Después de que el cachorro deje de moverse, repita las imágenes del paso 3.9. Cambie el área de imágenes si es necesario.
- Sacrificar al cachorro con una sobredosis de isoflurano. Fijar el cerebro mediante perfusión transcárdica de solución salina y PFA al 4%, seguida de una postfijación en PFA al 4% durante la noche para preparar cortes tangenciales y realizar inmunohistoquímica. De lo contrario, eutanasia al cachorro con una sobredosis de anestésico seguida de la decapitación.
- Si la madre no tiene otras crías, eutanasia a la madre ratón con una sobredosis de anestésico seguida de dislocación cervical.
4. Análisis
- Inicie MATLAB y ejecute EZcalcium toolbox15 para abrir una interfaz gráfica de usuario (GUI) 'Initial GUI'.
- Compense los desviaciones del marco de la imagen debidos a los movimientos del ratón u otras causas.
- Haga clic en Corrección de movimiento en la GUI inicial para abrir la GUI de corrección de movimiento. Haga clic en 'Agregar archivos...' para cargar un archivo TIF de los datos de imagen.
- Establezca la configuración de la siguiente manera: Corrección de movimiento no rígida, en blanco; factor de sobremuestreo, 50; Turno máximo, 15; tamaño del lote inicial, 200; Ancho del contenedor, 200. Haga clic en 'Ejecutar corrección de movimiento' para ejecutar la corrección. Los datos de imagen corregidos por movimiento se guardarán automáticamente.
NOTA: La configuración debe ajustarse a las propiedades de los datos de imagen. Si las derivas de algunos fotogramas no se compensan debido a distorsiones no lineales del fotograma o al movimiento de la corteza en la dirección de la profundidad, abra los datos de imagen originales sin corrección en ImageJ Fiji, elimine los fotogramas y reinicie el paso 4.2.
- Detecte neuronas y dibuje regiones de interés (ROI).
- Haga clic en Detección automatizada de ROI en la GUI inicial para abrir la GUI de detección de ROI. Haga clic en Agregar archivos... para cargar los datos de imágenes corregidas por movimiento.
- Establezca la configuración de la siguiente manera: Inicialización, Codicioso; Método de búsqueda, Elipse; Deconvolución, FOOPSI-SPGL1 restringido; autorregresión, decaimiento; # estimado de ROIs, 60 (se recomienda más del doble del número detectado visualmente); Ancho de ROI estimado, 17 (~20 μm); Umbral de fusión, 0,95; Factor de Engaño, 0.95; Reducción de muestreo espacial, 1; Reducción de muestreo temporal, 1; Iteraciones temporales, 5.
NOTA: La configuración debe ajustarse a las propiedades de los datos de imagen. - Haga clic en Ejecutar detección de ROI para ejecutar la detección. Los datos de ROI se guardarán automáticamente.
- Haga clic en Refinamiento del ROI en la GUI inicial para abrir la GUI de refinamiento del ROI. Haga clic en Cargar datos para cargar los datos de ROI. Seleccione las ROI que tenían una frecuencia de actividad baja (<1 Hz), ubicadas debajo del cráneo o que contenían neuritas de otras neuronas. Haga clic en Excluir ROI para excluir los ROI del análisis.
- Seleccione el Formato de exportación de datos a XLSX y haga clic en Exportar datos para obtener un archivo de Excel con valores dF/F sin procesar. El dF/F utiliza la ecuación (1), donde F es la intensidad media de los píxeles en cada fotograma, F0 es la intensidad de la señal de referencia y Fb es la fluorescencia de fondo.
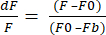 (1)
(1)
- Calcule el coeficiente de correlación de Pearson de dF/F entre ROI y haga una matriz de coeficientes de correlación. Solo use dF/F después de que la anestesia se haya debilitado y haya comenzado a ocurrir actividad espontánea (~ 10 minutos después de suspender el isoflurano).
- Defina los bordes del cañón a partir de la imagen TCA-RFP utilizando Fiji. Clasifique los ROI a sus respectivos barriles o septos. Compara la correlación por pares dentro de un mismo cañón y la que existe entre diferentes barriles.
- Genere de 1.000 a 10.000 datos sustitutos mezclando aleatoriamente la correspondencia entre el ROI y los seguimientos de Ca2+ . Calcule el coeficiente de correlación promedio dentro de barriles individuales en cada dato sustituto y evalúe la significación estadística de la correlación en los datos reales.
NOTA: Si uno de los 10.000 sustitutos tiene un valor superior al valor real, la significación estadística es 0,0001. Los análisis descritos en los pasos 4.5 y 4.6 se pueden realizar para datos agrupados de varios animales, como se realizó en otros lugares 7,16.
Access restricted. Please log in or start a trial to view this content.
Resultados
La Figura 1 muestra los resultados representativos de las actividades neuronales de la capa 4 en la corteza barril de una cría P6 visualizados utilizando el presente protocolo. Las imágenes de dos fotones del canal verde (GCaMP) y el canal rojo (TCA-RFP) se promediaron temporalmente y se mostraron en la Figura 1A. Debido a que la fluorescencia de TCA-RFP era mucho más débil que la fluorescencia de GCaMP, la señal de GCaMP s...
Access restricted. Please log in or start a trial to view this content.
Discusión
Dado que las actividades espontáneas emergen del órgano sensorial o del sistema nervioso inferior y viajan al área sensorial primaria a través de una vía equivalente a la deun sistema nervioso maduro, es crucial definir el área sensorial primaria y la ubicación de las neuronas fotografiadas dentro del área. En este protocolo, abordamos este requisito mediante el empleo de ratones transgénicos que visualizan los axones talamocorticales y el sistema Superno...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen intereses financieros contrapuestos que declarar.
Agradecimientos
Este trabajo contó con el apoyo de la Sociedad Japonesa para la Promoción de la Ciencia Grants-in-Aid for Transformative Research Areas (B) (22H05092, 22H05094) y para las Becas de Investigación Científica 20K06876, AMED bajo el número de subvención 21wm0525015, la Fundación Takeda Science, la Fundación Naito, la Fundación Kato Memorial Bioscience, la Fundación Kowa Life Science, NIG-JOINT (24A2021) (a H.M.); y la Sociedad Japonesa para la Promoción de la Ciencia (SIMCh) 19K06887 y 22K06446, el Fondo Conmemorativo Kodama para la Investigación Médica, la Fundación Conmemorativa Uehara, la Fundación Conmemorativa Kato Memorial Bioscience Foundation y la Fundación Científica Takeda (a N.N-T.). Agradecemos al Dr. Takuji Iwasato por los ratones TCA-RFP.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 20× objective lens (water immersion) | |||
| 250 mL Vacuum Filter/Storage Bottle System | Corning | 431096 | |
| 4%-paraformaldehyde phosphate buffer solution (4% PFA) | Nacalai | 09154-85 | |
| Acrylic resin (UNIFAST II) | GC | N/A | |
| Agarose | Sigma | A9793 | |
| Aspirator tube assembly | Drummond | 2-040-000 | |
| CaCl2•2H2O | Nacalai | 06731-05 | |
| Electroporator | BEX | GEB14 | |
| Eye drop (Scopisol) | Senju Pharmaceutical | N/A | |
| Fluorescence stereo microscope | Leica | M165FC | |
| Glucose | Nacalai | 16806-25 | |
| Heating pad | Muromachi Kikai | FHC-HPS | |
| HEPES | Gibco | 15630-080 | |
| Isoflurane | Pfizer | N/A | |
| KCl | Nacalai | 28514-75 | |
| MgSO4•7H2O | Wako | 131-00405 | |
| Micropipette puller | Narishige | PC-100 | |
| Multiphoton laser | Spectra-Physics | Mai Tai eHP DeepSee | |
| Multiphoton microscope | Zeiss | LSM 7MP | |
| NaCl | Nacalai | 31320-05 | |
| Non-woven fabric (Kimwipe) | Kimberly Clark | S-200 | |
| Phosphate buffered saline (PBS) | Nacalai | 27575-31 | |
| Plasmid: CAG-loxP-STOP-loxP-GCaMP6s-ires-tTA-WPRE | Addgene | pK175 | |
| Plasmid: TRE-nCre | Addgene | pK031 | |
| Precision calibrated micropipets | Drummond | 2-000-050 | |
| Razor blade | Feather | FA-10 | |
| Rimadyl (50 mg/mL Carprofen) | Zoetis JP | N/A | |
| Round cover glass, 3-mm-diameter | Matsunami | CS01078 | |
| Saline | Otsuka | 035175315 | |
| Sodium pentobarbital | Nacalai | 26427-72 | |
| Stage for imaging living pup (two single-axis translation stage for XY positioning, two-axis goniometer, base plate, adjustable pillar for z positioning) | ThorLabs | LT1/M, GN2/M, BM2060/M, MLP01/M | |
| TCA-RFP mouse | N/A | N/A | Mizuno et al., 2018a |
| Tissue adhesive (Vetbond) | 3M | 1469SB | |
| Titanium bar | Endo Scientific Instrument | N/A | Custom made (Mizuno et al., 2018b) |
| Titanium bar fixing plate | N/A | Custom made (Mizuno et al., 2018b) | |
| Trypan blue | Sigma | T8154 | |
| Tweezers with platinum plate electrode, 5 mm diameter | BEX | CUY650P5 | |
| Wild-type ICR mouse | Nihon SLC | Slc:ICR |
Referencias
- Rao, M. S., Mizuno, H. Elucidating mechanisms of neuronal circuit formation in layer 4 of the somatosensory cortex via intravital imaging. Neuroscience Research. 167, 47-53 (2021).
- Iwasato, T., Erzurumlu, R. S. Development of tactile sensory circuits in the CNS. Current Opinion in Neurobiology. 53, 66-75 (2018).
- Martini, F. J., Guillamón-Vivancos, T., Moreno-Juan, V., Valdeolmillos, M., López-Bendito, G. Spontaneous activity in developing thalamic and cortical sensory networks. Neuron. 109 (16), 2519-2534 (2021).
- Ackman, J. B., Burbridge, T. J., Crair, M. C. Retinal waves coordinate patterned activity throughout the developing visual system. Nature. 490 (7419), 219-225 (2012).
- Tritsch, N. X., Yi, E., Gale, J. E., Glowatzki, E., Bergles, D. E. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Babola, T. A., et al. Homeostatic control of spontaneous activity in the developing auditory system. Neuron. 99 (3), 511-524.e5 (2018).
- Mizuno, H., et al. Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Reports. 22 (1), 123-135 (2018).
- Mizuno, H., et al. NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron. 82 (2), 365-379 (2014).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Mizuno, H., Nakazawa, S., Iwasato, T. In vivo two-photon imaging of cortical neurons in neonatal mice. Journal of Visualized Experiments. 140, e58340(2018).
- Egashira, T., et al. In vivo two-photon calcium imaging of cortical neurons in neonatal mice. STAR Protocols. 4 (2), 102245(2023).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Antón-Bolaños, N., et al. Prenatal activity from thalamic neurons governs the emergence of functional cortical maps in mice. Science. 364 (6444), 987-990 (2019).
- Guillamón-Vivancos, T., et al. Input-dependent segregation of visual and somatosensory circuits in the mouse superior colliculus. Science. 377 (6608), 845-850 (2022).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Chen, J. L., Voigt, F. F., Javadzadeh, M., Krueppel, R., Helmchen, F. Long-range population dynamics of anatomically defined neocortical networks. eLife. 5, e14679(2016).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. The Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Murakami, T., Matsui, T., Uemura, M., Ohki, K. Modular strategy for development of the hierarchical visual network in mice. Nature. 608 (7923), 578-585 (2022).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of Calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Shemesh, O. A., et al. Precision calcium imaging of dense neural populations via a cell-body-targeted calcium indicator. Neuron. 107 (3), 470-486 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, e38173(2019).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. BioRxiv. , (2017).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2014).
- Marques-Smith, A., et al. A Transient translaminar GABAergic interneuron circuit connects thalamocortical recipient layers in neonatal somatosensory cortex. Neuron. 89 (3), 536-549 (2016).
- Tuncdemir, S. N., et al. Early somatostatin interneuron connectivity mediates the maturation of deep layer cortical circuits. Neuron. 89 (3), 521-535 (2016).
- Nakazawa, S., Yoshimura, Y., Takagi, M., Mizuno, H., Iwasato, T. Developmental phase transitions in spatial organization of spontaneous activity in postnatal barrel cortex layer 4. The Journal of Neuroscience. 40 (40), 7637-7650 (2020).
- Yu, Y. -C., et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature. 486 (7401), 113-117 (2012).
- Siegel, F., Heimel, J. A., Peters, J., Lohmann, C. Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Current Biology. 22 (3), 253-258 (2012).
- Nakagawa, N., Hosoya, T. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. 406, 554-554 (2019).
- Valiullina, F., et al. Developmental changes in electrophysiological properties and a transition from electrical to chemical coupling between excitatory layer 4 neurons in the rat barrel cortex. Frontiers in Neural Circuits. 10, 1(2016).
- Avitan, L., et al. Spontaneous and evoked activity patterns diverge over development. Elife. 10, e61942(2021).
- Mölter, J., Avitan, L., Goodhill, G. J. Detecting neural assemblies in calcium imaging data. BMC Biology. 16 (1), 143(2018).
- Nakazawa, S., Mizuno, H., Iwasato, T. Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nature Communications. 9 (1), 3106(2018).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados