Generación de un sistema de cultivo monocapa bidimensional derivado de enteroide primario bovino para aplicaciones en investigación biomédica traslacional
En este artículo
Resumen
Los enteroides están emergiendo como un modelo novedoso para estudiar la fisiología y la fisiopatología de los tejidos, el desarrollo de fármacos y la medicina regenerativa. Aquí, describimos un sistema de cultivo derivado de enteroides 2D de células primarias bovinas que permite el cocultivo con tipos de células de tejido relevantes. Este modelo ofrece una ventaja traslacional para el modelado de la investigación gastrointestinal.
Resumen
Los sistemas de cultivo de células organoides pueden recapitular la complejidad observada en los tejidos, lo que los hace útiles para estudiar las interacciones huésped-patógeno, evaluar la eficacia y toxicidad de los fármacos y la bioingeniería de tejidos. Sin embargo, la aplicación de estos modelos por las razones descritas puede ser limitada debido a la naturaleza tridimensional (3D) de estos modelos. Por ejemplo, el uso de sistemas de cultivo de enteroides en 3D para estudiar enfermedades digestivas es un desafío debido a la inaccesibilidad de la luz intestinal y sus sustancias secretadas. De hecho, la estimulación de organoides 3D con patógenos requiere microinyección luminal, alteración mecánica de la estructura 3D o generación de enteroides apicales. Además, estos organoides no pueden ser co-cultivados con células inmunes y estromales, lo que limita el análisis mecanicista en profundidad de la dinámica fisiopatológica. Para evitar esto, optimizamos un sistema de cultivo monocapa derivado de enteroides, bidimensional (2D) de células primarias bovinas, que permite el cocultivo con otros tipos celulares relevantes. Las criptas ileales aisladas de ganado adulto sano se cultivaron para generar organoides 3D que se criopreservaron para su uso futuro. Se creó una monocapa 2D utilizando enteroides 3D revividos que se dejaron pasar y se interrumpieron para producir células individuales, que se sembraron en insertos de cultivo celular transpocillos recubiertos de extracto de membrana basal, exponiendo así su superficie apical. La polaridad de la monocapa intestinal, la diferenciación celular y la función de barrera se caracterizaron mediante microscopía de inmunofluorescencia y midiendo la resistencia eléctrica transepitelial. La estimulación de la superficie apical de la monocapa reveló la funcionalidad esperada de la monocapa, como lo demuestra la secreción de citocinas de los compartimentos apical y basal. El modelo de monocapa derivado de enteroide 2D descrito es muy prometedor en la investigación de las interacciones huésped-patógeno y la fisiología intestinal, el desarrollo de fármacos y la medicina regenerativa.
Introducción
Los modelos animales en investigación desempeñan un papel crucial en la mejora de nuestra comprensión de la fisiopatología de la enfermedad y la dinámica de la respuesta inmunitaria del huésped durante la infección, y apoyan el desarrollo de nuevas estrategias preventivas y terapéuticas 1,2,3,4. Estos modelos apoyan el descubrimiento y el avance de la investigación en animales y son clave para el progreso de la investigación en salud humana. Durante décadas, los modelos de roedores han respaldado los avances en los mecanismos inmunológicos y la investigación biológica fundamental para las enfermedades humanas 3,5,6,7. Si bien los modelos de roedores son fundamentales en la investigación de detección y desarrollo temprano, los modelos de animales grandes ofrecen una comparación más relevante en la investigación de enfermedades humanas tanto en estudios de descubrimiento temprano como de desarrollo posterior, incluidas las pruebas de eficacia terapéutica y seguridad 1,3,4,5. La ganadería ofrece claras ventajas en comparación con los modelos de roedores para una traducción más eficiente para aplicaciones humanas para algunas enfermedades, como la criptosporidiosis, la salmonelosis, la tuberculosis, el virus respiratorio sincitial y la brucelosis 1,7,8. De hecho, estas y otras enfermedades se desarrollan espontáneamente en el ganado bovino, que comparte varias patogénesis de enfermedades y procesos inmunológicos análogos a los humanos, y como población endogámica, el ganado imita la heterogeneidad genética y ambiental que influye en las respuestas inmunitarias humanas 5,8,9,10 . Los beneficios de los modelos bovinos para la investigación de enfermedades infecciosas pueden maximizarse empleando primero un sofisticado sistema de cultivo y luego implementando estudios in vivo paso a paso. El uso inicial de un sistema de cultivo altamente complejo derivado de bovinos puede reducir considerablemente el número de estudios con animales vivos, al tiempo que mejora las posibilidades de éxito de la investigación traslacional y aplicada. Los modelos de cultivo deben recapitular los procesos de la enfermedad a nivel de órgano para una validez predictiva óptima, conservando el microambiente del tejido nativo espacial y funcionalmente.
La respuesta inmune de la mucosa es un sistema multifacético compuesto por una barrera altamente eficiente formada por enterocitos gastrointestinales y diversas poblaciones de células inmunes ubicadas debajo de la superficie mucosa11. Este sistema altamente complejo es crítico durante la infección para mantener la homeostasis gastrointestinal e iniciar las defensas inmunitarias contra patógenos entéricos11. La comunicación entre los enterocitos y las células inmunitarias innatas subyacentes inicia el desarrollo de respuestas inmunitarias protectoras contra microorganismos patógenos. Como tal, los sistemas de cultivo que son comparativos en su nivel de complejidad son necesarios para una investigación óptima de las interacciones huésped-patógeno entérico y son altamente efectivos en la comprensión de la fisiología entérica y el descubrimiento y desarrollo de fármacos12,13. Los organoides son un sistema de cultivo robusto que se asemeja a la arquitectura y función del tejido de origen14,15. La multicelularidad de estos modelos permite investigar el papel de diversas poblaciones celulares y las interacciones celulares implicadas en la salud y la enfermedad entérica12,14. Sin embargo, los modelos de organoides de origen humano en investigación están actualmente limitados por la dificultad de obtener una cantidad suficiente y una calidad constante de células epiteliales intestinales humanas y la limitada viabilidad celular en cultivo. Las líneas celulares inmortalizadas se pueden utilizar para obtener altos rendimientos de cultivos homólogos en estos modelos de manera consistente; Sin embargo, las células transformadas carecen inherentemente de la diversidad y complejidad funcional de las células epiteliales no transformadas16,17. Las ventajas de utilizar cultivos derivados de tejido bovino como modelo para investigar enfermedades gastrointestinales y fisiología incluyen la facilidad con la que se pueden obtener muestras de tejido de donantes sanos, una mejor viabilidad celular y una mayor diversidad celular que solo se puede lograr con tejido no inmortalizado. La transcriptómica comparativa de tejidos y la caracterización de organoides intestinales revelan similitudes en los genes ortólogos conservados y los potenciales celulares entre humanos y bovinos18. Por lo tanto, un sistema de cultivo derivado de organoides bovinos puede ser ventajoso en la investigación de enfermedades intestinales humanas, con hallazgos fácilmente trasladables a la medicina humana.
El protocolo descrito en este documento detalla una plataforma eficaz para evaluar las respuestas del huésped a patógenos o compuestos entéricos y la fisiología intestinal utilizando un sistema de cultivo celular primario 2D derivado de enteroides. A diferencia de los organoides 3D, los sistemas de cultivo 2D generados en insertos transwell permiten un cultivo dual de células intestinales con células inmunitarias o estromales, lo que permite estudiar la dinámica a nivel tisular. Con aplicaciones en la investigación biomédica, el desarrollo farmacéutico y las pruebas de eficacia, este modelo fisiológicamente relevante puede beneficiar la salud y el progreso tanto del ganado como de las personas.
Protocolo
Todos los protocolos se realizaron cumpliendo con los lineamientos y regulaciones institucionales y nacionales para el bienestar animal.
1. Preparación de reactivos
NOTA: El stock y las concentraciones finales de los reactivos utilizados en este estudio se enumeran en la Tabla 1.
- Prepare el tampón de recolección de muestras: Mezcle 1 litro de solución salina tamponada con fosfato (PBS) helada que contenga penicilina (100 U/mL), estreptomicina (100 μg/mL), gentamicina (25 μg/mL) y caspofungina (2,5 μg/mL). Almacenar solución madre a 4 °C.
- Preparar el reactivo de disociación #1: Mezclar 18,55 ml de tampón de recogida de muestras (como se describe en el paso 1.1), 1,422 ml de ácido etilendiaminotetraacético (EDTA, 0,422 M/pH 7,4), 20 μl de solución 1 M de 1,4-ditiotreitol (DTT), 4 μl de solución de Y-27632 (5000x/50 mM). Almacenar la solución a 4 °C.
- Prepare el reactivo de disociación #2: Mezcle 18,57 ml de tampón de recolección (como se describe en el paso 1.1), 1,422 ml de EDTA (0,422 M/pH 7,4), 4 μl de solución de Y-27632 (5000x/50 mM). Almacenar la solución a 37 °C.
- Prepare el stock de sustrato enteroide: Mezcle 9,875 ml de medio de crecimiento organoide más suplemento, 100 μl de penicilina (100 U/ml), estreptomicina (100 μg/ml), 5 μl de gentamicina (25 μg/ml) y 20 μl de caspofungina (2,5 μg/ml). Almacenar la solución a 4 °C.
- Prepare el material de medios de diferenciación de enteroides: Mezcle 10 ml de medio de diferenciación de organoides más suplemento, 100 μl de penicilina (100 U/ml), estreptomicina (100 μg/ml), 5 μl de gentamicina (25 μg/ml) y 20 μl de caspofungina (2,5 μg/ml). Almacenar la solución a -20 °C.
- Prepare los medios de lavado: Mezcle 48,45 ml de medio DMEM/F-12 1,1 (con L-glutamina, sin HEPES), 1 ml de suplemento B-27 sin vitamina A (50 veces el caldo), 500 μl de penicilina (100 U/ml), estreptomicina (100 μg/ml), 25 μl de gentamicina (50 mg/ml de stock) y 25 μl de caspofungina (5 mg/ml de stock). Almacenar la solución a 4 °C.
- Preparar el tampón de recubrimiento: Mezclar 25 mL de DMEM: F12 medio completo sin inhibidores y 25 mg de albúmina sérica bovina (BSA). Almacenar la solución a 4 °C.
2. Aislamiento de las criptas intestinales del tejido entero (Figura 1)
NOTA: Los enteroides del intestino delgado bovino se generaron a partir de tejido ileal obtenido de novillos Holstein adultos sanos (>2 años de edad) de una planta local de procesamiento de carne de res. Se utilizó un donante para esta serie de experimentos.
- Preparación de muestras de tejido intestinal
- Coloque las muestras de tejido intestinal recolectadas de ~ 10 pulgadas (25 cm) en ~ 400 ml de tampón de recolección helado (PBS + antibióticos / antimicóticos) y en hielo para transportarlas al laboratorio.
- Con tijeras quirúrgicas (p. ej., tijeras de mayonesa) y fórceps (p. ej., pinzas de adson), elimine el exceso de grasa y mesenterio de la muestra de tejido intestinal.
- Corta el pañuelo en dos trozos iguales.
- Abra el tejido longitudinalmente con unas tijeras quirúrgicas y enjuague el tejido en PBS estéril.
- Retire suavemente la capa de moco de la muestra intestinal utilizando el costado de un portaobjetos de microscopio de vidrio estéril y enjuague el tejido con PBS fresco.
NOTA: Este paso ayuda a eliminar las vellosidades y ayuda a aumentar la pureza de las fracciones de la cripta en los pasos posteriores. - Por cada pieza de 13 cm (5 pulgadas), corta el tejido en dos de 6,5 cm (2,5 pulgadas) y luego corta cada pieza en 4 piezas pequeñas aproximadamente iguales para facilitar la disociación del tejido.
- Disociación del tejido intestinal
- Prepare un volumen de 20 mL del reactivo de disociación tisular #1 en un tubo cónico estéril de 50 mL y deposite las pequeñas muestras de tejido en el tubo cónico hasta que el desplazamiento de volumen mueva el menisco de la marca de 20 mL a la marca de 35 mL en el tubo cónico.
- Repita el paso anterior para las piezas restantes de la muestra de tejido del intestino delgado.
- Selle los tubos cónicos con parafilm y agite manualmente el tubo cónico 10 veces.
NOTA: A lo largo del protocolo, la agitación manual debe realizarse de manera deliberada pero suave. - Coloque los tubos cónicos horizontalmente sobre hielo en un recipiente sobre una plataforma de agitación orbital.
- Agite los tubos cónicos sobre hielo en el recipiente durante 30 minutos a 80 revoluciones por minuto (rpm). Cada 10 minutos, agite manualmente el tubo cónico.
- Prepare un volumen de 20 ml de reactivo de disociación tisular #2 precalentado (37 °C) (formulado como el anterior, pero sin TDT) en un tubo cónico de 50 ml. Deposite las muestras de tejido de los tubos cónicos que contienen el reactivo de disociación #1 en los tubos cónicos que contienen el reactivo de disociación #2.
- Selle los tubos cónicos con parafilm y agite manualmente los tubos cónicos 10 veces.
- Coloque los tubos cónicos en un baño de agua agitado precalentado (37 °C), inclinado en un ángulo de aproximadamente 60 °C, y agite a 150 rpm durante 10 minutos, agitando manualmente después de 5 minutos y nuevamente después de los 10 minutos totales de incubación.
- Aislamiento de fragmentos de cripta
- Etiquete 10 tubos cónicos estériles #1 - #10. Agregue 20 ml de PBS estéril helado a cada tubo cónico etiquetado.
- Transfiera los trozos de tejido de los tubos cónicos que contienen el reactivo de disociación #2 a un nuevo tubo cónico estéril de 50 ml que contenga PBS #1 helado.
- Agite manualmente los tubos cónicos 10 veces.
- Selle los tubos cónicos con parafilm y colóquelos horizontalmente sobre hielo. Agite los tubos cónicos en un agitador orbital durante 10 minutos a 80 rpm. Después de 10 minutos, agite manualmente el tubo cónico #1 10 veces. Esto se considera Lavado #1.
- Transfiera suavemente las muestras de tejido con un par de pinzas quirúrgicas al tubo cónico # 2.
- Repita los pasos 2.3.2 - 2.3.4, esto se considera Lavado # 2.
- Repita los lavados hasta el lavado # 10.
- Los sobrenadantes de cada lavado contienen las criptas que se utilizarán para la generación de enteroides. Mantenga los tubos que contienen los sobrenadantes a 4 °C hasta que se completen los 10 lavados.
- Una vez finalizado el10º lavado y desechada la sección de tejido, centrifugar los sobrenadantes de los tubos cónicos #6-#10 a 400 x g durante 2 min a 4 °C para granular las criptas aisladas.
NOTA: Los lavados 6-10 contienen las fracciones más limpias de criptas intactas con escombros limitados y células individuales. Como tal, se recomienda que solo se usen estas fracciones para la generación de enteroides, y que se descarten los lavados anteriores (#2-#5) - Deseche el sobrenadante y agregue 4 ml de PBS fresco y helado a las criptas sin volver a suspender (esto ayuda a mantener los fragmentos intactos hasta la microscopía).
- Evaluar la pureza de las criptas disociadas para cada tubo cónico #6-#10 mediante microscopía.
- Agregue 50 μL de PBS a una placa de 384 pocillos.
- Agregue 10 μL de suspensión de cripta al PBS y use una lente de objetivo de aumento de 40x para determinar la pureza, integridad y recuento de criptas.
NOTA: Dibujar una cruz en la parte inferior del plato facilita el conteo.
3. Generación y paso ex vivo de enteroides ileales bovinos (Figura 2)
NOTA: Las criptas de los tubos cónicos con las criptas intestinales más puras e intactas se utilizarán para ensayos posteriores. Para todos los pasos que involucran criptas y enteroides, las puntas de pipeta, los raspadores celulares y los tubos deben recubrirse previamente con el tampón de recubrimiento, y se deben evitar las burbujas para evitar la pérdida de criptas. A menos que se indique lo contrario, se debe utilizar una punta de pipeta de 1000 μL para evitar la ruptura de los fragmentos de la cripta.
- Generación de enteroides a partir de fragmentos de cripta
- Combine las fracciones de cripta más puras (generalmente # 6-# 10) en un tubo cónico.
- Centrifugar el tubo cónico que contiene las criptas a 400 x g durante 2 min a 4 °C.
- Deseche el sobrenadante aspirándolo con una pipeta y vuelva a suspender el gránulo de cripta en el medio de lavado.
- Centrífuga como en el paso 3.1.2. Decantar el sobrenadante y añadir 2 ml de Wash Media al gránulo de la cripta.
- Cuente el número de criptas como se describe en el paso 2.3.11.1.
- Centrifugar como en el paso 3.1.2 para granular las criptas, desechar el sobrenadante y volver a suspender en una matriz extracelular (BME) de membrana basal con factor de crecimiento reducido al 100% para lograr una concentración de aproximadamente 400 criptas/100 μL.
NOTA: es importante descongelar correctamente el BME a 4 °C, ya que los cambios de temperatura alteran su consistencia. Se puede evitar que el BME se solidifique prematuramente utilizando un bloque de enfriamiento y puntas de pipeta preenfriadas.- El uso de otra formulación de matriz de membrana basal puede requerir la dilución del BME al crear domos. Consulte las instrucciones del fabricante específicas para el BME que se está utilizando.
- Pipetea hacia arriba y hacia abajo para suspender completamente las criptas en el BME.
- Realice domos crypt-BME pipeteando lentamente 50 μL de suspensión crypt-BME en una placa de cultivo de tejidos de 6 pocillos en una placa de calentamiento ajustada a 37 °C con hasta 8 domos/pocillo.
NOTA: La placa de 6 pocillos debe precalentarse en una incubadora a 37 °C durante la noche antes de la siembra de los domos. - Mantenga la placa de 6 pocillos en la placa de calentamiento durante 1 minuto antes de mover con cuidado la placa a una incubadora de 37 °C y 5% deCO2 .
- Después de 2 minutos, voltee la placa de 6 pocillos para que la tapa quede hacia abajo e incube durante 30 minutos más para permitir que las cúpulas se polimericen.
- Después de 30 minutos, agregue con cuidado 3 ml de medio de crecimiento enteroide a temperatura ambiente (RT) suplementado con 10 μM de SB202190, 0,5 μM de LY2157299 y 10 μM de Y-27632 a los pocillos que contienen domos.
- Incubar a 37 °C, 5% CO2.
- Retire el medio y reemplácelo con un medio de crecimiento enteroide fresco suplementado con inhibidores cada 2-3 días.
- Pasaje de enteroides
- Después de 7-10 días, asegúrese de que las criptas hayan formado enteroides 3D con muchas estructuras en ciernes, como en la Figura 2E, y estén listas para ser transitadas.
- Deseche los medios de los pozos que contienen domos.
- Por cada 4 domos por pocillo, agregue 1 ml de solución helada de disociación celular no enzimática suplementada con 10 μM Y-27632 a cada pocillo que contenga domos.
- Con un raspador celular prerrecubierto, separe suavemente la cúpula de la placa de cultivo de tejidos.
- Recoja los enteroides en un tubo cónico de 15 ml y triture pipeteando hacia arriba y hacia abajo 10 veces.
- Incubar el tubo cónico que contiene los enteroides fragmentados a RT en un agitador orbital a 80 rpm durante 10 min.
- Agregue 10 ml de medios de lavado helados con 10 μM Y -27632 a los enteroides.
- Centrifugar el tubo cónico a 300 x g durante 5 min a RT.
- Deseche el sobrenadante y vuelva a suspender el gránulo en 10 ml de medios de lavado nuevos y transfiéralo a un nuevo tubo cónico de 15 ml.
- Centrifugar el tubo cónico a 300 x g durante 5 min a RT.
- Deseche el sobrenadante y vuelva a suspender el gránulo en 1 ml de medio de crecimiento enteroide en un tubo de microcentrífuga de 1,5 ml.
- Centrifugar el tubo de microcentrífuga a 300 x g durante 5 min a RT y desechar el sobrenadante.
- Vuelva a suspender el gránulo enteroide en BME 100% frío como hielo y siga los pasos 3.1.6-3.1.13.
- Volver a pasar enteroides cada 7 días. Los tiempos de expansión pueden variar debido a la densidad, viabilidad y extensión de la brotación. Múltiples estructuras en ciernes que crean grandes estructuras enteroides son indicativas de que los enteroides necesitan ser pasados.
- Criopreservación de enteroides
- Para la criopreservación, asegúrese de que los enteroides no pasen más de cinco veces en cultivo.
NOTA: Esto no ha sido probado experimentalmente y se basa en la observación de los autores de que los pasajes posteriores han reducido la viabilidad y producen resultados variables. - Para recolectar los enteroides, utilice el tampón de disociación como se describe en los pasos 3.2.2-3.2.9.
NOTA: Disocie mecánicamente los enteroides con una pipeta de 5 ml. - Cuente el número de fragmentos enteroides como se describe en el paso 2.3.11.1.
- Centrifugar el tubo cónico a 300 x g durante 5 min a RT.
- Deseche el sobrenadante y vuelva a suspender los fragmentos de enteroides en medios de criopreservación suplementados con 10 μM Y-27632 para lograr una concentración de ~2000 fragmentos de enteroides/mL y una alícuota de 1 mL en crioviales premarcados.
- Coloque los crioviales en un recipiente de congelación controlada y guárdelos a -80 °C durante la noche.
- Transfiera los crioviales a nitrógeno líquido en fase de vapor para su almacenamiento a largo plazo.
- Para la criopreservación, asegúrese de que los enteroides no pasen más de cinco veces en cultivo.
- Reanimación de fragmentos de criptas intestinales
- Coloque una placa de 6 pocillos durante la noche dentro de la incubadora.
- Revise previamente un tubo de 5 ml con 5 ml de medio de recubrimiento.
- Retire los crioviales del almacenamiento de nitrógeno líquido.
- Inmediatamente, una vez descongelados, transfiera las criptas del criovial al tubo de 5 ml prerrevestido. Enjuague el criovial con medios de lavado y agréguelo al tubo de 5 ml. Evite las burbujas.
- Lleve el volumen hasta 5 ml con medios de lavado y centrifugue a 400 x g durante 5 min a 4 °C.
- Durante la centrifugación, recubra previamente un tubo de 1,5 ml con medios de recubrimiento.
- Después de la centrifugación, vierta el sobrenadante, vuelva a suspender el gránulo en el medio que queda en el tubo y transfiéralo al tubo de 1,5 ml prerrevestido. Lave el tubo de 5 ml con medios de lavado y transfiéralo a un tubo de 1,5 ml. Centrifugar a 400 x g durante 5 min a 4 °C.
- Aumente el volumen a 1,5 ml con los medios de crecimiento enteroides.
- Centrifugar como se indicó anteriormente (paso 3.4.7) y aspirar con cuidado.
- Tomar BME a partir de 4 °C y colocar sobre hielo/bloque de hielo.
- Vuelva a suspender el gránulo enteroide en BME 100% helado y siga los pasos 3.1.6- 3.1.12.
- Cambie los medios cada 2-3 días.
4. Generación y evaluación de monocapas 2D a partir de enteroides 3D
NOTA: Al igual que en el caso anterior, para todos los pasos que impliquen criptas y enteroides, las puntas de pipeta, los raspadores celulares y los tubos deben recubrirse previamente con el tampón de recubrimiento, y deben evitarse las burbujas para evitar la pérdida de criptas.
- Preparación de insertos transwell para la formación de monocapas 2D
- Coloque los insertos en una placa adaptadora de cultivo de tejidos de 24 pocillos y recubra previamente el lado apical de los insertos de cultivo celular PET de 1 μm de 24 pocillos con 100 μL de dilución 1:15 de BME en medios de crecimiento enteroides. Cubra siempre un inserto adicional que se utilizará como control al tomar medidas de integridad de la barrera.
- Coloque el inserto recubierto en una placa adaptadora de cultivo de tejidos de 24 pocillos en la incubadora.
NOTA: Se debe utilizar un adaptador específico o una placa de cultivo de tejidos complementaria con los insertos transwell. - Incubar los insertos de cultivo a 37 °C, 5% CO2 durante 1 h para permitir la polimerización.
NOTA: Los transpocillos recubiertos de BME pueden sellarse con parafilm y almacenarse a 4 °C durante un máximo de 1 semana si no se utilizan inmediatamente. - Al final de la incubación, aspire el medio de cultivo enteroide 3D.
- Disociación de enteroides 3D
- Genere monocapas de enteroides 2D a partir de fragmentos de enteroides criopreservados que fueron resucitados, plateados y cultivados como se describe anteriormente en la sección 3.1 para formar enteroides 3D. Pasar los enteroides descongelados al menos dos veces, con el último paso cultivado durante un mínimo de 5 días antes del procesamiento para generar cultivos monocapa 2D.
- Coseche los enteroides agregando medios de lavado helados suplementados con 10 μM Y-27632 a los domos de enteroides (use aproximadamente 1 ml de tampón de disociación para 4 domos)
- Separe los domos con un raspador de células y recójalos en un tubo cónico de 15 ml.
- Triturar 30 veces con una punta de pipeta de 1 ml para generar fragmentos enteroides.
- Triturar 40 veces con una punta de pipeta de 200 μL para romper aún más los fragmentos enteroides.
- Lleve el volumen del tubo cónico de 15 ml con fragmentos enteroides a 10 ml con medios de lavado helados.
- Centrifugar el tubo cónico a 300 x g durante 5 min a RT.
- Aspirar el sobrenadante, incluida la capa de BME, teniendo cuidado de no alterar el gránulo enteroide.
NOTA: La capa BME aparecerá como una capa gelatinosa turbia justo encima del gránulo. - Por cada 4 domos, resuspender el gránulo en 1 mL de enzima TrypLE express precalentada suplementada con 10 μM de Y-27632.
- Añadir la mezcla de enteroide y triplito a una placa de 24 pocillos e incubar a 37 °C, 5% de CO2 durante 10 min.
- Después de 10 minutos, pipetear la mezcla de enteroide y triplito 40 veces con una pipeta de 1 ml para fragmentar aún más los enteroides.
- A continuación, pipetea los fragmentos 40 veces con una pipeta de 200 μL para romper los fragmentos en células individuales.
- Usando una jeringa de 3 ml o 5 ml con una aguja estéril de 22 g conectada, aspire y dispense la suspensión celular 4 veces para lograr la suspensión de una sola célula.
- Monitorizar la disociación celular mediante microscopía como se describe en el paso 2.3.11.1, hasta que el 80% de los enteroides se descompongan en células individuales.
- Recoja la suspensión celular en un tubo cónico de 15 ml y apague la reacción enzimática agregando 4 veces el volumen de medios de lavado suplementados con FBS al 10%.
- Filtre los enteroides a través de un filtro de células de 40 μm prerrecubierto dos veces en un tubo cónico de 50 ml.
- Granular las células individuales centrifugando el tubo cónico a 300 x g durante 5 min.
- Siembra monocapa 2D en insertos transwell.
- Decantar el sobrenadante y resuspender el gránulo en un pequeño volumen (~600 μL) de medio de crecimiento organoide suplementado con un 20% de suero fetal bovino (FBS) a RT.
- Determine la densidad y la viabilidad de las células enteroides utilizando el método de exclusión de colorante azul de tripano, el hemacitómetro o el contador celular automatizado. Se espera una viabilidad media del 75%.
- Retire con cuidado el exceso de solución de recubrimiento aplicado en el paso 1.3 del inserto de cultivo celular justo antes de sembrar las células.
- Siembre las células individuales en 1 x 105 células en un volumen de 200 μL por inserto en la superficie apical de un inserto de cultivo celular prerrecubierto.
- Añadir 700 μL de medio completo suplementado con FBS al 20% en el lado basolateral del inserto de cultivo celular.
- Maniobre la placa 10 veces en forma de número 8 para permitir que las celdas se extiendan uniformemente sobre el inserto.
- Mantenga la placa en el calentador de platos durante 10 minutos en el gabinete de bioseguridad.
- Incubar la placa a 37 °C y 5% de CO2.
- Después de 48 h, reemplace los medios en los compartimentos apical y basal con medios de crecimiento enteroide frescos suplementados con FBS al 20% e inhibidores.
- Al tercer día, retire el medio de los compartimentos apical y basolateral, lave cuidadosamente el inserto con 1x PBS y reemplácelo con un medio de diferenciación enteroide complementado solo con inhibidores.
- Cambie los medios en ambos compartimentos cada 2-3 días.
- Medición cuantitativa de la integridad de la barrera epitelial y la confluencia de la monocapa
NOTA: La integridad de la barrera se puede evaluar mediante el uso de un voltohmímetro epitelial para medir la resistencia eléctrica transepitelial (TEER).- Retire la placa de cultivo transwell de la incubadora y deje que se equilibre a RT durante unos minutos en la cabina de bioseguridad.
- Asegúrese de que los electrodos STX2 hayan sido preacondicionados y calibrados con el voltohmetro a 1000 Ω según las instrucciones del fabricante.
- Inserte el palo largo de la sonda en el compartimiento basolateral y el extremo corto en el compartimiento apical del cultivo de células epiteliales transpocillo. Tenga cuidado de no romper la monocapa ni dañar el inserto.
- Una vez estable, registre 3 mediciones de TEER por inserto transpocillo, incluido el inserto sin células. Tome un promedio de las medidas de cada inserto.
- Calcule el valor de TEER corregido restando la medida promedio del pozo en blanco de las mediciones promedio de los pozos experimentales y luego multiplicándolo por el área de superficie del inserto para determinar la resistencia de la barrera epitelial (TEER [Ω.cm2] = [Rcell layer - Rblank] × Area).
Resultados Representativos
El primer paso para generar monocapas derivadas de enteroides 2D es preparar la sección de tejido intestinal extraída (Figura 1A) para la disociación del tejido. Esto se hace eliminando la grasa adherida y el mesenterio del tejido (Figura 1B), seguido de un corte longitudinal del tejido para exponer la superficie del lumen de modo que la capa de moco del intestino pueda eliminarse raspando suavemente con un portaobjetos de vidrio. A continuación, la sección intestinal extraída se corta en secciones de tejido progresivamente más pequeñas (Figura 1C) para aumentar la facilidad de disociación. A continuación, las criptas se disocian del tejido submucoso subyacente mediante una serie de lavados que consisten en tampones de quelación (Figura 1D, E) y PBS. Las criptas intestinales aisladas (Figura 1F) se incrustan en cúpulas de matriz de membrana basal (Figura 2A) y se cultivan durante varios días para generar enteroides 3D. A partir de una sección de 10 pulgadas de íleon bovino, se pueden aislar aproximadamente 900.000 criptas y utilizarlas para la formación de enteroides. Después de unas pocas horas de cultivo, las criptas plateadas comienzan a alargarse y a convertirse en enterosferas (Figura 2B). Después de 2 días, se puede observar una luz bien definida (Figura 2C), con estructuras en gemación observadas ya en el día 4 en cultivo (Figura 2D). Para el día 7, los enteroides maduros se han desarrollado (Figura 2E). La tinción de inmunofluorescencia de enteroide 3D de 7 días de edad demuestra la presencia de diferentes linajes celulares. La microscopía confocal de enteroides demuestra la localización de la tinción nuclear DAPI, la proteína E-cadherina en la unión adherente, la tinción de cromogranina-A (Chr-A) que muestra la presencia de células enteroendocrinas, la lisozima (LYZ) que muestra células de Paneth y la citoqueratina-18 (CK-18) que representa las células de enterocitos en la Figura 3. Después de 7-10 días en cultivo, los enteroides deben pasar para permitir una mayor expansión y evitar el hacinamiento. Se determinó que el tiempo óptimo para el paso de los enteroides es de 7 a 10 días después del aislamiento inicial de la cripta primaria y, en última instancia, depende de la salud y la tasa de crecimiento de los enteroides en cultivo. La densidad óptima de siembra para lograr la morfología y viabilidad del enteroide deseada, como se muestra en la Figura 2E, es de 400 criptas por domo. Los enteroides pueden crioconservarse fácilmente, y los fragmentos de enteroides descongelados se recuperan completamente para su uso experimental después de dos pasadas después de la descongelación. En particular, se recomiendan al menos dos pasajes del cultivo primario de la cripta antes de la criopreservación.
Con el fin de producir una monocapa derivada de enteroides 2D, los enteroides 3D se cosechan y, en una serie de pasos, se trituran mecánicamente en presencia de una solución de disociación (Figura 4A) en células individuales. A continuación, estas células individuales se pueden sembrar en un inserto transpocillo que ha sido recubierto previamente con una solución de medio de cultivo de matriz de membrana basal. En promedio, se pueden sembrar cuatro transpozos a partir de cuatro domos enteroides 3D. Por lo tanto, el número de enteroides 3D procesados depende del número de transpocillos necesarios para el experimento. La siembra de células individuales a una densidad de siembra de 1 x 105 y el cultivo inicial en presencia de 20% de FBS (Figura 4B-D) puede generar una monocapa confluente en menos de 1 semana. La confluencia progresiva de la monocapa 2D en cultivo se puede monitorizar a lo largo del tiempo mediante microscopía óptica (Figura 4E,F). Las mediciones de la resistencia eléctrica transepitelial (TEER) pueden confirmar la confluencia y caracterizar la integridad de la barrera epitelial a lo largo del tiempo y en respuesta a la estimulación experimental (Figura 5A). En promedio, después de siete días en cultivo, una monocapa aproximadamente 100% confluente tendrá un valor de TEER correspondiente de ~1500 Ω·cm2. Una evaluación longitudinal de los valores de TEER de monocapa enteroide 2D demuestra un aumento constante de los valores de TEER durante siete días, alcanzando un valor medio máximo de 1546 Ω·cm2 antes de disminuir con el valor más bajo de 11,5 Ω·cm2 obtenido en el duodécimo día (Figura 5B). El marcaje inmunofluorescente de monocapas diferenciadas indica que mediante este protocolo se forman láminas epiteliales intestinales intactas, organizadas y polarizadas (Figura 6). La microscopía confocal de la monocapa 2D teñida demuestra la localización de la tinción nuclear DAPI, la E-cadherina y la tinción con actina F (Figura 6A-D). La microscopía de fluorescencia de la monocapa 2D muestra características de células epiteliales intestinales diferenciadas con tinción de cromogranina-A (Chr-A) que muestra la presencia de células enteroendocrinas, lisozima (LYZ) que muestra células de Paneth y citoqueratina-18 (CK-18) que indica linajes celulares de enterocitos (Figura 6E-L). El modelado de la pila Z muestra la polarización esperada del cultivo de monocapa 2D con depósito característico de F-actina que se encuentra en las microvellosidades que cubren el aspecto apical de los enterocitos diferenciados y E-cadherina, una proteína ubicada en las uniones adherentes interespaciadas entre las células epiteliales (Figura 6M).
La funcionalidad de la monocapa puede evaluarse mediante estimulación apical con varios componentes, incluidos ligandos o patógenos del receptor tipo Toll (TLR), seguida de la cuantificación de citoquinas de sobrenadantes de cultivos celulares recolectados de los compartimentos apical y basal. De hecho, cuando se estimula el aspecto apical de la monocapa durante 24 h con el agonista de TLR 1/2 Pam3csk4 en el día 4 de cultivo, se observa un aumento de la producción de citoquinas en ambos compartimentos en comparación con las monocapas no tratadas (Figura 7A,B).
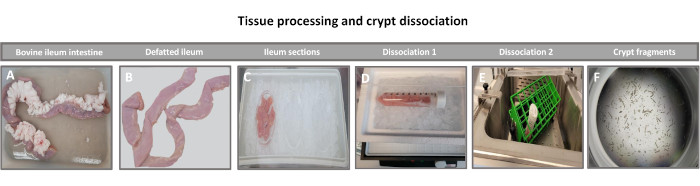
Figura 1: Aislamiento de criptas intestinales bovinas de bovinos adultos sanos. Imágenes que ilustran el procesamiento tisular de (A) íleon de ganado adulto entero, (B) íleon desgrasado, (C) íleon seccionado en trozos de 2,5 pulgadas (6,3 cm) en PBS sobre hielo, (D) secciones de tejido ileal en tampón de disociación #1 a 4 °C, y (E) en tampón de disociación 2 en un baño de agua agitado a 37 °C, y (F) fragmentos aislados de criptas ileales. Haga clic aquí para ver una versión más grande de esta figura.
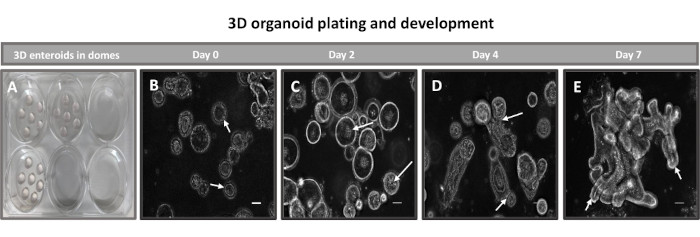
Figura 2: Desarrollo del enteroide ileal primario 3D bovino en la matriz de la membrana basal. Imágenes representativas de (A) domos enteroides, 3D creados en una placa de cultivo de tejidos de 6 pocillos y desarrollo de enteroides, 3D (B-E) de los días 0, 2, 4 y 7 en cultivo. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
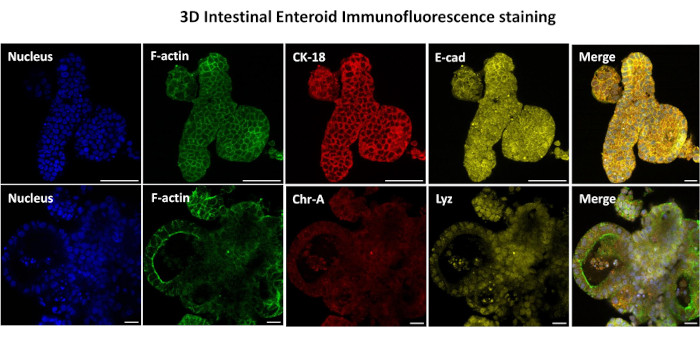
Figura 3: Los enteroides intestinales tridimensionales muestran la tinción del linaje de las células epiteliales. Las imágenes representativas de enteroides 3D después de 7 días en cultivo demuestran la presencia de tinción nuclear, F-actina, citoqueratina-18 (CK-18), cromogranina-A (Chr-A), ecadherina (E-cad), lisozima (Lyz) y superposición de imágenes (Merge). Barra de escala 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
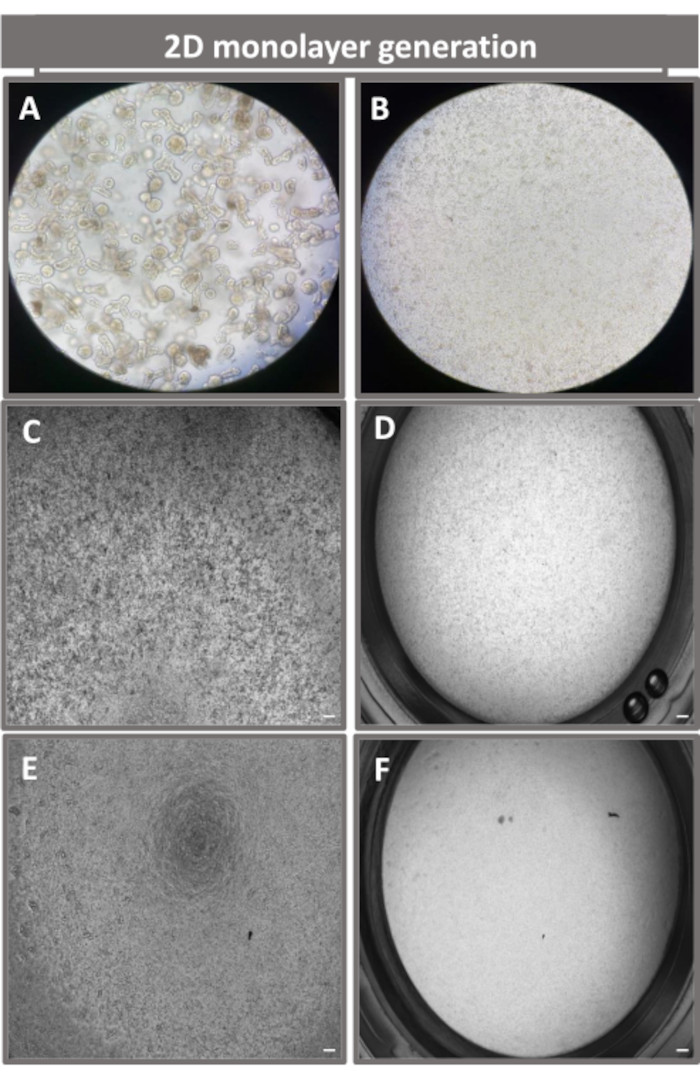
Figura 4: Establecimiento de una monocapa derivada de enteroides 2D a partir de enteroides ileales. Imágenes representativas de (A) fragmentos enteroides 3D en solución de disociación en preparación para la siembra monocapa, células individuales sembradas en un inserto transpocillo a una densidad de siembra de 1 x 105 fotografiadas en el día 0 utilizando (B) luz, (C) contraste de fase y (D) microscopía de campo claro, y revelado de monocapa en insertos transpocillos fotografiados en el quinto día utilizando (E) contraste de fase y (F) microscopía de campo claro. Aumento de 40x y barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
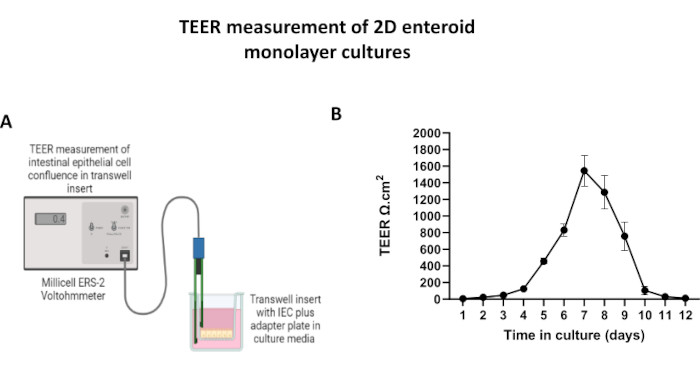
Figura 5: Mediciones de resistencia eléctrica transepitelial (TEER) de la monocapa derivada de enteroides 2D en insertos transwell. (A) Diagrama esquemático de cómo se obtienen las mediciones de TEER de la monocapa de células epiteliales intestinales (IEC) 2D utilizando los electrodos de palillo STX2 de un voltohmetro, (B) Monitoreo longitudinal de mediciones de TEER monocapa 2D durante 12 días en cultivo celular. Cada punto de datos representa un valor medio de TEER y un error estándar de la media (SEM) obtenidos a partir de dos réplicas técnicas. Haga clic aquí para ver una versión más grande de esta figura.
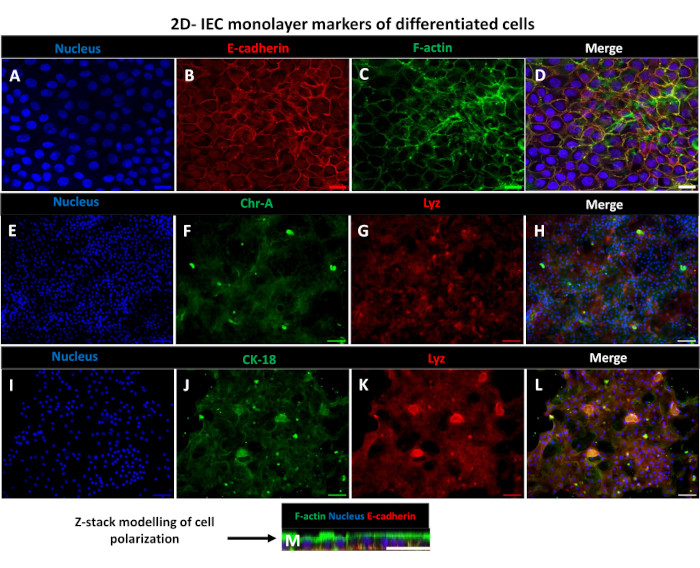
Figura 6: Las monocapas diferenciadas derivadas de enteroides, 2D, en insertos transpocillos, se convierten en láminas epiteliales intestinales polarizadas. (A-M) Imágenes inmunofluorescentes representativas de una monocapa derivada de enteroide 2D en un inserto transpocillo después de 5 días en cultivo que muestran el núcleo (A) (azul), (B) E-cadherina (rojo), (C) F-actina (verde) y (D) superposición de las 3 imágenes (fusión), (E,I) tinción nuclear, (F) cromogranina-A, (J) citoqueratina-18, (G,K) lisozima y (H,L) fusión de imágenes. (M) Modelado de pila Z que muestra la distribución de las mismas proteínas marcadoras de células epiteliales de la lámina monocapa 2D. Las imágenes se obtuvieron a partir de 2 réplicas biológicas. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
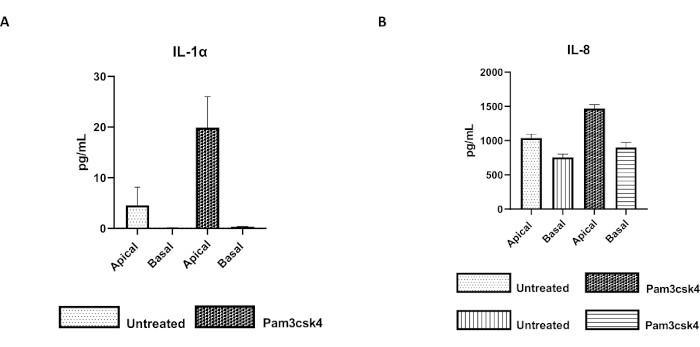
Figura 7: Las monocapas derivadas de enteroides 2D primarios bovinos en insertos transpocillos son funcionalmente activas. Secreción de citoquinas sobrenadantes en cultivos de células apicales y basales de (A) IL-1α y (B) IL-8 mediante monocapas 2D en insertos transpocillos después de 5 días en cultivo que no fueron tratados o estimulados con Pam3csk4 durante 24 h. Los datos son representativos de los niveles medios de citoquinas y SEM de monocapas derivadas de existencias congeladas de criptas de un animal y tres experimentos independientes. Las citocinas se cuantificaron mediante el ensayo multiplex basado en perlas (Tabla de Materiales) de acuerdo con las instrucciones del fabricante y se analizaron en una unidad de multiplexación compacta (Tabla de Materiales) y un software de ajuste de curva de inmunoensayo (Tabla de Materiales). Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Stock y concentraciones finales de los reactivos. Haga clic aquí para descargar la tabla.
Discusión
El protocolo que aquí se presenta describe un modelo fisiológicamente relevante para investigar la fisiología intestinal y los trastornos entéricos. Varios grupos de investigación han descrito la generación de cultivos enteroides, incluyendo monocapas 2D 16,19,20,21,22,23,24. Si bien la generación de monocapas no es un desafío técnico abierto, los pasos de varios minutos son fundamentales para desarrollar cultivos exitosos de manera consistente. Como tal, la reproducibilidad de las monocapas 2D utilizando los métodos brevemente descritos en la literatura publicada puede ser un desafío para un investigador novato en el campo de los organoides. El protocolo descrito en este documento es una adaptación de estos protocolos y de los publicados en otras especies, proporcionando una guía paso a paso para la generación de monocapas en insertos transwell que es altamente reproducible.
El protocolo descrito en este documento puede modificarse fácilmente para adaptarse a los objetivos específicos del diseño experimental o a la disponibilidad de reactivos. De hecho, siguiendo este protocolo, se pueden lograr cultivos exitosos mediante la siembra de monocapas a una densidad celular más baja (por ejemplo, 2,5 x 104) o en ausencia de FBS, como se describe en otras publicaciones24. Sin embargo, la alteración de estos parámetros puede requerir un aumento del cultivo para establecer una monocapa confluente. Por lo tanto, si otros factores integrales para el diseño del estudio, incluido el cocultivo con células inmunitarias, dictan un curso de tiempo específico para el experimento, la densidad de siembra puede modificarse según sea necesario. Si bien se pueden sustituir otras formulaciones de membrana basal en lugar de la utilizada en este protocolo para generar enteroides 3D y monocapas 2D, estas requerirán cierta optimización para determinar la relación óptima entre membrana basal y medio.
La aplicación de insertos transwell en la metodología descrita tiene muchos beneficios sobre el crecimiento monocapa en material plástico convencional y cultivos enteroides. En comparación con las placas de cultivo de tejidos estándar, el uso de pocillos trans para cultivos monocapa promueve la diferenciación y organización celular de una manera que conserva la semejanza con las criptas intestinales14,25. La barrera epitelial intestinal es vital para prevenir la translocación de toxinas y microorganismos en el cuerpo y, al mismo tiempo, facilitar la absorción de nutrientes. Como tal, es fundamental comprender cómo funciona la integridad de la barrera del intestino en un intestino sano y se altera durante los trastornos intestinales o en respuesta a los compuestos. A diferencia de los cultivos enteroides en 3D, la evaluación objetiva de la integridad de la barrera intestinal es posible cuando se combinan monocapas en pocillos trans y se mide TEER, como se demuestra en este trabajo14,25. La generación de monocapas 2D en transpocillos también permite el cultivo dual con tipos celulares pertinentes, como células inmunitarias o estromales. Esto permite caracterizar la diafonía de importancia crítica entre las células intestinales y las células del microambiente tisular, lo que no se puede lograr con cultivos 3D. La exposición de la superficie apical de la monocapa no solo permite la exposición experimental a patógenos y compuestos y la recolección de productos luminales, sino que también permite realizar estudios sobre otros aspectos de la fisiología y la enfermedad intestinales, incluida la investigación de la microbiota intestinal y la fisiología de la absorción molecular o del transporte13. El control independiente sobre las superficies intestinales apical y basal es una clara ventaja sobre los modelos enteroides.
A través de varios experimentos de prueba, identificamos los pasos clave que contribuyeron al éxito del protocolo. Si bien las muestras de tejido intestinal completo pueden refrigerarse durante la noche y procesarse al día siguiente, los pasos de disociación del tejido y aislamiento de los fragmentos de cripta deben realizarse rápidamente para evitar la desintegración de las fracciones de cripta aisladas. Después de completar los lavados de PBS, centrifugar las criptas en medios de lavado puede ayudar a evitar la ruptura de las criptas, como se detalla en el paso 2.3.10. Al pasar los enteroides o recolectarlos para la formación de monocapas, es esencial separar los enteroides de los domos BME. Los medios de lavado deben estar helados para ayudar a disolver el BME. Por el contrario, el uso de TrypLE precalentado y el filtrado de la suspensión celular dos veces puede ayudar a formar las células individuales necesarias para la generación de monocapas. Finalmente, maniobrar manualmente la placa en la forma del número 8 puede ayudar a dispersar uniformemente las celdas individuales sobre el inserto transwell.
Una limitación importante de este protocolo es que las monocapas 2D se produjeron a partir de cepas enteroides generadas a partir de un novillo Holstein maduro (>2 años de edad). La maduración del tracto gastrointestinal en los terneros puede requerir modificaciones menores en el protocolo descrito para obtener resultados óptimos. En la literatura se han descrito diferencias específicas de la raza en la fisiología intestinal de las razas bovinas26. Si bien se desconoce si estas diferencias podrían afectar a la generación de enteroides, sospechamos que cualquier diferencia daría lugar a cambios menores en nuestro protocolo. Además, el modelo de cultura 2D tiene algunas desventajas inherentes. En comparación con los modelos enteroides, los cultivos 2D pueden carecer de algunos aspectos de la arquitectura del tejido intestinal y la diversidad celular y crear restricciones y desafíos asociados con la propagación del cultivo 2D13. Aún así, los estudios demuestran que algunas monocapas pueden emular la organización esperada de la cripta27, y algunas de estas limitaciones pueden incluso superarse mediante el establecimiento de cultivos 2D con una interfaz aire-líquido. Sin embargo, las limitaciones de este modelo deben ser consideradas en su totalidad para determinar si su aplicación es adecuada para la pregunta experimental que se plantea.
Este protocolo describe un sistema de cultivo optimizado que modela el tracto gastrointestinal bovino utilizando enteroides derivados del íleon bovino para formar monocapas en insertos transwell. Con una amplia gama de aplicaciones, desde la investigación de enfermedades infecciosas hasta el descubrimiento de fármacos y la medicina regenerativa, este sistema de cultivo de alto rendimiento podría conducir al desarrollo sin precedentes de estrategias preventivas y terapéuticas que podrían ser mutuamente beneficiosas para la salud animal y humana.
Divulgaciones
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Reconocemos el uso de la Instalación Central Celular y Molecular de la Universidad Midwestern.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
Referencias
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972 (2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73 (2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225 (2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43 (2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54 (2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115 (2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42 (2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114 (2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados