Cristalización y recopilación de datos a temperatura ambiente in situ utilizando la instalación de cristalización en Harwell y Beamline VMXi, fuente de luz de diamante
En este artículo
Resumen
Presentamos un protocolo para la cristalización de proteínas utilizando la instalación de cristalización en el Complejo de Investigación en Harwell y la posterior recopilación de datos cristalográficos de rayos X in situ de cristales dentro de las placas en la línea de luz de Cristalografía Macromolecular Versátil in situ (VMXi) de Diamond. Describimos los requisitos de la muestra, los protocolos de cristalización y las pautas de recopilación de datos.
Resumen
Se describen los protocolos para la cristalización robótica de proteínas utilizando la Instalación de Cristalización en Harwell y la recopilación de datos a temperatura ambiente in situ de las placas de cristalización en la línea de luz VMXi de la fuente de luz de diamante. Este enfoque permite determinar estructuras cristalinas a temperatura ambiente de alta calidad a partir de múltiples cristales de una manera sencilla y proporciona una retroalimentación muy rápida sobre los resultados de los ensayos de cristalización, además de permitir la cristalografía en serie. El valor de las estructuras a temperatura ambiente para comprender la estructura de las proteínas, la unión de ligandos y la dinámica es cada vez más reconocido en la comunidad de biología estructural. Esta canalización es accesible para usuarios de todo el mundo con varios modos de acceso disponibles. Los experimentos de cristalización que se configuran se pueden visualizar y ver de forma remota con cristales identificados automáticamente mediante una herramienta de aprendizaje automático. Los datos se miden en un sistema basado en colas con conjuntos de datos de rotación de hasta 60° a partir de cristales seleccionados por el usuario en una placa. Los datos de todos los cristales dentro de un pozo o grupo de muestras en particular se fusionan automáticamente usando xia2.multiplex y se accede directamente a las salidas a través de una interfaz de navegador web.
Introducción
La cristalografía de rayos X sigue siendo una herramienta clave para comprender la estructura y función de las proteínas, ya que proporciona estructuras de alta resolución de proteínas o sus complejos con, por ejemplo, sustratos o candidatos a fármacos. En muchos casos, sin embargo, la obtención de cristales con propiedades deseables (muy difractables, cristalinos aptos para el remojo y sin patologías cristalinas como la maclificación) sigue siendo un cuello de botella considerable1. Dado que, en general, no se pueden predecir las condiciones químicas adecuadas para producir cristales de proteína, el cribado de cristalización que explora miles de posibles mezclas químicas es estándar, a menudo con la ayuda de la automatización/robótica en la configuración de pantallas y hoteles de cristal para monitorear, a menudo de forma remota, las imágenes de gota de cristalización que se registran.
Cuando aparecen los cristales, normalmente deben extraerse del entorno de cristalización utilizando un bucle de nailon o Kapton y luego, transferirse a una gota que contenga un agente de crioprotección (cuya búsqueda es una variable adicional) antes de sumergirse en nitrógeno líquido. Estos pasos adicionales entre la cristalización y la recopilación de datos de rayos X pueden implicar la deshidratación de la gota de cristalización cuando se rompe su entorno sellado, tensiones mecánicas en el cristal cuando se manipula y daños causados por los agentes de crioprotección a la red cristalina (lo que suele provocar un aumento de la propagación del mosaico), entre otros factores2. Además, la recolección de cristales requiere mucho tiempo y mano de obra y puede conducir a una falta de homogeneidad entre las muestras, especialmente cuando se forma piel en gotas durante el proceso de recolección. La línea de luz VMXi da acceso a datos utilizables de cristales que están pegados a la placa, que de otro modo se descartarían para la recopilación de datos.
La gran mayoría de las estructuras cristalinas de rayos X se determinan a 100K utilizando el enfoque anterior, lo que permite un transporte y manejo sencillos de los cristales y aumenta la vida útil del cristal en el haz de rayos X en órdenes de magnitud. Sin embargo, existe un creciente interés en la determinación de estructuras en condiciones no criogénicas, es decir, mucho más cercanas a las condiciones fisiológicas relevantes para la función de las proteínas 2,3,4. Esto permite una apreciación mucho mejor de la estructura dinámica de las proteínas, evita que las conformaciones o bucles de aminoácidos se congelen en estados funcionalmente no relevantes5, y permite explorar la unión de ligandos en condiciones mucho más cercanas a las del entorno natural de la proteína dentro de la célula y el organismo6.
Un enfoque alternativo, implementado en la línea de luz de Cristalografía Macromolecular Versátil in situ (VMXi) en el sincrotrón Diamond Light Source, Reino Unido, consiste en medir los datos de difracción directamente de los cristales dentro del entorno en el que han crecido (es decir, dentro de la placa de cristalización), en condiciones ambientales y sin perturbaciones 7,8. Esto permite una retroalimentación muy rápida de las pantallas de cristalización y optimizaciones para guiar al usuario hacia una forma cristalina óptima para sus requisitos. También permite producir estructuras a temperatura ambiente de alta calidad de forma automatizada9.
Este protocolo asume que un usuario tiene una muestra de proteína de alta pureza lista para la cristalización. Describimos la experiencia del usuario al acceder a la Instalación de Cristalización en Harwell para producir cristales de proteínas y luego usar la línea de luz VMXi para la recopilación de datos (Figura 1).
La instalación de cristalización en Harwell
La Instalación de Cristalización en Harwell (CF) está ubicada en el Complejo de Investigación en Harwell (RCaH) adyacente a la Fuente de Luz de Diamante. La instalación ofrece a los usuarios un laboratorio automatizado de alto rendimiento para la cristalización macromolecular, utilizando robótica para el cribado de cristalización, la optimización de cristales, la obtención de imágenes de cristales y la caracterización. A través de la estrecha integración con la línea de luz VMXi altamente automatizada, el ritmo de determinación de las estructuras a temperatura ambiente se ha acelerado enormemente y permite la caracterización de nuevas estructuras proteicas, complejos proteína-ligando y ADN-ligando, así como el cribado automatizado de fragmentos (Figura 1), todo ello en condiciones no criogénicas.
La tubería CF es un conjunto de instrumentación que abarca robots de cristalización de nanolitros9 para la cristalización de proteínas solubles y de membrana, robots de manipulación de líquidos para preparar cribas de cristalización comerciales y cribas de optimización personalizadas complejas, y cuatro instrumentos de obtención de imágenes (uno a 4 °C y tres a 20 °C para la obtención de imágenes de placas de cristalización (véase la Tabla de Materiales). Un generador de imágenes es capaz de obtener imágenes de placas de vidrio de fase cúbica lipídica (LCP) y un generador de imágenes está equipado con óptica de multifluorescencia (ambas a 20 °C).
En la actualidad, la instalación es ampliamente utilizada por un amplio espectro de usuarios académicos e industriales, incluido el Laboratorio de Proteínas de Membrana (MPL; https://www.diamond.ac.uk/Instruments/Mx/MPL.html), la instalación de cribado de fragmentos XChem 10, las líneas de luz MX, el concentrador XFEL, así como el Instituto Rosalind Franklin (RFI). Esta línea bien establecida y optimizada ha permitido realizar experimentos de cristalización en un amplio espectro de proyectos de biología estructural. En este artículo se describe la canalización de cristales destinados a la recopilación de datos en VMXi, aunque los cristales también pueden recolectarse y enfriarse criogénicamente o dirigirse a la tubería XChem.
El acceso de los usuarios se asigna a través del sistema de propuestas Diamond MX (https://www.diamond.ac.uk/Instruments/Mx/Synchrotron-Access.html) y los usuarios industriales reciben apoyo a través del grupo de enlace de la industria del diamante. Todos los usuarios pueden acudir al lugar con su(s) muestra(s) o placas, que pueden ser transportadas a mano. No se recomienda enviar las placas por mensajería, ya que nuestra experiencia sugiere que las gotas pueden alejarse del lugar en el que se dispensaron, o las gotas pueden dañarse por el depósito de cristalización. Alternativamente, por acuerdo, los usuarios pueden enviar sus muestras de proteínas al CF, donde los miembros del personal establecen experimentos de cristalización en su nombre. Los experimentos pueden ser monitoreados de forma remota por el usuario iniciando sesión en Rock Maker Web en el caso de CF o a través de ISPyB en el caso de VMXi. El acceso al CF se puede llevar a cabo de forma iterativa en función de los resultados de difracción de rayos X recogidos en Diamond.
Línea de luz VMXi en la fuente de luz de diamante
Beamline VMXi (en lo sucesivo, "la línea de luz") es un instrumento único y recientemente desarrollado totalmente dedicado a la cristalografía de rayos X altamente automatizada a temperatura ambiente, con un enfoque en la medición de datos de cristales dentro de placas de cristalización adecuadas. La línea de luz ofrece un microfoco (10 x 10 μm), haz rosa (paso de banda de <5 × 10-2ΔE/E) con un alto flujo de ~2 × 1013 fotones/s (a 16 KeV)7. Este haz de alto flujo, junto con un detector rápido, permite un rendimiento muy alto de las muestras y la recopilación de datos de muestras de más de 10 μm de tamaño.
Las placas de cristalización ingresan a la línea de luz almacenándose en un sistema de almacenamiento de muestras y se visualizan según el cronograma proporcionado por el usuario al registrar las placas utilizando la interfaz ISPyB11 SynchWeb12. Por lo general, se recomienda a los usuarios que seleccionen una secuencia de Fibonacci de puntos de tiempo para obtener imágenes (0, 12, 24, 36, 60... 7.320 h desde la entrada de la placa en el sistema). El usuario es informado por correo electrónico una vez que se ha tomado una imagen de una placa. Tanto las imágenes de luz visible como las de luz ultravioleta están disponibles para los usuarios bajo demanda. Las imágenes tomadas por el sistema de almacenamiento de muestras se analizan mediante un algoritmo de aprendizaje automático; Esto localiza y define automáticamente los puntos de interés de los objetos que se asemejan a cristales y registra los puntos de interés listos para que el usuario los agregue a una cola para la recopilación de datos. Los usuarios también pueden hacer clic manualmente en las imágenes de luz visible para registrar puntos de interés o pueden hacer clic y arrastrar una región para analizarla mediante escaneo ráster. Estos puntos están disponibles para que los usuarios los agreguen a la cola junto con los puntos ubicados automáticamente.
Una vez que todas las muestras tienen los parámetros apropiados para la recolección de datos, la placa entra en una cola. Cuando la placa llega a la parte superior de la cola, se dispensa automáticamente a la línea de luz. Las placas de cristalización se cargan automáticamente desde los hoteles de cristal a la línea de luz mediante un brazo robótico y, tras la comparación de imágenes, se miden conjuntos de datos cristalográficos de hasta 60° de rotación de cada cristal seleccionado según las instrucciones definidas por el usuario. Todas las gotas dentro de una placa se pueden usar para estos experimentos en la línea de luz. Los datos se fusionan a partir de múltiples cristales para producir conjuntos de datos isomorfos y fusionados de forma óptima de forma automatizada 7,9. Una vez que se recopilan todos los conjuntos de datos en cola, se envía al usuario un correo electrónico con un enlace a seguir para ver los conjuntos de datos en ISPyB11, como en otras líneas de luz Diamond MX. Los usuarios también son dirigidos a la página web de la línea de luz (https://www.diamond.ac.uk/Instruments/Mx/VMXi.html).
Protocolo
1. Producción de cristales dentro de placas in situ utilizando la Instalación de Cristalización en Harwell
NOTA: El acceso al CF está soportado por varias rutas diferentes y depende de la aplicación del proyecto y del tipo de usuario (académico o industrial). Los proyectos XChem y MPL tienen su propio sistema de solicitud de propuestas a través del Sistema de Administración de Usuarios (UAS) y se pueden enviar a través de la ruta de acceso estándar (incluidos iNEXT Discovery y EUbOPEN) o BAG Access. El protocolo siguiente es específico para los usuarios de VMXi.
- Presentación de propuestas y preparación de la visita
- Proporcione información sobre el proyecto a una solicitud de propuesta de BAG o agréguela a una propuesta de BAG activa. Por lo general, hay un coordinador de BAG, que organiza el papeleo. Alternativamente, envíe una propuesta de acceso rápido para acceder a la línea de luz.
- Asegúrese de que la muestra ha sido registrada y validada en UAS en una propuesta antes de su llegada al sitio, ya sea por mensajería o en persona.
- Asegúrese de que el usuario esté registrado (con FedID y contraseña).
- Asegúrese de que el usuario haya sido agregado a una propuesta de MX como asociado en UAS por el coordinador de BAG.
- Complete el formulario de detalles de la muestra de cristalización de la línea de luz y envíelo a VMXi@diamond.ac.uk.
- Comunícate con el personal de la línea de luz sobre los requisitos del experimento y la disponibilidad de la línea de luz.
- Si se envían muestras de proteínas, solo envíe muestras por acuerdo previo. Consulte la sección 1.2 para obtener más información.
- Si el usuario va a entrar en el sitio para instalar placas de cristalización en el CF, consulte con el personal de la instalación sobre la disponibilidad de un intervalo de tiempo para usar la instrumentación de la instalación y siga la sección 1.2.1.
- Si el usuario lleva placas al sitio, asegúrese de que la muestra se dispense en el tipo de placa correcto y coloque las gotas de cristalización en el lugar correcto y en la cantidad correcta. Siga la sección 1.2.2. La línea de luz acepta solo placas de cristalización in situ específicas (Greiner CrystalQuickX y MiTeGen In Situ-1); asegúrese de que las gotas no superen los 200 nL.
- Experimento de cristalización realizado en CF
NOTA: La instalación ofrece una serie de métodos de cristalización macromolecular de alto rendimiento, como la difusión de vapor, así como la cristalización por lotes bajo aceite y LCP. Se recomienda comenzar con 70-100 μL de proteína pura y realizar experimentos de difusión de vapor para proteínas solubles con tres cribas utilizando una proporción de 100 nL de solución proteica y 100 nL de solución de depósito de cristalización e incubando las placas a 20 °C. Una serie de pantallas comerciales están disponibles dentro de las instalaciones. El control de humedad y temperatura está disponible con 4 °C y 20 °C más utilizados. Los usuarios que visitan el CF reciben capacitación estandarizada y soporte para operar la instrumentación de cristalización y usarán la configuración descrita en este documento.- Envío de muestras para su instalación en el CF
NOTA: Antes de la llegada al sitio, la muestra de proteína debe haber sido validada en una propuesta dentro del sistema UAS. Una vez que la muestra de proteína haya llegado al sitio, los miembros del personal establecerán experimentos de cristalización según las instrucciones en las comunicaciones previas con el usuario. La confirmación se enviará por correo electrónico con la información del código de barras de las placas de cristalización experimentales. Se solicitará al usuario que añada las placas de cristalización como contenedores a la propuesta correspondiente. Una vez hecho esto, las placas se pueden almacenar en generadores de imágenes automatizados en la instalación de cristalización o en la línea de luz. ISPyB será la interfaz utilizada para la interacción en la línea de luz.- Proporcione la solución de muestra de proteína a la concentración para la cristalización en múltiplos de 25 μL alícuotas. Etiquete claramente los tubos de muestra que contienen la muestra de proteína.
- Si es necesario, proporcione una solución tampón proteica, una solución de ligando o una solución de reservorio.
- Informar al personal de la instalación qué pantallas y proporciones de caída deben utilizarse.
- Ajustes de la placa de cristalización
NOTA: Requerimos que las gotas de cristalización en la placa Greiner CrystalQuickX y MiTeGen In Situ-1 estén en una ubicación particular; Las placas instaladas en otro lugar deben usar las siguientes configuraciones de Mosquito13 que se describen aquí.- Para ajustar la definición de la placa para MiTeGen In Situ-1, abra el software Mosquito SPT y haga clic en la página de definición de la placa MiTeGen In Situ-1 estándar haciendo clic en Configuración | 96 Pocillos | MiTeGen In Situ-1 (96 x 2 gotas) (Figura 2A). Haga clic en el botón de edición y modifique los valores para la ubicación del subpozo 2: Desplazamiento X a - 1,2 y Desplazamiento Y a 1,8 y para la ubicación del subpozo 3: Desplazamiento X a 1,3 y Desplazamiento Y a 1,8 (Figura 2B, C).
- Para ajustar la definición de la placa para Greiner CrystalQuickX, abra el software Mosquito SPT y haga clic en la página de definición de placa estándar de Greiner CrystalQuickX haciendo clic en Configuración | 96 Pozo | Greiner CrystalQuickX (Figura 2D). Haga clic en el botón Editar y modifique los valores para la ubicación del subpozo 1: Desplazamiento X a - 1,95 y Desplazamiento Y a 1,45 y para la ubicación del subpozo 2: Desplazamiento X a 1,95 y Desplazamiento Y a 1,45 (Figura 2E,F).
- Envío de muestras para su instalación en el CF
2. Uso de la línea de luz en la fuente de luz de diamante
NOTA: Toda la interacción con la línea de luz por parte de los usuarios se realiza de forma remota utilizando la interfaz ISPyB11 . No se requiere presencia física en la línea de luz y los datos se recopilan utilizando un sistema basado en colas en lugar de programarse en un momento determinado. Los usuarios tendrán una propuesta asociada a su acceso a la fuente de luz Diamond. En la línea de luz, a cada placa de cristalización se le asigna una visita única y se define como un "contenedor" dentro de ISPyB11 análogo a un disco que contiene muestras a 100 K. Las pantallas de optimización no se pueden crear utilizando la interfaz SynchWeb y, como tal, la información generalmente se agrega a la sección de comentarios (consulte el paso 2.1.4.). La persona que registre la placa deberá verificar la dirección de correo electrónico, ya que el propietario de la placa recibirá correos electrónicos con respecto a las imágenes, así como notificaciones de placa completada.
- Matrículas de registro
- Inicie sesión en ISPyB con un FedID de diamantes apropiado y seleccione Propuestas. Busque la propuesta de interés desplazándose o escribiendo el número de propuesta en la barra de búsqueda. Seleccione Envío en el menú desplegable debajo del número de propuesta (Figura 3A), que abrirá la ventana Envíos con los envíos en esa propuesta. Haga clic en +Agregar envío en la parte superior derecha (Figura 3B) para abrir la ventana Agregar nuevo envío , asigne un nombre al envío, haga clic en Automatizado/Generador de imágenes y, a continuación, haga clic en el botón Agregar envío en la parte inferior izquierda (Figura 3C).
- En la ventana de envío (Figura 3D), haga clic en +Agregar contenedor, que luego mostrará la vista de página Agregar contenedor (Figura 3E). Elija en el menú desplegable Tipo de contenedor cualquiera de los tipos de placa relevantes. La página cambiará para reflejar el tipo de contenedor que se eligió. Ingrese un código de barras y un nombre de contenedor según las instrucciones por correo electrónico del personal de la línea de luz específicas para las placas experimentales. Tenga en cuenta que distingue entre mayúsculas y minúsculas.
- Seleccione el generador de imágenes VMXi 20 °C en el menú desplegable Generador de imágenes solicitado , el programa de imágenes de Fibonacci en el menú desplegable Programa de imágenes , la pantalla de cristalización en el menú desplegable Pantalla de cristalización y el nombre de usuario en el menú desplegable Propietario , haga clic en el botón Ver e ingrese la dirección de correo electrónico de contacto correcta en el cuadro Correo electrónico (Figura 3F).
- Introduzca más detalles sobre la placa en el cuadro Comentarios . Seleccione la muestra correspondiente en el menú desplegable Proteína , y utilice el acrónimo registrado en UAS y aprobado por Diamond dentro de la propuesta experimental. Escriba el mismo nombre en el cuadro Nombre de muestra ; Deja vacías las casillas restantes.
- Haga clic en el icono +Plato para replicar la muestra en todo el plato y rellenar todo el recipiente con cuadrados verdes. Haga clic en +Agregar contenedor en la parte inferior de la página para registrar la placa. Pida a un miembro del personal de la línea de luz que transfiera la placa al generador de imágenes adecuado, donde se almacenará y se tomarán imágenes. Se generará una visita cuando el contenedor esté almacenado en los generadores de imágenes y el usuario recibirá un correo electrónico con un enlace a la placa y sus imágenes.
- Visualización de los resultados de las imágenes
- Navegue hasta la propuesta de interés (pasos 2.1.1), seleccione Contenedores en el menú desplegable debajo del número de propuesta y observe la lista de contenedores disponibles para la propuesta. Seleccione las placas de filtro si hay otros tipos de portamuestras . Para limitar aún más la búsqueda, marque la casilla Mis contenedores para mostrar solo los contenedores más relevantes asociados con el ID de usuario que ha iniciado sesión actualmente. Haga clic en el contenedor apropiado moviendo el cursor sobre la línea individual y haciendo clic con el botón izquierdo del ratón.
- Al seleccionar el contenedor, se presentará una nueva vista que muestra una descripción general de la placa (Figura 4A). Haga clic en una gota en la representación de la placa en el lado izquierdo de la pantalla para mostrar la imagen más reciente de esa gota respectiva. Utilice las teclas de flecha para navegar entre las gotas o seleccione las gotas individuales con el ratón o el cursor.
- Para ver imágenes históricas de una gota, haga clic en el botón H y espere a que aparezca una galería emergente de imágenes sobre la imagen de caída de pozo actual. Coloque el cursor sobre las imágenes individuales para actualizar la imagen principal de colocación.
- Puntúa las imágenes para indicar el estado de cada gota pulsando los botones 0 - 9 . Para ver las categorías individuales, abre el menú desplegable Puntuación en la parte superior izquierda de la imagen de colocación. Busque cruces azules en cada una de las imágenes de gota, que son el resultado de un algoritmo (CHiMP) entrenado para buscar "cristales" dentro de las imágenes.
- Haga clic en el tercer botón de icono llamado Medir en la parte superior derecha de la imagen de la gota para acceder a una herramienta de medición. Para usar esta herramienta, haz clic y arrastra una línea, y una regla se extenderá y dará la distancia en μm.
- Para solicitar una sesión de imágenes adicional, haga clic en Visible o UV en el cuadro desplegable adyacente a Acciones que se dirige hacia la parte inferior de la página. A continuación, haga clic en el botón Solicitar imágenes de placas .
- Selección de cristales/CHiMP
- Para agregar puntos para la recopilación de datos manualmente, presione el botón +Marcar punto . Coloque el cursor sobre el punto de interés deseado y seleccione. Espera a que aparezca una cruz roja.
NOTA: Se pueden crear hasta 100 objetos por entrega. - Cuando todos los puntos estén marcados, haga clic en el botón +Finalizar . Recuerde también hacer clic en el botón +Finalizar antes de intentar medir objetos. Para agregar regiones para la recopilación de datos a través de escaneos de cuadrícula, haga clic en el botón +Marcar región . Haga clic en el punto superior izquierdo y arrastre hacia abajo y hacia la derecha para crear una región que se escaneará en ráster en la línea de luz. Al igual que con los puntos, haga clic en el botón +Finalizar cuando se hayan creado todas las regiones deseadas.
NOTA: Es mejor crear una región más grande que muchas regiones pequeñas. - Observe las cruces azules que ya están en las imágenes de caída, que son el resultado de un algoritmo diseñado para localizar automáticamente objetos cristalinos (CHiMP). Para visualizar la evaluación de CHiMP de las gotas de cristalización, haga clic en la casilla de verificación Mostrar puntuaciones automáticas y, a continuación, cambie el menú desplegable de Clase. Por lo general, la configuración más útil aquí es la opción de cristal (Figura 4B).
NOTA: Esta es una característica nueva y no se garantiza que encuentre todos los cristales y también puede encontrar otros objetos que no son cristales. - Cuando todos los puntos y regiones se hayan marcado en las gotas respectivas, haga clic en el botón Preparar para la recopilación de datos en la parte inferior de la página.
- Para agregar puntos para la recopilación de datos manualmente, presione el botón +Marcar punto . Coloque el cursor sobre el punto de interés deseado y seleccione. Espera a que aparezca una cruz roja.
- Preparación de muestras para la recopilación de datos
- Observe la lista de muestras que contienen los puntos o regiones seleccionados en el paso anterior, o ubicados automáticamente (Figura 4C). Agregue puntos o regiones individuales presionando el botón + o agregue todas las muestras mostradas haciendo clic en el botón Agregar página actual a la cola .
- Los filtros están disponibles para mostrar solo puntos, regiones, puntos automáticos o puntos manuales . Para mostrar solo las muestras que no se han tomado (es decir, expuestas a rayos X), haga clic en las opciones Sin datos y No completadas situadas encima de los botones de filtro.
- Seleccione muestras individuales haciendo clic en la línea respectiva y actualice la imagen en el lado derecho de la pantalla para mostrar la gota correcta y el punto individual. Si hay muchas muestras en la lista, aumente el número de muestras mostradas por página seleccionando el menú desplegable con 10 como valor predeterminado y hasta 100 como el número máximo de muestras mostradas.
- Una vez que se hayan agregado todos los puntos y regiones a la cola, asegúrese de que todos los parámetros de recopilación de datos experimentales estén asociados a cada experimento.
- Utilice filtros para Punto, Región, Manual y Automático. Haga clic en el filtro Punto y haga clic en la casilla de verificación Seleccionar todo debajo de los botones de filtro para aplicar simultáneamente parámetros a todas las muestras visibles en la lista actual de muestras en cola .
- Seleccione los parámetros experimentales en el menú desplegable en el lado derecho de la pantalla debajo de la foto de la gota (Figura 4D). Para regiones, seleccione la opción de Grid Scan DMM pasos de 10 micras, transmisión del 100 por ciento. Para todos los demás experimentos puntuales, seleccione otras opciones en el menú desplegable según corresponda.
- Para las recopilaciones de datos de oscilación, haga clic en la opción de transmisión Omega Scan DMM 60 grados 5 por ciento para recopilar la cantidad máxima de datos de una muestra individual. Aplique pequeñas rotaciones para cristales muy pequeños o muestras sensibles a la radiación y varíe la transmisión en función de la experiencia previa con una forma cristalina en particular. Una vez que todos los ejemplos tengan los parámetros experimentales aplicados correctamente, haga clic en el botón Contenedor de cola en la parte inferior de la página.
- Una vez que la placa haya llegado a la parte superior de la cola, se presentará a la línea de luz, se recopilarán conjuntos de datos y, a continuación, volverá de nuevo al almacenamiento de muestras dentro de la línea de luz. Una vez que se completa la recopilación de datos de una placa, busque un correo electrónico con un enlace para seguir para acceder a los datos relevantes.
- Creación de grupos de muestras
NOTA: Se pueden crear grupos de muestras para agrupar muestras similares en varias gotas o placas. Todos los conjuntos de datos dentro de estos grupos de muestra se procesarán utilizando la canalización xia2.multiplex14 una vez procesados por DIALS. Esto puede ser útil cuando se recopilan muchas cuñas muy pequeñas de datos y también puede ser útil para aumentar la relación señal-ruido para experimentos de unión de ligandos.- Seleccione Administración de grupos de muestra en el menú desplegable debajo del número de propuesta. Busque una lista de grupos si ya han sido creados por otros usuarios. Para generar un nuevo grupo, haga clic en el botón +Crear grupo de muestra . Haga clic en un envío en el menú desplegable de la página Crear grupo de muestras para ver el visor de muestras (Figura 5A). Haga clic en el contenedor que contiene las muestras relevantes de la lista que se rellena.
- Cuando se ha hecho clic en un contenedor, busque un gráfico que muestre la descripción general de la placa.
- Haga clic en las gotas individualmente haciendo clic en la gota individual (Figura 5B) o haga clic en las gotas en filas o columnas haciendo clic en la letra de fila o el número de columna correspondiente. Cuando se hayan seleccionado todos los pozos asociados a un grupo individual, introduzca un nombre para el grupo en el cuadro Nombre del grupo de muestras y haga clic en el botón Guardar grupo de muestras . Haga clic en el botón Ver grupos de muestra de esta página para volver a la lista de grupos de muestra ya generados asociados a la propuesta (Figura 5C).
- Edición de grupos de muestras
- Haga clic en un grupo de muestra de la lista de grupos de la página Administración de grupos de muestra .
- Haga clic en el botón +Editar grupo de muestras junto a los contenedores que aparecen debajo de la información del grupo (Figura 5C).
- Observe las gotas, ya asociadas con un grupo de muestras, resaltadas en la vista general de la placa.
- Agregue más gotas al grupo de muestra haciendo clic en gotas, pocillos o columnas como antes.
NOTA: Las gotas no se pueden eliminar de un grupo de muestras. - Una vez que se hayan agregado gotas adicionales, edite el nombre del grupo de muestras y, a continuación, guárdelo, o simplemente guárdelo haciendo clic en el botón Guardar grupo de muestras .
- Visualización y análisis de la salida de los grupos de muestra
- Haga clic en un grupo individual de la lista de grupos de muestras para mostrar la descripción general de la placa del contenedor o contenedores asociados con el grupo. Las gotas incluidas en el grupo se resaltarán en esta pantalla (Figura 5D).
- Busque una lista que contenga los últimos tres trabajos cronológicos de multiplex si se han recopilado datos en este grupo.
- Haga clic en la línea de una ejecución múltiplex para actualizar los resultados de procesamiento que se indican a continuación.
- Observe el botón de enlace rápido , que muestra el número de conjuntos de datos asociados al grupo. Haga clic en este botón para abrir una nueva página Colecciones de datos que muestra las colecciones de conjuntos de datos individuales.
3. Acceso al tratamiento automatizado de datos
NOTA: Una vez que se han recopilado los datos, se pasan a través de varias canalizaciones automáticas de procesamiento de datos. Las cuatro tuberías estándar utilizadas a través de las líneas de luz MX en Diamond también se ejecutan con datos recopilados en la línea de luz. Son 'fast_dp', 'xia2 dials', 'xia2 3dii' y 'autoPROC'15. 'fast_dp' proporcionará una rápida reducción de datos para evaluar rápidamente la calidad. Las otras tres canalizaciones requerirán más tiempo de cálculo y ejecutarán una variedad de diferentes paquetes de software de reducción de datos para comparar. En consecuencia, la salida suele ser de mayor calidad que la salida 'fast_dp'. Los conjuntos de datos recopilados en la línea de luz también se ejecutarán a través del software de fusión automática de multicristales 'xia2.multiplex'14, que fusionará todos los conjuntos de datos dentro de un grupo definido. Tenga en cuenta que, si bien los escaneos de cuadrícula no se procesan automáticamente actualmente, los datos se pueden procesar manualmente mediante la canalización 'xia2.ssx'. Los resultados de las canalizaciones de procesamiento automático se pueden encontrar en ISPyB11 utilizando el siguiente protocolo.
- Localización de los conjuntos de datos
- Inicie sesión en ISPyB como se ha descrito anteriormente y seleccione Propuestas.
- Busque la propuesta de interés desplazándose o escribiendo el número de propuesta en la barra de búsqueda.
- Haga clic en la visita deseada de la lista que aparece en la pantalla para acceder a la ventana Recopilaciones de datos para esa visita.
- Aplique los filtros que desee.
NOTA: Un filtro popular es el filtro "Integración automática", que solo mostrará los conjuntos de datos que se hayan ejecutado correctamente a través de una o más canalizaciones de procesamiento. Esto excluirá los escaneos de cuadrícula, ya que actualmente no se procesan automáticamente a través de ISPyB. - Desplácese hacia abajo en la página para encontrar el conjunto de datos de interés.
NOTA: Cada conjunto de datos mostrará el ID de la muestra, los parámetros experimentales utilizados, un visor de imágenes de difracción, un visor de imágenes cristalinas y un gráfico de análisis por imagen para una observación rápida de la calidad de los datos.
- Para acceder a los resultados del procesamiento automático
- Haga clic en la pestaña Procesamiento automático debajo del resumen de datos de un experimento específico para inspeccionar los resultados de la reducción automática de datos (Figura 6A).
- Haga clic en las diferentes pestañas correspondientes a las diferentes canalizaciones para ver un resumen detallado de cada salida.
NOTA: Si se han definido grupos de muestras, habrá dos pestañas correspondientes a los trabajos multiplexados. Uno corresponderá a la fusión de todos los conjuntos de datos del grupo hasta ese momento, mientras que el otro corresponderá a la fusión de conjuntos de datos dentro de esa caída solamente. - Haga clic en el botón Registros y archivos para descargar los archivos .mtz resultantes si el procesamiento se realizó correctamente y los archivos de registro asociados. Haga clic en la pestaña Procesamiento descendente debajo de la sección Procesamiento automático para ver la salida de DIMPLE.
NOTA: DIMPLE solo se ejecutará si se proporcionó un archivo PDB durante el envío de la muestra. - Haga clic en el botón Registros y archivos para descargar cualquier salida resultante de DIMPLE.
- Para acceder a los resultados de la multiplexación de grupos, abra el menú desplegable en la parte superior de la pantalla con el número de propuesta escrito en él y haga clic en Administración de grupos de muestra. Haga clic en la fila correspondiente al grupo deseado dentro del contenedor correcto. Desplácese hacia abajo para encontrar la lista de salidas multiplexadas correspondientes al grupo representado visualmente por un diagrama de la placa.
- Haga clic en la salida multiplexada deseada de la lista dada. Haga clic en el botón xxx Conjuntos de datos , donde xxx es el número de conjuntos de datos combinados (Figura 6B).
NOTA: Esto abrirá la pantalla Colecciones de datos , pero solo se mostrarán los conjuntos de datos del trabajo multiplexado seleccionado. - Haga clic en la pestaña Procesamiento automático del experimento superior.
- Haga clic en la pestaña Procesamiento múltiplex que corresponde al número correcto de conjuntos de datos combinados.
- Haga clic en el botón Registros y archivos para descargar el archivo .mtz y los archivos de registro correspondientes (como en el paso 3.2.3).
- Haga clic en la salida multiplexada deseada de la lista dada. Haga clic en el botón xxx Conjuntos de datos , donde xxx es el número de conjuntos de datos combinados (Figura 6B).
- Para acceder a los resultados del análisis de cuadrícula
- Vaya a la pantalla Recopilaciones de datos para la visita deseada. Los resultados de los datos del escaneo de cuadrícula se mostrarán junto con los datos de rotación recopilados.
NOTA: No habrá resultados de procesamiento automático. - La imagen de la gota de cristal tendrá la cuadrícula superpuesta con un mapa de calor que representa la presencia de difracción. Haga clic en un cuadrado para ver la imagen de difracción para esa posición en la cuadrícula. Haga clic en el menú desplegable en la parte superior de la imagen del pozo de cristal para cambiar lo que representa el mapa de calor. El valor predeterminado es la intensidad total de la difracción, pero se puede cambiar a puntos totales, resolución estimada o fotogramas sin hielo.
- Vaya a la pantalla Recopilaciones de datos para la visita deseada. Los resultados de los datos del escaneo de cuadrícula se mostrarán junto con los datos de rotación recopilados.
4. Reprocesamiento de datos
NOTA: Los conjuntos de datos seleccionados se pueden volver a procesar a través de la interfaz ISPyB11 utilizando las mismas canalizaciones de procesamiento que se ejecutan automáticamente con la configuración modificada definida por el usuario. Se puede aplicar un límite de resolución; Si se conoce la simetría/celda del cristal, esto también se puede definir para garantizar que las canalizaciones de procesamiento se ejecuten en la configuración correcta. Los rangos de imágenes seleccionados en conjuntos de datos específicos también se pueden combinar mediante canalizaciones multicristalinas disponibles. Esto puede resultar ventajoso si el daño sistemático por radiación hace que la última parte de las imágenes de difracción sea de mala calidad. También es una opción para que el usuario descargue sus conjuntos de datos utilizando el protocolo descrito anteriormente y ejecute el software de reprocesamiento deseado localmente, cuyos tutoriales están disponibles gratuitamente en otros lugares (https://dials.github.io/documentation/tutorials/index.html# ).
- Para volver a procesar varios conjuntos de datos individuales
- Inicie sesión en ISPyB y navegue hasta los conjuntos de datos de interés (paso 3.1).
- Haga clic en un conjunto de datos y haga clic en el icono de engranaje en la barra de título del conjunto de datos (Figura 6) para abrir la ventana de reprocesamiento.
- Configure los ajustes deseados y seleccione qué fotogramas se incluirán en el reprocesamiento.
NOTA: El rango de imagen se puede definir escribiendo un rango en los cuadros etiquetados o haciendo clic y arrastrando la región deseada en el gráfico de análisis por imagen (Figura 7A). - OPCIONAL: Para agregar otro conjunto de datos para el reprocesamiento individual, haga clic en su icono de engranaje y aparecerá en la ventana de reprocesamiento debajo del primer conjunto de datos. Marque la casilla Procesar individualmente .
- Haga clic en el botón Integrar .
- Para volver a procesar datos multicristalinos
- Abra la ventana de reprocesamiento desde cualquier conjunto de datos.
- Haga clic en el botón Multicristal para abrir una nueva pantalla.
- Desplácese hacia abajo para encontrar una serie de gráficos de análisis por imagen de los experimentos realizados durante la visita.
- Elija una canalización de procesamiento en el menú desplegable.
- OPCIONAL: Defina los límites de resolución o los parámetros de celda unitaria conocidos.
- Haga clic y arrastre para definir los rangos de imágenes que se incluirán en el reprocesamiento multicristalino (Figura 7).
NOTA: Esto debe hacerse en varias gráficas diferentes para que se combinen los conjuntos de datos de varios cristales diferentes. - Haga clic en el botón Integrar (Figura 7B).
- Para acceder a los datos reprocesados
- Vaya a la página Recopilaciones de datos para la visita específica (pasos 3.1.1-3.1.3).
- Haga clic en el botón Reprocesamiento en la parte superior de la pantalla.
- Desplácese hacia abajo para localizar el trabajo deseado.
- Haga clic en la ruta del archivo en la columna de la derecha para abrir la pantalla Recopilaciones de datos para los datos reprocesados.
- Abra la pestaña Procesamiento automático y descargue los datos como se describió anteriormente (paso 3.2).
NOTA: Los trabajos reprocesados se pueden identificar mediante el símbolo de flechas circulares situado junto al nombre de la canalización.
Resultados Representativos
La instalación de cristalización y la línea de luz VMXi se han utilizado para una amplia variedad de tipos de proyectos y casos de uso. Aquí hay un pequeño número de ejemplos para ilustrar lo que los usuarios pueden desear perseguir.
Estudio de caso 1: Recopilación de datos estándar
La línea de luz permite la determinación rápida de estructuras cristalinas a temperatura ambiente a partir de un pequeño número de cristales dentro de una placa de cristalización. El número mínimo de cristales depende del grupo espacial y de las orientaciones de los cristales, pero con frecuencia es de 1 a 4, aunque se puede lograr una mejor calidad de los datos mediante la fusión de datos de varias decenas de cristales. Un ejemplo reciente es uno de los estándares de la línea de luz, la taumatina. Se marcaron múltiples cristales, que se muestran en la Figura 8A, para la recopilación manual de datos, como se describe en la sección 2.3 del protocolo. Estos cristales se agregaron a la cola como se describe en la sección 2.4 del protocolo y los parámetros experimentales se seleccionaron de la lista desplegable. Una vez aplicados los parámetros experimentales, la placa se puso en cola para la recolección de datos. Los conjuntos de datos se recopilaron, escalaron automáticamente y fusionaron utilizando la canalización xia2.multiplex como se describe en la sección 3 del protocolo. En la figura 8A central se muestra un ejemplo de salida de SynchWeb. Cinco conjuntos de datos fusionados dieron lugar a un conjunto de datos de 1,66 Å de resolución. Para la recolección de datos estándar de aproximadamente cinco cristales en un pozo, los conjuntos de datos se recopilaron en 2,5 minutos.
Estudio de caso 2: Unión de ligandos – Experimento de fragmentos con la proteína Mac1
La producción de estructuras de complejos proteína-ligando a temperatura ambiente se puede lograr fácilmente utilizando la línea de luz. Los ligandos pueden añadirse a las gotas en placas de cristalización (ya sea manualmente o mediante inyección acústica de gotas) y los datos pueden medirse después de un tiempo de incubación adecuado. En el ejemplo aquí descrito, se dispensaron una serie de fragmentos en pocillos que contenían cristales del primer macrodominio del SARS-CoV-2 de la proteína nsp3 (Mac-1) en una placa de cristalización. Dos de los pocillos que contenían el mismo fragmento se asignaron como un grupo, como se describe en el paso 2.5 del protocolo. Se marcaron múltiples cristales (42) para la recolección de datos como se describe en los pasos 2.3 y 2.4 del protocolo, y los conjuntos de datos se recopilaron utilizando parámetros estándar (rotación de 60°, paso de 0,1°, exposición de 0,00178 s, transmisión del 5%, 16 KeV - por cristal) (Figura 8B). Los conjuntos de datos de los dos pozos se procesaron automáticamente utilizando la canalización xia2.dials y, posteriormente, se inició la canalización xia2.multiplex para fusionar automáticamente 22 de estos conjuntos de datos. A continuación, DIMPLE se ejecutó en la salida de estas tuberías y produjo mapas que mostraban claramente la evidencia del fragmento enlazado. El modelo de fragmentos se incorporó a la densidad desocupada y se refinó aún más (Figura 8B derecha). Las estructuras unidas a ligandos a temperatura ambiente se pueden determinar fácilmente utilizando esta serie de pasos para proporcionar información y retroalimentación invaluables para el proceso de diseño de fármacos basado en estructuras. Para esta recopilación de datos de 42 cristales en varios pozos, los conjuntos de datos se recopilaron en 10 minutos.
Estudio de caso 3: Solución de estructura con un grupo espacial de baja simetría y orientaciones preferidas Se produjo una pila de múltiples cristales con morfología en forma de placa a partir de experimentos de cristalización con un citocromo de unión a gas de tipo c (Figura 8C). Al seleccionar varias posiciones alrededor del borde de la pila donde solo había un solo cristal en el haz de rayos X, fue posible obtener un conjunto de datos de buena calidad con una resolución de 1,75 Å mediante la fusión de cuñas de cuatro cristales, a pesar de un grupo espacial monoclínico (C2). Esto permitió un rápido avance del proyecto sin necesidad de optimizar aún más las condiciones de cristalización. Este resultado ha sido descrito anteriormente9. Para esta recolección de datos de cuatro cristales en un pozo, los conjuntos de datos se recopilaron en 2 minutos.
Caso práctico 4: Obtención de información y estructura a temperatura ambiente a partir de microcristales en una placa mediante cristalografía seriada
A menudo, cuando los microcristales aparecen en una gota o cuando los usuarios buscan optimizar los protocolos de microcristalización por lotes como precursores de experimentos de cristalografía en serie en fuentes de sincrotrón o XFEL, es muy útil obtener información rápida sobre las propiedades de difracción y las dimensiones de la celda unitaria de diferentes ensayos utilizando un material mínimo. En este caso de uso, los microcristales de lisozima que crecían por lotes se pipetearon en una placa de cristalización (volumen de 200 nL por gota) y se recopilaron datos de ocho gotas utilizando un escaneo de cuadrícula con un tamaño de paso de 10 μm (Figura 9). Las 25.906 imágenes fijas resultantes se procesaron utilizando un software de cristalografía en serie, lo que dio como resultado un conjunto de datos, en el que se indexaron y fusionaron 9.891 patrones de difracción produciendo un conjunto de datos con una resolución de 2,0 Å que se refinó bien con respecto a la estructura de temperatura ambiente publicada (Rtrabajo = 19,6%, Rlibre = 23,6% utilizando PDB 8A9D) (Tabla 1). Esto permitió un análisis detallado de la distribución de celdas unitarias y una determinación de la estructura de microcristales a temperatura ambiente que podría alimentar experimentos complejos de cristalografía en serie, incluidos estudios resueltos en el tiempo. El volumen total de suspensión de microcristales requerido fue de 1,6 μL. Para esta recopilación de datos de microcristales en ocho pozos utilizando escaneos de cuadrícula, los conjuntos de datos se recopilaron en 40 minutos.
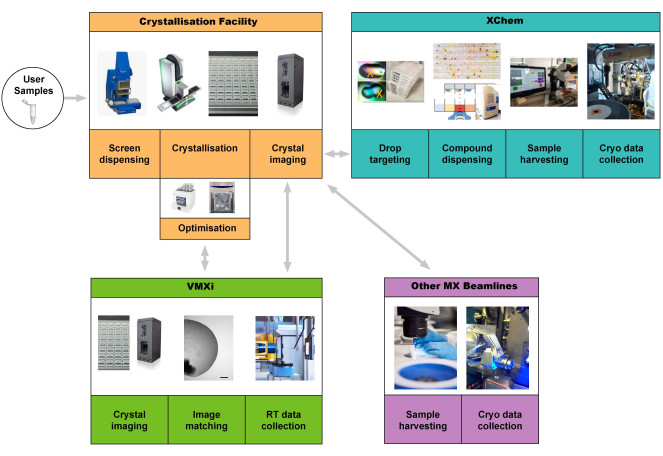
Figura 1: Esquema de la tubería de proteína a estructura que integra el cribado de cristalización, la optimización en la instalación de cristalización, la recopilación y el procesamiento automatizados de datos a temperatura ambiente sin recolección de muestras en VMXi, el cribado de fragmentos XChem y la recopilación de datos en otras líneas de luz MX. Los usuarios pueden iniciar la canalización suministrando una muestra o llevando placas a la línea de luz VMXi. Abreviatura: Cristalografía macromolecular versátil in situ. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: La interfaz de Mosquito SPT Labtech para configurar las placas de cristalización. (A) (1) La vista de configuración de MiTeGen In Situ-1. Elija la placa estándar de caída MiTeGen 2 yendo a (2) el tipo de placa de 96 pocillos y seleccionando (3) la placa de caída MiTeGen 2. Para cambiar los parámetros de definición de la colocación 1 y la colocación 2, que son necesarios para VMXi, haga clic en el icono de edición (4). Esto abre una nueva ventana (B) donde (5) los desplazamientos X e Y deben cambiarse como se muestra. Seleccione (B) el subpozo 2 y (C) el subpozo 3 y cambie los valores en consecuencia. (D) La vista de configuración de CrystalQuickX. Elija la placa estándar de caída CrystalQuickX 2 yendo al tipo de placa de 96 pocillos y seleccionando la placa de caída MiTeGen 2. Para cambiar los parámetros de definición de la colocación 1 y la colocación 2, que es necesaria para VMXi, haga clic en el icono de edición igual que el anterior. Esto abre una nueva ventana donde (E, F) los desplazamientos X e Y deben cambiarse como se muestra. Haga clic aquí para ver una versión más grande de esta figura.
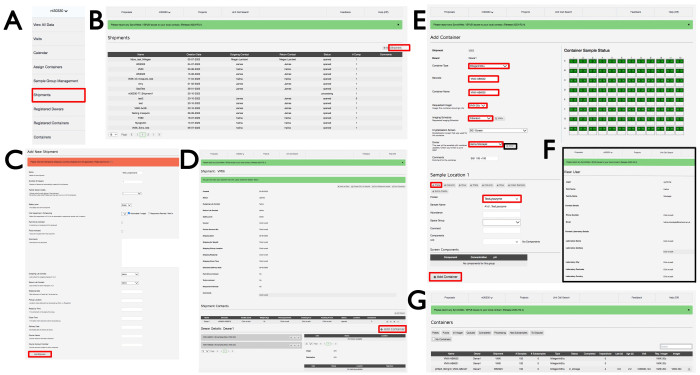
Figura 3: La interfaz de SynchWeb que muestra cómo crear un envío VMXi, registrar una placa y comprobar los datos de contacto. Las capturas de pantalla de las distintas etapas de la carga de información en la interfaz de SynchWeb se muestran desde (A) el menú desplegable, (B,C) el registro de un nuevo envío, (D) el registro de un nuevo contenedor, (E) la introducción de la información de la placa, (F) la comprobación de los datos de contacto y (G) una lista de contenedores registrados dentro de una propuesta. Haga clic aquí para ver una versión más grande de esta figura.
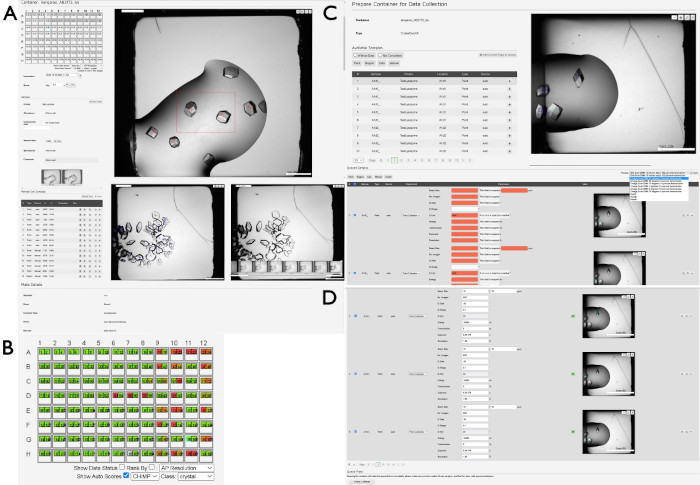
Figura 4: Selección y preparación de muestras para la recopilación de datos mediante SynchWeb. Se muestra una serie de capturas de pantalla que muestran las distintas etapas de la preparación de muestras para la recopilación de datos mediante la interfaz SynchWeb. (A) Los puntos y las regiones de interés se seleccionan en la vista general de la caída. En la parte inferior de este panel, hay una serie cronológica de fotografías de una gota. (B) Un ejemplo de la salida CHiMP para una placa que resalta los resultados para la categoría 'cristal'. (C) Agregar muestras a la cola desde la lista de puntos y regiones seleccionados y (D) aplicar parámetros para la recopilación de datos a las muestras en cola desde la lista desplegable de configuraciones de experimentos creadas por la línea de luz. Obsérvese la diferencia entre las muestras sin parámetros experimentales (en rojo) frente a las que tienen correctamente aplicados los parámetros (arriba y abajo). En la parte inferior de este panel se encuentra el botón Queue Container , que pone en cola la placa que se va a recoger en la línea de luz. Haga clic aquí para ver una versión más grande de esta figura.
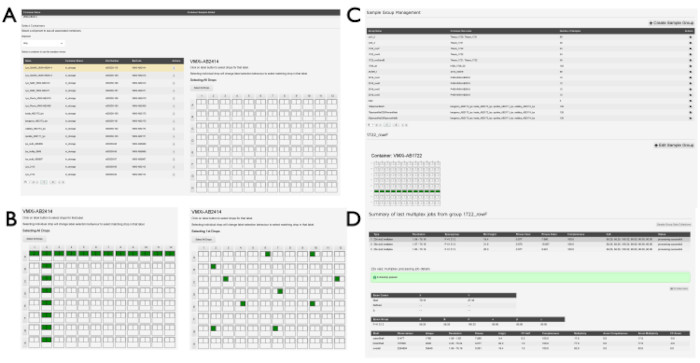
Figura 5: Creación de grupos de ejemplo en SynchWeb. Una serie de capturas de pantalla que muestran las distintas etapas de la creación de grupos de muestras. (A) La(s) placa(s) que contiene(n) las muestras se seleccionan del envío correspondiente y (B) se seleccionan las gotas dentro de la placa. Estos pueden ser gotas individuales o pueden seleccionarse por fila y/o columna. (C) Una lista de grupos de muestra que ya se han creado. (D) Se enumeran las salidas de los últimos tres trabajos de procesamiento multiplex y se pueden seleccionar para mostrar estadísticas de la canalización de procesamiento. Haga clic aquí para ver una versión más grande de esta figura.
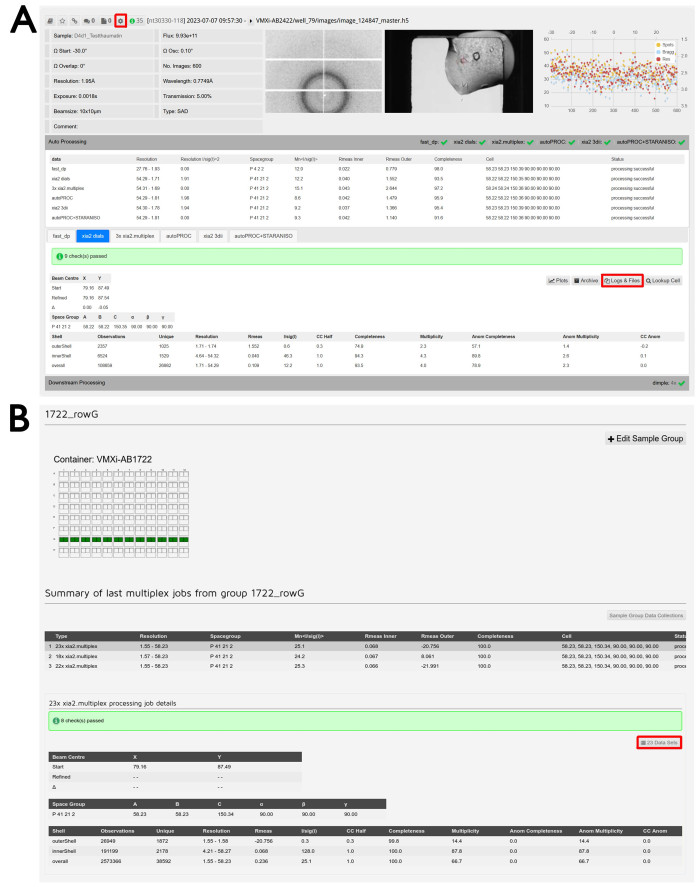
Figura 6: Procesamiento y reducción de datos. (A) Captura de pantalla de un conjunto de datos procesado en ISPyB11. Se resalta el botón para acceder a las funciones de reprocesamiento. La identificación de la muestra y los parámetros experimentales se muestran en la parte superior izquierda y el visor de imágenes de difracción en el centro. Al hacer clic en esta imagen, se abrirá una ventana interactiva para examinar diferentes imágenes. El visor de imágenes de cristal se muestra a la derecha y al hacer clic en esta imagen también se abrirá una ventana interactiva para comparar la línea de luz y las imágenes de almacenamiento de Formulatrix. El gráfico de análisis por imagen se muestra en el extremo derecho y, al hacer clic en esta imagen, se abrirá una versión ampliada de esta salida. Al hacer clic en la pestaña Procesamiento automático , el procesamiento automático será visible y facilitará la comparación entre los resultados de las diferentes canalizaciones. Haga clic en las pestañas para cambiar entre las diferentes canalizaciones de procesamiento y ver la salida detallada de la canalización seleccionada. Se resalta el botón Registros y archivos para la descarga de datos. Al hacer clic en la pestaña Procesamiento descendente , se expandirá y se proporcionarán resultados para cualquier conjunto de datos que se ejecute a través de canalizaciones posteriores a la reducción de datos cuando corresponda. (B) Captura de pantalla de la pantalla Administración de grupos de muestra . El nombre del grupo definido por el usuario se encuentra en la parte superior y la descripción visual de los pozos incluidos se puede ver a continuación. Un pozo verde indica que todos los cristales medidos a partir de esa gota se incluirán en el grupo. Se puede ver un resumen de los diferentes trabajos de multiplexación realizados en ese grupo y debajo se muestra la salida detallada de la multiplexación. Se resalta el botón Conjuntos de datos para examinar los experimentos incluidos. Haga clic aquí para ver una versión más grande de esta figura.
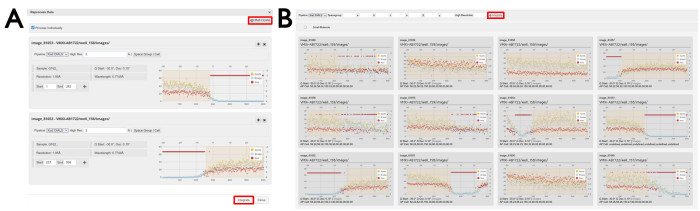
Figura 7: Ventanas de reprocesamiento de datos. (A) conjuntos de datos individuales y (B) conjuntos de datos multicristalinos. Se muestran dos conjuntos de datos individuales en los que se han seleccionado regiones de datos. Con la casilla de verificación Procesar individualmente marcada, las imágenes de difracción seleccionadas se procesarán individualmente pulsando el botón Integrar . Al hacer clic en el botón Multicristal , se abrirá una visualización de los conjuntos de datos individuales. Para volver a procesar imágenes de difracción de varios conjuntos de datos, las regiones de las imágenes se seleccionan tal como se muestran y el reprocesamiento se inicia haciendo clic en el botón Integrar resaltado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Resultados representativos de la canalización VMXi. (A) Cristales marcados para la taumatina de proteínas dentro de una gota de cristalización (panel izquierdo), resultados de procesamiento de datos (panel central) y densidad de electrones (panel derecho). (B) Recolección en múltiples cristales para determinar la unión del fragmento al macrodominio del SARS-CoV-2. Los conjuntos de datos se recogieron en múltiples cristales en presencia de un fragmento de la pantalla de fragmentos EU-OPENSCREEN utilizando una configuración experimental estándar. En este extracto de SynchWeb se muestran ejemplos de estas recopilaciones de datos. El fragmento se construyó en la densidad correspondiente y se refinó aún más, como se muestra en el extremo de la derecha. (C) Cristales monoclínicos marcados en una pila de un golpe de cristalización desafiante utilizado para la recopilación de datos. Las cruces verdes y los números rojos indican dónde se midieron los datos utilizando un haz de 10 μm y una rotación de 60°. Cuatro de las cuñas resultantes se fusionaron para producir un conjunto de datos con una resolución de 1,75 Å. La densidad de electrones alrededor del grupo hemo se muestra a la derecha. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Cristalografía seriada en la placa de cristalización. (A) Imagen óptica de la gota de cristalización, con un recuadro blanco que representa la región de interés. (B) Definición de los puntos de escaneo de la cuadrícula. (C) Mapa de calor que indica difracción. (D) Mapa de densidad de electrones que surge de un conjunto de datos de cristalografía en serie de más de 9.000 patrones de difracción fija. Haga clic aquí para ver una versión más grande de esta figura.
| Resolución (Å) | Completitud (%) | Multiplicidad | I/σ(I) | DivisiónR | CC1/2 | Observaciones únicas |
| En general | 100 | 95.5 | 20.8 | 0.063 | 0.998 | 8422 |
| Bajo (55.55 - 5.43) | 100 | 147.1 | 81.7 | 0.028 | 0.999 | 488 |
| Alta (2.03 -2.00) | 100 | 75.3 | 1.2 | 1.092 | 0.410 | 411 |
Tabla 1: Estadísticas de datos para el conjunto de datos en serie VMXi RT. Abreviaturas: I = intensidad media de las observaciones a escala; R split = una medida de discrepancia de las intensidades medidas; CC 1/2 = coeficiente de correlación entre dos mitades aleatorias del conjunto de datos.
Discusión
Hemos descrito el procedimiento completo desde la llegada de una muestra de proteína a la FQ hasta la descarga de los datos finales por parte del usuario para otras aplicaciones. Los pasos críticos son la producción de una muestra de proteína de alta calidad y las pantallas de cristal adecuadas, ya sea utilizando pantallas comerciales de matriz dispersa o pantallas de optimización basadas en las condiciones establecidas. Este proceso puede tener lugar en el CF, o los usuarios pueden llevar a cabo los procedimientos de cristalización en los laboratorios domésticos y llevar placas de cristalización adecuadas a la línea de luz. La identificación de parámetros adecuados para la recogida de datos puede ser importante para determinadas muestras, especialmente cuando los daños causados por la radiación son motivo de preocupación. En la mayoría de los casos, el procesamiento automatizado de datos es totalmente suficiente para responder a la pregunta científica, aunque los usuarios conservan la capacidad de volver a procesarlos utilizando las herramientas de línea de luz, por ejemplo, cuando el grupo espacial es ambiguo o solo se utiliza la parte inicial de los datos recopilados para minimizar los efectos de los daños causados por la radiación.
Si no se producen cristales adecuados a partir de los ensayos iniciales de cristalización, se pueden explorar cambios en la concentración de proteínas, la pureza o las pantallas de cristalización, al igual que el uso de la siembra de cristales. Si los cristales no se difractan a una resolución útil en la línea de luz, se pueden usar escaneos de cuadrícula con un haz no atenuado para evaluar el límite de difracción inherente y la celda unitaria de los cristales para guiar los esfuerzos de optimización. Los cristales que son demasiado pequeños para la recopilación de datos dentro de las placas (por ejemplo, <10 μm) pueden ser adecuados para experimentos de cristalografía en serie o nanoenfoque (por ejemplo, en la línea de luz de diamante VMXm). La resolución de estructuras utilizando datos de VMXi es generalmente sencilla mediante el reemplazo molecular, particularmente desde el advenimiento de Alphafold16 para proporcionar modelos de búsqueda efectivos. Si esto no tiene éxito, los cristales pueden recolectarse y crioenfriarse de las placas para permitir experimentos convencionales de difracción anómala de una sola longitud de onda, difracción anómala de longitud de onda múltiple o fase de longitud de onda larga.
Las ventajas de este método incluyen la capacidad de obtener conjuntos de datos rápidos y de alta calidad y retroalimentación directamente de las placas de cristalización sin la necesidad de perturbar los cristales de los entornos en los que han crecido. El llamado "renacimiento a temperatura ambiente" en biología estructural otorga una gran importancia a las estructuras obtenidas en condiciones no criogénicas para permitir explorar una mayor relevancia fisiológica y la dinámica de las proteínas2. Por lo general, se logra una resolución ligeramente inferior a la de un cristal crioenfriado optimizado, pero solo cuando se han establecido las condiciones criogénicas adecuadas y si los cristales son robustos a la manipulación mecánica y a la apertura de la gota de cristalización3. Una próxima aplicación para la que esta línea es muy adecuada es un cribado a gran escala de complejos proteína-ligando o campañas de fragmentos a temperatura ambiente en el descubrimiento de fármacos. Los ligandos o fragmentos pueden cocristalizarse o añadirse mediante pipeta o eyección de gotas acústicas antes de la recogida de datos a temperatura ambiente. Otra aplicación consiste en medir rápidamente los datos de muchos cientos o miles de cristales de una manera muy eficiente y, a continuación, utilizar el software DIALS17 multiplex14 para extraer grupos isomorfos que pueden representar diferentes entidades biológicas o para establecer diferencias estadísticamente significativas entre poblaciones de cristales que han sido tratadas de forma diferente o expuestas a diferentes ligandos o señales.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Agradecemos a los muchos científicos y miembros del equipo de apoyo de Diamond Light Source que contribuyeron al diseño, la construcción y la operación de la línea de luz VMXi. Agradecemos a los usuarios de la línea de luz, que han contribuido con ideas más tarde al desarrollo de las tuberías de cristalización y recopilación de datos. La instalación de cristalización en Harwell cuenta con el apoyo de Diamond Light Source Ltd, el Instituto Rosalind Franklin y el Consejo de Investigación Médica.
Materiales
| Name | Company | Catalog Number | Comments |
| Formulator | Formulatrix | on request | Liquid handling robot |
| Formulatrix imager | Formulatrix | on request | Crystallisation plate imager |
| Greiner CrystalQuick X | Greiner | Z617644 | Crystallisation plate |
| Gryphon | Art Robbins Instruments | 620-1000-10 | Crystalisation robot |
| MiTeGen Insitu-1 | Mitegen | InSitu-01CL-40 | Crystallisation plate |
| Mosquito LCP | (SPT Labtech) | on request | Crystallisation robot |
| Rock Imager & Maker | Formualtrix | on request |
Software for Imager [1] https://formulatrix.com/protein-crystallization-systems/rock-maker-crystallization-software/ |
| Scorpion | Art Robbins Instruments | 640-1000-10 |
Liquid handling robot https://www.artrobbins.com/scorpion |
Referencias
- Lynch, M. L., Snell, M. E., Potter, S. A., Snell, E. H., Bowman, S. E. J. 20 years of crystal hits: Progress and promise in ultrahigh-throughput crystallization screening. Acta Crystallographica Section D Structural Biology. 79 (Pt 3), 198-205 (2023).
- Fischer, M. Macromolecular room temperature crystallography. Quarterly Reviews of Biophysics. 54, 1 (2021).
- Helliwell, J. R. What is the structural chemistry of the living organism at its temperature and pressure. Acta Crystallographica Section D Structural Biology. 76 (Pt 2), 87-93 (2020).
- Thorne, R. E. Determining biomolecular structures near room temperature using x-ray crystallography: Concepts, methods and future optimization. Acta Crystallographica Section D Structural Biology. 79 (Pt 1), 78-94 (2023).
- Keedy, D. A., et al. Crystal cryocooling distorts conformational heterogeneity in a model michaelis complex of dhfr. Structure. 22 (6), 899-910 (2014).
- Huang, C. Y., et al. Probing ligand binding of endothiapepsin by 'temperature-resolved' macromolecular crystallography. Acta Crystallographica Section D Structural Biology. 78 (Pt 8), 964-974 (2022).
- Sanchez-Weatherby, J., et al. Vmxi: A fully automated, fully remote, high-flux in situ macromolecular crystallography beamline. Journal of Synchrotron Radiation. 26 (Pt 1), 291-301 (2019).
- Jacquamet, L., et al. Automated analysis of vapor diffusion crystallization drops with an x-ray beam. Structure. 12 (7), 1219-1225 (2004).
- Mikolajek, H., et al. Protein-to-structure pipeline for ambient-temperature in situ crystallography at vmxi. IUCrJ. 10, 420-429 (2023).
- Douangamath, A., et al. Achieving efficient fragment screening at xchem facility at diamond light source. Journal of Visualised Experiments. (171), (2021).
- Delageniere, S., et al. Ispyb: An information management system for synchrotron macromolecular crystallography. Bioinformatics. 27 (22), 3186-3192 (2011).
- Fisher, S. J., Levik, K. E., Williams, M. A., Ashton, A. W., Mcauley, K. E. Synchweb: A modern interface for ispyb. Journal of Applied Crystallography. 48 (Pt 3), 927-932 (2015).
- Jenkins, J., Cook, M. Mosquito®: An accurate nanoliter dispensing technology. JALA: Journal of the Association for Laboratory Automation. 9 (4), 257-261 (2016).
- Gildea, R. J., et al. Xia2.Multiplex: A multi-crystal data-analysis pipeline. Acta Crystallographica Section D Structural Biology. 78 (Pt 6), 752-769 (2022).
- Winter, G., Mcauley, K. E. Automated data collection for macromolecular crystallography. Methods. 55 (1), 81-93 (2011).
- Jumper, J., et al. Highly accurate protein structure prediction with alphafold. Nature. 596 (7873), 583-589 (2021).
- Winter, G., et al. Dials as a toolkit. Protein Science. 31 (1), 232-250 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados