Obtención de imágenes in vivo de esferoides hepáticos injertados en la cámara anterior del ojo de ratón
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, describimos una plataforma que permite la obtención de imágenes in vivo no invasivas de esferoides hepáticos injertados en la cámara anterior del ojo del ratón. El flujo de trabajo abarca desde la generación de esferoides a partir de células hepáticas primarias hasta el trasplante en el ojo del ratón y la obtención de imágenes in vivo a resolución celular mediante microscopía confocal.
Resumen
Los estudios biomédicos del hígado en mamíferos se ven obstaculizados por la falta de métodos para la obtención de imágenes longitudinales no invasivas in vivo a resolución celular. Hasta ahora, la imagen óptica del hígado in situ es posible mediante imágenes intravitales, que ofrecen imágenes de alta resolución a nivel celular pero que no se pueden realizar varias veces y, por lo tanto, longitudinalmente en el mismo animal. Los métodos de imagen no invasivos, como la bioluminiscencia, permiten sesiones repetidas de imagen en el mismo animal, pero no logran la resolución celular. Para abordar esta brecha metodológica, hemos desarrollado una plataforma para la obtención de imágenes in vivo no invasivas de esferoides hepáticos injertados en la cámara anterior del ojo del ratón. En el flujo de trabajo descrito en este estudio, los esferoides primarios del hígado de ratón se generan in vitro y se trasplantan a la cámara anterior del ojo de los ratones receptores, donde se injertan en el iris. La córnea actúa como una ventana natural del cuerpo a través de la cual podemos obtener imágenes de los esferoides injertados mediante microscopía confocal convencional. Los esferoides sobreviven durante meses en el ojo, durante los cuales las células pueden ser estudiadas en contextos de salud y enfermedad, así como ser monitoreadas en respuesta a diferentes estímulos a través de repetidas sesiones de imagen utilizando sondas fluorescentes adecuadas. En este protocolo, proporcionamos un desglose de los pasos necesarios para implementar este sistema de imágenes y explicamos cómo aprovechar mejor su potencial.
Introducción
El seguimiento de la función hepática en mamíferos durante la salud y la enfermedad está limitado por la falta de técnicas de imagen in vivo no invasivas y de alta resolución. La visualización de este órgano se ve obstaculizada por su ubicación inaccesible, y para reconstruir los procesos celulares, los estudios in vivo se basan en el sacrificio de animales en diferentes puntos de tiempo. Para eludir esta limitación de la obtención de imágenes, gran parte del trabajo se basa en modelos in vitro , en los que se visualizan y estudian microtejidos similares al hígado en un entorno controlado.
En los últimos años, el desarrollo de sistemas de cultivo tridimensionales, como los esferoides hepáticos, ha ayudado y avanzado en la investigación hepática. Los esferoides hepáticos son agregados multicelulares que imitan hasta cierto punto el microambiente y las complejas interacciones célula-célula del tejido hepático1 y ofrecen claras ventajas sobre los cultivos monocapa tradicionales 2,3. Los esferoides hepáticos también se utilizan como modelos para diferentes enfermedades hepáticas 4,5,6 y han sido fundamentales para comprender los mecanismos de la enfermedad. Sin embargo, las principales limitaciones de los modelos hepáticos in vitro actuales son la falta de un entorno fisiológico in vivo y el limitado tiempo de utilización en cultivo (alrededor de 20 días)3. Los esferoides hepáticos han sido previamente trasplantados a diferentes sitios in vivo, como debajo de la cápsula renal7 o intraperitonealmente8, que no son accesibles para la obtención de imágenes ópticas. La imagen hepática intravital es una técnica de última generación que ofrece imágenes en tiempo real con resolución celular. En la actualidad, esta imagen hepática in situ solo es posible en el órgano exteriorizado, que es altamente invasivo y, a menudo, terminal9. Aunque la colocación de una ventana abdominal permitiría repetir las sesiones de imagen hepática, implica una cirugía compleja y cuidados posteriores.
Para realizar el monitoreo longitudinal a resolución celular, exploramos el trasplante de esferoides hepáticos a la cámara anterior del ojo (ECA) de ratones, donde el tejido similar al hígado se injerta en un entorno fisiológico, conectado a los estímulos corporales y accesible para imágenes ópticas. La córnea es un tejido transparente y actúa como una ventana a través de la cual los microtejidos injertados en el iris pueden ser visualizados de forma no invasiva y longitudinal por microscopía confocal. Aquí, presentamos un flujo de trabajo de esta plataforma recientemente desarrollada para la obtención de imágenes in vivo de esferoides hepáticos10. Este protocolo es una guía paso a paso para su implementación, dividida en (1) la extracción de células hepáticas primarias de ratón y la formación in vitro de esferoides hepáticos, (2) el trasplante de esferoides hepáticos en el ECA de ratones receptores, y (3) la imagen in vivo de esferoides hepáticos injertados en ratones anestesiados. Además, mostraremos algunas de las posibilidades y aplicaciones de esta plataforma de imagen.
Protocolo
Todos los procedimientos realizados en animales fueron aprobados por el Comité de Ética de Experimentos Animales del Instituto Karolinska.
1. Extracción de células hepáticas primarias de ratón y generación de esferoides hepáticos in vitro
- Preparación
- Para la canulación, la resección hepática y el aislamiento de células hepáticas primarias, prepare los siguientes materiales estériles o de un solo uso, además de las pipetas serológicas y los tubos de centrífuga (figura 1A): bomba peristáltica, centrífuga de cubo oscilante, almohadilla absorbente, estera de disección, dos pinzas de punta curva, tijeras quirúrgicas, una aguja de mariposa de 27 G, un filtro de células de 70 μm, un elevador de células, una placa de Petri de 100 mm, cámara de recuento de células y microplacas de 96 pocillos con fondo en forma de U.
- Prepare las soluciones utilizadas en la perfusión hepática, el aislamiento de las células hepáticas primarias y la generación de esferoides hepáticos como se enumeran en la Tabla 1.
NOTA: El tampón de digestión y la solución de gradiente deben prepararse frescos. - Configure el sistema de perfusión que consiste en una bomba peristáltica, que conduce las soluciones desde el baño de agua a 42 °C hasta el hígado (Figura 1A). La temperatura más alta del baño de agua asegura que los tampones lleguen al hígado a la temperatura óptima de 37 °C. Personalícelo en función de la longitud del tubo y la temperatura ambiente (RT).
- Para la canulación, coloque una aguja de mariposa de 27 G en el extremo del tubo. Mantenga los medios de recubrimiento utilizados en los pasos finales de aislamiento a 4 °C.
- Procedimiento
- Precalentar las siguientes soluciones en el baño de agua a 42 °C en tubos de centrífuga de 50 mL: 40 mL de PBS, 20 mL de tampón de perfusión y 12 mL de tampón de digestión.
- Para limpiar y calentar los tubos de la bomba, haga circular aproximadamente 20 ml del PBS precalentado.
- Cambie el tubo al tampón de perfusión, cebe el tubo y la aguja de mariposa y ajuste el caudal a 4 mL/min. Asegúrese de que no haya burbujas en el tubo durante los cambios de búfer en todo el protocolo.
- Aplicar la eutanasia al ratón por dislocación cervical y usar agujas para fijar las extremidades a la tabla de disección.
- Humedecer el pelaje del abdomen con etanol al 70% y diseccionarlo para acceder a los órganos digestivos.
- Mueva los intestinos hacia la derecha para exponer la vena porta y la vena cava inferior (Figura 1B).
- Cánula de la vena cava aproximadamente a la mitad de su longitud con la aguja en posición horizontal, asegúrese de que esté estable y ponga en marcha la bomba.
- Cuando el hígado comience a inflarse, o aparezcan puntos blancos en los lóbulos más cercanos, corte la vena porta para permitir que la sangre y el tampón de perfusión drenen.
- El hígado debe comenzar a blanquearse inmediatamente. Fomente el aclarado con pinzas curvas para sujetar la vena porta a intervalos de 5 s.
- Repita el paso 1.2.9 hasta que el hígado esté amarillo y limpio de sangre (aprox. 15-20 ml de tampón de perfusión).
- Detenga la bomba peristáltica para cambiar el tubo al tampón de digestión y vuelva a encender la bomba. Cuando el tampón de digestión llegue al hígado, reduzca el caudal a 2,5 mL/min.
NOTA: El rojo de fenol en el tampón de digestión permite discriminar su llegada al hígado y permite el ajuste de los parámetros de la bomba durante el tratamiento. - Para favorecer que el tampón llegue a todos los lóbulos hepáticos y garantizar una digestión adecuada, repita el paso 1.2.9 varias veces.
- Detenga el flujo de la bomba peristáltica cuando el tampón de digestión se haya agotado o el hígado parezca suficientemente digerido.
NOTA: El grado de digestión se puede controlar visualmente pellizcando suavemente los lóbulos del hígado con pinzas y comprobando si aparecen pequeñas marcas en el tejido. El hígado también se volverá endeble. - Para extraer el hígado, se cortaron los ligamentos hepáticos y las conexiones dentro de la cavidad abdominal, con el objetivo de eliminarlo por completo, y se colocó en la placa de Petri que contenía 10 mL de medio de recubrimiento en frío (Tabla 1).
- Después de extraer la vesícula biliar, haga pequeños pellizcos en los lóbulos con pinzas, desgarrando ligeramente la cápsula hepática. Al agitar el hígado en el plato, observe las células que se vierten en el medio.
- Sosteniendo el hígado firmemente con fórceps, arrastre suavemente el elevador de células a lo largo de los lóbulos para liberar las células.
NOTA: La digestión interlobulillar correcta conducirá a la suspensión celular en el medio, no a fragmentos de tejido. - Con una pipeta serológica, recoja la suspensión celular de la placa de Petri y filtre a través del filtro celular de 70 μm colocado en un tubo de centrífuga de 50 mL. Utilice medios de recubrimiento nuevos para lavar el plato de células hepáticas digeridas y transferirlas al filtro.
- Centrifugar a 50 x g durante 5 min a 4 °C para peletizar las células.
- Retire el sobrenadante, dejando aproximadamente 1 mL para cubrir el pellet de la celda, agite el tubo para resuspender las células y luego agregue gradualmente 10 mL de medio de recubrimiento en frío.
- Agregue los 10 ml de solución de gradiente a la suspensión celular e invierta suavemente el tubo 10 veces.
- Centrifugar a 200 x g durante 10 min a 4 °C.
- El gránulo contiene células hepáticas viables enriquecidas para hepatocitos, mientras que el sobrenadante contiene células muertas y desechos. Deseche el sobrenadante con una pipeta serológica, dejando aproximadamente 1 mL, y vuelva a suspender el pellet mediante un suave remolino.
- Añadir 20 mL de medio de recubrimiento en frío a la suspensión celular y centrifugar a 50 x g durante 5 min a 4 °C para lavar la solución de gradiente.
- Retire el sobrenadante, dejando aproximadamente 1 mL por encima del pellet, y vuelva a suspender las células en 20 mL de medio de recubrimiento en frío.
NOTA: Aquí, el pellet de celda se puede compactar, por lo que, si es necesario, use una pipeta serológica de 10 mL para disociar suavemente las células. - Determine manualmente el número de células y la viabilidad utilizando una cámara de recuento de células y Trypan Blue.
NOTA: Las células de los hepatocitos se precipitarán rápidamente en el tubo; Para volver a suspenderlos, invierta suavemente el tubo unas cuantas veces. - Siembre las células hepáticas en 200 μL/pocillo de medio de siembra a 1200 células/pocillo en placas de adherencia ultrabaja de 96 pocillos.
NOTA: El volumen óptimo de medio por pocillo es de 200 μL; sin embargo, es posible sembrar células en 100 μL/pocillo. - Gire las placas a 200 x g durante 3 minutos para recoger las células en el centro de los pocillos.
- Incubar (37 °C, 5% CO2) las células y dejarlas formar esferoides durante 5 días (Figura 1C) de forma natural.
- El día 5, retire con cuidado la mitad del medio en el pocillo y reemplácelo con un medio de mantenimiento sin suero (Tabla 1). Repita este paso cada 48 h hasta el día 10, cuando los esferoides hepáticos estén listos para ser trasplantados.
NOTA: La formación de una estructura similar a una cápsula en esferoides hepáticos cultivados muestra una buena agregación y viabilidad.
2. Trasplante de esferoides hepáticos a la cámara anterior del ojo (ECA)
- Preparación
- Para el trasplante de esferoides hepáticos en la ECA, asegúrese de disponer de los siguientes recursos (Figura 2A): microscopio estereoscópico, unidad de anestesia con isoflurano, cámara de inducción, isoflurano, almohadilla térmica, placa base metálica hecha a medida, soporte para la cabeza del ratón y máscara antigás, pinzas fijadas a la junta universal sólida, jeringa de émbolo roscado Hamilton de 500 μL, silicona, polietileno y tubo de bomba, cánula de vidrio romo hecha a medida o catéter de 24 G, etanol 70%, solución salina estéril, agujas estériles de 23 G, ungüento oftálmico (parafina líquida y vaselina en proporción 1:1), jeringa desechable de 1 mL y plato de suspensión celular de 35 mm.
- Limpie la jeringa, el tubo y la cánula Hamilton pasando etanol al 70% y solución salina.
- Llene la jeringa, el tubo y la cánula de vidrio Hamilton con solución salina y fije la jeringa Hamilton al banco en posición horizontal con cinta adhesiva (Figura 2A).
- Utilice una cánula de vidrio romo hecha a medida.
- Alargue un capilar de vidrio de borosilicato con un extractor de micropipetas de doble etapa hasta un diámetro interior de >300 μm para permitir la aspiración de los esferoides.
- Biselar y desafilar la punta con un biselador de microelectrodos y exponer la punta de la cánula a una llama durante unos segundos para suavizar los bordes.
NOTA: La biseladora de microelectrodos consta de una piedra de lija giratoria que se opera manualmente; por lo tanto, la configuración específica no es aplicable.
- Alternativamente, construya una cánula utilizando la porción de plástico de un catéter de 24 G (Figura 2B).
- Prepare la unidad de isoflurano de anestesia y caliente la almohadilla térmica a 37 °C.
- Cubra las puntas de las pinzas unidas a la junta universal sólida con un trozo de tubo de polietileno para formar un bucle, que ayuda a estabilizar el ojo.
- Transfiera los esferoides hepáticos de la placa de 96 pocillos a una placa de suspensión celular de 35 mm con medios de mantenimiento utilizando una pipeta y una punta de 200 μL.
- Procedimiento
- Anestesiar al ratón en la cámara de inducción con una dosis de isoflurano al 2,5% y 280 mL/min de aire.
- Cuando el ratón esté inconsciente, baje la anestesia al 1,8% de isoflurano y 280 mL/min de aire, conecte el tubo de anestesia al soporte de la cabeza y transfiera rápidamente al animal a la almohadilla térmica, colocando la nariz dentro del soporte de la cabeza.
- Inmovilice la cabeza con los tornillos, saque suavemente el ojo de la cavidad y asegúrelo con las pinzas y coloque una gota de solución salina en ambos ojos para evitar que se seque.
- Bajo el estereoscopio, utilice la jeringa Hamilton para aspirar y recoger los esferoides hepáticos en la punta de la cánula y déjelos reposar horizontalmente sobre una superficie limpia.
NOTA: Los medios de aspiración junto con los esferoides hepáticos ayudan a evitar que se adhieran a las paredes de la cánula. - Perfore cuidadosamente la córnea con una aguja de 23 g y seque el humor acuoso que se filtra con un pañuelo de papel. Si es necesario, para ensanchar la incisión, deslice con cuidado la aguja hacia los lados para cortar la córnea.
NOTA: Se utiliza una aguja estéril de un solo uso para realizar la punción corneal, por lo que la córnea no se desinfecta antes de la incisión. - Agregue gotas de solución salina al ojo para evitar que se seque.
- Tome la cánula que contiene los esferoides hepáticos y sujétela verticalmente para permitir que los esferoides graviten hacia la punta de la cánula.
- Inserte suavemente la cánula en el orificio y, con el bisel dirigido hacia la pupila, utilice la jeringa Hamilton para expulsar lentamente los esferoides hepáticos en la ECA (Figura 2C).
NOTA: Antes de retirar la cánula, se recomienda esperar unos segundos para que las presiones del líquido dentro y fuera del ojo se reajusten y eviten que los esferoides se escapen fuera del ojo. - Desde el exterior de la córnea, coloque los esferoides hepáticos alrededor de la pupila y lejos de la incisión pinchando suavemente la córnea con la punta de la cánula (Figura 2C).
- Espere ~ 5-10 minutos para que los esferoides hepáticos se asienten en el iris antes de soltar el ojo de las pinzas.
- Aplique un ungüento oftálmico de vaselina en el ojo operado, que ayuda a lubricar y sanar la córnea.
- Si lo desea, proceda a operar el segundo ojo siguiendo el mismo método.
- Antes de despertar al ratón, administrar un analgésico para evitar molestias postoperatorias, por ejemplo, 0,1 mg/kg de buprenorfina en solución salina estéril, administrada por vía subcutánea.
NOTA: Solo se administró una dosis de analgésicos a los ratones, ya que se recuperaron rápidamente de este pequeño procedimiento y no mostraron ningún signo de dolor o comportamiento alterado. Dado que este procedimiento es muy rápido (dura menos de 10 minutos) y causa solo molestias menores, los ratones no requieren cuidados postoperatorios, aparte de la analgesia postoperatoria administrada antes de despertar al animal.
3. Imagen in vivo de esferoides hepáticos injertados en la ECA
- Preparación
- Preparar los siguientes materiales e instrumentos para la obtención de imágenes in vivo no invasivas de esferoides hepáticos injertados en ECA (Figura 3A): microscopio confocal vertical, objetivo de inmersión en agua a larga distancia de trabajo, unidad de anestesia con isoflurano, cámara de inducción, isoflurano, almohadilla térmica, placa base de metal hecha a medida, soporte para la cabeza del ratón y máscara antigás, pinzas unidas a la junta universal sólida, gel lagrimal artificial, ungüento para los ojos (parafina líquida y vaselina en proporción 1:1).
- Los materiales opcionales incluyen sondas fluorescentes inyectables, jeringas desechables y agujas de 27 G para inyección intravenosa en la cola.
- Procedimiento
- Anestesiar al ratón en la cámara de inducción con una dosis de isoflurano al 2,5% y 280 mL/min de aire.
- Cuando el ratón esté inconsciente, baje la anestesia al 1,8% de isoflurano y 280 mL/min de aire, conecte el tubo de anestesia al soporte de la cabeza y transfiera rápidamente al animal a la almohadilla térmica, colocando la nariz dentro del soporte de la cabeza.
- Inmovilice la cabeza en el soporte de la cabeza utilizando los tornillos.
- Coloque una gota de gel lagrimal artificial en ambos ojos para evitar que se sequen.
- En este punto, inyecte sondas fluorescentes por vía intravenosa a través de la vena de cola e imagen inmediatamente después.
- Inclina la cabeza, saca suavemente el ojo de la órbita y asegúralo con pinzas y colócalo en su posición debajo del objetivo.
- Aplique una cantidad generosa de gel lagrimal artificial para llenar el espacio entre la córnea y el objetivo y concéntrese en los esferoides hepáticos a través del ocular.
NOTA: Si es posible, retire el ocular de uno de los oculares para obtener una visión no ampliada y localizar más fácilmente los esferoides en el iris. - Para obtener imágenes de alta resolución a pesar de los movimientos respiratorios del animal, utilice objetivos de 25x y los siguientes ajustes de imagen: formato de 512 x 512 píxeles, velocidad de escaneo de 600 Hz y un grosor de pila Z de 3 μm. Consulte la configuración detallada de imágenes en la Tabla 2.
NOTA: A lo largo de las imágenes, la concentración de anestesia se ajusta de 1,6 a 2,2 mL/h de isoflurano para lograr un ritmo respiratorio poco profundo y controlado y, por lo tanto, minimizar el movimiento del animal. - Al final de la sesión de imagen, trate los ojos de la imagen con ungüento oftálmico de vaselina antes de retirar el isoflurano y despertar al animal.
Resultados Representativos
Las células hepáticas primarias, enriquecidas para hepatocitos, se aislaron del hígado de ratón mediante perfusión de colagenasa en dos pasos, utilizando una bomba peristáltica para hacer circular tampones calientes a través del hígado aprovechando la vasculatura del órgano para entregar enzimas de disociación a todas las células (Figura 1A). Para ello, se canuló la vena cava inferior y se cortó la vena porta para permitir el paso de los tampones (Figura 1B). Primero, se enjuagó un tampón basado en HBSS a través del hígado para eliminar la sangre. Si la canulación es exitosa y no hay coágulos de sangre, el hígado se blanquea y se vuelve amarillo en unos segundos. En segundo lugar, un tampón de digestión que contenía la mezcla de enzimas Liberasa circuló a través del hígado para disociar el tejido en una suspensión unicelular. Las células se contaron manualmente y se sembraron en placas de ultra baja adherencia (ULA) de 96 pocillos, lo que permite el autoensamblaje en esferoides en unos pocos días. En el día 5, se forman los esferoides, y la cápsula delgada que bordea los esferoides indica una agregación exitosa (Figura 1C). Esperamos hasta el día 10 para trasplantar, momento en el que los esferoides son compactos y han desarrollado fuertes conexiones célula-célula. El número de células sembradas por pocillo determinó el tamaño del esferoide hepático, con 1000, 1200 y 1500 células/pocillo con esferoides de 238 μm ± 10 μm, 248 μm ± 17 μm y 298 μm ± 19 μm (media ± DE) de diámetro, respectivamente (Figura 1C, D). Para el trasplante, seleccionamos esferoides de aproximadamente 250 μm de diámetro por las siguientes razones: (1) el tamaño de los esferoides no debe ser demasiado grande para evitar la hipoxia y el núcleo necrótico, pero debe contener suficientes células para soportar las comunicaciones célula-célula y permitir la remodelación del injerto en el ojo, (2) el peso de los esferoides de este tamaño les permite gravitar hacia el iris y mejorar su injerto, (3) Este tamaño es apropiado en relación con el trasplante de 5-10 esferoides por ojo de ratón.
La cirugía de trasplante requiere una jeringa de rosca manual conectada a una cánula de vidrio (Figura 2A). La cánula de vidrio consta de un capilar de vidrio de borosilicato modificado internamente para tener una punta roma fina utilizando un extractor y biselador de micropipetas. Se puede crear una cánula alternativa más sencilla utilizando un catéter de plástico disponible en el mercado conectado al tubo de la jeringa y estabilizado en una punta de pipeta (Figura 2B). La cirugía consiste en la inoculación de esferoides hepáticos en la ECA a través de una incisión en la córnea (Figura 2C). Los esferoides se colocaron en los bordes de la pupila para hacerlos más accesibles para la obtención de imágenes y evitar que se movieran hacia el ángulo ocular. Se utilizaron ratones albinos para el trasplante, ya que su iris no pigmentado permite la obtención de imágenes in vivo de los esferoides hepáticos injertados. Los ratones receptores se trasplantaron a ambos ojos con 7-10 esferoides/ojo, y se tomaron imágenes estereoscópicas a los 3 días después del trasplante (post-Tx), así como a 1 semana y 1 mes después de la transmisión para documentar la cicatrización de la córnea y el éxito del injerto esferoide (Figura 2D). Cabe destacar que el cambio en la apariencia de los esferoides hepáticos en el ECA entre el recién trasplantado y el injerto completo se debe al asentamiento del injerto en el iris, así como al crecimiento de una monocapa de células del iris sobre el esferoide. La tasa de éxito del injerto de esferoides hepáticos en la ECA es del 70% (n = 9 ojos en ratones machos y hembras) (Figura 2E). Los primeros días después de la transmisión son los más críticos para la supervivencia y el injerto, probablemente debido a que el animal receptor se frota los ojos y desaloja los esferoides antes de que la córnea se haya curado. El tamaño de los esferoides hepáticos no difiere significativamente después de la transmisión y los cambios en la forma se atribuyen a la remodelación y el injerto del injerto (Figura 2F). A 1 mes después de la Tx, todos los esferoides injertados presentes en el iris fueron vascularizados e inervados, como se muestra mediante tinción de inmunofluorescencia (Figura 2G).
Las imágenes in vivo no invasivas se realizan en ratones receptores anestesiados utilizando un microscopio confocal vertical y un objetivo de inmersión a larga distancia (Figura 3A, Tabla 2). Las imágenes de fluorescencia en el ACE se pueden lograr a través de diferentes enfoques, como se muestra en la Figura 3B. La inyección de sondas fluorescentes en la circulación del ratón receptor permite la visualización de diferentes tipos de células y estructuras dentro de los esferoides. Utilizamos lectina para marcar los vasos sanguíneos (Figura 3C), CMFDA para observar la red de canalículos biliares (Figura 3D) y pHrodo-LDL, que confirmó la absorción activa de LDL en las células esferoides (Figura 3E). También se pueden utilizar esferoides hepáticos generados a partir de modelos de ratones reporteros. Los esferoides de albúmina-Cre:tdTomate permitieron el marcaje y seguimiento de los hepatocitos (Figura 3F), y los esferoides que expresan el biosensor Fluorescente del Indicador del Ciclo Celular de Ubiquitina (FUCCI) para visualizar la dinámica del ciclo celular a una resolución de una sola célula (Figura 3G). Por último, los esferoides hepáticos pueden ser modificados genéticamente in vitro antes del trasplante y, en el caso de la transducción adenoasociada virus-GFP, la expresión se observó in vivo durante más de 6 meses (Figura 3H).
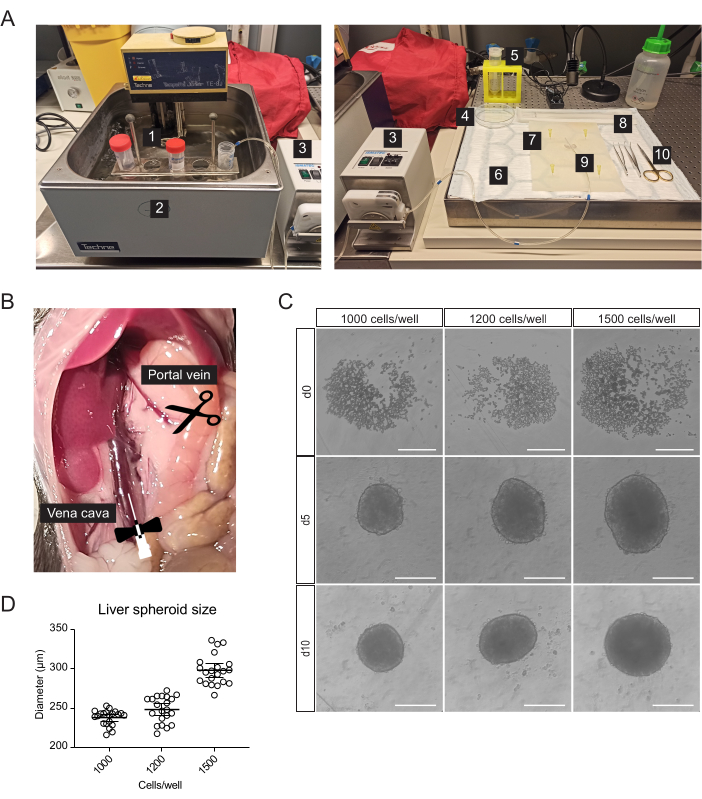
Figura 1: Aislamiento de hepatocitos primarios de ratón y generación de esferoides hepáticos. (A) Material y equipo utilizado para el aislamiento de hepatocitos primarios de ratón: 1. Tampones de aislamiento; 2. Baño de agua; 3. Bomba peristáltica; 4. Placa de Petri; 5. Filtro de células; 6. Almohadilla absorbente; 7. Alfombra de disección; 8. Elevador de células; 9. Aguja de mariposa 27 G; 10. Herramientas de disección. (B) Cavidad abdominal durante la cirugía: la vena cava se canula y se perfunde, y la vena porta se corta para permitir el flujo de los tampones. (C) Imágenes de campo claro de la formación de esferoides hepáticos in vitro a los 0 (d0), 5 (d5) y 10 (d10) días después de la siembra, barras de escala = 200 μm. (D) Tamaño del esferoide hepático a diferentes concentraciones de siembra celular, n = 21 esferoides. Haga clic aquí para ver una versión más grande de esta figura.
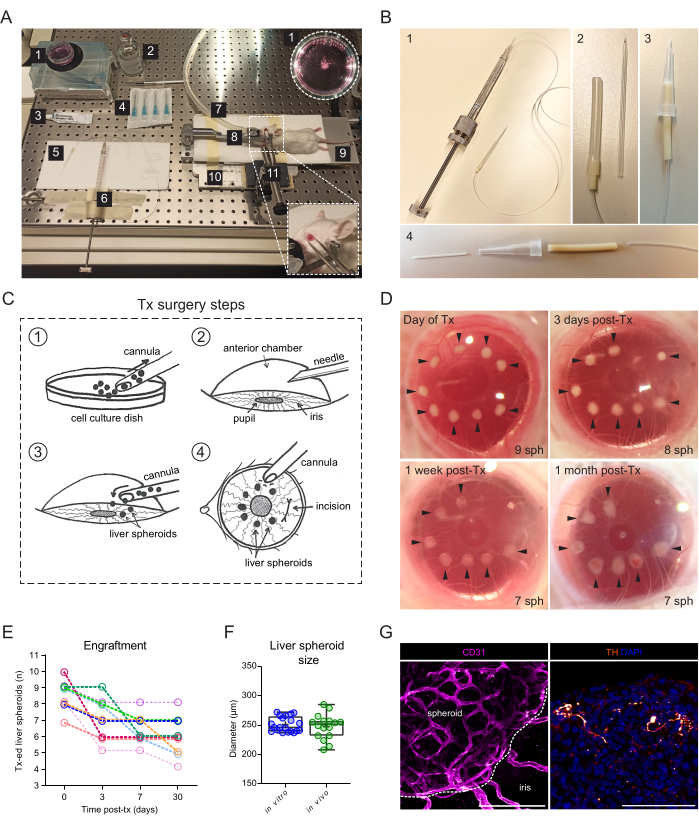
Figura 2: Trasplante e injerto de esferoides hepáticos en la ECA de ratones. (A) Materiales y equipos utilizados para el trasplante (Tx) de esferoides hepáticos en la ACE: 1. Esferoides hepáticos en placa de cultivo; 2. Solución salina estéril; 3. Ungüento para los ojos; 4. Agujas 23 g; 5. Cánula; 6. Jeringa Hamilton; 7. Tubo de gas de anestesia; 8. Soporte para la cabeza y máscara antigás; 9. Almohadilla térmica; 10. Placa base de metal hecha a medida; 11. Pinzas y junta universal sólida. (B) Configuración de la cánula y la jeringa Hamilton: 1. Cánula de vidrio conectada a la jeringa Hamilton a través de un tubo Portex y una aguja de 27G; 2. La cánula de vidrio se conecta a la tubería Portex a través de segmentos adicionales de tubería de silicona y tubería PharMed; 3. Cánula de plástico ensamblada alternativa; 4. Partes que forman la cánula de plástico: Catéter de plástico BD Insyte de 24G conectado a través de un tubo PharMed y revestido con una punta de pipeta recortada de 10 μl para mayor estabilidad y agarre. (C) Ilustración de los pasos de la cirugía Tx: 1. Los esferoides se recogen en la cánula; 2. Se perfora la córnea con una aguja; 3. La cánula se inserta en la incisión y los esferoides se liberan en la ECA; 4. Desde el exterior del ojo, los esferoides se colocan cerca de la pupila y lejos de la incisión. (D) Imágenes estereoscópicas de esferoides hepáticos (sph) en el ojo del ratón el día de la cirugía y a los 3, 7 y 30 días después de la Tx. Las flechas indican esferoides viables. (E) Tasa de injerto de esferoide hepático (tamaño de 1200 células/pocillo) post-Tx, n = 9 ojos en 6 ratones receptores. (F) Tamaño de los esferoides hepáticos en cultivo, antes del trasplante (in vitro, n= 20 esferoides de una sola preparación) y a 1 mes post-Tx en el ECA (in vivo, n= 16 esferoides en 3 ratones receptores), calculado promediando diámetros verticales y horizontales. (G) Tinción por inmunofluorescencia de esferoides hepáticos injertados a los 2 meses post-Tx, que muestra vascularización (CD31, rosa, línea discontinua delinea la masa esferoide) e inervación simpática (tirosina hidroxilasa (TH), naranja), barra de escala = 100 μm. Los datos del panel F han sido adaptados con permiso de Lazzeri-Barceló et al.10. Haga clic aquí para ver una versión más grande de esta figura.
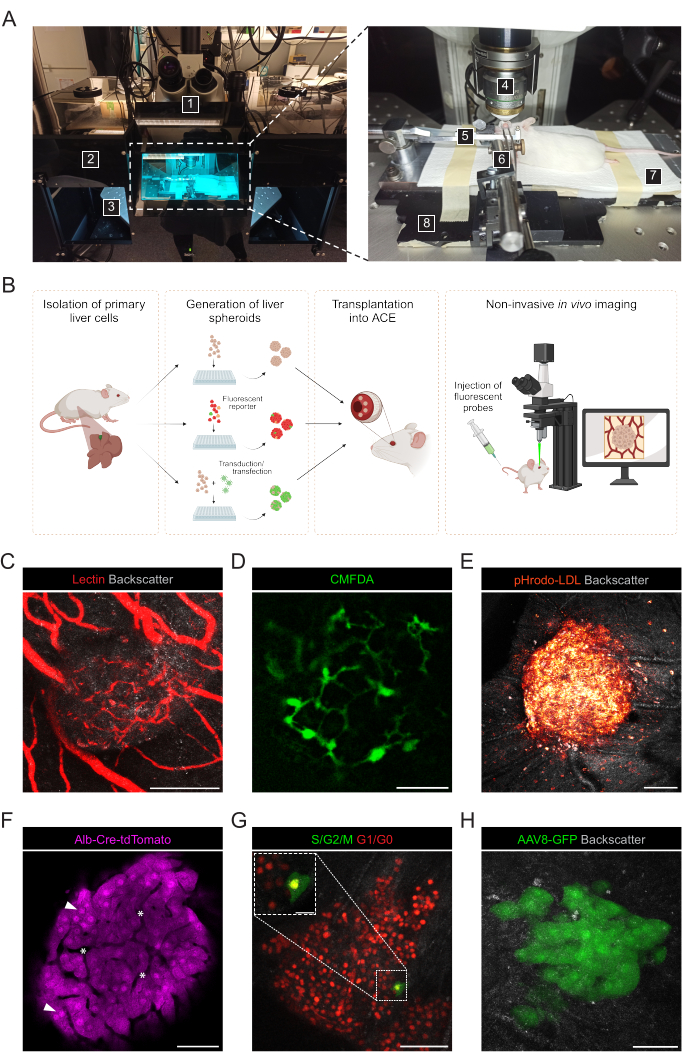
Figura 3: Imágenes intraoculares in vivo no invasivas de esferoides hepáticos injertados. (A) Material y equipo utilizado para la obtención de imágenes ACE in vivo : 1. Microscopio confocal de barrido láser vertical; 2. Caja oscura; 3. Etapa XYZ motorizada; 4. Objetivo de inmersión; 5. Soporte para la cabeza y máscara antigás; 6. Pinzas y junta universal sólida; 7. Almohadilla térmica; 8. Placa base de metal hecha a medida. (B) Diagrama que representa los diferentes enfoques utilizados para la obtención de imágenes in vivo de lecturas fluorescentes en esferoides hepáticos injertados en el ojo. (C-H) Imágenes representativas de esferoides hepáticos ECA durante la obtención de imágenes in vivo mediante microscopía confocal. La señal de retrodispersión se utiliza para observar el volumen y la estructura del esferoide; (C) Vasos sanguíneos marcados por inyección intravenosa de lectina fluorescente, barra de escala = 100 μm; (D) Red de canalículos biliares marcados por inyección de CMFDA fluorescente, barra de escala = 50 μm; (E) Absorción de LDL por inyección de sonda fluorescente pHrodo-LDL, barra de escala = 100 μm; (F) Hepatocitos que expresan tomate Td, las puntas de flecha indican núcleos y los asteriscos indican vasculatura intraesferoide, barra de escala = 50 μm; (G) Monitorización de la dinámica del ciclo celular en esferoides hepáticos que expresan FUCCI, barras de escala = 50 μm (imagen principal) y 20 μm (inflado). (H) esferoides hepáticos transducidos in vitro con AAV8-GFP antes de Tx y tomados en imágenes en el ojo a los 6 meses después de Tx, barra de escala = 50 μm. La imagen del panel G ha sido adaptada con permiso de Lazzeri-Barceló et al.10. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Soluciones utilizadas para el aislamiento de hepatocitos primarios de ratón. Composición de las soluciones y tampones necesarios para el aislamiento de hepatocitos de ratón. El tampón de digestión y los componentes de la solución de gradiente deben mezclarse frescos el día del aislamiento. Haga clic aquí para descargar esta tabla.
Tabla 2. Configuración de microscopio confocal Leica SP5 utilizada para la obtención de imágenes intraoculares in vivo de esferoides hepáticos. La tabla ha sido adaptada con permiso de Lazzeri et al.10. Haga clic aquí para descargar esta tabla.
Discusión
Este protocolo describe una nueva plataforma para la obtención de imágenes intraoculares in vivo de esferoides hepáticos injertados en la ECA. El ECA se ha utilizado previamente como sitio de trasplante de otros microtejidos derivados de órganos, como los islotes pancreáticos11,12, debido a su microambiente de injerto único, rico en vasos, nervios y oxígeno, y al acceso a las imágenes a través de la córnea. Si bien las imágenes hepáticas intravitales permiten la visualización de células y procesos in situ, la monitorización longitudinal no es posible. Las imágenes del hígado a través de una ventana abdominal implican una cirugía compleja, y el movimiento del órgano dentro del cuerpo dificulta el seguimiento de una sola célula a lo largo del tiempo. Por lo tanto, este novedoso método de imagen permite la monitorización longitudinal no invasiva de las células hepáticas con una resolución de una sola célula.
Este protocolo se divide en tres partes. El primero es el aislamiento de los hepatocitos primarios mediante perfusión de colagenasa en dos etapas, adaptado de Charni-Natan et al.13, con la diferencia de que realizamos la perfusión hepática en el ratón muerto en lugar de en los animales vivos anestesiados. Esta variación trae ciertas ventajas, como menos consideraciones éticas y la evitación de residuos de anestesia en el organismo. En este trabajo, generamos esferoides hepáticos a partir de la fracción enriquecida con hepatocitos del aislamiento, pero esto no excluye el potencial de aislar otras poblaciones celulares no parenquimatosas utilizando otros protocolos especializados para hacer esferoides de cocultivo de composición diversa14,15.
La segunda parte de este protocolo consiste en el trasplante de los esferoides hepáticos en la ECA de los ratones receptores. Se trata de una cirugía rápida (menos de 10 min) y sencilla realizada en ratones anestesiados y que no requiere ningún tratamiento postoperatorio. La punción de la córnea se autosella y se cura en 3-5 días. Ocasionalmente, durante el proceso de curación, se observan algunas novatadas alrededor de la incisión, pero esto desaparece a los pocos días. No hemos experimentado casos de sinequia anterior en los ojos de animales operados. Realizamos los procedimientos de trasplante en un laboratorio limpio pero al aire libre y sin problemas de infecciones en los ojos operados. La inoculación e injerto de esferoides en el ojo no compromete la visión ni altera el comportamiento del animal receptor. En este protocolo, utilizamos anestesia con isoflurano tanto para la cirugía de trasplante como para la obtención de imágenes in vivo , que es bien tolerada en ratones. Debido a su efecto dependiente de la dosis, se puede ajustar fácilmente a lo largo de los procedimientos y tiene la ventaja de reducir los tiempos de sueño y despertar. Sin embargo, se pueden utilizar anestésicos inyectables alternativos. Después del trasplante, generalmente dejamos pasar 1 mes para que los esferoides se injerten completamente, se vascularicen y se inerven, antes de realizar intervenciones de tratamiento e imágenes in vivo . También hemos demostrado que el trasplante y el injerto son posibles utilizando esferoides hepáticos humanos y ratones receptores inmunocomprometidos10.
La tercera parte de este método es la obtención de imágenes in vivo de los esferoides hepáticos injertados en la ECA. Este protocolo describe la configuración de imágenes in vivo, que utiliza equipos de microscopía que se encuentran comúnmente en las instalaciones de imágenes de investigación. Además, los materiales especializados, como el soporte para la cabeza del ratón y la cánula de plástico, ahora están disponibles comercialmente. Con esta configuración de imágenes, podemos capturar secciones z y obtener una reconstrucción tridimensional de la arquitectura del esferoide, dependiendo de la profundidad de penetración del láser y la detección de fluorescencia. El monitoreo de la función celular en los esferoides hepáticos injertados se basa en la visualización de proteínas fluorescentes que informan sobre los tipos de células, las funciones celulares y la dinámica. Por lo tanto, esta plataforma de imágenes se puede explotar utilizando diferentes modalidades, solas o en combinación: (1) Las sondas fluorescentes se pueden administrar por vía intravenosa, por ejemplo, anticuerpos para marcar y rastrear células, así como colorantes funcionales; (2) Los esferoides hepáticos se pueden generar a partir de células aisladas de modelos de ratón reporteros que expresan proteínas fluorescentes específicas del hígado, por ejemplo, esferoides hepáticos FUCCI que informan sobre la dinámica del ciclo celular; (3) La formación de esferoides hepáticos in vitro puede combinarse con la transfección o la transducción, para equipar a los esferoides con proteínas fluorescentes y biosensores. por ejemplo, virus adenoasociados. En nuestros entornos experimentales y mediante el uso de un solo fotón para la excitación, la profundidad de imagen que es posible alcanzar es de aproximadamente 60-100 μm. Sin embargo, esto depende de la potencia del láser y de la disponibilidad de imágenes multifotónicas, de las características de emisión de la sonda de fluorescencia y de la sensibilidad de los detectores, así como del ángulo del ojo en el que se injerta el esferoide. Después de la adquisición de imágenes, el análisis de imágenes posteriores se puede realizar utilizando programas populares como Image J e Imaris. Por ejemplo, en el caso del reportero FUCCI, las células activas del ciclo celular en verde se pueden contar y contrastar con el número total de glóbulos rojos para evaluar la actividad del ciclo celular dentro del esferoide injertado. Además, la plataforma de imágenes ACE permite aplicar sustancias en el ojo (en forma de gotas oftálmicas) o inyectarlas directamente en el ACE para tratar el injerto y controlar su reacción. Los esferoides trasplantados post-mortem pueden recuperarse fácilmente mediante microdisección manual y pueden aportar información valiosa mediante técnicas ex vivo, como tinción de inmunofluorescencia, análisis transcriptómico, etcétera10.
Esta técnica tiene ciertas limitaciones. La primera es que, según nuestra experiencia, los ratones receptores deben ser albinos, es decir, tener el iris no pigmentado. Tras el injerto, los esferoides hepáticos quedan cubiertos por una monocapa de células del iris, lo que no afecta a la viabilidad ni a la función de los esferoides, pero el pigmento de las células del iris impide la obtención de imágenes. Una segunda consideración es la estabilidad durante la obtención de imágenes intraoculares en ratones anestesiados. Durante las sesiones de imágenes in vivo , la concentración de anestesia y la respiración del animal deben ser monitoreadas de cerca para minimizar el movimiento. Sin embargo, utilizando la configuración de imagen indicada aquí, podemos lograr imágenes de alta resolución a nivel de una sola célula.
En resumen, este protocolo describe la implementación de una plataforma de imagen in vivo no invasiva de tejido similar al hígado injertado en los ojos de ratones. Utilizamos procedimientos sencillos, equipos comunes y materiales asequibles, lo que lo convierte en un enfoque asequible para muchos investigadores. Este modelo combina las ventajas de los esferoides hepáticos en 3D in vitro con el entorno in vivo y la accesibilidad óptica proporcionada por el ACE para crear una valiosa plataforma para el estudio de la fisiología y la patología hepática en investigación básica y entornos preclínicos.
Divulgaciones
P-OB es el cofundador y director ejecutivo de Biocrine AB, IBL y BL son consultores de Biocrine AB.
Agradecimientos
Este trabajo contó con el apoyo de la Asociación Sueca de Diabetes, los fondos del Instituto Karolinska, el Consejo Sueco de Investigación, la Fundación Novo Nordisk, la Fundación Familia Erling-Persson, el Programa de Investigación Estratégica en Diabetes del Instituto Karolinska, la Fundación Familia Knut y Alice Wallenberg, la Fundación Jonas y Christina af Jochnick, la Asociación Sueca de Diabetología y ERC-2018-AdG 834860-EYELETS. Los dibujos de las figuras fueron creados por FL-B utilizando BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 27 G butterfly needle | Venofix | 4056388 | |
| AAV8-CAG-GFP | Charles River | CV17169-AV9 | Incubated with isolated hepatocytes at 1 µL/mL during liver spheroid formation |
| Absolute and 70% ethanol | N/A | N/A | |
| Absorbent pad | Attends | 203903 | |
| Albumin-Cre;RCL-tdTomato (B6.Cg-Speer6-ps1Tg(Alb-cre)21Mgn/J ; B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J) | Jackson | #003574 and #007914 | Mice obtained from in-house breeding |
| B6 albino mice (B6(Cg)-Tyrc-2J/J) | Jackson | #000058 | Mice obtained from in-house breeding |
| B6;129P2-Gt(ROSA)26Sor[tm1(CAG-Venus/GMNN,-Cherry/CDT1)Jkn]/JknH | INFRAFRONTIER/EMMA | EM:08395 | Mice obtained from in-house breeding |
| BD Insyte IV Catheter 24 G x 0.75 in | BD Medical | 381212 | |
| Borosillicate standard glass cappilaries | World Precision Instruments | 1B150-4 | |
| Cell lifter | Corning | 3008 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Custom-made metal plate | Hardware store | N/A | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dual-Stage Glass Micropipette Puller | Narshige | Model PC-100 | |
| EDTA | Sigma-Aldrich | E9884 | |
| Electric heating pad | Hardware store | N/A | |
| FBS | Gibco | N/A | |
| GlutaMAX | Gibco | 35050061 | |
| Green CMFDA | Abcam | ab145459 | Reconstituted in DMSO, administered at 100 µg/mouse in PBS 10% FBS |
| Hamilton syringe | Hamilton | 81242 | Model 1750 Luer Tip Threaded Plunger Syringe, 500 µL |
| HBSS; no calcium, no magnesium and no phenol red | Gibco | 14175095 | |
| HCX IRAPO L 25x/0.95 W objective | Leica | N/A | |
| HEPES | Gibco | 15630080 | |
| Induction chamber 0.8 L | Univentor | 8329001 | |
| Insulin-Transferrin-Selenium (ITS-G) | Gibco | 41400045 | |
| Isoflurane | Baxter | N/A | |
| Lectin DyLight-649 | Invitrogen | L32472 | Administered at 1 mg/mL and 100 µL/mouse |
| Liberase TM Research Grade | Sigma-Aldrich | 5401127001 | |
| Microelectrode beveler | World Precision Instruments | Model BV-10 | |
| Mouse head-holder and gas mask | Narshige | Model SGM-4 | |
| Nunclon Sphera 96-Well, U-Shaped-Bottom Microplate | Thermo Fisher | 174929 | |
| Oculentum simplex | APL | N/A | |
| PBS 10x | Gibco | 14080055 | |
| PBS 1x; no calcium, no magnesium | Gibco | 14190144 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Percoll | Sigma-Aldrich | P1644 | |
| Peristaltic pump | Ismatec | Model ISM795 | |
| PharMed BPT Pump Tubing | VWR | VERN070540-07 | Inner diameter 0.76 mm, outer diameter 2.46 mm |
| pHrodo Red-LDL | Invitrogen | L34356 | Administered at 1 mg/mL and 100 µL/mouse |
| Portex Fine Bore Polyethylene Tubing | Smiths Medical | 800/100/140 | Inner diameter 0.4 mm, outer diameter 0.8 mm |
| Silicone dissection mat | Hardware store | N/A | |
| Sodium chloride 0.9% | Braun | N/A | |
| Solid Universal Joint | Narshige | Model UST-2 | |
| Stereomicroscope | Leica | Model M80 | |
| Suspension culture dish 35 mm | Sarstedt | 833900500 | |
| Temgesic | Indivor | N/A | Administered s.c. at 0.05 mg/mL and 2 µL/g mouse |
| Translucent Silicone Tubing | VWR | 228-1450 | Inner diameter 1.5 mm, outer diameter 3 mm |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Univentor 400 Anesthesia unit | Univentor | 8323001 | |
| Upright laser scanning confocal microscope | Leica | Model TCS SP5 II | |
| Viscotears | Novartis | N/A | |
| William's E Medium; no glutamine, phenol red | Gibco | 22551089 |
Referencias
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Sci Rep. 6, 25187 (2016).
- Lauschke, V. M., et al. Massive rearrangements of cellular MicroRNA signatures are key drivers of hepatocyte dedifferentiation. Hepatology. 64 (5), 1743-1756 (2016).
- Oliva-Vilarnau, N., Vorrink, S. U., Ingelman-Sundberg, M., Lauschke, V. M. A 3D cell culture model identifies Wnt/beta-catenin mediated inhibition of p53 as a critical step during human hepatocyte regeneration. Adv Sci (Weinh). 7 (15), 2000248 (2020).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964 (2020).
- Kozyra, M., et al. Human hepatic 3D spheroids as a model for steatosis and insulin resistance. Sci Rep. 8 (1), 14297 (2018).
- Lauschke, V. M., Shafagh, R. Z., Hendriks, D. F. G., Ingelman-Sundberg, M. 3D primary hepatocyte culture systems for analyses of liver diseases, drug metabolism, and toxicity: Emerging culture paradigms and applications. Biotechnol J. 14 (7), e1800347 (2019).
- Shibuya, K., et al. The efficacy of the hepatocyte spheroids for hepatocyte transplantation. Cell Transplant. 30, 9636897211000014 (2021).
- Hamazaki, K., Doi, Y., Koide, N. Microencapsulated multicellular spheroid of rat hepatocytes transplanted intraperitoneally after 90% hepatectomy. Hepatogastroenterology. 49 (48), 1514-1516 (2002).
- Marques, P. E., et al. Imaging liver biology in vivo using conventional confocal microscopy. Nat Protoc. 10 (2), 258-268 (2015).
- Lazzeri-Barcelo, F., et al. Intraocular liver spheroids for noninvasive high-resolution in vivo monitoring of liver cell function. Nat Commun. 15 (1), 767 (2024).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Mol Metab. 6 (9), 1002-1009 (2017).
- Charni-Natan, M., Goldstein, I. Protocol for Primary Mouse Hepatocyte Isolation. STAR protocols. 1 (2), 100086 (2020).
- Baze, A., et al. Three-dimensional spheroid primary human hepatocytes in monoculture and coculture with nonparenchymal cells. Tissue Eng Part C Methods. 24 (9), 534-545 (2018).
- Mohar, I., Brempelis, K. J., Murray, S. A., Ebrahimkhani, M. R., Crispe, I. N. Isolation of nonparenchymal cells from the mouse liver. Methods Mol Biol. 1325, 3-17 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados