Fenotipado basado en imágenes de alto rendimiento para determinar las respuestas morfológicas y fisiológicas a estreses simples y combinados en patata
En este artículo
Resumen
Diseñamos un protocolo de fenotipado basado en imágenes para determinar las respuestas morfológicas y fisiológicas a tratamientos únicos y combinados de calor, sequía y encharcamiento. Este enfoque permitió la identificación de respuestas tempranas, tardías y de recuperación a nivel de toda la planta, particularmente en las partes aéreas, y destacó la necesidad de utilizar múltiples sensores de imagen.
Resumen
El fenotipado basado en imágenes de alto rendimiento es una herramienta poderosa para determinar de manera no invasiva el desarrollo y el rendimiento de las plantas en condiciones específicas a lo largo del tiempo. Mediante el uso de múltiples sensores de imagen, se pueden evaluar muchos rasgos de interés, incluida la biomasa de las plantas, la eficiencia fotosintética, la temperatura del dosel y los índices de reflectancia de las hojas. Las plantas están frecuentemente expuestas a múltiples estreses en condiciones de campo donde las olas de calor severas, las inundaciones y los eventos de sequía amenazan seriamente la productividad de los cultivos. Cuando las tensiones coinciden, los efectos resultantes en las plantas pueden ser distintos debido a interacciones sinérgicas o antagónicas. Para dilucidar cómo responden las plantas de papa a estreses simples y combinados que se asemejan a escenarios de estrés que ocurren naturalmente, se impusieron cinco tratamientos diferentes a un cultivar de papa seleccionado (Solanum tuberosum L., cv. Lady Rosetta) al inicio de la tuberización, es decir, control, sequía, calor, anegamiento y combinaciones de estrés por calor, sequía y anegamiento. Nuestro análisis muestra que el estrés por encharcamiento tuvo el efecto más perjudicial en el rendimiento de la planta, lo que llevó a respuestas fisiológicas rápidas y drásticas relacionadas con el cierre de los estomas, incluida una reducción en el rendimiento cuántico y la eficiencia del fotosistema II y un aumento en la temperatura del dosel y el índice de agua. Bajo tratamientos térmicos y de estrés combinados, la tasa de crecimiento relativo se redujo en la fase temprana del estrés. Bajo sequía y estreses combinados, el volumen de la planta y el rendimiento fotosintético disminuyeron con un aumento de la temperatura y el cierre de los estomas en la fase tardía del estrés. La combinación del tratamiento optimizado del estrés en condiciones ambientales definidas junto con protocolos de fenotipado seleccionados permitió revelar la dinámica de las respuestas morfológicas y fisiológicas a estreses simples y combinados. Aquí, se presenta una herramienta útil para los investigadores de plantas que buscan identificar los rasgos de las plantas indicativos de resiliencia a varios estreses relacionados con el cambio climático.
Introducción
Los efectos potenciales del cambio climático, incluido el aumento de la intensidad y la frecuencia de las olas de calor, las inundaciones y las sequías, tienen impactos negativos en los cultivosen crecimiento 1. Es importante comprender la influencia del cambio climático en la variabilidad de los cultivos y las consecuentes fluctuaciones en la producción anual de cultivos2. Con el aumento de la población y la demanda de alimentos, mantener el rendimiento de las plantas de cultivo es un desafío, por lo tanto, se requiere urgentemente encontrar cultivos resistentes al clima para el mejoramiento 3,4. La papa (Solanum tuberosum L.) es uno de los cultivos alimentarios esenciales que contribuye a la seguridad alimentaria mundial debido a su alto valor nutricional y mayor eficiencia en el uso del agua. Sin embargo, la reducción del crecimiento y del rendimiento en condiciones desfavorables es un problema principal, particularmente en las variedades susceptibles 5,6. Muchos estudios destacaron la importancia de investigar enfoques alternativos para mantener la productividad del cultivo de papa, incluyendo prácticas agrícolas, encontrando genotipos tolerantes y entendiendo el impacto del estrés en el desarrollo y el rendimiento 7,8,9, que también es muy demandado por los productores (o agricultores) europeos de papa10.
Las plataformas de fenotipado automatizado, incluido el fenotipado basado en imágenes, permiten los análisis cuantitativos de la estructura y función de la planta que son esenciales para seleccionar rasgos relevantes de interés11,12. El fenotipado de alto rendimiento es una técnica avanzada y no invasiva para determinar diversos rasgos morfológicos y fisiológicos de interés de forma reproducible y rápida 13. A pesar de que el fenotipo refleja diferencias genotípicas en relación con los efectos ambientales, la comparación de plantas en condiciones controladas con estrés permite vincular la extensa información fenotípica con una condición específica (estrés)14. El fenotipado basado en imágenes es esencial para describir la variabilidad fenotípica, y también es capaz de detectar un conjunto de rasgos a lo largo del desarrollo de la planta, independientemente del tamaño de la población15. Por ejemplo, la medición de los rasgos morfológicos, incluida la forma, el tamaño y el índice de color de las hojas mediante sensores de imágenes Rojo-Verde-Azul (RGB), se utiliza para determinar el crecimiento y el desarrollo de las plantas. Además, las mediciones de los rasgos fisiológicos, incluido el rendimiento fotosintético, la temperatura del dosel y la reflectancia de las hojas, se cuantifican utilizando múltiples tipos de sensores, como la fluorescencia de clorofila, el infrarrojo térmico (IR) y las imágenes hiperespectrales16. Estudios recientes en ambientes controlados mostraron el potencial del uso del fenotipado basado en imágenes para evaluar diferentes mecanismos y respuestas fisiológicas de plantas bajo estreses abióticos como el calor en la papa17, la sequía en la cebada18, el arroz19 y los tratamientos combinados de sequía y calor en el trigo20. A pesar de que el estudio de las respuestas de las plantas a múltiples interacciones de estrés es complejo, los hallazgos revelan nuevos conocimientos en la comprensión de los mecanismos de las plantas para hacer frente a los rápidos cambios en las condiciones climáticas21.
Las respuestas fisiológicas y morfológicas de las plantas están directamente influenciadas por las condiciones de estrés abiótico (altas temperaturas, déficit hídrico e inundaciones), lo que resulta en una reducción del rendimiento22. A pesar de que las papas tienen una alta eficiencia en el uso del agua en comparación con otros cultivos, el déficit de agua afecta negativamente la cantidad y calidad del rendimiento debido a la arquitectura de las raíces poco profundas5. Dependiendo de la intensidad y duración del nivel de sequía, el índice de área foliar se reduce, y el retraso en el crecimiento del dosel con inhibición de la formación de nuevas hojas es pronunciado durante las etapas posteriores del estrés, lo que lleva a una reducción en la tasa fotosintética23. El nivel umbral de agua es crítico con exceso de agua o períodos de sequía prolongados, lo que resulta en un efecto negativo en el crecimiento de las plantas y el desarrollo de los tubérculos debido a la limitación de oxígeno, la disminución de la conductividad hidráulica de las raíces y la restricción del intercambio de gases24,25. Además, las papas son sensibles a las altas temperaturas, donde las temperaturas por encima de los niveles óptimos dan como resultado un retraso en las tasas de iniciación, crecimiento y asimilación de los tubérculos26. Cuando los estreses aparecen en combinación, las regulaciones bioquímicas y las respuestas fisiológicas difieren de las respuestas individuales al estrés, lo que pone de relieve la necesidad de investigar las respuestas de las plantas a las combinaciones de estrés27. Las tensiones combinadas pueden dar lugar a reducciones (aún más) graves en el crecimiento de las plantas y efectos determinantes en los rasgos relacionados con la reproducción28. El impacto de la combinación de estrés depende de la dominancia de cada estrés sobre los demás, lo que lleva a una respuesta mejorada o suprimida de la planta (por ejemplo, la sequía generalmente conduce al cierre de los estomas mientras los estomas están abiertos para permitir el enfriamiento de la superficie de la hoja bajo estrés térmico). Sin embargo, la investigación combinada sobre el estrés aún está emergiendo, y se requieren más investigaciones para comprender mejor la compleja regulación que media las respuestas de las plantas en estas condiciones29. Por lo tanto, este estudio tiene como objetivo resaltar y recomendar un protocolo de fenotipado utilizando múltiples sensores de imagen que pueden ser adecuados para evaluar las respuestas morfofisiológicas y comprender los mecanismos subyacentes del rendimiento general de la papa bajo tratamientos de estrés únicos y combinados. Según la hipótesis, la combinación de múltiples sensores de imagen demostró ser una herramienta valiosa para caracterizar las estrategias tempranas y posteriores durante la respuesta al estrés de las plantas. La optimización del protocolo de fenotipado basado en imágenes será una herramienta interactiva para que los investigadores y mejoradores de plantas encuentren rasgos de interés para la tolerancia al estrés abiótico.
Protocolo
1. Preparación del material vegetal y condiciones de crecimiento
- Trasplante in vitro de esquejes de papa (Solanum tuberosum L., cv. Lady Rosetta) de cultivo de tejidos a macetas de 250 mL.
- Llena las macetas con Klasmman Substrate 2 completamente saturado y mantenlas en la cámara de crecimiento en condiciones de poca luz durante 1 semana.
- Ajuste las condiciones de luz en el nivel del dosel a 160 μmol·m-2·s-1 con una combinación de 25% de luz blanca y 35% de infrarrojos utilizando un fotómetro.
- Trasplante las plantas después de 10 días de crecimiento de los esquejes in vitro en tierra a macetas de 3 L (15,5 cm de diámetro, 20,5 cm de altura).
- Rellena la maceta de 3 L con 1850 g de Klasmann Sustrato 2: Arena 3:1.
- Coloque las plantas en la cámara de crecimiento bajo condiciones de luz de 320 μmol·m-2·s-1 con una combinación de 55% de luz blanca y 81% de infrarrojos y configúrelo en un régimen de día largo (fotoperíodo de 16 h).
- Ajuste la temperatura en la cámara de crecimiento a 22 °C/19 °C para el día/noche y la humedad relativa (HR) al 55% durante todo el experimento.
- Mantener el peso de la maceta al 60% de contenido relativo de agua del suelo (SRWC) como el nivel de control adecuado para mantener el crecimiento y rendimiento30,31.
NOTA: Según ensayos anteriores, mantener el contenido volumétrico de agua por encima del 60% promovió el crecimiento de musgo en la superficie del suelo y elevó el riesgo de enfermedades de las plantas. Además, la presencia de musgo podría generar señales positivas engañosas a partir de imágenes de fluorescencia de clorofila, que es difícil de filtrar. Utilice la siguiente ecuación: SRWC% = (FW-DW)/(TW-DW) × 100, donde FW es el peso fresco del suelo, TW es el peso de turgencia y DW es el peso seco32.- Seleccione las muestras de suelo (100 g) de tres bolsas de mezcla Klasmman Substrate 2 diferentes como réplicas y pese el peso fresco del suelo.
- Sature la tierra con agua hasta que las macetas retengan el agua sin gotear y pesen el peso de la turgencia del suelo.
- Coloque la muestra en el horno a 80 °C durante 3 días hasta que las muestras de suelo estén completamente secas y pesen el peso seco del suelo33.
- Coloque las alfombrillas azules en la superficie de la maceta para reducir la evaporación.
NOTA: El color azul es necesario para restar el fondo del suelo de los píxeles de la planta en la segmentación de la imagen. - Seleccionar diez réplicas biológicas por tratamiento.
- Aleatorizar las macetas durante el riego (en total, 50 macetas).
- Agregue los soportes azules para sostener las plantas y evitar daños mecánicos al colocarlas en el sistema de fenotipado.
2. Aplicación de estrés
- En la etapa temprana de tuberización (28 días después del trasplante de los esquejes in vitro ), dividir las plantas en cinco grupos de tratamiento y fenotipar diez plantas por tratamiento (Figura 1).
- Induzca la tensión simple y combinada a un nivel que no sea perjudicial de la siguiente manera:
- En la cámara de crecimiento, mantener las plantas bajo control, los tratamientos de sequía y encharcamiento a 22 °C/19 °C día/noche (paso 1.7), con diferentes porcentajes de SRWC:
Control (C) con 60% de SRWC durante todo el experimento.
Sequía (D) con 20% de SRWC gradual durante 7 días, seguido de 1 día de recuperación.
Encharcamiento (W) con 160% de SRWC durante 5 días, seguido de 10 días de recuperación. - Para mantener el nivel de agua por encima de la superficie del suelo en el tratamiento de encharcamiento, inserte una bolsa de plástico en la maceta vacía y luego coloque la maceta principal con tierra en la segunda maceta preparada.
- Coloque las plantas en una cápsula de crecimiento a 30/28 °C día/noche y 55% HR para tratamientos térmicos. Imponga tensiones térmicas simples y combinadas de la siguiente manera:
- Para calor (H), mantener la temperatura entre 30 y 28 °C con un 60% de CSRW durante 15 días.
- Para el triple estrés de Calor + Sequía + Anegamiento (HDW), exponga las plantas a un tratamiento térmico a 30 °C/28 °C de temperatura día/noche durante los primeros 7 días (manteniendo un 60% de SRWC), seguido de un tratamiento combinado de sequía + calor durante los otros 7 días (20% de SRWC y 30 °C/28 °C) y finalmente exponga las plantas a un estrés de encharcamiento durante 1 día. Para esto último, vuelva a colocar las plantas en la cámara de crecimiento (consulte el paso 1.7 para conocer las condiciones) e induzca el anegamiento al 160% de SRWC durante 1 día.
NOTA: Las duraciones seleccionadas de los estreses inducidos se basaron en un experimento piloto que mostró efectos de estrés sin impactos perjudiciales con una supervivencia del 100% de las plantas tratadas. En el ambiente de la cámara de crecimiento, la variación de las condiciones ambientales estuvo en el rango ± 0,2 °C para la temperatura y ± 3% para la humedad.
- En la cámara de crecimiento, mantener las plantas bajo control, los tratamientos de sequía y encharcamiento a 22 °C/19 °C día/noche (paso 1.7), con diferentes porcentajes de SRWC:
3. Preparación de la planta para el fenotipado
- Después de encender las luces a las 6:00 a.m. en las cámaras de crecimiento, permita que las plantas se aclimaten bajo las condiciones de luz de crecimiento constante (320 μmol·m-2·s-1) durante al menos 2-3 h antes del inicio del protocolo de fenotipado. Esto asegura que la fotosíntesis y la regulación estomática estén en un estado estacionario34.
- Antes de la medición, transfiera las plantas de su lugar de cultivo al área de amortiguación de crecimiento del sistema de fenotipado utilizado para la carga manual de plantas en el sistema mientras el marcado automatizado está en modo de espera y posicionado dentro del invernadero (Figura complementaria 1, Figura complementaria 2 y Figura complementaria 3).
NOTA: Las plantas se mantuvieron en el área de amortiguamiento de crecimiento durante el período de fenotipado que duró 3.5 h. En el invernadero, la variación de las condiciones ambientales estuvo en el rango de ± 2 °C para la temperatura, ± 5% para la humedad y 20% de fluctuación en la intensidad de la luz. Por lo tanto, considere que las mediciones deben comenzar de inmediato y ser cortas, evitando la influencia de las condiciones del invernadero en las plantas. - En la plataforma de fenotipado, coloque los recipientes en los discos que se mueven automáticamente en una cinta transportadora en intervalos determinados hasta el sensor de imagen de acuerdo con los protocolos de medición especificados en la sección 4.
- Etiquete cada planta/bandeja con una identificación única para asegurarse de que los datos medidos se asignen a la planta correcta durante todo el experimento.
4. Protocolo de fenotipado
- Optimizar el protocolo de fenotipado utilizando múltiples sensores de imagen (fluorescencia de clorofila, IR térmico, RGB e imágenes hiperespectrales), permitiendo así la medición simultánea de los parámetros fisiológicos y morfológicos de las plantas (Figura 2).
NOTA: Dado que las respuestas de las plantas reflejan las condiciones ambientales y los efectos diurnos, es importante considerar la aleatorización de las macetas y realizar el fenotipado dentro del mismo período del día. - En la plataforma de fenotipado, asegúrese de que las plantas ingresen al sistema a través de un túnel de adaptación (Figura 2A) donde primero se captura la altura de la planta y luego se ajusta la altura de cada sensor en función de la distancia de trabajo fija.
- Realice las mediciones en dos rondas según lo justificado en el protocolo de medición utilizando el software.
- En la primera ronda, comprenden las mediciones de respuestas fisiológicas cuantificadas como "reacciones rápidas" utilizando fluorescencia de clorofila e imágenes térmicas.
- Comienza midiendo los parámetros fisiológicos bajo tratamientos de estrés térmico y luego el resto de tratamientos.
- En la segunda ronda, proceda con otras mediciones para evaluar las respuestas más lentas, incluyendo RGB estructural e imágenes hiperespectrales, seguidas de la evaluación del peso y el riego.
- Durante la etapa de pesaje y riego, defina el peso de referencia para cada planta para permitir el riego y el pesaje automatizados para el tratamiento dado.
- Asegúrese de que el peso total de referencia incluya el peso del disco, el inserto ubicado en la cinta transportadora, el soporte azul del soporte, la estera azul, la maceta, el suelo y la biomasa vegetal en el protocolo definido.
- Para una medición precisa de la evapotranspiración durante la etapa de pesaje y riego, prepare macetas vacías como referencia. Además, prepare macetas adicionales para corregir el peso de la biomasa de la planta.
- Para medir 50 plantas, la duración total del protocolo de fenotipado es de 215 min (85 min en la1ª ronda y 130 min en la2ª ronda).
- Fenotipar diariamente todas las plantas en condiciones de control (1 día antes del tratamiento) y luego inducir los tratamientos de estrés para monitorear las respuestas dinámicas y evaluar las fases tempranas y tardías del estrés inducido.
5. Ajuste de la configuración de cada sensor de imagen
- Imágenes de fluorescencia cinética de clorofila
NOTA: La fluorescencia cinética de clorofila se utiliza para investigar la capacidad fotosintética de las plantas en respuesta a diferentes condiciones ambientales, incluidos los estreses abióticos, y para proporcionar información valiosa sobre la eficiencia cuántica de la fotoquímica y la disipación de calor (proceso no fotoquímico).- Realizar mediciones de fluorescencia de clorofila en plantas adaptadas a la luz utilizando un protocolo de luz corto para discriminar las respuestas de las plantas bajo diferentes tratamientos.
- Aclimatar35 plantas durante 5 min bajo la luz en el túnel de adaptación equipado con LEDs de color blanco frío (6500 K) a 500 μmol·m-2·s-1.
NOTA: Las imágenes de fluorescencia de clorofila son la primera medición después de la adaptación a la luz utilizada para monitorear los cambios en las capacidades fotosintéticas de las plantas. - Seleccione y optimice el protocolo predefinido de acuerdo con el tamaño de la planta y las intensidades de luz requeridas.
- Optimice los ajustes de medición, incluidos los ajustes de la cámara y la intensidad de la luz para garantizar la adquisición de una señal fuerte con una relación señal-ruido óptima.
- Ajuste la configuración de la cámara, como el obturador (tiempo de exposición, duración de los flashes de medición) y la sensibilidad (ganancia eléctrica de la cámara). Utilice el obturador a 2 ms y la sensibilidad al 12%.
NOTA: Estos valores se ajustan en función del tamaño y la forma de la hoja y la distancia definida entre la parte superior del dosel y el sensor de imagen. - Ajuste la intensidad de la luz actínica a 500 μmol·m-2·s-1 y ajuste el pulso de saturación a 3200 μmol·m-2·s-1, que es al menos 6-7 veces mayor que la luz actínica.
- Ajuste la configuración de la cámara, como el obturador (tiempo de exposición, duración de los flashes de medición) y la sensibilidad (ganancia eléctrica de la cámara). Utilice el obturador a 2 ms y la sensibilidad al 12%.
- Para medir los parámetros en estado estacionario ligero (Lss) (descrito a continuación), las plantas de adaptación a la luz duran 5 minutos antes de las mediciones en el túnel de adaptación a la luz.
- Para estimar el rendimiento cuántico del fotosistema II en estado estacionario (PSII) de plantas adaptadas a la luz, seleccione el protocolo de luz corta (Figura 3) y establezca el protocolo de la siguiente manera.
NOTA: La duración del protocolo fue de 10 s por planta.- Comience la medición encendiendo la luz actínica de color blanco frío a 500 μmol·m-2·s-1 durante 3 s para medir la fluorescencia de estado estacionario en la luz (Ft_Lss aka. Ft')
- Aplique un pulso de saturación a 3200 μmol·m-2·s-1 durante 800 ms para medir la fluorescencia máxima en estado estacionario en luz (Fm_Lss aka. Fm')
- Apague la luz actínica, luego encienda la luz roja lejana (735 nm) para permitir que PSII se relaje en la oscuridad durante 800 ms y mida la fluorescencia mínima en luz en estado estacionario (Fo_Lss aka. Fo').
- Para calcular los parámetros relativos, utilice un software de análisis de datos que reste el fondo y extraiga los parámetros relevantes.
NOTA: Los parámetros extraídos del protocolo utilizado son: máxima eficiencia de la fotoquímica PSII de la muestra adaptada a la luz en estado estacionario a la luz determinada como Fv/Fm_Lss aka. Fv'/Fm', rendimiento cuántico del fotosistema II o eficiencia operativa del fotosistema II en estado estacionario de luz definido como QY_Lss aka. φPSII = Fq'/Fm', y la fracción de centros de reacción abiertos en PSII (QA oxidado) se determina como qL_Lss = (Fq'/Fv') x (F0'/Ft').
- Imágenes térmicas infrarrojas (IR)
NOTA: Las imágenes térmicas IR se utilizan para la medición no invasiva de la temperatura real del dosel, determinando así las diferentes regulaciones estomáticas. En la unidad de imágenes térmicas IR, una cámara térmica está montada lateralmente en el brazo robótico para medir la temperatura de la cubierta desde la vista lateral.- Para aumentar el contraste de la temperatura de fondo sobre la temperatura del objeto fotografiado durante el procesamiento de la imagen, utilice una pared calefactada controlada automáticamente en el lado opuesto de la cámara térmica para aumentar el contraste. Regule la temperatura de la pared a 8 °C por encima de la temperatura del aire en la unidad de imagen.
NOTA: Las imágenes térmicas se adquirieron en la oscuridad utilizando el modo de escaneo lineal35. - Después de la adquisición de la imagen, genere una máscara de planta basada en datos de vista lateral RGB y utilícela para corregistrar con los datos térmicos en el análisis de la imagen. Esto garantiza una identificación precisa del objeto escaneado al tiempo que elimina las interferencias de fondo, como el soporte de la planta.
- Para evitar la influencia de las condiciones ambientales fluctuantes a lo largo de todo el experimento, calcule el parámetro diferencia de temperatura (delta T o ΔT).
NOTA: Delta T (ΔT) se define como la diferencia entre la temperatura medida de la superficie de la hoja (el promedio de todos los píxeles de toda la superficie detectada de la planta) y la temperatura del aire ambiente dentro de la caja de imágenes.
- Para aumentar el contraste de la temperatura de fondo sobre la temperatura del objeto fotografiado durante el procesamiento de la imagen, utilice una pared calefactada controlada automáticamente en el lado opuesto de la cámara térmica para aumentar el contraste. Regule la temperatura de la pared a 8 °C por encima de la temperatura del aire en la unidad de imagen.
- Imágenes RGB
NOTA: Las imágenes RGB se basan en cámaras de sistema visual inercial (VIS) que detectan luz en el rango visible de 400 a 700 nm, donde se utilizan para el análisis en profundidad de la morfología de la planta, la arquitectura y la extracción de las características del índice de color.- La unidad de imagen contiene una mesa giratoria para un posicionamiento preciso de la bandeja y, al mismo tiempo, permite la obtención de imágenes desde varios ángulos para vistas laterales.
- Configure las imágenes RGB basadas en imágenes de vista lateral para capturar la planta desde tres ángulos (0°, 120° y 240°), que se toman en el modo de escaneo en línea (RGB1) y las imágenes de vista superior en el modo de instantánea (RGB2).
- Ambas cámaras tienen una fuente de luz basada en LED, lo que garantiza una iluminación homogénea de la planta fotografiada y, por lo tanto, determina con precisión las características morfológicas y de color.
- Extraiga los parámetros calculados mediante el uso de software de análisis de datos.
- Para obtener parámetros adicionales basados en las vistas lateral y superior, calcule el volumen de la planta (biomasa digital)36:
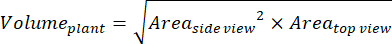
- Calcular la tasa de crecimiento relativo (RGR)37:
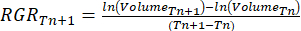
Donde Tn y Tn+1 indican el intervalo de tiempo (días).
- Imágenes hiperespectrales
NOTA: Las imágenes hiperespectrales se utilizan para la visualización de la reflectancia espectral de las plantas. Los cambios en la reflectancia de las hojas son indicadores de los diferentes estados fisiológicos de la planta en cuestión.- Utilice el sensor de imágenes hiperespectrales para cuantificar la reflectancia del dosel en la parte visible de los espectros de luz, con una cámara hiperespectral de infrarrojo cercano (VNIR) en un rango de 380-900 nm y una cámara infrarroja de longitud de onda corta (SWIR) en un rango de 900-1700 nm.
- Las cámaras están montadas en un brazo robótico con una fuente de luz de tubo halógeno implementada (600 W) para una iluminación de muestra homogénea y espectralmente apropiada durante la adquisición de imágenes que se mueven a través del área XZ.
- Ambas cámaras funcionan en modo de escaneo lineal y están colocadas en una caja de imágenes aislada de la luz.
- Antes de cada ronda de medición, realice dos mediciones de calibración (automáticamente): calibración de corriente oscura y calibración radiométrica utilizando el estándar de teflón de reflectancia espectral.
- La imagen de calibración oscura se resta de la imagen de calibración en blanco y sin procesar para eliminar el ruido de corriente oscuro. A continuación, genere la hiperespectral final dividiendo la imagen en bruto después de la sustracción por la imagen de calibración blanca.
6. Exportación de datos y análisis de imágenes
- Utilice el software del analizador de datos para la extracción automática, la sustracción de fondo y la segmentación de la máscara de planta de la canalización de procesamiento de imágenes (Figura 2B).
- El software realiza un análisis totalmente automatizado en el que la aplicación de mascarillas, la sustracción de fondo en la que las plantas se aíslan de su fondo y el cálculo de parámetros se procesan como se describe para la imagen RGB38 y la imagen térmica20.
- Extraiga los parámetros medidos y calculados de los píxeles específicos de la planta definidos por la máscara de planta y la máscara de bandeja generadas por imagen RGB.
- Si las imágenes no se seleccionaron completamente, lo que puede ocurrir debido a cambios en el verdor de la vegetación durante etapas posteriores de desarrollo o el efecto del tratamiento de estrés, abra la parte de análisis de datos locales en el software y vuelva a ajustar la configuración de la máscara de planta en el software del analizador de datos dependiendo de cada sensor.
- En el procesamiento de imágenes de fluorescencia de clorofila, ajuste los parámetros de análisis de la configuración de la máscara vegetal de fluorescencia de clorofila (Figura complementaria 4).
- Establezca el umbral como Verdadero, lo que significa que la segmentación de la planta se realiza automáticamente.
- Establezca el Índice de marco de máscara como Falso, lo que significa que para la detección de máscara de planta , se utiliza el marco Tiempo-Visual tal como se define en el protocolo de fluorescencia de clorofila.
- En el procesamiento de imágenes térmicas, establezca los parámetros para el análisis de la máscara de plantas (Figura complementaria 5).
- Establezca el umbral automático para la generación de máscara de objeto como Falso.
- Establezca la máscara de la imagen lateral RGB como True para utilizarla en el análisis.
- En el procesamiento de imágenes RGB, ajuste los parámetros de análisis de la configuración de la máscara de planta (Figura complementaria 6 y Figura complementaria 7) en función de la especie y la etapa de desarrollo.
- Seleccione la fórmula 4 * G-3 * B-R, que es la definición para la generación de máscaras de objetos y define el componente de color utilizado (componente rojo, verde, azul).
NOTA: Esta fórmula estándar y otras configuraciones pueden cambiar según el tipo de cámara utilizada (vista superior o de tamaño), el tratamiento aplicado y los diferentes cultivares. - Ajuste el umbral utilizado para la conversión de la imagen en escala de grises con un canal verde mejorado a una imagen binaria, determinando la superficie cubierta por la planta.
- Ajuste el tamaño medio del filtro utilizado para reducir el ruido y los píxeles no válidos y rellene los que faltan.
- Ajuste el tamaño mínimo del objeto en píxeles que se incluirá en el análisis.
- Ajuste el tamaño mínimo de los agujeros de los objetos de máscara en píxeles, normalmente decenas de píxeles. Los agujeros más pequeños que este valor se cierran y se toman en los píxeles del objeto.
- Establezca Usar reducción de reflexión como verdadero para normalizar los valores RGB en cada píxel.
- Establezca Omitir puntos expuestos incorrectos como Verdadero para recortar los píxeles expuestos por encima o por debajo de la máscara de la planta (por ejemplo, omisión de los reflejos de la superficie o los píxeles oscuros donde el ruido es mayor que la señal).
- Seleccione la fórmula 4 * G-3 * B-R, que es la definición para la generación de máscaras de objetos y define el componente de color utilizado (componente rojo, verde, azul).
- Colorea la configuración de segmentación analizada desde RGB utilizando el software analizador de datos para proporcionar información sobre los cambios de color relacionados con las respuestas al estrés y la senescencia de la planta.
NOTA: El verdor se estima utilizando una gama predefinida de colores que representan todas las etapas del desarrollo de la planta. La intensidad en los canales de color de todos los píxeles correspondientes a la superficie de la planta se agrupó y agrupó para ser utilizada como mapa de color de origen para la segmentación de color.- Proporcione la imagen RGB procesada (fondo eliminado), mapa de colores: lista de tonos para un análisis específico, como entrada en el software.
- Para obtener resultados imparciales, realice la selección de tonos utilizando un conjunto de datos de "entrenamiento" y seleccione diferentes etapas de desarrollo y tratamientos.
NOTA: El análisis guarda los valores R, G y B de cada píxel de cada imagen de este conjunto de datos de entrenamiento. - Defina el número de tonos (seleccione 6 tonos) utilizando el software para la salida de definición de color, que va de 0 a 255 para cada canal.
- Proporcione la lista de tonos generados en el software del analizador de datos (Colores).
- En el procesamiento de imágenes hiperespectrales, procese los datos hiperespectrales adquiridos utilizando el análisis píxel por píxel implementado en el software del analizador hiperespectral, con calibración radiométrica y de ruido oscuro, sustracción de fondo y segmentación de máscaras de plantas. Utilice los espectros promedio y los índices de vegetación para un análisis más detallado.
- Cree la máscara para la extracción de datos de la imagen hiperespectral de la imagen VNIR tomada por la cámara hiperespectral VNIR. Para el escaneo hiperespectral SWIR, genere una máscara de planta basada en el análisis SWIR.
- En VNIR Plant Mask, use la fórmula 1.2 * (2.5 * (R740-R672) -1.3 * (R740-R556)) para visualizar las imágenes donde R representa el valor de reflectancia en una longitud de onda específica (Figura complementaria 8).
- En SWIR Plant Mask, utilice la fórmula (R960-R1450)-(R960-R1200) en el procesamiento de imágenes para visualizar las imágenes (Figura complementaria 9).
7. Pesaje y riego
- Guarde el peso (antes) de regar durante el procedimiento de pesaje y riego. Luego aplique riego y mantenga el peso después de regar también.
- Riegue las bandejas en el modo de referencia: cada bandeja tenía un valor de referencia almacenado en la base de datos, al que siempre se regaba. Determine la referencia en función del tratamiento.
8. Análisis de datos
- Analice los datos utilizando ANOVA y prueba de Shapiro.
- Realice comparaciones por pares entre diferentes tratamientos mediante la prueba de Wilcox por pares en R Studio (versión 4.2.3) utilizando los paquetes (dplyr), (tidyverse), (rstatix) y (ggpubr).
NOTA: El análisis de la imagen se realizó automáticamente mediante el uso de un software analizador de datos. Para un análisis más detallado de la adquisición de imágenes, utilice el software de análisis de datos específico del sensor.
Resultados Representativos
En este estudio, se utilizó el fenotipado automatizado basado en imágenes para investigar las respuestas morfológicas y fisiológicas de la papa (cv. Lady Rosetta) bajo estrés simple y combinado. El enfoque aplicado mostró las respuestas dinámicas de las plantas en alta resolución espacio-temporal cuando se indujo estrés en la etapa de iniciación del tubérculo. Para evaluar las fases temprana y tardía del estrés, los resultados se presentaron en 3 períodos de tiempo ([0-5 días de fenotipado (DOP)], [6-10 DOP] y [11-15 DOP]) (Figura 1). Hasta 0 DOP, todas las plantas se cultivaron bajo condiciones de control (C), luego de 1-5 DOP, donde se aplicó estrés por encharcamiento (W) y estrés por calor (H). Así, las respuestas se observaron de la siguiente manera: (i) en 0-5 DOP, indicaron el calor inicial y el encharcamiento; (ii) en 6-10 DOP, se observó la sequía temprana (D) y se observó calor combinado y sequía (HD) y (iii) en 11-15 DOP, se observaron los estreses de calor tardío, sequía y calor combinado + sequía + anegamiento (HDW). La recuperación del anegamiento se observó en 6-10 DOP y 11-15 DOP.
Rasgos morfológicos
Se aplicaron imágenes RGB para determinar el efecto de diferentes tensiones y combinaciones en el crecimiento de las plantas aéreas. Los resultados de la Figura 4 muestran que el tratamiento térmico y el estrés de encharcamiento (0-5 DOP) ya causan una reducción del volumen de la planta y de la RGR en comparación con el control. Durante 6-10 DOP, el volumen de plantas y la RGR de las plantas de control aumentaron continuamente, mientras que bajo calor, calor combinado, sequía y anegamiento, este aumento en el volumen de plantas se redujo claramente (Figura 4A). Debido a que las plantas son muy susceptibles al estrés por encharcamiento, se produjo una disminución pronunciada de la RGR (Figura 4B). Durante el estrés por sequía tardía (11-15 DOP), donde el SRWC se mantuvo en un 20%, se observó una clara reducción de la RGR en comparación con el control. Sin embargo, en la fase tardía de la HDW combinada, la aplicación del tratamiento de encharcamiento provocó un aumento de la RGR en el último día de estrés.
Rasgos fisiológicos
Se aplicó la combinación de fenotipado estructural y fisiológico para revelar nuevas respuestas al estrés. El uso de múltiples sensores de imagen permite la determinación de las respuestas fisiológicas en la fase temprana del estrés. Un análisis más detallado de los datos de fluorescencia de la clorofila mostró que el anegamiento estaba afectando negativamente a la eficiencia fotosintética, donde Fv'/Fm' (Fv/Fm_Lss) disminuyó drásticamente en 0-5 DOP y 6-10 DOP, pero se observó una respuesta de recuperación en 11-15 DOP donde Fv'/Fm' aumentó ligeramente (Figura 5A). Durante la fase de estrés tardío (11-15 DOP), se observó una reducción de Fv'/Fm' en sequía y calor y sequía combinados. En las plantas anegadas, la eficiencia operativa de las plantas (QY_Lss también conocida comoφ PSII) fue significativamente menor en comparación con otros tratamientos en 0-5 DOP y 6-10 DOP, pero un ligero aumento a 11-15 DOP, lo que indica la recuperación de la planta (Figura 5B). Además, se determinaron los diferentes mecanismos en la regulación de la eficiencia que contribuye a la protección de PSII mediante el cálculo de la fracción de centros de reacción abiertos en PSII en un estado estacionario ligero (qL_Lss) (Figura 5C). Solo bajo sequía se observó un aumento en la CV, probablemente debido a la fotoinhibición.
Estos hallazgos estuvieron de acuerdo con los datos de RI que reflejaron diferentes mecanismos subyacentes bajo tensiones (Figura 6). Se observó un aumento de deltaT (ΔT) en el anegamiento, reduciendo la tasa de intercambio de gases. Bajo sequía tardía y estrés combinado de calor y sequía, un aumento en el ΔT se debió al cierre de los estomas, considerado una de las principales respuestas para evitar la pérdida excesiva de agua. Por otro lado, se observó una reducción de ΔT bajo tratamientos térmicos a medida que los estomas se abren para mejorar la eficiencia de la transpiración y enfriar la superficie foliar.
Al investigar los datos hiperespectrales, se seleccionaron dos parámetros de los datos VNIR hiperespectrales para evaluar los índices de reflectancia de las hojas, incluido el NDVI como indicador del contenido de clorofila y el PRI como indicador de la eficiencia de la fotosíntesis. Los resultados mostraron una disminución del NDVI y del PRI solo bajo encharcamiento, en relación con la reducción observada en los rasgos morfológicos (Figura 7A,B). Además, a partir de los datos hiperespectrales SWIR utilizados para evaluar el contenido de agua en las plantas, se observó un aumento en el índice de agua en el anegamiento durante 0-5 DOP (Figura 7C). Sin embargo, bajo tratamientos térmicos, se observó una respuesta opuesta donde el índice de agua fue menor que el control. Estos hallazgos estuvieron de acuerdo con un examen de la vegetación a partir de la segmentación de color de la vista superior RGB. Los cambios en la proporción de tonos indican las respuestas al estrés a lo largo del tiempo (Figura 8). El índice de reverdecimiento mostró una reducción en el contenido de pigmentos bajo sequía y HDW combinado en la fase de estrés tardía y una recuperación gradual del tratamiento de encharcamiento. Por lo tanto, el uso de los sensores de imagen múltiple reflejó la correlación de los rasgos morfofisiológicos y permitió la evaluación del rendimiento general de la planta bajo estreses abióticos.
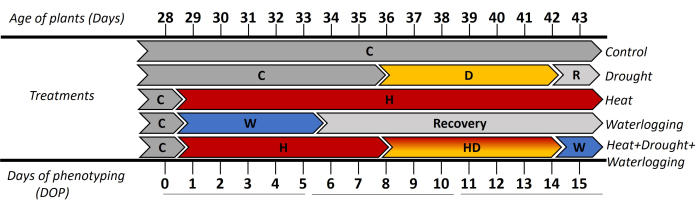
Figura 1: Cronología de la aplicación de los diferentes tratamientos, incluyendo la edad de las plantas en días después del trasplante de los esquejes in vitro . El día 0 de fenotipado (DOP) se midió en condiciones de control (C), y luego se indujeron las diferentes tensiones con diferentes duraciones. De 1 a 5 DOP se aplicó tensión de encharcamiento (W) y la respuesta inicial del tratamiento térmico (H). Los días siguientes 6-10 DOP, donde se presentó la fase inicial de estrés por sequía (D) y estrés combinado por calor y sequía (HD). Durante 11-15 DOP se reflejó la respuesta de las plantas a la fase tardía de sequía y tratamientos térmicos y la aplicación de encharcamiento a HD (HDW) durante 1 día. Haga clic aquí para ver una versión más grande de esta figura.
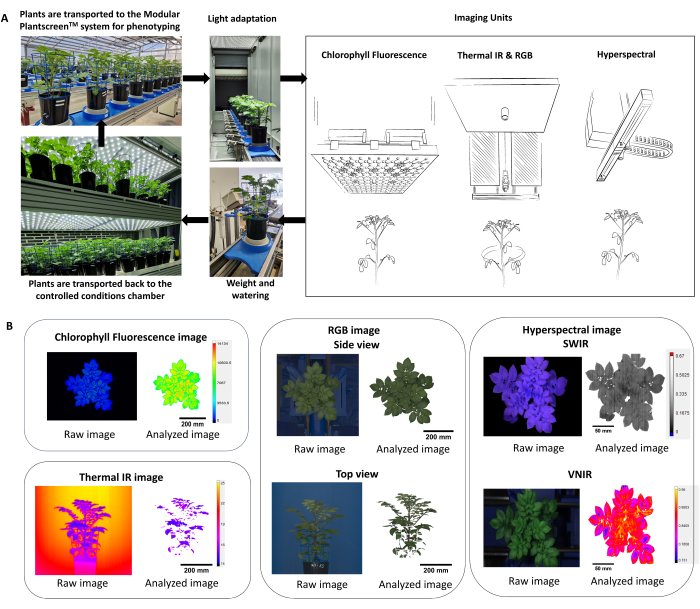
Figura 2: Esquema que resume el protocolo de fenotipado y análisis de datos. (A) Descripción general del protocolo de fenotipado. Las plantas se transportan al sistema de fenotipado desde las condiciones controladas en la cámara de crecimiento FS-WI (PSI). Las plantas se aclimataron a la luz en la cámara de adaptación a la luz durante 5 min a 500 μmol.m-2.s-1 antes de las mediciones. Se utilizaron múltiples sensores de imagen para determinar los rasgos morfológicos y fisiológicos, seguidos de la estación de pesaje y riego. Dependiendo del tratamiento, las plantas se volvieron a colocar en condiciones controladas, ya sea a 22 °C/19 °C o a 30 °C/28 °C. (B) Extracción y segmentación automáticas de la tubería de procesamiento de imágenes de cada sensor de imágenes. Haga clic aquí para ver una versión más grande de esta figura.
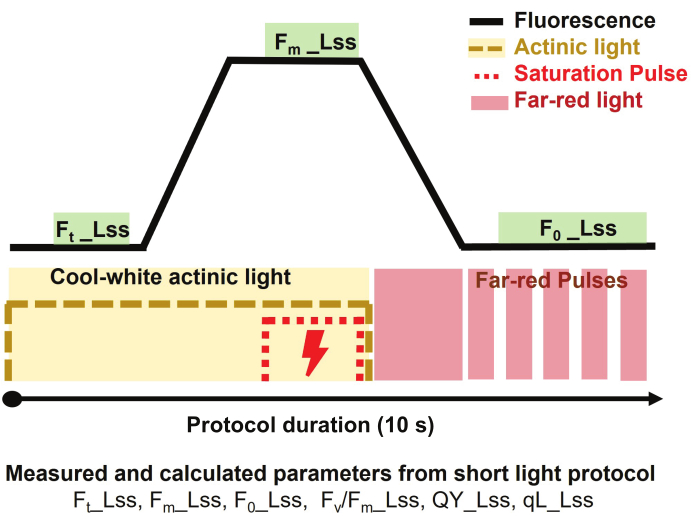
Figura 3: Breve descripción del protocolo de luz para imágenes de fluorescencia de clorofila. El protocolo de medición comenzó encendiendo la luz actínica de color blanco frío para medir la fluorescencia de estado estacionario en la luz (Ft_Lss) y luego aplicando un pulso de saturación para medir la fluorescencia máxima en estado estacionario en la luz (Fm_Lss). La luz actínica se apagó y la luz roja lejana se encendió para determinar la fluorescencia mínima en estado estacionario en la luz (Fo_Lss). La duración del protocolo fue de 10 s por planta. Haga clic aquí para ver una versión más grande de esta figura.
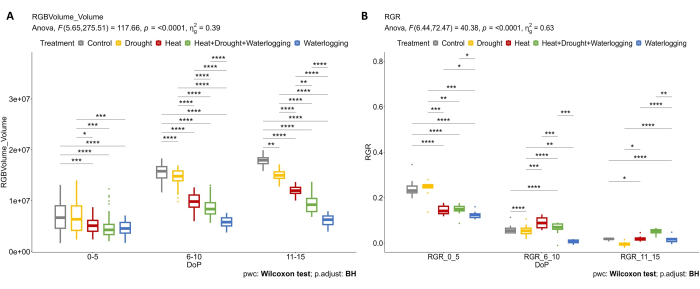
Figura 4: Imágenes RGB utilizadas para la evaluación morfológica. (A) Volumen de planta calculado a partir del área de vistas superior y lateral RGB. (B) Tasa relativa de crecimiento (RGR) durante la etapa de iniciación del tubérculo. Los datos representan valores medios ± desviación estándar (n = 10). Haga clic aquí para ver una versión más grande de esta figura.
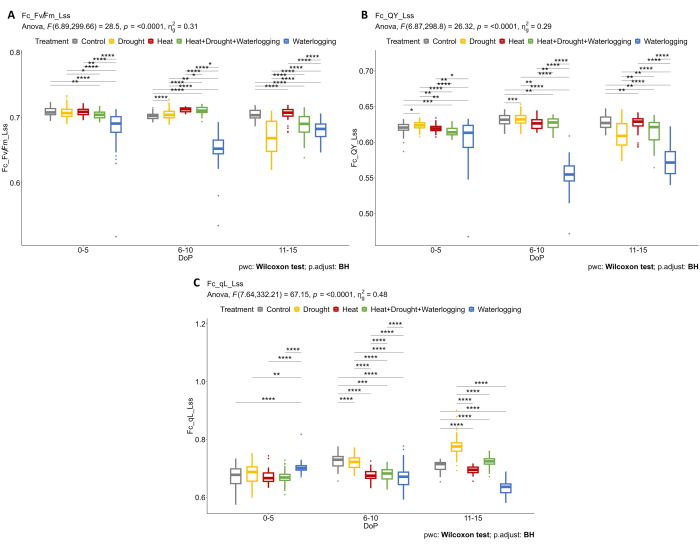
Figura 5: Imágenes de fluorescencia de clorofila en plantas adaptadas a la luz. (A) Máxima eficiencia de la fotoquímica PSII de una muestra adaptada a la luz en estado estacionario a la luz (Fv/Fm_Lss). (B) Rendimiento cuántico del fotosistema II o eficiencia operativa del fotosistema II en estado estacionario de luz (QY_Lss). (C) Fracción de centros de reacción abiertos en PSII en estado estacionario ligero (QA oxidado) (qL_Lss). Los datos representan valores medios ± desviación estándar (n = 10). Haga clic aquí para ver una versión más grande de esta figura.
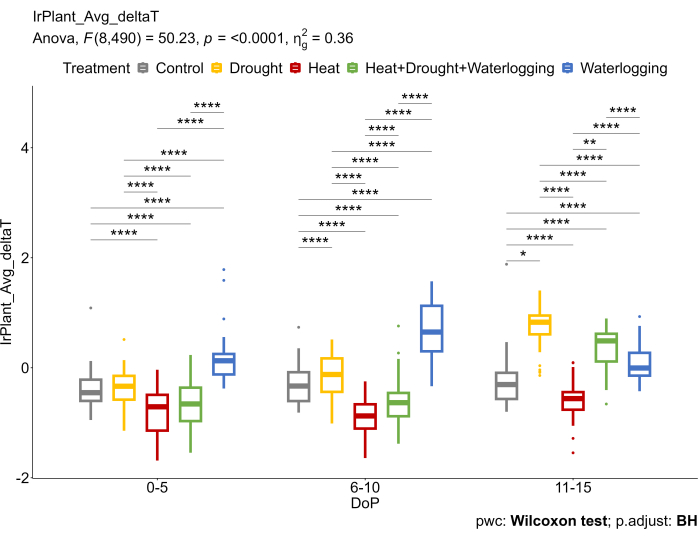
Figura 6: Se utilizaron imágenes térmicas IR para calcular la diferencia entre la temperatura promedio del dosel extraída de las imágenes térmicas IR y la temperatura del aire (ΔT). Los datos representan valores medios ± desviación estándar (n = 10). Haga clic aquí para ver una versión más grande de esta figura.
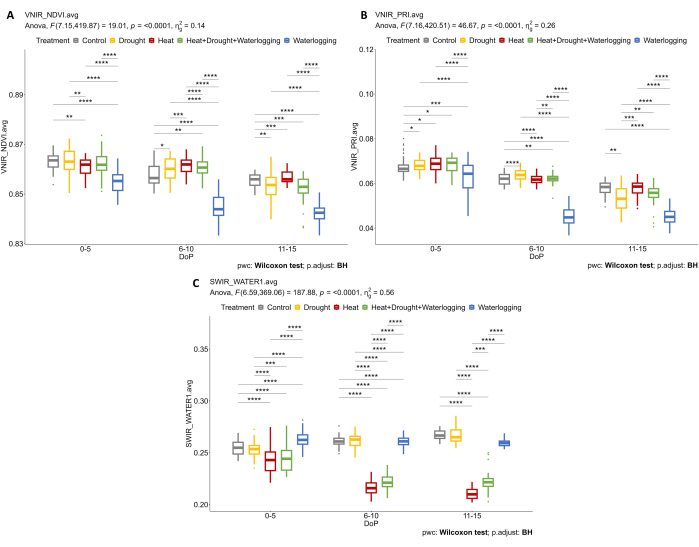
Figura 7: Imágenes hiperespectrales para determinar los índices de vegetación y el contenido de agua. (A) Índice de Vegetación de Diferencia Normalizada (NDVI). (B) Índice de reflectancia fotoquímica (PRI) calculado a partir de imágenes VNIR. (C) Índice de agua calculado a partir de imágenes SWIR. Los datos representan valores medios ± desviación estándar (n = 10). Haga clic aquí para ver una versión más grande de esta figura.
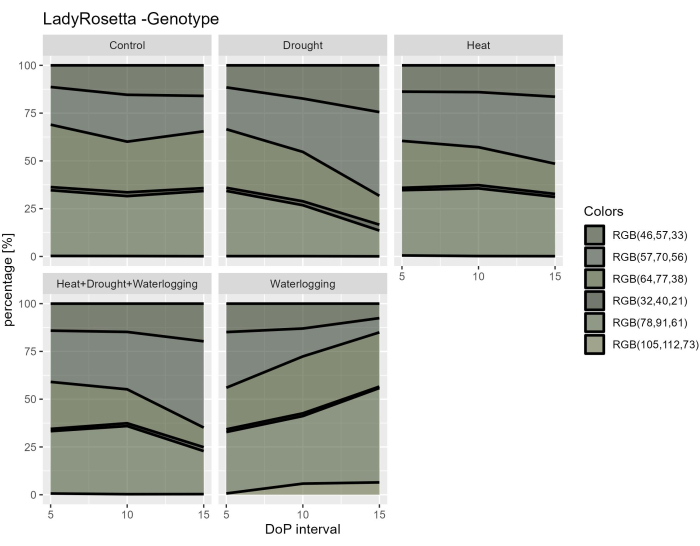
Figura 8: Índice de enverdecimiento para plantas bajo diferentes tratamientos. El procesamiento de imágenes se basa en la transformación de la imagen RGB original en un mapa de color que consta de 6 tonos definidos. Los datos representan valores medios ± desviación estándar (n = 10). Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Intensidad lumínica medida durante los días de fenotipado (DOP). La duración de las mediciones desde las 9:00 am hasta las 12:35 pm. LI_Buff refiere a los datos medianos de 5 sensores de luz distribuidos en el invernadero. Haga clic aquí para descargar este archivo.
Figura suplementaria 2: Humedad relativa (HR) medida durante los días de fenotipado (DOP). La duración de las mediciones desde las 9:00 am hasta las 12:35 pm. RH_Buff refiere a los datos medianos de 5 sensores de humedad distribuidos en el invernadero. RH2 se refiere a la humedad relativa en la cámara de adaptación. Haga clic aquí para descargar este archivo.
Figura complementaria 3: Temperatura medida durante los días de fenotipado (DOP). La duración de las mediciones desde las 9:00 am hasta las 12:35 pm. T_Buff refiere a los datos medianos de 5 sensores de temperatura distribuidos en el invernadero. T2 se refiere a la temperatura en la cámara de adaptación. T3 se refiere a la temperatura de la pared calefactora. T4 se refiere a la temperatura en la unidad de imágenes térmicas IR. Haga clic aquí para descargar este archivo.
Figura complementaria 4: Captura de pantalla del software del analizador de datos que muestra los parámetros ajustados para el análisis de mascarillas vegetales en sensores de imágenes de fluorescencia de clorofila. Haga clic aquí para descargar este archivo.
Figura complementaria 5: Captura de pantalla del software del analizador de datos que muestra los parámetros ajustados para el análisis de máscaras de plantas en sensores de imágenes térmicas infrarrojas. Haga clic aquí para descargar este archivo.
Figura complementaria 6: Captura de pantalla del software del analizador de datos que muestra los parámetros ajustados para el análisis de máscaras de plantas en sensores de imágenes RGB de 1 vista lateral. Haga clic aquí para descargar este archivo.
Figura complementaria 7: Captura de pantalla del software del analizador de datos que muestra los parámetros ajustados para el análisis de máscaras vegetales en sensores de imagen de vista superior RGB2. Haga clic aquí para descargar este archivo.
Figura complementaria 8: Captura de pantalla del software del analizador de datos que muestra los parámetros ajustados para el análisis de la mascarilla vegetal en los sensores de imagen VNIR. Haga clic aquí para descargar este archivo.
Figura complementaria 9: Captura de pantalla del software del analizador de datos que muestra los parámetros ajustados para el análisis de máscaras de plantas en sensores de imágenes SWIR. Haga clic aquí para descargar este archivo.
Discusión
La mejora de las herramientas avanzadas de adquisición de imágenes de alta resolución y las técnicas de visión por ordenador han permitido el rápido desarrollo del fenotipado de plantas para obtener datos cuantitativos a partir de imágenes masivas de plantas de forma reproducible39. Este estudio tuvo como objetivo adaptar y optimizar la metodología basada en imágenes de alto rendimiento utilizando una serie de sensores de imágenes actualmente disponibles para monitorear las respuestas dinámicas de las plantas bajo estreses abióticos simples y combinados. Algunos pasos críticos del enfoque aplicado requieren ajustes, incluida la aplicación de tensión y la selección de un protocolo de imagen adecuado para las mediciones. El uso de múltiples sensores para la adquisición de imágenes permite la cuantificación de rasgos fenotípicos clave (como el crecimiento de las plantas, la eficiencia fotosintética, las regulaciones estomáticas, la reflectancia de las hojas, etcétera). Además, mejora la comprensión de cómo las plantas de papa responden a diferentes estreses abióticos. Este es un requisito previo clave para acelerar los proyectos de fitomejoramiento a fin de desarrollar genotipos tolerantes al clima40. Las respuestas morfológicas al estrés inducido dependen de la etapa de desarrollo. Por ejemplo, la inducción de estrés en la etapa de iniciación del estolón o tubérculo inhibe el desarrollo de hojas y plantas y limita el número de estolones, reduciendo así el rendimiento final41. Sin embargo, en condiciones desfavorables, las plantas utilizan las respuestas al estrés como respuesta adaptativa para prevenir y reparar el daño celular inducido por el estrés42. Las plantas tienen mecanismos adaptativos para evitar y tolerar condiciones de estrés dependiendo del nivel de severidad43.
Para comprender los mecanismos de las plantas, uno de los pasos críticos se considera inducir la duración e intensidad adecuadas del estrés y determinar las respuestas de las plantas al estrés mediante el uso de sensores de imagen. Cuando varias tensiones coinciden, la intensidad de una tensión puede anular el efecto de las demás dependiendo de la combinación, intensidad y duración de las tensiones. Por lo tanto, los efectos del estrés pueden acumularse, o las respuestas opuestas pueden cancelarse (parcialmente) entre sí, lo que en última instancia resulta en efectos positivos o negativos en las plantas. El protocolo seleccionado en este estudio se basó en la experiencia previa para garantizar que se aplicaran niveles de estrés suficientes. Por ejemplo, la aplicación del estrés por sequía se ajustó a un nivel moderado, ya que en un experimento anterior, la respuesta no fue diferente de los tratamientos de control en una etapa temprana del estrés basados en imágenes de fluorescencia de clorofila. Esto se debe a la aparición de la fotorrespiración que actúa como un sumidero alternativo para los electrones en la membrana tilacoide y un mecanismo protector para el fotosistema II44,45. En el marco de la respuesta combinada al estrés, la exposición de las plantas a un factor estresante primario leve podría mejorar la tolerancia a un factor estresante posterior, que puede tener un impacto beneficioso o perjudicial46. En este estudio, se observó una respuesta más fuerte bajo estrés combinado en comparación con el estrés por sequía individual. Al investigar otras respuestas fisiológicas, los resultados mostraron un aumento de ΔT (deltaT) bajo sequía a medida que los estomas se acercan para evitar la pérdida excesiva de agua. En contraste, la respuesta inversa se observó bajo estrés térmico, donde el ΔT fue menor en comparación con el control, reflejando la apertura de los tomas para mejorar el enfriamiento de las hojas, de acuerdo con los hallazgos en trigo bajo estrés combinado de calor y sequía20. Durante el anegamiento, el aumento de ΔT debido al cierre de los estomas fue el resultado de la deficiencia de oxígeno en el suelo y la interrupción de la homeostasis del agua de las raíces, disminuyendo así la corriente de transpiración con un aumento en el ABA, una hormona clave en las respuestas al estrés hídrico47.
En los estudios de estrés vegetal, la duración del estrés y los tratamientos de recuperación posteriores es directamente proporcional a la intensidad del estrés. Por ejemplo, el estrés por sequía moderado, como mantener la humedad del suelo al 20% de la capacidad del campo (FC), induce cambios fenotípicos reversibles que generalmente se recuperan después de un solo día de reriego. Por el contrario, las condiciones de estrés severo, como el anegamiento, provocan un daño fenotípico extenso, que requiere un período de recuperación más largo. Aunque lo ideal es estandarizar la duración del tratamiento, la variabilidad inherente a las intensidades de estrés debe tenerse en cuenta en el diseño experimental.
El segundo paso crítico es seleccionar un protocolo apropiado y optimizar la configuración de cada sensor. La fluorescencia de la clorofila es una herramienta poderosa para determinar el rendimiento de los aparatos fotosintéticos bajo estrés48. Se pueden seleccionar diferentes protocolos de medición de la fluorescencia de la clorofila con plantas adaptadas a la luz o a la oscuridad, dependiendo de la pregunta de investigación y del diseño experimental49. En este estudio, el protocolo seleccionado (respuesta a la luz corta) permite la determinación de varios rasgos, entre ellos Fv'/Fm',φ PSII y qL, que indican el rendimiento de la fotosíntesis en diferentes condiciones50. Estudios previos demostraron que el protocolo utilizado en el fenotipado de alto rendimiento es efectivo para investigar la eficiencia fotosintética de plantas bajo diferentes aplicaciones de tratamientos de estrés y discriminar entre plantas sanas y estresadas14,20. Con base en el diseño experimental, es muy importante considerar la duración del protocolo seleccionado cuando se mide en un sistema de alto rendimiento con una alta población de plantas. Por lo tanto, se seleccionó la medición de la fluorescencia de la clorofila en plantas adaptadas a la luz utilizando un protocolo de corto tiempo para discriminar las respuestas bajo diferentes tratamientos. Las interacciones genotipo-ambiente pueden influir en muchos rasgos fenotípicos, lo cual es crítico durante la medición12. Es fundamental considerar que la duración de la medición debe completarse en poco tiempo para minimizar el efecto diurno sobre las limitaciones fotosintéticas51.
Se utilizaron imágenes térmicas IR para determinar la temperatura del dosel y comprender la regulación estomática bajo diferentes tratamientos52. Cabe mencionar que se utilizó la optimización tecnológica donde la pared calefactora se ubicó en el lado opuesto de la cámara, y la temperatura de la pared se controló dinámicamente y fue programable. Por lo tanto, es necesario ajustar la pared calefactada de fondo con sensores ambientales integrados para seleccionar correctamente las plantas del fondo aumentando el contraste de la temperatura de fondo sobre la temperatura del objeto fotografiado.
A pesar de que el análisis de imágenes está automatizado, todavía es necesario ajustar los índices de umbral RGB para obtener una máscara binaria adecuada en imágenes RGB para seleccionar con precisión las plantas53. Además, la elección de múltiples ángulos es importante para estimar adecuadamente los parámetros cuantitativos, incluida la biomasa digital y la tasa de crecimiento. En este estudio, se seleccionaron tres ángulos (0°, 120° y 240°) en la vista lateral RGB y se promediaron para calcular con precisión el volumen de la planta y la tasa de crecimiento relativo.
Dependiendo del rango espectral, muchos rasgos fisiológicos pueden ser investigados utilizando imágenes hiperespectrales54. Es necesario determinar cuál de los índices de reflectancia proporciona la información necesaria y muestra la respuesta de las plantas en diferentes condiciones14. Es muy demandado en el cribado de variedades tolerantes y en el fenotipado de plantas para determinar la correlación entre los índices hiperespectrales y otros rasgos fisiológicos55. En este estudio, las plantas bajo tratamiento de encharcamiento mostraron una respuesta pronunciada en el contenido de clorofila y la eficiencia fotosintética de las imágenes VNIR. Además, se observaron diferentes respuestas en el índice de agua calculado a partir de imágenes SWIR bajo tratamientos térmicos y encharcamientos debido a diferentes regulaciones estomáticas y contenido de agua en las hojas.
Por lo tanto, estos hallazgos ponen de manifiesto la utilidad de este enfoque después de optimizar la configuración y el potencial del uso de múltiples sensores para encontrar rasgos de estrés relevantes para la tolerancia climática. La evaluación de la dinámica de las respuestas utilizando múltiples sensores de imagen puede ser utilizada como una de las herramientas más poderosas para mejorar los programas de mejoramiento.
Divulgaciones
Los autores declaran que no tienen intereses financieros o relaciones personales contradictorias que puedan haber influido en el trabajo reportado en este artículo.
Agradecimientos
Este proyecto ADAPT (Desarrollo Acelerado de Patata tolerante al estrés múltiple) ha recibido financiación del programa de investigación e innovación Horizonte 2020 de la Unión Europea en virtud del acuerdo de subvención n.º GA 2020 862-858. Este trabajo fue parcialmente apoyado por el Ministerio de Educación, Juventud y Deportes de la República Checa con el Proyecto del Fondo Europeo de Desarrollo Regional "SINGING PLANT" (no. CZ.02.1.01/0.0/0.0/16_026/0008446). La Instalación Central de Ciencias de las Plantas de CEITEC MU es reconocida por su apoyo a las instalaciones de cultivo. Agradecemos a Meijer BV por proporcionar los esquejes in vitro utilizados en este estudio. Agradecemos a Lenka Sochurkova por ayudar en el diseño gráfico de la Figura 2 y a Pavla Homolová por ayudar con la preparación del material vegetal durante los experimentos en el Centro de Investigación de Photon Systems Instruments (PSI) (Drásov, República Checa).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.1” CMOS Sensor with RGB camera | PSI, Drásov, Czech Republic | https://psi.cz/ | The sensor delivers a resolution of 4112 × 4168 pixels for side view and 2560 × 1920 pixels for top view. The sensor is extremely sensitive and is a real megapixel CCD replacement and produces sharp, low-noise images |
| FluorCam | PSI, Drásov, Czech Republic | FC1300/8080-15 | Pulse amplitude modulated (PAM) chlorophyll fluorometer |
| Fluorcam 10 software | PSI, Drásov, Czech Republic | Version 1.0.0.18106 | For Chlorophyll fluorescence images visualization and analysis |
| GigE PSI RGB – 12.36 Megapixels Camera | PSI, Drásov, Czech Republic | https://psi.cz/ | For the side view projections, line scan mode was used with a resolution of 4112 px/line, 200 lines per second. The imaged area from the side view was 1205 × 1005 mm (height × width), while the imaged area from the top view position was 800 × 800 mm. |
| Hyperspectral Analyzer software | PSI, Drásov, Czech Republic | Version 1.0.0.14 | For hyperspectral images visualization and analysis |
| Hyperspectral camera HC-900 Series | PSI, Drásov, Czech Republic | https://hyperspec.org/products/ | Visible-near-infrared (VNIR) camera 380-900 nm with a spectral resolution of 0.8 nm FWHM |
| Hyperspectral camera SWIR1700 | PSI, Drásov, Czech Republic | https://hyperspec.org/products/ | Short-wavelength infrared camera (SWIR) camera 900 - 1700 nm with a spectral resolution of 2 nm FWHM |
| InfraTec thermal camera (VarioCam HEAD 820(800)) | Flir, United States | https://www.infratec.eu/thermography/infrared-camera/variocam-hd-head-800/ | Resolution of 1024 × 768 pixels, thermal sensitivity of < 20 mK and thermal emissivity value set default to 0.95. with a scanning speed of 30 Hz and each line consisting of 768 pixels. The imaged area was 1205 × 1005 mm (height × width). |
| LED panel | PSI, Drásov, Czech Republic | https://led-growing-lights.com/products/ | Equipped with 4 × 240 red-orange (618 nm), 120 cool-white LEDs (6500 K) and 240 far-red LEDs (735 nm) distributed equally over an imaging area of 80 × 80 cm |
| Light, temperature and relative humidity sensors | PSI, Drásov, Czech Republic | https://psi.cz/ | Sensors used to monitor controlled conditions in greenhouse |
| MEGASTOP Blue mats | Friedola | 75831 | To cover soil surface |
| Morphoanalyzer software | PSI, Drásov, Czech Republic | Version 1.0.9.8 | For RGB images visualization and analysis and color segmentation analysis |
| PlantScreen Data Analyzer software (Version 3.3.17.0) | PSI, Drásov, Czech Republic | https://plantphenotyping.com/products/plantscreen-modular-system/ | To visualize and analyze the data from all imaging sensors, watering-weighing unit and environmental conditions in greenhouse |
| PlantScreen Modular system | PSI, Drásov, Czech Republic | https://plantphenotyping.com/products/plantscreen-modular-system/ | Type of phenotyping platform |
| Plantscreen Scheduler software | PSI, Drásov, Czech Republic | Version 2.6.8368.25987 | To plan the experiment and set the measuring protocol |
| SpectraPen MINI | PSI, Drásov, Czech Republic | https://handheld.psi.cz/products/spectrapen-mini/#details | Light meter to adjust light level on a canopy level |
| TOMI-2 high-resolution camera | PSI, Drásov, Czech Republic | https://fluorcams.psi.cz/products/handy-fluorcam/ | Resolution of 1360 × 1024 pixels, frame rate 20 fps and 16-bit depth) with a 7-position filter wheel is mounted on a robotic arm positioned in the middle of the multi-color LED light panel with dimensions of 1326 x 1586 mm. |
| Walk-in FytoScope growth chamber | PSI, Drásov, Czech Republic | https://growth-chambers.com/products/walk-in-fytoscope-fs-wi/ | Type of chambers used to grow the plant |
Referencias
- Climate Change 2021: The Physical Science Basis. IPCC Available from: https://www.ipcc.ch/report/ar6/wg1/ (2021)
- Ray, D. K., Gerber, J. S., Macdonald, G. K., West, P. C. Climate variation explains a third of global crop yield variability. Nat Commun. 6, 5989 (2015).
- Acevedo, M., et al. A scoping review of adoption of climate-resilient crops by small-scale producers in low- and middle-income countries. Nat Plants. 6 (10), 1231-1241 (2020).
- van Dijk, M., Morley, T., Rau, M. L., Saghai, Y. A meta-analysis of projected global food demand and population at risk of hunger for the period 2010-2050. Nat Food. 2 (7), 494-501 (2021).
- Handayani, T., Gilani, S. A., Watanabe, K. N. Climatic changes and potatoes: How can we cope with the abiotic stresses. Breed Sci. 69 (4), 545-563 (2019).
- Devaux, A., Goffart, J. P., Kromann, P., Andrade-Piedra, J., Polar, V., Hareau, G. The potato of the future: Opportunities and challenges in sustainable agri-food systems. Potato Res. 64 (4), 681-720 (2021).
- Dahal, K., Li, X. Q., Tai, H., Creelman, A., Bizimungu, B. Improving potato stress tolerance and tuber yield under a climate change scenario - a current overview. Front Plant Sci. 10, 563 (2019).
- Ahmad, U., Sharma, L. A review of best management practices for potato crop using precision agricultural technologies. Smart Agricultural Technology. 4, 100220 (2023).
- Cabello, R., Monneveux, P., De Mendiburu, F., Bonierbale, M. Comparison of yield based drought tolerance indices in improved varieties, genetic stocks and landraces of potato (Solanum tuberosum L). Euphytica. 193 (2), 147-156 (2013).
- von Gehren, P., et al. Farmers feel the climate change: Variety choice as an adaptation strategy of European potato farmers. Climate. 11 (9), 189 (2023).
- Fiorani, F., Schurr, U. Future scenarios for plant phenotyping. Annu Rev Plant Biol. 64, 267-291 (2013).
- Poorter, H., et al. Pitfalls and potential of high-throughput plant phenotyping platforms. Front Plant Sci. 14, 1233794 (2023).
- Berger, B., de Regt, B., Tester, M. High-throughput phenotyping of plant shoots. Methods Mol Biol. 918, 9-20 (2012).
- Humplík, J. F., Lazár, D., Husičková, A., Spíchal, L. Automated phenotyping of plant shoots using imaging methods for analysis of plant stress responses - a review. Plant Methods. 11, 29 (2015).
- Danilevicz, M. F., Bayer, P. E., Nestor, B. J., Bennamoun, M., Edwards, D. Resources for image-based high-throughput phenotyping in crops and data sharing challenges. Plant Physiol. 187 (2), 699-715 (2021).
- Abebe, A. M., Kim, Y., Kim, J., Kim, S. L., Baek, J. Image-based high-throughput phenotyping in horticultural crops. Plants. 12 (10), 2061 (2023).
- Lazarević, B., Carović-Stanko, K., Safner, T., Poljak, M. Study of high-temperature-induced morphological and physiological changes in potato using nondestructive plant phenotyping. Plants. 11 (24), 3534 (2022).
- Marchetti, C. F., et al. A novel image-based screening method to study water-deficit response and recovery of barley populations using canopy dynamics phenotyping and simple metabolite profiling. Front Plant Sci. 10, 1252 (2019).
- Kim, S. L., et al. High-throughput phenotyping platform for analyzing drought tolerance in rice. Planta. 252 (3), 38 (2020).
- Abdelhakim, L. O. A., Rosenqvist, E., Wollenweber, B., Spyroglou, I., Ottosen, C. O., Panzarová, K. Investigating combined drought- and heat stress effects in wheat under controlled conditions by dynamic image-based phenotyping. Agronomy. 11 (2), 364 (2021).
- Zandalinas, S. I., Sengupta, S., Fritschi, F. B., Azad, R. K., Nechushtai, R., Mittler, R. The impact of multifactorial stress combination on plant growth and survival. New Phytologist. 230 (3), 1034-1048 (2021).
- Raza, A., et al. Impact of climate change on crops adaptation and strategies to tackle its outcome: A review. Plants. 8 (2), 34 (2019).
- Nasir, M. W., Toth, Z. Effect of drought stress on potato production: A review. Agronomy. 12 (3), 635 (2022).
- Wagg, C., Hann, S., Kupriyanovich, Y., Li, S. Timing of short period water stress determines potato plant growth, yield and tuber quality. Agric Water Manag. 247, 106731 (2021).
- Yamauchi, T., Colmer, T. D., Pedersen, O., Nakazono, M. Regulation of root traits for internal aeration and tolerance to soil waterlogging-flooding stress. Plant Physiol. 176 (2), 1118-1130 (2018).
- Aien, A., Chaturvedi, A. K., Bahuguna, R. N., Pal, M. Phenological sensitivity to high temperature stress determines dry matter partitioning and yield in potato. Indian J Plant Physiol. 22 (1), 63-69 (2017).
- Zandalinas, S. I., Mittler, R., Balfagón, D., Arbona, V., Gómez-Cadenas, A. Plant adaptations to the combination of drought and high temperatures. Physiol Plant. 162 (1), 2-12 (2018).
- Suzuki, N., Rivero, R. M., Shulaev, V., Blumwald, E., Mittler, R. Abiotic and biotic stress combinations. New Phytologist. 203 (1), 32-43 (2014).
- Atkinson, N. J., Jain, R., Urwin, P. E. The Response of Plants to Simultaneous Biotic and Abiotic Stress. Combined Stresses in Plants. , (2015).
- Harris, P. M., Harris, P. M. . The Potato Crop. 2nd ed. , (1992).
- Weisz, R., Kaminski, J., Smilowitz, Z. Water deficit effects on potato leaf growth and transpiration: Utilizing fraction extractable soil water for comparison with other crops. Am Potato J. 71 (12), 829-840 (1994).
- Wang, X., Vignjevic, M., Jiang, D., Jacobsen, S., Wollenweber, B. Improved tolerance to drought stress after anthesis due to priming before anthesis in wheat (Triticum aestivum L.) var. Vinjett. J Exp Bot. 65 (22), 6441-6456 (2014).
- Junker, A., et al. Optimizing experimental procedures for quantitative evaluation of crop plant performance in high throughput phenotyping systems. Front Plant Sci. 5, 770 (2015).
- Smith, S. M., et al. Diurnal changes in the transcriptome encoding enzymes of starch metabolism provide evidence for both transcriptional and posttranscriptional regulation of starch metabolism in arabidopsis leaves. Plant Physiol. 136 (1), 2687-2699 (2004).
- Findurová, H., Veselá, B., Panzarová, K., Pytela, J., Trtílek, M., Klem, K. Phenotyping drought tolerance and yield performance of barley using a combination of imaging methods. Environ Exp Bot. 209, 105314 (2023).
- Klukas, C., Chen, D., Pape, J. M. Integrated analysis platform: an open-source information system for high-throughput plant phenotyping. Plant Physiol. 165 (2), 506-518 (2014).
- Paul, K., et al. Understanding the biostimulant action of vegetal-derived protein hydrolysates by high-throughput plant phenotyping and metabolomics: A case study on tomato. Front Plant Sci. 10, 47 (2019).
- Awlia, M., et al. High-throughput non-destructive phenotyping of traits that contribute to salinity tolerance in Arabidopsis thaliana. Front Plant Sci. 7, 1414 (2016).
- Li, Z., Guo, R., Li, M., Chen, Y., Li, G. A review of computer vision technologies for plant phenotyping. Comput Electron Agric. 176, 105672 (2020).
- Li, L., Zhang, Q., Huang, D. A review of imaging techniques for plant phenotyping. Sensors (Switzerland). 14 (11), 20078-20111 (2014).
- Obidiegwu, J. E., Bryan, G. J., Jones, H. G., Prashar, A. Coping with drought: Stress and adaptive responses in potato and perspectives for improvement. Front Plant Sci. 6, 542 (2015).
- Zhang, H., Zhao, Y., Zhu, J. K. Thriving under stress: How plants balance growth and the stress response. Dev Cell. 55 (5), 529-543 (2020).
- Bandurska, H. Drought stress responses: Coping strategy and resistance. Plants. 11 (7), 922 (2022).
- Wingler, A., Lea, P. J., Quick, W. P., Leegood, R. C. Photorespiration: metabolic pathways and their role in stress protection. Philos Trans R Soc Lond B Biol Sci. 355 (1402), 1517-1529 (2000).
- Baker, N. R., Rosenqvist, E. Applications of chlorophyll fluorescence can improve crop production strategies: an examination of future possibilities. J Exp Bot. 55 (403), 1607-1621 (2004).
- Georgieva, M., Vassileva, V. Stress management in plants: Examining Provisional and Unique Dose-Dependent Responses. Int J Mol Sci. 24 (6), 5105 (2023).
- Leeggangers, H. A. C. F., Rodriguez-Granados, N. Y., Macias-Honti, M. G., Sasidharan, R. A helping hand when drowning: The versatile role of ethylene in root flooding resilience. Environ Exp Bot. 213, 105422 (2023).
- Baker, N. R. Chlorophyll fluorescence: a probe of photosynthesis in vivo. Annu Rev Plant Biol. 59 (1), 89-113 (2008).
- Murchie, E. H., Lawson, T. Chlorophyll fluorescence analysis: a guide to good practice and understanding some new applications. J Exp Bot. 64 (13), 3983-3998 (2013).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence-a practical guide. J Exp Bot. 51 (345), 659-668 (2000).
- Yokoyama, G., Ono, S., Yasutake, D., Hidaka, K., Hirota, T. Diurnal changes in the stomatal, mesophyll, and biochemical limitations of photosynthesis in well-watered greenhouse-grown strawberries. Photosynthetica. 61 (1), 1-12 (2023).
- Jones, H. G. Application of thermal imaging and infrared sensing in plant physiology and ecophysiology. Advances in Botanical Research. 41, 107-163 (2004).
- Brainard, S. H., Bustamante, J. A., Dawson, J. C., Spalding, E. P., Goldman, I. L. A digital image-based phenotyping platform for analyzing root shape attributes in carrot. Front Plant Sci. 12, 690031 (2021).
- Huber, S., Tagesson, T., Fensholt, R. An automated field spectrometer system for studying VIS, NIR and SWIR anisotropy for semi-arid savanna. Remote Sens Environ. 152, 547-556 (2014).
- Mertens, S., et al. Proximal hyperspectral imaging detects diurnal and drought-induced changes in maize physiology. Front Plant Sci. 12, 640914 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados