Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Mediciones de microdureza en hueso dental y alveolar en modelos de enfermedades orales en roedores
* Estos autores han contribuido por igual
En este artículo
Resumen
La microdureza es una propiedad mecánica y un parámetro informativo para evaluar la fisiopatología de los tejidos duros. Aquí, demostramos un protocolo estandarizado (preparación de muestras, pulido, superficie plana y sitios de indentación) para el análisis de microdureza en dientes y huesos alveolares en modelos de enfermedades orales en roedores, a saber, fluorosis dental y resorción ósea periodontal inducida por ligaduras.
Resumen
La propiedad mecánica, la microdureza, se evalúa en el esmalte dental, la dentina y el hueso en modelos de enfermedades orales, incluidas la fluorosis dental y la periodontitis. La micro-TC (μCT) proporciona información de imágenes en 3D (volumen y densidad mineral) y la microscopía electrónica de barrido (SEM) produce imágenes de microestructura (esmalte, prisma y laguna ósea-canalicular). De forma complementaria al análisis estructural por μCT y SEM, la microdureza es uno de los parámetros informativos para evaluar cómo los cambios estructurales alteran las propiedades mecánicas. A pesar de ser un parámetro útil, los estudios sobre la microdureza del hueso alveolar en las enfermedades orales son limitados. Hasta la fecha, se han reportado métodos de medición de microdureza divergentes. Dado que los valores de microdureza varían en función de la preparación de la muestra (pulido y superficie plana) y de los sitios de indentación, los diversos protocolos pueden causar discrepancias entre los estudios. La estandarización del protocolo de microdureza es esencial para una evaluación consistente y precisa en modelos de enfermedades orales. En el presente estudio, demostramos un protocolo estandarizado para el análisis de microdureza en hueso dental y alveolar. Los especímenes utilizados son los siguientes: para el modelo de fluorosis dental, se recolectaron incisivos de ratones tratados con/sin agua que contenía fluoruro durante 6 semanas; para el modelo de resorción ósea periodontal inducida por ligadura (L-PBR), se recolectaron huesos alveolares con resorción ósea periodontal de ratones ligados en el2º molar maxilar. A las 2 semanas después de la ligadura, se recogió el maxilar. La dureza Vickers se analizó en estos especímenes de acuerdo con el protocolo estandarizado. El protocolo proporciona materiales y métodos detallados para la inclusión de resina, el pulido en serie y los sitios de indentación para incisivos y alveolares. Hasta donde sabemos, este es el primer protocolo de microdureza estandarizado para evaluar las propiedades mecánicas del diente y el hueso alveolar en modelos de enfermedades orales en roedores.
Introducción
La dureza es una de las propiedades mecánicas (por ejemplo, elasticidad, dureza, viscoelasticidad y comportamiento de fractura) y se usa comúnmente para caracterizar la capacidad de resistir la compresión, la deformación y la fractura de un área local de un material. La prueba de dureza de indentación estática es el método más utilizado, incluida la dureza Vickers y la dureza Knoop1. La prueba de dureza Vickers se implementa presionando un penetrador de diamante en la superficie bajo una carga de prueba fija. El penetrador tiene forma piramidal, con una base cuadrada y un ángulo de 136° entre caras opuestas. Se mide la longitud de ambas diagonales formadas en la superficie de ensayo y se utiliza el promedio para calcular la dureza, que se determina mediante la relación F/A (donde F es la fuerza y A es el área superficial de la indentación). El número de microdureza Vickers (HV=F/A) suele expresarse en kilogramos-fuerza (kgf) pormm2 de indentación, con 1 HV ≈ 0,1891 F/d2 (N/mm2). La dureza Knoop también consiste en un indentador piramidal cuadrado de diamante formado por dos ángulos opuestos desiguales. El número de dureza Knoop (HK) es igual a la relación entre la carga aplicada y el área de contacto proyectada. Los ensayos de dureza se clasifican en ensayos de microindentación (microdureza) y ensayos de macroindentación, en función de la fuerza aplicada al material de ensayo. Las pruebas de microindentación suelen utilizar cargas en el rango de 0,01-2 N (aproximadamente 1-203 gf); mientras tanto, las pruebas de macroindentación utilizan más de 10 N (10119 gf)1.
Para evaluar las características de los tejidos duros dentales en las enfermedades orales, incluidos los dientes y el hueso alveolar, se utilizan micro-CT (μCT) y microscopía electrónica de barrido (SEM) para el análisis estructural. La μCT proporciona información de imagen en 3D (volumen y densidad mineral)2, y el SEM produce imágenes de microestructura (prisma de esmalte y laguna canalicular ósea)3. Complementariamente al análisis estructural por μCT y SEM, la microdureza es uno de los parámetros informativos para evaluar cómo los cambios estructurales alteran las propiedades mecánicas del diente y el hueso alveolar en enfermedades orales, por ejemplo, malformación del esmalte y resorción ósea periodontal. El valor de microdureza Vickers del esmalte humano (HV = 283-374) es aproximadamente de 4 a 5 veces mayor que el de la dentina (HV = 53-63)4,5. En modelos de fluorosis dental en roedores, la microdureza del esmalte disminuye significativamente en los incisivos de ratón tratados con fluoruro (HV = 136) en comparación con el esmalte control (HV = 334)6,7. Esto sugiere que el esmalte fluorado es más suave y débil, con un menor contenido de minerales y un mayor contenido de proteínas que el que se encuentra en el esmalte no fluorado. La microdureza se utiliza para evaluar las propiedades mecánicas del hueso. Varios estudios previos han examinado el comportamiento mecánico del hueso humano a partir de diferentes sitios anatómicos, incluida la microdureza del hueso largo 8,9,10. La microdureza media de los fémures humanos fluorados mostró una disminución significativa (HV = 222,4) en comparación con los fémures no fluorados (HV = 294,4)11. A pesar de ser un parámetro útil, existe una escasez de literatura que describa la microdureza (Vickers12 o Knoop 13,14) del hueso alveolar en las enfermedades orales.
Hasta la fecha, se han reportado métodos de medición de microdureza divergentes. Dado que los valores de microdureza varían15 dependiendo de la preparación de la muestra (pulido y superficie plana) y del sitio de indentación, diversos protocolos pueden causar discrepancias entre los estudios. La estandarización del protocolo de pruebas de microdureza es esencial para una evaluación consistente y precisa en modelos de enfermedades orales. En el presente estudio, demostramos un protocolo estandarizado para el análisis de microdureza en hueso dental y alveolar en modelo de fluorosis dental en ratón y modelo de resorción ósea periodontal.
Protocolo
Todos los procedimientos descritos en este protocolo se han realizado de acuerdo con las pautas y regulaciones para el uso de animales vertebrados aprobadas por el Comité Institucional de Uso de Cuidado de Animales (IACUC) de la Universidad de Augusta y en la Universidad Nova Southeastern, que está acreditada por la Asociación para la Evaluación y Acreditación de Cuidado de Animales de Laboratorio Internacional (AAALAC). Nótese que el Dr. Suzuki fue empleado por la Universidad de Augusta, donde se completaron los experimentos de fluorosis dental en ratones.
1. Extracción de incisivos mandibulares en un modelo de fluorosis dental de ratón
- Alimente a los ratones C57BL/6 (machos de 5 semanas de edad) con dietas libres de flúor desde 1 semana antes del tratamiento con flúor hasta la finalización del tratamiento con flúor.
- Prepare el agua fluorada agregando NaF en agua destilada seguida de una filtración al vacío con un filtro de 0,2 μm. Dele a los animales agua con flúor como NaF (0 ppm y 125 ppm; N=5/grupo) ad libitum durante 6 semanas. Reemplace el agua con flúor con un lote recién preparado cada 2 días.
- Después de 6 semanas de tratamiento con agua con fluoruro, eutanasia a los animales con CO2 seguido de decapitación.
- Extraiga el hemi mandibular con incisivo de cada ratón. Para recoger el hemi-mandibular con incisivo, corte los músculos alrededor de la mandíbula mandibular sin aplicar una fuerza excesiva.
- Coloque el hemi mandibular en PBS y manténgalo a 4 °C hasta el análisis de μ-TC (opcional). Separe el incisivo del mandibular con un bisturí (#15) y unas tijeras sin dañar ni romper la muestra.
- Lavar el incisivo aislado con PBS y realizar la deshidratación sumergiéndolo en alcohol de grado creciente (70% y 100% etanol) durante 2-3 h.
NOTA: Si el tejido (por ejemplo, la pulpa) no está suficientemente deshidratado, es probable que se inhiba la impregnación de resina y que la evaluación posterior sea inadecuada. - Después de la deshidratación con etanol, incruste el incisivo horizontalmente en resina. Continúe con el paso 3.
2. Extracción de huesos alveolares maxilares en un modelo de resorción ósea periodontal inducida por ligadura de ratón (L-PBR)
- Administrar 0,8 mL de ketamina (100 mg/mL) + 0,1 mL de Xilacina (100 mg/mL) + 9,1 mL de PBS por vía intraperitoneal (i.p.) a ratón (C57BL/6, 8-12 semanas de edad, macho) como anestésico. La dosis es de 0,01 mL/g (peso). Aplique ungüento oftálmico en ambos ojos para prevenir la sequedad bajo anestesia.
- Coloque el ratón anestesiado sobre una almohadilla térmica durante 5-10 minutos. Evalúe las respuestas a los pinzamientos de la cola y los dedos de los pies y la integridad del reflejo ocular. Confirme que el ratón no responde a los estímulos nocivos y que el reflejo está ausente.
- Coloque el ratón en la mesa de tratamiento y mantenga la boca abierta por medio de una ligadura de sutura de seda 5-0 atada a un poste magnético en la mesa de tratamiento.
- Bajo un microscopio quirúrgico, enrolle la ligadura (sutura de seda trenzada 6-0) alrededor de un lado del segundo molar maxilar (una sola capa) usando micro portaagujas. Minimice las diferencias individuales en el análisis utilizando un lado como el lado del tratamiento y el otro lado como el control.
- Ata la ligadura y haz un nudo en el lado del paladar. Después de hacer un nudo, corte la ligadura restante lo más corto posible para que la ligadura excesiva no interfiera con la masticación o la alimentación. Esto es importante para asegurar que la ligadura no se afloje al masticar durante el período de observación posterior.
NOTA: No deje al animal desatendido hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal. No devuelva el animal que ha sido sometido a una cirugía a la compañía de otros animales hasta que esté completamente recuperado. Mantener condiciones estériles durante la supervivencia. - Alimenta a los ratones con dieta y agua ad libitum durante 2 semanas. Después de 2 semanas de ligadura, se practica la eutanasia de los ratones con CO2 seguida de la decapitación.
- Extraiga ambos maxilares laterales (lado de ligadura y lado de control) con molares de cada ratón. Para recolectar maxilares con molares, corte los músculos y el hueso alrededor de la mandíbula maxilar con unas tijeras sin aplicar una fuerza excesiva. Coloque cada maxilar en PBS y manténgalo a 4 °C hasta el análisis de μCT (opcional).
- Separe el hueso alveolar con molares (1a 3punto) del maxilar con un bisturí (# 15) y unas tijeras sin dañar ni romper la muestra.
- Lavar el hueso alveolar aislado con PBS, luego deshidratar y desengrasar por inmersión en alcohol creciente (70% y 100% etanol) durante 2-3 h.
NOTA: Si el tejido (por ejemplo, pulpa y hueso) no está suficientemente deshidratado, es probable que se inhiba la impregnación de resina y que la evaluación posterior sea inadecuada. - Después de la deshidratación con etanol, incruste el hueso alveolar horizontalmente en resina. Continúe con el paso 3.
- Opcional: Realice la evaluación de μCT antes de la prueba de microdureza.
- Antes de la prueba de microdureza, realice un análisis estructural no destructivo (por ejemplo, μCT) utilizando la misma muestra para la prueba de microdureza como evaluación complementaria (Figura 1). La información estructural (imagen 3D, densidad mineral, volumen) por μCT podría ayudar a evaluar las propiedades mecánicas y la calidad de la muestra que pueden afectar los resultados de microdureza.
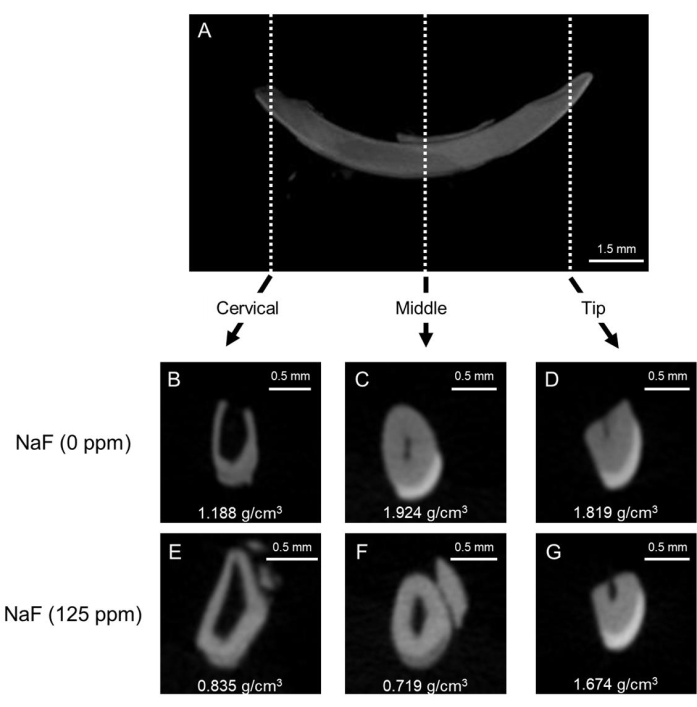
Figura 1: Imágenes representativas de μCT de esmalte en incisivos de ratones control y tratados con fluoruro. (A) Imagen sagital μCT representativa de incisivos mandibulares. (B-D) Imágenes coronales μCT del incisivo de control (NaF 0 ppm). (E-G) Imágenes coronales μCT de incisivos tratados con NaF (125 ppm). Se muestra la densidad mineral representativa del esmalte (EMD) (g/cm3). Haga clic aquí para ver una versión más grande de esta figura.
3. Incrustación de muestras en resina
- Continúe desde el paso 1.7 (modelo de fluorosis dental) o el paso 2.10 (modelo L-PBR).
- Cubra la superficie interior de la copa de montaje (1 pulgada) con una capa delgada de vaselina. Mezcle la resina (resina de incrustación de fraguado en frío) de acuerdo con las instrucciones. Vierta la resina y el endurecedor en el vaso de plástico provisto en una proporción de volumen de 15:2 y mezcle cuidadosamente con una espátula de madera durante al menos 2 minutos. Evite las burbujas de aire.
- Colocar incisivo deshidratado y desengrasado (Figura 2A) o hueso alveolar con molares (Figura 2B) orientados horizontalmente y paralelos al fondo de la copa de montaje (1 muestra por copa).
- Vierta la resina mezclada (suficiente resina, aproximadamente 1,5 ml) en la taza de montaje para cubrir completamente la muestra. Evite agregar más resina de la necesaria, ya que el exceso de resina impedirá el proceso de pulido (Figura 2C, D). Coloque la copa de montaje que contiene la muestra en una placa calefactora a 50 °C durante al menos 8 h para promover la polimerización de la resina. Este procedimiento contribuye a mantener el espécimen en una posición estable.
NOTA: Dependiendo del tamaño de la muestra, ajuste la cantidad de resina para cubrir completamente la muestra. No llene demasiada resina, de lo contrario, se necesitará más tiempo para eliminar la resina superflua. - Después del curado, retire la resina que contiene la muestra de la copa de montaje. Retire las rebabas y coloque el plano de la muestra y el plano lateral opuesto como paralelos y planos utilizando una amoladora-pulidora avanzada con papel abrasivo rugoso resistente al agua (grano 60/P60 y 120/P120) bajo inundación de agua. Mantenga la altura de la muestra a aproximadamente 3 mm para el incisivo y el hueso alveolar (Figura 2E, F).
NOTA: Cuando la muestra se analiza por SEM después de la medición de microdureza, el espesor de la muestra debe ser de unos 3 mm para que la observación posterior del SEM no se vea afectada. Las muestras más pequeñas son más difíciles de manipular con el molinillo. Para las muestras destinadas solo a la microdureza, la altura de la muestra puede aumentar a unos 10-20 mm. - Recorte la forma externa para hacer un bloque rectangular de resina sólida y esquinas redondeadas (aproximadamente, ancho 30 mm, largo 10 mm para el incisivo (Figura 2G) y ancho 10 mm, largo 5 mm, para el hueso alveolar (Figura 2H)) utilizando una sierra de corte de precisión.
- Una vez completada la corrección de la forma aproximada, elimine los residuos y las partículas del bloque de resina con un limpiador ultrasónico (aproximadamente 1 min). Continúe con el paso 4.

Figura 2: Flujo del procedimiento de incrustación y pulido de resina. (A) Incisivo deshidratado y desengrasado. (B) Hueso alveolar deshidratado y desengrasado en L-PBR. (C, D) Incisivos y hueso alveolar sumergidos en resina. (E, F) Al cortar la resina, es más fácil pulir la superficie del tejido objetivo. (G, H) Esquinas de resina redondeadas para el proceso de pulido. Abreviaturas: L-PBR = resorción ósea periodontal inducida por ligadura. Haga clic aquí para ver una versión más grande de esta figura.
4. Pulido de especímenes
NOTA: El pulido de las muestras se realiza manualmente utilizando papeles abrasivos impermeables (de ásperos a más finos) en una amoladora-pulidora avanzada bajo inundación de agua.
- Coloque un papel abrasivo rugoso resistente al agua (grano 600/P1200) en la amoladora. Coloque el bloque de resina recortado y limpio (del paso 3.7) sobre el papel abrasivo rugoso resistente al agua.
- Mientras vierte agua, sostenga el bloque de resina y pula la superficie de evaluación de la muestra en la amoladora-pulidora (Velocidad 1-10 x g). En este momento, tenga cuidado de sujetar el bloque de resina de modo que la superficie de evaluación quede paralela al suelo. Para mantener intacta la superficie de evaluación, examínela a simple vista o bajo un microscopio.
NOTA: Tenga en cuenta que el molinillo gira en el sentido de las agujas del reloj y la presión uniforme puede dar lugar a una superficie no paralela. Para obtener una superficie paralela, mantenga constante la velocidad de rotación del parapente y presione la muestra con cuidado durante unos segundos, y luego gire la muestra 180° para presionar durante la misma cantidad de tiempo. El papel abrasivo rugoso puede eliminar no solo la resina sino también la muestra. - Cambie el papel abrasivo por el Grano 800/P2400 y coloque el bloque de resina sobre él. Repita el paso 4.2.
- Elimine los residuos y las partículas del bloque de resina con un limpiador ultrasónico (aproximadamente 1 min).
NOTA: Antes de continuar, se recomienda usar un limpiador ultrasónico para eliminar cualquier residuo de la superficie y evitar obstrucciones. - A continuación, realice el pulido en serie con papeles abrasivos más finos; El orden de pulido es de 12 μm, 9 μm, 3 μm, 1 μm y 0,3 μm.
- Coloque una película de lapeado (12 μm) en la mesa de la amoladora-pulidora sin rotación y coloque el bloque de resina sobre la película de lapeado.
NOTA: En este experimento, la mesa del molinillo es adecuada para obtener una condición de superficie plana bajo inundación de agua. Alternativamente, también se puede utilizar un espejo plano grande (o similar) que proporcione paralelismo. - Bajo enfriamiento por agua, pula cuidadosamente la superficie de evaluación de la muestra en la película de lapeado a mano. Mueva la muestra vertical, horizontal y diagonalmente durante el mismo número de segundos bajo inyección de agua con movimientos de 2 a 3 cm (1 pulgada). Cuando el procedimiento de pulido se logra correctamente, la muestra de resina se adherirá a la película de lapeado.
- Retire los residuos y las partículas como en el paso 4.4. Cambie el papel abrasivo al siguiente tamaño según el orden de pulido en serie (de 12 μm a 0,3 μm) y coloque el bloque de resina sobre él.
- Mientras vierte agua, sostenga el bloque de resina y pula cuidadosamente la superficie de la muestra en la película de lapeado con la mano. Retire los residuos y las partículas como en el paso 4.4.
- Repita los pasos 4.5 - 4.8 para completar el pulido final (0,3 μm). Después de completar el pulido final (0,3 μm), la muestra debe tener una superficie con acabado de espejo (Figura 3A).
- Limpie la superficie de la muestra con etanol (100%) para desengrasar y deshidratar y almacene los bloques de resina a temperatura ambiente hasta la prueba de microdureza. Durante el almacenamiento, evite la humedad y el polvo excesivos. Continúe con el paso 5.
5. Prueba de microdureza Vickers
NOTA: La indentación de una muestra de superficie con acabado de espejo se realiza utilizando un probador de microdureza. Las pruebas se realizan con una carga de 25 g durante 10 s con una punta Vickers.
- Ensayo de microdureza Vickers para incisivos (modelo de fluorosis dental)
NOTA: El esmalte se puede dividir en tres capas desde el exterior (lado de la cavidad oral) hasta el interior (lado de la pulpa); a saber, la capa superficial, la capa intermedia y la capa profunda (unión dentina-esmalte, DEJ) (Figura 3B)16. En este protocolo, se prueban tres capas de esmalte.- Ajuste la fuerza de carga a 25 g y la duración de carga a 10 s. Coloca el bloque de resina en el escenario.
- Sangría de 6 puntos en cada capa de esmalte (superficial, medio y DEJ) y dentina en cada región (cervical, media y punta; Figura 3B).
- Mide la longitud de las dos diagonales (d1 y d2; Figura 3B) para calcular el valor de microdureza Vickers (HV; Figura 4).
- Ensayo de microdureza Vickers para hueso alveolar (modelo L-PBR)
- Ajuste la fuerza de carga a 25 g y la duración de carga a 10 s. Coloca el bloque de resina en el escenario.
- Sangría de 3 a 6 puntos en cada lado mesial y distal del hueso alveolar desde la cresta alveolar. Huesos alveolares dentados entre el1º y el2º molar (cuadrado blanco), y el2º y3º molar.
NOTA: En este protocolo, se evaluaron 6 puntos en cada lado mesial y distal (12 puntos en total) para el hueso control (intacto), y 3 puntos en cada lado (6 puntos en total) para L-PBR. El número de puntos de indentación depende de las condiciones de la lesión (p. ej., demasiada pérdida ósea limita el área de indentación).
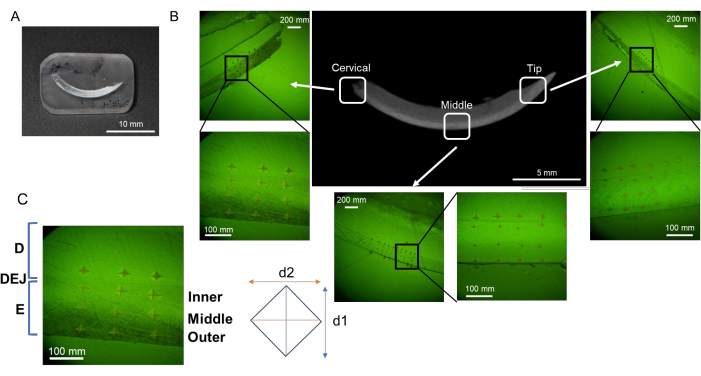
Figura 3: Regiones de evaluación de la microdureza en el incisivo mandibular. (A) Muestra de superficie con acabado espejo que contiene incisivo mandibular. (B) Sangrías en cada región; cervical, media y punta (NaF 0 ppm). (C) Tres capas de esmalte; de DEJ, esmalte interior, medio y externo. Abreviaturas: D = dentina, E = esmalte, DEJ = unión del esmalte dentinario Haga clic aquí para ver una versión más grande de esta figura.
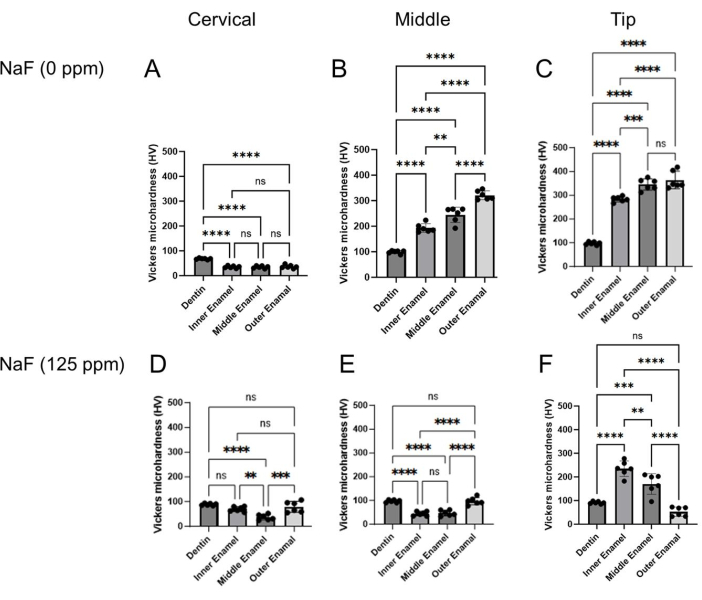
Figura 4: Microdureza Vickers del esmalte tratado con o sin NaF. Se evaluó la microdureza de la dentina y de las tres capas de esmalte en cada región, cervical, media y punta. (A-C) Control y tratamiento (D-F) NaF (125 ppm). Los datos se presentan como media ± DE. Las diferencias significativas se evaluaron mediante ANOVA de una vía con la prueba post-hoc de Tukey. Los valores de p < 0,05 se consideraron estadísticamente significativos. **p < 0.005, ***p < 0.0005, ****p < 0.0001 Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Modelo de fluorosis dental: La Figura 1 muestra imágenes representativas de μCT de incisivos en ratones control y tratados con fluoruro. En el control (Figura 1B-D), la región cervical mostró menor densidad mineral del esmalte (EMD) de 1,188 g/cm3 (Figura 1B) en comparación con la media (1,924 g/cm3) y la punta (1,819 g/cm3; Figura 1C,D
Discusión
La microdureza se realiza para evaluar las propiedades mecánicas de tejidos duros como el diente y el hueso. Hasta la fecha, se han reportado métodos de medición de microdureza divergentes. Es probable que la mayor parte de la información de medición, especialmente la preparación de las muestras y los sitios de indentación, sea insuficiente. Este estudio se centró en el protocolo de microdureza para esmalte y hueso alveolar en modelos de fluorosis dental y enfermedades periodontales. Para obtener resultados consi...
Divulgaciones
Los autores declaran no tener conflicto de intereses.
Agradecimientos
La investigación reportada en esta publicación fue apoyada por JSPS KAKENHI JP21K09915 (MO) y el Instituto Nacional de Ciencias Médicas Generales; T34GM145509 (MM) y el Instituto Nacional de Investigación Dental y Craneofacial; R01DE025255 y R21DE032156 (XH); R01DE029709, R21DE028715 y R15DE027851 (CC.TT.); R01DE027648 y K02DE029531 (EM).
Materiales
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
Referencias
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23 (2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714 (2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347 (2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302 (2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85 (2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014 (2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980 (2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335 (2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973 (2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados