Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Inyección intracameral en ratas con bajo riesgo de efectos adversos
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe una técnica para la inyección intracameral en ratas utilizando una incisión corneal central y un túnel largo hacia la cámara anterior. Este método de inyección minimiza el riesgo de inducir daño tisular involuntario y, por lo tanto, mejora la precisión y la reproducibilidad.
Resumen
La inyección intracameral es una rutina de administración estándar en oftalmología. La aplicación de la inyección intracameral en roedores para la investigación es un desafío debido a las dimensiones y la anatomía limitantes del ojo, incluido el pequeño volumen de humor acuoso, la curvatura del cristalino y el grosor del cristalino. El daño potencial durante las inyecciones intracamerales introduce efectos adversos y variabilidad experimental. Este protocolo describe un procedimiento para la inyección intracameral en ratas, que permite precisión y reproducibilidad.
Se utilizaron ratas Sprague-Dawley como modelos experimentales. Dado que la posición del cristalino en las ratas sobresale en la cámara anterior, la inyección desde la periferia, como se hace en los humanos, es desfavorable. Por lo tanto, se crea una incisión en la región central de la córnea utilizando una hoja de aguja de 0,8 mm de calibre 31 para formar un túnel autosellante en la cámara anterior. Una incisión en un ángulo cercano al plano permite crear un túnel largo, lo que minimiza la pérdida de humor acuoso y la poca profundidad de la cámara anterior. Se inserta una nanoaguja de calibre 34 en el túnel para la inyección. Esto permite la penetración con una resistencia mínima a la fricción y evita tocar la lente. La inyección de tripano-azul permite visualizar mediante microscopía de hendidura la presencia del colorante en la cámara anterior y excluir fugas. La biodisponibilidad de la capa endotelial corneal se demuestra mediante la inyección de colorante de Hoechst, que tiñe los núcleos de las células endoteliales de la córnea después de la inyección.
En conclusión, este protocolo implementa un procedimiento para la inyección intracameral precisa en ratas. Este procedimiento se puede utilizar para la administración intracameral de diversos fármacos y compuestos en modelos experimentales de ratas, lo que aumenta la eficiencia y la reproducibilidad de la investigación oftalmológica.
Introducción
La biodisponibilidad de los compuestos administrados por administración tópica a la superficie del ojo es muy limitada, normalmente un <5%1. Los compuestos administrados por colirios se eliminan principalmente por drenaje, lagrimeo inducido, renovación del líquido lagrimal y absorción conjuntival. Además, la permeabilidad de los compuestos a través de la superficie ocular está muy restringida por la barrera córnea-conjuntiva 1,2,3. La córnea está compuesta por tres capas principales: el epitelio más externo, el estroma intermedio y el endotelio más interno. El epitelio corneal superficial está interconectado por fuertes uniones estrechas y crea una alta resistencia paracelular, que es la principal barrera para la permeabilidad de la sustancia. Múltiples capas de epitelio limitan aún más la permeación de moléculas hidrófilas y grandes a través de los espacios intercelulares del epitelio de la córnea. Después del epitelio, el estroma está compuesto por fibras de colágeno y contiene poros acuosos. A diferencia del epitelio corneal, el estroma permite el movimiento de fármacos hidrofílicos; sin embargo, es muy impermeable a los compuestos lipofílicos 1,2,3. Juntos, el epitelio corneal y las capas estromales presentan importantes barreras tisulares que limitan la absorción del fármaco. No se considera que el endotelio corneal restrinja el transporte de fármacos.
Una alternativa a la vía de liberación de la córnea es la vía conjuntival. La conjuntiva es una capa multiepitelial que cubre la cara interna de los párpados y la parte anterior de la esclerótica. La conjuntiva se caracteriza por tener menos uniones estrechas que el epitelio corneal, lo que permite una mejor permeabilidad de los fármacos hidrofílicos. Sin embargo, la vascularización de la conjuntiva da lugar a la absorción sistémica de una gran fracción de las moléculas administradas, limitando de nuevo en gran medida la biodisponibilidad de los compuestos suministrados a la cámara anterior 1,2. Una forma eficaz de eludir las barreras externas de permeabilidad ocular es administrar el fármaco directamente en la región de interés. Por ejemplo, la inyección intravítrea es común para la administración en el humor vítreo4. Del mismo modo, se utiliza la inyección intracameral para la administración en la cámara anterior5. El establecimiento de una concentración eficiente en la cámara anterior es crítico para diversas situaciones clínicas, como el tratamiento de la infección mediante la inyección intracameral de antibióticos y los tratamientos antiinflamatorios postoperatorios en cirugías de cataratas. A pesar de la ventaja de la biodisponibilidad mejorada de la sustancia que otorga la inyección intracameral, existen importantes problemas de seguridad que deben tenerse en cuenta. Por ejemplo, la inyección intracameral de fármacos puede inducir aumento de la presión intraocular, síndrome del segmento anterior tóxico y síndrome de destrucción de células endoteliales tóxicas 5,6. Por lo tanto, es esencial evaluar cuidadosamente en estudios preclínicos la eficacia y la seguridad de los fármacos administrados por inyecciones intracamerales para maximizar la eficacia del tratamiento y minimizar los posibles efectos adversos en los pacientes.
Los modelos animales experimentales son indispensables en los estudios preclínicos para investigar nuevos tratamientos. Los pequeños roedores, como los ratones y las ratas, son los animales de laboratorio más utilizados para tales fines. Estos animales exhiben numerosas similitudes con la anatomía y fisiología humanas, lo que proporciona información valiosa. Además, su uso es económicamente ventajoso debido a su pequeño tamaño, facilidad de mantenimiento, rápida gestación y capacidad para producir un gran número de crías7.
A pesar del uso generalizado de pequeños roedores en modelos de enfermedades oculares, sus dimensiones oculares y anatomía únicas plantean desafíos significativos durante las manipulaciones experimentales. Por ejemplo, procedimientos como las inyecciones intracamerales, que son relativamente sencillos en humanos, se vuelven técnicamente exigentes en ratones y ratas. Los desafíos se derivan de factores como el pequeño volumen de humor acuoso, el cristalino relativamente grande e inflexible, y la posición y curvatura obstructivas del cristalino dentro de los ojos de los roedores (Figura 1)8. Estos desafíos aumentan el riesgo de daño durante las inyecciones intracamerales en roedores, lo que conduce a posibles efectos adversos e introduce variabilidad experimental que puede afectar la validez de las conclusiones del estudio. En nuestra investigación, hemos desarrollado con éxito un procedimiento para la inyección intracameral segura en ratas. La técnica consiste en crear un túnel largo, plano y autosellante en la córnea hacia la cámara anterior. Este método no solo garantiza la precisión, sino que también mejora la reproducibilidad experimental, abordando los problemas asociados con las técnicas de inyección en pequeños roedores.
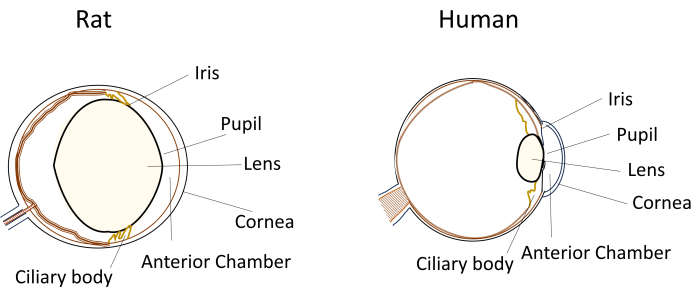
Figura 1: Representación esquemática de las características anatómicas del segmento anterior de los ojos de rata y humano. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Los experimentos en el protocolo fueron aprobados por el Comité Nacional de Permisos para la ciencia animal y cumplen con la Declaración de ARVO sobre el uso de animales en la investigación oftálmica y de la visión. Para el presente estudio se utilizaron ratas hembras Sprague-Dawley, de 8 a 10 semanas de edad, y se expusieron a ciclos de luz-oscuridad de 12/12 h. Los animales se obtuvieron de una fuente comercial (ver Tabla de Materiales).
1. Preparación animal
- Preparar una mezcla anestésica de ketamina (80 mg/kg de peso corporal en 0,8 mL) y xilacina (4 mg/kg de peso corporal en 0,2 mL) e inyectarla intraperitonealmente en una sola inyección para anestesiar a las ratas.
- Inyectar buprenorfina analgésica (0,03 mg/kg) por vía intraperitoneal en una sola inyección.
- Aplique anestésico oftálmico tópico oxibuprocaína al 0,4% en ambos ojos.
2. Creación de un túnel corneal autosellante
- Estabilice el ojo sosteniendo la esclerótica superior en la línea media vertical junto a la unión córneoescleral con pinzas oftálmicas quirúrgicas.
- Bajo un microscopio quirúrgico, coloque una hoja de tacón de aguja estéril de 0,8 mm y 31 G en la región córnea paracentral en la línea media vertical (por encima del centro de la pupila) en una posición plana en un ángulo lo más cercano posible a la horizontal (Figura 2).
- En esta posición, punción de la córnea para hacer una incisión y crear un túnel largo (2-3 mm) hasta que penetre en la zona central de la cámara anterior. Evite tocar la lente (Figura 2).
NOTA: Un túnel exitoso no inducirá fugas del humor acuoso ni poca profundidad de la cámara anterior. - Aplique dexametasona al 0,3% y dexametasona al 0,1% en el ojo inyectado.
- Examine bajo microscopía de hendidura de la siguiente manera.
- Observe la profundidad de la cámara anterior del ojo inyectado en comparación con el ojo no inyectado.
NOTA: La profundidad debe ser similar. - Observe el cristalino del ojo inyectado en comparación con el ojo no inyectado.
NOTA: La lente debe ser transparente. La opacidad puede reflejar el daño del cristalino durante el procedimiento quirúrgico.
- Observe la profundidad de la cámara anterior del ojo inyectado en comparación con el ojo no inyectado.
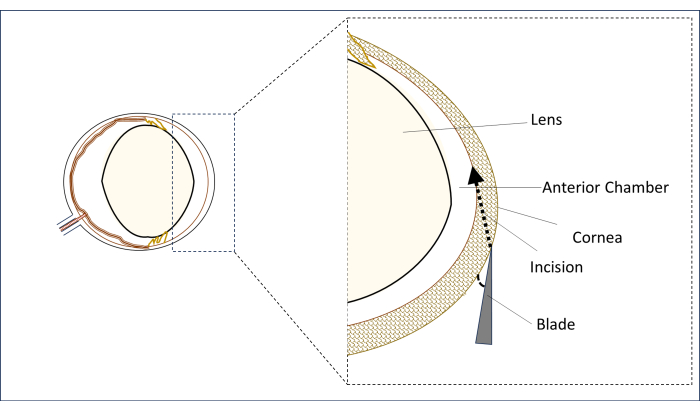
Figura 2: Representación esquemática de la cuchilla y el ángulo y la posición de la incisión. Haga clic aquí para ver una versión más grande de esta figura.
3. Opción 1: Inyección intracameral de azul de tripán para evaluar el éxito de la inyección en la cámara anterior
- Cargue 5 μL de azul de tripán en una jeringa Hamilton estéril de vidrio de 10 μL con una aguja roma de 34 G.
NOTA: La inyección de azul de tripán se describe como un medio para evaluar el éxito de la inyección durante las etapas de calibración o configuración del modelo. En los entornos experimentales, la jeringa puede cargarse con una solución del compuesto elegido. - Inserte la aguja de la jeringa cargada a través del túnel creado en la sección 2 hacia la cámara anterior.
- Inyecte y sostenga la aguja en su lugar después de la inyección durante 2-3 segundos hasta que todo el líquido se aclare.
- Retire la aguja tirando de ella suave y lentamente para evitar fugas del túnel corneal.
- Examinar bajo microscopía de hendidura. Evalúe la profundidad de la cámara anterior para excluir la superficialidad y verifique la presencia de azul de tripán en la cámara anterior.
- Repita el examen de hendidura después de 24 h, 48 h y 72 h.
4. Opción 2: Inyección intracameral de Hoechst para evaluar la biodisponibilidad del material inyectado en la capa de células endoteliales
- Cargue 5 μL de Hoechst en una jeringa Hamilton estéril de vidrio de 10 μL con una aguja roma de 34 G.
NOTA: La inyección de Hoechst se describe como un medio para evaluar la biodisponibilidad del material inyectado por absorción en la capa de células endoteliales y es útil durante las etapas de calibración o configuración del modelo. En los entornos experimentales, la jeringa puede cargarse con una solución del compuesto elegido. - Inserte la aguja de la jeringa cargada a través del túnel creado en la sección 2 hacia la cámara anterior.
- Inyecte y sostenga la aguja en su lugar después de la inyección durante 2-3 segundos hasta que todo el líquido se aclare.
- Retire la aguja tirando de ella suave y lentamente para evitar fugas de la incisión del túnel corneal.
- Aproximadamente 15-20 minutos después de la inyección, eutanasiar a las ratas mediante una inyección intraperitoneal de 500 mg/kg de pentobarbitona sódica.
- Enuclear ambos ojos y aislar las córneas. Recoja la córnea no inyectada como control.
- Tiñe ambas córneas con Alizarin Red S al 0,5% de acuerdo con las instrucciones del fabricante para identificar las células endoteliales.
- Examinar bajo un microscopio óptico para obtener imágenes de la tinción de rojo alizarina de las células endoteliales y bajo un microscopio fluorescente para observar la tinción de Hoechst, en comparación con la córnea no inyectada como control.
Resultados
Las ratas Sprague Dawley fueron inyectadas por vía intracameria con 5 μL de azul de tripano de acuerdo con el protocolo descrito anteriormente. El examen con lámpara de hendidura inmediatamente después de la inyección demostró que la cámara estaba teñida con azul tripano, lo que indica que el material inyectado alcanzó la cámara anterior (Figura 3). Además, la profundidad de la cámara anterior estaba intacta, lo que sugiere que la inyección no c...
Discusión
Los modelos de investigación preclínica deben proporcionar un entorno controlado y reproducible para garantizar la fiabilidad y aplicabilidad de los hallazgos. En la investigación oftalmológica, los modelos de inyección ocular se utilizan comúnmente en diversos aspectos de la investigación que van desde el establecimiento de modelos de enfermedad, la prueba de nuevos tratamientos y la evaluación de las reacciones tisulares y los posibles efectos adversos.
Divulgaciones
Marcovich A. L. es titular de patentes en Steba Biotech, Yeda Weizmann, EyeYon Medical y Mor Isum y es consultor de EyeYon Medical y Johnson & Johnson. Todos los demás autores no tienen intereses contrapuestos.
Agradecimientos
Esta investigación fue apoyada por las subvenciones 2670/23 y 1304/20 de la Fundación Científica de Israel.
Materiales
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
Referencias
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. . Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269 (2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. . The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574 (2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416 (2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados