Organoides del epitelio de la superficie del ovario humano como plataforma para estudiar la regeneración de tejidos
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe el establecimiento de organoides tisulares tridimensionales (3D) a partir de células primarias del epitelio de superficie ovárica humana (hOSE). El protocolo incluye el aislamiento de hOSE a partir de ovarios recién recolectados, la expansión celular de la hOSE, los procedimientos de criopreservación-descongelación y la derivación de organoides. Se incluyen la inmunofluorescencia, el análisis cuantitativo y la demostración de su utilidad como plataforma de cribado.
Resumen
El epitelio de la superficie ovárica (OSE), la capa más externa del ovario, se rompe durante cada ovulación y desempeña un papel crucial en la cicatrización de las heridas ováricas, al tiempo que restaura la integridad ovárica. Además, el OSE puede servir como fuente de cánceres epiteliales de ovario. Aunque las propiedades regenerativas de la OSE se han estudiado bien en ratones, la comprensión del mecanismo preciso de reparación de tejidos en el ovario humano sigue obstaculizada por el acceso limitado a los ovarios humanos y los protocolos de cultivo in vitro adecuados. Los organoides específicos de tejidos, modelos in vitro miniaturizados que replican aspectos estructurales y funcionales del órgano original, ofrecen nuevas oportunidades para estudiar la fisiología de los órganos, el modelado de enfermedades y las pruebas de fármacos.
Aquí, describimos un método para aislar OSE humano primario (hOSE) de ovarios completos y establecer organoides hOSE. Incluimos una caracterización morfológica y celular que muestra heterogeneidad entre donantes. Además, demostramos la capacidad de este método de cultivo para evaluar los efectos hormonales sobre el crecimiento de organoides OSE durante un período de 2 semanas. Este método puede permitir el descubrimiento de factores que contribuyen a la regeneración de la OSE y facilitar la detección de fármacos malignos específicos para cada paciente.
Introducción
El ovario se considera uno de los órganos más dinámicos del cuerpo, que experimenta ciclos constantes de cicatrización y remodelación de heridas a lo largo de la vida reproductiva del individuo. Un actor principal implicado en la regeneración del tejido ovárico después de cada ciclo ovulatorio es el epitelio de superficie ovárica (OSE)1. El OSE es una capa única derivada del mesotelio que contiene células epiteliales planas, cuboidales y cilíndricas que cubren toda la superficie ovárica2. Antes de la ovulación, el tejido estromal ovárico en la superficie del folículo ovulatorio sufre una interrupción proteolítica para permitir la liberación del complejo cúmulo-ovocito. A continuación, se repara la zona lesionada, conocida como estigma ovulatorio, y se consigue el cierre completo de la superficie ovárica en menos de 72 horas en ratones3. La alta eficiencia de la capacidad de la OSE para proliferar y cerrar la herida ovulatoria pone de manifiesto la supuesta existencia de una población de células madre residentes4. Debido a la limitada disponibilidad de ovarios humanos de donantes en edad reproductiva, la mayor parte del conocimiento sobre los mecanismos de reparación de la OSE proviene de modelos animales. Sin embargo, las características específicas de cada especie dificultan la traslación de la investigación ovárica basada en animales a los humanos5.
Los estudios in vitro han utilizado predominantemente el cultivo celular bidimensional (2D) de OSE humano, en el que las células crecieron en una monocapa adherida a la superficie de una placa de cultivo, debido a su rentabilidad y facilidad de cultivo 6,7,8. Sin embargo, este abordaje tiene limitaciones para replicar la complejidad de la dinámica del tejido ovárico9. En este sentido, las plataformas de cultivo celular en 3D, con especial atención a los organoides ováricos, han revolucionado la investigación ovárica10. Los organoides tisulares son representaciones in vitro miniaturizadas del órgano del que se derivan, exhibiendo capacidad de autoorganización en 3D e imitando funciones y estructuras clave de sus contrapartes in vivo 11. Esta tecnología ofrece la posibilidad de arrojar luz sobre cuestiones fundamentales relacionadas con el desarrollo, la regeneración y la reparación de tejidos en el ovario humano10. En los últimos años, los investigadores también han aplicado el conocimiento sobre los organoides ováricos para la generación de organoides de cáncer de ovario (CO) específicos de cada paciente para el modelado de enfermedades y la medicina personalizada 12,13,14.
Basándonos en diferentes métodos utilizados para la generación de organoides OSE de ratón y organoides de trompas de Falopio (FT)15,16, así como organoides OSEhumanos 12 y organoides FT17, describimos aquí un protocolo para la derivación de organoides OSE humanos a partir de ovarios humanos con aplicaciones potenciales en estudios de regeneración de OSE. Este protocolo aísla de manera eficiente las células OSE primarias de los ovarios humanos completos e incluye una descripción paso a paso de la expansión celular 2D y la generación de organoides hOSE 3D. Los organoides hOSE mostraron variabilidad (específica del donante) en morfología y crecimiento, lo que destaca su utilidad para estudios personalizados. Además, este protocolo incluye el mantenimiento de organoides hOSE, el paso y la inmunofluorescencia dentro de la misma placa de cultivo. Además, proporciona una descripción de las diferentes morfologías que pueden adoptar los organoides hOSE y caracteriza los cambios en el inmunofenotipo durante el cultivo. Por último, muestra la utilidad al investigar la influencia de las señales ambientales, como las hormonas ováricas, en la formación y el crecimiento de organoides hOSE en función del número y el tamaño de los organoides hOSE.
La aplicación de la tecnología de organoides hOSE mejorará nuestra comprensión del ovario, con un énfasis específico en los mecanismos responsables de su notable capacidad regenerativa. A medida que los modelos ováricos humanos en 3D continúen evolucionando, la dependencia de los modelos animales en la investigación ovárica disminuirá, lo que conducirá a terapias innovadoras en el campo de la medicina regenerativa18.
Protocolo
El estudio se llevó a cabo de acuerdo con las directrices de la Declaración de Helsinki. El diseño del estudio se presentó al Comité de Ética Médica del Centro Médico de la Universidad de Leiden (LUMC) y se obtuvo una carta de no objeción (B18.029) antes del estudio. El tejido ovárico humano primario utilizado se recolectó de personas transmasculinas sometidas a cirugía de afirmación de género en el hospital VUmc (Ámsterdam, Países Bajos). Se obtuvo el consentimiento informado firmado de todos los donantes. Todos los materiales utilizados en este protocolo se enumeran en la Tabla de Materiales.
1. Aislamiento de células OSE primarias humanas
- Después de la ooforectomía, coloque los ovarios en NaCl al 0,9% o en una solución salina estéril similar y transpórtela al laboratorio en hielo.
- Transfiera los ovarios individuales a un tubo cónico de 50 mL que contenga 2-3 mL de medio digestivo (Tabla 1) o suficiente para cubrir el ovario.
PRECAUCIÓN: Si el ovario no está intacto (se ha cortado parte del órgano para su análisis histológico), es crucial no cubrir esta parte con el medio de digestión. - Coloque el tubo en un baño de perlas precalentado (o baño de agua) a 37 °C durante 30 min.
- Transfiera cuidadosamente el ovario a una placa de Petri de 60 mm que contenga 10 mL de medio de recolección (Tabla 1).
- Raspe suavemente la superficie ovárica que contiene las células hOSE con un raspador de células. Lave el raspador en el medio y repita este paso al menos tres veces (Figura 1).
PRECAUCIÓN: Si el ovario no está intacto, evite raspar y sumergir el área dañada para minimizar la contaminación con tipos de células no deseadas. - Transfiera las células hOSE en el medio de recolección a un tubo de 15 ml.
- Centrifugar las células hOSE a 240 x g durante 5 min.
- Si el pellet muestra un color rojo, indicativo de contaminación con glóbulos rojos (RBC), vuelva a suspender el pellet con 1 mL de tampón de lisis de RBC. Incubar durante 3 min a temperatura ambiente (RT) con pipeteo ocasional, añadir 4 mL de PBS con calcio y magnesio (PBS+/+) y centrifugar a 240 x g durante 5 min. Si los glóbulos rojos persisten, repita este paso.
- Criopreservar el pellet de células hOSE (Sección 2), utilizarlo para cultivo 2D (Sección 3) u organoides 3D (Sección 4) (Figura 1).
2. Criopreservación-descongelación de células hOSE
- Crioconservación
- Vuelva a suspender el pellet de células hOSE en 1 ml de medio de congelación de células.
- Transfiera la suspensión celular a crioviales (2x crioviales por ovario).
- Coloque los crioviales en un recipiente de congelación y colóquelo a -80 °C durante la noche.
- Transfiera los crioviales congelados a un tanque de nitrógeno líquido para su almacenamiento a largo plazo.
- Descongelación:
- Retire el criovial del nitrógeno líquido.
- Coloque el criovial en un baño de perlas precalentado (o baño de agua) a 37 °C durante 5 minutos o hasta que solo se vea un pequeño núcleo congelado dentro del criovial.
- Pipetear la suspensión celular hOSE en un tubo de 15 mL con 10 mL de medio de recolección (Tabla 1).
- Centrifugar a 240 x g durante 5 min.
- Utilice el pellet de células hOSE para cultivo 2D (Sección 3) u organoides 3D (Sección 4).
3. Cultivo 2D hOSE en monocapa
- Vuelva a suspender el pellet de hOSE en 1 mL de medio OSE_2D (Tabla 1) y transfiéralo a un pocillo desde una placa de 12 pocillos.
- Añada 1 mL de medio extra de OSE_2D en el pocillo y cultive a 37 °C en una incubadora humidificada (5% de CO2) durante 72 h para asegurar que las células hOSE se adhieran antes del primer cambio de medio.
- Actualice los medios cada 2-3 días hasta que las células hOSE alcancen el 70%-90% de confluencia (P0) (Figura 2A).
NOTA: Si los glóbulos rojos todavía están presentes en el cultivo, se eliminarán durante el primer cambio de medio y solo las células hOSE permanecerán unidas al pocillo. - Para pasar las células hOSE, siga los pasos que se describen a continuación.
- Retire los medios de cultivo del pozo.
- Lavar con 1 mL de PBS estéril.
- Retire el PBS y añada suficiente tripsina/EDTA al 0,05% para cubrir las células.
- Coloque la placa a 37 °C en una incubadora humidificada (5% CO2) durante 4-7 min hasta que note que las células se redondean y se desprenden del pocillo.
- Detenga la reacción enzimática agregando 1 mL de medio de recolección.
- Recoja las células hOSE y centrifugue a 240 x g durante 5 min.
- Coloque las células de siembra en un nuevo pocillo a la densidad deseada, refresque los medios cada 2-3 días hasta que las células hOSE alcancen el 70%-90% de confluencia y repita el paso 3.4.
NOTA: Las células hOSE primarias se pueden cultivar hasta tres veces. Posteriormente, la mayoría de las células se volverán senescentes (Figura 2A).
- Utilice las células hOSE expandidas para una caracterización adicional mediante inmunofluorescencia (Figura 2B) para probar los efectos de los medios de cultivo (Figura 2C) o para organoides 3D (Sección 4).
4. 3D cultivo de organoides hOSE
- Portaobjetos precalentado con cámara de pocillos múltiples a 37 °C.
- Recuento (recién aislado o criopreservado-descongelado) de células hOSE con un contador de células automatizado o manualmente con un hemocitómetro.
- Vuelva a suspender el número deseado de células hOSE a 1 mL de medio básico de organoide OSE helado (Tabla 1) en un tubo de 1,5 mL.
- Centrifugar a 240 x g durante 5 min.
- Vuelva a suspender el pellet de hOSE en la cantidad deseada de solución de extracto de membrana basal (BME) sin diluir helada para obtener una concentración celular de 1 x 104 células/10 μL de BME.
- Pipetea la solución hOSE-BME hacia arriba y hacia abajo para garantizar una distribución homogénea.
- Produzca 10 μL de gotas de solución de hOSE-BME por pocillo en el portaobjetos precalentado de múltiples pocillos.
NOTA: Asegúrese de que cada gota esté en el centro del pozo para obtener una forma de gota. - Coloque la placa con las gotas boca abajo a 37 °C en una incubadora humidificada (5% CO2) durante 15 min para permitir la solidificación del gel.
- Añadir 100 μL de medio OSE_3D (Tabla 1) y cultivar a 37 °C en una incubadora humidificada (5% CO2).
- Refresque el medio cada 3-4 días.
NOTA: los organoides hOSE continúan creciendo al menos hasta 28 días en cultivo (Figura 3A, B), pero se recomienda el paso cada 14-28 días (la tasa de crecimiento depende del donante, fresco versus criohOSE) para estimular la proliferación celular y la supervivencia de los organoides. Tres líneas independientes de organoides hOSE fueron transitadas al menos 4 veces sin signos de senescencia. Los organoides hOSE muestran diferentes morfologías (Figura 3C). - Para el paso de organoides hOSE:
- Retire el medio y agregue 100 μL de DMEM/F12 avanzado helado a cada pocillo.
- Raspe el fondo de los pocillos con una punta de pipeta P1000 para separar las gotas de gel.
- Transfiera cada gota de gel flotante a un tubo de 1,5 ml.
- Centrifugar los tubos con las gotas de gel a 240 x g durante 5 min.
- Retire el sobrenadante, vuelva a suspender el pellet en 300 μL de tampón de disociación celular y coloque los tubos en un baño de perlas precalentado (o baño de agua) a 37 °C durante 5-10 min.
NOTA: Si algunos organoides permanecen intactos, pipetee hacia arriba y hacia abajo un par de veces con la punta de pipeta helada recubierta de suero bovino fetal para interrumpirlos mecánicamente. El recubrimiento de las puntas de las pipetas con suero fetal bovino evita que los organoides se adhieran a la punta. - Añadir 300 μL de medio básico organoide hOSE y centrifugar a 240 x g durante 5 min.
- Vuelva a suspender el pellet en la cantidad deseada de solución de BME sin diluir, vuelva a sembrarlos en una proporción adecuada (distribuya el contenido de 1 gota en 1-4 gotas) y cultive como se mencionó anteriormente.
NOTA: Los organoides no se disocian en células individuales y, por lo tanto, las células no se pueden contar con precisión para su posterior paso.
5. Inmunofluorescencia de montaje completo de organoides 3D hOSE
NOTA: La inmunofluorescencia de montaje completo se puede realizar en el mismo pocillo de cultivo (en gota) si se utilizan portaobjetos de cámara múltiple adecuados para técnicas de microscopía.
- Fije los organoides hOSE en las gotas con paraformaldehído (PFA) al 4% durante 20 min en RT.
- Lavar dos veces con PBS durante 5 min en RT en una plataforma giratoria/agitadora.
- Permeabilizar los organoides hOSE en las gotas utilizando 100 μL de tampón de permeabilización (Tabla 1) durante 15 min en RT.
- Lavar tres veces con 100 μL de tampón de bloqueo (Tabla 1) durante 15 min a RT y bloquear durante la noche (o/n) a 4 °C en una plataforma giratoria/agitadora.
- Incubar con 100 μL de mezcla de anticuerpos primarios diluida en tampón de bloqueo a 4 °C o/n en una plataforma giratoria/agitadora.
NOTA: Consulte la Tabla de materiales para obtener una lista de los anticuerpos primarios utilizados, el tipo de célula marcado y el modelo animal utilizado para validar la expresión 12,19,20,21,22,23,24,25. - Acerque la placa a RT y lávela tres veces con 100 μL de tampón de bloqueo durante 15 min a RT en una plataforma giratoria/agitadora.
- Incubar con 100 μL de mezcla de anticuerpos secundarios diluidos en tampón de bloqueo durante 2 h a RT en una plataforma giratoria/agitadora, pero protegida de la luz.
NOTA: Consulte la Tabla de materiales para obtener una lista de los anticuerpos secundarios utilizados. Para protegerlo de la luz, coloque la placa dentro de una caja oscura o cúbrala con papel de aluminio. - Lavar tres veces en 100 μL de PBS durante 15 min en RT sobre una plataforma giratoria/agitadora.
- Guarde la placa a 4 °C cubierta con papel de aluminio hasta obtener imágenes (Figura 4).
6. Cuantificación del tamaño del organoide hOSE
- Tome imágenes de campo claro de 10x (imagen TIFF) con un microscopio.
- Descarga e instala Fiji (https://imagej.net/software/fiji/)26.
- Mida el área de imagen de los organoides hOSE con el software ImageJ Fiji:
- Cargue archivos TIFF de imagen en Fiji.
- Cree un umbral para que el software reconozca los organoides hOSE (área más oscura) en la imagen de campo claro cargada haciendo clic en Imagen > Ajustar > umbral. Ajuste los valores por debajo y por encima hasta que se elimine la mayor parte del fondo y se conserven los organoides individuales.
- Abra la herramienta ROI haciendo clic en Analizar > herramienta > ROI.
- Seleccione la herramienta Varita y haga clic en la región con un organoide hOSE hasta ver una línea amarilla que rodea todo el perímetro del organoide. En el panel ROI, haga clic en Agregar y medir para obtener el valor de área de ese organoide OSE.
- Repita el paso 6.3.4. para cada organoide hOSE que se va a medir.
Resultados Representativos
Cultivo hOSE 2D
Las células hOSE recién aisladas se sembraron en una placa de 12 pocillos y se cultivaron durante 3 semanas. Durante este período, las células fueron pasadas tres veces (Figura 2A). Las células primarias de hOSE en cultivo exhibieron una morfología similar a un adoquín hasta el pasaje 3 (P3), pero posteriormente comenzaron a mostrar signos de senescencia, de acuerdo con los resultados previos que informan el período limitado de paso de hOSE27. Además, se ha demostrado que el OSE murino experimenta una transición epitelial a mesenquimal (EMT) in vitro, mostrando características similares a las de los fibroblastos, como el reordenamiento del citoesqueleto de actina y la deposición de colágeno I19. De acuerdo, ACTA2+CD44+ hOSE mostró una pronunciada regulación positiva de COL1A1 entre P2 y P3 (Figura 2B), lo que sugiere que las células hOSE se someten a EMT durante el cultivo.
La señalización de TGF-β es un importante regulador de EMT28 capaz de inducir EMT en varios tipos de células epiteliales29. Aunque el TGF-β no se añadió al medio OSE_2D, el FBS añadido podría contener niveles detectables de esta citocina30,31. Por esta razón, probamos si la adición del receptor SB-431542 del inhibidor de TGF-β tipo I podría prevenir la EMT, permitiendo un cultivo 2D prolongado. Sorprendentemente, la suplementación del medio OSE_2D con 10 μM de SB-43154232dificultó la proliferación celular (Figura 2C). Llegamos a la conclusión de que la señalización de TGF-β es esencial para la proliferación de OSE, y se realizaron más experimentos de cultivo en 2D sin el inhibidor.
Cultivo de organoides hOSE en 3D
Sobre la base de las condiciones de cultivo publicadas para cultivar organoides OSE humanos12, derivamos organoides hOSE incrustados en gotas de BME y cultivados en medio OSE_3D (que contiene una concentración estándar de 100 nM de estradiol) durante un máximo de 28 días. En 7 días, muchos organoides hOSE derivados de células OSE recién aisladas eran quísticos con un diámetro promedio de 130 mm (Figura 3A,B). Estos resultados fueron similares a los reportados por Kopper y sus colegas sobre la derivación de organoides hOSE a partir de tejido ovárico humano picado y digerido enzimáticamente12. Curiosamente, los organoides hOSE derivados de células OSE recién aisladas crecieron más (diámetro promedio de 160 mm) que los organoides hOSE de células OSE expandidas en 2D (diámetro promedio de 100 mm) después de 14 días en cultivo (Figura 3B), probablemente debido a la propensión de las células OSE expandidas en 2D a disminuir la proliferación. Además, mientras que muchos organoides hOSE 3D consistían en una monocapa de células epiteliales planas (Figura 3C , panel superior izquierdo), algunos exhibían una monocapa cuboidal de células (Figura 3C , panel superior derecho), otros eran multicapa (Figura 3C , panel inferior derecho) o formaban un grupo de células no lumenizadas (Figura 3C , panel inferior izquierdo).
Para probar si los organoides de hOSE también podían obtenerse utilizando OSE_2D medio, las células hOSE recién aisladas se incrustaron en gotas de BME y se cultivaron en medios OSE_2D durante 12 días. Después de 6 días, las células en forma de hOSE eran visibles, lo que sugiere que las células hOSE estaban sufriendo EMT en las gotas. Es importante destacar que no se formaron organoides hOSE utilizando OSE_2D medio (Figura 3D).
Características celulares de los organoides hOSE
En el ovario adulto humano, la queratina 8 (KRT8) marca específicamente la población de OSE (Figura 4A) y, en consecuencia, los organoides hOSE retuvieron la expresión de KRT8, validando su identidad celular (Figura 4B). En las células OSE de ratón, la localización nuclear de la proteína asociada a Yes1 (YAP1) se asoció específicamente con las células madre/progenitoras de OSE capaces de expandirse y curar el área lesionada después de la ovulación24,33. YAP mostró localización nuclear en la mayoría de las células de los organoides hOSE, independientemente de su tamaño (Figura 4B). También se investigaron otros marcadores que se expresan en células OSE de ratón, como CD4420 y LGR522. Curiosamente, tanto CD44 como LGR5 se expresaron en organoides hOSE pequeños (<100 μm de diámetro), mientras que en organoides más grandes, CD44 y LGR5 parecían estar regulados a la baja (Figura 4B).
A continuación, investigamos si los organoides hOSE mostraban la polaridad apical-basal típicamente observada en los organoides embebidos en BME (apical-in)34. Se utilizaron la proteína basolateral integrina beta 1 (ITGB1) y la proteína apical podocalixina (PODXL) para mostrar la polaridad celular en los organoides hOSE, confirmando una clara polaridad apical-in independiente del tamaño del organoide hOSE (Figura 4B).
Se sabe que el OSE humano expresa el marcador mesenquimal N-cadherina (CDH2), mientras que la expresión del marcador epitelial E-cadherina (CDH1) se limita a las células OSE columnares (Figura 4A)2. Curiosamente, los organoides hOSE derivados en este trabajo expresaron los marcadores mesenquimales CDH2 y vimentina (VIM), y los organoides hOSE quísticos grandes con epitelios cuboides/columnares fueron tanto CDH1+ como CDH2+VIM+ (Figura 4C). Todavía no está claro si los organoides CDH1+ hOSE se derivaron de células OSE CDH1+ primarias o de células CDH1-OSE que sufrieron diferenciación epitelial o transformación (neoplásica) in vitro25,35.
Demostración del uso de organoides hOSE: efecto de las señales ovulatorias en los organoides hOSE
Las hormonas hormona foliculoestimulante y gonadotropina coriónica humana pueden utilizarse para inducir el crecimiento folicular y la ovulación, mientras que, después de la ovulación, se produce un marcado aumento en la concentración de hormonas producidas por los ovarios, como la progesterona y el estradiol36. Para mostrar la utilidad de los organoides hOSE como plataforma de cribado, examinamos el efecto de estas hormonas en los organoides hOSE, utilizando el número y el tamaño de los organoides como resultado de la cuantificación (utilizando Fiji). Para ello, derivamos organoides hOSE en OSE_3D medios que carecían de estradiol (sin hormona) y en OSE_3D medios que contenían FSH, hCG, estradiol o progesterona a diferentes concentraciones (Figura 5A).
Se cuantificó el número de organoides hOSE derivados de células hOSE criopreservadas-descongeladas (no expandidas) de 3 donantes diferentes (n=3) por gota después de 7 días de cultivo (Figura 5A,B). Los medios de cultivo se cambiaron cada 3 días. No se observaron diferencias significativas en el número total de organoides hOSE por gota que se formaron en las hormonas que contenían medio en comparación con el medio sin hormonas (Figura 5A,B). Para cuantificar el efecto de las hormonas en el tamaño de los organoides, después de 14 días en cultivo, se tomaron imágenes de cada gota (de cada condición) y se midió el área de los 4 organoides hOSE más grandes utilizando Fiji. Curiosamente, la generación de organoides hOSE a partir de dos donantes diferentes (n = 2) en presencia de progesterona (1000 nM) o estradiol (200 nM) dio como resultado al menos un organoide muy grande (alrededor de 700 μm de diámetro) por gota (Figura 5C,D).
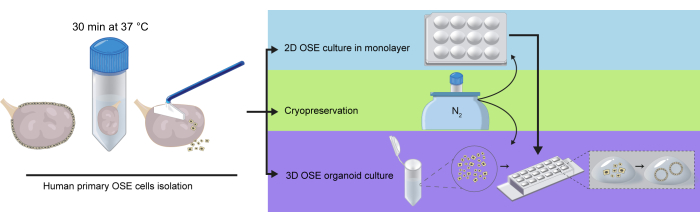
Figura 1: Representación esquemática del aislamiento de células hOSE de ovarios completos. Los ovarios se incubaron en solución de digestión durante 30 min a 37 °C. Las células hOSE se desprendieron de la superficie ovárica mediante raspado suave y posteriormente se criopreservaron, se sembraron directamente en cultivo 2D de OSE en monocapa o se incrustaron en extracto de membrana basal (BME) para cultivo de organoides hOSE en 3D. Las células hOSE criopreservadas-descongeladas se pueden utilizar para el cultivo 2D o la formación de organoides en 3D, y las células hOSE expandidas en 2D se pueden utilizar para generar organoides hOSE en 3D. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cultivo primario 2D de células hOSE. (A) Imágenes de campo claro de células hOSE en los pasajes 0 (P0), 2 (P2) y 3 (P3) que representan la morfología típica de los adoquines epiteliales. Las barras de escala son de 750 μm en los paneles superiores y de 125 μm en los paneles inferiores. (B) Inmunofluorescencia para ACTA2, CD44, COL1A1 en células hOSE 2D en P2 y P3. Las barras de escala son de 50 μm. (C) Imágenes de campo claro de células hOSE cultivadas con 10 μM de SB-431542 en P0, P2 y P3. Las células mostraron signos de senescencia de P2 y no alcanzaron una alta confluencia durante el cultivo. Las barras de escala son de 750 μm en los paneles superiores y de 125 μm en los paneles inferiores. Haga clic aquí para ver una versión más grande de esta figura.
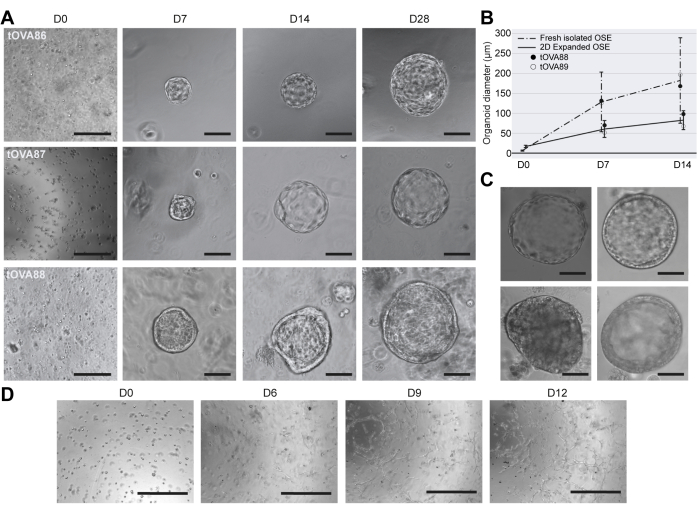
Figura 3: Caracterización morfológica de organoides hOSE. (A) Imágenes de campo claro de tres derivaciones independientes de organoides hOSE de tres donantes diferentes (tOVA86, tOVA87, tOVA88). Las imágenes se tomaron después de la inclusión celular (D0), el día 7 (D7), el día 14 (D14) y el día 28 (D28) de cultivo. Las barras de escala son de 750 μm en D0 y de 50 μm para el resto. (B) Diámetro de los organoides hOSE derivados de células hOSE recién aisladas (línea discontinua) y células hOSE expandidas en 2D (línea sólida). Se muestra el tamaño promedio ± la desviación estándar medidos en D0, D7 y D14. Se muestran los resultados de dos donantes diferentes (tOVA88 y tOVA89). (C) Imágenes de campo claro de organoides hOSE que muestran diferentes morfologías: una sola capa plana (arriba a la izquierda), una sola capa columnar (arriba a la derecha), multicapa (abajo a la derecha) y agregado celular no lumenizado (abajo a la izquierda). Las barras de escala son de 100 μm. (D) Imágenes de campo claro de células hOSE incrustadas en BME y cultivadas durante 12 días con medios OSE_2D. Las imágenes se tomaron después de la inclusión de células (D0), el día 6 (D6), el día 9 (D9) y el día 12 (D12). Las células similares a los fibroblastos superaron al cultivo y no se formaron estructuras similares a organoides. Las barras de escala son de 750 μm. Haga clic aquí para ver una versión más grande de esta figura.
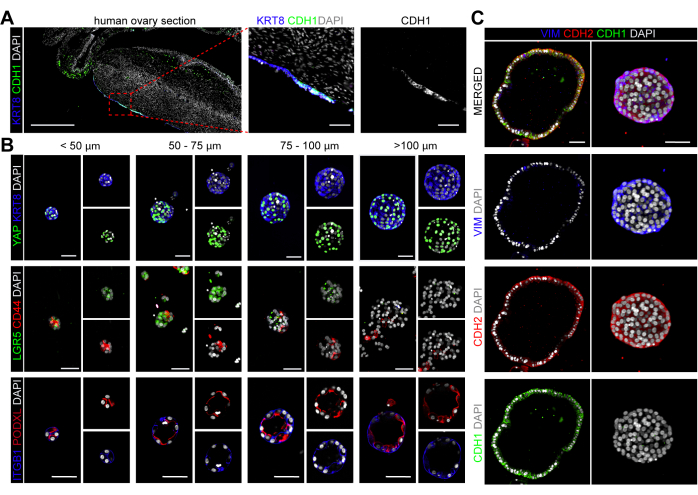
Figura 4: Caracterización celular de organoides hOSE. (A) Inmunofluorescencia para KRT8 y CDH1 en la sección ovárica humana. La barra de escala en el panel izquierdo es de 500 μm, y los paneles central y derecho son de 50 μm. (B) Inmunofluorescencia para KRT8 y YAP, LGR5 y CD44, e ITGB1 y PODXL en organoides hOSE de diferentes tamaños (<50 μm, 50-75 μm, 75-100 μm, >100 μm). Las barras de escala son de 50 μm. (C) Inmunofluorescencia para VIM, CDH1, CDH2 en organoides hOSE. Las barras de escala son de 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
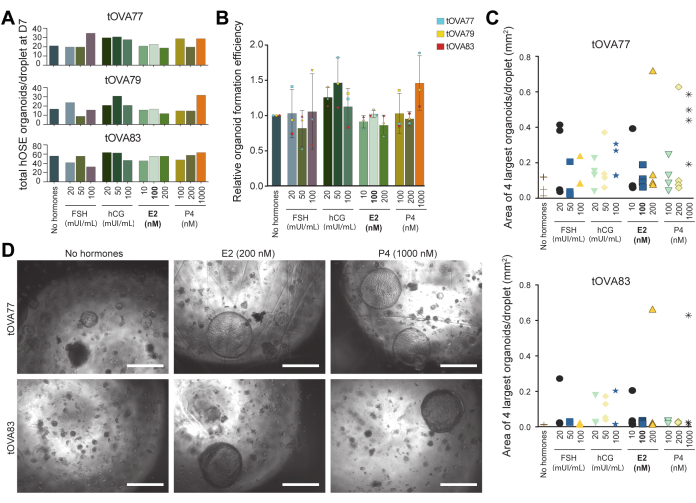
Figura 5: Efecto de las señales ovulatorias en la formación de organoides hOSE. (A) Número total de organoides hOSE por gota formada en el día 7 en diferentes medios de cultivo. Los organoides hOSE se derivaron de tres donantes diferentes (tOVA77, tOVA79, tOVA83). En negrita está el medio OSE_3D utilizado para la derivación de organoides. (B) Formación relativa de organoides en comparación con el medio sin hormonas. Los valores agrupados de los organoides hOSE se derivaron de tres donantes diferentes (tOVA77, tOVA79, tOVA83). (C) Gráfico que muestra el área de la imagen de los 4 organoides hOSE más grandes en el día 14 en cada una de las condiciones experimentales probadas de dos donantes diferentes (tOVA77, tOVA83). (D) Imágenes de campo claro que muestran organoides hOSE en el día 14 de cultivo con medio sin hormonas, 200 nM E2 y 1000 nM P4 de dos donantes diferentes (tOVA77, tOVA83). Las barras de escala son de 750 μm. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Composición de las soluciones de trabajo utilizadas en el estudio. Haga clic aquí para descargar esta tabla.
Discusión
La tecnología de organoides 3D se está convirtiendo en una herramienta indispensable para la investigación médica. Por un lado, esta plataforma in vitro ofrece la posibilidad de estudiar cuestiones mecanicistas fundamentales sobre la regeneración de tejidos, la cicatrización de heridas y el desarrollo18. Por otro lado, los organoides 3D derivados de muestras de pacientes permiten estudios de medicina personalizada, incluyendo diagnósticos, pruebas de fármacos y terapia celular 12,13,14,37,38. En el campo de la investigación ovárica, la hOSE ha ganado un interés sustancial desde su implicación como origen de los carcinomas epiteliales de ovario39. Aunque se cree que la mayoría de los carcinomas serosos de ovario de alto grado (HGSOC), uno de los cánceres epiteliales de ovario más comunes, surgen de las trompas de Falopio40, la investigación actual en organoides ováricos 3D de ratones ha propuesto un posible origen dual del HGSOC a partir de OSE y trompa de Falopio 15,16.
Aquí, describimos un protocolo para la derivación de organoides hOSE 3D y describimos su aplicación para aportar nuevos conocimientos mecanicistas en la regeneración de tejido ovárico. Este protocolo incluye un método paso a paso para aislar células hOSE primarias de ovarios humanos y generar organoides hOSE en 3D. Para garantizar una derivación eficiente de organoides hOSE, es crucial minimizar la manipulación ovárica. Debido a su ubicación en la superficie ovárica y a su organización monocapa, la hOSE es propensa a sufrir daños y pérdidas durante la ooforectomía y la manipulación de órganos. Por este motivo, hemos apostado por un método enzimático y de raspado aplicado a todo el ovario para aislar hOSE 2,8. En el presente protocolo, se aplicó un tratamiento enzimático suave para interrumpir las conexiones intercelulares hOSE, seguido de un raspado suave de la superficie ovárica.
Al comparar el cultivo 2D con el cultivo 3D de hOSE, es importante señalar que, a pesar de la alta tasa de proliferación inicial de las células hOSE en el cultivo 2D, sus características celulares se alteraron debido a la EMT, lo que sugiere que las condiciones de cultivo 2D aplicadas no son adecuadas para mantener una morfología epitelial. Por el contrario, los organoides 3D hOSE pudieron pasar al menos 4 veces sin signos de senescencia. El OSE_3D medio de cultivo de organoides utilizado se basó en el utilizado por Kopper y sus colegas para la derivación de OC y organoides hOSE sanos12 y por Kessler y colaboradores para la derivación de organoides FT humanos17. La principal diferencia fue la sustitución de los medios condicionados Wnt3a y R-Spondin-1 humanos por proteínas recombinantes disponibles comercialmente para facilitar la reproducibilidad.
Las técnicas de inmunofluorescencia suelen consistir en extraer la muestra de tejido de la placa de cultivo y procesarla para su corte en parafina o criosección. Cuando se trabaja con estructuras muy pequeñas, el riesgo de perderlas durante el procesamiento de muestras es alto. En este protocolo, la derivación de organoides hOSE se lleva a cabo en placas de cultivo celular que permiten la obtención de imágenes directas al microscopía sin necesidad de extraer los organoides hOSE de la matriz BME. Además, el método de inmunofluorescencia de montaje completo utilizado aquí, descrito por Rezanejad y sus colegas para organoides ductales pancreáticos41, permitió la observación in situ de la localización de proteínas dentro de organoides morfológicamente intactos. Demostramos que, al realizar este protocolo de inmunofluorescencia en organoides hOSE derivados en portaobjetos de múltiples pocillos, hay una penetración de anticuerpos altamente eficiente con una señal de fondo muy baja.
Aunque la mayoría de los organoides hOSE derivados mediante este método carecían de expresión de CDH1, se formaron algunos organoides CDH1+ hOSE, que alcanzaron tamaños más grandes en comparación con los organoides CDH1-hOSE. La expresión de CDH1 se ha asociado con fenotipos neoplásicos de hOSE 2,35. Los ovarios utilizados para el aislamiento de hOSE fueron donados por donantes transmasculinas sanas en edad reproductiva (27,1 ± 5 años). Estos donantes estuvieron bajo tratamiento con testosterona durante un período de 38 ± 15 meses antes de la ooforectomía. No podemos descartar la posibilidad de que las células CDH1+ hOSE en la superficie ovárica puedan atribuirse al tratamiento con testosterona. Aunque el tratamiento con andrógenos se ha relacionado con cambios ováricos, como la anovulación42, la hiperplasia del área cortical43 y el aumento de la rigidez cortical44, la patología ovárica general sigue siendo benigna mientras se usa testosterona45.
En resumen, este protocolo pone de manifiesto el potencial de la generación de organoides hOSE 3D para decodificar cuestiones mecanicistas sobre la regeneración del tejido ovárico. Es importante destacar que este método también podría aplicarse para la detección de células malignas presentes en biopsias de ovario de pacientes con riesgo de desarrollar cáncer. En conjunto, este método respalda las posibles aplicaciones de esta innovadora plataforma in vitro tanto para estudios fundamentales de la función ovárica como para aplicaciones clínicas para tratamientos médicos individualizados.
Divulgaciones
Ninguno.
Agradecimientos
Nos gustaría agradecer a todos los pacientes que donaron tejido para este estudio, a los miembros del grupo de Chuva de Sousa Lopes por sus útiles discusiones y a I. De Poorter por diseñar las caricaturas utilizadas en la Figura 1. Esta investigación ha sido financiada por el Consejo Europeo de Investigación, número de subvención ERC-CoG-2016- 725722 (OVOGROWTH) para J.S.D.V. y S.M.C.d.S.L.; y la Fundación Novo Nordisk (reNEW), subvención número NNF21CC0073729 para J.S.D.V. y S.M.C.d.S.L.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Invitrogen | 25200-056 | |
| 12-well Culture Plate | Corning | 3336 | Sterile |
| 15 mL tubes | Greiner | 188271 | Sterile |
| 28cm Cell Scraper | Greiner Bio-One | 541070 | |
| 50 mL tubes | Greiner | 227261 | Sterile |
| 60 mm Petri dish | Greiner Bio-One | 628160 | |
| A83-01 | Stem Cell Technologies | 72024 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement (50x) | ThermoFisher Scientific | 17504-044 | |
| Bead bath | M714 | ||
| Bovine serum albumin (BSA) | Sigma Aldrich | 10735086001 | |
| Cell Dissociation Buffer | ThermoFisher Scientific | 13151014 | |
| Cryo-container "Mr. Frosty" | BD Falcom | 479-3200 | |
| DMEM Medium | ThermoFisher Scientific | 41966-029 | |
| Donkey anti-Goat IgG Alexa Fluor 647 | Invitrogen | A-21447 | |
| Donkey anti-Mouse IgG Alexa Fluor 488 | Invitrogen | A-21202 | |
| Donkey anti-Mouse IgG Alexa Fluor 647 | Invitrogen | A-31571 | |
| Donkey anti-Rabbit IgG Alexa Fluor 488 | Invitrogen | A-21206 | |
| Donkey anti-Rabbit IgG Alexa Fluor 594 | Invitrogen | A-21207 | |
| Donkey anti-Sheep IgG Alexa Flour 647 | Invitrogen | A-21448 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | A4736401 | |
| Follicle Stimulating Hormone (FSH) | Sigma Aldrich | F4021 | |
| Forskolin | Peprotech | 6652995 | |
| Glutamax (100x) | Gibco | 35050-038 | |
| Goat anti-CDH2 (N/R-cadherin) | Santa Cruz | SC-1502 | Mesenchymal Cells; Wong et al 1999 (human)25 |
| Goat anti-PODXL (podocalyxin of GP135) | R&D Systems | AF1658 | Apical Polarity; Bryant et al 2014 (canine)21 |
| Goat anti-Rat IgG Alexa Fluor 555 | Invitrogen | A-21434 | |
| hEGF | R&D Systems | 263-EG | |
| HEPES | Gibco | 15630-056 | |
| Hydrocortisone | Sigma Aldrich | H0888 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS-X; 100x) | ThermoFisher Scientific | 51500-056 | |
| Liberase DH Research Grade | Sigma Aldrich | A4736401 | |
| Luna-II cell counter | Logos Biosystems | L40001 | |
| Matrigel | Sigma Aldrich | 354277 | |
| McCoy’s 5A Medium | ThermoFisher Scientific | 26600-023 | |
| Mouse anti-ITGB1 (integrin beta 1) | Santa Cruz | SC-53711 | Basolateral Polarity; Bryant et al 2014 (canine)21 |
| Mouse anti-KRT8 (cytokeratin 8) | Santa Cruz | SC-101459 | OSE Cells; Kopper et al 2019 (human)12 |
| Mouse anti-VIM (vimentin) | Abcam | AB0809 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Mycozap Plus-CL | Lonza | V2A-2011 | |
| N-Acetyl-L-cysteine | Sigma Aldrich | A9165 | |
| Nicotinamide | Sigma Aldrich | N0636-100G | |
| OVITRELLE-Choriogonadotropin alfa (hCG) | Merk | G03GA08 | |
| Progesterone (P4) | Sigma Aldrich | P8783 | |
| Rabbit anti-ACTA2 (alpha smooth muscle actin) | Abcam | AB5694 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Rabbit anti-CDH1 (E-cadherin) | Cell Signaling | CST 3195S | Epithelial Cells; Wong et al 1999 (human)25 |
| Rabbit anti-LGR5 | Abcam | AB75850 | OSE Progenitor Cells; Flesken-Nikitin et al 2013 (mouse)22 |
| Rabbit anti-YAP | Cell Signaling | 14074S | Proliferative OSE; Wang et al 2022 (mouse)24 |
| Rat anti-CD44 PE-conjugated | eBioscience | 12-0441-81 | OSE Progenitor Cells; Bowen et al 2009 (human)20 |
| Recombinant Human Heregulinβ-1 | Peprotech | 100-03 | |
| Recombinant Human Noggin | Peprotech | 120-10C | |
| Recombinant Human Wnt3a | R&D Systems | 5036-WN-010 | |
| Recombinant Rspondin-1 | Peprotech | 120-38 | |
| Red blood cells lysis buffer | eBiosciences | 00-4333-57 | |
| Revitacell Supplement (100x) | ThermoFisher Scientific | A26445-01 | |
| RNAse free DNAse | Qiagen | 79254 | |
| SB-431542 | Tocris Bioscience | 1624/10 | |
| Sheep anti-COL1A1 (pro-collagen 1 alpha 1) | R&D Systems | AF6220 | Mesenchymal Cells; Hosper et al 2013 (human)23 |
| Y-27632 | StemCell Technologies | 72304 | |
| β-Estradiol (E2) | Sigma-Aldrich | E8875 | |
| μ-Slide 18-well culture plate | Ibidi | 8181 | Sterile |
Referencias
- Ng, A., Barker, N. Ovary and fimbrial stem cells: biology, niche and cancer origins. Nat Rev Mol Cell Biol. 16 (10), 625-638 (2015).
- Auersperg, N., Wong, A. S., Choi, K. C., Kang, S. K., Leung, P. C. Ovarian surface epithelium: biology, endocrinology, and pathology. Endocr Rev. 22 (2), 255-288 (2001).
- Tan, O. L., Fleming, J. S. Proliferating cell nuclear antigen immunoreactivity in the ovarian surface epithelium of mice of varying ages and total lifetime ovulation number following ovulation. Biol Reprod. 71 (5), 1501-1507 (2004).
- Carter, L. E., et al. Transcriptional heterogeneity of stemness phenotypes in the ovarian epithelium. Commun Biol. 4 (1), 527 (2021).
- Chumduri, C., Turco, M. Y. Organoids of the female reproductive tract. J Mol Med (Berl). 99 (4), 531-553 (2021).
- Edmondson, R. J., Monaghan, J. M., Davies, B. R. The human ovarian surface epithelium is an androgen responsive tissue. Br J Cancer. 86 (6), 879-885 (2002).
- Karlan, B. Y., Jones, J., Greenwald, M., Lagasse, L. D. Steroid hormone effects on the proliferation of human ovarian surface epithelium in vitro. Am J Obstet Gynecol. 173 (1), 97-104 (1995).
- Nakamura, M., Katabuchi, H., Ohba, T., Fukumatsu, Y., Okamura, H. Isolation, growth and characteristics of human ovarian surface epithelium. Virchows Arch. 424 (1), 59-67 (1994).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nat Rev Drug Discov. 15 (11), 751-769 (2016).
- Del Valle, J. S., Chuva de Sousa Lopes, S. M. Bioengineered 3D ovarian models as paramount technology for female health management and reproduction. Bioengineering (Basel). 10 (7), 832 (2023).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Maenhoudt, N., et al. Developing organoids from ovarian cancer as experimental and preclinical models. Stem Cell Reports. 14 (4), 717-729 (2020).
- Senkowski, W., et al. A platform for efficient establishment and drug-response profiling of high-grade serous ovarian cancer organoids. Dev Cell. 58 (12), 1106-1121.e7 (2023).
- Lohmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nat Commun. 11 (1), 2660 (2020).
- Zhang, S., et al. Both fallopian tube and ovarian surface epithelium are cells-of-origin for high-grade serous ovarian carcinoma. Nat Commun. 10 (1), 5367 (2019).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6, 8989 (2015).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nat Rev Mol Cell Biol. 21 (10), 571-584 (2020).
- Abedini, A., Sayed, C., Carter, L. E., Boerboom, D., Vanderhyden, B. C. Non-canonical WNT5a regulates Epithelial-to-Mesenchymal Transition in the mouse ovarian surface epithelium. Sci Rep. 10 (1), 9695 (2020).
- Bowen, N. J., et al. Gene expression profiling supports the hypothesis that human ovarian surface epithelia are multipotent and capable of serving as ovarian cancer-initiating cells. BMC Med Genomics. 2, 71 (2009).
- Bryant, D. M., et al. A molecular switch for the orientation of epithelial cell polarization. Dev Cell. 31 (2), 171-187 (2014).
- Flesken-Nikitin, A., et al. Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche. Nature. 495 (7440), 241-245 (2013).
- Hosper, N. A., et al. Epithelial-to-mesenchymal transition in fibrosis: collagen type I expression is highly upregulated after EMT, but does not contribute to collagen deposition. Exp Cell Res. 319 (19), 3000-3009 (2013).
- Wang, J., et al. Selective YAP activation in Procr cells is essential for ovarian stem/progenitor expansion and epithelium repair. Elife. 11, e75449 (2022).
- Wong, A. S., et al. Constitutive and conditional cadherin expression in cultured human ovarian surface epithelium: influence of family history of ovarian cancer. Int J Cancer. 81 (2), 180-188 (1999).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Shepherd, T. G., Theriault, B. L., Campbell, E. J., Nachtigal, M. W. Primary culture of ovarian surface epithelial cells and ascites-derived ovarian cancer cells from patients. Nat Protoc. 1 (6), 2643-2649 (2006).
- Xu, J., Lamouille, S., Derynck, R. TGF-beta-induced epithelial to mesenchymal transition. Cell Res. 19 (2), 156-172 (2009).
- Miettinen, P. J., Ebner, R., Lopez, A. R., Derynck, R. TGF-beta induced transdifferentiation of mammary epithelial cells to mesenchymal cells: involvement of type I receptors. J Cell Biol. 127 (6 Pt 2), 2021-2036 (1994).
- Danielpour, D., et al. Sandwich enzyme-linked immunosorbent assays (SELISAs) quantitate and distinguish two forms of transforming growth factor-beta (TGF-beta 1 and TGF-beta 2) in complex biological fluids. Growth Factors. 2 (1), 61-71 (1989).
- Oida, T., Weiner, H. L. Depletion of TGF-beta from fetal bovine serum. J Immunol Methods. 362 (1-2), 195-198 (2010).
- Halder, S. K., Beauchamp, R. D., Datta, P. K. A specific inhibitor of TGF-beta receptor kinase, SB-431542, as a potent antitumor agent for human cancers. Neoplasia. 7 (5), 509-521 (2005).
- Wang, J., Wang, D., Chu, K., Li, W., Zeng, Y. A. Procr-expressing progenitor cells are responsible for murine ovulatory rupture repair of ovarian surface epithelium. Nat Commun. 10 (1), 4966 (2019).
- Kawata, M., et al. Polarity switching of ovarian cancer cell clusters via SRC family kinase is involved in the peritoneal dissemination. Cancer Sci. 113 (10), 3437-3448 (2022).
- Davies, B. R., Worsley, S. D., Ponder, B. A. Expression of E-cadherin, alpha-catenin and beta-catenin in normal ovarian surface epithelium and epithelial ovarian cancers. Histopathology. 32 (1), 69-80 (1998).
- Skory, R. M., Xu, Y., Shea, L. D., Woodruff, T. K. Engineering the ovarian cycle using in vitro follicle culture. Hum Reprod. 30 (6), 1386-1395 (2015).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nat Cell Biol. 21 (8), 1041-1051 (2019).
- Phan, N., et al. A simple high-throughput approach identifies actionable drug sensitivities in patient-derived tumor organoids. Commun Biol. 2, 78 (2019).
- Ducie, J., et al. Molecular analysis of high-grade serous ovarian carcinoma with and without associated serous tubal intra-epithelial carcinoma. Nat Commun. 8 (1), 990 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. J Pathol. 211 (1), 26-35 (2007).
- Rezanejad, H., Lock, J. H., Sullivan, B. A., Bonner-Weir, S. Generation of pancreatic ductal organoids and whole-mount immunostaining of intact organoids. Curr Protoc Cell Biol. 83 (1), e82 (2019).
- Asseler, J. D., et al. One-third of amenorrheic transmasculine people on testosterone ovulate. Cell Rep Med. 5 (3), 101440 (2024).
- Ikeda, K., et al. Excessive androgen exposure in female-to-male transsexual persons of reproductive age induces hyperplasia of the ovarian cortex and stroma but not polycystic ovary morphology. Hum Reprod. 28 (2), 453-461 (2013).
- De Roo, C., et al. Texture profile analysis reveals a stiffer ovarian cortex after testosterone therapy: a pilot study. J Assist Reprod Genet. 36 (9), 1837-1843 (2019).
- Grimstad, F. W., et al. Ovarian histopathology in transmasculine persons on testosterone: A multicenter case series. J Sex Med. 17 (9), 1807-1818 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados