Method Article
Modelo murino transgénico tricolor para el estudio de la lesión del cartílago de crecimiento
En este artículo
Resumen
Este protocolo describe un modelo de ratón mejorado para las lesiones de la placa de crecimiento óseo en adolescentes. Utilizando ratones transgénicos con reporteros fluorescentes de tres linajes para los tipos de colágeno I, II y X, las matrices primarias asociadas con tres sustratos diferentes de la placa de crecimiento, la ubicación de la lesión es guiada por fluorescencia nativa bajo el microscopio.
Resumen
Las placas de crecimiento del cartílago en los huesos de los niños permiten el alargamiento de las extremidades, pero son débiles en relación con el hueso, lo que las hace propensas a fracturarse cuando los huesos están sobrecargados. Se necesitan mejores tratamientos para las placas de crecimiento gravemente fracturadas porque la respuesta a la lesión es un puente óseo que fusiona prematuramente la placa de crecimiento, lo que provoca extremidades atrofiadas y/o torcidas. Los modelos murinos de lesión de la placa de crecimiento son ventajosos para los estudios mecanicistas, pero son desafiantes porque es difícil visualizar y dañar con precisión las pequeñas placas de crecimiento en ratones jóvenes. Describimos aquí un modelo mejorado de lesión del cartílago de crecimiento utilizando ratones transgénicos con reporteros fluorescentes de tres linajes para los tipos de colágeno I, II y X.
Estos ratones muestran fluorescencia nativa asociada con los tres sustratos primarios de la placa de crecimiento. Una lesión del cartílago de crecimiento similar a una lesión de Salter-Harris Tipo II se crea de forma reproducible con una fresa utilizando la sección hipertrófica del cartílago de crecimiento como referencia durante la obtención de imágenes en vivo bajo la guía de microscopía estereoscópica de fluorescencia. El análisis histológico congelado de la fluorescencia nativa simplifica la evaluación de la respuesta celular a la lesión. Esta metodología representa un salto sustancial en la investigación de la lesión del cartílago de crecimiento, proporcionando un método detallado y reproducible para investigar la patología y evaluar nuevas estrategias terapéuticas.
Introducción
Las placas de crecimiento óseo desempeñan un papel fundamental en el crecimiento longitudinal de los huesos largos durante la infancia y la adolescencia1. Situada en los extremos de los huesos largos, la placa de crecimiento comprende múltiples zonas, siendo los condrocitos los componentes celulares clave responsables de producir y mantener esta área de crecimiento dinámica. La osificación endocondral de la placa de crecimiento ocurre para alargar y expandir los huesos a través de una progresión secuencial de proliferación de condrocitos, hipertrofia, apoptosis, invasión de vasos sanguíneos, reclutamiento de células osteoprogenitoras y, finalmente, formación ósea2. Dado que el cartílago de crecimiento es relativamente más blando que el hueso, es muy susceptible a fracturarse cuando los huesos se sobrecargan durante los deportes u otras actividades. La clasificación de Salter-Harris describe cinco tipos distintos de lesiones del cartílago de crecimiento3. La fractura tipo II a través de la zona hipertrófica del cartílago de crecimiento y el tejido óseo inferior adyacente es la más prevalente4. Un puente óseo a menudo se forma en respuesta a lesiones de la zona hipertrófica o del hueso adyacente y conduce a la fusión prematura de las secciones de hueso largo adyacentes5. Los puentes óseos impiden la expansión normal de la placa de crecimiento. En la actualidad, no existen tratamientos preventivos para la formación del puente óseo, y algunos no se tratan dependiendo de la edad del paciente y del tamaño y la ubicación del puente óseo6. Cuando la malformación de la extremidad es grave, las opciones quirúrgicas incluyen la extirpación seguida de la implantación de materiales interposicionales como grasa o caucho de silicona o osteotomía correctiva y procedimientos de alargamiento óseo; Sin embargo, un puente óseo aún puede reformar6. Se necesita más investigación para prevenir la formación de puentes óseos y mejorar los resultados de los niños con lesiones del cartílago de crecimiento óseo.
Se han establecido varios modelos animales para explorar los mecanismos subyacentes y desarrollar nuevas estrategias para prevenir el deterioro del puente óseo de las placas de crecimiento después de la lesión 7,8,9,10,11,12. Estos modelos animales se centran con frecuencia en la placa de crecimiento tibial proximal y la placa de crecimiento del fémur distal como el sitio principal de la lesión, dado que este es típicamente donde ocurren las lesiones humanas. Los defectos óseos de los animales se crean mediante un abordaje lateral similar a una vía de fractura real o un abordaje desde arriba o por debajo de la placa de crecimiento que conduce a un orificio central en la placa de crecimiento. En un modelo de rata previamente reportado, se crea un defecto de la placa de crecimiento insertando una fresa dental a través de una ventana cortical en el eje medio tibial y perforando hacia arriba a través de la médula hacia la articulación de la rodilla para lesionar centralmente la placa de crecimiento 7,13. Alternativamente, un modelo de ratón reciente utiliza un enfoque lateral con una aguja de pequeño diámetro para crear una pista de aguja plana a través de la placa de crecimiento8. En un modelo de rata ampliamente utilizado, el defecto se crea en la placa de crecimiento del fémur distal mediante la perforación a través del cartílago articular entre los cóndilos 9,14. En animales más grandes, como conejos y ovejas, los defectos del cartílago de crecimiento se han inducido lateralmente directamente en la tibia proximal y en el fémur distal mediante la perforación o el corte en el cartílago de crecimiento o acercándose desde abajo y creando un defecto central que deja los bordes del cartílago de crecimiento inalterados 10,11,12,15.
Los modelos murinos para las lesiones de la placa de crecimiento son ventajosos para los estudios mecanicistas que se pueden realizar con ratones modificados genéticamente, como los estudios de rastreo de linaje de células madre8. Sin embargo, un desafío importante en modelos animales murinos o de rata es lograr un daño consistente y preciso en una subregión particular de la placa de crecimiento. La lesión de zonas particulares de la placa de crecimiento y el hueso adyacente es necesaria para imitar una de las trayectorias de fractura clínicamente relevantes descritas por las clasificaciones de Salter-Harris. Los desafíos hasta la fecha en modelos de roedores se deben principalmente a la falta de un medio visual para identificar los sustratos de la placa de crecimiento durante la creación quirúrgica de la lesión. Este protocolo describe una técnica refinada para crear defectos en la placa de crecimiento en sustratos específicos de la placa de crecimiento murina mediante la utilización de ratones transgénicos triples que expresan colágeno I, II y X fluorescentes 16,17,18. La fluorescencia de diferentes colores de estos colágenos en cada una de las zonas primarias de la placa de crecimiento permite la discriminación visual de las diversas secciones de la placa de crecimiento bajo un microscopio estereoscópico de fluorescencia durante la creación quirúrgica de la lesión de la placa de crecimiento. El uso de estos ratones transgénicos permite una precisión de lesiones sin precedentes en un ratón joven en una etapa de desarrollo comparable a la de los niños que se lesionan.
Protocolo
La investigación se realizó de acuerdo con los lineamientos institucionales. Todos los procedimientos con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Centro de Salud de la Universidad de Connecticut antes de iniciar el trabajo. En el esquema de la Figura 1 se describe un esquema del protocolo.

Figura 1: Esquema del protocolo de lesión del cartílago de crecimiento en ratones reporteros de colágeno tricolor. Haga clic aquí para ver una versión más grande de esta figura.
1. Cría de ratones y preparación para la cirugía
- Cría ratones reporteros de colágeno transgénico tricolor que expresen Col1a1-GFPTpz, Col2a1-CFP y Col10a1-mCherry 16,17,18,19,20,21 según los procedimientos de cría estándar para obtener cachorros para cirugía que tengan 2 semanas de edad (± 1 día). Verificar la expresión del triple transgén mediante el genotipado de un fragmento de la punta de la cola bajo un microscopio de fluorescencia. Utilice únicamente los ratones que sean positivos para los tres colores para maximizar el beneficio del sistema indicador durante el análisis histológico posterior.
NOTA: Se selecciona esta edad de 2 semanas de edad (± 1 día) porque sus placas de crecimiento óseo se encuentran en una etapa de desarrollo similar a la del adolescente humano22. Este protocolo se aplica a ambos sexos de ratones. - El día de la cirugía o un día antes, identifique de manera única cada ratón utilizado para la cirugía con un punzón en la oreja después de desinfectar la oreja y el punzón en la oreja con almohadillas antisépticas con alcohol, pesar cada ratón y registrar el valor.
- Afeitar toda la extremidad trasera derecha, desde la cadera hasta el pie, con una maquinilla eléctrica mientras el ratón está bajo el efecto de la anestesia con isoflurano. Para inducir la anestesia en ratones, se utiliza una mezcla de isoflurano (2-3%) y oxígeno al 100%, administrada a un caudal de 1 L/min dentro de una cámara de inducción de 1-2 L. Retire el ratón y confirme que la profundidad de la anestesia es suficiente con un pellizco en el dedo del pie que no haga que el ratón se mueva.
NOTA: Esta profundidad de anestesia durará el tiempo suficiente para realizar el afeitado sin necesidad de un cono nasal de anestesia. - Emplee imágenes de rayos X con una configuración de potencia de 26 kV (800 mA) para capturar imágenes tibiales en ratones vivos bajo anestesia inducida por isoflurano para registrar la longitud inicial de la extremidad.
- Antes de colocar los ratones en la cabina de rayos X, inducir un estado profundo de anestesia utilizando una mezcla de isoflurano (2-3%) y oxígeno al 100%, administrada a un caudal de 1 L/min dentro de una cámara de inducción de 1-2 L.
- Coloque tres ratones anestesiados a la vez en paralelo sobre sus estómagos en el gabinete de rayos X a una altura de estante que permita obtener una imagen que incluya a los tres ratones. Separe las piernas para que los huesos tibiales no se oscurezcan debajo del ratón. Para mejorar la precisión de la medición, coloque una escala radiopaca cerca del ratón durante la obtención de imágenes (Figura 2A).
- Regrese los ratones preparados a su jaula de alojamiento con la madre ratón para esperar los procedimientos quirúrgicos posteriores.
2. Preparación de material quirúrgico y área de trabajo estéril
- Esterilice los siguientes artículos: 10-20 almohadillas de gasa, hisopos aplicadores con punta de algodón, fresas dentales (0,5 mm de diámetro), piezas de mano dentales, pinzas de Graefe, pinzas hemostáticas curvas para mosquitos, tijeras finas curvas, portaagujas, sondas periodontales y talladores discoidales de cleoides dentales.
- Reúna los suministros estériles adicionales necesarios: una suspensión inyectable de buprenorfina, agujas de 20 G, jeringas de 1 ml, cortinas de toalla, suturas de vicryl 5-0 sin teñir, trenzadas, recubiertas, povidona-yodo, solución salina tamponada con fosfato, almohadillas antisépticas con alcohol, bisturíes # 15, guantes quirúrgicos, tubo de barrera de superficie ambiental SOX, lubricante para ojos, aerosol de etanol al 70%. Encienda un esterilizador de perlas de vidrio para la esterilización adicional de artículos durante la cirugía y la almohadilla térmica eléctrica debajo de una jaula de ratón limpia con ropa de cama esterilizada.
- Limpie y esterilice la platina del microscopio estereoscópico de fluorescencia, las superficies adyacentes y el soporte del instrumento quirúrgico con etanol al 70%. Cubra estas áreas que se convertirán en el espacio de trabajo quirúrgico con paños de toalla estériles.
- Ensamble el sistema electrónico de perforación dental de alta velocidad. Conecte el pedal electrónico a la unidad de control y cubra el cable de la pieza de mano con un tubo de barrera de superficie desinfectado SOX. Coloque la fresa dental redonda estéril de 0,5 mm. Encienda el controlador y configúrelo en una relación de transmisión de 1:1 y un máximo de 30,000 rpm.
- Asegure, con cinta adhesiva, la manguera flexible de la máquina de isoflurano que termina con el cono de la nariz cubierto con un tubo de barrera de superficie desinfectado sox en la platina del microscopio estereoscópico de fluorescencia.
- Encienda el microscopio estereoscópico de fluorescencia y el equipo auxiliar y abra el software de adquisición de imágenes.
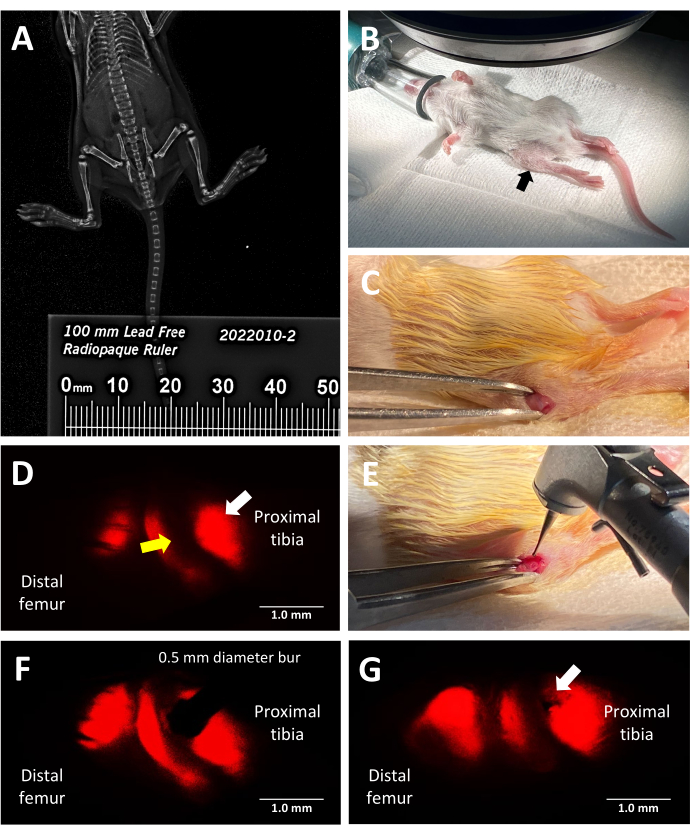
Figura 2: Pasos clave del procedimiento de lesión de la placa de crecimiento murina reportera fluorescente de tres linajes. (A) Medición de la longitud de la tibia mediante imágenes de rayos X de faxitrón utilizando una regla radiopaca colocada junto a los ratones en el gabinete de rayos X. (B) Posición correcta de un ratón anestesiado para la cirugía bajo un microscopio estereoscópico de fluorescencia. Tibia proximal indicada por una flecha negra. (C) Un ejemplo de una incisión hecha para acceder a la placa de crecimiento. (D) Microscopía estereoscópica de fluorescencia que ilumina la zona hipertrófica de la placa de crecimiento (flecha blanca). La zona proliferativa adyacente se indica con una flecha amarilla. (E) Iluminación de luz brillante del cirujano colocando la fresa dental de 0,5 mm contra la placa de crecimiento. (F) La colocación precisa de la fresa dental es guiada por microscopía estereoscópica de fluorescencia en la zona hipertrófica. (G) Un ejemplo de un defecto de la placa de crecimiento tipo II de Salter-Harris (flecha blanca). Barras de escala = 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
3. Procedimiento de lesión de la placa de crecimiento proximal de la tibia
- Anestesiar al ratón en la cámara de anestesia de isoflurano, ajustando la concentración de isoflurano al 2-3% y el caudal de oxígeno a 1 L/min. Esperar la inducción de un estado anestésico profundo, verificado por una prueba de pinzamiento del dedo del pie y la observación de patrones respiratorios.
- Administrar la mitad de la dosis prescrita de buprenorfina por vía subcutánea inmediatamente después de retirar el ratón de la cámara. La dosificación de buprenorfina se realiza según el protocolo aprobado para animales.
- Aplique lubricante ocular para proteger los ojos del ratón para que no se sequen durante la cirugía y transfiera el ratón en posición supina al cono de la nariz de la máquina de isoflurano en la platina de microscopio estereoscópico (Figura 2B). Ajuste el flujo de anestesia a través del cono de la nariz al 2% y el caudal de oxígeno a 1 L/min.
- Desinfectar la extremidad posterior derecha, la región pélvica, la cara anterior de la extremidad posterior izquierda y la cola secuencialmente con povidona yodada seguida de etanol al 70%.
- Verifique una profundidad estable y continua de la anestesia a través de una prueba adicional de pinzamiento de los dedos del pie y la observación de los patrones respiratorios antes del comienzo de la cirugía.
- Bajo una iluminación de luz brillante, emplee un bisturí # 15 para crear una incisión en la piel justo debajo de la articulación de la rodilla con una longitud inicial de aproximadamente 5 mm, para revelar el extremo proximal de la tibia derecha (Figura 2C). Use tijeras para extender el corte si es necesario. Mantenga la tibia contralateral izquierda intacta para que sirva como un control interno sin lesiones.
- Realice una disección roma vertical a través del músculo suprayacente en la tibia proximal utilizando la parte posterior del bisturí # 15, eliminando el tejido blando para una exposición clara de la placa de crecimiento.
- Apague las luces del quirófano y seleccione el canal de fluorescencia correcto para iluminar la región deseada de la placa de crecimiento. Los conjuntos de filtros necesarios para obtener imágenes de cada uno de los colágenos fluorescentes son Col 2 Cian: ET436/20x (excitación), ET480/40 m (emisión), Col 10 mCherry: ET577/20x (excitación), ET640/40 m (emisión), Col 1 Topacio: ET500/20x (excitación), ET535/30 m (emisión). Coloque el ratón para observar la placa de crecimiento tibial proximal (Figura 2D). Ajuste la abertura de la piel un poco más proximal y luego distal para asegurarse de que la placa de crecimiento tibial esté a la vista y no la placa de crecimiento del fémur.
- Cree una lesión similar a la de Salter-Harris tipo II mientras mira a través del ocular del microscopio colocando la fresa del taladro dental de 0,5 mm paralela al eje tibial en el centro de la zona de la placa de crecimiento hipertrófica, empleando un abordaje lateral (Figura 2E, F). Para producir de manera reproducible un defecto que imite una lesión de Salter-Harris tipo II, mantenga la extremidad paralela a la superficie de trabajo para que la vía de entrada de la fresa no se incline hacia la epífisis. Aplique presión sobre el pedal del taladro para iniciar la rotación de la fresa y presione suavemente la fresa en la placa de crecimiento, deteniéndose antes de que el defecto sea más profundo que el diámetro de la fresa (Figura 2G).
NOTA: Un segundo par de manos que ayudan a estabilizar la extremidad del ratón es útil. - Irrigar el sitio de la lesión con una gota de PBS estéril para eliminar cualquier residuo.
- Confirme la profundidad del defecto a 0,5 mm con una sonda periodontal.
4. Procedimientos posteriores a la lesión y cierre
- Para la caracterización de defectos de tiempo cero, coseche la extremidad posterior lesionada y la extremidad de control antes del cierre del tejido. Siga la recolección de tejido y la preparación para la posterior microtomografía computarizada (microTC) y criohistología en la sección 6.
NOTA: En el caso de los experimentos que implican la implantación de una sustancia terapéutica en el defecto del cartílago de crecimiento, el defecto en sí solo puede acomodar una pieza de biomaterial que sea aproximadamente esférica y de 0,5 mm de diámetro o 0,082 mm3 (0,082 μL) de volumen. - Utilice fórceps bajo visualización microscópica para insertar el biomaterial o inyectar un líquido terapéutico en el defecto dentro de la placa de crecimiento. Utilizar un volumen mayor de biomaterial o sustancia inyectada si el diseño del estudio no requiere que la terapéutica se limite únicamente al defecto.
- Vuelva a alinear cuidadosamente los bordes de la piel, asegurándose de que el material implantado, si lo hay, permanezca seguro dentro del sitio del defecto.
- Emplee técnicas de sutura interrumpida con suturas de ácido poliglicólico 5-0 para sellar la incisión cutánea de manera efectiva.
- Limpie a fondo las áreas más allá de la región quirúrgica de residuos de povidona yodada con hisopos con agua estéril, aplicando cuidado para evitar el contacto con la herida y las áreas circundantes cercanas.
- Retire el ratón del cono de la nariz de isoflurano en la platina del microscopio y colóquelo en una jaula de recuperación, colocándolo lateralmente sobre ropa de cama fresca sobre una almohadilla térmica.
- Observar de cerca la frecuencia respiratoria del ratón durante aproximadamente 5 min, administrando la dosis restante de buprenorfina para la analgesia justo cuando los efectos del anestésico isoflurano disminuyen, indicados por un aumento de la frecuencia respiratoria, pero antes del inicio de la movilidad. Mantenga al ratón en una jaula de recuperación aislada hasta que demuestre capacidades ambulatorias completas, a partir de entonces, reuniéndolo con su madre y hermanos.
- Realizar inspecciones diarias durante las primeras 48 horas después de la operación, seguidas de evaluaciones semanales hasta el momento de la eutanasia. Concéntrese en los signos de infección, la eficacia de la locomoción, la accesibilidad a los alimentos y la integridad de las suturas.
- Desteta a los ratones a la hora estándar (es decir, a las 3 semanas de edad).
5. Medidas de la longitud de las extremidades
- Sobre la base de los puntos de tiempo determinados por la hipótesis experimental y el diseño, anestesiar a los ratones con isoflurano y realizar imágenes de rayos X de la longitud total de las tibias lesionadas y no lesionadas, como se muestra en la Figura 2A y se describe en la Sección 1.4. Los puntos de referencia adecuados para realizar mediciones consistentes de la longitud de las extremidades incluyen la parte superior de la epífisis tibial y el extremo distal de la tibia en la articulación tibioastragalina, como se muestra en la Figura 3.
NOTA: Las imágenes se utilizan para evaluar la longitud de la extremidad y las discrepancias en la longitud de la extremidad debido a la lesión, así como el desarrollo del puente óseo dentro de los tejidos de la placa de crecimiento a intervalos postoperatorios específicos.
6. Disección de tejidos, fijación, imágenes por microTC e inclusión
- Eutanasia del ratón mediante asfixia por CO2 , preferiblemente utilizando un sistema automatizado de inducción de CO2 con una confirmación de muerte por un método alternativo como la luxación cervical.
- Aísle ambas extremidades traseras intactas y extraiga la piel y el músculo del hueso y el área capsular de la rodilla en preparación para el análisis histológico y microCT.
- Antes de colocar las extremidades traseras en el fijador, extirpe la rótula con cuidado cortándola con unas tijeras de microdisección para facilitar la penetración del fijador en la cavidad de la rodilla. Utilice una jeringa de insulina de 29 g para distribuir completamente la formalina fría tamponada al 10% en todas las áreas de la cavidad de la rodilla. Cortar la región diafisaria del fémur y la tibia para mejorar el acceso del fijador al espacio medular. Mantenga el tejido articular en una posición completamente extendida dentro del fijador durante 24-36 h a 4 °C atándolo con una gasa a una clavija fina.
PRECAUCIÓN: La formalina es tóxica y debe manipularse en una campana extractora mientras se usa el equipo de protección personal adecuado.
- Antes de colocar las extremidades traseras en el fijador, extirpe la rótula con cuidado cortándola con unas tijeras de microdisección para facilitar la penetración del fijador en la cavidad de la rodilla. Utilice una jeringa de insulina de 29 g para distribuir completamente la formalina fría tamponada al 10% en todas las áreas de la cavidad de la rodilla. Cortar la región diafisaria del fémur y la tibia para mejorar el acceso del fijador al espacio medular. Mantenga el tejido articular en una posición completamente extendida dentro del fijador durante 24-36 h a 4 °C atándolo con una gasa a una clavija fina.
- Después de 24-48 h de fijación de formalina a 4 °C, realizar microTC de rayos X de alta resolución de muestras contralaterales y lesionadas mediante imágenes de microCT después de transferir las muestras a PBS, para evaluar el desarrollo del puente óseo. Utilice un tamaño de vóxel de 6,0 μm, tiempos de muestreo de 330.000 ms y ajustes de energía de 55.000 V con una intensidad de 145 μA.
- Después de la obtención de imágenes por microTC y 24 h adicionales de fijación de formalina a 4 °C, enjuague las muestras en 1X PBS durante 3 x 5 min y luego, sumerja las muestras en sacarosa al 10% en 1X PBS durante 1 h, 20% de sacarosa en 1X PBS durante 1 h y 30% de sacarosa en 1X PBS durante la noche. Use una jeringa de insulina de 29 G llena de solución de sacarosa para asegurarse de que la solución de sacarosa penetre en todas las regiones de la cavidad de la rodilla. Transfiera a un congelador a -80 °C si no está incluido después de la inmersión nocturna en sacarosa para garantizar la retención del indicador de GFP y la actividad enzimática de los tejidos.
- Retire cualquier tejido muscular residual de la región de la articulación antes de incrustar. Equilibre la muestra con un medio crioincrustante durante la noche, facilitando la penetración del medio en la cavidad de la rodilla.
- Vea las imágenes de microCT para determinar dónde se encuentran el defecto y el puente óseo antes de la inclusión. Aplique una capa delgada del medio crio-incrustante en un criommoldo y coloque la tibia/fémur/articulación disecada y aún conectada de manera que la región de interés mire 90° con respecto a la superficie del medio de inclusión.
NOTA: Esta orientación permite que el seccionamiento capture la vista lateral del defecto creado lateralmente. Si el puente óseo está cerca del borde del defecto, entonces esta orientación también evitará la posibilidad de pasar por alto la región de interés durante las primeras secciones más gruesas tomadas a través del tejido. - Coloque el criommould sobre hielo seco hasta que el medio crioincrustante se solidifique, asegurando la muestra. Continúe llenando el criomold con el medio mientras lo mantiene en hielo seco.
- Después de asegurar la muestra, sumerja el criomold en 2-metil-butano enfriado con hielo seco hasta que esté completamente congelado. Después de la congelación, elimine el exceso de 2-metil-butano, envuelva los criomoldes en celofán y guárdelos a -20 °C o -80 °C.
NOTA: Para un almacenamiento prolongado más allá de 1-2 meses en un medio crioincrustado, se recomienda -80 °C para evitar que se seque. La criosección asistida por cinta y la adhesión de las secciones a los portaobjetos de vidrio se describen anteriormente23.
7. Imágenes secuenciales, tinción y regeneración de imágenes
- Implementar un procedimiento secuencial de obtención de imágenes, tinción y regeneración de imágenes para facilitar la detección y colocalización de múltiples señales biológicas dentro de la misma sección de tejido, como se describió anteriormente23. Específicamente para las secciones de la placa de crecimiento de los ratones reporteros de colágeno tricolor, se recomiendan los siguientes pasos. Este enfoque ordenado garantiza una visualización completa tanto de las señales moleculares como de los detalles estructurales.
- Inicialmente, captura señales fluorescentes endógenas para los tres colágenos en la primera ronda de imágenes.
- Aplique la tinción con azul de calceína y la imagen del tejido mineralizado23, seguida de la tinción con actividad enzimática de la fosfatasa ácida resistente al tartrato (TRAP) y la obtención de imágenes23.
NOTA: Si bien los resultados de la tinción con actividad enzimática TRAP no se muestran aquí, este paso de tinción se realiza ya que es esencial para la eliminación del mineral antes de los resultados de la tinción de Safranin O/Fast Green presentados en la sección de resultados representativos. - Realice la tinción nuclear de 4',6-diamidino-2-fenilindol (DAPI) como se describe a continuación y luego la imagen.
- Coloque los portaobjetos que hayan sido sometidos a imágenes previas en un frasco Coplin que contenga 1x PBS. Déjalos sumergidos hasta que los cubreobjetos se desprendan de los portaobjetos. Una vez desmontados, retire y seque bien los cubreobjetos.
- Aplique la solución contratintante DAPI a los cubreobjetos, utilizando una dilución 1:1,000 de DAPI en una mezcla de 50% de glicerol y 1x PBS. Continúe con el proceso de creación de imágenes después de la aplicación.
- Concluir con la aplicación de la tinción Safranin O/Fast Green para acentuar la arquitectura del tejido y luego la imagen.
NOTA: Realice esto como paso final para correlacionar imágenes cromogénicas con señales fluorescentes.- Prepare las soluciones de hematoxilina de hierro de Weigert. Prepare la solución A disolviendo 1 g de hematoxilina en 100 ml de etanol al 95% y la solución B combinando 4 ml de solución de cloruro férrico al 29%, 95 ml de agua desionizada y 1 ml de HCl concentrado. Mezcle partes iguales de la solución A y B para crear la solución de hematoxilina de trabajo de Weigert, estable durante aproximadamente 4 semanas.
- Sumerja los portaobjetos en agua desionizada durante 2 x 2 min para hidratarse.
- Aplique la solución de hematoxilina de Weigert durante 5 min.
- Lave los portaobjetos en agua del grifo durante 5 minutos, luego brevemente en agua desionizada durante 1 minuto.
- Teñir con una solución de Fast Green al 0,2% (0,2 g de Fast Green FCF en 100 mL de agua desionizada) durante 2 min.
- Enjuague brevemente con ácido acético al 1% durante 1 min.
- Manchar con solución de Safranina O al 0,1% (0,1 g de Safranina O en 100 mL de agua desionizada) durante 1 min.
- Enjuague con agua desionizada hasta lograr un color visualmente equilibrado, aproximadamente 5 min.
- Monte los portaobjetos en glicerol al 30% en agua desionizada (evite PBS) y proceda a la obtención de imágenes de inmediato para evitar la difusión del color del tejido. Para acentuar las células de la zona de reposo de la placa de crecimiento, conducen la imagen con un filtro Cy5: ET640/30x (EX), ET690/50 m (EM).
Resultados
Este protocolo utiliza ratones reporteros fluorescentes trilinaje para inducir un defecto de la placa de crecimiento lateral en la tibia proximal con precisión al aprovechar la fluorescencia roja inherente emitida por el colágeno tipo X para la guía quirúrgica. La vista que tiene el cirujano mientras mira a través del ocular de microscopio estereoscópico con el juego de filtros mCherry se muestra en la Figura 2D. La fluorescencia nativa de tipo X permite al cirujano colocar la fresa en la zona hipertrófica y crear una lesión que imita un tipo común de lesión de la placa de crecimiento que conduce a un puente óseo (Figura 2F). La fluorescencia bajo el canal rojo es la más brillante y, por lo tanto, se recomienda su uso durante la colocación de fresas. Alternativamente, la creación de defectos podría guiarse mediante el uso de otros colores de la fluorescencia nativa de los ratones transgénicos triples si el objetivo del experimento es estudiar las lesiones en otras zonas de la placa de crecimiento que no sean la zona hipertrófica y la región calcificada adyacente.
La creación de un defecto tipo II de Salter-Harris en la zona hipertrófica de la placa de crecimiento y el tejido óseo inferior adyacente, utilizando una fresa dental de 0,5 mm de diámetro, se validó mediante microTC y criohistología de las tibias proximales lesionadas (tiempo 0) en comparación con los controles laterales no lesionados en ratones N = 3 (Figura 4). Los defectos eran difíciles de ver en las imágenes 3D de microCT, pero eran detectables en las secciones transversales 2D (Figura 3A,B,E,F). La figura 3G muestra la distribución de las células óseas productoras de colágeno tipo I (fluorescencia verde), los condrocitos proliferativos productores de colágeno tipo II (fluorescencia cian) y los condrocitos hipertróficos productores de colágeno tipo X. En la imagen del ratón lesionado (Figura 4G), hay una alteración de la zona hipertrófica, la capa provisionalmente calcificada y parte del hueso más reciente formado en relación con el control, con la zona proliferativa solo ligeramente alterada. La tinción con Safranin O/Fast Green (Figura 4H) ilustra mejor la ubicación del defecto dentro de la placa de crecimiento lesionada, ya que todas las células son claramente visibles.
El análisis de rayos X proporciona información sobre ratones vivos en cuanto al impacto de este tipo de lesión de la placa de crecimiento en la longitud de la tibia y la formación de puentes óseos a lo largo del tiempo (Figura 3). Las imágenes comparativas entre tibias no lesionadas (Figura 3A) y lesionadas (Figura 3B), tomadas antes de la cirugía y 3 semanas después de la cirugía, revelan una gran cantidad de crecimiento de las extremidades, adelgazamiento de las placas de crecimiento y una región opaca distinta que se ha desarrollado en el área de la placa de crecimiento lesionada a las 3 semanas. Esta opacidad dentro de la placa de crecimiento no está presente en la contraparte no lesionada ni en los ratones antes de la cirugía. Por lo tanto, el faxitrón es una forma de observar los cambios patológicos inducidos por la lesión en ratones vivos, como la formación de un puente óseo y cambios en la longitud de las extremidades.
Las imágenes por microtomografía computarizada de los huesos disecados ofrecen una visualización detallada de la formación de puentes óseos dentro de las placas de crecimiento lesionadas tres semanas después de la cirugía (Figura 5). Como se ve en las imágenes de seis ratones lesionados diferentes que se muestran en la Figura 5, hay un desarrollo consistente de puentes óseos en todos los ratones. Utilizando el software Scanco Medical, el volumen del puente óseo se calculó revisando cada sección de la placa de crecimiento tibial proximal, delineando el área del puente óseo (Figura 5B) con la herramienta de selección y, a continuación, integrando cada área de la sección a lo largo de todo el volumen de la placa de crecimiento para obtener el volumen total24. El volumen del puente óseo calculado de esta manera fue de 0,0761 mm3 ± 0,0246 (media ± desviación estándar, N = 6). La mayoría de los puentes óseos se forman cerca de la mitad de la placa de crecimiento a pesar del abordaje lateral, que lesiona el borde exterior y el centro de la placa de crecimiento. Este fenómeno puede atribuirse al hecho de que las células madre mesenquimales (MSC) de la médula ósea, en lugar del pericondrio, son responsables de la formación de puentes óseos25.
En estos ratones transgénicos tricolores, el análisis criohistológico de la placa de crecimiento lesionada se enriquece con la fluorescencia del colágeno nativo (Figura 6). Revela la compleja interacción de las células óseas y los condrocitos en el sitio de la lesión. Las imágenes de microTC que se muestran en la Figura 6J,K se proporcionaron al técnico de histología para guiar la inclusión y el corte. Las células óseas productoras de colágeno tipo I se observan en la Figura 6L,O,P (fluorescencia verde), mientras que los condrocitos proliferativos productores de colágeno tipo II se ven en la Figura 6L,O,Q (fluorescencia cian). Los condrocitos hipertróficos productores de colágeno tipo X se observan en la Figura 6L,O,R (fluorescencia roja). Este enfoque de fluorescencia multicolor permite un examen detallado de la diferenciación de condrocitos postoperatorios dentro del área del puente óseo contra un fondo de tejido mineralizado. Se utilizó la tinción DAPI para confirmar la distribución de todos los tipos de células dentro del área de la placa de crecimiento (Figura 6M). La tinción con Safranin O/Fast Green demuestra la organización compuesta y estructural del cartílago y el hueso dentro de la placa de crecimiento lesionada (Figura 6N). La obtención de imágenes de estas secciones teñidas bajo un conjunto de filtros Cy5 ilumina notablemente las células de la zona de reposo en la interfaz entre el hueso epifisario y el cartílago.
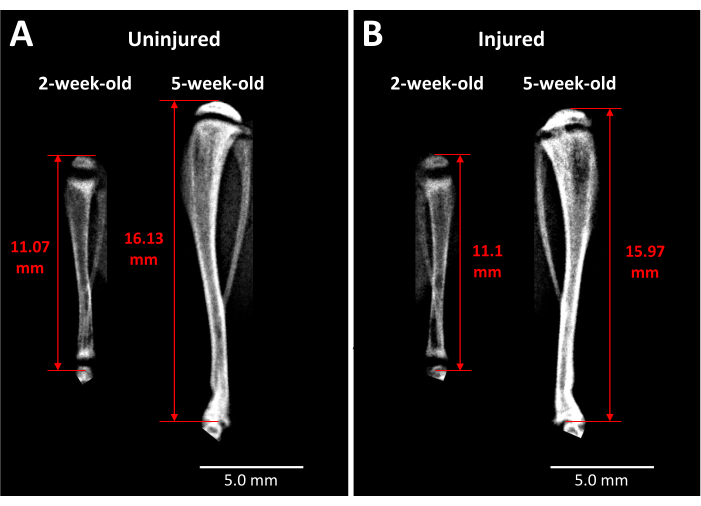
Figura 3: Imágenes de rayos X del control contralateral y de las tibias de ratón lesionadas. (A) Las imágenes de rayos X de la tibia de control contralateral se toman justo antes de la lesión cuando los ratones tienen 2 semanas de edad y a las 3 semanas después de la cirugía cuando los ratones tienen 5 semanas de edad, lo que demuestra el grado de crecimiento que ocurre durante este período. (B) Tibia lesionada por el mismo ratón en los mismos puntos de tiempo que en (A). Los puntos de referencia utilizados para las mediciones de la longitud de la tibia son el ápice de la cabeza proximal de la tibia hasta el final de la tibia en la articulación del tobillo (flechas rojas de doble punta). El puente óseo opaco es visible en la placa de crecimiento de la tibia proximal lesionada a las 5 semanas. Barras de escala = 5.00 mm. Haga clic aquí para ver una versión más grande de esta figura.
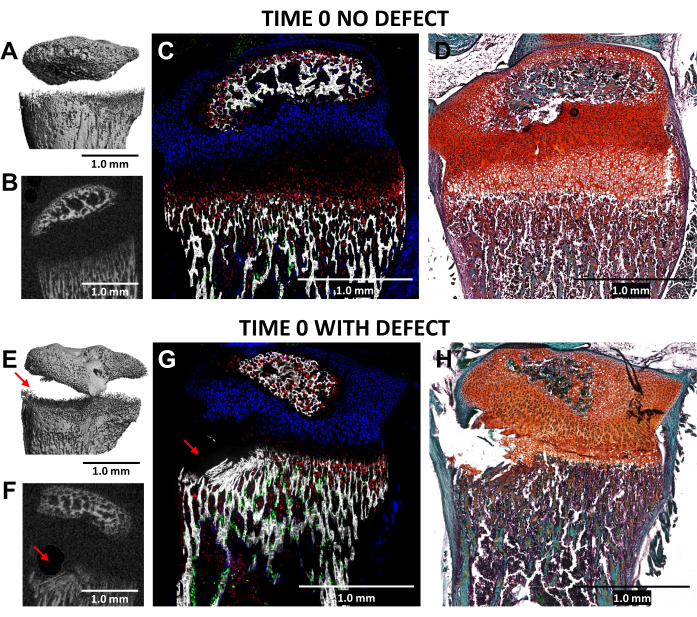
Figura 4: MicroCT e imágenes histológicas del control contralateral en tiempo cero y tibias proximales de ratón lesionadas. (A,E) y (B,F) muestran vistas de microCT en 3D y 2D transversales, con el defecto indicado por flechas rojas en (E) y (F). (C,G) Imágenes criohistológicas compuestas fusionadas fusionando tres capas de fluorescencia innata con una capa de tejido mineralizado. Los glóbulos verdes (Col3.6GFPtpz) son las células óseas productoras de colágeno tipo I, las células de color azul cian (Col2A1GFPcyan) son condrocitos proliferativos productores de colágeno tipo II y los glóbulos rojos (Col10A1RFPchry) son condrocitos hipertróficos productores de colágeno tipo X. (D,H) Tinción de Safranina O/Fast Green de la misma región que (C) y (G). Barras de escala = 1,0 mm. Haga clic aquí para ver una versión más grande de esta figura.
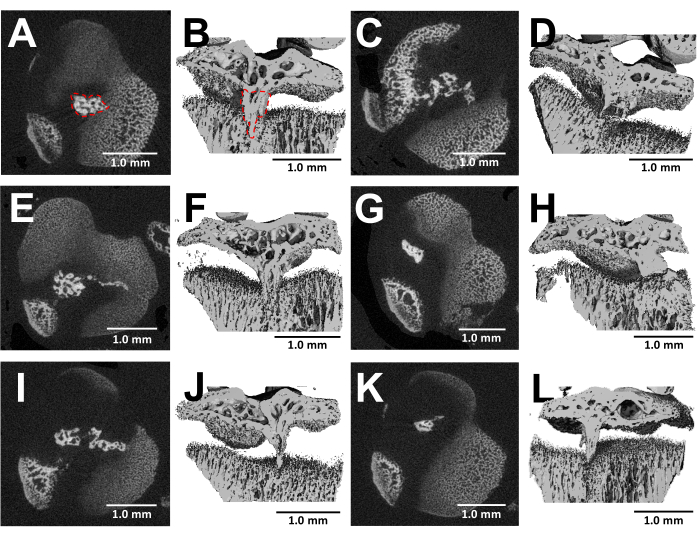
Figura 5: Imágenes de MicroCT de puentes óseos formados por este protocolo. (A,C,E,G,I,K) Secciones transversales transversales de la placa de crecimiento tibial proximal de seis ratones diferentes a las 3 semanas después de la creación del defecto de fresa. Puente óseo delineado por una línea punteada roja en (A). (B,D,F,H,J,L) Reconstrucciones 3D con un plano longitudinal recortado. Puente óseo delineado por una línea punteada roja en (B). Barras de escala = 1,0 mm. Haga clic aquí para ver una versión más grande de esta figura.
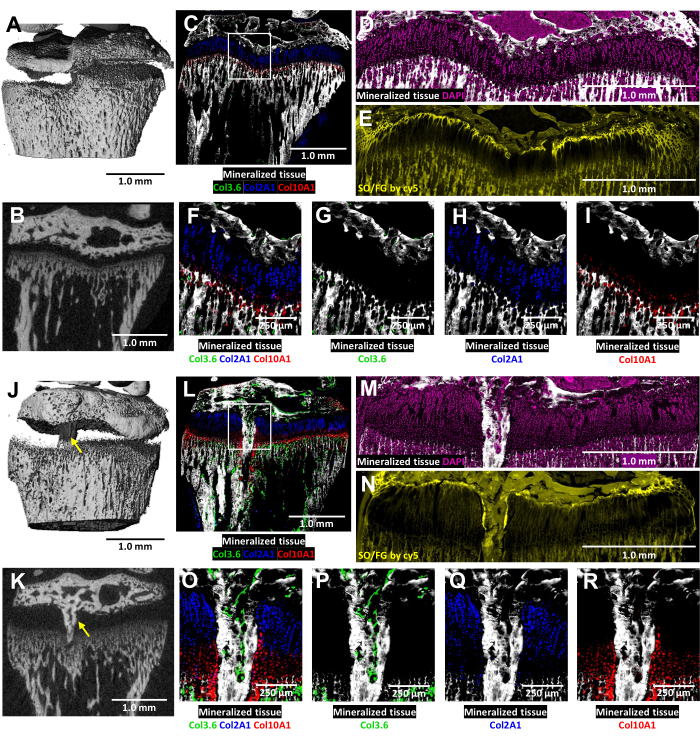
Figura 6: MicroTC e imágenes histológicas de control contralateral y tibia proximal de ratón lesionada con formación de puente óseo. (A,J) y (B,K) muestran vistas de microCT en 3D y 2D transversales, con el puente óseo indicado con flechas amarillas en (J) y (K). (C,L) Imágenes criohistológicas compuestas fusionadas fusionando tres capas de fluorescencia innata con una capa de tejido mineralizado. Los glóbulos verdes (Col3.6GFPtpz) son las células óseas productoras de colágeno tipo I, las células de color azul cian (Col2A1GFPcyan) son condrocitos proliferativos productores de colágeno tipo II y los glóbulos rojos (Col10A1RFPchry) son condrocitos hipertróficos productores de colágeno tipo X. El recuadro blanco indica el aumento más alto que se muestra en los paneles F y O. (D,M) El tejido mineralizado y la tinción de DAPI en el área de la placa de crecimiento de los paneles C y L. (E,N) Tinción con safranina O/Fast Green de la misma región que (D) y (M) escaneada con fluorescencia cy5. (F,O) Un mayor aumento del área de la placa de crecimiento en la imagen combinada de los paneles C y L. (G-I,P-R) Se muestran canales individuales de la fluorescencia nativa con un fondo de tejido mineralizado. Barras de escala = 1,0 mm (A-E) y (J-N), = 250 μm en (F-I) y (O-R). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El uso innovador de ratones reporteros de colágeno tricolor permite la creación de defectos en la placa de crecimiento con un tamaño y ubicación predeterminados, lo que mejora significativamente la precisión de los modelos experimentales murinos para las lesiones de la placa de crecimiento. Dado el pequeño tamaño de los ratones de 2 semanas de edad, es fundamental utilizar una pequeña fresa de 0,5 mm para crear la lesión y evitar debilitar la extremidad y causar una fractura de espesor completo. El cirujano también debe aplicar la presión suficiente al crear el defecto para evitar perforar demasiado profundamente el hueso por la misma razón. El uso de la periosonda es fundamental para confirmar una profundidad de lesión constante.
Al igual que con cualquier cirugía, es importante confirmar una profundidad adecuada de anestesia, confirmada por un pellizco ocasional en el dedo del pie, y la esterilidad se mantiene en todo momento. Otro punto quirúrgico de importancia es que se ha descrito la disección roma con un tallador porque evita dañar los tejidos blandos y ayuda a garantizar que los ratones puedan deambular inmediatamente después de recuperarse de la anestesia para llegar a la madre ratón para su nutrición y comodidad. En nuestra experiencia, las heridas cerradas con suturas han permanecido cerradas con éxito y no se requieren clips para heridas. Se recomienda la cirugía en ratones a las 2 semanas de edad para imitar mejor al niño pequeño que experimenta fracturas del cartílago de crecimiento. Una desventaja de este protocolo es que, dada la naturaleza impredecible del parto, el uso de este modelo de ratón requiere la disponibilidad del cirujano a corto plazo.
En cuanto a la posición de la fresa para crear el defecto, el protocolo describe la creación de la lesión utilizando un conjunto de filtros mCherry/Texas red que ilumina la zona hipertrófica dentro de la placa de crecimiento debido al brillo de la fluorescencia del colágeno X. Para asegurarse de que la lesión se crea dentro de la placa de crecimiento tibial, es beneficioso mover ligeramente la abertura del tejido blando hacia la izquierda y la derecha para confirmar que la placa de crecimiento tibial proximal está a la vista, y no el fémur. El cambio entre los canales del conjunto de filtros para iluminar la zona proliferativa de condrocitos o las secciones óseas adyacentes es útil para confirmar la ubicación precisa en relación con la ubicación de la zona proliferativa y las secciones óseas adyacentes.
Si bien la zona proliferativa de condrocitos y el hueso epifisario y metafisario se pueden distinguir bajo microscopía de fluorescencia en los ratones vivos, el valor real de los reporteros de colágeno tipo II y tipo I se percibe durante el análisis histológico de la placa de crecimiento. Dada la naturaleza acuosa de los procesos criohistológicos, los protocolos tradicionales de precipitación de colorantes cromogénicos no son adecuados debido a la posible desalineación del color con las imágenes fluorescentes causada por los pasos de deshidratación. Aunque el protocolo acuoso produce patrones de tinción similares a los de las secciones de parafina, es esencial obtener imágenes rápidas después de la tinción para evitar la difusión del colorante desde el tejido. El uso de un 30% de glicerol en agua destilada como medio de montaje puede desacelerar esta difusión, lo que permite múltiples tinciones cromogénicas en la misma sección, incluido el cartílago con Safranin O/Fast Green.
El proceso de osificación endocondral es claramente visible con condrocitos rojos que recubren el puente óseo en evolución (Figura 6). El uso adicional de técnicas de inmunohistoquímica, para las que hay muchos anticuerpos murinos disponibles, podría mejorar aún más los estudios mecanicistas realizados en estos ratones transgénicos. En conjunto, la combinación de faxitrón, microTC y técnicas de imágenes criohistológicas en este modelo de ratón transgénico ofrece una comprensión completa de los cambios macroscópicos y microscópicos que ocurren en respuesta a las lesiones de la placa de crecimiento, allanando el camino para futuras intervenciones terapéuticas para mitigar tales resultados adversos. Se podrían realizar más manipulaciones genéticas de estos ratones transgénicos para permitir que los estudios de rastreo de linaje comprendan el origen de las células que están involucrada temporal y espacialmente en la curación. La experimentación en ratones con modificaciones adicionales permitiría el estudio de enfermedades del cartílago como el osteocondroma, un crecimiento excesivo de cartílago y hueso cerca de la placa de crecimiento.
La consistencia de nuestro modelo se demuestra por la formación reproducible de puentes óseos en todos los ratones sin necesidad de descartar ningún ratón del grupo debido a una lesión del cartílago articular. Esta es una mejora con respecto a los modelos anteriores que se acercaban a la placa de crecimiento desde una ventana cortical debajo de la placa de crecimiento y inclinaban una herramienta afilada o fresa hacia arriba, hacia la placa de crecimiento y, en ocasiones, se sobrepasaban en el cartílago articular. Una lesión adicional del cartílago articular no imita las lesiones del cartílago de crecimiento que ocurren comúnmente en los niños. La lesión más precisa de este modelo animal reduce el número de ratones necesarios por experimento y esa es otra mejora. El uso de ratones transgénicos permite al investigador enfocar la lesión en subsecciones de la placa de crecimiento, como el área hipertrófica/provisionalmente calcificada o el área de la epífisis/zona de reposo/zona proliferativa, sin afectar el cartílago articular. Sin embargo, una limitación de este modelo es la variabilidad en el volumen del puente óseo, que puede diferir hasta en un 30% entre los animales lesionados. En consecuencia, la detección de un efecto clínicamente significativo en la formación de puentes óseos todavía requiere un gran número de animales para alcanzar la relevancia estadística.
Los beneficios de un modelo de ratón como se describe aquí en comparación con los modelos de lesiones del cartílago de crecimiento de rata o conejo publicados anteriormente 7,9,10,14, incluyen un menor número de animales utilizados, reducción de costos, un tamaño de réplica eficiente debido a la formación de barras óseas reproducibles, un marco de tiempo de estudio más corto y una ubicación más precisa de las lesiones debido a las imágenes en vivo de los ratones transgénicos triples. Aunque no se ha analizado en detalle, este modelo de ratón puede utilizarse para probar implantes de ingeniería tisular o biomateriales que administran factores de crecimiento. Una limitación notable de este método murino es que el tamaño de un implante utilizado para administrar fármacos terapéuticos o células se limita al volumen del defecto de aproximadamente 0,5 mm de diámetro. Solo los modelos animales más grandes pueden acomodar el volumen de material de prueba que se utilizaría en pacientes humanos. El defecto de fresa creado en este protocolo no tiene la misma geometría que una fractura delgada y, por lo tanto, difiere de las lesiones humanas reales. No obstante, los beneficios de este modelo de ratón son muchos, y el abordaje lateral evita dañar el cartílago articular que ocurriría al acercarse ciegamente por encima o por debajo de la placa de crecimiento en línea con el eje largo tibial. Esta metodología representa un salto sustancial en la investigación de la lesión del cartílago de crecimiento, proporcionando un método detallado y reproducible para investigar la patología y evaluar nuevas estrategias terapéuticas.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo fue apoyado por una subvención de los Institutos Nacionales de Salud, el Instituto Nacional de Artritis y Enfermedades Musculoesqueléticas y de la Piel (NIAMS) 1R21AR079153 y una subvención del Programa de Mejora de la Investigación (REP) de la Universidad de Connecticut. Los autores desean agradecer la ayuda de Renata Rydzik del centro de imágenes MicroCT de la Universidad de Connecticut.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-methyl-butane | Sigma Aldrich | M32631 | |
| Alcohol antiseptic pads | Acme United Corporation | H305-200 | |
| Axio Scan.Z1 | Carl Zeiss AG | Axio Scan.Z1 | |
| AxioVision software | Carl Zeiss AG | ||
| Betadine solution (10% povidone-iodine) | Avrio Health L.P. | 67618-150-01 | |
| Calcein | Sigma Aldrich | C0875 | |
| Calcein Blue | Sigma Aldrich | M1255 | |
| CFP filter set | Chroma Technology Corp. | 49001 | |
| Cryomatrix | Thermo Scientific | 6769006 | |
| Cryomolds | Fisher Scientific | Fisherbrand #22-363-554 | |
| Cryostat | Leica Biosystems | 3050s | |
| Cryostat blades | Thermo Scientific | 3051835 | |
| Cryotape | Section Lab | Cryofilm 2C | |
| Curved fine scissor | Fine Science Tools | 14061-11 | |
| Curved mosquito hemostatic forceps | HuFriedyGroup | H3 | |
| cy5 filter set | Chroma Technology Corp. | 49009 | |
| DAPI | ThermoFisher Scientific | 62247 | |
| DAPI filter set | Chroma Technology Corp. | 49000 | |
| Dental bur (0.5 mm diameter) | |||
| Dental cleoid discoid carver | ACE Surgical Supply Inc. | 6200097A-EA | |
| Dry glass bead sterilizer (Inotech Steri 350) | Inotech Bioscience, LLC | IS-250 | |
| Ear punch | Fine Science Tools | 24212-01 | |
| Electric heating pad | |||
| Electronic foot control | Nouvag AG | 1866nou | |
| Electronic motors 31 ESS | Nouvag AG | 2063nou | |
| Environmental surface barrier (3 x 12 inch tube sox) | Patterson Companies, Inc. | BB-0312H | |
| Ethanol (70%) | |||
| Ethiqa XR (buprenorphine extended-release injectable suspension) 1.3 mg/mL | Fidelis Animal Health | 86084-100-30 | |
| Faxitron x-ray cabinet | Kubtech Scientific | Parameter | |
| Fluorescence Stereomicroscope | Carl Zeiss AG | Lumar V12 | |
| GFP filter set | Chroma Technology Corp. | 49020 | |
| Glacial acetic acid | Sigma Aldrich | ARK2183 | |
| Glass microscope slides | Thermo Scientific | 3051 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Graefe forceps | Fine Science Tools | 11051-10 | |
| Handpiece (contra angle 32:1 push button) | Nouvag AG | 5201 | |
| Implantology/oral surgery system control unit (Straumann) | Nouvag AG | SEM | |
| Instant sealing sterilization pouch with dual internal/external process indicators (3 1/2 x 5 1/4 inch) | Fisher Scientific | 01-812-50 | |
| Instant sealing sterilization pouch with dual internal/external process indicators (5 4/1 x 10 inch) | Fisher Scientific | 01-812-54 | |
| Insulin syringe (29 G) | Exel International | 26028 | |
| Isoflurane | Dechra Pharmaceuticals plc | 17033-091-25 | |
| Isoflurane anesthetic system | |||
| mCherry filter set | Chroma Technology Corp. | 39010 | |
| Micro-dissecting scissor | Fine Science Tools | 14084-08 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| Needle (20 G) | Becton, Dickinson and Company | 305178 | |
| Needle holder | HuFriedyGroup | NHCW | |
| Neutral buffered formalin (10%) | Sigma Aldrich | HT501128-4L | |
| Non-sterile applicator swabs | Allegro Industries | 205 | |
| Non-woven gauze (3 x 3 inch) | Fisher Scientific | 22028560 | |
| Norland Optical Adhesive, 61 | Norland Optical | Norland Optical Adhesive, 61 | |
| Ophthalmic ointment (Optixcare eye lube) | CLC Medica | ||
| PBS | Sigma Aldrich | P5368 | |
| Periodontal probe | HuFriedyGroup | PQW | |
| Phosphate buffered saline (PBS) pH 7.4 (1x) | Gibco, by Life Technologies | 10-010-023 | |
| Plastic microscope slides | Electron Microscopy Sciences | 71890-01 | |
| Professional clipper/trimmer (Wahl Classic Peanut) | Wahl Clipper Corporation | 8685 | |
| Roller | Electron Microscopy Sciences | 62800-46 | |
| Scanco Medical software | SCANCO Medical | Scanco μCT 50 | |
| Sodium acetate anhydrous | Sigma Aldrich | S2889 | |
| Sodium nitrite | Sigma Aldrich | S2252 | |
| Sodium tartrate dibasic dihydrate | Sigma Aldrich | T6521 | |
| Specimen disc | Leica Biosystems | 14037008587 | |
| Stainless steel #15 surgical blade | Aspen Surgical Products, Inc. | 371615 | |
| Sterile surgical gloves | Cardinal Health, Inc. | 2D72PT65X | |
| Sterile towel drape (18 x 26 inch) | IMCO | 4410-IMC | |
| Sucrose | Sigma Aldrich | S9378 | |
| Syringe (1 mL) | Becton, Dickinson and Company | 309659 | |
| Undyed braided coated vicryl suture (5-0) | Ethicon Inc. | J490G | |
| UV black light | General Electric | F15T8-BLB |
Referencias
- Iannotti, J. P. Growth plate physiology and pathology. Orthop Clin North Am. 21 (1), 1-17 (1990).
- Chung, R., Foster, B. K., Xian, C. J. Injury responses and repair mechanisms of the injured growth plate. Front Biosci (Schol Ed). 3 (1), 117-125 (2011).
- Salter, R. B., Harris, W. R. Injuries involving the epiphyseal plate. JBJS. 45 (3), 587-622 (1963).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications in brief: Salter-harris classification of pediatric physeal fractures. Clin Orthop Relat Res. 474 (11), 2531-2537 (2016).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured. Bone. 49 (4), 904-912 (2011).
- Shaw, N., et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev. 24 (2), 85-97 (2018).
- Xian, C. J., Zhou, F. H., Mccarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Muruganandan, S., et al. A foxa2+ long-term stem cell population is necessary for growth plate cartilage regeneration after injury. Nat Commun. 13 (1), 2515 (2022).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, E. H., Gao, G. X., Bose, K. Management of partial growth arrest: Physis, fat, or silastic. J Pediatr Orthop. 13 (3), 368-372 (1993).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Foster, B. K., et al. Reimplantation of growth plate chondrocytes into growth plate defects in sheep. J Orthop Res. 8 (4), 555-564 (1990).
- Erickson, C. B., et al. A rat tibial growth plate injury model to characterize repair mechanisms and evaluate growth plate regeneration strategies. J Vis Exp. (125), (2017).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Mccarty, R. C., Xian, C. J., Gronthos, S., Zannettino, A. C., Foster, B. K. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury. Open Orthop J. 4, 204-210 (2010).
- Chen, J., et al. Isolation and characterization of murine mandibular condylar cartilage cell populations. Cells Tissues Organs. 195 (3), 232-243 (2012).
- Clearfield, D. S., Xin, X., Yadav, S., Rowe, D. W., Wei, M. Osteochondral differentiation of fluorescent multireporter cells on zonally-organized biomaterials. Tissue Eng Part A. 25 (5-6), 468-486 (2019).
- Dyment, N. A., et al. Response of knee fibrocartilage to joint destabilization. Osteoarthritis Cartilage. 23 (6), 996-1006 (2015).
- Kalajzic, I., et al. Use of type i collagen green fluorescent protein transgenes to identify subpopulations of cells at different stages of the osteoblast lineage. J Bone Miner Res. 17 (1), 15-25 (2002).
- Maye, P., et al. Generation and characterization of col10a1-mcherry reporter mice. Genesis. 49 (5), 410-418 (2011).
- Chokalingam, K., et al. Three-dimensional in vitro effects of compression and time in culture on aggregate modulus and on gene expression and protein content of collagen type ii in murine chondrocytes. Tissue Eng Part A. 15 (10), 2807-2816 (2009).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sci. 152, 244-248 (2016).
- Dyment, N. A., et al. High-throughput, multi-image cryohistology of mineralized tissues. J Vis Exp. (115), (2016).
- Chavez, M. B., et al. Guidelines for micro-computed tomography analysis of rodent dentoalveolar tissues. JBMR Plus. 5 (3), e10474 (2021).
- Chung, R., Xian, C. J. Recent research on the growth plate: Mechanisms for growth plate injury repair and potential cell-based therapies for regeneration. J Mol Endocrinol. 53 (1), T45-T61 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados