Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Resonancia magnética y espectroscopía pulmonar hiperpolarizada de 129xe en ratones ventilados mecánicamente
En este artículo
Resumen
La resonancia magnética de xenón hiperpolarizado puede cuantificar la microestructura pulmonar regional (dimensiones del espacio aéreo) y la fisiología (ventilación e intercambio de gases) en la investigación traslacional y la atención clínica. Aunque es un desafío, puede proporcionar información pulmonar comparable en estudios preclínicos. Este protocolo describe la infraestructura y los procedimientos necesarios para realizar una resonancia magnética pulmonar de xenón de rutina en ratones.
Resumen
El xenón-129 (129Xe) hiperpolarizado (HP) es un agente de contraste de imágenes por resonancia magnética (IRM) inhalado con propiedades espectrales y físicas únicas que se pueden explotar para cuantificar la fisiología pulmonar, incluida la ventilación, la difusión restringida (tamaño del espacio aéreo alveolar) y el intercambio de gases. En los seres humanos, se ha utilizado para evaluar la gravedad y la progresión de la enfermedad en una variedad de trastornos pulmonares y está aprobado para uso clínico en los Estados Unidos y el Reino Unido. Más allá de sus aplicaciones clínicas, la capacidad de la resonancia magnética 129Xe para evaluar de forma no invasiva la fisiopatología pulmonar y proporcionar información resuelta espacialmente es valiosa para la investigación preclínica. Entre los modelos animales, los ratones son los más utilizados debido a la accesibilidad de los modelos de enfermedades modificadas genéticamente. En este caso, la resonancia magnética con 129Xe es prometedora como una técnica mínimamente invasiva, sin radiación y sensible para monitorizar longitudinalmente la progresión de la enfermedad pulmonar y la respuesta al tratamiento (por ejemplo, en el descubrimiento de fármacos). Esta técnica puede extenderse a aplicaciones preclínicas mediante la incorporación de un aparato de respiración libre activado por resonancia magnética o un ventilador mecánico para administrar gas. Aquí, describimos los pasos y proporcionamos listas de verificación para garantizar una recopilación y un análisis de datos sólidos, incluida la creación de un maniquí de gas xenón polarizado térmicamente para el control de calidad, la optimización de la polarización, el manejo de animales (sedación, intubación, ventilación y cuidado de ratones) y los protocolos para la ventilación, la difusión restringida y los datos de intercambio de gases. Si bien la resonancia magnética preclínica de 129Xe se puede aplicar en varios modelos animales (por ejemplo, ratas, cerdos, ovejas), este protocolo se centra en ratones debido a los desafíos que plantea su pequeña anatomía, que se equilibran con su asequibilidad y la disponibilidad de muchos modelos de enfermedades.
Introducción
Si bien los trastornos pulmonares siguen siendo las principales causas de morbilidad y mortalidad a nivel mundial1, en la última década se han producido mejoras drásticas en los resultados de los pacientes. Estas mejoras se deben en parte a dos factores. En primer lugar, los ensayos clínicos de fase III ahora priorizan los cambios en la función pulmonar como criterios de valoración en lugar de la mortalidad, lo que acelera los ensayos de fármacos 2,3,4,5. En segundo lugar, los avances en modelos animales mejorados han proporcionado información sobre los mecanismos de la enfermedad y han ayudado al desarrollo de terapias 6,7. Los modelos de ratón suelen ser los preferidos para la investigación traslacional porque ofrecen paralelismos fisiológicos con los humanos, asequibilidad y rápido desarrollo de enfermedades. La ingeniería genética ha ampliado la gama y la calidad de los modelos disponibles, con el International Mouse Strain Resource que ahora cuenta con más de 32.000 cepas de ratones8, en comparación con solo 4.218 cepas de ratas (Rat Genome Database9). Estos modelos han abierto nuevas vías para investigar los impulsores mecanicistas y las respuestas terapéuticas para una serie de enfermedades pulmonares, como la enfermedad pulmonar obstructiva crónica (EPOC)10, la fibrosis quística (FQ)11, la fibrosis pulmonar12,13, la hipertensiónpulmonar14,15 y el asma16.
Desafortunadamente, la investigación pulmonar con ratones está limitada por las técnicas disponibles para cuantificar la carga de la enfermedad. Los estudios a menudo se basan en procedimientos terminales que 1) proporcionan información de todo el pulmón (ensayos bioquímicos) o información localizada (histología) y 2) exigen diseños transversales y tamaños de muestra grandes. Por lo tanto, no captan ni espacial ni temporalmente la dinámica de la enfermedad. Por el contrario, las imágenes tridimensionales no invasivas pueden evaluar la estructura, los procesos moleculares y la función de los pulmones a lo largo del tiempo.
La estructura pulmonar (p. ej., anomalías de las vías respiratorias y fibrosis intersticial) se puede visualizar con una resonancia magnética de tiempo de eco ultracorto (UTE) y una tomografía microcomputarizada (μCT) de alta resolución. La información funcional y mecanicista (por ejemplo, ventilación, perfusión, metabolismo tumoral y procesos inflamatorios) se puede obtener con agentes de contraste exógenos (por ejemplo, TC mejorada con xenón y UTE mejorada con oxígeno) y abordajes de medicina nuclear ionizante (es decir, tomografía por emisión de positrones [PET] y tomografía computarizada por emisión de fotón único [SPECT]). Sin embargo, las imágenes funcionales son un desafío debido al modesto contraste a ruido (particularmente para UTE mejorado con oxígeno a las altas intensidades de campo magnético utilizadas para la resonancia magnética preclínica, donde T1 se alarga) disponible sin emplear modalidades ionizantes con niveles de radiación más altos de lo normal. Si bien las imágenes con estas modalidades son bien toleradas en modelos animales que utilizan dosis convencionales, la radiación acumulada puede confundir los resultados en estudios sobre inmunología, inflamación y cáncer de pulmón17. Sin embargo, las imágenes de resonancia magnética (RM) de xenón-129 (129Xe) hiperpolarizadas (HP) proporcionan información estructural y funcional mínimamente invasiva, no irradiante y altamente sensible. Si bien esta técnica se ha empleado en la investigación preclínica para caracterizar afecciones como el enfisema18,19, la fibrosis20, el cáncer de pulmón21, la EPOC22 y la lesión pulmonar inducida por radiación23 en puntos de tiempo únicos o múltiples, sigue estando infrautilizada en el entorno preclínico.
Para permitir la resonancia magnética preclínica de rutina con 129Xe, se requieren varios requisitos previos, incluido el apoyo regulatorio institucional, un dispositivo de hiperpolarización, una bobina de radiofrecuencia (RF) sintonizada con 129Xe y un escáner con capacidad multinuclear. Aunque las aplicaciones avanzadas 24,25,26,27,28,29,30,31,32,33 requieren una programación de pulsos específica del proveedor que está fuera del alcance de este protocolo, las aplicaciones básicas se pueden lograr con modificaciones de software modestas. Por lo tanto, nos enfocamos en el control de calidad, el manejo de magnetización, la recopilación de datos y los procedimientos de manejo de animales, incluida la ventilación mecánica, que son exclusivos de la resonancia magnética preclínica de 129Xe (Figura 1).
Hasta la fecha, las imágenes de 129Xe para animales pequeños han empleado tres enfoques de administración de gas seguros para resonancia magnética, cada uno con ventajas y desventajas: respiración libre, accionamiento por pistón y caída de presión. La respiración libre permite la inhalación espontánea sin riesgo de lesiones por intubación o traqueostomía, pero consume significativamente más gas HP y puede introducir artefactos de movimiento34,35. Los dispositivos comerciales accionados por pistón se autocalibran y son fáciles de usar nada más sacarlos de la caja, pero pueden ser prohibitivamentecaros. El enfoque basado en la caída de presión utilizado aquí está bien descrito en la literatura, modular, personalizable y ejecutado por código abierto 37,38,39,40. Además, es rentable, por lo general por un total de menos de $ 10k y unas pocas semanas de tiempo de construcción dedicado. El ventilador con caída de presión suministra 129Xe desde una bolsa de dosis dentro de un recipiente presurizado mientras monitorea la presión de las vías respiratorias de un ratón intubado.
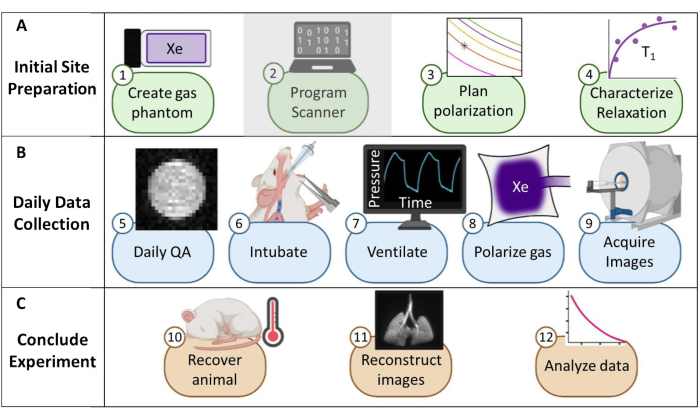
Figura 1: Descripción general del protocolo para recolectar imágenes de resonancia magnética (MRI) de xenon-129 (129Xe) de rutina en ratones. (A) Pasos para la configuración inicial. (Nota: la programación del escáner es única para cada proveedor y no se describe en este protocolo). (B) Pasos para recopilar datos diarios de aseguramiento de la calidad (QA) y de los animales. (C) Pasos para la conclusión exitosa del experimento y el análisis de datos. Haga clic aquí para ver una versión más grande de esta figura.
Aquí, recopilamos y analizamos las tres clases comunes de datos de resonancia magnética de 129Xe: ventilación, imágenes ponderadas por difusión (tamaño del espacio aéreo alveolar) e intercambio de gases. Las imágenes de ventilación muestran la distribución del gas 129Xe inhalado. Las regiones de los pulmones con flujo de aire reducido aparecen oscuras en las imágenes de gas HP, y la patología se cuantifica por el volumen de ventilación defectuosa. En humanos, el porcentaje de defectos ventilatorios (VDP) ha mostrado una fuerte repetibilidad41,42 y una alta sensibilidad a la obstrucción pulmonar en enfermedades como la EPOC 43,44,45 y el asma 46,47.
La difusión restringida de los átomos de 129Xe en el espacio aéreo se puede medir a través del coeficiente de difusión aparente (ADC) y sirve como sustituto del tamaño del espacio aéreo. El ADC se calcula adquiriendo una imagen de referencia (b0) sin ponderación de difusión y una o más imágenes adquiridas en presencia de ponderación de difusión inducida por gradiente bipolar (bN). Un ADC elevado refleja un aumento en el tamaño del espacio aéreo debido al envejecimiento o a la remodelación enfisematosa18,48. Además, el uso de múltiples imágenes de valor b (≥4) permite calcular información morfométrica más detallada (por ejemplo, la intersección lineal media)49,50.
El intercambio de gases se puede caracterizar debido a 1) la solubilidad de 129Xe en el tejido de la membrana capilar, el plasma y los glóbulos rojos y 2) el cambio químico de >200 ppm en el campo de 129Xe cuando se disuelve en estos compartimentos. Tanto los datos espectroscópicos como los de imagen proporcionan información sobre las enfermedades cardiopulmonares (p. ej., hipertensión pulmonar e insuficiencia cardíaca izquierda 51,52,53). Mientras que muchas especies (humanos, caninos y ratas) muestran picos espectrales únicos que se originan en cada compartimento, los ratones carecen de una señal única de glóbulos rojos debido a las diferencias en las interacciones del sitio de unión de la hemoglobina y el xenón. En cambio, todos los componentes disueltos se combinan en una sola señal en los ratones54. Sin embargo, es posible observar una resonancia distintiva de los glóbulos rojos en ratones transgénicos que expresan hemoglobina humana, como los utilizados en modelos de enfermedad de células falciformes54. En general, la espectroscopia y las imágenes de 129Xe disuelto proporcionan información única sobre la fisiopatología cardiopulmonar en ratones55,56.
Antes de intentar este protocolo, es necesario comprender la información general sobre el escáner de resonancia magnética, la ventilación mecánica y las técnicas de manejo de ratones necesarias para los estudios con animales. Antes de iniciar estudios con animales, todos los procedimientos deben ser aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) local57. Debido a que el momento magnético total disponible en el pulmón del ratón es intrínsecamente bajo (es decir, volumen corriente ~ 250 μL), el tamaño del vóxel debe ser 1000 veces más pequeño que en los humanos para lograr una resolución anatómicamente equivalente. La frecuencia respiratoria murina también es extremadamente rápida (>100 respiraciones/minuto). Como tal, los procedimientos de retención de la respiración única que se utilizan normalmente para las imágenes humanas no son factibles. En cambio, solo se pueden aplicar unas pocas excitaciones de RF dentro de cada respiración, por lo que se deben codificar imágenes de 129Xe durante decenas o cientos de respiraciones. Es posible que se requiera programación de pulsos para permitir la activación externa de las adquisiciones y para reproducir correctamente los cortes, las codificaciones de fase y/o las imágenes ponderadas en difusión, al tiempo que se equilibra la relación señal-ruido (SNR), la resolución y la duración del escaneo. Aquí, el ventilador emite un pulso de lógica de transistor-transistor (TTL) una vez por respiración para desencadenar la adquisición de datos (Figura 2).
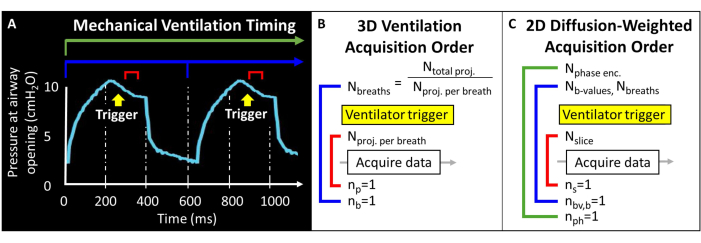
Figura 2: Ventilación mecánica representativa y temporización de adquisición de datos. (A) La ventilación controlada por el usuario puede desencadenar la adquisición de datos al final de la inspiración, durante la retención de la respiración o al final de la espiración. (B) Para esta secuencia de ventilación radial 3D, el usuario define el número total de proyecciones adquiridas y el número de proyecciones por respiración. (C) En el caso de una imagen ponderada en difusión 2D con selección de segmentos, el usuario define el orden de los sectores, las imágenes de valor b y las codificaciones de fase. Haga clic aquí para ver una versión más grande de esta figura.
Para permitir una ventilación confiable y la administración de 129Xe, se requieren procedimientos sólidos de sedación e intubación. Para cada estudio, se deben considerar los efectos posteriores de cada anestésico, incluidos los cambios en la ventilación por minuto, la frecuencia cardíaca (FC) y la presión arterial 58,59,60,61,62,63,64,65,66. Si bien se han utilizado una variedad de sedantes para la resonancia magnética preclínica con gases HP, empleamos una mezcla de ketamina, xilacina y acepromazina, debido a su disponibilidad, rentabilidad, confiabilidad y duración67,68. Una vez sedados, los animales deben ser intubados para una ventilación mecánica efectiva. La intubación de ratones es difícil debido al pequeño tamaño de su anatomía, por lo que es importante entrenarse a fondo en esta técnica. Animamos a los investigadores a revisar los protocolos de vídeo publicados69,70. Debido a que la mayoría de las cánulas de intubación comerciales contienen acero inoxidable, introducimos una técnica para fabricar cánulas en forma de cuña sin metal (es decir, compatibles con MRI y gas HP) que se pueden personalizar para que coincidan con el diámetro de las vías respiratorias para crear un sello hermético con la pared traqueal del ratón.
Debido a que se recopilan 129imágenes Xe durante muchas respiraciones, la configuración del ventilador es fundamental. Las estrategias de ventilación protectora deben ser cuidadosamente consideradas para prevenir la lesión pulmonar 71,72,73,74. En particular, el uso de bajo volumen corriente (TV), presión positiva moderada al final de la espiración (PEEP) y maniobras de reclutamiento alveolar (RM) reducen el riesgo de lesión pulmonar inducida por ventilador en pacientes humanos y modelos animales 75,76,77,78,79,80,81. En este caso, recomendamos una técnica sencilla que es compatible con la ventilación mecánica con caída de presión 129Xe que es protectora y proporciona suficiente SNR de imagen 129Xe. En concreto, aplicamos la PEEP añadiendo una válvula comercial de PEEP a la línea de exhalación del ventilador. Para realizar RM, la línea de exhalación debe estar cerrada de modo que el animal reciba múltiples inhalaciones sin exhalar hasta que se haya alcanzado una presión y duración objetivo.
A lo largo de todo el estudio, proporcionamos configuraciones generales de ventilación, pero se recomienda revisar la literatura para abordar los objetivos específicos del estudio82,83. Además de controlar la presión inspiratoria máxima durante la ventilación mecánica, es importante controlar la temperatura del animal, lo que se puede hacer utilizando métodos estándar de control de la temperatura en ratones. Si bien no es necesario para la obtención de imágenes, el monitoreo de la frecuencia cardíaca a través de un electrocardiograma (ECG) puede ser ventajoso; El ECG puede indicar si un animal se está despertando de la sedación, con una sobredosis o angustiado, lo que permite que el investigador intervenga.
El protocolo que describimos está diseñado para recopilar datos de ventilación radial 3D 129Xe61, datos ponderados en difusión GRE2D 76 y datos de intercambio de gases de espectroscopia dinámica de adquisición de pulsos. Este protocolo tiene como objetivo cerrar la brecha entre la investigación preclínica en modelos de animales pequeños y el potencial de la resonancia magnética con 129Xe para avanzar en nuestra comprensión de los trastornos pulmonares.
Protocolo
Todos los métodos descritos aquí fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC, por sus siglas en inglés) del Centro Médico del Hospital Infantil de Cincinnati.
1. Preparación inicial del sitio
- Cree y pruebe un maniquí de gas 129Xe polarizado térmicamente (Figura 3).
- Obtenga un recipiente de vidrio de borosilicato (~ 60 mL), una válvula de émbolo con una junta tórica de sellado frontal y un vástago de vidrio de borosilicato molido, todo con una capacidad de hasta 150 psig. Asegúrese de que no haya partes magnéticas. Coloque un accesorio de compresión en el vástago de vidrio. Apriete para producir un sello hermético al gas.
- Conecte el recipiente a una bomba de vacío y un depósito de oxígeno de acuerdo con la Figura 3A. Recipiente de vacío a menos de 100 mTorr de presión absoluta.
- Llene el recipiente con oxígeno a una presión de 1,5 atm para reducir el 129Xe T1 de > 30 minutos a ~2 s (a una intensidad de campo magnético de 7 T; Para un escáner de 9,4 T, utilice oxígeno de 1,6 atm). Recipiente de sellado.
NOTA: Para intensidades de campo más altas, se requerirá una presión parcial de oxígeno algo más alta para lograr T1≤ 2 s84. - Llene un depósito impermeable al gas con 400 mL de xenón enriquecido isotópicamente (85% 129Xe).
NOTA: También se puede utilizar xenón de abundancia natural (26% 129Xe), pero será necesario aumentar el promedio de la señal para mitigar la reducción de ~ 3 veces en SNR. - Conecte el recipiente al depósito de 129Xe. Tubo de vacío a menos de 100 mTorr de presión absoluta.
- Llene un líquido de sobremesa de boca abierta N2 Dewar hasta ~90%. Sumerja el fondo del recipiente (~5 cm) en nitrógeno líquido para condensar elO2 y crear un vacío (Figura 3B). Mientras está sumergido, abra la válvula para permitir que 129Xe del depósito fluyan hacia el recipiente (Figura 3C).
- Selle la válvula del émbolo tirando lentamente del vástago hasta que el orificio de entrada en el émbolo pase por la junta tórica. Inmediatamente después de que el orificio haya pasado la junta tórica, apriételo a mano para sellar el recipiente. Retire el recipiente del nitrógeno líquido y deje que se descongele.
NOTA: Una vez descongelado, el recipiente se presurizará a ~ 4,5 atm (2 atm O2 + 2,5 atm 129Xe). - Proteja la cristalería (p. ej., inserte el recipiente en un recipiente de tubería acolchado de cloruro de polivinilo (PVC), Figura 3D).
NOTA: Si se le da el mantenimiento adecuado, el maniquí puede mantener la presión durante una década o más. - Mida el T1 del maniquí (por ejemplo, utilizando una secuencia espectroscópica de recuperación de inversión). Confirme T1 < 2 s para escáneres de 7 T. Seguimiento de la señal y T1 a lo largo del tiempo para el aseguramiento de la calidad (QA).
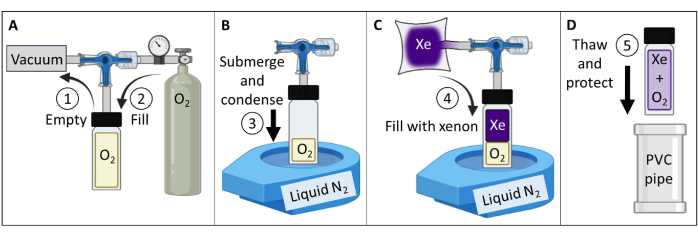
Figura 3: Creación de un maniquí de gas 129Xe polarizado térmicamente guiado por el protocolo detallado en el Paso 1.1. Las presiones parciales de O2 y 129Xe se pueden modificar para personalizar el T1 para producir tiempos apropiados de 129Xe T1 y una intensidad de señal a una intensidad de campo dada84. Haga clic aquí para ver una versión más grande de esta figura.
- Realice el aseguramiento de la calidad con el fantasma de gas polarizado térmicamente (Tabla 1 y Figura 4).
- Coloque la bobina 129Xe en el isocentro del imán y centre el maniquí de gas 129Xe dentro de la bobina. En una sola secuencia de pulso y adquisición ("pulso único"), ajuste la frecuencia de trabajo para que coincida con la frecuencia de gas aproximada de 129Xe en el maniquí (~83,07 MHz a 7T).
- Centre las frecuencias de adquisición y excitación a la frecuencia 129Xe Larmor y utilice esta frecuencia para todos los escaneos de calibración y control de calidad 129Xe de Phantom. Consulte la Tabla 1 para conocer los parámetros experimentales de todas las exploraciones de control de calidad. Confirme que el maniquí está centrado con un localizador de fantasmas (Figura 4A).
- Realice el experimento de nutación para calibrar el ángulo de volteo: Suponiendo que SNR es suficiente, use pulsos de RF individuales con un espaciado de tiempo de repetición (TR) > 5 x T1. Para cada adquisición, aumente gradualmente la potencia de RF hasta que la señal se anule y comience a invertirse. El estándar utilizado aquí es: número de pulsos = 65; TR = 10 s; duración del pulso = 125 μs; Potencia de RF = 1-13,8 W, incrementada en 0,2 W
- Transformada de Fourier y fase del primer espectro (es decir, el espectro adquirido con la potencia de RF más baja). Aplique la misma fase para todos los espectros. Trace los espectros reales en función de la potencia del pulso de RF (Figura 4B).
- La potencia que produce un pico nulo (es decir, la altura mínima del pico) corresponde al ángulo de giro de 180°. Logre un ángulo de giro de 90° utilizando la misma potencia a la mitad de la longitud de pulso necesaria para producir el ángulo de giro de 180°. Suponiendo que el software del escáner lo permita, configure esta potencia de referencia de 90° y la longitud del pulso para el escalado posterior del ángulo de volteo.
- Utilice un solo pulso para calzar minimizando el ancho total a la mitad del máximo del espectro de 129Xe (TR ~ 1 s). Si es necesario, vuelva a centrar la frecuencia después de calzar. Grabe el ancho completo medio máx.
- Ejecute el escaneo de control de calidad 129Xe (Tabla 1 y Figura 4C). Registre los datos de control de calidad: SNR, señal fantasma media y desviación estándar del ruido.
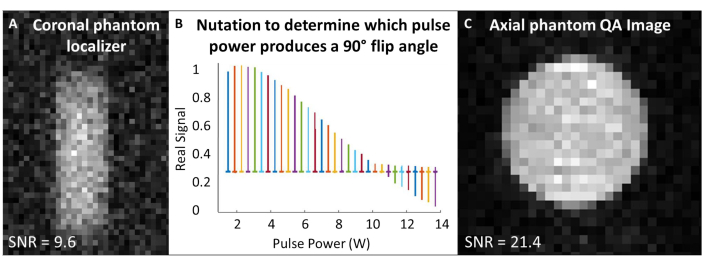
Figura 4: Aseguramiento de la calidad previo al escaneo. (A) Un localizador de maniquí coronal GRE 2D de baja resolución garantiza que el maniquí esté centrado en el imán. (B) Un experimento de nutación para establecer un pulso de 90° muestra un pico nulo en el pulso de 180°. (C) Después de localizar y calibrar el ángulo de volteo, adquiera una imagen de control de calidad GRE 2D de mayor resolución. Haga clic aquí para ver una versión más grande de esta figura.
| Nombre abreviado del protocolo | Descripción de la secuencia | TR (ms) | TE (ms) | Promedios / Repeticiones | Ángulo de giro (°) | Tamaño de la matriz o Npts | Campo de visión (mm2) | Ancho de banda de RF (kHz) | Espesor de la rebanada / losa (mm) | Duración del escaneo |
| Pulso único | Adquisición de pulso | 1000 | 1 / 1 | 60 | 2048 | 10 | 1 s | |||
| Localizador fantasma | GRE 2D | 200 | 3.7 | 20 / 1 | 48 | 60 × 32 | 120 × 48 | 3 | 60 | 2 minutos |
| Calibración del ángulo de volteo | Adquisición de pulso | 7000 | 1 / 65 | 20 | 2048 | 5.12 | 7.5 minutos | |||
| Artículo 129Xe QA | GRE 2D | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | 21 minutos |
Tabla 1: Parámetros de la secuencia de aseguramiento de la calidad de la calibración fantasma. TR = tiempo de repetición, TE = tiempo de eco, Npts = número de puntos, FOV = campo de visión, BW = ancho de banda. Haga clic aquí para descargar esta tabla.
- Polarización plana (Figura 5A, B).
- Seleccione el volumen polarizado 129Xe y el tiempo de acumulación: 400 mL en 15 min es óptimo para este protocolo (Figura 5), pero se puede ajustar fácilmente para otras aplicaciones y equipos.
- Suponiendo un volumen muerto conocido dentro del hiperpolarizador (por ejemplo, Vvol muerto = 80 mL), calcule el caudal (FXe en SLM) para un volumen dispensado Vdeseado, 129Xe fracción de gas f, y el tiempo de acumulación tacc:
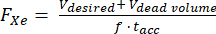 (1)
(1)
NOTA: Si bien los tiempos de producción más largos generalmente producirán una polarización más alta, es posible que no sean prácticos para la obtención de imágenes in vivo. Utilice un modelo apropiado para el hiperpolarizador 85,86,87,88 para determinar un caudal que equilibre el tiempo de producción y la polarización. En este caso, se utilizó el modelo de J. W. Plummer et al.89 (Figura 5A). Esto se aplica a los polarizadores de flujo continuo y no es aplicable a los hiperpolarizadores de flujo detenido90. - Polarizar el gas de acuerdo con estos parámetros, medir la polarización con un dispositivo comercial o casero y compararla con la polarización predicha para el control de calidad.
- Mida la pérdida de polarización durante el transporte. Si la polarización disminuye en una cantidad suficientemente grande (por ejemplo, >10%), construya un estuche de transporte magnético para proteger la polarización durante el transporte. Ver Archivo Suplementario 1: Gestión de la polarización durante el transporte y Figura Suplementaria 1.
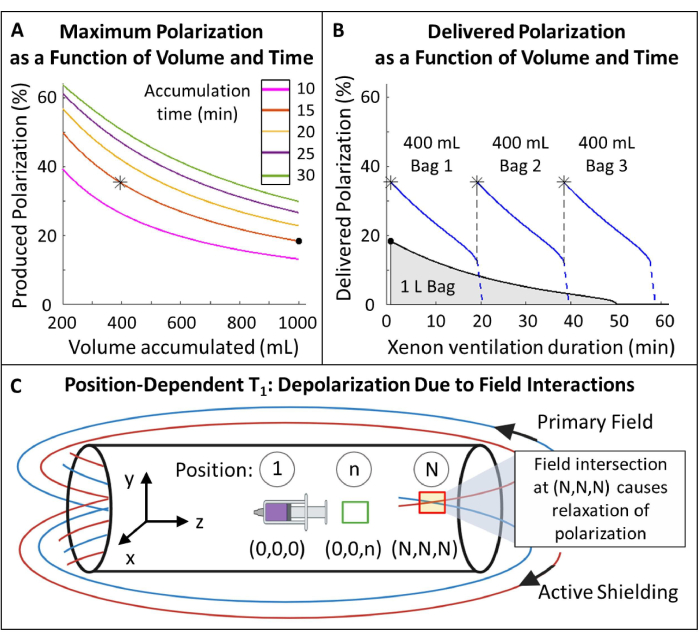
Figura 5: Gestión de la polarización. (A) La polarización y el volumen producido son una función del tiempo de acumulación y el caudal. Una bolsa de gas de 400 mL proporciona una alta polarización inicial (~35%) durante 20 min. Si bien el uso de 1 L de gas puede parecer atractivo, tendrá una polarización inicial más baja (~ 20%). (B) Después de ~ 15 minutos de ventilación, un lote de 1 litro de HP 129Xe se agotaría a una polarización del <10%, mientras que 600 mL de gas permaneceríanen 116. Por lo tanto, el uso de múltiples bolsas de 400 mL de 129Xe mantiene una polarización promedio entregada más alta. C) Las ubicaciones donde el campo primario y el campo de blindaje activo se cruzan (cuadro rojo en la posición (N,N,N)) pueden causar una relajación rápida del HP 129Xe. La caracterización del campo de franjas del imán ayuda a identificar las zonas seguras en las que se pueden colocar los depósitos de HP 129Xe sin una relajación rápida (cuadro verde en la posición (0,0,n)). Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1: Gestión de la polarización durante el transporte. Haga clic aquí para descargar este archivo.
- Mida el T1 dependiente de la posición de HP 129Xe dentro del campo de franjas (Figura 5C).
- Cree puntos de referencia con distancias y posiciones conocidas en relación con el isocentro del imán a lo largo de las dimensiones X, Y y Z. Etiquete el isocentro y etiquete las otras posiciones de n a N. El número de puestos a investigar dependerá del espacio disponible.
- Hiperpolarizar un pequeño volumen de 129Xe (~250 mL) y transportarlo a la sala de control de resonancia magnética. Llene una jeringa grande (50-100 mL) con 129Xe y colóquela en el isocentro dentro del imán (Posición 1 en la Figura 5C). Reproduzca un pulso de ángulo de giro de ~1° para medir la señal.
- Deje la jeringa en posición durante ~ 10 minutos, luego adquiera otro espectro. Vuelva a medir la señal cada 10 minutos hasta que la señal haya decaído al menos 1 T1 (es decir, la señal haya decaído a ~1/3 de su valor inicial).
- Inicie un nuevo experimento T1 con una nueva jeringa de 129Xe repitiendo el paso 1.4.2.
- Mueva la jeringa a una nueva posición (por ejemplo, la posición n en la figura 5C) y déjela allí durante 10 minutos. Regrese la jeringa al isocentro para adquirir un espectro de ángulo de giro adicional de ~1°.
- Repita este proceso: mueva la jeringa a la posición n, espere 10 minutos, vuelva a colocarla en el isocentro y vuelva a medir la señal hasta que haya decaído al menos 1 T1.
- Repita los pasos 1.4.4 - 1.4.6 para las posiciones de referencia restantes que cubren las direcciones X, Y y Z.
- La señal inicial (S0) decaerá monoexponencialmente sobre n pulsos de RF con un ángulo de inversión θ . Ajuste la señal (S) en función del tiempo (t) en el campo marginal para calcular el T1 en cada posición:
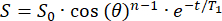 (2)
(2) - Identifique una posición con suficiente T1 (>20 min) para la colocación del depósito de 129Xe.
- Cree cánulas de intubación sin metal (Figura 6).
- Obtenga dos catéteres de politetrafluoroetileno (PTFE) permanentes venosos con conectores Luer. Deseche las agujas en un recipiente para desechar objetos punzocortantes.
NOTA: Para ratones >25 g, use catéteres de 18 G y 20 G. Para animales más pequeños, use catéteres de 20 G y 22 G. - Corte el conector Luer de los catéteres. Introduzca el catéter más pequeño en el extremo superior del catéter más grande para crear una cánula más larga y más afilada. Corte la cánula compuesta a ~4,6 cm con un extremo biselado, sin incluir la base Luer (Figura 6A, B).
- Corte el extremo más ancho de la punta de una pipeta de 200 μL hasta una longitud de ~2,6 cm (Figura 6C).
- Cubra el interior de la punta de la pipeta con lubricante desmoldante general. Utilice otra punta de pipeta insertada en el interior para distribuir finamente el lubricante. Llene la punta de la pipeta con epoxi de pasta vulcanizante de silicona acetoxy (Figura 6D, E).
- Enchufe la cánula con un cable de 22 G que se extienda por ambos extremos. Alimente el tubo de la cánula a través de silicona en la punta de la pipeta. Extienda el tubo ~7 mm más allá del extremo de la punta de la pipeta (Figura 6F, G).
- Deslice el tubo de la cánula en el lado más ancho de la punta de la pipeta a través de un conector Luer deslizante macho de plástico, pegando las piezas con el epoxi. Ajuste el tubo que se extiende más allá del conector Luer (Figura 6H).
- Espere a que el epoxi se seque (>24 h) y, a continuación, retire con cuidado la cánula de intubación de silicona del molde de la punta de la pipeta. Retire el alambre de la cánula, asegurándose de que el tubo no se haya ocluido (Figura 6I).
- Para hacer un mango que facilite la intubación, conecte el tubo (1/16" o 1/8") a un conector Luer hembra. Cuando esté listo para la intubación, conecte este conector Luer hembra a la cánula de intubación Luer macho. Esta pieza se puede desmontar fácilmente después de la intubación (Figura 6J).
- Desinfectar antes de cada uso en animales: limpie el exterior de la cánula con alcohol al 70%. Limpie el alambre de 20 g con desinfectante y luego pase el alambre a través de la cánula para desinfectar el interior y asegurarse de que no haya obstrucciones.
- Obtenga dos catéteres de politetrafluoroetileno (PTFE) permanentes venosos con conectores Luer. Deseche las agujas en un recipiente para desechar objetos punzocortantes.
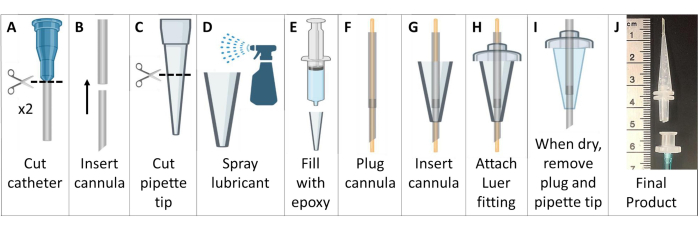
Figura 6: Creación de cánulas de intubación de ratón compatibles con resonancia magnética y HP 129Xe. Estas cánulas están construidas con catéteres venosos, puntas de pipeta y sellador de silicona, como se describe en el paso 1.5. Haga clic aquí para ver una versión más grande de esta figura.
2. Recopilación diaria de datos
NOTA: Consulte el Archivo complementario 2: Lista de verificación de control de calidad de exploración preclínica.
Archivo complementario 2: Lista de verificación de control de calidad de la exploración preclínica. Haga clic aquí para descargar este archivo.
- Control de calidad diario completo del escáner y configuración del ventilador (Figura 4).
- Con maniquíes, ejecute protocolos de control de calidad en el escáner (consulte la Tabla 1 para conocer los parámetros de análisis de control de calidad y el Paso 1.2 para conocer los pasos diarios de control de calidad).
- Calibrar el ventilador según el método de J. Nouls et al.38. Ver Archivo Suplementario 3: Calibración del Ventilador, Figura Suplementaria 2 y Figura Suplementaria 3.
- Ajuste la configuración del ventilador para la obtención de imágenes al final de la inspiración (Tabla 2). Coloque la cama del animal en el estante del escáner y el módulo de soporte vital (es decir, las piezas del ventilador mecánico) en la mesa junto al escáner.
- Active el sistema de calefacción de animales específico del sitio. Ajuste un calentador a 35.5 - 40 °C, encienda el aire circulante y coloque la manguera de aire a menos de ~ 5 "de donde descansará la cabeza del animal para precalentar el orificio del escáner.
| Ajuste de ventilación | Recomendación para la resonancia magnética HP 129Xe | Notas |
| Volumen corriente (TV) | 8–10 mL/kg de peso corporal ideal | Televisión moderada; un televisor bajo requiere un BR más alto, lo que puede causar artefactos de movimiento en las imágenes |
| Presión positiva al final de la espiración (PEEP) | 2–6 cmH2O | |
| Frecuencia respiratoria (BR) | 80–120 br/min | |
| Maniobras de reclutamiento (RMs) | ~35 cmH2O durante 6 s cada 5 min | |
| Duración de la ventilación; Posición | < 6 h; supino | Decúbito supino para ver mejor el movimiento del pecho |
| Fracción de oxígeno inspirado (FIO2) | 0.3–0.5 | Prevenir la hipoxia en ratones anestesiados |
| Relación inspiratoria/espiratoria (I:E) | 1:2–1:4 | |
| Inspiratorio a la duración total del ciclo | 0.2–0.4 | |
| Ventilación por minuto | ≥0.57 mL·g-1·min-1 | |
| Nuestros estándares: | ||
| BR = 80 br/min, duración de la inspiración = 200 ms, FIO2 = 0,3 | ||
| Imágenes al final de la inspiración: apnea = 200 ms, retardo de disparo = 200 ms después del inicio de la inspiración | ||
| Imágenes durante la apnea: apnea = 250 ms, retardo de disparo = 250 ms después del inicio de la inspiración | ||
| Imágenes al final de la espiración: apnea = 200 ms, retardo de disparo = 650 ms después del inicio de la inspiración | ||
Tabla 2: Ajustes recomendados del ventilador para la obtención de imágenes de 129Xe. Los parámetros se pueden ajustar para objetivos de estudio específicos y condiciones experimentales 117,118,119,120,121,122,123,124. Haga clic aquí para descargar esta tabla.
Archivo complementario 3: Calibración del ventilador. Haga clic aquí para descargar este archivo.
- Animal sedado e intubado.
- Encienda la incubadora a 27,7 °C y/o la almohadilla térmica eléctrica a 37,7 °C. Mida y registre la masa corporal del animal. Calcule la dosis de sedante en función de la masa. Consulte la Tabla 3 para ver un régimen de dosificación típico.
- Inyectar el sedante por vía intraperitoneal. Anote la hora de la inyección y programe el temporizador para la siguiente dosis de sedante.
NOTA: Complete los pasos restantes de la Sección 2 (Recopilación diaria de datos) lo más rápido posible para minimizar el tiempo bajo sedación y el riesgo de sobredosis. - Aplique lubricante ocular en los ojos del animal y colóquelo en una jaula sobre la almohadilla térmica o dentro de una incubadora para prevenir la hipotermia.
- Confirme que el animal está completamente sedado realizando una prueba de pellizco de los dedos del pie 10-15 minutos después de la inyección de sedante68. Intubar siguiendo los procedimientos descritos en Das et al.69.
NOTA: El artículo de Das et al.69 va acompañado de una completa demostración en vídeo de la técnica. Los pasos son los siguientes: - Cuelga al animal en decúbito supino por los dientes sobre una tabla inclinada. Use un depresor de lengua para roedores para sacar la lengua.
- Para asegurarse de que las cuerdas vocales sean visibles, suministre luz blanca a través de un cable de fibra óptica dentro de la cánula de intubación o una luz brillante colocada en el exterior de la garganta. Inserte la cánula a menos de 5 mm de las cuerdas vocales.
- Asegúrese de que la cánula esté en la tráquea, no en el esófago, conectándola a un trozo de tubo con una pequeña gota de agua en su interior. Si la gota de agua se mueve al ritmo de la respiración del animal, es probable que la posición sea correcta.
| Agente | Dosis | Ruta | Duración | Comentarios | |||
| Agentes inhalados | |||||||
| Isoflurano | Inducción: 4%–5% Mantenimiento: 1%– 3% o al efecto | Inhalado | Durante el flujo continuo | • Requiere el uso de un vaporizador calibrado | |||
| Agentes inyectables | |||||||
| Recomendado: Ketamina + xilacina + acepromazina | 90 + 9 + 3 mg/kg | Intraperitoneal | De 20 a 60 minutos | • Crea susceptibilidad a la hipotermia | |||
| • Para dosis repetidas, se recomienda cambiar a una mezcla de ketamina + xilacina para prevenir una sobredosis | |||||||
| • Provoca temblores a medida que pasa el efecto. Para la obtención de imágenes, cumpla estrictamente con el programa de dosificación | |||||||
| • Puede causar bradicardia | |||||||
| Ketamina + xilacina | 90 + 9 mg/kg | Intraperitoneal | De 20 a 40 minutos | • Ver arriba (Ketamina + xilacina + acepromazina) | |||
| Pentobarbital | 50 - 70 mg/kg | Intraperitoneal | De 20 a 60 minutos | • Deprime la frecuencia respiratoria y el movimiento | |||
| • El costo puede ser prohibitivo | |||||||
| • Es posible que el grado farmacéutico no esté disponible | |||||||
| Descargo de responsabilidad: Estas son pautas generales. Consulte a un veterinario para obtener más información antes de la implementación. | |||||||
Tabla 3: Formulario anestésico común para ratones. Haga clic aquí para descargar esta tabla.
- Ventilar al animal (Tabla 2).
- Conecte el animal al ventilador a través del conector Luer en la cánula de intubación. Monitorizar el movimiento diafragmático y la presión inspiratoria máxima (~10-12 cm H2O para un volumen corriente de 10 mL/kg de peso corporal). Si la presión o el movimiento respiratorio son anormales, ajuste cuidadosamente el ángulo del cuello y la profundidad de la cánula según sea necesario.
- Asegúrese de que la cánula de intubación sea hermética realizando una maniobra de reclutamiento: evite la exhalación (por ejemplo, con un dedo, bloquee el puerto de exhalación) de modo que el animal inhale varias veces sin exhalar.
NOTA: Si la presión de la vía aérea alcanza la presión inspiratoria máxima de 35 cmH2O durante ~6 s, el sello de la vía aérea está suficientemente apretado. Si no es así, consulte la explicación para solucionar problemas. - Permita que se reanude la exhalación normal. Realice maniobras de reclutamiento entre exploraciones y cada ~ 5 minutos cuando no esté explorando para mantener la distensibilidad pulmonar y prevenir la atelectasia. Conecte la válvula PEEP a la línea de exhalación. Ajuste PEEP a 4 cmH2O. Observe cómo la presión inspiratoria máxima aumenta en esa cantidad.
- Después de una intubación exitosa, planifique e inicialice la producción de HP 129Xe en torno al programa de redosis de sedantes para evitar que el animal se despierte durante una exploración. Controla la temperatura corporal durante todo el experimento.
- Adquisición de datos: Recogida de imágenes de ventilación.
NOTA: Los pasos de adquisición de datos 2.4, 2.5 y 2.6 se pueden realizar en cualquier orden- Ajuste el ventilador de acuerdo con la Tabla 2 para obtener imágenes al final de la inspiración.
- Cargue los siguientes protocolos de configuración: localizador de animales de protones, pulso único para centrarse en la frecuencia del gas en los pulmones del ratón y localizador de animales 129Xe. Consulte la Tabla 4 para conocer los parámetros de exploración.
- Coloque al animal en el isocentro y confirme que la cavidad torácica está en el centro del campo de visión con localización de protones. Si utiliza bobinas de frecuencia única, reemplace la bobina de protones con una bobina de RF sintonizada con 129Xe.
- Registre la polarización de 129Xe y transpórtela al escáner de resonancia magnética. Ver Archivo Complementario 4: Lista de verificación de control de calidad de polarización de xenón.
- Coloque una bolsa de 129Xe dentro del recipiente del ventilador y séllelo. Conecte el recipiente en línea con el ventilador y permita que el recipiente se presurice (3 - 6 psig).
- Iniciar la ventilación mecánica 129Xe. Cada vez que se activa la ventilación 129Xe, permita que el animal complete ~ 5 respiraciones antes de comenzar una exploración para cambiar la capacidad residual funcional de los pulmones.
NOTA: Cambie a la mezcla N2/O2 entre 129exploraciones Xe para conservar el gas hiperpolarizado. - Con un solo pulso, ajuste la frecuencia de trabajo para que coincida con la frecuencia de resonancia in vivo de 129Xe gaseoso (~83,07 MHz a 7 T). Copie la frecuencia en todos los escaneos posteriores de la fase gaseosa 129Xe. Realice la localización de 129Xe para confirmar que los pulmones están en el isocentro.
- Cargue y ejecute la secuencia de ventilación radial 129Xe. Controle la presión inspiratoria máxima.
NOTA: Si el gas 129Xe se agota antes de que finalice el protocolo, la presión inspiratoria máxima disminuirá rápidamente. Una bolsa de 400 mL de 129Xe puede ventilar un ratón de 30 g durante ~24 minutos cuando se ventila con un 70% de 129Xe a 80 respiraciones por minuto con un volumen corriente de 10 mL/kg de peso corporal ideal. - Una vez finalizada la exploración, cambie a la ventilación con la mezcla N2/O2 y retire la bolsa vacía de 129Xe.
- Para obtener imágenes al final de la espiración, cambie la duración de la apnea y el retardo del disparo de acuerdo con la Tabla 2 y repita los pasos 2.4.2 a 2.4.9.
- Exporte los datos sin procesar del escáner.
| Nombre abreviado del protocolo | Descripción de la secuencia | Detonante | TR (ms) | TE (ms) | Repeticiones | Ángulo de giro (°) | Tamaño de la matriz o Npts | Campo de visión (mm2) | Ancho de banda de RF (kHz) | Espesor de la loncha/losa (mm) | Duración del escaneo |
| Pulso único | Adquisición de pulsos (fase gaseosa) | Opcional | 1000 | 1 | 60 | 2048 | 10 | 1 s | |||
| Localizador de animales | GRE 2D | Sí | 50 | 1.7 | 1 | 60 | 642 | 322 | 3 | 25 | 60 s |
| Ventilación radial | Radial multieco 3D | Sí | 20 | Ver pie de foto | 1 | 30 | 613 | 223 | 32.05 | 30 | 16 minutos |
| Fase disuelta pulso único | Adquisición de pulsos (fase disuelta) | No | 80 | 1 | 90 | 512 | 10.35 | 80 ms | |||
| Especificaciones dinámicas de fase disuelta. | Adquisición de pulsos (fase disuelta) | No | 50 | 1000 | 90 | 512 | 10.5 | 50 s | |||
| Difusión ponderada | GRE 2D | Sí | 12.2 | 8.1 | 4 | 45 | 642 | 322 | 3 | 1.5 | 18 minutos |
Tabla 4: Parámetros de secuencia in vivo . La secuencia de ventilación radial multieco 3D descrita anteriormente39 adquiere imágenes a 6 veces de eco. Se muestran los resultados de la primera imagen de eco (TE = 1,12 ms, Figura 7). Haga clic aquí para descargar esta tabla.
Archivo complementario 4: Lista de verificación de control de calidad de polarización de xenón. Haga clic aquí para descargar este archivo.
- Adquisición de datos: Ejecute espectroscopía dinámica de fase disuelta.
- Configure el ventilador de acuerdo con la Tabla 2 para obtener imágenes durante la retención de la respiración. Ajuste el BR a 100 respiraciones/min. Prepárese para una nueva bolsa de 129Xe como en los pasos 2.4.2 - 2.4.5.
- Iniciar la ventilación mecánica 129Xe. Cargue y ejecute un solo pulso para ajustar la frecuencia de trabajo para que coincida con la frecuencia disuelta (~ 83.084 MHz a 7 T). Copie la frecuencia de trabajo en la espectroscopia dinámica de fase disuelta.
NOTA: Este será un solo pico en ratones con hemoglobina54 de tipo salvaje. - Cargue y ejecute la secuencia de espectroscopia dinámica centrada en la frecuencia disuelta en los pulmones de los animales. Una vez finalizada la exploración, cambie a la ventilación con la mezcla N2/O2 y retire la bolsa vacía de 129Xe. Exporte los datos sin procesar del escáner.
- Adquisición de datos: Recopile imágenes ponderadas por difusión.
- Configure el ventilador de acuerdo con la Tabla 2 para obtener imágenes durante la retención de la respiración. Prepárese para una nueva bolsa de 129Xe como en los pasos 2.4.2 - 2.4.7.
- Cargue y ejecute la secuencia ponderada de difusión. Una vez finalizada la exploración, cambie a la ventilación con la mezcla N2/O2 y retire la bolsa vacía de 129Xe. Exporte los datos sin procesar del escáner.
3. Conclusión del experimento
- Recuperar animal.
- Tire de la cánula de intubación directamente fuera de la boca del animal. Si el animal no comienza a respirar espontáneamente de inmediato, administre compresiones torácicas ligeras. Si está disponible, administre un flujo ligero de oxígeno de grado médico cerca de la cara del animal para apoyar la recuperación de la sedación.
- Una vez que el animal esté respirando de manera constante por sí solo y si el animal estuvo sedado durante >2 h, administre 0,5 - 1 mL de solución salina normal por vía subcutánea para prevenir la deshidratación.
- Regresa al animal a una jaula por sí solo. Coloque la jaula en una incubadora o en una almohadilla térmica.
NOTA: Los animales sedados son vulnerables al canibalismo y no se pueden colocar en una jaula con compañeros de jaula hasta que estén completamente recuperados (es decir, deambulando de forma independiente). Los animales sedados no pueden regular su temperatura corporal. Use el dorso de la mano para sentir la temperatura del animal cada pocos minutos. - Vigile al animal de cerca hasta que su reflejo de enderezamiento haya regresado (es decir, puede voltearse de forma independiente de una posición supina a una posición prona).
- Retire al animal del soporte térmico una vez que pueda deambular de forma independiente. Regrese al animal a una jaula con sus compañeros de jaula.
NOTA: si el animal no tiene compañeros de jaula, es más susceptible a la hipotermia inducida por la sedación. Proporciónale al animal ropa de cama adicional y, si está disponible, déjalo en una incubadora durante la noche. - Registre el peso del animal una vez por semana durante 2 semanas para controlar su salud.
NOTA: Si el animal sufrió una lesión en la boca o el esófago a causa de la intubación, puede dejar de comer. Si el animal pierde el >20% de su peso corporal inicial, consulte a un veterinario sobre la eutanasia.
- Analice las imágenes de ventilación (Figura 7).
- Cargue datos sin procesar en una plataforma de programación. Descargue el marco de reconstrucción de código abierto para imágenes no cartesianas91.
- Reconstruya las imágenes de acuerdo con las instrucciones del marco de código abierto. Normalice el primer punto de cada proyección radial39.
- Segmente el parénquima pulmonar en las imágenes, incluidos los vóxeles con señal 129Xe baja o nula. No incluya las vías respiratorias grandes. Segmente el ruido de fondo en la imagen, excluyendo los pulmones, las vías respiratorias y los artefactos de imagen.
NOTA: La imagen del localizador de protones puede ayudar a determinar los límites del parénquima. - Calcule la SNR usando la fórmula:
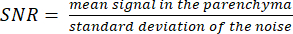 (3)
(3) - Cuantificar la ventilación defectuosa.
NOTA: Se han propuesto varios métodos para cuantificar el deterioro de la ventilación en modelos de animales pequeños. Los métodos de análisis siguen siendo un área abierta de investigación, pero los enfoques de fácil implementación incluyen: (i) Segmentación manual semicuantitativa92, (ii) Enfoque de histograma que utiliza la señal de la tráquea para normalizar la señal parenquimatosa47, y (iii) Segmentación del volumen pulmonar total (TLV) y definición de un umbral de señal (por ejemplo, <60% de la media pulmonar total) para dividir los pulmones en volumen defectuoso y volumen pulmonar ventilado (VV). Cuantificar VDP 93,94 según:
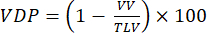 (4)
(4)
- Analice la espectroscopia dinámica de fase disuelta (Figura 8).
- Cargue datos sin procesar en una plataforma de programación. Realice una transformada rápida de Fourier y fone los espectros (la fase manual simultánea de orden cero de los espectros es suficiente para esta aplicación).
- Calcule los datos estándar de resonancia magnética nuclear (RMN)95,96: SNR, ancho completo medio máximo, área integrada, desplazamiento químico y fase de ambos picos.
- A partir de los datos de magnitud, divida la amplitud de la señal del espectro disuelto por la del espectro de gases para cada repetición para encontrar la relación entre disueltos y gases a lo largo del tiempo.
- Analice las imágenes ponderadas por difusión (Figura 9).
- Cargue datos sin procesar en una plataforma de programación. Segmente el parénquima pulmonar de la imagen b0 como en el paso 3.2.3. Calcule la SNR para cada imagen de valor b.
- Calcule la relación señal-valor-ruido, SVNR0, dividiendo la señal en cada vóxel de la imagen b0 por la desviación estándar del ruido de la imagen. Excluya vóxeles con SVNR0 < 2,5 veces el ruido de la imagen97.
NOTA: El SVNR0 es una métrica de vóxel individual, mientras que el SNR parenquimatoso es una métrica de todo el pulmón. - Calcule el ADC ajustando el decaimiento de la señal sobre los valores b (bi) de acuerdo con la Ecuación 598,99:
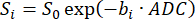 (5)
(5)
Resultados
Imágenes de ventilación
Si los procedimientos de preparación y ventilación de los animales se implementan correctamente, las imágenes radiales en 3D pueden capturar con éxito los patrones de ventilación cuando la adquisición de datos se realiza en la inspiración o en la espiración (Figura 7). Si bien estas imágenes se recopilan a lo largo de muchas respiraciones, el método descrito aquí es similar al ...
Discusión
La resonancia magnética hiperpolarizada con 129X se está convirtiendo en una técnica sofisticada y potente para estudiar la microestructura y la función pulmonar en modelos animales pequeños. Este protocolo tiene como objetivo guiar la preparación inicial del sitio y describir los procedimientos experimentales necesarios para cuantificar la ventilación, la difusión y el intercambio de gases en pulmones de ratón con HP 129Xe. Los requisitos previos clave par...
Divulgaciones
Peter Niedbalski es consultor de Polarean Imaging, Plc.
Agradecimientos
Los autores extienden su más sincero agradecimiento a Jerry Dalke por ser una luz guía en la construcción de ventiladores. Nos gustaría agradecer a Carter McMaster por elaborar la HP 129Xe de gas. También nos gustaría agradecer al Dr. Matthew Willmering y al Dr. Juan Parra-Robles por sus discusiones científicas que invitan a la reflexión. Figuras creadas con BioRender.com. Este trabajo fue financiado por los Institutos Nacionales de la Salud (Subvención Nº: NHLBI R01HL143011, R01HL151588)
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
Referencias
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042 (2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25 (2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475 (2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091 (2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702 (2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159 (2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302 (2020).
- Akinyi, T. G. . An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441 (2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713 (2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035 (2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029 (2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831 (2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23 (2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251 (2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269 (2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30 (2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201 (2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11 (2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845 (2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. . Magnetic Resonance Imaging: Physical Principles and Sequence Design. , (2014).
- Levitt, M. H. . Spin Dynamics: Basics of Nuclear Magnetic Resonance. , (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639 (2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147 (2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527 (2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419 (2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados