Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Identificación de células T raras específicas de antígeno de pulmones de ratón con tetrámeros del complejo de histocompatibilidad peptídico:principal
En este artículo
Resumen
Proporcionamos un protocolo detallado para aislar e identificar poblaciones de células T específicas de antígenos raros en pulmones de ratón a través del enriquecimiento de células T basado en perlas magnéticas y tetrámeros del complejo de histocompatibilidad mayor (MHC) de péptidos.
Resumen
La identificación y caracterización de las células T específicas de antígeno durante la salud y la enfermedad sigue siendo clave para mejorar nuestra comprensión de la fisiopatología inmunitaria. Los desafíos técnicos del seguimiento de las poblaciones de linfocitos T específicos de antígeno dentro del repertorio de linfocitos T endógenos han avanzado enormemente gracias al desarrollo de reactivos tetrámeros péptido:MHC. Estos multímeros solubles marcados con fluorescencia de moléculas MHC de clase I o clase II complejadas con epítopos peptídicos antigénicos se unen directamente a las células T con la correspondiente especificidad del receptor de células T (TCR) y, por lo tanto, pueden identificar poblaciones de células T específicas de antígeno en su estado nativo sin necesidad de una respuesta funcional inducida ex vivo estimulación. Para poblaciones extremadamente raras, las células T unidas a tetrámeros se pueden enriquecer magnéticamente para aumentar la sensibilidad y la fiabilidad de la detección.
A medida que se profundiza la investigación de la inmunidad de las células T residentes en los tejidos, existe una necesidad apremiante de identificar las células T específicas de antígeno que trafican y residen en los tejidos no linfoides. En este protocolo, presentamos un conjunto detallado de instrucciones para el aislamiento y la caracterización de las células T específicas de antígeno presentes en los pulmones de ratón. Esto implica el aislamiento de las células T del tejido pulmonar digerido, seguido de un paso general de enriquecimiento magnético de células T y tinción con tetrámeros para el análisis y la clasificación de la citometría de flujo. Los pasos destacados en este protocolo utilizan técnicas comunes y reactivos fácilmente disponibles, lo que lo hace accesible para casi cualquier investigador dedicado a la inmunología de células T de ratón, y son altamente adaptables para una variedad de análisis posteriores de cualquier población de células T específicas de antígeno de baja frecuencia que resida dentro de los pulmones.
Introducción
En el corazón del sistema inmunitario adaptativo se encuentra la capacidad de una célula T para reconocer y responder a un antígeno específico. El momento y el lugar en que una célula T responde a su antígeno afín determina el equilibrio de la infección y la autoinmunidad, la homeostasis y el cáncer, la salud yla enfermedad. De ello se deduce que el estudio de las células T en un contexto específico de inmunidad debe centrarse en las células con especificidad para un antígeno relevante de interés. Entre los avances tecnológicos que han mejorado en gran medida la capacidad de caracterizar las poblaciones de linfocitos T específicos de antígeno se encuentran los multímeros solubles marcados con fluorescencia (generalmente tetrámeros) de moléculas de clase I o clase II del complejo mayor de histocompatibilidad (MHC) complejadas con epítopos de péptidos antigénicos, más conocidos como "tetrámeros péptido:MHC"2,3,4,5 . Al representar los ligandos naturales de los receptores de antígenos de células T (TCR), los tetrámeros de clase I y clase II de péptido:MHC proporcionan un medio para identificar directamente las células T CD8+ y CD4+ específicas del antígeno, respectivamente, dentro del repertorio endógeno de células T en el sistema inmunitario sin necesidad de una respuesta a la estimulación del antígeno en un ensayo. Los tetrámeros representan un enfoque más elegante para el estudio de los linfocitos T específicos de antígeno que los modelos de transferencia adoptivos de linfocitos T transgénicos TCR6, y se han utilizado cada vez más para identificar poblaciones de linfocitos T extraños y autoespecíficos de antígeno tanto en modelos experimentales de ratón como en enfermedades humanas 4,5.
Si bien los tetrámeros pueden identificar fácilmente poblaciones de alta frecuencia de células T que se han expandido en respuesta a la estimulación de antígenos, su uso para células T ingenuas, autoespecíficas de antígeno o de memoria está limitado por las frecuencias muy bajas deestas poblaciones. Nuestro grupo y otros han desarrollado y popularizado estrategias de enriquecimiento magnético basadas en tetrámeros que aumentan la sensibilidad de la detección para permitir estudios de estas poblaciones celulares en tejidos linfoides de ratón 8,9,10,11.
La aparición de células T residentes en tejidos en el campo ha puesto un mayor énfasis en el desarrollo de nuevas formas de investigar las células T en el espacio no linfoide. Al igual que muchas otras superficies mucosas, las células T de los pulmones se encuentran con una serie de antígenos propios y extraños derivados del epitelio del huésped, microbios comensales e infecciosos, y entidades ambientales, incluidos los alérgenos. El análisis transcripcional de las células T recolectadas de tejido no linfoide (NLT) demuestra un fenotipo similar a la memoria que tiene un destino y una función únicos específicos del tejido, a menudo dirigidos al tráfico y la homeostasis tisular12. Además, los linfocitos T de memoria residentes en los tejidos (Trms) tienden a estar más restringidos clonalmente que los que están en circulación13. Determinar cómo y por qué los antígenos impulsan la residencia de las células T en la NLT es fundamental para comprender cómo el sistema inmunitario protege contra las infecciones, mantiene la homeostasis de los tejidos y, a veces, se convierte en autoinmunidad. Sin embargo, parece haber una mayor deserción entre las células T residentes en el tejido de los pulmones en comparación con otras NLT14. En consecuencia, la capacidad de identificar y caracterizar las células T endógenas del pulmón con una especificidad antigénica dada está limitada por su rareza inherente.
Mediante la combinación del uso de técnicas de enriquecimiento celular basadas en perlas magnéticas y la tinción de tetrámero péptido:MHC, hemos logrado detectar células T específicas de antígeno propio expandidas pero raras en pulmones de ratón15,16. Aquí, presentamos una descripción detallada de un protocolo que hemos optimizado para aislar y caracterizar de manera confiable cualquier población de células T específicas de antígeno raro presente en pulmones de ratón (Figura 1). Este protocolo incorpora un paso de tinción de anticuerpos in vivo para distinguir las células T vasculares residentes en el tejido17, seguido de dos métodos diferentes para el procesamiento del tejido pulmonar para adaptarse a la disponibilidad de recursos. A esto le sigue una etapa general de enriquecimiento magnético de células T, tinción con tetrámeros y análisis por citometría de flujo. La viabilidad celular y la tinción de tetrámeros se mejoran aún más en este protocolo mediante la adición de aminoguanidina, que bloquea la apoptosis18 inducida por la activación de las células T mediada por óxido nítrico sintasa (iNOS) y dasatinib, que limita la regulación negativa de TCR19. Los pasos destacados en este protocolo utilizan técnicas comunes y reactivos fácilmente disponibles, lo que lo hace accesible para casi cualquier investigador dedicado a la inmunología de células T de ratón y es altamente adaptable para una variedad de análisis posteriores. Aunque no es probable que las células T vírgenes se encuentren en los pulmones, creemos que este protocolo será particularmente útil para el estudio de las células T específicas de antígeno propio y las Trm en los pulmones.
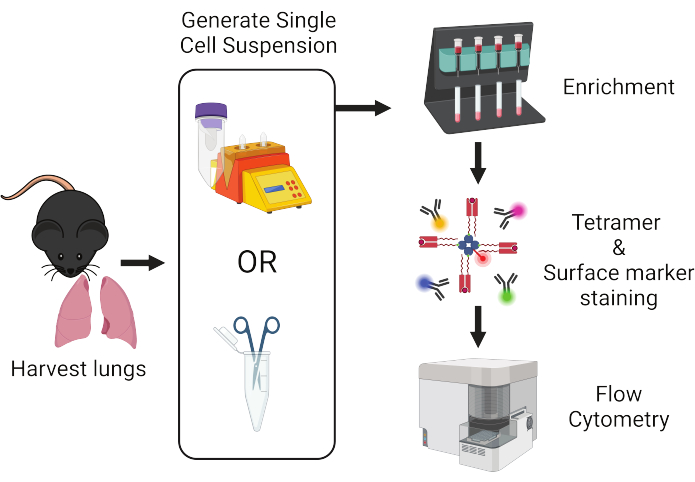
Figura 1: Descripción general del flujo de trabajo del protocolo. Los pulmones se extraen de ratones y se disocian en células individuales. Posteriormente, las muestras se enriquecen para obtener células T antes de teñirlas con tetrámeros péptidos:MHC y anticuerpos marcados con fluorescencia para el análisis por citometría de flujo. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Los procedimientos descritos en este protocolo están aprobados y desarrollados de acuerdo con las pautas establecidas por el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Hospital General de Massachusetts, un programa de manejo animal acreditado por la Asociación Americana para la Acreditación del Cuidado de Animales de Laboratorio (AAALAC). Los experimentos se realizaron en ratones machos y hembras de 8 a 12 semanas de edad con un fondo genético C57BL/6 criados y mantenidos en las instalaciones de animales de MGH en condiciones específicas libres de patógenos.
1. Preparación de soluciones madre
- Prepare el tampón HEPES disolviendo 10 mM de HEPES, 5 mM de KCl, 1,8 mM de CaCl2, 150 mM de NaCl y 1 mM de MgCl2, y ajústelo a pH 7,4.
- Prepare 10 veces la solución madre de Liberase disolviendo 700 μg/mL de medio de termolisina (TM) de Liberase (ver Tabla de Materiales) en la Solución Salina Balanceada de Hank con Ca++ y Mg++ (ver Tabla de Materiales).
- Prepare 10 veces la solución madre de aminoguanidina disolviendo 100 mM de sal de hemisulfato de aminoguanidina (ver Tabla de Materiales) en la Solución Salina Balanceada de Hank con Ca++ y Mg++ (ver Tabla de Materiales).
- Prepare el medio completo de aminoácidos del jamón de águila (EHAA) mezclando el medio EHAA (ver Tabla de materiales) con 10% de suero fetal bovino (FBS), 100 U/mL de penicilina/estreptomicina, 50 μg/mL de gentamicina, 2 mM de L-glutamina y 55 μM de 2-mercaptoetanol.
NOTA: También se pueden utilizar otros medios comunes de células T, como RPMI o DMEM. - Prepare el tampón clasificador mezclando 1x PBS con 2% de FBS y 0,05% de azida de sodio.
- Prepare el bloque Fc diluyendo el anticuerpo anti-ratón CD16/32 purificado (ver Tabla de Materiales) a 1:100 v/v en tampón clasificador.
- Prepare la solución de digestión de Liberase TM/DNasa añadiendo 100 μg/mL de Liberase TM y 50 μg/mL de DNasa I (ver Tabla de Materiales) en medio RPMI 1640 sin L-glutamina (ver Tabla de Materiales).
- Prepare la mezcla de ketamina/xilacina añadiendo 10 mg/mL de ketamina (ver Tabla de Materiales) y 1 mg/mL de xilacina (ver Tabla de Materiales) en solución salina normal (0.9% de NaCl) (ver Tabla de Materiales).
2. Generación de suspensión unicelular a partir de tejido pulmonar a través de un disociador tisular automatizado
- Para cada ratón, prepare 4 mL de tampón HEPES helado en un tubo disociador de tejido especializado (consulte la Tabla de materiales) y manténgalo en hielo.
- Anestesiar ratones mediante inyección intraperitoneal de 150-200 μL de mezcla de ketamina/xilacina. Inyectar 1-3 μg de anticuerpo anti-ratón CD45 conjugado con fluoróforos (ver Tabla de Materiales) diluido en 100 μL de solución salina normal por vía intravenosa en cada ratón anestesiado. Eutanasiar al ratón 3 min después de la administración de anticuerpos con una inyección intraperitoneal de 500-600 μL de mezcla de ketamina/xilacina.
- Resecar los pulmones y colocarlos en su respectivo tubo disociador de tejido enfriado en hielo. Coloque los tubos en el disociador de tejido automatizado (consulte la tabla de materiales) y ejecute el primer programa (programa preestablecido) para el tejido pulmonar.
- Añadir 500 μL de solución madre de Liberase y 500 μL de solución madre de aminoguanidina a cada tubo que contenga el tejido pulmonar disociado. Incubar en una batidora nutante durante 30 min a 37 °C.
- Vuelva a colocar los tubos en el disociador y ejecute el segundo programa (programa preestablecido) para el tejido pulmonar.
- Vierta la suspensión unicelular del tubo disociador de tejidos a través de un filtro celular de 100 μm (consulte la tabla de materiales) en un tubo cónico de 50 ml. Enjuague el tubo disociador de tejidos con 5 mL de EHAA completo (o cualquier medio de células T equivalente) y páselo a través del filtro al tubo de 50 mL.
- Retire el filtro y eleve el volumen de la suspensión celular a 50 mL con EHAA completo. Centrifugar la suspensión celular a 400 x g durante 5 min a 4 °C. Aspire cuidadosamente el sobrenadante, dejando atrás aproximadamente 100 μL de sobrenadante y gránulo de células.
- Agregue aproximadamente 100 μL de solución Fc Block para aumentar el volumen total a 200 μL y haga un vórtice vigoroso para resuspender el pellet.
3. Protocolo alternativo: Generación de suspensión unicelular a partir de tejido pulmonar mediante disociación manual
- Para cada ratón, prepare 1 mL de EHAA completo en un tubo de microfuga de 1,5 mL y manténgalo en hielo.
- Anestesiar ratones mediante inyección intraperitoneal de 150-200 μL de mezcla de ketamina/xilacina. Inyecte 1-3 μg de anticuerpo anti-ratón CD45 conjugado con fluoróforos diluido en 100 μL de solución salina normal por vía intravenosa en cada ratón anestesiado. Eutanasiar al ratón 3 min después de la administración de anticuerpos con una inyección intraperitoneal de 500-600 μL de mezcla de ketamina/xilacina.
- Reseca los pulmones y colócalos en su respectivo tubo de microfuga de 1,5 mL enfriado en hielo.
- Una vez que se hayan extraído todos los pulmones, transfiera cada pulmón a un tubo de microfuga nuevo sin ningún medio celular.
- Corta los pulmones en pequeños fragmentos (~2-3 mm en trozos) con unas tijeras dentro del tubo de microfuga.
- Añadir 1 mL de cóctel de digestión Liberase TM/DNase I a cada tubo.
- Incubar durante 30 min a 37 °C en un baño de agua. Vuelva a colocar las muestras en hielo después para evitar la digestión excesiva.
- Vierta la muestra sobre un filtro de células de 100 μm colocado encima de un tubo cónico de 50 mL. Machaca el pañuelo contra la malla con el extremo de goma del émbolo de una jeringa estéril de 1 ml.
- Enjuague el colador con tampón clasificador en frío, recogiendo un volumen final de 7 mL en el tubo. Centrifugar la suspensión celular a 400 x g durante 5 min a 4 °C. Aspire cuidadosamente el sobrenadante, dejando aproximadamente 100 μL de sobrenadante y gránulo de células.
- Agregue 100 μL de solución Fc Block para aumentar el volumen total a 200 μL y haga un vórtice vigoroso para resuspender el pellet.
4. Enriquecimiento de la muestra pulmonar para células T mediante enriquecimiento magnético de perlas
- Añadir 50 μL de microperlas anti-ratón CD90.2 (ver Tabla de Materiales). Agitar e incubar durante 10 min a 4 °C.
NOTA: CD90.2 corresponde al alelo expresado por las células T en ratones C57BL/6. Compruebe el genotipo del alelo si se utilizan otras cepas de ratones. - Mientras tanto, coloque una columna de separación de celdas paramagnéticas (ver Tabla de Materiales) en un imán de separación de celdas de una o cuatro posiciones (ver Tabla de Materiales). Coloque un tubo cónico abierto de 15 ml debajo de cada columna para capturar el flujo a través de él. Prepare la columna con 3 mL de tampón clasificador en frío, permitiendo que la columna drene por gravedad hacia el tubo cónico que se encuentra debajo.
- Una vez que las células hayan incubado con las microperlas durante 10 minutos, agregue tampón clasificador en frío a un volumen de 1 ml y transfiéralo a través de un colador de células de 100 μm colocado encima de la columna. Recoja el flujo de la columna a través de un tubo cónico nuevo de 15 mL colocado debajo de la columna.
- Una vez que la suspensión de la celda se haya drenado completamente a través de la columna por gravedad, lave la columna enjuagando el tubo original con 3 mL adicionales de tampón clasificador en frío y aplicándolo a la columna a través de la malla, enjuagando así el colador. Retira el colador.
- Cuando la muestra se haya drenado completamente en la columna y no salga más de la columna, retire la columna del imán y colóquela encima de un tubo cónico nuevo de 15 mL.
- Añada 5 ml de tampón de clasificador en frío a la columna.
- Eluya inmediatamente las celdas unidas a la columna empujando el émbolo de la columna hacia la parte superior en un movimiento continuo y forzando el tampón clasificador fuera de la parte inferior de la columna hacia el nuevo tubo.
- Centrifugar las muestras eluidas a 400 x g durante 5 min a 4 °C. Aspire cuidadosamente el sobrenadante, dejando atrás aproximadamente 100 μL de sobrenadante y gránulo de células.
- Añada 100 μL de tampón clasificador en frío para elevar el volumen total a 200 μL y haga un vórtice vigoroso para resuspender el pellet.
- Analice la muestra de flujo que contiene la fracción de células no unidas, si lo desea.
5. Tinción de las células T específicas de antígeno con tetrámeros peptídicos:MHC
- Agregue 1 μL de 10 μM de Dasatinib (ver Tabla de Materiales) a cada muestra, vórtice e incube durante 5 min en RT.
- Añada un péptido:tetrámero MHC conjugado con PE o APC a una concentración final de 10 nM (o una concentración empíricamente optimizada para un tetrámero dado).
- Vórtice e incube en la oscuridad durante 1 h a RT (o tiempo y temperatura optimizados empíricamente).
6. Análisis de los linfocitos T marcados con tetrámeros mediante citometría de flujo
- Mientras la muestra se tiñe con tetrámeros peptídicos:MHC, prepare una mezcla maestra de anticuerpos para teñir los marcadores de superficie de las células (Tabla 1).
NOTA: Evite los fluoróforos que entren en conflicto con el anticuerpo CD45 administrado por vía intravenosa o los tetrámeros. - Con 15 minutos restantes en el período de incubación para la tinción de tetrámeros, agregue la mezcla maestra de anticuerpos de superficie a 1:100 (o concentración empíricamente optimizada) a cada muestra.
- Continúe incubando en la oscuridad en RT durante el resto del período de incubación de 1 h.
- Agregue 50,000 perlas de conteo de citometría de flujo (consulte la Tabla de materiales) y agregue tampón clasificador en frío a un volumen final de aproximadamente 5 mL. Centrifugar la muestra teñida a 400 x g durante 5 min a 4 °C. Aspire cuidadosamente el sobrenadante, dejando atrás aproximadamente 100 μL de sobrenadante y gránulos de células/perlas.
- Vuelva a suspender la muestra con 200 μL adicionales de tampón clasificador y transfiera la muestra a un tubo de clasificación de células activadas por fluorescencia (FACS) de 5 mL.
- Analice la muestra en un citómetro de flujo. Recoge tantas celdas como sea posible, hasta un máximo de 2.500.000 eventos en total. Asegúrese de que se hayan recopilado al menos 20.000 eventos de cuentas de recuento. Mantenga la tasa de adquisición en o por debajo de 5.000 eventos por segundo.
- Guarde todos los datos como archivos FCS.
| Fluorocromo | Anticuerpo |
| BUV395 | CD90.2 |
| Azul Pacífico | CD45 (añadido anteriormente por inyección intravenosa) |
| Naranja del Pacífico | CD8 |
| Violeta Brillante 785 | CD4 |
| FITC | CD3 |
| PerCP-Cy5.5 | Volcado (B220, CD11b, CD11c, F4/80) |
| PEI | tetrámero pMHC o marcador fenotípico |
| PE-Cy7 | Marcador fenotípico (por ejemplo, CD44, PD-1, CD69, etc.) |
| APC | tetrámero pMHC o marcador fenotípico |
| AlexaFluor 700 | Marcador fenotípico (por ejemplo, CD44, PD-1, CD69, etc.) |
| APC-Cy7 | Mancha de vivo/muerto |
Tabla 1: Matriz de tinción de la muestra. Panel típico de anticuerpos de citometría de flujo conjugados con fluoróforos que se utiliza para identificar y caracterizar células T específicas de antígeno.
7. Análisis de datos
- Analice los archivos de datos FCS utilizando el software de citometría de flujo adecuado.
- Establezca una secuencia de puertas de inclusión sucesivas para identificar 1) eventos similares a linfocitos, 2) únicos, 3) vivos, 4) extravasculares, 5) negativos para volcado y 6) eventos positivos para CD90.2 que sean CD4 o CD8 positivos (Figura 2).
- Identificar los linfocitos T tetrámeros positivos dentro de estas poblaciones.
- Determine los recuentos absolutos de células tetrámeras positivas calculando la relación de perlas añadidas (50.000) con el número de perlas recogidas durante la toma de muestras y multiplicando el valor por el número total de células tetrámeras positivas recogidas.
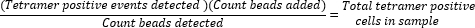
Access restricted. Please log in or start a trial to view this content.
Resultados
La Figura 2 muestra la estrategia representativa de compuerta utilizada en la identificación de células T CD4+ específicas de antígeno raro en los pulmones con tetrámeros de clase II de péptido:MHC. El mismo proceso se puede aplicar para los linfocitos T CD8+ específicos de antígeno con tetrámeros de clase I péptido:MHC (datos no mostrados).
Debido al elevado número de células no linfoides en los pulmones, la detección fiable de ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Las caracterizaciones previas de las células T específicas de antígeno de los pulmones se han beneficiado de la gran cantidad de células T específicas de antígeno que se expanden después de un evento de cebado agudo, como la inmunización intranasal o la infección 20,21,22. Sin embargo, las poblaciones de linfocitos T más raras en los pulmones, como los linfocitos T específicos de antígeno propio o los linfocitos T de...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos que revelar.
Agradecimientos
Agradecemos a L. Kuhn por su asistencia técnica en el procesamiento de tejidos y la producción de tetrámeros. Este trabajo fue financiado por los Institutos Nacionales de Salud (R01 AI107020 y P01 AI165072 a J.J.M., T32 AI007512 a D.S.S.), el Consorcio de Massachusetts sobre Preparación para Patógenos (J.J.M.) y el Comité Ejecutivo de Investigación del Hospital General de Massachusetts (J.J.M.).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 mm cell strainer | Fisher Scientific | 22-363-549 | |
| 10x PBS without Ca++ or Mg++ | Corning | 46-013-CM | |
| 1x PBS without Ca++ or Mg++ | Corning | 21-031-CV | |
| AccuCheck Counting Beads | Invitrogen | PCB100 | |
| Aminoguanidine Hemisulfate Salt | Sigma-Aldrich | A7009 | |
| CD90.2 microbeads, mouse | Miltenyi | 130-121-278 | |
| Cell separation magnet (MidiMACS Separator) | Miltenyi | 130-042-302 | Holds single LS column |
| Cell separation magnet (QuadroMACS Separator) | Miltenyi | 130-090-976 | Holds 4 LS columns |
| Dasatinib | Sigma-Aldrich | CDS023389 | |
| DNase I | Roche | 10104159001 | |
| Eagle’s Ham’s Amino Acids medium | Sigma-Aldrich | C5572 | |
| gentleMACS | Miltenyi | 130-093-235 | Automated tissue dissociator |
| gentleMACS C Tubes | Miltenyi | 130-093-237 | Automated tissue dissociator tubes |
| Hank's Balanced Salt Solution with Ca++ or Mg++ | Corning | 21-020-CM | |
| HEPES | Gibco | 15630080 | |
| Ketamine | Vedco | NDC 50989-996-06 | |
| Liberase TM | Roche | 5401119001 | |
| Pacific Blue anti-mouse CD45 antibody (Clone: 30-F11) | Biolegend | 103126 | |
| Paramagnetic cell separation columns (LS Columns) | Miltenyi | 130-042-401 | Comes with plunger |
| Purified anti mouse CD16/32 antibody (Clone: 93) | Biolegend | 101302 | |
| RPMI 1640 medium without L-glutamine | Corning | 15-040-CM | |
| Sodium Chloride 0.9% (Normal Saline) | Cytiva | Z1376 | |
| Xylazine | Pivetal | NDC 466066-750-02 |
Referencias
- Sun, L., Su, Y., Jiao, A., Wang, X., Zhang, B. T cells in health and disease. Signal Transduct Target Ther. 8 (1), 235(2023).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Crawford, F., Kozono, H., White, J., Marrack, P., Kappler, J. Detection of antigen-specific T cells with multivalent soluble class II MHC covalent peptide complexes. Immunity. 8 (6), 675-682 (1998).
- Nepom, G. T., et al. HLA class II tetramers: tools for direct analysis of antigen-specific CD4+ T cells. Arthritis Rheum. 46 (1), 5-12 (2002).
- Davis, M. M., Altman, J. D., Newell, E. W. Interrogating the repertoire: broadening the scope of peptide-MHC multimer analysis. Nat Rev Immunol. 11 (8), 551-558 (2011).
- Moon, J. J., et al. Tracking epitope-specific T cells. Nat Protoc. 4 (4), 565-581 (2009).
- Jenkins, M. K., Moon, J. J. The role of naive T cell precursor frequency and recruitment in dictating immune response magnitude. J Immunol. 188 (9), 4135-4140 (2012).
- Moon, J. J., et al. Naive CD4(+) T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Obar, J. J., Khanna, K. M., Lefrancois, L. Endogenous naive CD8+ T cell precursor frequency regulates primary and memory responses to infection. Immunity. 28 (6), 859-869 (2008).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. J Immunol. 181 (3), 2124-2133 (2008).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J Vis Exp. (68), e4420(2012).
- Szabo, P. A., Miron, M., Farber, D. L. Location, location, location: Tissue resident memory T cells in mice and humans. Sci Immunol. 4 (34), 9673(2019).
- Poon, M. M. L., et al. Tissue adaptation and clonal segregation of human memory T cells in barrier sites. Nat Immunol. 24 (2), 309-319 (2023).
- Zheng, M. Z. M., Wakim, L. M. Tissue resident memory T cells in the respiratory tract. Mucosal Immunol. 15 (3), 379-388 (2022).
- Legoux, F. P., et al. CD4+ T cell tolerance to tissue-restricted self antigens is mediated by antigen-specific regulatory T Cells rather than deletion. Immunity. 43 (5), 896-908 (2015).
- Shin, D. S., et al. Lung injury induces a polarized immune response by self-antigen-specific CD4(+) Foxp3(+) regulatory T cells. Cell Rep. 42 (8), 112839(2023).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nat Protoc. 9 (1), 209-222 (2014).
- Vig, M., et al. Inducible nitric oxide synthase in T cells regulates T cell death and immune memory. J Clin Invest. 113 (12), 1734-1742 (2004).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. J Immunol Methods. 340 (1), 11-24 (2009).
- Hogan, R. J., et al. Protection from respiratory virus infections can be mediated by antigen-specific CD4(+) T cells that persist in the lungs. J Exp Med. 193 (8), 981-986 (2001).
- Hogan, R. J., et al. Activated antigen-specific CD8+ T cells persist in the lungs following recovery from respiratory virus infections. J Immunol. 166 (3), 1813-1822 (2001).
- Zhao, J., et al. Airway memory CD4(+) T cells mediate protective immunity against emerging respiratory coronaviruses. Immunity. 44 (6), 1379-1391 (2016).
- Hondowicz, B. D., et al. Interleukin-2-dependent allergen-specific tissue-resident memory cells drive asthma. Immunity. 44 (1), 155-166 (2016).
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. J Vis Exp. (29), e1266(2009).
- Faustino, L. D., et al. Interleukin-33 activates regulatory T cells to suppress innate gammadelta T cell responses in the lung. Nat Immunol. 21 (11), 1371-1383 (2020).
- Atif, S. M., Gibbings, S. L., Jakubzick, C. V. Isolation and identification of interstitial macrophages from the lungs using different digestion enzymes and staining strategies. Methods Mol Biol. 1784, 69-76 (2018).
- Pape, K. A., Taylor, J. J., Maul, R. W., Gearhart, P. J., Jenkins, M. K. Different B cell populations mediate early and late memory during an endogenous immune response. Science. 331 (6021), 1203-1207 (2011).
- Naeher, D., et al. A constant affinity threshold for T cell tolerance. J Exp Med. 204 (11), 2553-2559 (2007).
- Moon, J. J., et al. Quantitative impact of thymic selection on Foxp3+ and Foxp3- subsets of self-peptide/MHC class II-specific CD4+ T cells. Proc Natl Acad Sci U S A. 108 (35), 14602-14607 (2011).
- Koehli, S., Naeher, D., Galati-Fournier, V., Zehn, D., Palmer, E. Optimal T-cell receptor affinity for inducing autoimmunity. Proc Natl Acad Sci U S A. 111 (48), 17248-17253 (2014).
- Zhang, Z., Legoux, F. P., Vaughan, S. W., Moon, J. J. Opposing peripheral fates of tissue-restricted self antigen-specific conventional and regulatory CD4(+) T cells. Eur J Immunol. 50 (1), 63-72 (2020).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados