Method Article
Monitorización de la actividad de repeticiones ricas en leucina que contiene 8 canales (LRRC8/VRAC) mediante transferencia de energía de resonancia de Förster de emisión sensibilizada (SE-FRET)
En este artículo
Resumen
La electrofisiología es el estándar de oro para investigar la actividad de los canales iónicos. Sin embargo, hay muchos enfoques alternativos, incluidos los métodos ópticos. Aquí, describimos un método para monitorear la actividad de la repetición rica en leucina que contiene canales aniónicos formados por 8 canales (LRRC8) utilizando un método basado en la transferencia de energía de resonancia de Förster (FRET) entre subunidades.
Resumen
Los miembros de la familia de proteínas LRRC8 forman canales heteroméricos de iones y osmolitos con funciones en numerosos procesos fisiológicos. Como canales aniónicos regulados por volumen (VRAC)/canales rectificadores externos sensibles al volumen (VSOR), se activan ante la hinchazón de las células osmóticas y median la extrusión de cloruro y osmolitos orgánicos, lo que provoca la salida de agua y, por lo tanto, la contracción de las células. Más allá de su papel en la regulación del volumen osmótico, los VRAC se han implicado en procesos celulares como la diferenciación, la migración y la apoptosis. A través de su efecto sobre el potencial de membrana y su transporte de varias moléculas de señalización, los canales de repetición ricos en leucina que contienen 8 (LRRC8) desempeñan funciones en la comunicación neurona-glía, la secreción de insulina y la respuesta inmunitaria. El mecanismo de activación ha permanecido esquivo. Los canales LRRC8, al igual que otros canales iónicos, se estudian normalmente mediante métodos electrofisiológicos. Aquí, describimos un método para detectar la activación del canal LRRC8 midiendo la transferencia de energía de resonancia de Förster de emisión sensibilizada intracompleja (SE-FRET) entre proteínas fluorescentes fusionadas con los dominios repetidos ricos en leucina C-terminal de las subunidades LRRC8. Este método ofrece la posibilidad de estudiar la activación de canales in situ sin intercambio del entorno citosólico y durante procesos como la diferenciación celular y la apoptosis.
Introducción
Los canales iónicos compuestos por heterómeros de proteínas de la familia 8 (LRRC8) se encuentran en todas las células de los vertebrados, participando en una amplia gama de funciones fisiológicas 1,2. Estos canales LRRC8, identificados por primera vez como canales aniónicos regulados por volumen (VRAC) o canales rectificadores externos sensibles al volumen (VSOR), desempeñan un papel crucial en la disminución del volumen regulatorio celular 3,4. Facilitan la expulsión de iones de cloruro y osmolitos orgánicos, a lo que sigue el flujo de agua en respuesta a la hinchazón osmótica. Más allá de su papel en la respuesta al estrés osmótico, su papel en la regulación del volumen celular se ha relacionado con la proliferación y migración celular, la apoptosis, la espermiogénesis y la integridad epitelial 5,6,7. Se ha demostrado que la alteración del potencial de membrana tras la activación de LRRC8/VRAC contribuye a la diferenciación de los miotubos8 y a la secreción de insulina por las células β pancreáticas 9,10,11. Además, los canales LRRC8 conducen una variedad de osmolitos orgánicos como las moléculas de señalización purinérgicas ATP y cGAMP o el aminoácido excitador glutamato, colocando estos canales en la comunicación célula-célula en el sistema inmune o en la interacción glía-neurona 12,13,14,15,16,17,18,19,20,21,22. Incluso los xenobióticos, como el colorante fluoresceína, el antibiótico blasticidina S o el fármaco anticancerígeno cisplatino, son conducidos por los canales LRRC8 23,24,25.
Existen numerosos informes sobre la transducción de señales que conduce a la activación de LRRC8/VRAC 26,27,28. Sin embargo, el mecanismo sigue sin estar claro, y la literatura presenta una amplia gama de mecanismos potenciales que podrían depender del proceso fisiológico específico. Estos incluyen cambios en la fuerza de los iones citosólicos, la interacción con el citoesqueleto, la composición de la membrana, las proteínas G, el estado redox y las cascadas de fosforilación 2,27,29,30,31.
Los canales LRRC8/VRAC contienen LRRC8A como una subunidad esencial 3,4 que debe heteromerizarse con al menos uno de sus parálogos LRRC8B-E para formar canales fisiológicamente funcionales 4,14,32. La composición de la subunidad determina las propiedades biofísicas del canal, como la rectificación y la inactivación dependiente de la despolarización 4,29,32,33,34, la especificidad del sustrato 15,17,20,21,24,35 y algunas vías de activación 36,37. Las estructuras de criomicroscopía electrónica (crio-EM) muestran que los homómeros de LRRC8A, así como los heterómeros, se ensamblan como hexámeros38,39,40, mientras que las quimeras de LRRC8A/LRRC8C que forman canales funcionales son heptámeros41. La parte N-terminal de todas las proteínas LRRC8 comprende cuatro hélices transmembrana, y la parte C-terminal contiene un dominio con repeticiones ricas en leucina (LRRD). Las estructuras complejas LRRC8 disponibles proporcionan evidencia de que los LRRDs, que se extienden hacia el citosol 3,4,23, pueden sufrir reordenamientos conformacionales durante la compuerta del canal 34,42,43. Esta noción se ve corroborada por el hallazgo de que la fusión C-terminal de proteínas fluorescentes da lugar a la actividad del canal basal14 y que la unión de los nanocuerpos a los dominios puede modular la actividad del canal44. Además, las alteraciones conformacionales de los terminales C se mostraron mediante la transferencia de energía de resonancia de Förster intracompleja (FRET)45.
El método más común para estudiar la actividad de los canales iónicos son las mediciones electrofisiológicas46, que se aplicaron ampliamente en la investigación de los VRAC antes de su identificación molecular47. Sin embargo, existen varias formas adicionales de monitorear la actividad de VRAC indirectamente, incluida la medición de sus sustratos conducidos -iones de haluro u osmolitos orgánicos- o su efecto sobre el volumen celular48. De hecho, la identificación de las proteínas LRRC8 como VRAC se basó en un ensayo basado en el enfriamiento de una proteína fluorescente sensible a haluros49 mediante la entrada de yoduro en la célula a través de VRACs activados 3,4. Otro método para monitorear la actividad del canal LRRC8/VRAC hace uso del movimiento de los dominios citosólicos que se puede observar, como en otros canales iónicos 50,51,52,53, por cambios en FRET45. Con este fin, las proteínas fluorescentes que sirven como pares FRET, como la proteína cian-fluorescente (CFP)/mCerulean3 como donante y la proteína amarillo-fluorescente (YFP)/mVenus como aceptor, se fusionaron con el C-terminal de las proteínas LRRC8 (Figura 1). La FRET intracompleja entre las subunidades de LRRC8 se demostró mediante experimentos de fotoblanqueo de aceptores45. Evitando el método de fotoblanqueo destructivo, los cambios de FRET a lo largo del tiempo se monitorearon mediante FRET de emisión sensibilizada (SE-FRET), donde básicamente se mide la emisión sensibilizada del aceptor al excitar el donante debido a la superposición del espectro de emisión del donante con el espectro de excitación del aceptor. La aplicación de hipotonicidad extracelular, un estímulo para la activación de LRRC8/VRAC, resultó en una reducción reversible en la intensidad de SE-FRET45. Es importante destacar que las mediciones simultáneas de patch-clamp de células enteras y la monitorización de FRET durante el tratamiento hipotónico mostraron que esta reducción de FRET reflejaba la activación de LRRC8/VRAC45. Este método, que evita la alteración de la membrana plasmática o la alteración del entorno intracelular mediante una solución de pipeta, ofrece una alternativa para monitorizar la actividad de LRRC8/VRAC. Es particularmente útil en entornos fisiológicos donde el mantenimiento del citosol nativo es crucial, es necesaria la resolución subcelular o se requiere una observación prolongada de la actividad del canal.
Aquí, presentamos un protocolo para estudiar LRRC8 / VRAC con una lectura basada en FRET. El protocolo describe cómo manipular y transfectar células, adquirir imágenes de muestra y control, analizar los datos y calcular los valores de FRET (SE-TRAST) de emisión sensibilizada.
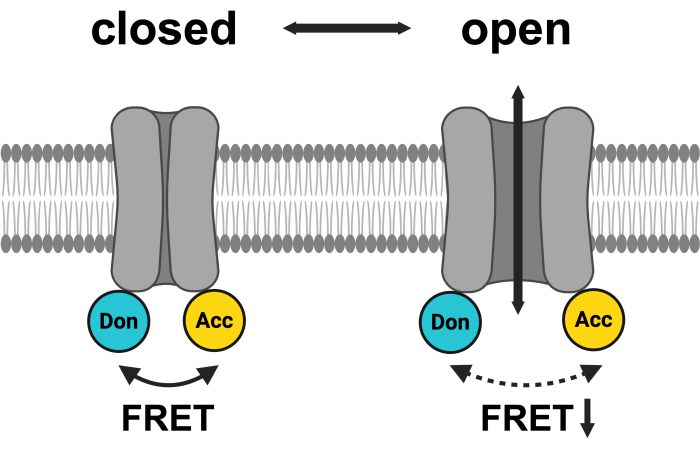
Figura 1: Esquema del sistema de pares FRET LRRC8. mCerulean3 se muestra en cian y mVenus se muestra en amarillo. Después de la apertura del VRAC, la distancia (y/o la orientación espacial) entre los fluoróforos cambia, lo que resulta en una menor transferencia de energía entre el donante (Don) y el aceptor (Acc) y, a su vez, reduce el FRET observado. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Preparación de tampón y reactivos
- Prepare tampones de medio e isotónicos, hipotónicos e hipertónicos y mida la osmolaridad de los tampones con un osmómetro para asegurarse de que la osmolaridad (Osm) esté en el rango esperado con solo una desviación aceptable.
- Medios de cultivo celular: Prepare el medio Eagle modificado de Dulbecco (DMEM) suplementado con un 10% de suero fetal bovino (FBS) y un 1% de penicilina/estreptomicina
- Tampón de imagen isotónica (~340 mOsm): Prepare el tampón de imagen isotónica mezclando 150 mM de NaCl, 6 mM de KCl, 1 mM de MgCl2, 1,5 mM de CaCl2, 10 mM de D(+)-glucosa y 10 mM de ácido 4-(2-hidroxietil)-1-piperazina etano sulfónico (HEPES).
- Tampón de imagen hipotónica (~250 mOsm): Prepare el tampón de imagen hipotónica mezclando 105 mM de NaCl, 6 mM de KCl, 1 mM de MgCl2, 1,5 mM de CaCl2, 10 mM de D(+)-glucosa y 10 mM de HEPES.
- Tampón de imagen hipertónica (~500 mOsm): Prepare el tampón de imagen hipertónica mezclando 160 mM de D(-)-manitol, 150 mM de NaCl, 6 mM de KCl, 1 mM de MgCl2, 1,5 mM de CaCl2, 10 mM de D(+)-glucosa y 10 mM de HEPES.
NOTA: Los tampones pueden complementarse con fármacos específicos dependiendo de lo que se investigue.
2. Crecimiento de células adherentes en platos con fondo de vidrio
- Prepare al menos una placa para la transfección solo con la proteína de interés (POI) fusionada con el fluoróforo donante o aceptor y al menos una placa para la transfección con el par donante y aceptor (Tabla 1 y Figura 2). Utilice placas con fondo de vidrio para permitir la microscopía de fluorescencia. Dependiendo del tipo de célula, trate previamente la superficie con una limpieza especial o recubriéndola con polilisina.
NOTA: En este caso, el donante FRET mCerulean3 (mCer)54 y el aceptor FRET mVenus (mVen)55 se utilizan como par FRET, pero también se aplican otras combinaciones de fluoróforos. La muestra que expresa el POI fusionado con el donante o solo con el aceptor se utiliza para determinar los factores de corrección β y γ (Tabla 1) necesarios para corregir el sangrado del donante en el canal aceptor y la excitación cruzada del aceptor por la longitud de onda de excitación del donante (Figura 2Ac, Bf). - El día antes de la transfección, siembre 1 x 105 células HeLa en 2 mL de medio de cultivo celular en placas de 35 mm con un fondo de vidrio adecuado para microscopía de fluorescencia. Cultivo de células durante la noche a 37 °C y 5% de CO2 en una atmósfera en una incubadora de cultivos celulares.
NOTA: Los volúmenes de reactivos se pueden adaptar a la superficie de otras placas/matraces de cultivo celular con un tamaño diferente. El número de células se puede adaptar a una densidad adecuada para diferentes líneas celulares y enfoques experimentales.- Aspirar el sobrenadante de cultivo celular de la monocapa de células adherentes cultivadas en matraces de cultivo celular T75 utilizando una bomba de vacío.
- Lave las células añadiendo 10 ml de solución salina tamponada con fosfato (DPBS) de Dulbecco al matraz de cultivo celular y aspirando la solución después con una bomba de vacío.
- Cubrir completamente las células con 1 ml de tripsina-EDTA al 0,05% e incubar las células durante 2 min a 37 °C y 5% de CO2 en una incubadora de cultivos celulares.
- Añada 9 mL de medio de cultivo celular y suspenda las células mediante pipeteo.
- Transfiera la suspensión celular a un tubo de 15 mL y centrifugue a 700 x g durante 3 min a temperatura ambiente (RT).
- Aspire el sobrenadante con una bomba de vacío y vuelva a suspender el pellet celular en 10 mL de medio de cultivo celular.
- Mezcle volúmenes iguales de suspensión celular y azul de tripano al 0,4% en un tubo y agregue 10 μL a un portaobjetos de conteo. Coloque el portaobjetos en el contador de células automatizado y comience a contar utilizando el programa adecuado para el recuento de células.
- Para calcular el volumen de suspensión celular necesario para cada plato, divida el número de celdas necesario por plato (1 x 105) por el número de celdas por mililitro obtenido del contador de celdas.
- Prepare una suspensión celular en un tubo adecuado que contenga el número de células necesarias por placa en el volumen necesario por placa (2 mL) más la cantidad adicional para una placa.
- Mezcle la suspensión celular al menos 20 veces invirtiendo el tubo y pipetee 2 mL de la suspensión celular en cada plato.
- Para asegurar una distribución celular más uniforme, deje los platos durante 30 minutos en RT antes de colocarlos en la incubadora de cultivos celulares.
3. Transfección celular
NOTA: Aquí, FuGENE se utilizó como reactivo de transfección. También son aplicables otros reactivos y métodos de transfección. Es necesario evaluar empíricamente las proporciones óptimas de ADN plasmídico (ADNp) y los reactivos de transfección y el tiempo para la expresión óptima de cada POI y modelo celular. En este caso, se utilizaron 2 μg de ADNp total por plato de 35 mm. Se utilizaron construcciones de donante y aceptor FRET en una proporción de 1:1, y la relación ADNp a reactivo de transfección fue de 1:4 (Tabla 1).
- Antes de la transfección, sustituya el sobrenadante del cultivo celular por 2 mL nuevos de medios precalentados.
- Diluir el ADNp en un medio esencial Opti-Minimal (MEM) con un volumen final de 100 μL (=solución de ADNp).
- Diluir el reactivo de transfección en Opti-MEM con un volumen final de 100 μL (=solución de reactivo).
NOTA: Para una transfección más uniforme, prepare una mezcla maestra para la solución de ADNp y reactivo. - Mezcle bien el ADNp y la solución reactiva.
- Agregue la solución de ADNp a la solución reactiva (=solución de transfección).
- Mezcle bien la solución de transfección.
- Incubar la solución de transfección durante 15 min en RT.
- Agregue la solución de transfección gota a gota en espiral al plato.
- Mezcle moviendo el plato 5 veces horizontal y verticalmente sobre la superficie del banco.
- Cultivo de células durante la noche a 37 °C y 5% de CO2 en una atmósfera en una incubadora de cultivos celulares.
| Condición | Constructo (s) | Muestra | Se utiliza para |
| 1 | LRRC8A-mCerúleo | Solo construcción donante | Determinar el factor de corrección β |
| 2 | LRRC8E-mVenus | Solo construcción de aceptante | Determinar el factor de corrección γ |
| 3 | LRRC8A-mCerúleo y LRRC8E-mVenus | Par de FRET | Cuantificación SE-FRET |
Tabla 1: Ejemplo de las condiciones necesarias para que un experimento SE-FRET típico mida la actividad de LRRC8/VRAC de un canal compuesto por la subunidad LRRC8A fusionada con el fluoróforo donante (mCerulean3) y LRRC8E fusionada con el fluoróforo aceptor (mVenus).
4. Adquisición de imágenes para la determinación del factor de corrección
NOTA: Hay un sangrado de la emisión del donante en la emisión detectada del aceptor durante el FRET. Además, hay excitación cruzada del fluoróforo aceptor por la longitud de onda de excitación del donante. Estos procesos deben ser compensados durante el cálculo del SE-FRET. Para ello, se determinan factores de corrección en células que expresan únicamente el FRET donante o aceptor 24 h después de la transfección. Aquí, las imágenes se llevaron a cabo en un Leica THUNDER Imager equipado con una lámpara Leica LED8, el CYR71010 de cubo de filtro, un objetivo HC PL APO 63x/1.40 OIL, un filtro de paso largo para 460/80 y 553/70 y una cámara Leica DFC9000GTC. Los experimentos se realizaron sin control ambiental, pero en presencia de HEPES en los tampones de imagen para estabilizar el pH. Para observaciones/mediciones a largo plazo, se recomienda utilizar un sistema de control ambiental. Para el análisis, SE-FRET se calcula a partir de las imágenes sin procesar capturadas. Esto se puede hacer simultáneamente durante la adquisición o después. En este caso, se utilizó el software Leica LAS X con el complemento SE-FRET para simplificar el procedimiento experimental relacionado con el cálculo de los factores de corrección y la visualización de los cambios en el valor de SE-FRET en tiempo real durante la adquisición de imágenes. Para la posterior adquisición, los factores de corrección y SE-FRET se pueden determinar con otros paquetes de software (por ejemplo, FIJI) después de la adquisición de datos brutos de acuerdo con el protocolo que se proporciona a continuación.
- Antes de la adquisición de imágenes de células individuales transfectadas para calcular los factores de corrección, utilice una muestra que exprese el par FRET para configurar la configuración de microscopía para todos los canales (excitación del donante/emisión del donante DD, DA del donante/aceptor y AA del aceptor/aceptor; ver Tabla 1 y Figura 2C y Figura 3A).
NOTA: Para las mediciones de SE-FRET con subunidades VRAC marcadas con mCerulean3 y mVenus transfectadas como se describe anteriormente, se utilizaron los siguientes parámetros: agrupamiento de píxeles de 8x8, tiempo de exposición de 100 ms e intensidad de la lámpara LED del 10%. - Tome la muestra que expresa solo la construcción del donante (Figura 2A), aspire el medio de cultivo celular y lave las células tres veces con 2 mL de tampón isotónico.
- Añadir 3 mL de tampón isotónico y colocar la muestra en la platina del microscopio.
- Encuentre un campo de visión (FOV, por sus siglas en inglés) con al menos una celda que exprese la construcción del donante.
- Tome una imagen de todos los canales (DD, DA y AA, consulte la Tabla 2 y la Figura 2A).
- Dibuje una región de interés (ROI) alrededor de la célula o células y mida la intensidad media de DA (= IDA; Figura 2Ac) y DD (= IDD; Figura 2Aa).
- Para la resta de fondo, dibuje un ROI en los canales DA y DD donde solo se encuentra la señal de fondo y mida la intensidad media (IBDA y IBDD).
- Reste la intensidad media del ROI de fondo de la intensidad media medida en el ROI de la celda del canal correspondiente (
 y
y 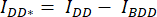 ).
). - Repita los pasos 4.2 a 4.5 con la muestra expresando solo la construcción del aceptor (Figura 2B).
- Dibuje un ROI alrededor de la(s) celda(s) y mida la intensidad media de DA (= IDA; Figura 2Bf) y AA (= IAA; Figura 2Be).
- Para la resta de fondo, dibuje un ROI en los canales DA y AA donde solo se encuentra la señal de fondo y mida las intensidades medias (IBDA e IBAA).
- Reste la intensidad media del ROI de fondo de la intensidad media medida en el ROI de la celda del canal correspondiente (
 y
y 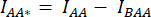 ).
). - Utilice los valores determinados para IDA*, IDD* e IAA* para calcular los factores
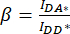 de corrección y
de corrección y 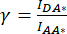 ,
,
Por lo tanto, el factor de corrección β se utiliza para compensar el sangrado de la emisión del donante en el canal DA. El factor de corrección γ se utiliza para compensar la excitación cruzada del fluoróforo aceptor por la longitud de onda de excitación del donante en el canal DA.
| Excitación de | Emisión de | Nombre del canal | Línea LED | Cubo de filtro | Filtro de paso largo |
| Donante | Donante | DD | 440 nm | CYR71010 | 460/80 nm |
| Donante | Aceptador | DA | 440 nm | CYR71010 | 535/70 nm |
| Aceptador | Aceptador | AA | 510 nm | CYR71010 | 535/70 nm |
Tabla 2: Resumen de los canales necesarios para los experimentos SE-FRET.
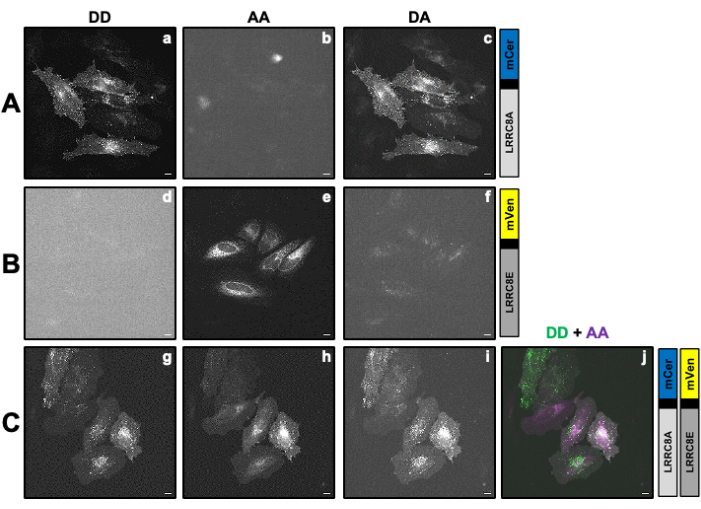
Figura 2: Imágenes representativas de fluorescencia de las muestras utilizadas para calcular los factores de corrección β y γ necesarios para determinar la actividad VRAC de un canal compuesto por la subunidad LRRC8A fusionada con el donante mCerulean3 (mCer) y la subunidad LRRC8E fusionada con el fluoróforo aceptor mVenus (mVen) mediante mediciones SE-FRET. (A,B) Detección del canal DD donante/donante, AA aceptor/aceptor y DA donante/aceptor en células HeLa que solo expresan el donante (A) LRRC8A-mCer o el aceptor (B) LRRC8E-mVen. (C) Detección de canales DD, AA y DA en células HeLa co-transfectadas con el par donante y aceptor LRRC8A-mCer y LRRC8E-mVen. Los paneles a-i muestran imágenes tomadas en el canal de detección del donante (excitación del donante y detección de la señal del donante; DD; a, d y g), el canal de detección del aceptor (excitación del aceptor y detección de la señal del aceptor; AA; b, e y h ) y el canal de detección de señales FRET (excitación del donante y detección de la señal aceptora; DA; c, f e i). El panel j es la superposición de los paneles g y h. El canal DD se muestra en verde y el canal AA en magenta. Barra de escala = 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
5. Imágenes de lapso de tiempo para la cuantificación SE-FRET
- Tomar la muestra que expresa la construcción del donante y del aceptor (Tabla 1, Figura 2C y Figura 3A), aspirar los medios de cultivo celular y lavar las células tres veces con 2 mL de tampón isotónico 24 h después de la transfección.
- Añadir 3 mL de tampón isotónico y colocar la muestra en la platina de microscopía.
- Para la aspiración posterior del tampón isotónico, fije y ajuste una cánula de manguera para que la punta de la cánula llegue al fondo de la placa.
- Para agregar tampones, fije y ajuste los tubos para que el tampón impulsado por el flujo de gravedad pueda caer en el plato.
NOTA: Aquí, se utilizó un sistema de perfusión por gravedad controlado por válvula con cuatro válvulas magnéticas para controlar el flujo tampón, pero también se aplican otros métodos. - Encuentre un campo de visión con al menos una célula que exprese simultáneamente la construcción del donante y del aceptor.
- Configure un experimento de lapso de tiempo para los canales DD, DA y AA con un intervalo de 10 s y una duración que cubra todas las condiciones de la secuencia de estimulación, por ejemplo, 12 ciclos de línea de base seguidos de 15 ciclos por condición (Figura 3).
NOTA: El intervalo y el número de ciclos se pueden adoptar de acuerdo con las necesidades experimentales, pero siempre deben incluir una medición de referencia para la normalización para una mejor visualización y comparación de los datos. - Después de la medición de referencia, lave la muestra en el tampón para la primera condición.
- Aspirar el tampón isotónico a través de la cánula de manguera, aplicando un vacío con una jeringa.
- Agregue 3 mL del tampón de la siguiente condición por flujo de gravedad.
- Aspire el tampón y vuelva a añadir 3 mL del mismo tampón.
- Repita el paso 5.7.3 una vez más.
- Después de la medición de la primera condición, lavar la muestra en el tampón para la siguiente condición (pasos 5.7.1-5.7.4).
- Repita los pasos 5.5 a 5.8 hasta que se capturen todas las condiciones.
- Para la cuantificación de SE-FRET, dibuje un ROI alrededor de la celda o celdas y mida la intensidad media en el canal DD = (IDD), DA (IDA) y AA (IAA) para todas las imágenes (puntos de tiempo) en la serie de tiempo (Figura 3A, B).
- Para la sustracción de fondo de la señal FRET, dibuje un ROI en el canal DA donde solo se encuentra la señal de fondo y mida la intensidad media (IBDA).
- Reste la intensidad media del ROI de fondo de la intensidad media medida en el ROI de la celda del canal DA (
 ).
). - Utilice los valores determinados para calcular los valores medios de SE-FRET para cada ROI y todos los puntos
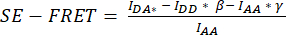 de tiempo.
de tiempo. - Para una mejor comparabilidad de diferentes condiciones y visualización de los valores SE-FRET, utilice la media de los valores de referencia de cada ROI para normalizar todos los puntos temporales del ROI correspondiente.
- Represente los valores normalizados de SE-FRET a lo largo del tiempo (Figura 3B).
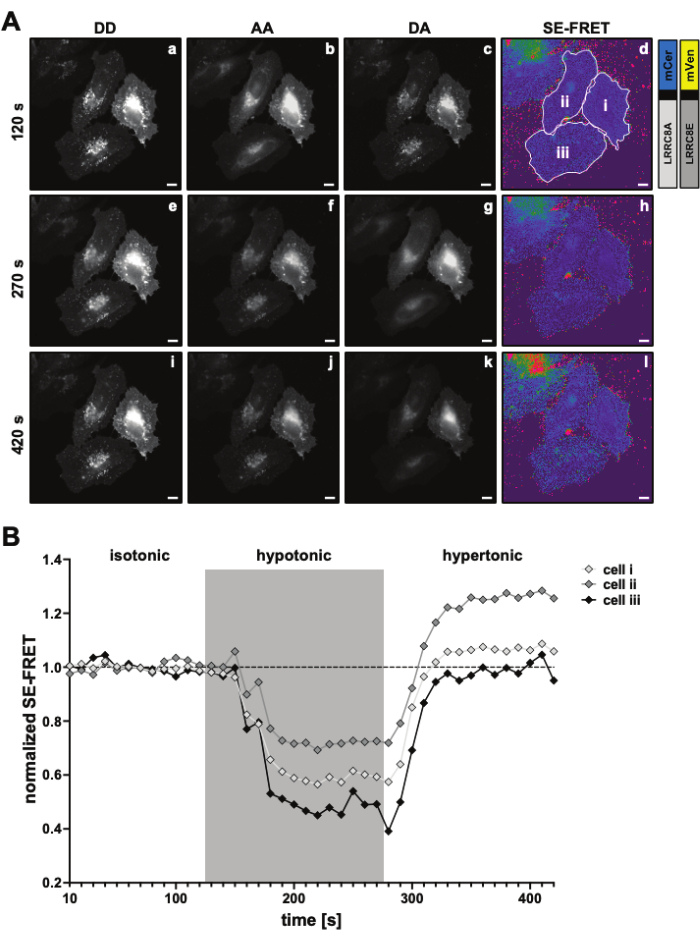
Figura 3: Imágenes representativas de fluorescencia y cuantificación de SE-FRET. (A) Imágenes representativas de fluorescencia y el SE-FRET aparente del primer punto de tiempo de un experimento de lapsos de tiempo para medir la actividad VRAC por SE-FRET de un canal compuesto por subunidades LRRC8A y LRRC8E dependiendo de la tonicidad. Barra de escala = 10 μm. Las mismas celdas se muestran en la Figura 2C. Los paneles a-i muestran la detección de los canales DD, AA y DA y el SE-FRET aparente calculado. Los contornos blancos representan las ROI (celdas i-iii en el panel d) utilizadas para medir las intensidades medias de la señal en DD, AA y DA y la imagen aparente SE-FRET. (B) Cuantificación de los valores de SE-FRET a lo largo del tiempo. La secuencia de condiciones fue de 12 ciclos de tampón de imagen isotónica (línea de base) seguidos de 15 ciclos de tampón de imagen hipotónica y 15 ciclos de tampón de imagen hipertónica. El valor medio bruto de SE-FRET de cada ROI (celdas i-iii) y punto de tiempo se normalizó a la media del valor basal (isotónico) para el ROI correspondiente. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Con este método basado en FRET, se puede monitorizar la actividad de LRRC8/VRAC durante la estimulación osmótica, y la reducción de SE-FRET se correlaciona con el grado de hipotonicidad extracelular45. Aquí también se muestran resultados representativos de la activación del canal inducida por hipotonía (Figura 3 y Figura 4). Además, se puede observar la activación de LRRC8/VRAC por diferentes estímulos isismóticos, como la manipulación de la señalización de diacilglicerol45 o durante la activación de miocitos56.
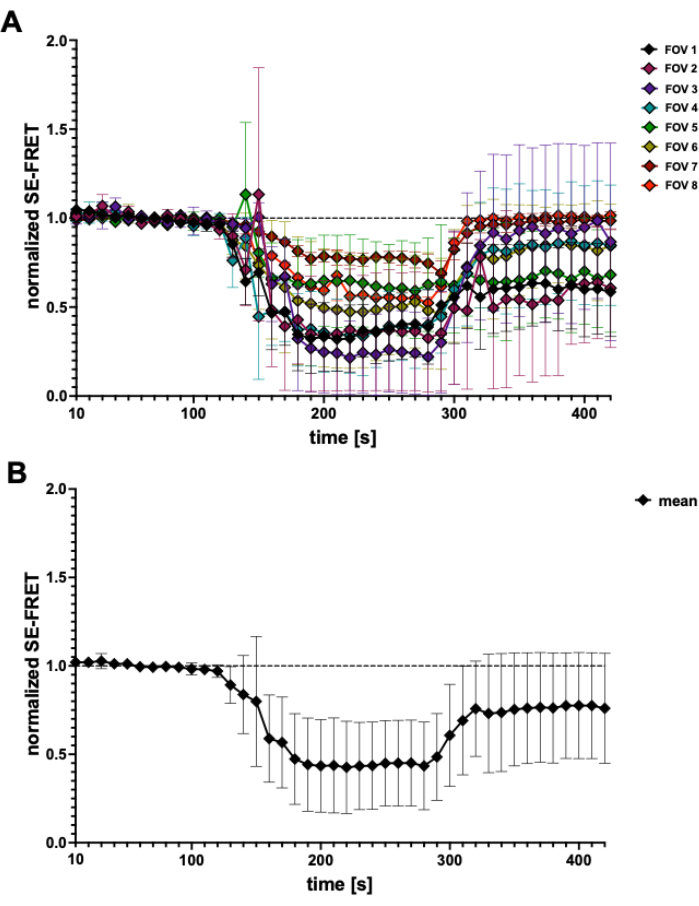
Figura 4: Trazas de SE-FRET. (A) Trazas aparentes de SE-FRET de 5 experimentos independientes. Los datos representan la media ± DE de N = 2 a N = 7 celdas por campo de visión (FOV). (B) Media ± DE de todas las celdas (N = 31 celdas). Haga clic aquí para ver una versión más grande de esta figura.
Dado que los canales LRRC8/VRAC también están implicados en la disminución del volumen apoptótico24,57, la observación de la actividad del canal tras la inducción de la apoptosis sería otra aplicación para el método descrito aquí. En consecuencia, el protocolo para monitorizar SE-FRET en células HeLa que expresan LRRC8A-mCerulean3 y LRRC8E-mVenus se llevó a cabo mientras se aplicaban fármacos inductores de apoptosis mediados por receptores de muerte. Previamente se demostró que el factor de necrosis tumoral (TNF)-α y la cicloheximida (CHX) evocan corrientes VRAC en pocos minutos58. Después de la adición de 2 ng/mL de TNF-α y 1 μg/mL de CHX en tampón isotónico, hubo una disminución robusta de SE-FRET (Figura 5). Al reemplazar el tampón por un medio hipertónico, aunque contenga TNF-α y CHX, los valores de SE-FRET se recuperaron cerca de la línea de base (Figura 5A), lo que corresponde a la disminución de las corrientes de VRAC en la solución de baño hipertónica durante el tratamiento con el ligando Fas58 inductor de apoptosis. El tratamiento de las células con DMSO, el disolvente del TNF-α y el CHX, no dio lugar a una reducción de SE-FRET. TNF-α + CHX no afectó a SE-FRET de CFP-18aa-YFP, una construcción en tándem de EYFP y ECFP como control FRET59, lo que demuestra la especificidad para LRRC8/VRAC (Figura 5B).
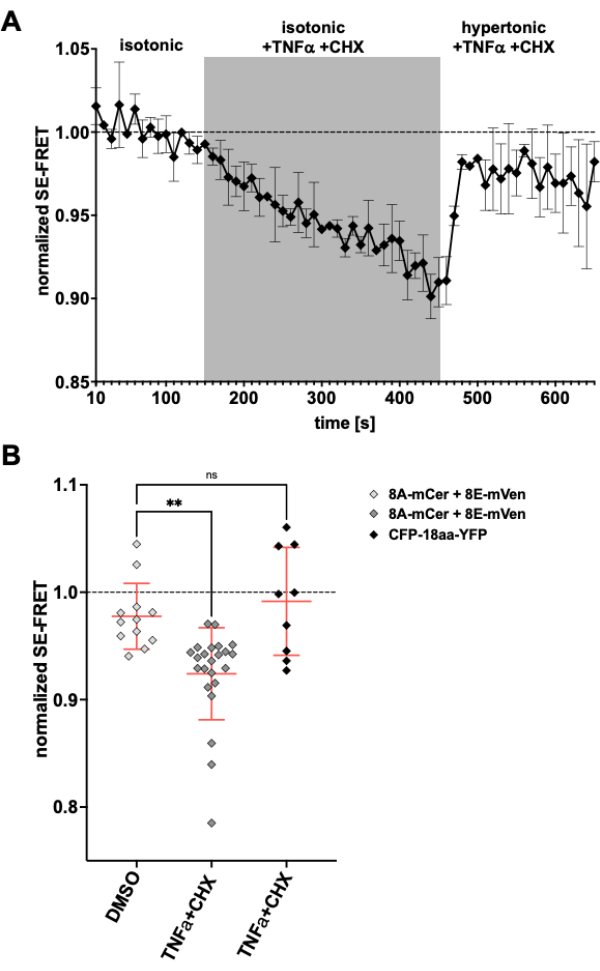
Figura 5: Activación isosmótica de VRAC por apoptosis mediada por receptores de muerte. (A) Valores normalizados de SE-FRET de células HeLa que expresan LRRC8A-mCer/LRRC8E-mVen (n = 8 platos, 23 células) a lo largo del tiempo. Después de 15 ciclos en tampón de imagen isotónica (línea de base), la solución de baño se reemplazó por tampón isotónico suplementado con 2 ng/mL de TNF-α y 1 μg/mL de cicloheximida (CHX) durante 30 ciclos, seguidos de 20 ciclos de tampón de imagen hipertónica con TNF-α y CHX. El valor medio bruto de SE-FRET de cada ROI y punto de tiempo se normalizó a la media del valor basal (isotónico) para el ROI respectivo. (B) Cuantificación de los valores normalizados de SE-FRET de las células HeLa que expresan LRRC8A/E como en A con una solución isotónica que contiene DMSO como vehículo de control para CHX (n = 5 platos, 12 células) o tampón isotónico que contiene inductores de apoptosis como en A (n = 8 platos, 23 células), o de células HeLa que expresan CFP-18aa-YFP con inductores de apoptosis (n = 3 platos, 9 células). Los datos representan la media de los últimos 10 puntos de tiempo en el búfer respectivo de celdas individuales (símbolos) y la media de todas las celdas ± SD; ** p < 0,01 ANOVA ordinario de un factor seguido de la prueba post-hoc de comparación múltiple de Tukey. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La microscopía FRET es una técnica bien establecida y ampliamente utilizada para estudiar la interacción entre proteínas. Por lo tanto, los métodos basados en FRET se pueden aplicar en muchos laboratorios de experiencia variable. Los reordenamientos conformacionales durante la activación se han monitoreado para una amplia gama de canales iónicos utilizando ensayos basados en FRET (por ejemplo, ver referencias 34,50,51,52,53,60,61,62,63,64,65,66,67), en algunos casos combinado con electrofisiología en fluorometría patch-clamp 68,69,70,71. FRET se puede utilizar para estudiar las relaciones estructura-función de estos canales iónicos o para monitorear su actividad independiente del transporte iónico. El método presentado aquí puede tener claras ventajas sobre la electrofisiología, ya que permite monitorizar in situ la actividad de los canales LRRC8/VRAC.
Los pasos críticos en el protocolo incluyen la siembra de las células para alcanzar la confluencia óptima para la transfección y la obtención de imágenes, lo que idealmente facilita la distinción fácil de las células para su posterior análisis. La co-transfección efectiva de las diferentes subunidades es crucial para la correcta localización subcelular; por ejemplo, un exceso de la subunidad no LRRC8A conducirá a una mejor localización del retículo endoplásmico (RE)4. Por lo tanto, es posible que sea necesario ajustar las proporciones de plásmidos. Dependiendo del sistema, los pares FRET recién generados deben verificarse, por ejemplo, mediante blanqueo de aceptores. El binning y el tiempo de exposición deben equilibrarse entre sí para permitir una resolución temporal y espacial óptima para la pregunta de investigación. La agrupación permite tiempos de exposición más cortos y, por lo tanto, reduce el posible blanqueo del sensor FRET al tiempo que disminuye la resolución espacial. Por lo tanto, si la configuración experimental requiere, por ejemplo, la discriminación subcelular de la actividad de LRRC8/VRAC, se debe evitar el agrupamiento. La pregunta de investigación determina igualmente el número y el intervalo de ciclos en una serie de lapsos de tiempo. El intervalo solo es relevante si se requiere la cinética de los cambios FRET (y, por lo tanto, la activación/inactivación de LRRC8/VRAC); De lo contrario, también se pueden realizar grabaciones sencillas de "antes y después". La duración del experimento depende del proceso fisiológico. Idealmente, la actividad de LRRC8/VRAC sobre los estímulos debe ser monitoreada hasta que SE-FRET se haya estabilizado. Estos factores se pueden determinar en experimentos piloto. Los factores de corrección para calcular la señal SE-FRET real deben determinarse para todas las condiciones. Los factores de corrección determinados incorrectamente pueden llevar a una sobreestimación o subestimación de las intensidades SE-FRET. Por último, después de establecer una línea de base estable, el intervalo de tiempo entre imágenes debe ser lo suficientemente corto como para capturar el proceso fisiológico de interés.
El método tiene algunas limitaciones. Una de ellas es que los cambios en las intensidades de FRET inter-LRRC8, al tiempo que reflejan los movimientos de los LRRD, no se corresponden necesariamente con el transporte de iones u osmolitos a través del poro. Esto se desprende de los cambios en el FRET observados con los homómeros LRRC8A45 a pesar de sus corrientes mínimas 4,32,72. Es posible que los bloqueadores de poros de los canales LRRC8/VRAC no afecten a la señal FRET, lo que hace que este método no sea adecuado para la búsqueda de moduladores de canal específicos. Además, los niveles de expresión de las proteínas LRRC8 sobreexpresadas podrían afectar a los procesos fisiológicos observados, especialmente porque las proteínas LRRC8 marcadas con C-terminal muestran actividad basal14.
Un aspecto que puede considerarse una limitación o una ventaja dependiendo de la pregunta de investigación en particular es que en este método, solo se miden selectivamente las subunidades LRRC8 expresadas ectópicamente. Por lo tanto, los niveles de fondo de proteínas endógenas apenas interfieren con las mediciones. Por otro lado, es posible que las proteínas sobreexpresadas no se comporten como los canales LRRC8 endógenos con una composición de subunidades y estequiometría potencialmente diferentes. Por ejemplo, varios estímulos, como la oxidación, pueden tener efectos moduladores opuestos en los canales LRRC836 compuestos de manera diferente. Al alterar las proporciones entre las subunidades coexpresadas, su estequiometría y la conductancia iónica general se pueden ajustar14,73, pero su composición nativa, con probablemente más de dos parálogos dentro de un complejo21, no está clara y puede variar entre los tipos de células 74,75,76. Además, se demostró que la fusión de proteínas fluorescentes en el extremo C-terminal citosólico de las proteínas LRRC8 aumenta la actividad del canal basal LRRC8/VRAC en ovocitos de Xenopus 14, probablemente porque las etiquetas grandes modulan la conformación de las LRRD, lo que puede gobernar la apertura del canal 14,44,45 . Por lo tanto, el tamaño de las proteínas fluorescentes, el enlazador y su orientación no solo pueden afectar la eficiencia de FRET, sino también la actividad del canal. Sin embargo, es importante destacar que los canales VRAC de proteínas LRRC8 fusionadas con proteínas fluorescentes siguieron respondiendo a la estimulación hipotónica14, lo que permitió su uso como sensores FRET45.
Las ventajas de este método no invasivo para monitorizar la actividad del canal LRRC8/VRAC mediante microscopía óptica en comparación con otros métodos son: (i) Permite observar LRRC8/VRAC dentro de células o compartimentos normalmente inaccesibles para la electrofisiología. Esto incluye orgánulos intracelulares en los que se pueden encontrar complejos LRRC8 o dirigirse a 45,77,78. (ii) La composición citosólica permanece inalterada por el método, mientras que durante las mediciones de patch-clamp de células completas, el citosol se reemplaza en gran medida por una solución de pipeta, lo que puede afectar las vías de señalización como se observa con la activación de LRRC8/VRAC inducida por forbol-12-miristato-13-acetato (PMA)45. (iii) Ofrece la posibilidad de observar la activación de LRRC8/VRAC con resolución subcelular, como distinguir la actividad en los bordes delantero y trasero durante la migración celular, donde -restringido a espacios confinados- VRAC ha sido implicado 79,80. (iv) Permite la monitorización continua de la actividad de LRRC8/VRAC durante procesos fisiológicos prolongados, como la diferenciación de miocitos56.
Si bien existen limitaciones y desafíos con este método, es prometedor para una mayor exploración, incluidas las posibles aplicaciones en modelos animales. En combinación con otros métodos para estudiar esta familia de canales iónicos y osmolíticos, este ensayo basado en FRET puede contribuir significativamente a desentrañar los mecanismos de activación y explorar las diversas funciones fisiológicas de los canales LRRC8 en sus entornos nativos.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos a C.F. Kaminski por el amable obsequio del plásmido que codifica la construcción CFP-18aa-YFP, a A. Klemmer por su asistencia técnica y a todos los miembros actuales y anteriores del laboratorio Stauber que contribuyeron al desarrollo de este método.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
Referencias
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367 (2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974 (2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885 (2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461 (2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431 (2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382 (2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532 (2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435 (2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421 (2019).
- Hille, B. . Ion Channels of Excitable Membranes. 3rd edn. , (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896 (2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215 (2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118 (2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093 (2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755 (2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108 (2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7 (2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940 (2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879 (2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663 (2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados