Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de rata de remodelación cardíaca derecha y arritmia mediante bandas de la arteria pulmonar
En este artículo
Resumen
La insuficiencia cardíaca derecha (IRH) se caracteriza por dilatación e hipertrofia cardíaca del lado derecho, lo que provoca un mal funcionamiento ventricular y auricular. Las afecciones cardiopulmonares asociadas con la RHF se acompañan de un mayor riesgo de arritmias cardíacas. Este artículo describe un modelo estandarizado de RHF inducida por bandas en la arteria pulmonar asociada con un aumento de la arritmogénesis ventricular y auricular.
Resumen
Las afecciones clínicas, como la enfermedad pulmonar obstructiva crónica o la hipertensión arterial pulmonar (HAP), pueden provocar una sobrecarga crónica de la presión del ventrículo derecho e insuficiencia cardíaca derecha (ICR) progresiva. La RHF puede identificarse por la hipertrofia y dilatación cardíaca del lado derecho asociada a una función miocárdica anormal que afecta al VD y a la aurícula derecha (AR). Recientemente hemos demostrado que la RHF grave se acompaña de un mayor riesgo de inflamación auricular, fibrosis auricular y fibrilación auricular (FA), el tipo más común de arritmia cardíaca (AC). Estudios recientes han demostrado que la inflamación del VD y la AR desempeña un papel importante en la arritogénesis de la AC, incluida la FA. Sin embargo, el impacto de la inflamación en el desarrollo de AC y FA en la ICR está mal descrito.
Se requieren modelos experimentales de RHF para comprender mejor la asociación entre la inflamación miocárdica del lado derecho y la CA. El modelo de rata de hipertensión pulmonar (HP) inducida por monocrotalina (MCT) está bien establecido para provocar RHF. Sin embargo, el MCT desencadena neumotoxicidad grave e inflamación pulmonar. Por lo tanto, la RHF inducida por MCT no ayuda a distinguir si la inflamación miocárdica posterior se origina en la RHF per se o en señales inflamatorias circulantes secretadas por el pulmón lesionado.
En este artículo, se utilizó un método mecánico que involucra el bandeo del tronco de la arteria pulmonar (PAB) para provocar la arritmogénesis cardíaca derecha. La PAB consiste en realizar una sutura permanente del tronco de la arteria pulmonar durante 3 semanas. Este enfoque genera una mayor sobrecarga de presión en el lado derecho. En el D21 post-PAB, la sutura da lugar a un VD y AR hipertrofiados, dilatados e inflamados. La RHF inducida por PAB también se acompaña de vulnerabilidad a arritmias ventriculares y auriculares, incluida la FA.
Introducción
La insuficiencia cardíaca derecha (ICR) se caracteriza por hipertrofia y dilatación del ventrículo derecho (VD) y auricular (AR), lo que conduce a un mal funcionamiento cardíaco del lado derecho en respuesta a una sobrecarga crónica de la presión del VD debido a la constricción de las arterias pulmonares (AP)1. Por lo tanto, las condiciones que provocan el estrechamiento de la PA pueden ser responsables de un mayor riesgo de RHF 1,2,3,4. Los datos clínicos revelaron que la RHF es la principal causa de hospitalización (56%) en pacientes con hipertensión arterial por AF (HAP)2. Los estudios clínicos han demostrado que, independientemente de la causa de la HAP, incluida la hipertensión pulmonar (HP) tromboembólica y la HAP idiopática, los pacientes a menudo se ven afectados por RHF y son un 20% más susceptibles a desarrollar arritmias cardíacas, incluidas taquiarritmias supraventriculares y fibrilación auricular (FA)2,5,6.
Para comprender mejor la asociación entre la HAP y la RHF, se han utilizado estudios en animales, incluido el modelo de una dosis única de monocrogalina (MCT), para provocar inflamación pulmonar grave y RHF 7,8. Recientemente observamos que la RHF inducida por MCT se asoció con la inflamación de la AR y la FA9. Sin embargo, debido a la importancia de la inflamación pulmonar inducida por MCT y de las citocinas circulantes, fue difícil describir si la inflamación por AR inducida por MCT es una consecuencia de la RHF solo9. Por lo tanto, se requirió un nuevo modelo de arritmia cardíaca inducida por RHF para estudiar el estado inflamatorio de la AR.
El modelo experimental de banda del tronco de PA (PAB) se ha utilizado en varias especies animales para imitar las enfermedades obstructivas de la PA y para estudiar la remodelación cardíaca patológica asociada que afecta el lado derecho del corazón10. El PAB ha sido reportado como un método efectivo para inducir disfunción y fracaso del VD derecho en varios estudios que imitan la sobrecarga del VD 10,11,12,13,14,15,16. Técnicamente, la PAB es la colocación de una sutura permanente en el tronco de la AP, provocando una reducción mecánica del diámetro del tronco de la AP10. El PAB genera una mayor sobrecarga de presión en el RV10. En primer lugar, como adaptación compensatoria al aumento brusco de la poscarga del VD, la cavidad del VD se dilata, lo que conduce a una hipertrofia crónica del VD10,13. La dilatación e hipertrofia del VD afectan a las válvulas tricúspide, que se vuelven permeables13. Más precisamente, la dilatación pronunciada del VD combinada con una alta poscarga del VD tiene el efecto de estirar el anillo de la válvula tricúspide ubicado entre el VD y la AR13,17. Debido a la oclusión incompleta de la válvula, una porción de la sangre expulsada del VD durante la sístole se dirigirá hacia la cavidad de la AR17. La fuga de la válvula tricúspide se puede observar a través de la ecocardiografía y se denomina insuficiencia tricuspídea17. Luego, la AR recibe una presión arterial inapropiadamente alta, lo que contribuye al aumento de la dilatación e hipertrofia de la AR13. El remodelado crónico del VD y la AR se acompaña de reacciones inflamatorias locales del miocardio que conducen a fibrosis del VD y a la AR y a la pérdida de la función 9,13. La fibrosis cardíaca se caracteriza por el desarrollo de zonas de bajo voltaje, menos contráctiles y más susceptibles a provocar el bloqueo de la conducción y los circuitos de reentrada implicados en el desarrollo de arritmias cardíacas, incluyendo la fibrilación ventricular y la FA18,19.
La originalidad de este trabajo reside en la utilización de un método estandarizado de remodelación cardíaca derecha inducida por PAB para provocar y estudiar la inducibilidad de arritmias cardíacas en 3 semanas después de la PAB. Las principales ventajas de este abordaje quirúrgico son: i) el control directo de la reducción del diámetro del tronco de la AF y ii) la evitación de la inflamación pulmonar para centrarse en la inflamación miocárdica inducida por la RHF para estudiar las arritmias cardíacas, incluida la FA.
El abordaje descrito aquí implica un procedimiento microquirúrgico preciso para crear la PAB, la evaluación del aumento de la poscarga del VD, la ecocardiografía para observar el remodelado estructural y funcional del miocardio inducido por la PAB y el estudio electrofisiológico para evaluar la vulnerabilidad a las arritmias cardíacas, incluida la FA.
Protocolo
Todos los procedimientos descritos a continuación fueron aprobados por el comité de ética del Instituto del Corazón de Montreal (números de protocolo: 2021-2938-2021-47-01 y 2024-3412-2024-48-01) y siguieron estrictamente las pautas del Consejo Canadiense de Cuidado Animal (CCAC). Para los procedimientos se utilizaron ratas Wistar macho (225-275 g) de 6-8 semanas de edad. Todos los animales fueron alojados en el centro de cuidado animal del Instituto del Corazón de Montreal, con acceso gratuito a agua y comida.
1. Preparación preoperatoria
- Esterilice todos los instrumentos y materiales quirúrgicos antes de la cirugía utilizando un autoclave de vapor saturado a alta presión a temperaturas entre 121 °C y 134 °C por debajo de 15-30 psi durante 30-40 minutos seguido de un ciclo de secado de 25 minutos.
- Prepare todos los volúmenes de medicamentos necesarios para la cirugía. Utilizar un abordaje analgésico multimodal con buprenorfina (0,05 mg/kg) y ketoprofeno (5 mg/kg) inyectados por vía subcutánea 30 min antes de la cirugía y repetidos a las 6 h (buprenorfina) y 24 h postoperatorios (buprenorfina y ketoprofeno). Además, realizar una analgesia local en el sitio de la incisión (lidocaína 5 mg/mL).
- Realice una ecocardiografía transtorácica basal antes de la cirugía (consulte el procedimiento detallado para la ecocardiografía transtorácica en los pasos 6.1-6.13) para determinar el diámetro de la PA y seleccionar la aguja de calibre adecuada que se utilizará como cable para generar la reducción esperada del 60% del diámetro de la PA durante la PAB.
NOTA: En este trabajo, se utilizaron ratas Wistar macho de 225-275 g, y la utilización de una aguja de 19 G fue apropiada para generar una reducción del 60% del diámetro del PA. - Prepare una aguja de 19 G (o el calibre apropiado según se determine en el paso 1.3) que se utilizará como cable (ver más abajo: pasos 4.18 y 4.19) para obtener una constricción óptima del tronco de PA, provocando una remodelación severa del corazón de rata. Con una pinza, doble los 19 G a 90-110° (Figura 1A).
NOTA: Doblar los 19 G facilita i) el posicionamiento cerca del tronco PA y ii) la aplicación de la ligadura durante el procedimiento. El 19 G se utiliza como cable alrededor del cual se instalará la sutura para reducir el diámetro del PA a 1,0 mm (reducción del 60 % para ratas que pesan 225-275 g), lo que induce una sobrecarga significativa de presión en el VD responsable de una remodelación severa del VD en 3 semanas.
2. Inducción de la anestesia y preparación animal
NOTA: Los análisis se realizaron en ratas Wistar macho (225-275 g) de 6-8 semanas de edad. Utilice una almohadilla térmica durante todos los pasos de los siguientes procedimientos para mantener la temperatura corporal del animal alrededor de 37 °C. Aplique una sonda rectal para controlar la temperatura corporal.
- Anestesiar al animal con isoflurano inhalado continuamente al 3% y oxígeno al 100% 2-3 L/min.
- Aplique gel lubricante para los ojos para proteger la córnea de la desecación.
- Verifique el nivel de anestesia usando el reflejo de pellizco de los dedos del pie.
3. Intubación
NOTA: La intubación se realizó como se describió anteriormente20.
- Transfiera al animal a una estación de intubación inclinada en posición supina. Sujete la rata por los incisivos superiores con un lazo de hilo para mantener el cuerpo en posición suspendida a 45° para obtener una mejor visualización de la garganta.
- Dirija una fuente de luz flexible a la superficie del cuello para transiluminar a través de la región faringoepiglótica.
- Extienda la lengua con un bastoncillo de algodón y estabilícela en el maxilar con una espátula de pesaje curva como depresor lingual.
- Visualiza la tráquea y las cuerdas vocales.
- Utilice un angiocatéter de 16 g para realizar la intubación. Use el catéter como un tubo traqueal y desafile la aguja de punta biselada para usarla como introductor.
- Avance el tubo endotraqueal (angiocatéter de 16 G) montado en el introductor (aguja de punta biselada) en la tráquea y, una vez colocado, retire el introductor (Figura 1B).
- Confirme la posición correcta del tubo observando un patrón de respiración normal (unas 80 respiraciones/min para las ratas que pesan 225 g y unas 70 respiraciones/min para las ratas que pesan 275 g) y la presencia de niebla en la superficie de la espátula metálica (o espejo pequeño) cuando se coloca en el reborde del cubo de la cánula.
- Una vez correctamente intubado, transfiera rápidamente el animal a la estación quirúrgica en decúbito supino sobre una almohadilla térmica homeotérmica.
- Ajuste el volumen corriente y la velocidad del ventilador de acuerdo con el peso corporal de la rata. Las ratas de alrededor de 225-275 g reciben un volumen corriente de 2,0-2,5 mL y 70-80 respiraciones/min con el ventilador.
- Conecte el tubo endotraqueal al ventilador para iniciar la ventilación mecánica. Coloque la punta de salida del ventilador en un cilindro de agua. Las burbujas de aire que salen del flujo de salida después de cada respiración indican una intubación exitosa.
- Una vez que se establezca una respiración constante, asegure el tubo endotraqueal con cinta quirúrgica y fije la sonda rectal a lo largo de la cola para controlar la temperatura corporal.
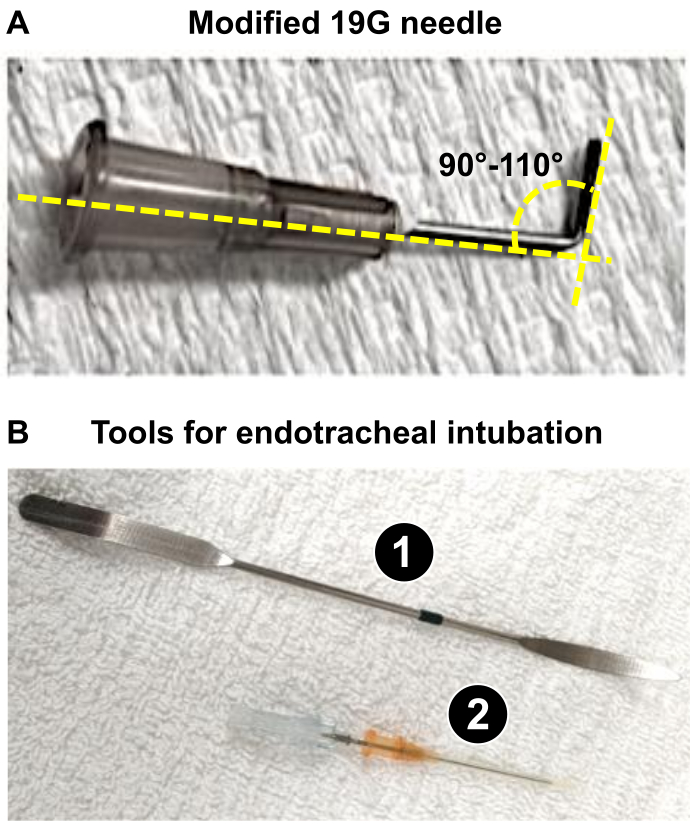
Figura 1: Instrumentos clave necesarios para la preparación del procedimiento microquirúrgico de PAB. (A) Aguja modificada de 19 G utilizada como cable para obtener un diámetro de 1 mm del tronco de PA después de PAB. (B) Herramientas endotraqueales utilizadas o intubación exitosa de ratas. 1. La espátula se utiliza como depresor lingual en ratas anestesiadas para exponer la tráquea. 2. El catéter 16G actúa como un tubo endotraqueal después de desafilar la punta de su aguja. Haga clic aquí para ver una versión más grande de esta figura.
4. Cirugía PAB (Figura 2)
NOTA: Todos los procedimientos deben realizarse de acuerdo con estrictas técnicas de cirugía aséptica.
- Afeitar el lado izquierdo del tórax con una maquinilla y una crema depilatoria y preparar la piel con aplicaciones de clorhexidina al 2% seguidas de exfoliantes con alcohol al 70% (repetidas tres veces).
- Inmovilice las extremidades anteriores en posición abierta con cinta médica, teniendo cuidado de no extender demasiado las extremidades para evitar afectar la respiración.
- Tira de la extremidad trasera derecha ligeramente hacia abajo y fíjala a lo largo de la cola.
- Extender y aducir la extremidad trasera izquierda y fijarla al lado derecho del animal para generar una ligera posición lateral derecha, dejando al descubierto el lado izquierdo del pecho.
- Use guantes estériles en este paso para la parte restante de la cirugía.
- Coloque un paño estéril sobre el animal y haga una incisión en la piel de 2-3 cm en el lado izquierdo del tórax, comenzando unos 2 cm por encima de la apófisis xifoides y orientada en diagonal hacia la base de la extremidad delantera izquierda de la rata.
- Debajo de la piel, separe los músculos pectorales posteriormente (pectoral menor y mayor) y muévalos a un lado mediante una disección roma con tijeras de punta redonda. Use retractores magnéticos para sujetar los músculos, para permitir una visualización adecuada de la caja torácica ubicada debajo.
- Desinfle los pulmones retirando el tubo de salida (conectado al ventilador) del cilindro de agua (ver paso 3.10). La extracción del tubo de salida del agua disminuye la presión en los pulmones, lo que genera la desinflación de los lóbulos.
- Realizar una toracotomía del lado izquierdo con pinzas de disección curvas. Perfora un pequeño orificio en la línea clavicular media del músculo ubicado entre la3ª y la4ª costilla.
- Introduzca las pinzas curvas en la abertura y deslícelas a lo largo de la pared interior izquierda del músculo entre las dos costillas para levantar ligeramente la pared torácica izquierda y evitar tocar los pulmones mientras corta el músculo.
- Utilice las pinzas introducidas como guía y realice una incisión longitudinal en las costillas de aproximadamente 1 cm con unas tijeras de iris. Mantenga la pared torácica izquierda levantada y manipule las tijeras con cuidado para evitar dañar los lóbulos del pulmón izquierdo directamente debajo.
- Expanda la incisión intercostal a 1-2 cm a la izquierda del animal con unas tijeras de punta redonda.
- Vuelva a colocar los retractores debajo de las costillas para mantener la herida abierta.
- Observe la parte inferior del timo y una porción del lóbulo izquierdo del pulmón.
- Empuje a un lado el timo y los pulmones a este nivel, dado el espacio significativo que ocupan estos órganos. Separe los lóbulos del timo mediante una disección roma con fórceps y sujete el pulmón por el lado izquierdo con una gasa húmeda. Luego, exponga la porción superior del corazón, la aurícula izquierda (AI), así como el tronco pulmonar y el arco aórtico.
- Diseccione cuidadosamente la capa delgada de pericardio que cubre el corazón en esta área, junto con cualquier tejido adiposo adherido, para ayudar a localizar la parte donde la aorta y el tronco pulmonar aún están unidos. Diseccionar mínimamente el pericardio y evitar tocar la membrana pleural.
- Inserte las pinzas curvas en una posición cerrada en el espacio entre el apéndice AI y el tronco pulmonar, en el centro de la porción visible del vaso, para llegar al otro lado del vaso (Figura 2A).
PRECAUCIÓN: Evite trabajar demasiado cerca de la raíz aórtica del corazón para prevenir el riesgo de ruptura de vasos y hemorragia. - Visualice la punta de las pinzas a través de la membrana conjuntiva cranealmente al tronco pulmonar. Use las segundas pinzas para diseccionar la punta y perfore cuidadosamente la membrana para crear una pequeña abertura. A continuación, las pinzas curvas colocadas debajo del tronco pulmonar se abren ligeramente para agarrar un hilo de seda 5-0. Retraiga las pinzas para llevar el hilo de un lado al otro del tronco pulmonar (Figura 2B, C).
- Realizar la constricción del tronco pulmonar. En primer lugar, practica un nudo doble suelto de la Silk 5-0 cerca de la arteria. Inserte la aguja de 19 G a lo largo del recipiente y debajo del hilo. Apriete este primer nudo y fíjelo con un segundo nudo simple antes de quitar los 19 G (Figura 2D).
PRECAUCIÓN: Trabaje rápida y cuidadosamente para minimizar la duración de la obstrucción completa del tronco pulmonar. - Realice un último nudo simple y corte el hilo de seda 5-0 restante a unos 0,5-1 cm del nudo (Figura 2D).
- Reposicione los lóbulos del timo y retire los retractores de tórax.
- Vuelva a inflar los pulmones pellizcando el flujo de salida del ventilador durante 2 s.
- Cierre la caja torácica realizando un patrón de punto de cruz con un hilo de sutura sintético absorbible 5-0.
- Aplique unas gotas de solución salina al 0,9% sobre el área de la herida y comprima cada lado de la pared torácica para eliminar las burbujas de aire y restablecer la presión torácica negativa.
- Vuelva a colocar los músculos pectorales y limpie la solución salina restante con una gasa estéril.
- Use una jeringa para aplicar un bloque de lidocaína en la superficie y el área circundante de la herida.
- Cierre la piel con un hilo de sutura sintético absorbible 5-0 con aguja en un patrón subcuticular continuo.
NOTA: Las ratas simuladas reciben el mismo procedimiento sin los pasos 4.18 y 4.19.
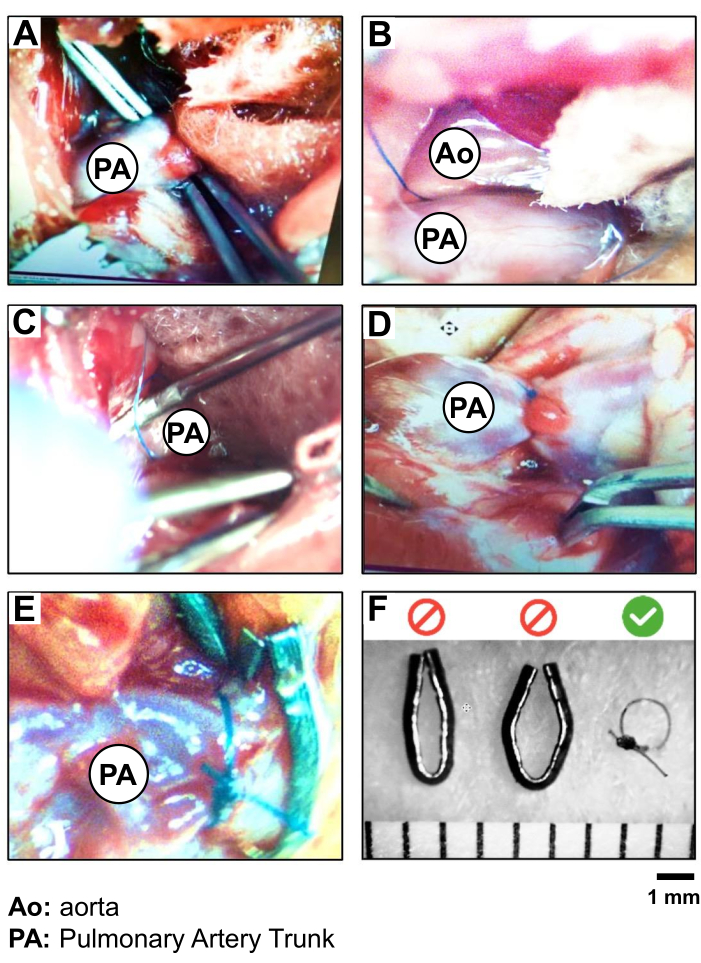
Figura 2: Procedimiento PAB y validación de la sutura de seda 5.0 frente a clips metálicos. Fotografía del paso a paso del aislamiento y ligadura del tronco de AP, mostrando (A) la exposición y el aislamiento del tronco de AP, (B) la posición de la sutura (seda 5.0) alrededor del tronco de AP, (C) la ligadura de PA (PAB) (utilizando una aguja de 19 G como derivación); (D) la verificación del movimiento cardíaco y la sobrecarga de la raíz PA y el VD después de la PAB; (E) una comparación de PAB realizada con sutura de seda versus un clip de metal; y (F) la validación de la elección de la sutura de seda para el PAB para crear un diámetro más reproducible de 1 mm alrededor del tronco de PA. Haga clic aquí para ver una versión más grande de esta figura.
5. Recuperación postoperatoria
- Retire el isoflurano mientras mantiene a la rata bajo ventilación mecánica con flujo de oxígeno solamente. Gira la rata sobre su lado derecho o ventral para facilitar la respiración.
- Inyectar un volumen de solución salina al 0,9% por vía subcutánea en la región dorsal del cuello para promover la recuperación de líquidos (calculado como 10 mL/kg/h de anestesia).
- Una vez confirmada la respiración autónoma, retire suavemente el tubo endotraqueal.
- Observe cuándo la rata comienza a moverse por sí misma y transfiera al animal de la almohadilla térmica a una nueva jaula estéril para su recuperación. Proporcionar agua y comida húmeda ad libitum.
- Durante el postoperatorio (4-6 h), coloque la jaula sobre una almohadilla térmica (la mitad de la jaula) para ayudar a mantener la temperatura corporal y vigilar de cerca al animal.
- Controle con prontitud cualquier signo de dolor, dificultad para respirar o comportamiento anormal.
- En el postoperatorio, 6 h después de la cirugía, inyectar una segunda dosis de 0,05 mg/kg de buprenorfina. Al día siguiente, 24 h después de la cirugía, inyectar una tercera dosis de 0,05 mg/kg de buprenorfina y una segunda dosis de 5 mg/kg de ketoprofeno.
- Monitorea a las ratas hasta que se recuperen completamente de su salud.
6. Ecocardiografía transtorácica
NOTA: Este trabajo muestra los datos obtenidos en el 21º día postoperatorio, cuando las ratas fueron sometidas a ecocardiografía transtorácica. Sin embargo, dependiendo de los objetivos de la investigación y los requisitos del diseño del estudio, los investigadores pueden definir otros puntos temporales para la ecocardiografía transtorácica pre y post PAB.
- Realizar una ecocardiografía transtorácica basal antes de la cirugía para determinar el diámetro de la PA y seleccionar la aguja de calibre adecuada utilizada como derivación para generar la reducción esperada del 60% del diámetro de la PA durante la PAB.
NOTA: En este estudio, se utilizaron ratas Wistar macho de 225-275 g y la utilización de una aguja de 19 G fue apropiada para generar una reducción del 60% del diámetro del PA. - Pesar y anestesiar a las ratas con isoflurano inhalado de forma continua (3% y 2 L/min O2).
- Realizar ecocardiografía transtorácica en cada animal utilizando una sonda de sector 12S/multielemento (4,5-11,5 MHz) y un sistema de adquisición de imágenes.
- Utilice el mapeo de colores en una vista bidimensional (2D) del eje corto paraesternal colocando la sonda 12S al nivel de la válvula aórtica. Haga clic en el botón Doppler color de la máquina de ecocardiograma para visualizar el patrón de flujo sanguíneo que cruza el área de bandas de la arteria pulmonar (PAB) en el tronco pulmonar.
- Realice Doppler de onda continua (CW) cruzando el PAB guiado por mapeo de color en la vista 2D paraesternal de eje corto para registrar las propiedades del flujo sanguíneo que cruza el área del PAB, incluida la velocidad máxima (cm/s) y el gradiente de presión media (mmHg). Para obtener las curvas Doppler, ajuste el volumen de la muestra a nivel de las bandas de la arteria pulmonar.
- Aplique una vista apical 2D de 4 cámaras colocando la sonda 12S a nivel del ápice del corazón para demostrar el agrandamiento de la AR y el VD después de la cirugía y determinar la dimensión horizontal de la AR al final de la sístole cardíaca (RAD) expresada en milímetros (mm).
- Aplique el mapeo de color en la vista apical 2D de 4 cámaras para revelar la regurgitación tricuspídea debido a PAB mediante la adquisición de bucles de cine en la máquina de eco.
- Realizar ecocardiografía en modo M en vista apical de 4 cámaras cruzando la conjunción del anillo tricúspide y la pared lateral del VD para estudiar la excursión sistólica del plano del anillo tricúspide (TAPSE) expresada en mm.
- Utilice la imagen Doppler tisular (TDI) en la vista apical de 4 cámaras a nivel de la conjunción del anillo tricúspide y la pared lateral del VD para la medición de la contractilidad sistólica (Sr) de la pared lateral del VD expresada en centímetros por segundo (cm/s) para evaluar el rendimiento sistólico del VD.
- Registre el flujo transtricuspídeo diastólico (TTF) utilizando Doppler de onda pulsada en la vista apical de 4 cámaras para estudiar las propiedades diastólicas del VD, incluida la velocidad máxima en la onda de llenado temprano (E), la onda de llenado auricular (A) y la relación E/A en TTF.
- Realizar ecocardiografía en modo M en la vista paraesternal de eje largo a nivel de la válvula aórtica para medir el tracto de salida del VD al final de la diástole cardíaca (TSVD, expresado en milímetros) y la dimensión de la aurícula izquierda al final de la sístole cardíaca (LAD, expresada en milímetros).
- Realizar ecocardiografía 2D en modo M en vista paraesternal de eje corto a nivel de los músculos papilares para evaluar las dimensiones del VI al final de la sístole y la diástole (LVD y LVDd); y el espesor de la pared anterior del VI al final de la diástole (DAVI), todos expresados en milímetros.
- Realice el modo M 2D en vista paraesternal de eje corto para determinar el acortamiento fraccional del VI (LVFS, expresado en porcentaje) y la fracción de eyección del VI (FEVI, expresada en porcentaje).
7. Estudio electrofisiológico (Figura 3)
- Mantener a las ratas bajo anestesia después de una ecocardiografía in vivo para el estudio electrofisiológico transesofágico (EPS) in vivo .
- Inserte los electrodos de ECG debajo de la piel de las ratas (1 cerca de la extremidad delantera izquierda, 1 cerca de la extremidad trasera derecha y 1 cerca de la extremidad posterior izquierda).
- Introduzca suavemente un catéter cuadripolar 4F con una distancia entre polos de 5 mm en el esófago (Figura 3A).
- Ajustar la posición del catéter transesofágico cerca de la AR determinando con precisión cuándo la onda P, que representa las contracciones auriculares en el ECG de superficie, coincide con la onda P obtenida con el ECG del catéter transesofágico (Figura 3A, B).
- Determine el umbral de estimulación para cada animal. Este umbral es el voltaje mínimo al que el estimulador influye directamente en la frecuencia cardíaca.
- Evalúe la vulnerabilidad de la FA aplicando una ráfaga de tensión equivalente a 4 veces la tensión umbral siguiendo un protocolo de 3 series de 12 ráfagas de estimulación, cada una con una duración de 3 s a 50 Hz, seguidas de 2 s de reposo (1 min/set). Entre cada serie, las ratas tuvieron un período de descanso de 1 minuto 9,13,21.
- Identificar y cuantificar, después de cada estallido, la aparición de taquiarritmias cardíacas, incluida la FA o el aleteo auricular.
NOTA: La fibrilación auricular se define como latidos auriculares irregulares y ultrarrápidos (>800 lpm). El aleteo auricular se define como un ritmo auricular regular pero rápido asociado con la ausencia de la onda P o la presencia de un patrón regular de múltiples ondas P entre intervalos R-R regularmente consecutivos. Solo se consideran los episodios arrítmicos que duran más de 1 s. - Evite interrumpir los episodios continuos de fibrilación auricular o aleteo auricular deteniendo la siguiente serie de estimulaciones si el ritmo sinusal no se recupera por sí solo dentro del período de descanso entre dos estimulaciones consecutivas.
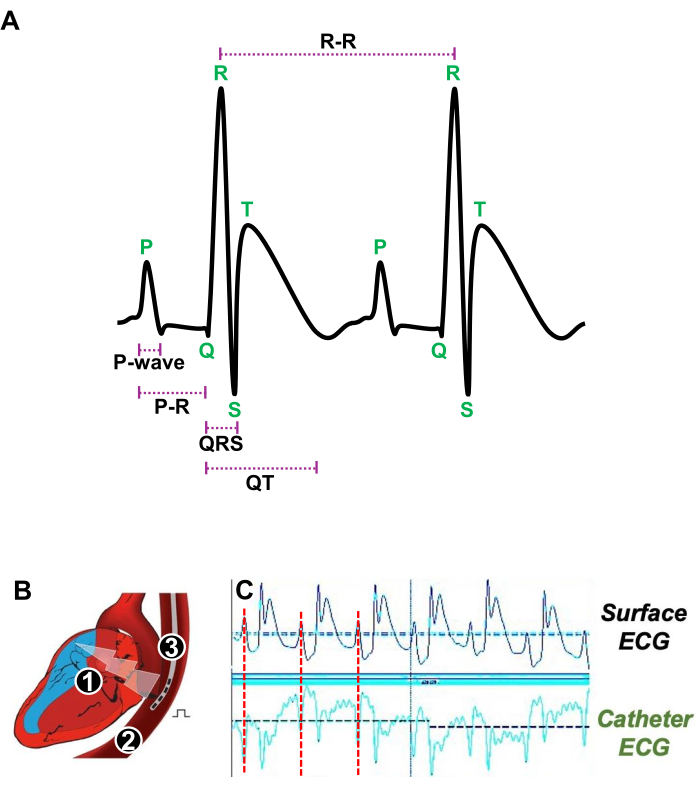
Figura 3: Ilustración de los latidos cardíacos en reposo y la posición adecuada de un catéter transesofágico para el estudio electrofisiológico in vivo . (A) ECG representativo de dos latidos cardíacos consecutivos en reposo que muestra la onda P, el intervalo PR, el complejo QRS, el intervalo QT y el intervalo R-R. (B) Esquema de una sección longitudinal del corazón (1) y del esófago (2) en la que se introduce un catéter cuadripolar (3) para estimular y adquirir el ECG auricular. (C) Señales representativas de ECG que muestran la posición preferida del catéter transesofágico cuando la señal auricular (línea roja) del ECG de superficie (trazas superiores) coincide con la señal auricular del ECG del catéter (trazas inferiores). Haga clic aquí para ver una versión más grande de esta figura.
8. Análisis de ECG
NOTA: Los registros y estimulaciones del ECG se realizaron utilizando un software de adquisición de ECG. Los análisis se realizaron mediante un software de análisis de ECG (Figura 3A).
- Mide la duración de la onda P correspondiente a la contracción auricular expresada en milisegundos (ms).
- Determinar el intervalo PR (expresado en milisegundos) correspondiente a la duración de la conducción eléctrica a través del nódulo auriculoventricular (AV).
- Informar la duración del complejo QRS (expresada en milisegundos) correspondiente a la despolarización ventricular.
- Se evaluó el intervalo QT (expresado en milisegundos) que refleja la duración total de la despolarización y repolarización ventricular.
- Cuantificar el intervalo RR (expresado en milisegundos) indicando la duración entre dos latidos cardíacos consecutivos y determinando la frecuencia cardíaca.
9. Análisis histológicos
- Eutanasia de las ratas por exanguinación bajo anestesia con isoflurano (5%, 2 L/min O2) el día 21 post-PAB.
- Aislar la AR y la AI para analizar el remodelado histológico auricular asociado o no a la ICR y a las arritmias cardíacas.
- Realizar una sección transversal de los corazones recién extirpados, a 5 mm del ápice, para evaluar el remodelado ventricular asociado o no a la ICR y a las arritmias cardíacas.
- Fijar las muestras miocárdicas en formol y teñir los portaobjetos histológicos con la solución tricrómica22 de Masson para cuantificar el grosor y la dilatación de la pared ventricular y la fibrosis auricular en D21 post-PAB.
10. Análisis estadístico
- Evaluar la normalidad de las distribuciones mediante la prueba de Shapiro-Wilk. Compare los datos distribuidos normalmente utilizando la prueba t de Student.
- Si los datos son de distribución no paramétrica, realice una prueba de Mann-Whitney. Analice variables categóricas como la inducibilidad de AF utilizando la prueba exacta de Fisher.
- Exprese los resultados como media ± error estándar a la media (S.E.M.). Considere las diferencias estadísticamente significativas con valores de P de dos colas < 0,05.
Resultados
Confirmación visual de la ligadura adecuada del tronco de PA durante la cirugía
Durante el procedimiento de PAB, una indicación de una buena posición de la sutura es un aumento inmediato de la presión arterial y una dilatación rápida del VD y la raíz del tronco del PA en la unión con el VD. La sutura no debe moverse para asegurar una sobrecarga de presión constante y permanente durante 3 semanas. En este estudio, se validó el uso de un 5-0 Silk como más es...
Discusión
El rendimiento exitoso del PAB es la parte más crucial de este protocolo. Es importante distinguir correctamente la aorta y el tronco PA. El aislamiento de la PA debe realizarse meticulosamente para evitar desgarros, hemorragias y la muerte durante el procedimiento. La aplicación de la sutura alrededor del cable 19G debe realizarse rápidamente y debe ir seguida de una extracción inmediata del cable, para evitar una "obstrucción completa" demasiado prolongada del PA debido a la prese...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a Colombe Roy, YanFen Shi, Sandra Querry y Josiane Deslandes por el rendimiento técnico de la ecocardiografía transtorácica y a Nathalie L'Heureux por la asistencia técnica preliminar durante la estandarización del método PAB. Agradecemos a los miembros del centro de cuidado animal del Instituto del Corazón de Montreal.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlorine Injection USB (100 ml) | Baxter | JB1302P | Solution used for drugs (analgesic and anti-inflammatory) dilution and for preparing saline water syringes dedicated to rehydrating the animal after the surgery |
| 19 G x 1 1/2 PrecisionGlide Needle | BD | 305187 | Needle modified (bent and blunted) to be used as a spacer during for the partial constriction of the pulmonary trunk |
| 2" x 2" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply | AMD-Ritmed | A2101-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 4" x 4" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply (x200) | AMD-Ritmed | A2100-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 5-0 Vicryl Violet Suture RB-1 1/2 Circle Needle 17mm 27" | Ethicon | J303H | Synthetic absorbable sterile surgical suture with a taperpoint needle used for muscle and skin wounds closure. |
| Anafen (100 mg/mL) | Merial Canada, Inc. | 1938126 | Diluted injectable solution of ketoprofen administered as a nonsteroidal anti-inflammatory, analgesic and antipyretic drug. |
| AutoClip System | FST | 12020-00 | Can be used to close the skin wound. Includes a clip applier, wound clips (9 mm) and a clip remover. |
| Dumont #5/45 Forceps | FST | 11251-35 | Dumoxel forceps with tips angled at 45°. Used to tighten the knots around the spacer placed on the pulmonary trunk. |
| Fine Scissors - Sharp | FST | 14060-10 | Stainless steel iris scissors dedicated to intercostal muscles incision and suture cutting. |
| Forane (Isoflurane) 100 mL | Baxter Canada | BAXCA2L9100 | Inhalation anesthetic used for rodents during their PAB surgery. |
| IV Catheter 16 G x 1.77 " (Straight) | BD Insyte | 381257 | Catheter used as an endotracheal tube with its metal stylet blunted. |
| Light LED 130 F - DrMach | Eickemeyer | M130300 | LED wall mounted light. |
| Magnetic Fixator Retraction System: Base plate | FST | 18200-50 | Metal plate on which the associated fixtures are installed. It is placed around the heating plate. |
| Magnetic Fixator Retraction System: Elastomer (2 m Roll) | FST | 18200-07 | Used to attach the retractors to the fixators. |
| Magnetic Fixator Retraction System: Fixators | FST | 18200-02 | Movable anchors that can be placed on the base plate. |
| Magnetic Fixator Retraction System: Retractors | FST | 18200-11 | Retractors allowing to maintain the surgical wound with the desired opening |
| Metzenbaum Scissors (Curved) | FST | 14017-14 | Stainless steel blunt scissors used for blunt dissection of the skin and muscles. |
| Micro-Adson Forceps | FST | 11018-12 | Stainless steel serrated forceps used to grasp skin and other tissues. |
| Oster Golden A5 2-Speed Clipper | Oster Professional | 34264416949 | Pet grooming clipper used to prepare the surgical field. Since it's meant to be used with large animals, the user needs to be careful with rats. |
| Rodent heating plate or warming system | Custom made | N/A | Plate connected to a unit equipped with a LED screen displaying the temperature detected by the rectal probe as well as the target temperature. |
| Rodent Ventilator Model 683 | Harvard Apparatus | 74240-2 | Mechanical ventilator used for small laboratory animals (max 5 kg). |
| Semken Forceps with Serrations (Curved) | FST | 11009-13 | Stainless steel forceps used for tissue dissection. |
| Semken Forceps with Serrations (Straight) | FST | 11008-13 | Stainless steel forceps used for tissue dissection. |
| Silky Fresh Hair removal Cream | Veet | 62200825036 | Hair removal product used to prepare the surgical site after shaving. |
| Soluprep | 3M | 103.26 | Bottled antiseptic solution tinted with 2% chlorhexidine and 70 % alcohol 225 mL. |
| Stainless steel spatula 195 mm | Heathrow Scientific | HS15907 | Spatula used as a tongue depressor during rat intubation. |
| Stereomicroscope System SZ61TR | Olympus | 88-126 | Microscope equipped with binoculars and a built-in camera allowing for video filming. |
| Sterile Sodium Chloride 0.9% Irrigation Bottle (60 mL) | Saline H2O | 25-6048SA-L | Solution used to keep the wound moist throughout the surgery. |
| Surgical Scissors - Sharp-Blunt (Straight) | FST | 14001-12 | Stainless steel scissors used to make the initial skin incision. |
| Suture 5-0 Silk No Needle | Henry Schein | 102-6344 | Silk thread used to do the constriction of the pulmonary trunk |
| Systane Ointment | Alcon | 2444062 | Eyes lubricant providing a temporary relief of burning and irritation caused by the dryness of the eyes during surgery. |
| SZ2-STU2 stereomicroscope stand | Olympus | N1198900 | The arm attached to the base provides a great freedom of movement to the microscope head. |
| Tissue forceps - 1X2 Teeth | FST | 11021-15 | Stainless steel forceps allowing to grasp, hold and manipulate tissues (skin and muscles). |
| Transpore Surgical Tape | 3M | 1527-1 | Medical tape used to immobilized the rats' forelimbs and hindlimbs. |
| Vetbond Tissue Adhesive (3 mL) | 3M | 1469SB | Surgical glue that can be applied in small amounts on the skin It can be used as a complement to subcutaneous sutures. |
| Vetergesic Multidose (0.3 mg/mL) 10 mL | Ceva Canada | 2342510 | Diluted injectable solution of buprenorphine administered as an analgesic drug. |
| Veterinary anesthesia evaporator Tec 4 | Dispomed | 34001 Iso | Enables vaporization of isoflurane and concentration at 0–5%. |
Referencias
- Cassady, S. J., Ramani, G. V. Right heart failure in pulmonary hypertension. Cardiol Clin. 38 (2), 243-255 (2020).
- Campo, A., et al. Outcomes of hospitalization for right heart failure in pulmonary arterial hypertension. Eur Respir J. 38 (2), 359-367 (2011).
- Naeije, R., Manes, A. The right ventricle in pulmonary arterial hypertension. Eur Respir Rev. 23 (134), 476-487 (2014).
- Vonk-Noordegraaf, A., et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology. J Am Coll Cardiol. 62 (25 Suppl), D22-D33 (2013).
- Olsson, K. M., Nickel, N., Tongers, J., Hoeper, M. M. Atrial flutter and fibrillation in patients with pulmonary hypertension. Int J Cardiol. 167 (5), 2300-2305 (2013).
- Mercurio, V., et al. Pulmonary arterial hypertension and atrial arrhythmias: incidence, risk factors, and clinical impact. Pulm Circ. 8 (2), 2045894018769874 (2018).
- Dignam, J. P., Scott, T., Kemp-Harper, B., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2021).
- Silva, A. L., et al. Monocrotaline induces acutely cerebrovascular lesions, astrogliosis and neuronal degeneration associated with behavior changes in rats: A model of vascular damage in perspective. Neurotoxicology. 94, 59-70 (2023).
- Hiram, R., et al. Right atrial mechanisms of atrial fibrillation in a rat model of right heart disease. J Am Coll Cardiol. 74 (10), 1332-1347 (2019).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Jalal, Z., et al. Unexpected internalization of a pulmonary artery band in a porcine model of tetralogy of Fallot. World J Pediatr Congenit Heart Surg. 8 (1), 48-54 (2017).
- Akazawa, Y., et al. Pulmonary artery banding is a relevant model to study the right ventricular remodeling and dysfunction that occurs in pulmonary arterial hypertension. J Appl Physiol. 129 (2), 238-246 (2020).
- Le Quilliec, E., et al. Atrial cardiomyocytes contribute to the inflammatory status associated with atrial fibrillation in right heart disease. Europace. 26 (4), euae082 (2024).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Cheng, T. C., Philip, J. L., Tabima, D. M., Hacker, T. A., Chesler, N. C. Multiscale structure-function relationships in right ventricular failure due to pressure overload. Am J Physiol Heart Circ Physiol. 315 (3), H699-H708 (2018).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Prihadi, E. A., et al. Morphologic types of tricuspid regurgitation. Characteristics and prognostic implications. JACC: Cardiovasc Imaging. 12 (3), 491-499 (2019).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulm Circ. 7 (3), 572-587 (2017).
- Liu, Z., et al. Low-voltage zones as the atrial fibrillation substrates: Relationship With initiation, perpetuation, and termination. Front Cardiovasc Med. 8, 705510 (2021).
- Tomasello, G., et al. Simple and fast orotracheal intubation procedure in rats. Acta Biomed. 87 (1), 13-15 (2016).
- Halațiu, V. B., Perian, M., Balan, A. I., Scridon, A. Transesophageal atrial burst pacing for atrial fibrillation induction in rats. J Vis Exp. (180), e63567 (2022).
- Prophet, E. B., Mills, B., Arrington, J. B., Sobin, L. H. . Laboratory Methods in Histotechnology. , (1992).
- Silva, J. M. A., et al. Hypertrophy of the right ventricle by pulmonary artery banding in rats: a study of structural, functional, and transcriptomics alterations in the right and left ventricles. Front Physiol. 14, 1129333 (2023).
- Camacho, P., Fan, H., Liu, Z., He, J. Q. Small mammalian animal models of heart disease. Am J Cardiovasc Dis. 6 (3), 70-80 (2016).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Ukita, R., et al. A large animal model for pulmonary hypertension and right ventricular failure: Left pulmonary artery ligation and progressive main pulmonary artery banding in sheep. J Vis Exp. (173), e62694 (2021).
- Myers, P. O., et al. Impact of age and duration of banding on left ventricular preparation before anatomic repair for congenitally corrected transposition of the great arteries. Ann Thorac Surg. 96 (2), 603-610 (2013).
- Liu, C., et al. Reverse remodeling of pulmonary arterioles after pulmonary artery banding in patients ≥ 2 years old with severe pulmonary arterial hypertension and congenital heart disease. Pediatr Cardiol. 40 (5), 958-964 (2019).
- Roy, B., Vacas, S., Ehlert, L., McCloy, K., Saggar, R., Kumar, R. Brain structural changes in patients with pulmonary arterial hypertension. J Neuroimaging. 31 (3), 524-531 (2021).
- Hiram, R. Resolution-promoting autacoids demonstrate promising cardioprotective effects against heart diseases. Mol Biol Rep. 49 (6), 5179-5197 (2022).
- Hiram, R. Cardiac cytokine therapy? Relevance of targeting inflammatory mediators to combat cardiac arrhythmogenic remodeling. Int J Cardiol Heart Vasc. 37, 100918 (2021).
- Al-U'datt, D. G. F., et al. Implications of enigmatic transglutaminase 2 (TG2) in cardiac diseases and therapeutic developments. Biochem Pharmacol. 201, 115104 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados