Avances en la tecnología de organoides bovinos mediante interfaces monocapa de intestino delgado y grueso
En este artículo
Resumen
Este estudio presenta un protocolo para la generación de monocapas 2D intestinales bovinas a partir de organoides, ofreciendo un mejor acceso para el estudio de las interacciones huésped-patógeno. Incluye métodos para evaluar la integridad y funcionalidad de la membrana, avanzando en modelos in vitro que imitan la fisiología gastrointestinal del ganado. Este enfoque promete importantes beneficios biomédicos y agrícolas, incluidas estrategias de tratamiento mejoradas.
Resumen
El avance del conocimiento de la fisiología gastrointestinal y sus enfermedades depende fundamentalmente del desarrollo de modelos in vitro precisos y específicos de cada especie que imiten fielmente los tejidos intestinales in vivo . Esto es particularmente vital para investigar las interacciones huésped-patógeno en los bovinos, que son importantes reservorios de patógenos que plantean graves riesgos para la salud pública. Los organoides 3D tradicionales ofrecen un acceso limitado a la superficie apical del epitelio intestinal, un obstáculo superado por el advenimiento de los cultivos monocapa 2D. Estos cultivos, derivados de células organoides, proporcionan una superficie luminal expuesta para un estudio más accesible. En esta investigación, se presenta un protocolo detallado para crear y mantener cultivos monocapa 2D a partir de células de organoides bovinos del intestino delgado y grueso. Este método incluye protocolos para evaluar la integridad de la membrana a través de la resistencia eléctrica transepitelial y la permeabilidad paracelular junto con técnicas de tinción inmunocitoquímica. Estos protocolos sientan las bases para establecer y caracterizar un sistema de cultivo monocapa bovina en 2D, ampliando los límites de las aplicaciones de estos métodos en la investigación biomédica y traslacional de importancia para la salud pública. El empleo de este enfoque innovador permite el desarrollo de modelos in vitro fisiológicamente pertinentes para explorar los estados normales y enfermos de la fisiología intestinal del ganado. Las implicaciones para los avances biomédicos y agrícolas son profundas, allanando el camino para tratamientos más efectivos para las dolencias intestinales en el ganado, mejorando así tanto el bienestar animal como la seguridad alimentaria.
Introducción
El cultivo de células madre epiteliales intestinales en cultivos tridimensionales (3D), conocidos como organoides intestinales, marca un avance significativo en la tecnología in vitro para investigar las funciones intestinales, la nutrición y las interacciones con patógenos 1,2. Estos organoides imitan la compleja estructura del epitelio intestinal in vivo al autorreplicarse y organizarse en formaciones 3D que abarcan varios linajes de células intestinales3. Esta característica pone de manifiesto su considerable potencial para impulsar la comprensión de la biología intestinal.
El creciente interés en la aplicación de la tecnología de organoides intestinales a los animales de granja requiere el refinamiento de las técnicas de cultivo y mantenimiento 4,5. La relevancia de esta tecnología se subraya por su impacto potencial en el estudio de la salud intestinal de los animales de granja, que desempeña un papel crítico en su productividad y, en consecuencia, en la economía de la industria animal-alimentaria al influir en el bienestar animal y los costos operativos 6,7. En concreto, el empleo de cultivos de organoides intestinales para explorar la función intestinal del ganado es de suma importancia, dado su papel como reservorios de patógenos entéricos zoonóticos, como Salmonella spp. y Escherichia coli (E. coli) O157:H78. Estos patógenos se localizan en segmentos particulares del intestino, por lo que es esencial diferenciar los métodos de cultivo de organoides intestinales por segmento intestinal para mejorar la precisión en los estudios9.
Un obstáculo importante en el estudio de los organoides intestinales es el acceso restringido a la superficie apical de la célula epitelial10. Cuando se cultivan dentro de una matriz extracelular (MEC), las células se orientan naturalmente de modo que la superficie basal mire hacia afuera y la superficie apical se dirijahacia adentro. Para abordar este desafío, se presentan métodos que implican disociar organoides 3D en células individuales y sembrarlos en insertos de cultivo celular semipermeables. Esta configuración establece una interfaz entre la superficie apical y un compartimento basolateral. Este protocolo demuestra que las células derivadas de organoides intestinales bovinos pueden formar una monocapa 2D coherente, como lo demuestran las mediciones de resistencia eléctrica transepitelial (TEER) y los ensayos de permeabilidad paracelular. Además, el desarrollo de polaridad celular con bordes en cepillo y uniones estrechas en las células monocapa 2D derivadas de organoides se confirma mediante inmunofluorescencia y microscopía electrónica, lo que refleja las propiedades del epitelio intestinal in vivo .
En este estudio, el íleon representa el tracto intestinal delgado y el recto significa el tracto intestinal grueso. Estas selecciones se basan en patógenos entéricos relevantes, como Salmonella spp., que puede translocar el íleon11, y E. coli O157:H7, que se sabe que coloniza principalmente el recto9 en el ganado. La selección de estos segmentos intestinales específicos pone de manifiesto la necesidad de adaptar los métodos de cultivo de organoides intestinales a la región intestinal para lograr precisión en la investigación. Estos métodos detallan el procedimiento para cultivar eficazmente una interfaz monocapa 2D derivada de organoides a partir de estos segmentos intestinales, proporcionando un modelo sólido para explorar la salud intestinal del ganado, las infecciones por patógenos y las interacciones entre el microbioma intestinal y el huésped.
Protocolo
Las criptas intestinales se obtuvieron a partir de muestras intestinales excedentes obtenidas en un matadero local, y la señalización de los donantes se proporciona en la Tabla Suplementaria 1. Los organoides se generaron utilizando tejidos derivados de animales que fueron sacrificados humanitariamente en un matadero, y los animales no se adquirieron únicamente para esta investigación; por lo tanto, este estudio está exento de la revisión de la IACUC y no es aplicable una declaración de ética.
1. Recubrimiento ECM en insertos de cultivo celular para el cultivo monocapa 2D derivado de organoides
NOTA: Todos los procedimientos se llevan a cabo utilizando materiales esterilizados y técnicas asépticas en una cabina de bioseguridad. Todos los reactivos se mantienen en hielo durante todo el procedimiento, a menos que se indique lo contrario.
- Prepare 100 μL de ECM para recubrir cada inserto de cultivo celular de0,33 cm2 mezclando bien el medio basal con un hidrogel a base de ECM al 2% (v/v) en un microtubo.
- Retire el inserto de cultivo celular individual del empaque con pinzas esterilizadas y colóquelo individualmente en los pocillos de una placa de cultivo celular transparente de fondo plano de 24 pocillos.
- Aplique 100 μL de recubrimiento ECM preparado en el paso 1.1 a la cámara apical de cada inserto de cultivo celular preparado en el paso 1.2.
- Vuelva a colocar la tapa e incube la placa de cultivo celular que contiene los insertos de cultivo celular recubiertos en una incubadora humidificada a 37 °C y 5% deCO2 durante 1 h.
- En el caso de las células organoides ileales, el inserto está listo para su uso después de 1 h de incubación. En el caso de las células organoides rectales, después de 1 h de incubación, se sustituya el recubrimiento de ECM por un medio de cultivo monocapa rectal e incube durante la noche (Tabla 1). Prepare insertos de cultivo celular adicionales para controles en blanco si está destinado a realizar mediciones de TEER.
| Íleon | Recto | |
| Tiempo de incubación del recubrimiento ECM | 1 h | 1 h seguido de Noche en medio de cultivo monocapa |
| Suplementación a medio de cultivo de organoides | ||
| CHIR99021 | ||
| LY2157299 | LY2157299 | |
| Y-27632 | Y-27632 | |
| Suero fetal bovino | Suero fetal bovino | |
| Densidad de siembra celular (células/pocillo) | 5 x 105 | 3 x 105 |
Tabla 1: Resumen del protocolo optimizado para la creación de monocapas 2D derivadas de organoides ileales y rectales bovinos adultos.
2. Siembra de células organoides ileales y/o rectales bovinos y cultivo monocapa 2D
NOTA: El protocolo descrito en esta sección utiliza organoides ileales y rectales bovinos, los cuales fueron cultivados y mantenidos en placas de 48 pocillos utilizando las técnicas descritas5. Para obtener resultados óptimos, se aconseja utilizar organoides mantenidos de forma estable que hayan pasado más de 3 veces después del establecimiento inicial y que se hayan cultivado durante más de 3 días después del paso más reciente.
- Sin alterar la cúpula de hidrogel basada en ECM que contiene organoides maduros, retire los medios de cultivo de organoides con una pipeta Pasteur de vidrio desechable conectada a un sistema de vacío y agregue 300 μL de solución de despolimerización de ECM helada por pocillo. Incubar durante al menos 1 h a 4 °C.
NOTA: Alternativamente, interrumpa mecánicamente el organoide que contiene la cúpula de hidrogel basada en ECM después de la adición de la solución de despolimerización de ECM y recoja la suspensión en un tubo cónico de 15 mL antes de incubar a 4 °C. Este método se recomienda cuando se cultivan simultáneamente en la misma placa organoides que no están destinados a ser utilizados para el cultivo monocapa 2D. La densidad de los cultivos de organoides influye significativamente en el número de pocillos de cultivo de organoides necesarios para una siembra óptima de los insertos de cultivo celular.- Para cultivos de organoides de alta densidad (Figura suplementaria 1A), los insertos de cultivo de células rectales utilizan una proporción de siembra en el rango de 1:1 a 1:2, lo que significa que un pocillo de cultivo puede sembrar uno o dos pocillos. Para el íleon, mantenga la proporción en 1:1. En contraste, los cultivos de menor densidad (Figura Suplementaria 1B) requieren más pocillos de cultivo; Utilice 3-4 pocillos de cultivo de organoides rectales para un inserto de cultivo de células rectales (proporción 3-4:1) y 4-5 pocillos de cultivo de organoides ileales para un inserto de cultivo de células ileales (proporción 4-5:1).
- Inspeccione visualmente la disolución completa del hidrogel a base de ECM y recoja la suspensión de organoides en un tubo cónico de 15 ml.
- Organoides en pellets por centrifugación a 200 x g y 4 °C durante 5 min. Desechar el sobrenadante. Resuspender el pellet en 1 mL de solución de enzima de disociación celular recombinante suplementada con 10 μM de Y-27632.
- Incubar la suspensión de organoide en un baño de agua a 37 °C durante 10 min con agitación intermitente de 3-5 s con un vórtice cada 2-3 min para facilitar la disociación efectiva del organoide.
- Después de la digestión enzimática, agregue 5 mL de medio basal y pipetee agresivamente con una micropipeta P1000 para interrumpir aún más los organoides a células individuales. Inspeccione la suspensión en busca de grumos de organoides y, si aún son visualmente apreciables, repita el pipeteo para mejorar la disociación de una sola célula.
- Prepare un tubo cónico de 50 mL con un filtro de células de 70 μm. Prehumedece el colador aplicando 1-2 mL de medio basal.
- Filtre la suspensión de la célula a través del filtro para eliminar los residuos de hidrogel a base de ECM y los grumos de células grandes. Enjuague el tubo original de 15 ml y el filtro de células de 70 μm con 10 ml adicionales de medio basal.
NOTA: Si la suspensión celular no pasa fácilmente a través de un colador, puede ser una indicación de disociación incompleta del organoide. Se puede intentar volver a pasar la suspensión celular recolectada a través del mismo filtro celular de 70 μm. Puede ser necesaria una alteración enzimática o mecánica adicional. - Suspensión monocelular de pellet por centrifugación a 200 x g y 4 °C durante 5 min. Retire el sobrenadante y vuelva a suspender las células con un volumen adecuado de medio basal para realizar el recuento celular.
- Cuente las células viables con un hemocitómetro después de la tinción con azul de tripán para calcular el número total de células recolectadas.
- Suspensión monocelular de pellet por centrifugación a 200 x g y 4 °C durante 5 min. Eliminar el sobrenadante y resuspender las células hasta alcanzar la densidad de siembra adecuada en el medio de cultivo monocapa respectivo (Tabla 1).
- En el caso de las células organoides ileales, resuspender las células a una concentración de 2,5 x 106 células/ml para lograr una densidad de siembra de 5 x 105 células por cultivo celular insertadas en 200 μL de medio de cultivo monocapa ileal, que es el medio de cultivo de organoides suplementado con 500 nM de LY2157299, 10 μM Y-27632 y 20% de suero fetal bovino (FBS).
- En el caso de las células organoides rectales, resuspender las células hasta una concentración de 1,5 x 106 células/ml para lograr una densidad de siembra de 3 x 105 células por cultivo celular insertar en 200 μL de medio de cultivo rectal monocapa, que es el medio de cultivo de organoides complementado con 100 nM CHIR99021, 500 nM LY2157299, 10 μM Y-27632, y el 20 por ciento de FBS.
- Recupere la placa de cultivo celular de 24 pocillos con insertos de cultivo celular recubiertos de ECM y vacíe la cámara apical del inserto de cultivo celular con una succión cuidadosa al vacío para no interrumpir el recubrimiento.
- Aplique suavemente 200 μL de suspensión unicelular preparada en el paso 2.10 a la cámara apical del inserto de cultivo celular. Para el control en blanco, añadir 200 μL de medio de cultivo sin células en la cámara apical. Para el control en blanco, añadir 200 μL de medio de cultivo sin células en la cámara apical.
- Aplique 500 μL de medio de cultivo monocapa adecuadamente suplementado (dependiendo de las células ileales frente a las rectales) en la cámara basolateral de cada pocillo.
- Incubar en una incubadora humidificada a 37 °C y 5% de CO2 para facilitar la adhesión celular y el crecimiento para formar una monocapa 2D confluente en el inserto de cultivo celular.
- Cambie los medios de cultivo en las cámaras apical y basolateral cada dos días a partir de las 48 h después de la siembra celular. Asegure el mismo tiempo de incubación para el control de la pieza en bruto y el inserto que contiene la celda.
3. Medición de TEER
NOTA: El método descrito aquí utiliza un sistema de medición manual de TEER disponible en el mercado conocido como voltohmímetro epitelial con un par de electrodos de Ag/AgCl (Figura 1A). La determinación de TEER a través de una monocapa 2D requiere la medición de pozos en blanco. Asegúrese de que la lectura en blanco se tome de la misma manera que la muestra.
- Recupere la placa que contiene insertos de cultivo celular con monocapa 2D derivada de organoides y blanco de la incubadora. Deje que el plato alcance la temperatura ambiente durante aproximadamente 10 minutos.
- Desinfecte los electrodos con etanol al 70% y deje que se sequen por completo.
- Introduzca con cuidado los electrodos con el extremo corto en la cámara apical y el extremo largo en la cámara basolateral (Figura 1A).
NOTA: Se debe tener especial precaución para no alterar la monocapa celular. - Permita que la lectura se equilibre y registre el valor en ohmios cuando se estabilice.
NOTA: La sensibilidad del voltohmímetro es tal que se producirán fluctuaciones del valor de ohmios mientras se realiza la medición de la resistencia eléctrica. Se obtiene una lectura fiable cuando las mediciones se estabilizan y se sitúan constantemente en torno a un valor de meseta. - Determine TEER de monocapa 2D con la siguiente fórmula:
TEER (Ω x cm2) = superficie de los insertos de cultivo celular (cm2) x Resistencia eléctrica neta
Donde la resistencia eléctrica neta es igual a la resistencia medida del inserto monocapa de celda menos la resistencia medida del inserto en bruto. Los insertos de cultivo celular para placas de 24 pocillos tienen una superficie de 0,33cm2.
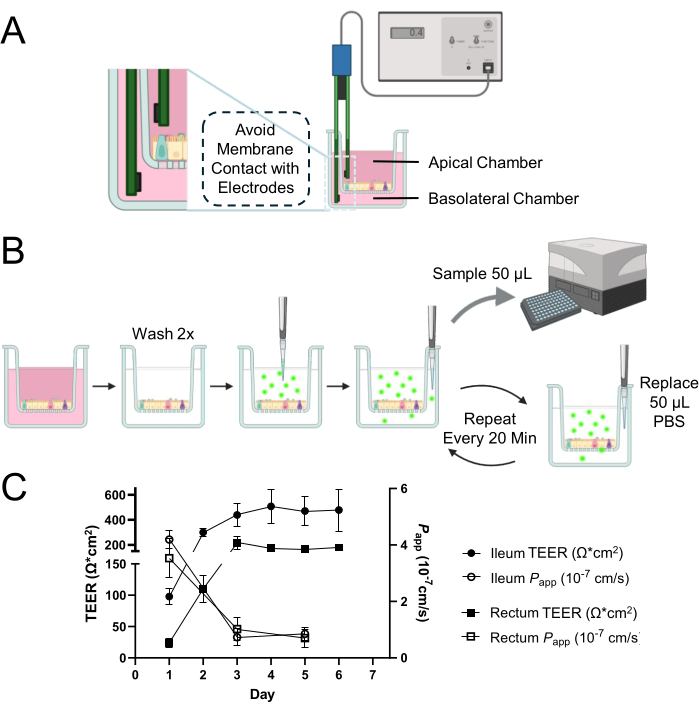
Figura 1: Evaluación de la integridad de la barrera epitelial de la monocapa 2D derivada de organoides intestinales bovinos. (A) Esquema de la posición apropiada de los electrodos dentro de las cámaras apical y basolateral de un inserto de cultivo celular para mediciones de TEER. El electrodo corto se inserta en la cámara apical y el electrodo largo se coloca en la cámara basolateral con cuidado para evitar el contacto con la membrana. (B) Esquema del proceso de ensayo de permeabilidad. Las cámaras de cultivo celular se lavan 2 veces con PBS calentado y se aplica a la cámara apical un trazador FITC-dextrano de 4 kDa de 0,5 mg/mL disuelto en PBS. Se muestrean alícuotas repetidas de 50 μL de la cámara basolateral con el reemplazo de un volumen igual de PBS para mantener el volumen total en la cámara basolateral durante todo el período de incubación. La intensidad de fluorescencia de la alícuota se mide utilizando un lector de microplacas para cuantificar la difusión del trazador FITC-dextrano de 4 kDa a través de la monocapa celular. (C) El desarrollo dinámico de la integridad de la barrera dentro de las monocapas ileales y rectales a lo largo del tiempo se evaluó utilizando mediciones de TEER (representadas por círculos cerrados para el íleon y cuadrados cerrados para el recto) y ensayos de permeabilidad (denotados por círculos abiertos para el íleon y cuadrados abiertos para el recto) con un trazador FITC-dextrano de 4 kDa. Para el día 3 de cultivo, ambos tipos de monocapas mostraron el establecimiento de barreras epiteliales estables y funcionales, como lo demuestran sus respectivos perfiles de TEER y permeabilidad. Los resultados son la media de al menos dos experimentos independientes con dos réplicas técnicas. Las barras de error representan el SEM de las mediciones. Haga clic aquí para ver una versión más grande de esta figura.
4. Ensayo de permeabilidad paracelular
NOTA: Este ensayo implica la determinación de la intensidad de fluorescencia resultante de la difusión de isotiocianato de fluoresceína (FITC)-dextrano desde la cámara apical a la cámara basolateral a través de monocapas 2D durante 120 min (Figura 1B). Para obtener resultados óptimos, se recomienda minimizar la exposición a la luz durante el ensayo y realizar mediciones en un lector de microplacas inmediatamente después de cada muestreo para evitar cualquier disminución o extinción de la fluorescencia. Cada pocillo solo se puede utilizar una vez y no se puede reutilizar en ensayos posteriores. Prepare al menos 2 pocillos para que sirvan como réplicas técnicas para cada ensayo. Por ejemplo, se necesitan un total de 6 pocillos para obtener los resultados presentados en la Figura 1C, donde los ensayos se realizaron por duplicado en 3 puntos de tiempo diferentes (días 1, 3 y 5 de cultivo).
- Prepare una serie de diluciones de curva estándar con 4 kDa de FITC-dextrano en solución salina tamponada con fosfato (PBS). Para cada dilución, pipetee 50 μL en una placa de 96 pocillos por triplicado.
NOTA: Se recomienda crear una serie de 5-7 diluciones que van de 0 a 0,5 mg/mL. - Determine la intensidad de fluorescencia de los patrones en un lector de microplacas precalibrado a una longitud de onda de excitación de 495 nm y una longitud de onda de emisión de 535 nm.
- Calcule la regresión lineal con los resultados de la intensidad de fluorescencia para crear una curva estándar.
- Recupere la placa que contiene insertos de cultivo celular con monocapas 2D derivadas de organoides de la incubadora. Retire los medios de cultivo monocapa de la cámara apical y basolateral del inserto de cultivo celular que contiene la monocapa 2D derivada de organoides que se va a evaluar.
- Lave suavemente cada cámara 2 veces con 200 μL (cámara apical) y 500 μL (cámara basolateral) de PBS precalentado, respectivamente.
- Retirar la solución de lavado de la cámara apical y aplicar 200 μL de trazador FITC-dextrano de 0,5 mg/mL de 4 kDa en PBS a la cámara apical del inserto de cultivo celular.
- Incubar en una incubadora humidificada a 37 °C y 5% de CO2 durante 20 min.
- Tome una muestra de 50 μL de la cámara basolateral de la placa incubada de 24 pocillos y transfiérala a una placa de 96 pocillos compatible con un lector de microplacas.
- Reemplace 50 μL de PBS fresco en la cámara basolateral del pocillo muestreado.
- Realice inmediatamente la medición de la intensidad de fluorescencia en un lector de microplacas precalibrado a una longitud de onda de excitación de 495 nm y una longitud de onda de emisión de 535 nm.
- Repita los pasos 4.6-4.10 cada 20 minutos hasta 120 minutos. Al final del ensayo, si se desea preservar la monocapa 2D, enjuague tanto la cámara apical como la basolateral con PBS fresco 2x, reemplácelo con medio de cultivo de monocapa fresco e incube.
NOTA: Se puede realizar una evaluación adicional de las monocapas 2D, es decir, mediciones de TEER, tinción de inmunofluorescencia, etc.; sin embargo, no se recomienda, ya que es probable que se formen trazadores fluorescentes residuales y que puedan afectar al análisis. - Determine el coeficiente de permeabilidad aparente (Papp) con la siguiente fórmula:
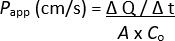
ΔQ / Δt = concentración de trazador fluorescente que ha pasado la monocapa a la cámara basolateral del inserto de cultivo celular durante el tiempo específico, medida por la intensidad de fluorescencia y extrapolada a μg/mL a través de la curva estándar
A = superficie de los insertos de cultivo celular
Co = concentración de trazador fluorescente añadido a la cámara apical del inserto de cultivo celular en μg/mL
5. Tinción por inmunofluorescencia de monocapa 2D derivada de organoides
- Retire los medios de cultivo monocapa del inserto de cultivo celular con succión al vacío y agregue 200 μL de paraformaldehído (PFA) al 4%. Incubar a temperatura ambiente durante 15-30 min para la fijación celular.
- Elimine el PFA con succión al vacío y lave con 100 μL de PBS 2x.
- Permeabilizar las células con 100 μL de Triton X-100 al 0,3% en albúmina sérica bovina (BSA) al 2% en PBS incubando a temperatura ambiente durante 10 min.
- Eliminar el sobrenadante con aspiración al vacío y lavar con 100 μL de PBS 2x.
- Retire el sobrenadante y reemplácelo con BSA al 2% en PBS e incube a temperatura ambiente durante 1 h para el bloqueo.
- Retirar el sobrenadante, aplicar 100 μL de anticuerpo primario diluido en BSA al 2% en PBS e incubar a temperatura ambiente durante 1 h, o toda la noche a 4 °C.
NOTA: Las concentraciones de anticuerpos primarios utilizados se encuentran en la Tabla de Materiales. A menos que se especifique, se siguen las recomendaciones del fabricante. - Retirar el sobrenadante y lavar con 100 μL de PBS 3x.
- Aplicar 100 μL de anticuerpo secundario diluido en BSA al 2% en PBS e incubar a temperatura ambiente durante 1 h, o toda la noche a 4 °C.
NOTA: Este paso se puede omitir si el anticuerpo primario utilizado se conjuga con una sonda de fluorescencia. Las concentraciones de anticuerpos secundarios utilizados se encuentran en la Tabla de Materiales. A menos que se especifique, se siguen las recomendaciones del fabricante. - Retirar el sobrenadante y lavar con 100 μL de PBS 3x.
- Opcional: Para la contratinción de F-actina y núcleos (DAPI), prepare mezclando ambas sondas a la dilución adecuada (según la recomendación del fabricante) en PBS, aplique 100 μL e incube a temperatura ambiente durante 30 min. Retirar el sobrenadante y lavar con 100 μL de PBS 3x.
- Corte cuidadosamente la membrana de inserto de cultivo celular con una hoja de bisturí y móntela en un portaobjetos de vidrio con una solución de montaje. Coloque una cubierta y observe.
Resultados Representativos
Este protocolo genera de forma fiable monocapas 2D robustas derivadas de organoides intestinales bovinos a partir del tracto intestinal delgado y grueso, emulando la complejidad del epitelio intestinal in vivo . Este método utiliza organoides maduros desarrollados a partir de especímenes de criptas intestinales de ganado sano cultivado en condiciones optimizadas. Curiosamente, las condiciones exitosas y repetibles para las monocapas 2D derivadas de organoides son exclusivas del segmento del intestino (Tabla 1). Esto refuerza la importancia de contar con técnicas de cultivo optimizadas para el segmento intestinal de interés.
1 día después de sembrar organoides maduros disociados en un inserto de cultivo celular, pareció formarse una monocapa 2D (Figura 2A). Sin embargo, a pesar de esta aparición inicial, las mediciones de TEER para las monocapas ileal y rectal se mantuvieron bajas en esta etapa (Figura 1C). Además, un ensayo de permeabilidad paracelular reveló que la monocapa, después de solo 1 día de cultivo, permitía el paso de un trazador FITC-dextrano de 4 kDa a través de la capa celular (Figura 1C). Al3er día de cultivo, ambos tipos de monocapas 2D derivadas de organoides mostraron una maduración significativa, evidenciada por un aumento de los valores de TEER y resistencia al trazador FITC-dextrano de 4 kDa, tendencia que continuó hasta el día 5 de cultivo.
Particularmente notable es la variabilidad entre especies, donde a pesar de los valores más bajos de TEER de los cultivos monocapa 2D derivados de organoides bovinos en relación con sus contrapartes humanas y caninas en condiciones similares 12,13,14,15, la integridad de la membrana permanece intacta. Esta conclusión se extrae de la respuesta apropiada de las monocapas en los ensayos de permeabilidad, lo que sugiere que los valores bajos de TEER en muestras bovinas no reflejan necesariamente una falta de función de barrera. Esta integridad es crucial para una barrera epitelial funcional y se demuestra de manera efectiva a través de la interpretación cuidadosa de los resultados del ensayo de permeabilidad junto con las mediciones de TEER.
Visualización de la demarcación celular y las microvellosidades bien desarrolladas en la superficie apical de las monocapas 2D con microscopía electrónica de barrido, mostrando estructuras microanatómicas especializadas, maduración reforzada de las monocapas 2D derivadas de organoides ileales y rectales (Figura 2B). Además, la tinción por inmunofluorescencia de las monocapas 2D confirmó la presencia de borde apical en cepillo, uniones de adherencia basolateral y células caliciformes productoras de moco en monocapas 2D derivadas de organoides ileales (Figura 3A) y rectales (Figura 3B). Estos resultados refuerzan que la monocapa 2D desarrollada es compleja en composición y formación, ya que no solo expresa las características clave de un epitelio intestinal intacto, sino que está compuesta por una población celular multilinaje.
El éxito del desarrollo de monocapas 2D se basa en la adherencia de las células a la MEC y en el crecimiento a la confluencia para crear una capa epitelial intacta. En particular, una distribución desigual de la MEC o condiciones subóptimas durante la incubación en el inserto de cultivo celular pueden dar lugar al desprendimiento parcial de la capa celular, especialmente notable a lo largo de sus bordes (Figura 4Ai). Este problema se agrava aún más si las células se siembran a una densidad superior a la óptima o si las células de siembra no se distribuyen uniformemente por la superficie de cultivo, un escenario que a menudo se deriva de la disociación incompleta de los organoides en una sola suspensión celular. Esta distribución desigual puede conducir a la formación de huecos dentro de la monocapa y/o a la morfogénesis 3D en un inserto de cultivo celular (Figura 4Aii). Por el contrario, la subsiembra de las células también puede dar lugar a un desarrollo de monocapa fallido o retrasado durante el período de cultivo esperado, lo que afecta inadvertidamente a la eficiencia de los estudios posteriores que utilizan el sistema de monocapa 2D (Figura 4Aiii). Además, la contaminación del sistema de cultivo también puede conducir a la formación de brechas dentro de la monocapa, interrumpiendo la monocapa confluente una vez formada en una etapa posterior del cultivo (Figura 4Aiv). Los valores sostenidos de TEER y la respuesta de permeabilidad paracelular pueden verse afectados por alteraciones en la capa celular debido a técnicas agresivas de lavado o manipulación, incluso cuando las causas potenciales de falla antes mencionadas no se habían encontrado antes de estos ensayos (Figura 4B). Por lo tanto, el manejo cuidadoso de las células y la evaluación de la formación o interrupciones de monocapas son primordiales para el desarrollo exitoso de monocapas 2D derivadas de organoides mediante la aplicación efectiva de estrategias de resolución de problemas.
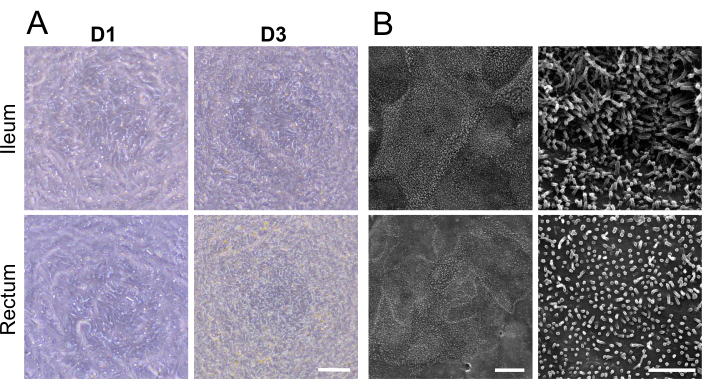
Figura 2: Caracterización microscópica de las monocapas 2D derivadas de organoides ileales y rectales bovinos. (A) Imágenes representativas de microscopía de contraste de fase de monocapas 2D en el día 1 y el día 3 (D1 y D3) de cultivo en un inserto de cultivo celular. Barra de escala = 100 μm. (B) Imágenes representativas de microscopía electrónica de barrido de monocapas 2D con aumentos menores (izquierda) y mayores (derecha). La estructura detallada de la superficie celular, incluidas las microvellosidades, se puede apreciar tanto en monocapas ileales (superior) como rectales (inferiores). Barra de escala izquierda = 10 μm, barra de escala derecha = 2 μm. Haga clic aquí para ver una versión más grande de esta figura.
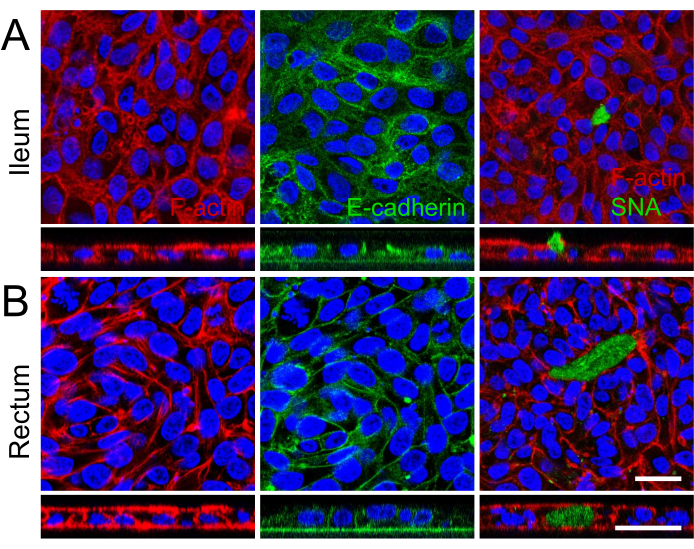
Figura 3: Caracterización por inmunofluorescencia de monocapas 2D derivadas de organoides ileales y rectales. (A, B) El panel (A) muestra el íleal y el panel (B) muestra los organoides rectales. A la izquierda, las fibras de F-actina están resaltadas con faloidina (rojo), lo que ilustra la arquitectura del citoesqueleto y la formación del borde apical en cepillo. La imagen central capta la localización basolateral de las uniones adherentes, marcadas con E-cadherina (verde), indicativa de la adhesión célula-célula y de la integridad de la monocapa. A la derecha, la presencia de células caliciformes productoras de mucina se identifica por SNA (verde), con una imagen de pila z que representa la secreción apical de mucina en la monocapa ileal. Los núcleos de todas las imágenes se contratiñeron con DAPI (azul). Además, las imágenes de la pila z en todas las imágenes demuestran aún más la formación de una sola capa celular dentro del inserto de cultivo. Barra de escala = 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
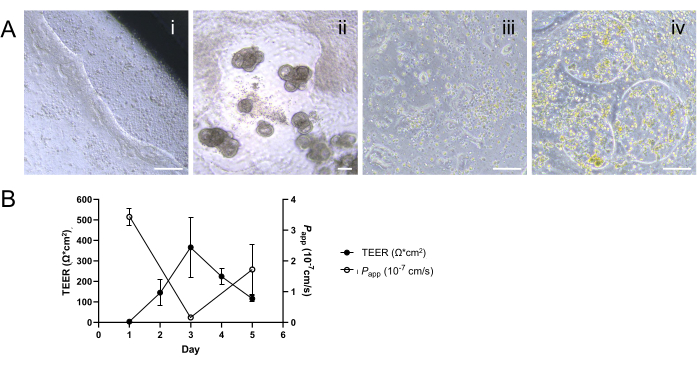
Figura 4: Caracterización de la formación de monocapas 2D subóptimas. (A) Imágenes representativas de contraste de fase que demuestren (i) el desprendimiento parcial de la monocapa a lo largo del borde del inserto de cultivo celular; (ii) el desarrollo de excrecencias 3D y la formación de brechas dentro de la monocapa; (iii) formación incompleta o tardía de monocapas debido a una densidad de siembra inferior a la óptima, observada como una adherencia irregular de las células; y (iv) formación de brechas dentro de la monocapa 2D una vez formada en una etapa posterior, probablemente como resultado de una presunta contaminación. Barras de escala = 100 μm. (B) La disminución de las mediciones de TEER junto con el aumento de los perfiles de permeabilidad después del día 3 indica una falla en el establecimiento de barreras epiteliales estables y funcionales. Los resultados se presentan como media ± error estándar de la media (SEM) de un solo experimento con dos réplicas técnicas. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Variaciones de densidad en cultivos de organoides intestinales bovinos en hidrogel basado en ECM. Organoides intestinales bovinos cultivados en un hidrogel a base de ECM; (A) alta densidad y (B) baja densidad. Barra de escala = 100 μm. Haga clic aquí para descargar este archivo.
Tabla complementaria 1: Señales resumidas de los donantes de tejidos. Haga clic aquí para descargar este archivo.
Discusión
La salud del tracto intestinal es primordial tanto para la productividad como para el bienestar general del ganado16. Aprovechando la tecnología de monocapa 2D derivada de organoides, los científicos ahora pueden imitar con mayor precisión la compleja estructura del epitelio intestinal bovino en un entorno in vitro 5. Este enfoque innovador no solo reproduce la composición celular diversa del revestimiento intestinal, incluidos sus linajes multicelulares, sino que también captura características funcionales clave, como la secreción de moco y la presencia de microvellosidades, esenciales para comprender la fisiología y la patología intestinal3. El desarrollo de protocolos de cultivo personalizados para segmentos de íleon y recto ha dado lugar a una plataforma avanzada que mejora significativamente la capacidad de estudio de la salud intestinal bovina. Este enfoque sofisticado permite investigaciones detalladas de las interacciones entre los patógenos zoonóticos y el entorno intestinal bovino. La capacidad de reproducir y estudiar de cerca los aspectos únicos del ecosistema intestinal bovino in vitro es un avance significativo hacia el desarrollo de estrategias específicas para mejorar la salud del ganado y mitigar la propagación de enfermedades zoonóticas.
Sin embargo, para garantizar el éxito del desarrollo de monocapas 2D utilizando organoides intestinales bovinos, es fundamental mantener la salud y la vitalidad tanto de los organoides como de sus células individuales disociadas. El manejo cuidadoso y la minimización del estrés son primordiales para preservar la integridad y la funcionalidad de las células, que son esenciales para el crecimiento efectivo de los organoides y la posterior creación de una monocapa funcional. Además, el logro de una monocapa uniforme depende de la disociación exitosa de los organoides en células individuales sin formar grandes grupos. Tales grupos pueden interrumpir la distribución celular y comprometer la estructura de la monocapa. Por lo tanto, es crucial emplear técnicas precisas para una disociación suave, lo que da como resultado una suspensión unicelular consistente. Además, resulta beneficioso minimizar las perturbaciones durante la adhesión celular y al lavar el exceso de células no adherentes. Este enfoque es particularmente importante para abordar posibles problemas con la morfogénesis 3D, mejorando así la calidad general de la monocapa.
Un desafío notable con los hidrogeles basados en ECM que son de origen biológico es la variación de lote a lote en la composición17. Si bien esto no se observó utilizando los protocolos y materiales descritos, las variaciones de lote a lote en la composición de ECM podrían plantear desafíos para el desarrollo exitoso de monocapas. Si la formación de la monocapa se ve comprometida cuando cambian los productos, las marcas o los números de lote de ECM, pueden ser necesarios pasos de optimización para determinar la concentración de ECM adecuada requerida para recubrir los insertos de cultivo celular.
Además, ajustar el medio de cultivo a la temperatura ambiente antes de realizar cualquier cambio es un paso crítico que ayuda a mitigar el choque térmico, proteger la salud celular y mantener la calidad de los cultivos de organoides y monocapas. Las prácticas de lavado suaves también son primordiales para mantener la integridad de la monocapa durante su formación y ensayos posteriores, y evitar interrupciones puede prevenir imprecisiones en los resultados. La sustitución de PBS por la solución salina equilibrada de Hank (HBSS) pareció útil para minimizar el desprendimiento de monocapa cuando se convirtió en un problema durante el lavado repetido o la exposición prolongada al PBS, como en los ensayos de permeabilidad paracelular. Por último, adaptar el medio de cultivo para satisfacer las necesidades específicas de las células de diferentes segmentos del tracto intestinal, como el íleon y el recto, es esencial para replicar con precisión las condiciones in vivo . Esta especificidad garantiza una salud y funcionalidad celulares óptimas, lo que facilita un modelado preciso de la fisiología intestinal del ganado y las interacciones con los patógenos, lo que pone de relieve estos pasos críticos en la investigación de organoides.
Además de emplear una práctica de manejo suave de células, el desarrollo de una buena competencia técnica asociada con el recuento de células y las mediciones de TEER es crucial para el desarrollo exitoso de una monocapa 2D funcional. Dado que tanto las densidades de siembra demasiado bajas como las demasiado altas resultantes de un recuento excesivo o insuficiente de las células, respectivamente, pueden comprometer el crecimiento de una sola capa. Se recomienda revisar cuidadosamente los recuentos de células y asegurar una densidad de siembra adecuada en ocasiones en que se sospeche que las densidades de siembra son inexactas. Además, las técnicas de medición de TEER inadecuadas pueden provocar la interrupción de la monocapa por arañazos involuntarios con los electrodos. La introducción cuidadosa de los electrodos en la cámara apical y la atención especial a mantener su orientación vertical en relación con la superficie de la membrana podría ayudar a mitigar el riesgo de daños accidentales en las monocapas.
Los métodos de ensayo de permeabilidad paracelular descritos aquí han sido adaptados de un protocolo previo18. Se realizan modificaciones al protocolo notificado, que incluyen muestreos múltiples durante 120 minutos y la sustitución de la alícuota muestreada por cantidades iguales de PBS, para mejorar la precisión y fiabilidad de los resultados. Mantener el volumen total dentro de la cámara es fundamental por varias razones: preserva el equilibrio osmótico, garantiza la integridad de la celda, mantiene el gradiente de concentración esencial para una evaluación precisa de la permeabilidad y evita alteraciones en la presión hidrostática que podrían afectar las tasas de transporte. Esta práctica de reponer la cámara basolateral con PBS fresco equivalente al volumen del PBS que contiene trazador fluorescente muestreado es fundamental para preservar estas condiciones, lo que permite evaluaciones precisas y significativas de la permeabilidad de la monocapa. El ensayo de permeabilidad paracelular sirve como complemento a la medición de TEER al evaluar el movimiento de las moléculas trazadoras a través de la monocapa directamente. Además, la comparación de los valores de TEER en varios laboratorios puede no arrojar información relevante, ya que estos valores pueden verse afectados por numerosas variables, como la temperatura y las condiciones específicas en las que se cultivan las células, incluidos los tipos de células, el número de pasos y la composición del medio de cultivo19. El ensayo de permeabilidad paracelular proporciona una evaluación funcional in vitro de la expresión efectiva de adherentes y uniones estrechas dentro de una barrera epitelial20.
Si bien el desarrollo de monocapas 2D a partir de organoides 3D representa un avance significativo en la tecnología de cultivo, es importante reconocer las limitaciones asociadas con las monocapas 2D. Un inconveniente importante es que sigue siendo un sistema de cultivo estático, que carece de la estimulación dinámica que se encuentra en el entorno in vivo . Además, la modificación del contenido de oxígeno dentro del sistema de cultivo presenta desafíos debido a su configuración abierta que involucra placas de cultivo con tapas, lo que lo hace menos adecuado para el cocultivo a largo plazo con bacterias anaeróbicas. Estas limitaciones podrían abordarse mediante la adopción de plataformas de cultivo más dinámicas, como los sistemas microfluídicos21, que ofrecen un entorno más controlado y fisiológicamente relevante. Además, es crucial reconocer que, si bien las condiciones actuales de cultivo son ricas en nutrientes beneficiosos para mantener el crecimiento de las células madre, pueden no ser óptimas para inducir la diferenciación fisiológica de las células epiteliales. Esta discrepancia pone de manifiesto la necesidad de optimización en futuras investigaciones para imitar de cerca las condiciones in vivo y apoyar el proceso de diferenciación. Al abordar estas limitaciones y refinar estos enfoques, se mejora la utilidad y aplicabilidad de las tecnologías de cultivo de organoides, acercándose a la reproducción de la compleja dinámica e interacciones del tracto gastrointestinal in vitro.
El protocolo para generar monocapas 2D a partir de tejidos ileales y rectales bovinos ofrece a los investigadores un valioso modelo in vitro de la interfaz luminal del epitelio del intestino delgado y grueso. Este modelo abre grandes posibilidades de aplicación en estudios fundamentales de nutrición animal, particularmente en el examen de cómo se absorben los nutrientes en diversas condiciones. Un área de interés notable es la investigación del síndrome del intestino permeable, caracterizado por un aumento anormal de la permeabilidad gastrointestinal, a menudo desencadenado por cambios en la dieta y temperaturas ambientales extremas22,23. Además, este modelo sirve como una herramienta esencial para explorar las complejas interacciones entre el microbioma intestinal y su huésped. Permite estudiar cómo los microorganismos comensales pueden afectar la salud del organismo huésped, abordando un aspecto crucial de la ciencia veterinaria y médica 1,24. Además, los patógenos transmitidos por los alimentos humanos se encuentran frecuentemente como comensales en diferentes segmentos del intestino del ganado 8,9,25, este protocolo permite estudios detallados de las condiciones específicas que permiten que estos agentes zoonóticos prosperen en sus respectivos nichos.
A lo largo de este estudio, se observó que las monocapas derivadas de organoides rectales e ileales requieren diferentes condiciones para un desarrollo exitoso. Específicamente, cuando las monocapas derivadas de organoides rectales se sembraron inicialmente en insertos de cultivo celular preparados con hidrogel basado en ECM al 2% en medios basales durante 1 h, se observaron grandes agujeros y desprendimiento celular. Este problema se resolvió cambiando a un medio de cultivo monocapa rectal especializado y extendiendo el período de incubación hasta toda la noche antes de la siembra, mientras que las monocapas derivadas de organoides ileales se desarrollaron con éxito utilizando un protocolo de preparación más corto. Además, la adición de CHIR99021 al medio de cultivo mejoró consistentemente el establecimiento de monocapas rectales26 , pero no fue necesaria para las monocapas ileales27. Además, las monocapas ileales requirieron una mayor densidad celular para un desarrollo exitoso en comparación con los organoides rectales27. Estas condiciones optimizadas (Tabla 1) han desarrollado repetidamente monocapas que mantienen la integridad de la barrera resistente, lo que subraya la importancia de adaptar las condiciones de cultivo al segmento intestinal específico.
El acceso a un modelo que refleje con precisión la complejidad del linaje multicelular del intestino in vivo es fundamental para estas investigaciones. Permite a los investigadores imitar de cerca las condiciones naturales del entorno intestinal, proporcionando una base más fiable para los experimentos. Con este protocolo, los investigadores están equipados con un modelo robusto que mejora sus capacidades de investigación, lo que puede conducir a descubrimientos innovadores en sus campos de estudio. Este enfoque no solo contribuye a comprender la salud y las enfermedades intestinales, sino que también ayuda en el desarrollo de estrategias para mejorar el manejo del ganado y la seguridad alimentaria.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que declarar.
Agradecimientos
Este estudio fue apoyado en parte por la Oficina del Director de los Institutos Nacionales de Salud (K01OD030515 y R21OD031903 a YMA) y la Beca de Investigación para Estudiantes Residentes y Graduados de WSU VCS (a GDD). Los autores desean agradecer al matadero participante por el suministro de ganado donante.
Materiales
| Name | Company | Catalog Number | Comments |
| Basal Medium | |||
| Advanced DMEM/F12 (1X) | Gibco | 12634-010 | n/a |
| GlutaMAX-I (100X) | Gibco | 35050-061 | 2 mM |
| HEPES (1M) | Gibco | 15630-080 | 10 mM |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | 1X |
| Organoid Culture Medium (Supplements to Basal Medium) | |||
| A-83-01 | Sigma-Aldrich | SML0788-5MG | 500 nM |
| B27 Supplement (50X) | Gibco | 17504-001 | 1X |
| [Leu15]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Murine EGF | PeproTech | 315-09-500UG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | MP Biomedicals | 194603 | 1 mM |
| N-2 MAX Media Supplement (100X) | R&D Systems | AR009 | 1X |
| Nicotinamide | Sigma-Aldrich | N0636-100G | 10 mM |
| Noggin Conditioned Medium | n/a | n/a | 10 vol/vol % |
| Primocin | InvivoGen | ant-pm-2 | 100 µg/mL |
| R-Spondin-1 Conditioned Medium | n/a | n/a | 20 vol/vol % |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Monolayer Culture Medium (Supplements to Organoid Culture Medium) | |||
| CHIR99021 | Sigma-Aldrich | SML1046-5MG | 2.5 µM |
| HI FBS | Gibco | 10438-034 | 20 vol/vol % |
| LY2157299 | Sigma-Aldrich | SML2851-5MG | 500 nM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| Reagents | |||
| Alexa Fluor 488 Mouse anti-E-cadherin | BD Biosciences | 560061 | 1:200 dilution |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | 1:400 dilution |
| BSA | Cytiva | SH30574.02 | 2 w/vol % |
| Cell Recovery Solution | Corning | 354253 | n/a |
| DAPI Solution (1 mg/mL) | Thermo Scientific | 62248 | 1:1000 dilution |
| DPBS (1X) | Gibco | 14190-144 | n/a |
| Fluorescein Isothiocyanate–Dextran | Sigma-Aldrich | FD4-100MG | 0.5 mg/mL |
| Matrigel Matrix | Corning | 354234 | n/a |
| Paraformaldehyde Solution (4%) | Thermo Scientific | J19943K2 | n/a |
| ProLong Gold antifade reagent | Invitrogen | P36930 | n/a |
| SNA, EBL, Fluorescein | Vector Laboratories | FL-1301 | 1:100 dilution |
| Triton X-100 | Thermo Scientific | A16046.AE | 0.3 vol/vol % |
| TrypLE Express | Gibco | 12605-028 | n/a |
| Trypan Blue Solution, 0.4% | VWR Life Science | K940-100ML | n/a |
| Materials and Equipment | |||
| 0.4 µm Cell Culture Insert | Falcon | 353095 | |
| 24-well Cell Culture Plate | Corning | 3524 | |
| 48-well Cell Culture Plate | Thermo Scientific | 150687 | |
| 70 µm Sterile Cell Strainer | Fisher Scientific | 22-363-548 | |
| 96-well Cell Culture Plate | Greiner Bio-One | 655086 | |
| Centrifuge | Eppendorf | 5910Ri | |
| CO2 Incubator | Thermo Scientific | 370 | |
| Epithelial Volt-Ohm Meter | Millipore | Millicell ERS-2 | |
| Hemocytometer | LW Scientific | CTL-HEMM-GLDR | |
| Inverted Confocal Microscope | Leica Microsystems | SP8-X | |
| Inverted Phase-Contrast Microscope | Leica Microsystems | DMi1 | |
| Microscope Cover Glass | Fisher Scientific | 12-540-B | |
| Microplate Reader | Molecular Devices | SpecrtraMax i3x | |
| Microscope Slides | Fisher Scientific | 22-034-486 | |
| Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| Scalpel Blade | iMed Scientific | - | #11 carbon steel |
| Vortex Mixer | Scientific Industries | SI-0236 | |
| Software | |||
| LAS X imaging software | Leica Microsystems | LAS X 3.7.6.25997 | |
| Microplate Reader software | Molecular Devces | SoftMax Pro 7.1.2 |
Referencias
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Fitzgerald, S. F., et al. Shiga toxin sub-type 2a increases the efficiency of Escherichia coli O157 transmission between animals and restricts epithelial regeneration in bovine enteroids. PLoS Pathogens. 15 (10), e1008003 (2019).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trend Mol Med. 23 (5), 393-410 (2017).
- Beaumont, M., et al. Intestinal organoids in farm animals. Vet Res. 52 (1), 33 (2021).
- Kawasaki, M., Dykstra, G. D., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Adult bovine-derived small and large intestinal organoids: In vitro development and maintenance. J Tissue Eng Regene Med. 2023, e3095002 (2023).
- Kvidera, S. K., et al. Intentionally induced intestinal barrier dysfunction causes inflammation, affects metabolism, and reduces productivity in lactating Holstein cows. J Dairy Sci. 100 (5), 4113-4127 (2017).
- Crawford, C. K., et al. Inflammatory cytokines directly disrupt the bovine intestinal epithelial barrier. Sci Rep. 12 (1), 14578 (2022).
- Heredia, N., García, S. Animals as sources of food-borne pathogens: A review. Animal Nutri. 4 (3), 250-255 (2018).
- Naylor, S. W., et al. Lymphoid follicle-dense mucosa at the terminal rectum is the principal site of colonization of enterohemorrhagic Escherichia coli O157:H7 in the bovine host. Infect Immun. 71 (3), 1505-1512 (2003).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26 (9), 2509-2520.e4 (2019).
- Pullinger, G. D., et al. Systemic translocation of Salmonella enterica Serovar Dublin in cattle occurs predominantly via efferent lymphatics in a cell-free niche and requires type III secretion system 1 (T3SS-1) but not T3SS-2. Infect Immun. 75 (11), 5191-5199 (2007).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiol Spectr. 9 (1), e0000321 (2021).
- Varani, J., McClintock, S. D., Aslam, M. N. Cell-matrix interactions contribute to barrier function in human colon organoids. Front Med. 9, 838975 (2022).
- Freire, R., et al. Human gut derived-organoids provide model to study gluten response and effects of microbiota-derived molecules in celiac disease. Sci Rep. 9, 7029 (2019).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), e0231423 (2020).
- Kogut, M. H., Arsenault, R. J. Editorial: Gut health: The new paradigm in food animal production. Front Vet Sci. 3, 71 (2016).
- Lingard, E., et al. Optimising a self-assembling peptide hydrogel as a Matrigel alternative for 3-dimensional mammary epithelial cell culture. Biomater Adv. 160, 213847 (2024).
- Turksen, K. . Permeability Barrier: Methods and Protocols. , (2011).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Frost, T. S., Jiang, L., Lynch, R. M., Zohar, Y. Permeability of epithelial/endothelial barriers in Transwells and microfluidic bilayer devices. Micromachines. 10 (8), 533 (2019).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cell Mol Gastroenterol Hepatol. 5 (4), 659 (2018).
- Sanz-Fernandez, M. V., et al. Targeting the hindgut to improve health and performance in cattle. Animals. 10 (10), 1817 (2020).
- Gressley, T. F., Hall, M. B., Armentano, L. E. Ruminant nutrition symposium: Productivity, digestion, and health responses to hindgut acidosis in ruminants. J Anim Sci. 89 (4), 1120-1130 (2011).
- O'Hara, E., Neves, A. L. A., Song, Y., Guan, L. L. The role of the gut microbiome in cattle production and health: Driver or passenger. Ann Rev Animal Biosci. 8 (2020), 199-220 (2020).
- Beach, J. C., Murano, E. A., Acuff, G. R. Prevalence of Salmonella and Campylobacter in beef cattle from transport to slaughter. J Food Protect. 65 (11), 1687-1693 (2002).
- Kawasaki, M., Ambrosini, Y. M. Accessible luminal interface of bovine rectal organoids generated from cryopreserved biopsy tissues. PLoS One. 19 (3), e0301079 (2024).
- Kawasaki, M., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Pathogen-epithelium interactions and inflammatory responses in Salmonella Dublin infections using ileal monolayer models derived from adult bovine organoids. Scientific Reports. 14 (1), 11479 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados