Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Un modelo modificado de preparación para la reperfusión de oclusión de la arteria cerebral media
En este artículo
Resumen
Este protocolo describe el proceso de preparación para la reperfusión de la oclusión de la arteria cerebral media a través de la arteria carótida común.
Resumen
El modelo de reperfusión de oclusión de la arteria cerebral media (MCAO/R) es crucial para comprender los mecanismos patológicos del accidente cerebrovascular y para el desarrollo de fármacos. Sin embargo, entre los métodos de modelado comúnmente utilizados, el método de Koizumi a menudo se enfrenta a un escrutinio debido a su ligadura de la arteria carótida común (CCA) y su incapacidad para lograr una reperfusión adecuada. Del mismo modo, el método Longa ha sido criticado por desconectar y ligar la arteria carótida externa (ECA). Este estudio tiene como objetivo introducir un método de preparación de modelos modificado que preserve la integridad del ACE, implica la inserción de una sutura de nailon monofilamento a través del CCA, la reparación de la incisión del CCA ligada y el mantenimiento de la reperfusión del CCA. La reperfusión del flujo sanguíneo se confirmó mediante imágenes de flujo de moteado láser. Los métodos de evaluación, como la escala de Longa, la puntuación de gravedad neurológica modificada, la tinción con cloruro de trifeniltetrazolio (TTC) y el marcaje con inmunofluorescencia de las neuronas, demostraron que este enfoque podría inducir daño estable del nervio isquémico. Este protocolo modelo MCAO/R modificado es simple y estable, y proporciona una valiosa orientación para los profesionales en el campo de la isquemia cerebral.
Introducción
Según la Organización Mundial de la Salud, el ictus se ha mantenido como la segunda causa de muerte en todo el mundo durante la última década, con una alta tasa de incidencia, alta mortalidad y alta tasa de discapacidad 1,2. A medida que la población mundial envejece, se espera que la incidencia de accidentes cerebrovasculares aumente en los países en desarrollo, lo que podría convertirse en la principal causa de muerte prematura y discapacidad en adultos. Además, existe una tendencia a que los accidentes cerebrovasculares ocurran a una edad más temprana de3 años. La pérdida de la fuerza de trabajo después de un accidente cerebrovascular también supone una pesada carga para las familias y la sociedad4. Por lo tanto, el desarrollo de tratamientos seguros y eficaces plantea un gran reto en la investigación del ictus.
Los modelos animales sirven como herramientas cruciales para estudiar la prevención y el tratamiento de las enfermedades humanas. El éxito de la traslación de las estrategias de tratamiento del ictus se basa en la reproducibilidad y fiabilidad de los modelos animales de ictus 5,6. La arteria cerebral media (ACM) es un sitio común para el accidente cerebrovascular clínico, lo que convierte al modelo MCAO en el modelo más cercano al accidente cerebrovascular isquémico humano. El modelo MCAO, elaborado mediante el método de sutura, ha sido favorecido por los investigadores debido a ventajas como la ausencia de craneotomía y el fácil control del tiempo de isquemia. Se ha utilizado en más del 40% de los experimentos neuroprotectores7. Sin embargo, a pesar de sus numerosas ventajas, los detalles operativos de este modelo siguen siendo un tema controvertido para muchos investigadores.
Para el modelo de oclusión de la arteria cerebral media inducida por sutura (MCAO), la reperfusión se produce mediante la retirada de la sutura. Actualmente, se utilizan dos métodos principales para la inserción de suturas: el método8 de Koizumi y el método9 de Longa. En el método de Koizumi, la sutura entra en la arteria carótida interna (ACI) principalmente a través de la incisión de la arteria carótida común (ACC), mientras que en el método de Longa, pasa a través de la arteria carótida externa (ECA) cortada a la ACI. Durante la reperfusión, el método de Koizumi requiere un ligado permanente de la incisión de la CCA y se basa en el círculo de Willis para la reperfusión10. Sin embargo, algunos estudios sugieren que la reperfusión efectiva no se puede lograr únicamente a través del suministro compensatorio del círculo de Willis después de perder el suministro de CCA. Además, el círculo de Willis exhibe una alta variabilidad anatómica, especialmente en ratones C57Bl/6, lo que aumenta la variabilidad del infarto y reduce la fiabilidad de los datos experimentales. En consecuencia, este método ha sido cada vez más cuestionado por los investigadores11.
El método de Longa consiste en insertar una sutura a través de la ECA cortada y luego ligar permanentemente la arteria carótida interna (ICA) una vez que se retira la sutura. Esto preserva la permeabilidad del CCA, lo que permite una perfusión sanguínea de hasta el 100% de los valores basales. Sin embargo, este método requiere separar la arteria carótida externa y las pequeñas ramas arteriales, cortarlas o electrocoagularlas, lo que dificulta el procedimiento. También altera la estructura completa del flujo sanguíneo del cerebro, que difiere del estado del paciente clínico12. Es importante destacar que los estudios indican que el corte o ligado del ECA puede causar lesiones isquémicas en los músculos que controlan la masticación y la deglución, afectando la dieta de los animales y provocando la muerte postoperatoria de los animales y graves daños sensoriales y motores en ratas13,14.
Por lo tanto, se necesita urgentemente un método modificado de preparación de modelos para abordar estos problemas. Este estudio presenta un método de modelado MCAO modificado que repara la incisión de inserción de CCA y logra una reperfusión efectiva. El procedimiento es simple, práctico y factible, e induce un daño neurológico significativo y lesiones de infarto replicables y proporciona una valiosa orientación para los investigadores de accidentes cerebrovasculares.
Protocolo
El protocolo experimental se llevó a cabo de acuerdo con las directrices del Comité de Uso de Animales de Laboratorio y del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Medicina Tradicional China de Chengdu (Número de registro: 2019-DL-002). Todos los datos de investigación con animales se han documentado siguiendo las directrices ARRIVE (Animal Research: Reporting In Vivo Experiments). Para este estudio se utilizaron ratas macho Sprague Dawley (SD) con un peso de 250 g ± 20 g y con edades comprendidas entre 6 y 8 semanas. Los detalles sobre los animales, los reactivos y el equipo empleado se enumeran en la Tabla de Materiales.
1. Preparación animal
- Inducir y mantener la anestesia profunda en ratas utilizando Zoletil 50 (50 mg/kg, IM) y clorhidrato de xilacina (40 mg/kg, IP). Asegúrese de que la temperatura corporal se mantenga entre 37 ± 0,5 °C utilizando una sonda rectal conectada a una almohadilla térmica durante todo el procedimiento quirúrgico. Aplica ungüento veterinario en los ojos de la rata para evitar que se sequen.
- Afeita el pelo de la cabeza y el cuello de las ratas. Use crema depilatoria para eliminar el pelo de la cabeza y el cuello, luego lave la crema con solución salina normal. Desinfecte la piel en el sitio quirúrgico aplicando etanol y povidona yodada tres veces con bolas de algodón estériles.
- Haz una incisión de 2 cm en el centro de la cabeza de la rata a lo largo de la dirección de la sutura sagital con un bisturí y retira con cuidado los músculos que cubren el cráneo.
- Adelgace el cráneo del lado isquémico de la rata con un taladro de cráneo. Use solución salina normal para enfriar y eliminar los desechos durante el proceso de molienda. Registre el flujo sanguíneo basal de las ratas mediante imágenes de contraste de moteado láser (LSCI).
- Aplique etanol y povidona yodada tres veces sobre la piel del cuello con bolas de algodón estériles. Haga una incisión de 2 cm a lo largo de la línea media del cuello con una cuchilla quirúrgica. Use retractores para retraer lateralmente la piel y las glándulas salivales, exponiendo los músculos esternocleidomastoideos y cervicales.
- Separe los músculos esternocleidomastoideo y cervical para exponer el territorio carotídeo. Identificar la anatomía vascular de la arteria carótida común (ACC), la arteria carótida interna (ACI) y la arteria carótida externa (ECA). Con base en la anatomía vascular, separar el CCA, así como el ECA derivado del CCA y el ICA15.
NOTA: La estructura anatómica de la rata indica que la región del CCA está cubierta principalmente por músculos esternocleidomastoideos y cervicales, con el ICA y el ECA derivados del CCA. Después de que la separación expone el CCA, se puede ver una bifurcación en forma de Y a lo largo del CCA, que representa el ICA y el ECA. Tenga cuidado de no dañar el nervio vago, que corre paralelo al CCA.
2. Oclusión del MCA
- Haz un nudo fácil de desenredar sobre la arteria carótida externa (ECA) y la arteria carótida común (CCA) usando un hilo de seda 3-0 para bloquear temporalmente el flujo sanguíneo. Coloque un clip de recipiente en el CCA aproximadamente a 0,5 cm del primer nudo.
- Tiñe la aguja de una jeringa de 5 ml de negro. Crea una pequeña punción en el CCA con la aguja teñida de negro y marca los agujeros de alfiler en negro.
- Inserte la sutura de nailon monofilamento en el CCA a través de la marca negra. Abra el clip vascular y guíe el alambre de nailon hacia la arteria carótida interna (ICA) hasta que se detenga con una ligera resistencia. Apriete firmemente el segundo nudo para mantener la sutura de nailon monofilamento en su lugar dentro de la arteria, evitando el desplazamiento de la posición de bloqueo.
- Anote el tiempo de isquemia en este punto y mida el valor del flujo sanguíneo en el lado isquémico usando LSCI. Administrar gotas de bupivacaína en la herida del cuello para analgesia y cierre de la herida. Retire la máscara de anestesia y permita que la rata se recupere.
NOTA: Si la sutura de nailon monofilamento tiene dificultades para entrar en el ICA, retírela ligeramente e intente la inserción de nuevo.
3. Reperfusión de MCAO
- Después de 90 min de isquemia, reanestesiar a las ratas con isoflurano. Mida el flujo sanguíneo cerebral desde el lado isquémico utilizando LSCI y asegúrese de que la sutura de nailon monofilamento no se haya desplazado.
- Desata los nudos de la arteria carótida externa (ECA) para permitir la reperfusión sanguínea. Suelte el nudo en la arteria carótida común (CCA), asegure la sutura del monofilamento y retire la sutura. Aplique una pinza vascular antes de la sutura fija de monofilamento para evitar el sangrado.
- Reemplace el primer nudo CCA con un clip vascular. Use pinzas para rotar la incisión del vaso hacia los lados (Figura 1). Pinza la incisión con pinzas y lítala con hilo 6-0 para reparar la incisión. Retire el clip vascular, verifique si hay fugas y confirme la reperfusión completa (Video 1).
NOTA: Realice la ligadura para reparar la incisión y evitar un pinzamiento excesivo de los vasos, lo que podría provocar estenosis de la CCA. - Registre los valores de flujo sanguíneo cortical cerebral utilizando LSCI después de la ligadura de incisión para confirmar la reperfusión exitosa. Cerrar la incisión del cuello con suturas y administrar 1.00.000 unidades de penicilina y 2 mL de suero fisiológico para prevenir la infección y la deshidratación.
- Mantenga el calor hasta que las ratas recuperen la conciencia. Ofrecer alimentos blandos después de la cirugía y controlar los signos vitales de los animales.
4. Evaluación de la función nerviosa y de la lesión isquémica cerebral
- Una vez que las ratas se hayan despertado por completo, su función neuronal será evaluada por investigadores que desconocen el agrupamiento de animales. Utilice la escala de puntuación de Longa (Tabla 1) y la escala de puntuación de gravedad neurológica modificada (mNSS) (Tabla 2) para evaluar la función neurológica de todas las ratas.
- Después de 24 h después de la cirugía, sacrificar a las ratas bajo anestesia inducida por isoflurano (4% de isoflurano a 4 L/min de oxígeno) a través de la luxación cervical16 (siguiendo los protocolos aprobados institucionalmente). Enjuague el cerebro con agua helada para eliminar cualquier resto de sangre.
- Divida el tejido cerebral en 5 secciones y tíñalas con TTC. Capture imágenes de ambos lados de los cortes de tejido cerebral, mida el área isquémica de los lados frontal y posterior utilizando el software Image J y calcule la tasa de infarto utilizando la siguiente fórmula:
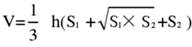
NOTA: S1 y S2 representan el área del infarto del prosencéfalo proximal y los lados del tronco encefálico proximal de los cortes de cerebro, respectivamente. El área del infarto de cada corte de cerebro se corrige utilizando la fórmula de Swanson, donde h representa el grosor del corte de cerebro. Esta fórmula, previamente esbozada por el autor en una investigación previa17, permite un cálculo más preciso del tamaño de la lesión del infarto. - Analice los datos utilizando software estadístico y gráfico para evaluar la tasa de éxito y la estabilidad del modelo.
- Emplear el método de inmunofluorescencia para marcar las neuronas corticales en ratas, validando aún más el daño neuronal causado por este método. Después de 24 h de isquemia-reperfusión en ratas, se realizó perfusión cardíaca utilizando PBS preenfriado para obtener tejido cerebral.
- Incrusta y congela el tejido cerebral en secciones. Utilice anticuerpos neuronales como el marcador neuronal inmaduro Doublecortin (DCX)18, el marcador del núcleo neuronal Neuronal Nuclei (NeuN)18 y el marcador dendrítico neuronal Proteína-2 asociada a microtúbulos (MAP-2)19. Observar la expresión de las neuronas isquémicas mediante microscopía confocal láser.
Resultados
Las imágenes de flujo de moteado láser demostraron que antes de la oclusión de la sutura de nailon monofilamento, había abundante flujo sanguíneo en el área de la arteria cerebral media (MCA), y se registraron los valores basales de flujo sanguíneo de las ratas. Después de la oclusión del MCA, el valor del flujo sanguíneo en el lado isquémico del cerebro disminuyó rápidamente. Antes de retirar la sutura, se volvieron a comprobar los valores de flujo sanguíneo en el lado isquémico para confirmar si la sutur...
Discusión
El modelo de oclusión de la arteria cerebral media (MCAO) inducida por una sutura de nailon monofilamento es el método más común utilizado para preparar modelos de MCAO. Este enfoque es ampliamente adoptado en estudios preclínicos y ha ganado el reconocimiento de muchos profesionales debido a su simplicidad, falta de necesidad de craneotomía, trauma quirúrgico mínimo y capacidad para lograr la reperfusión.
Existen dos técnicas quirúrgicas clásicas para el filamento intraluminal MCA...
Divulgaciones
Ninguno.
Agradecimientos
Este trabajo contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (82173781 y 82373835), el proyecto de investigación postdoctoral (BKS212055), el Proyecto de Innovación Científica y Tecnológica de la Oficina de Ciencia y Tecnología de Foshan (2320001007331), la Fundación de Investigación Básica y Básica Aplicada de Guangdong (2019A1515010806), los Proyectos de Campo Clave (Fabricación Inteligente) de las Universidades Generales de la Provincia de Guangdong (2020ZDZX2057) y los Proyectos de Investigación Científica (Innovación Característica) de General Universidades en la provincia de Guangdong (2019KTSCX195).
Materiales
| Name | Company | Catalog Number | Comments |
| Animal anesthesia system | Rayward Life Technology Co., Ltd | R500IE | |
| Animal temperature maintainer | Rayward Life Technology Co., Ltd | 69020 | |
| Cy3 secondary antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB21303 | |
| DAP1 antibody | Wuhan Saiweier Biotechnology Co., Ltd | G1012 | |
| DCX antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB13434 | |
| Goat serum | Beyotime Biotechnology Co., LTD | C0265 | |
| GraphPad Prism | GraphPad Software | GraphPad Prism 8.0 | |
| ImageJ | National Institutes of Health | ImageJ software | |
| Isofluran | Rayward Life Technology Co., Ltd | R510-22 | |
| Laser speckle blood flow imaging system | Rayward Life Technology Co., Ltd | PeriCam PSI NR | |
| MAP-2 antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11128 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| monofilament suture | Rayward Life Technology Co., Ltd | 250-280g | |
| NeuN antibody | Wuhan Saiweier Biotechnology Co., Ltd | GB11138 | |
| OCT embedding agent | BIOSHARP | BL557A | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| Quick Antigen Retrieval Solution for Frozen Sections | Beyotime Biotechnology Co., LTD | P0090 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 250-280g | |
| Triton X-100 | Beyotime Biotechnology Co., LTD | ST795 | |
| TTC | Chengdu Kelong Chemical Co., Ltd. | 2019030101 |
Referencias
- Paul, S., Candelario-Jalil, E. Emerging neuroprotective strategies for the treatment of ischemic stroke: An overview of clinical and preclinical studies. Exp Neurol. 335, 113518 (2021).
- Feigin, V. L., Owolabi, M. O. Pragmatic solutions to reduce the global burden of stroke: a World Stroke Organization-Lancet Neurology Commission. Lancet Neurol. 22 (12), 1160-1206 (2023).
- Putaala, J. Ischemic Stroke in Young Adults. Continuum (Minneapolis, Minn). 26 (2), 386-414 (2020).
- Girotra, T., Lekoubou, A., Bishu, K. G., Ovbiagele, B. A contemporary and comprehensive analysis of the costs of stroke in the United States. J Neurol Sci. 410, 116643 (2020).
- Howells, D. W., et al. Different strokes for different folks: The rich diversity of animal models of focal cerebral ischemia. JCBFM. 30 (8), 1412-1431 (2010).
- Matur, A. V., et al. Translating animal models of ischemic stroke to the human condition. Transl Stroke Res. 14 (6), 842-853 (2023).
- O'Collins, V. E., et al. 1,026 experimental treatments in acute stroke. Ann Neurol. 59 (3), 467-477 (2006).
- Koizumi, J., Yoshida, Y., Nakazawa, T., Ooneda, G. Experimental studies of ischemic brain edema 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Nosotchu. , 1-7 (1986).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Faber, J. E., Moore, S. M., Lucitti, J. L., Aghajanian, A., Zhang, H. Sex differences in the cerebral collateral circulation. Transl Stroke Res. 8 (3), 273-283 (2017).
- Justić, H., et al. Redefining the Koizumi model of mouse cerebral ischemia: A comparative longitudinal study of cerebral and retinal ischemia in the Koizumi and Longa middle cerebral artery occlusion models. J Cereb Blood Flow Metab. 42 (11), 2080-2094 (2022).
- Li, Y., et al. Comparison of cerebral microcirculation perfusion in rat models of middle cerebral artery occlusion prepared through common carotid artery insertion and external carotid artery insertion. CJTER. 27 (11), 1683-1691 (2023).
- Dittmar, M., Spruss, T., Schuierer, G., Horn, M. External carotid artery territory ischemia impairs outcome in the endovascular filament model of middle cerebral artery occlusion in rats. Stroke. 34 (9), 2252-2257 (2003).
- Trueman, R. C., et al. A critical re-examination of the intraluminal filament MCAO model: impact of external carotid artery transection. Transl Stroke Res. 2 (4), 651-661 (2011).
- Ziegler, K. A., et al. Local sympathetic denervation attenuates myocardial inflammation and improves cardiac function after myocardial infarction in mice. Cardiovasc Res. 114 (2), 291-299 (2018).
- Pitoulis, F. G., et al. Remodelling of adult cardiac tissue subjected to physiological and pathological mechanical load in vitro. Cardiovasc Res. 118 (3), 814-827 (2022).
- Ma, R., et al. Animal models of cerebral ischemia: A review. Biomed Pharmacother. 131, 110686 (2020).
- Belayev, L., et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke. Mol Neurobiol. 55 (8), 7090-7106 (2018).
- Guo, H., et al. Carthamin yellow improves cerebral ischemia-reperfusion injury by attenuating inflammation and ferroptosis in rats. Int J Mol Med. 47 (4), 52 (2021).
- Chia, N. H., et al. Determining the number of ischemic strokes potentially eligible for endovascular thrombectomy: a population-based study. Stroke. 47 (5), 1377-1380 (2016).
- Henninger, N., Fisher, M. Extending the time window for endovascular and pharmacological reperfusion. Transl Stroke Res. 7 (4), 284-293 (2016).
- Zhang, P. L., et al. Use of Intravenous thrombolytic therapy in acute ischemic stroke patients: evaluation of clinical outcomes. Cell Biochem Biophys. 72 (1), 11-17 (2015).
- Morris, G. P., et al. A comparative study of variables influencing ischemic injury in the Longa and Koizumi methods of intraluminal filament middle cerebral artery occlusion in mice. PLOS One. 11 (2), e0148503 (2016).
- Smith, H. K., Russell, J. M., Granger, D. N., Gavins, F. N. Critical differences between two classical surgical approaches for middle cerebral artery occlusion-induced stroke in mice. J Neurosci Methods. 249, 99-105 (2015).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Exp Neurol. 195 (2), 372-378 (2005).
- Lourbopoulos, A., et al. Inadequate food and water intake determine mortality following stroke in mice. J Cereb Blood Flow Metab. 37 (6), 2084-2097 (2017).
- Ogishima, H., et al. Ligation of the pterygopalatine and external carotid arteries induces ischemic damage in the murine retina. Invest Ophth Vis Sci. 52 (13), 9710-9720 (2011).
- Irvine, H. J., et al. Reperfusion after ischemic stroke is associated with reduced brain edema. J Cereb Blood Flow Metab. 38 (10), 1807-1817 (2018).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRx. 2 (3), 396-409 (2005).
- Dirnagl, U., Dirnagl, U. Bench to bedside: The quest for quality in experimental stroke research. J Cereb Blood Flow Metab. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: A meta-analysis. Sci Rep. 6, 21086 (2016).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Res. 997 (1), 15-23 (2004).
- Kitagawa, K., et al. Cerebral ischemia after bilateral carotid artery occlusion and intraluminal suture occlusion in mice: Evaluation of the patency of the posterior communicating artery. J Cereb Blood Flow Metab. 18 (5), 570-579 (1998).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Dis Model Mech. 10 (7), 931-938 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados