Method Article
Un modelo murino para el deterioro cognitivo vascular y la demencia basado en la estenosis bilateral asimétrica de la arteria carótida común guiada por aguja
En este artículo
Resumen
Se propone el método de aguja para la estenosis bilateral asimétrica de la arteria carótida común para crear un modelo de ratón para el deterioro cognitivo vascular y la demencia. Da lugar a resultados a largo plazo en comparación con los modelos establecidos anteriormente y es compatible con la resonancia magnética en vivo. La representación visual que demuestra el procedimiento proporciona orientación para dominar la cirugía.
Resumen
El deterioro cognitivo vascular y la demencia (VCID, por sus siglas en inglés) son el resultado de una lesión cerebral vascular. Dada la alta incidencia de VCID, que se espera que continúe aumentando a medida que la población envejece, es fundamental establecer un modelo animal sólido para la enfermedad. Este artículo presenta un método novedoso para crear un modelo de ratón de VCID que se basa en la estenosis bilateral asimétrica de la arteria carótida común, que imita la hipoperfusión cerebral crónica humana causada por la aterosclerosis carotídea.
En resumen, las arterias carótidas comunes (CCA) se ligan a agujas de diferentes calibres (32 G para la CCA derecha y 34 G para la CCA izquierda) mediante suturas de seda 7-0 seguidas de la extracción inmediata de la aguja. Los anillos de sutura restantes causan una reducción persistente del flujo sanguíneo y un deterioro cognitivo a largo plazo asociado con lesiones de la sustancia blanca, microinfartos y gliosis reactiva, imitando así de cerca la patogénesis de la VCID. Es importante destacar que, en este modelo de aguja, las representaciones clínicas no se revierten con el tiempo, lo que proporciona un deterioro cognitivo fiable a largo plazo. Además, la tasa de supervivencia a las 24 semanas después de la cirugía fue del 81,6%, que es más alta en comparación con los otros modelos establecidos de VCID con un nivel similar de reducción del flujo sanguíneo.
Las ventajas adicionales incluyen el bajo costo del material y la compatibilidad con la resonancia magnética para monitorear la lesión cerebral en animales vivos, ya que no se implanta metal. El principal desafío en el empleo del modelo de aguja de VCID es el requisito de desarrollar habilidades quirúrgicas avanzadas, ya que los CCA de ratón tienen menos de 0,6 mm de diámetro y son muy frágiles. Por lo tanto, la representación visual de alta calidad de la cirugía ayudará a los investigadores a dominar esta técnica y avanzar en nuestra comprensión de la VCID, lo que podría conducir al desarrollo de nuevas modalidades terapéuticas para disminuir el devastador deterioro cognitivo asociado con la VCID.
Introducción
El deterioro cognitivo vascular y la demencia (VCID) es la segunda causa principal de deterioro cognitivo. A pesar del innegable progreso que se ha logrado hacia la comprensión de la patogénesis de la VCID y sus factores de riesgo, el mecanismo de cómo la disfunción neurovascular contribuye al deterioro de la capacidad cognitiva sigue siendo vago. Se han establecido una serie de modelos de roedores de diversa complejidad para inducir isquemia cerebral con el fin de imitar las representaciones clínicas de la VCID1 humana. Algunos de estos modelos se basan en la creación de hipoperfusión cerebral transitoria; sin embargo, la mayoría de ellos son generados por la inducción de hipoperfusión cerebral crónica, el principal mecanismo que conduce a la VCID en pacientes humanos2.
La hipoperfusión cerebral crónica puede introducirse mediante la oclusión bilateral de la arteria carótida (BCAO), que causa resultados graves, pero a menudo mortales, o la estenosis bilateral de la arteria carótida (BCAS). El BCAS generalmente se realiza utilizando uno de dos métodos: colocando microbobinas idénticas alrededor de ambos CCA, lo que resulta en una estenosis simétrica3; o mediante la implantación de un constrictor ameroide y una microbobina alrededor de los CCA izquierdo y derecho, respectivamente, causando una oclusión gradual y una reducción del flujo sanguíneo de ~50% en los CCA izquierdo y derecho, respectivamente4. Los inconvenientes de ambos métodos son la alta tasa de mortalidad si la estenosis es demasiado grave o si el ACC está ocluido y la incompatibilidad con la resonancia magnética de animales vivos debido a la presencia de metal en el cuerpo. También se han establecido algunos modelos genéticos de ratón 1,5,6,7,8. Las opciones adicionales incluyen arteriopatía cerebral autosómica dominante con infartos subcorticales y modelos de ratón de leucoencefalopatía 9,10. Sin embargo, ninguno de los modelos propuestos imita la gama completa de daño isquémico que se presenta en pacientes humanos, por lo que continúa la búsqueda de modelos VCID actualizados.
En este trabajo se presenta un nuevo método quirúrgico para inducir estenosis bilateral asimétrica de la arteria carótida común (ABCS) en ratones, donde la estenosis de la CCA se realiza utilizando suturas de seda y se controla mediante la ligadura de CCA a agujas de varios diámetros, seguida de la extracción inmediata de la aguja11. Como resultado, los anillos de sutura de diámetros precisos se dejan permanentemente en los CCA para garantizar la estenosis crónica. El beneficio de usar ABCS sobre un método simétrico es que la hipoperfusión moderada en la derecha asegura una mejor supervivencia, mientras que la hipoperfusión más pronunciada en la izquierda asegura representaciones neurológicas y patológicas a largo plazo. Este modelo de aguja tiene varias ventajas sobre los modelos BCAS tradicionales11 , como resultados persistentes, menor mortalidad, costo ultra bajo, flexibilidad y la posibilidad de utilizar enfoques analíticos especiales.
Para profundizar en estas ventajas, tres ligaduras causan un fragmento de estenosis CCA en lugar de estenosis de punto focal, lo que conduce a hipoperfusión persistente, lesión de la sustancia blanca y deterioro cognitivo en ~ 90% de los ratones. La mortalidad de los ratones aguja fue de ~17%, menor que la del modelo 4 de restrictor ameroide/microbobinade Hattori, que tiene una mortalidad de ~30% durante 16 semanas según nuestra experiencia. Cada modelo BCAS suele costar alrededor de $ 100 debido a las costosas microbobinas o restrictores ameroides, mientras que el modelo de aguja cuesta solo alrededor de $ 1 por mouse. Además, el calibre de las agujas podría modificarse en función de los requisitos específicos de la investigación para la restricción del flujo sanguíneo en ambos lados. En la variación presentada en el presente trabajo, el modelo de aguja imita la fisiopatología de la estenosis carotídea severa, causada por estenosis permanente unilateral sin oclusión, que es la representación más común de la enfermedad en la clínica11. Además, los restrictores ameroides, y las microbobinas que se utilizan en los modelos BCAS tradicionales, están hechos de metal, lo que puede causar artefactos significativos si se realiza una resonancia magnética in vivo , aunque el metal no se implante en el cerebro sino en el pecho. Podría ser difícil predecir cómo exactamente la presencia de metal afectaría a las imágenes.
Generalmente, la resonancia magnética in vivo que se realiza después de la implantación de la microbobina suele ser una imagen anatómica simple, no adecuada para el análisis cuantitativo de múltiples agresiones, que es muy deseable para la investigación de VCID. Por el contrario, el modelo de aguja que se presenta aquí utiliza solo suturas de seda y es totalmente compatible con cualquier tipo de resonancia magnética in vivo. Esto es significativo por dos razones: (1) la resonancia magnética es extremadamente sensible a pequeñas lesiones cerebrales, microhemorragias o siderosis superficial12, por lo que se prefiere a los otros métodos de análisis, como la tomografía computarizada (2) se debe preferir la resonancia magnética in vivo a la resonancia magnética ex vivo , ya que la investigación de VCID sin duda puede beneficiarse del seguimiento de la dinámica de la progresión / curación de la lesión. especialmente en respuesta a los nuevos tratamientos propuestos. Además, se puede realizar una resonancia magnética funcional (fMRI) en el modelo de aguja para proporcionar información crítica sobre la integridad del acoplamiento neurovascular en respuesta a la hipoperfusión cerebral. Por lo tanto, la posibilidad de utilizar la resonancia magnética in vivo abre una vía para el análisis en profundidad de la intrincada correlación entre el tamaño y la ubicación de las lesiones y la función cognitiva, así como el acoplamiento neurovascular, especialmente en estudios de farmacodinámica.
Protocolo
Todos los protocolos para animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Pittsburgh y se realizaron de acuerdo con la Guía de los Institutos Nacionales de Salud para el Cuidado y Uso de Animales de Laboratorio. Las técnicas estériles deben mantenerse en todas las cirugías de supervivencia. En los experimentos presentados se utilizaron ratones machos C57BL/6J de doce semanas de edad con un peso corporal de 25-30 g.
1. Preparación de los materiales y del espacio de trabajo
- Prepare los fragmentos de aguja (~4 mm de largo; 32 G para el CCA derecho y 34 G para el CCA izquierdo). Embota ligeramente el extremo afilado de las agujas golpeando con cuidado el extremo afilado contra una superficie dura y separa cuidadosamente las agujas de las piezas de plástico con un portaagujas. Suturas de seda 7-0 precortadas en trozos de 1-2 cm de largo.
- Esterilizar los instrumentos quirúrgicos, los fragmentos de agujas y las suturas mediante autoclave o cualquier otro método apropiado.
2. Realización de la cirugía
- Pesar al ratón e inducir la anestesia colocando al ratón durante 2-3 min en una cámara ventilada con isoflurano al 3% en una mezcla de 25%O2 y 72% N2O.
- Coloque el ratón (con la ventral hacia arriba) sobre una almohadilla térmica cubierta por una lámina quirúrgica estéril para mantener una temperatura corporal constante (37 °C) y asegure una mascarilla para la ventilación con isoflurano al 1% en una mezcla de 25%O2 y 74% N2O. Asegure las extremidades del ratón con cinta adhesiva.
- Afeita el pelaje del cuello con una afeitadora eléctrica. Limpie el cabello fino con cinta adhesiva o una aspiradora de teclado.
- Desinfecte el sitio quirúrgico con Betadine Solution (10% de yodo). Desyodar la piel con etanol al 70%. Repetir la desinfección 3 veces. Asegúrese de que el nivel de anestesia sea adecuado por falta de respuesta a un pellizco firme del dedo del pie (reflejo del pie).
- Cubra el área quirúrgica. Luego, haga una incisión vertical en la línea media a lo largo de la tráquea y separe las glándulas tiroides bilaterales con micropinzas. Retire la piel y el tejido con pequeños retractores cutáneos estériles.
- Bajo el microscopio, use pinzas en ángulo para exponer cuidadosamente y diseccionar sin empalmo uno de los CCA del nervio vago y la vaina. Use agua estéril o solución salina tamponada con fosfato (PBS) para humedecer el sitio de la incisión si el CCA tiende a adherirse a las pinzas. Coloque una pequeña jeringa de plástico debajo del cuello para apoyar la postura si es necesario.
NOTA: Tenga especial cuidado de no romper el CCA. - Enhebre tres fragmentos de sutura de seda precortados (tamaño 7-0) debajo del CCA (separados por 1 mm) con pinzas en ángulo.
- Dibuje un nudo doble muy suelto alrededor del CCA en uno de los fragmentos de sutura.
NOTA: Humedecer el sitio quirúrgico y las suturas con agua estéril o PBS puede ayudar a dibujar un nudo. - Coloque un fragmento de aguja (32 G para el CCA derecho y 34 G para el CCA izquierdo) paralelo al CCA, dentro del nudo suelto (Figura 1A). Apriete con cuidado el nudo primario alrededor de la aguja y el CCA hasta que no se observe flujo sanguíneo y asegúrelo con un nudo secundario. Tire inmediatamente de la aguja para restaurar el flujo sanguíneo parcial y recortar los extremos de la sutura.
NOTA: El cirujano debe tener mucho cuidado al recortar los extremos de la sutura después de que se completen los nudos. Cortar demasiado cerca del nudo puede resultar en aflojar el nudo. Además, es fundamental observar el CCA después de retirar la aguja para asegurarse de que el flujo sanguíneo aún esté habilitado aguas abajo del nudo. Si el CCA se ve muy pálido después de la extracción de la aguja, significa que el CCA está sobrecomprimido. - Repita los pasos 2.8-2.9 para la2.ª y3.ª roscas de sutura en el mismo CCA, aproximadamente a 1 mm de distancia entre sí (Figura 1B).
- Repita los pasos 2.6-2.10 con el CCA opuesto utilizando un fragmento de aguja de 32 G.
- Examine cuidadosamente si ambos CCA están ligados de manera eficiente: confirme que las tres bandas de sutura estén bien anudadas en su lugar, pero no estén tan apretadas como para bloquear completamente el flujo sanguíneo (verifique que los CCA no estén pálidos aguas abajo de los nudos). Compruebe que las tres bandas de sutura de cada CCA estén separadas aproximadamente 1 mm entre sí.
- Cierre la piel con suturas de monofilamento estériles.
- Inmediatamente después de la cirugía, inyecte 100-150 μL de ketoprofeno (1 mg/mL de stock; 5 mg/kg de peso corporal) por vía intraperitoneal para aliviar el dolor postoperatorio. Repita esta inyección 24 h y 48 h después de la cirugía.
- Coloque el ratón sobre una manta homeotérmica a 37 °C para un seguimiento continuo durante 2 h antes de devolver el animal al animalario.
NOTA: Para el procedimiento simulado, se deben omitir los pasos 2.7-2.12.
3. Validación del modelo
NOTA: La lesión cerebral se analizó con resonancia magnética in vivo y se verificó con tinción de azul rápido de Luxol (LFB) y pruebas de comportamiento.
- Imágenes de la perfusión sanguínea cerebral.
- Anestesiar al ratón con isoflurano al 1-1,5%. Esterilizar el sitio quirúrgico con Betadine Solution (10% de yodo). A continuación, desyodar la piel con etanol al 70%.
- Asegure el cráneo del animal en un marco estereotáctico. Hacer una incisión sagital en la línea media del cuero cabelludo desde el hueso frontal hasta el occipital para exponer el cráneo y limpiar la superficie del cráneo con solución salina estéril.
- Coloque una cámara de dispositivo de acoplamiento cargado a 10 cm por encima del cráneo utilizando un sistema de moteado láser bidimensional. Coloque un soporte de sonda sobre el sitio de la craniectomía y asegúrelo firmemente.
- Tome imágenes de perfusión sanguínea 5 minutos antes de la cirugía e inmediatamente después de la liberación de la aguja o 7, 14, 21, 28, 35 y 42 días después de la cirugía.
- Cierre la piel con suturas de monofilamento estériles. Inyectar 100-150 μL de ketoprofeno (1 mg/mL de stock; 5 mg/kg de peso corporal) por vía intraperitoneal para aliviar el dolor postoperatorio. Repita esta inyección 24 h y 48 h.
- In vivo MRI
- Anestesiar a los ratones con isoflurano al 1-1,5%, con monitorización continua de la respiración y mantenimiento de la temperatura a 37 °C con aire caliente durante la adquisición de la imagen.
- Realice una resonancia magnética in vivo utilizando un escáner de 9,4T, una bobina Tx de 86 mm y un conjunto de receptores cerebrales de ratón de 4 canales, ejecutando el software asociado. Después de los escaneos piloto y de posicionamiento, adquiera imágenes ponderadas en T2 (T2WI) utilizando una secuencia de adquisición rápida con mejora de la relajación (RARE), con los siguientes parámetros: Tiempo de eco/Tiempo de repetición (TE/TR) = 40/4.000 ms, medias = 8.256 × matriz 256, 16 cortes con un grosor de corte de 0,5 mm, un factor RARE = 4 y un campo de visión (FOV) de 20 x 20 mm.
- Recopile datos de imágenes de tensor de difusión (DTI) utilizando una secuencia de imágenes de imagen de eco planar (EPI)-DTI utilizando la misma geometría y parámetros que el T2WI con las siguientes excepciones: TR/TE = 2.300/22 ms, matriz de adquisición = 128 x 128, 2 segmentos, 5 imágenes A0 y 30 imágenes de difusión no colineales, Δ/δ = 10/3 ms y un valor b = 1.000 s/mm2.
- Analice los datos DTI utilizando el software DSI Studio (http://dsistudio.labsolver.org/), buscando diferencias en los parámetros escalares de difusión (anisotropía fraccional (FA), difusividad media (MD), difusividad axial (AD) y difusividad radial (RD)). Dibuje regiones de interés (ROI) para el cuerpo calloso (CC), la cápsula externa (EC), la cápsula interna (IC), la fimbra, la comisura anterior (AC), el cíngulo (Cing), el hipocampo (hipopótamo), la corteza (C) y el cuerpo estriado (Str) de ambos hemisferios.
- Tinción con azul rápido de Luxol (LFB)
- Prepare secciones cerebrales: fije el cerebro con PFA al 4% durante 24 horas y luego sumerja el cerebro en sacarosa al 30% hasta que el cerebro se hunda. Incrustar el cerebro en un compuesto OCT sobre hielo seco. Corte una rebanada de cerebro coronal de 20 μm de grosor en un micrótomo deslizante. Guarde los trozos de cerebro en una solución de almacenamiento (30% de glicerol/30% de etilenglicol en PBS).
- Sumerja las secciones del cerebro en LFB (solución de alcohol al 0,1%), manténgalas a 56 °C durante la noche y lávelas con agua destilada.
- Incubar secciones de cerebro en carbonato de litio al 0,05% y deshidratar a través de alcoholes graduados.
- Teñir las secciones con violeta de cresilo al 0,5% durante 5 min, diferenciado con etanol al 70%.
- Monte las secciones del cerebro teñidas con medio de montaje.
- Evaluación de la función cognitiva con una prueba de laberinto acuático de Morris modificada
- Llene un tanque circular con agua (25 oC, profundidad 33 cm) y sumerja una plataforma cuadrada de plexiglás de ~ 10 x 10 cm2 a 1,2 cm por debajo del nivel del agua, a 31 cm del borde norte, este, sur u oeste de la piscina.
NOTA: Esta plataforma debe permanecer en el mismo lugar durante toda la duración de la prueba. - Encienda una cámara de video montada en el techo. Coloque un ratón en el tanque (no lo suelte al nivel del agua), mirando hacia la pared y comenzando en el noreste, sureste, suroeste o noroeste. Permita que el ratón nade durante un máximo de 90 segundos para encontrar una plataforma sumergida.
- Permita que el ratón permanezca en la plataforma sumergida durante 30 segundos si se encuentra la plataforma. Si no se encuentra la plataforma, coloque el ratón allí durante 30 s.
- Deje que el ratón descanse durante 5 minutos y repita la prueba de natación (pasos 3.4.2 - 3.4.3) 2 veces.
- Seca al ratón con un trozo de tela y devuélvelo a su jaula debajo de una bombilla calefactora.
- Repita tres pruebas de natación todos los días durante 5 días consecutivos.
- Con secuencias de vídeo, calcule la latencia para escapar (cuánto tiempo se tarda en encontrar la plataforma en cada prueba).
- El último día de prueba, retire la plataforma y registre el tiempo que el mouse pasa en el cuadrante donde se encontraba anteriormente la plataforma.
- Llene un tanque circular con agua (25 oC, profundidad 33 cm) y sumerja una plataforma cuadrada de plexiglás de ~ 10 x 10 cm2 a 1,2 cm por debajo del nivel del agua, a 31 cm del borde norte, este, sur u oeste de la piscina.
Resultados
Hipoperfusión cerebral asimétrica a largo plazo
El flujo sanguíneo del CCA se midió antes e inmediatamente después de la liberación de la aguja de la última (tercera) ligadura, como se describió anteriormente11. El flujo sanguíneo se redujo en ~70% en el CCA izquierdo y ~50% en el CCA derecho. La perfusión sanguínea cerebral se monitorizó dinámicamente mediante un rayado láser bidimensional. La cirugía provocó hipoperfusión cerebral en ambos hemisferios, siendo el hemisferio izquierdo el más afectado (Figura 2). La hipoperfusión cerebral se mantiene durante al menos 24 semanas después de la cirugía11.
Menor mortalidad
La tasa de supervivencia de los ratones macho durante 6 semanas fue del 81,6% (Figura 3); Los ratones eran más propensos a morir en la primera semana después de la cirugía.
Detección de lesiones cerebrales por resonancia magnética in vivo
Las imágenes ponderadas en T2 revelaron regiones hipo o hiperintensas en el hipocampo (Hippo), la cápsula externa (EC), la cápsula interna (IC), el cuerpo calloso (CC) y el cuerpo estriado (Str) en ratones sometidos a cirugía ABCS, lo que indica lesión cerebral (Figura 4A). Se observó daño estructural en los mapas de color codificados direccionalmente (DEC) de DTI de ratones ABCS cuando se compararon con el simulado (Figura 4B).
Los análisis cuantitativos mostraron que los ratones ABCS mostraron una anisotropía fraccional (FA) significativamente menor en hipopótamo izquierdo, IC, comisura anterior (AC), cíngulo (Cg) y Fimbria (Fi) en comparación con sham (P < 0,05 versus sham), lo que indica un compromiso de la microestructura de la sustancia blanca en el hemisferio izquierdo (panel superior izquierdo, Figura 4C). También se redujeron los AG en el Cg derecho y el Fi en ratones ABCS (P < 0,05 frente a los simulados). Los AG en el IC y Fi izquierdos fueron significativamente más bajos que los del derecho en los ratones ABCS (P < 0,05, izquierda versus derecha).
De manera similar, se exhibió una difusividad axial (DA) significativamente menor en la EC, IC, Str y Fi izquierdas en ratones ABCS en comparación con sham, lo que sugiere lesión axonal (panel superior derecho, Figura 4C (P < 0.05 versus sham)). Solo el Str izquierdo mostró una reducción de la difusividad media (MD) en los ratones ABCS en comparación con los simulados (panel inferior izquierdo, Figura 4C). Se observó diferencia en la difusividad radial (RD) en CC, Str y Fi izquierdos en ratones ABCS (panel inferior derecho, Figura 4C), lo que sugiere inflamación y aumento de la celularidad en estas regiones13.
Lesión cerebral asimétrica en los dos hemisferios y daño en las regiones de la sustancia blanca en el hemisferio izquierdo
El daño encefálico se analizó adicionalmente con tinción de LFB mediante el procedimiento descrito anteriormente14 (Figura 5). Las imágenes de menor potencia mostraron tinción azul más clara en EC y Str, lo que sugiere desmielinización en estas regiones. Las imágenes de alta definición mostraron que los ratones simulados mostraban axones bien organizados y mielinizados con oligodendrocitos orientados linealmente en la CE; sin embargo, los axones desaparecieron y se observaron células penetrantes teñidas de azul en EC en ratones ABCS. Los ratones simulados mostraron estructuras de haces de fibras bien organizadas y teñidas de azul profundo en Str. Sin embargo, los haces de fibras se tiñeron más claros y pequeños, y su integridad se vio comprometida; algunos haces de fibras fueron vacuolados en ratones ABCS. Los haces de fibras se distorsionaron y la matriz entre haces se engrosó significativamente en AC en ratones ABCS. En resumen, la cirugía ABCS causa desmielinización y daño axonal; El daño de la sustancia blanca ocurre principalmente en el hemisferio izquierdo.
Disfunción del aprendizaje y la memoria
La cirugía con aguja ABCS resultó en una discapacidad de aprendizaje significativa, como lo indica un mayor tiempo para encontrar una plataforma sumergida (latencia para escapar) durante una prueba de laberinto acuático de Morris (Figura 6). Esta discapacidad se mantuvo durante al menos 24 semanas después de la cirugía. La memoria también se vio significativamente afectada, como lo indica una disminución del tiempo que se pasa en el cuadrante objetivo después de que se retiró la plataforma.
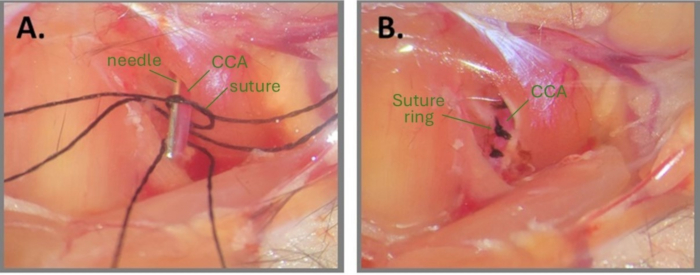
Figura 1: Pasos de la cirugía con aguja para crear el ABCS. (A) El CCA izquierdo está expuesto y se enhebran tres suturas de seda debajo del CCA. Se dibuja un nudo suelto en uno de los fragmentos de sutura y la aguja se coloca paralela al CCA. (B) Tres anillos de sutura están colocados aproximadamente a 1 mm de distancia. Abreviaturas: ABCS = estenosis bilateral asimétrica de la arteria carótida común; CCA = arteria carótida común. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Hipoperfusión cerebral asimétrica persistente en el modelo ABCS con aguja. Monitorización dinámica del flujo sanguíneo cerebral después de la cirugía. Se observa hipoperfusión cerebral persistente en ambos hemisferios, siendo más profunda en el izquierdo. Los asteriscos negros indican regiones de hipoperfusión. Abreviatura: ABCS = estenosis bilateral asimétrica de la arteria carótida común. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Tasa de supervivencia después de la cirugía ABCS con aguja. La cirugía resultó en una tasa de supervivencia del 81,6% durante 6 semanas; La muerte ocurrió principalmente durante la primera semana postoperatoria. Abreviatura: ABCS = estenosis bilateral asimétrica de la arteria carótida común. Haga clic aquí para ver una versión más grande de esta figura.
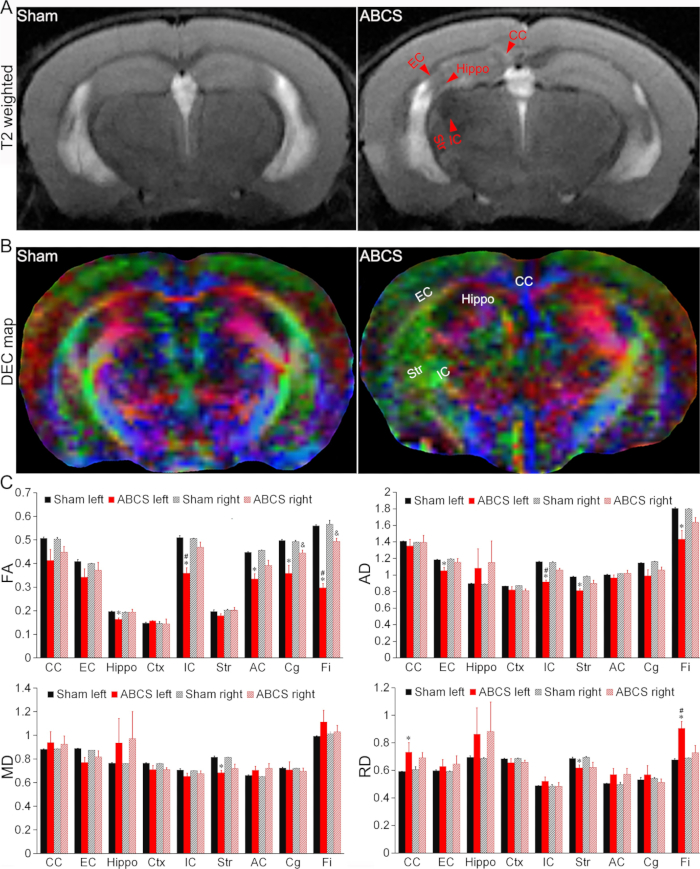
Figura 4: Detección in vivo de lesiones cerebrales en resonancia magnética en el modelo ABCS con aguja. (A) Imágenes representativas ponderadas en T2 de ratones simulados y ABCS. Las puntas de flecha rojas indican regiones hipo o hiperintensas. (B) Mapa representativo de DEC de DTI in vivo 2 semanas después de la cirugía ABCS con aguja. Los colores indican la direccionalidad del eje principal de difusión (rojo = izquierda/derecha, verde = dorsal/ventral y azul = rostral/caudal). (C) Análisis cuantitativo en ratones simulados y ABCS (ANOVA de una vía). * representa p < 0,05 ABCS frente a sham (hemisferio izquierdo). # representa p < 0,05 a la izquierda frente a la derecha. y representa p < 0.05 ABCS versus simulado (hemisferio derecho). Los datos se presentan como media ± SEM; n = 4 para simulación, n = 4 para ratones ABCS. Abreviaturas: ABCS = estenosis bilateral asimétrica de la arteria carótida común; Hipopótamo = hipocampo; EC = cápsula externa; IC = cápsula interna; CC = cuerpo calloso; Str = cuerpo estriado; DEC = color codificado direccionalmente; DTI = imágenes de tensor de difusión; FA = anisotropía fraccional; MD = difusividad media; AD = difusividad axial; RD = difusividad radial. Haga clic aquí para ver una versión más grande de esta figura.
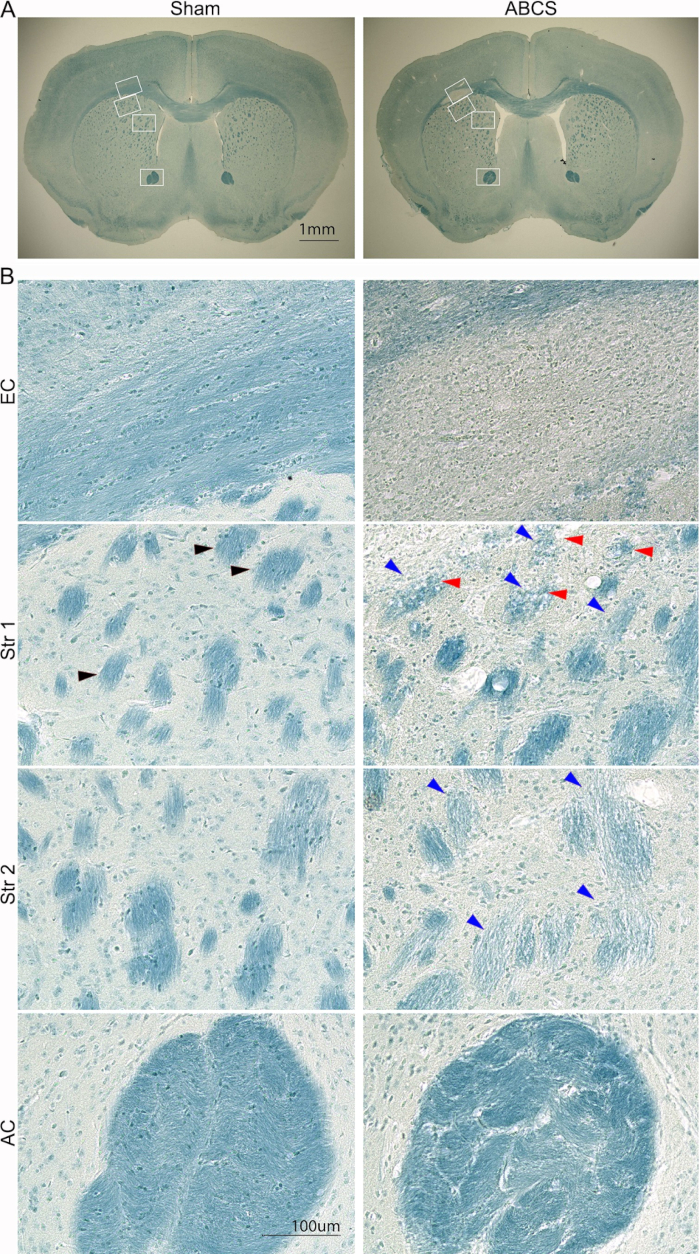
Figura 5: Tinción representativa de LFB de cortes de cerebro 6 semanas después de la cirugía con aguja ABCS. (A) Imágenes de baja potencia de tinción de LFB de ratones simulados y ABCS. Los cuadros blancos denotan la ubicación correspondiente a las imágenes de mayor definición en B. (B) Imágenes de alta definición (200x) de EC (panel superior) y Str ubicaciones 1 y 2 (panel central) y AC (panel inferior). La punta de flecha negra muestra un haz de fibras normal. Las puntas de flecha azules apuntan a un haz de fibras dañado. Las puntas de flecha rojas denotan fibras vacuoladas. Barras de escala = 1 mm (A), 100 μm (B). Abreviaturas: ABCS = estenosis bilateral asimétrica de la arteria carótida común; LFB = Luxol azul rápido; EC = cápsula externa; Str = cuerpo estriado; AC = comisura anterior. Haga clic aquí para ver una versión más grande de esta figura.
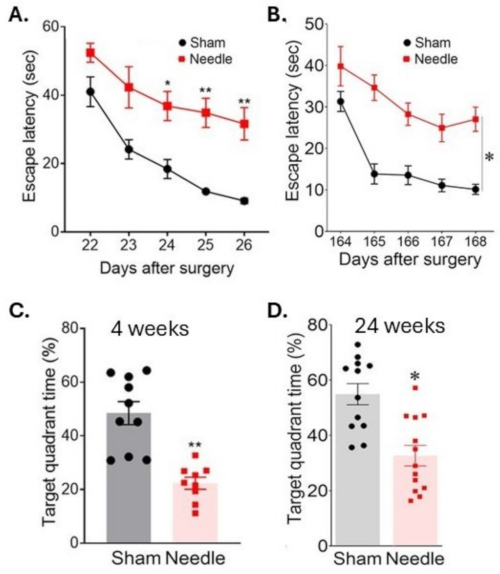
Figura 6: Aprendizaje espacial y evaluación de la memoria en la prueba del laberinto acuático. El aprendizaje espacial se evaluó (A) a las 3 semanas y (B) a las 24 semanas después de la cirugía, midiendo el tiempo para localizar la plataforma en días consecutivos. La memoria se evaluó (C) 4 semanas y (D) 24 semanas después de la cirugía midiendo el tiempo de permanencia en el cuadrante objetivo después de que se retiró la plataforma. La cirugía resultó en una interrupción a largo plazo de las funciones cognitivas. Los datos se expresaron como media ± SEM, *p < 0,05 aguja versus simulada; **p < 0,01 frente a la simulación; ANOVA de dos vías y post hoc de Neuman-Keuls. n = 10 para simulación, n = 10 para grupos de agujas. Esta figura ha sido modificada con respecto a Weng et al.11. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Se han descrito varios métodos de inducción de VCID utilizando estenosis asimétrica de CCA, y todos ellos comparten un paso quirúrgico importante y crítico: el aislamiento de la CCA del nervio vago y la vaina y la exposición de la CCA para hacerla accesible para la estenosis. Si bien proporcionamos orientación visual de buena calidad sobre la exposición quirúrgica de los ACC antes de la ligadura, también nos gustaría indicar a los investigadores que vean videos adicionales sobre el aislamiento de CCA que están disponibles en línea en el contexto de otras cirugías con ratones y ratas 15,16,17,18. Se debe tener especial cuidado de no comprimir o romper el CCA, ya que es la arteria principal que suministra sangre oxigenada al cerebro.
Otro paso crítico de la cirugía que debe dominarse es dibujar un nudo suelto y apretarlo aún más alrededor de la CCA con la aguja, seguido de la extracción de la aguja. Recomendamos encarecidamente practicar este paso solo con la aguja antes de intentar realizarlo en un ratón anestesiado. Esto permitirá dominar los delicados movimientos de las pinzas y perfeccionar las manipulaciones con las suturas sin riesgo de lastimar al ratón. El nudo debe estar bien asegurado sin desmoronarse durante la extracción de la aguja, lo suficientemente apretado para sujetar la aguja pero lo suficientemente suelto como para permitir el deslizamiento de la aguja lejos de la sutura anudada con pinzas.
Es importante destacar que encontramos que una sola ligadura de cada ACC no es suficiente para disminuir de manera confiable el flujo sanguíneo y mantener la hipoperfusión cerebral a largo plazo11. Una posible explicación podría ser que una sola ligadura causa estenosis puntual, que probablemente cause un aumento local de la presión, lo que lleva a un aumento de la velocidad del flujo sanguíneo para compensar la reducción del flujo sanguíneo. Recomendamos realizar tres ligaduras a ~1 mm de distancia entre sí para crear un fragmento de estenosis. Un beneficio adicional de usar tres ligaduras es que los nudos sirven como mecanismo de prueba en caso de que uno de los nudos se afloje durante la extracción adicional de la aguja. De hecho, un fragmento de estenosis causado por tres ligaduras separadas del mismo CCA aumenta la consistencia del modelo, lo que conduce a una hipoperfusión cerebral persistente en aproximadamente el 90% de los ratones. Además, la estenosis de fragmentos imita con mayor precisión la estenosis de CCA causada por aterosclerosis en pacientes humanos en comparación con la estenosis de punto focal, lo que aumenta la relevancia clínica del modelo de aguja.
Recomendamos encarecidamente retirar la aguja inmediatamente después de terminar la primera ligadura para asegurarse de que el flujo sanguíneo de CCA se recupere parcialmente, y solo luego pasar a la segunda y tercera ligaduras secuencialmente. No se recomienda terminar las tres ligaduras con la aguja dentro de los tres nudos, ya que esto aumentaría significativamente el tiempo de obstrucción completa del flujo sanguíneo. Por lo general, no recomendamos más de 1 minuto de oclusión completa de CCA antes de retirar la aguja. Esta recomendación se basa en el informe de que los ratones no mostraron signos de deterioro funcional después de 3 sesiones de 60 s de oclusión de ambos CCA19. En nuestro modelo, el cirujano trabaja en un ACC a la vez, lo que es más indulgente que la oclusión de ambos ACC simultáneamente, pero aún así recomendamos seguir esta línea de tiempo para excluir cualquier artefacto causado por una oclusión prolongada en lugar de hipoperfusión crónica en cualquiera de los lados.
Si bien este modelo de aguja permite ajustar los diámetros de las suturas anudadas mediante el uso de agujas de varios diámetros (según el peso corporal o los requisitos específicos de restricción del flujo sanguíneo), en nuestra experiencia, los ratones tuvieron tasas de supervivencia más altas cuando la hipoperfusión en el hemisferio derecho fue moderada en lugar de grave. Por otro lado, la hipoperfusión severa persistente en el hemisferio izquierdo produjo resultados patológicos y neurológicos a largo plazo. Por lo tanto, recomendamos realizar una ligadura asimétrica mediante el uso de una aguja más gruesa para ligar el ACC derecho (causando hipoperfusión moderada en el hemisferio derecho) y una aguja más delgada para ligar el CCA izquierdo (causando hipoperfusión severa en el hemisferio izquierdo).
Por último, los investigadores deben tener en cuenta que diferentes cepas de ratón pueden producir diferentes resultados a partir de la agresión isquémica o traumática, principalmente debido a las diferencias en la anatomía vascular cerebral20,21. Dado que hoy en día muchos estudios requieren la generación de nuevos ratones transgénicos, la cepa de fondo debe considerarse cuidadosamente si se requiere cirugía de BCAO en cualquier etapa del diseño experimental. Por ejemplo, las cepas C57BL/6 y SV129 son una opción de fondo común para la generación de animales transgénicos para la investigación del ictus21. Sin embargo, está bien documentado que los ratones C57BL/6 son mucho más sensibles a la isquemia en comparación con las otras cepas analizadas, incluidos los ratones SV129 20,21. De hecho, hay evidencia de que el efecto de la cepa murina puede ser incluso más importante que el efecto de la técnica utilizada para inducir VCID21. Por lo tanto, se vuelve de vital importancia mantener los fondos de los ratones consistentes a lo largo de todos los experimentos que involucran la inducción de lesiones cerebrales isquémicas en roedores. Es importante destacar que los investigadores pueden evaluar la eficiencia del resultado de la cirugía en animales vivos utilizando sistemas de puntuación neurológica22 con una puntuación de 0,5 como criterio de inclusión. La lesión cerebral puede confirmarse aún más mediante la inmunotinción Iba1, que es muy sensible al daño cerebral incluso después de una lesión focal menor.
En resumen, es importante recordar que la VCI es un término complejo que reúne muchas representaciones clínicas y causas bajo un mismo paraguas. Por lo tanto, los investigadores siempre deben tener en cuenta qué modelo debe seleccionarse en función de los aspectos de VCI que les gustaría estudiar. Nunca puede haber un único modelo universal para todas las manifestaciones de VCI. Los modelos de estenosis CCA limitan severamente el flujo sanguíneo de las arterias principales, imitando así a los pacientes con estenosis arteriosclerótica. El novedoso método de aguja para crear BCAS asimétricos en ratones C57BL/6J es un método fiable para imitar la VCID que ofrece varias ventajas sobre los métodos informados anteriormente (especialmente alta flexibilidad, baja mortalidad, resultados a largo plazo, coste mínimo y monitorización de la resonancia magnética en directo). Debido a sus ventajas sobre los otros modelos, se puede utilizar para avanzar aún más en nuestro conocimiento de la progresión de la VCID, así como para servir como base para el cribado de posibles agentes terapéuticos para curar o retrasar la progresión de la VCID. Al igual que otros métodos reportados de BCAS, el modelo de aguja requiere habilidades quirúrgicas avanzadas que se pueden dominar con el tiempo, utilizando esta demostración visual como guía.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este proyecto contó con el apoyo de las subvenciones de los Institutos Nacionales de Salud/NINDS RF1NS117509 (G. Cao) y las subvenciones de Revisión al Mérito del VA BX003923 y BX006454 (G. Cao).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
Referencias
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49 (2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92 (2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472 (2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124 (2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados