Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Procedimientos de Operación y Biocontención de una Instalación para Ratones de Laboratorio con un Microbioma Natural: Procedimiento de Inmunofenotipado
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, describimos la estructura y los procedimientos operativos, incluidas las medidas de contención microbiana de una instalación para "ratones salvajes" utilizando como ejemplo la toma de muestras de sangre para el inmunofenotipado.
Resumen
El uso de ratones de laboratorio con un microbioma natural, como los "ratones salvajes", ofrece una herramienta de investigación prometedora tanto para la ciencia básica como para la aplicada debido a su gran parecido con el superorganismo humano. Sin embargo, la cría y el mantenimiento de estos ratones, que albergan un microbioma diverso que incluye bacterias, virus y parásitos, plantean desafíos significativos para las instalaciones de cría de animales en las instituciones de investigación. Para hacer frente a estos desafíos, se desarrolló un concepto de instalación especializada para albergar "ratones salvajes" en Charité - Universitätsmedizin Berlin. Este enfoque implicó diseñar una instalación con características estructurales y protocolos operativos específicos para contener de manera efectiva el microbioma natural, protegiendo así las áreas con estándares de higiene más altos.
Se demuestra una metodología para la toma de muestras de sangre de ratones libres de patógenos especificados (SPF) y "ratones salvajes" para el inmunofenotipado, destacando el flujo de trabajo y las medidas de biocontención implementadas en la instalación. Los resultados notables revelan que los "ratones salvajes" expuestos a un microbioma natural desarrollan distintas poblaciones de células inmunitarias, que se reducen significativamente en los ratones criados y mantenidos bajo estrictas condiciones de higiene.
La importancia de este estudio radica en su potencial para proporcionar a los investigadores acceso a ratones que poseen un microbioma natural y un sistema inmunológico maduro similar al de los adultos humanos. Este enfoque podría mejorar la traducibilidad de los hallazgos preclínicos a la práctica clínica, avanzando así en el campo de la investigación biomédica.
Introducción
La experimentación con ratones sigue siendo indispensable en la ciencia básica y aplicada, como la investigación preclínica y toxicológica. Sin embargo, la estandarización de la higiene en los entornos de laboratorio, con el objetivo de reducir el ruido biológico y minimizar la variabilidad en los resultados experimentales, ha llevado a la exclusión en gran medida de la microbiota natural. Por lo tanto, las condiciones en las que nacen y se mantienen ratones de laboratorio higiénicamente estandarizados, especificados y libres de patógenos (SPF) difieren de las condiciones del mundo real a las que normalmente se exponen los seres humanos y los animales. Este desajuste entre las condiciones de laboratorio y los entornos naturales en los que se producen las enfermedades humanas da lugar a la "falacia de la estandarización": suponer que minimizar la variación en las condiciones experimentales mejora los resultados traslacionales. Sin embargo, en realidad, limita la relevancia biológica de los hallazgos 1,2. Por ejemplo, la investigación ha demostrado que la ausencia de diversidad microbiana y ambiental en ratones SPF puede dar lugar a un sistema inmunitario subdesarrollado, lo que socava la validez de los estudios inmunológicos y preclínicos3.
Se han propuesto varios enfoques para abordar la variación biológica en modelos de ratones, cada uno con sus propias ventajas y limitaciones, incluyendo el co-alojamiento con ratones salvajes y de tiendas de mascotas 3,4,5,6,7,8, la exposición secuencial a comensales 9, el mantenimiento de los animales en recintos al aire libre 10 o en camas de animales grandes11, y los trasplantes fecales de ratones silvestres12. Un nuevo modelo de ratón prometedor para la investigación preclínica y toxicológica es el modelo de "ratones salvajes", que consiste en cepas de ratones de laboratorio estándar que albergan un microbioma natural13. Estos "ratones salvajes" se generan mediante el trasplante de embriones de cepas de ratones de laboratorio a ratones capturados en la naturaleza. Durante el nacimiento, las cepas de ratones de laboratorio adquieren el microbioma natural de sus madres sustitutas, imitando la inoculación natural que se produce durante el parto humano13. Los "ratones salvajes" se pueden criar como cualquier otra cepa de ratón de laboratorio, con su microbioma natural conservado a lo largo de las generaciones.
Los "ratones salvajes" albergan una microbiota diversa, que incluye bacterias, virus y parásitos, que normalmente se excluyen de las instalaciones de ratones SPF. En consecuencia, mantener un microbioma natural en las instalaciones de investigación presenta desafíos, ya que estos microbios deben contenerse sin comprometer los estándares generales de higiene SPF.
En Charité - Universitätsmedizin Berlin, se estableció una instalación dedicada a los "ratones salvajes", separada de las áreas SPF por estrictas medidas de biocontención. La instalación incluye salas de cría y experimentación, lo que garantiza que se mantenga el microbioma natural de los "ratones salvajes" mientras se protegen las áreas de SPF (Figura 1).
Las parejas fundadoras de la colonia de Charité fueron importadas de la colonia "Ratones salvajes" establecida en el Departamento de Investigación del Microbioma del Hospital Universitario de Erlangen, Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Alemania. Se les suministra un certificado sanitario y se les supervisa con un panel ampliado de patógenos zoonóticos antes de la importación de los fundadores de la colonia. Se utilizarán centinelas para monitorear el microbioma a lo largo del tiempo. Tanto el SPF como los "ratones salvajes" se alojan en las mismas condiciones. Los ratones se crían y se mantienen preferentemente en jaulas con ventilación individual (IVC) tipo II en grupos de cinco ratones. La temperatura dentro de la instalación es de 22 °C y el ciclo de luz/oscuridad es de 12 h. Los ratones reciben comida estándar a base de grano y agua del grifo. La esterilización de la ropa de cama y los artículos de enriquecimiento es innecesaria para los "ratones salvajes". Sin embargo, la esterilización en autoclave de estos elementos evita la confusión de materiales en las áreas donde se alojan los ratones SPF.
En este protocolo, se demuestran los procedimientos de inmunofenotipado tanto para SPF como para "ratones salvajes", destacando los estrictos protocolos de contención microbiana en las instalaciones de "ratones salvajes". Estas medidas garantizan la integridad de los entornos SPF al tiempo que proporcionan los beneficios de trabajar con ratones portadores de un microbioma natural.
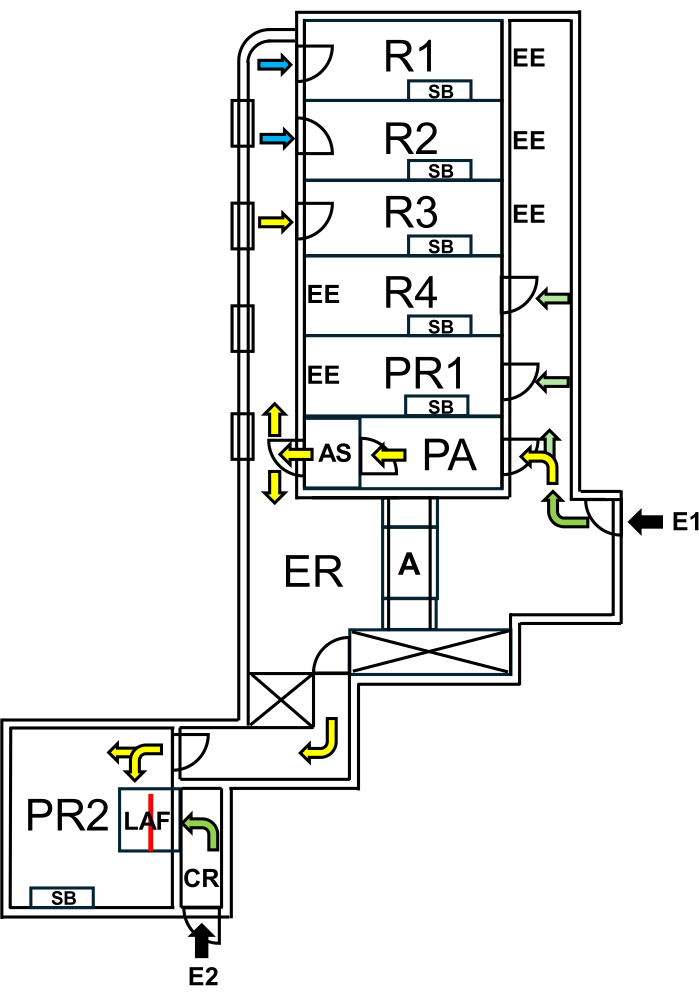
Figura 1: Disposición de la instalación para ratones salvajes. E1 = acceso a la instalación. Las flechas indican la ruta de entrada a las instalaciones. E2 = acceso a la cabina de flujo de aire laminar desde el exterior de la instalación. PA = esclusa de personal con ducha de aire. AS = ducha de aire. R1, R2 = salas para la cría de ratones salvajes. R3 = espacio para mantener ratones salvajes. R4 = espacio para mantener ratones SPF. PR1 = sala de procedimientos para ratones con SPF. PR2 = sala de procedimientos para ratones salvajes. SB = banco de trabajo estéril. EE = salidas de emergencia. CR = vestuario frente a la cabina LAF. LAF = cabina de flujo de aire laminar para intervenciones bajo flujo de aire protector. A = autoclave. ER = sala de equipos. Las flechas verdes representan las rutas accesibles cuando se trabaja con animales SPF, y las flechas amarillas indican los caminos disponibles para trabajar con ratones salvajes después de ducharse al aire. Las flechas azules indican el acceso solo para el personal de cría. La línea roja marca la pared de vidrio dentro de la cabina LAF, que divide el espacio en dos secciones a las que se puede acceder desde E1 a través de PR2 o desde E2 a través de CR. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
La instalación para "ratones salvajes" y los procedimientos con animales vivos fueron aprobados por la oficina estatal responsable de la experimentación animal, "Landesamt für Gesundheit und Soziales Berlin" (LAGeSo). Los pasos más importantes del protocolo se resumen en la Figura 2.
1. Obtener acceso a las instalaciones de Wilding
- Obtenga una introducción personal a los procedimientos operativos y de biocontención de la instalación del oficial de bienestar animal responsable.
- Obtenga la llave del transpondedor para ingresar a las instalaciones para "ratones salvajes" y reserve las salas de procedimientos a través del sistema de reservas en línea.
2. Entrada a las instalaciones para "ratones salvajes"
- Deposita la ropa en el probador.
- Cámbiese a la ropa de área: pantalones, kasak y cubrezapatos desechables (Figura 3).
3. Toma de muestras de sangre de ratones SPF en el área SPF
- Transfiera los ratones con SPF (macho y hembra, 8-20 semanas) de la sala donde se mantienen (R4) a la sala de procedimientos para animales con SPF (PR1) en una jaula IVC cerrada.
- Encienda el banco de flujo laminar y desinfecte la superficie del espacio de trabajo con etanol al 70% Vol. Trabaja dentro del banco.
- Inspeccione los tubos capilares en busca de secciones rotas o astilladas para evitar un mayor riesgo de rotura o daño.
- Bajo breve anestesia general con isoflurano (inducción al 5% de isoflurano en aire medicinal enriquecido con oxígeno, seguida de 1,5%-2,0% para mantenimiento), después de la pérdida del reflejo de retirada del pedal (como se indica mediante un pellizco en el dedo del pie), comprima las venas del cuello de los ratones agarrando el pescuezo.
- Con una mano, asegure la cabeza del animal con el pulgar y el índice. Inserte un capilar fresco en el canto medial del ojo debajo de la membrana nictitante en un ángulo de 45°. Asegúrese de que el capilar esté colocado entre el globo ocular y la órbita ósea del ojo.
NOTA: Para evitar traumatismos, no permita que la punta del tubo capilar toque la superficie del ojo. - Inserte el capilar a través de la membrana sinusal con un suave movimiento de rotación axial. Continúe girando el tubo en la parte posterior de la órbita hasta que la sangre fluya. Recoja un mínimo de 15 μL de sangre en un tubo de extracción de sangre que contenga ácido etilendiaminotetraacético (EDTA) (aproximadamente 1 gota).
- Antes de retirar el capilar, afloje el agarre del pescuezo para mantener el sangrado en el tejido al mínimo. Para asegurar una buena hemostasia, use una gasa limpia o un hisopo para detener el sangrado.
- Gire ligeramente el tubo para mezclar la sangre y el EDTA. No agite el tubo. Guarde la muestra de sangre en hielo.
- Desinfecte la superficie de trabajo y apague el banco de flujo laminar. Regrese los ratones SPF en un IVC cerrado a la sala de alojamiento SPF (R4).
4. Entrar en la zona de "Ratones salvajes"
- Quítese los zapatos y los calcetines en la antesala de la ducha de aire (PA). Póngase calcetines de área y equipo de protección personal (EPP) de cuerpo completo que consiste en un mono Tyvek, una redecilla para el cabello, si es necesario, guantes de algodón, guantes de nitrilo y mascarillas (Figura 3).
- Ingrese a la ducha de aire en calcetines a través del revestimiento adhesivo del suelo. Mientras se ducha al aire, levante los brazos y realice un giro de 360°.
- Salga de la ducha de aire y póngase los zapatos del otro lado.
5. Toma de muestras de sangre de "ratones salvajes"
- Transfiera a los "ratones salvajes" (machos y hembras, de 8 a 20 semanas) de la sala donde se mantienen (R3) en una jaula IVC cerrada a la sala de procedimientos (PR2).
- Encienda el banco de flujo laminar y desinfecte la superficie del espacio de trabajo.
- Siga los procedimientos descritos para muestrear ratones con SPF en la sección 3, pasos 2-8.
- Después de completar la toma de muestras de sangre, cámbiese los guantes. Desinfectar todos los materiales y superficies. Apague el banco de flujo laminar.
6. Exportación de muestras de sangre del área de "ratones salvajes" a través del gabinete de flujo de aire laminar (LAF)
NOTA: La sala de procedimientos (PR2) contiene un gabinete LAF, que sirve como cerradura de material y sala de intervención estéril. Las muestras se transfieren a través de la cabina LAF. El interior es accesible tanto desde el interior (a través de E1 y PR2) como desde el exterior (a través de E2 y CR) el área Wildling y está dividida en el medio por una pared de vidrio con una puerta corredera (Figura 1). Se requieren dos personas para exportar materiales: la Persona 1 (dentro del área de Wildling [a través de PR2]) realizará los pasos 6.1 y 6.2. La Persona 2 (fuera del área de Wildling [a través de E2]) realizará los pasos 6.3-6.5.
- Desinfecte los recipientes de muestras. Retire los recipientes de muestras a través de la puerta corredera en la pared de vidrio de la cabina LAF.
- Una vez completada la transferencia de los contenedores de muestras a la persona 2, reciba ropa protectora de la persona 2 (usa ropa protectora en la cerradura de la bata de la cabina) al otro lado de la cabina LAF y deséchela. Desinfectar todas las superficies.
- Póngase ropa protectora en el acceso LAF frente a la cabina LAF (CR, Figura 1).
- Reciba contenedores de muestras desinfectados de la zona Wildling sin contacto a través de la puerta corredera en la pared de vidrio de la cabina LAF.
- Quítese la ropa protectora y pásela a través de la puerta corredera hacia el área interior de la cabina LAF para su eliminación.
7. Salir de las instalaciones para "ratones salvajes"
- Deje los overoles desechables y los zapatos de área dentro del área. Deseche la redecilla para el cabello, los guantes de goma y la mascarilla.
NOTA: Los zapatos y overoles se pueden reutilizar. - Ingrese a la ducha de aire inmediatamente en el área de calcetines. Levante los brazos y realice un giro de 360° mientras se ducha al aire.
- Deje la ducha de aire y coloque los calcetines del área en el colector de ropa. Póngase los calcetines, los zapatos y los cubrezapatos desechables. Zona de depósito de ropa en el vestuario en el colector de lavandería. Cámbiate a la ropa en el probador
8. Procesamiento y análisis de muestras de sangre
- Lleve muestras de sangre al laboratorio.
- Prepare un cóctel de tinción de anticuerpos conjugados con fluoróforos: Para cada muestra, agregue 0,25 μL de Alexa Fluor 700 anti-mouse CD45, 0,25 μL de Brilliant Violet 605 anti-cadena TCR-β de ratón, 0,25 μL de APC anti-mouse CD4, 0,25 μL de Brilliant Violet 785 anti-mouse CD8, 0,25 μL de FITC anti-mouse CD44 y 0,25 μL de anticuerpo PerCP/Cyanine5.5 anti-mouse CD62L a 50 μL de tampón de citometría de flujo (solución salina tamponada con fosfato, 2 mM de EDTA, 0,1% albúmina sérica bovina, 4 °C). Manténgalo en la oscuridad sobre el hielo hasta el paso 8.8.
NOTA: Los fluoróforos utilizados se pueden adaptar a la configuración del citómetro de flujo que se utilizará para la adquisición de muestras.
- Prepare un cóctel de tinción de anticuerpos conjugados con fluoróforos: Para cada muestra, agregue 0,25 μL de Alexa Fluor 700 anti-mouse CD45, 0,25 μL de Brilliant Violet 605 anti-cadena TCR-β de ratón, 0,25 μL de APC anti-mouse CD4, 0,25 μL de Brilliant Violet 785 anti-mouse CD8, 0,25 μL de FITC anti-mouse CD44 y 0,25 μL de anticuerpo PerCP/Cyanine5.5 anti-mouse CD62L a 50 μL de tampón de citometría de flujo (solución salina tamponada con fosfato, 2 mM de EDTA, 0,1% albúmina sérica bovina, 4 °C). Manténgalo en la oscuridad sobre el hielo hasta el paso 8.8.
- Desinfectar los tubos de extracción de sangre. Agregue 2 mL de tampón de citometría de flujo helado a un tubo de poliestireno de fondo redondo de 5 mL. Coloque el tubo sobre hielo.
- Tubo abierto de extracción de sangre. Añadir 10 μL de sangre al tubo que contiene el tampón de citometría de flujo y el vórtice de pulso.
- Girar a 400 x g durante 5 min a 4 °C.
- Aspirar el sobrenadante. Agregue 1 ml de tampón de lisis de glóbulos rojos (RBC), vórtice de pulso e incube durante 3 minutos a temperatura ambiente (RT).
- Agregue 100 μL de PBS 10x. Girar a 400 x g durante 5 min a 4 °C.
- Repita los pasos 8.5-8.6.
- Aspirar el sobrenadante. Añadir 50 μL de cóctel de tinción de anticuerpos, vórtice e incubar durante 20 minutos en hielo en la oscuridad.
- Agregue 1 mL de tampón de citometría de flujo. Girar a 400 x g durante 5 min a 4 °C.
- Aspirar el sobrenadante. Añadir 180 μL de tampón de citometría de flujo.
- Añadir 20 μL de SYTOX Blue Dead Cell Stain (concentración final 1:1000) para la discriminación de vivos/muertos.
- Adquiera muestras en un citómetro de flujo y analice los datos utilizando el software de adquisición de citómetros de flujo o el programa de análisis de datos de citometría de flujo.
Resultados
Los "ratones salvajes" albergan potencialmente microorganismos típicamente excluidos de las instalaciones de SPF, lo que plantea un desafío para las prácticas de cría de animales dentro de las instituciones de investigación que mantienen estrictos estándares de higiene. En los últimos 4 años, los científicos y veterinarios de la Charité - Universitätsmedizin Berlin y el Centro Alemán para la Protección de los Animales de Laboratorio (Bf3R) han desarrollado una instalación d...
Discusión
Los ratones con un microbioma natural son una herramienta de investigación prometedora para la ciencia básica y aplicada debido a su mayor parecido con el superorganismo humano 3,9,10,11,12. Los intentos de incorporar la complejidad biológica en los modelos de ratón han llevado al desarrollo de varios enfoques, cada uno co...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo contó con el apoyo de Charité 3R| Reemplazar - Reducir - Refinar. S.P.R. contó con el apoyo de la Deutsche Forschungsgemeinschaft (DFG, Fundación Alemana de Investigación) Emmy Noether-Programm RO 6247/1-1 (ID de proyecto 446316360), la DFG SFB1160 IMPATH (ID de proyecto 256073931) y el TRR 359 PILOT (ID de proyecto 491676693). S.J. contó con el apoyo de la Deutsche Forschungsgemeinschaft (DFG, Fundación Alemana de Investigación) JO 1216/2-1 y la Sociedad Alemana de Esclerosis Múltiple (DMSG e.V.).
Materiales
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
Referencias
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345 (2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119 (2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108 (2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069 (2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361 (2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143 (2018).
- . Premier Available from: https://premier-qms.org/ (2024)
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados