Method Article
Identificación de células infectadas por EcoHIV en ratones transgénicos manipulados con microglía
En este artículo
Resumen
Este protocolo describe cómo la combinación de la infección por EcoHIV con ratones Tmem119-EGFP ofrece un valioso sistema biológico para investigar las alteraciones microgliales y los reservorios virales en modelos de roedores con trastornos neurocognitivos asociados al VIH.
Resumen
La terapia antirretroviral combinada (cART) ha mejorado drásticamente la calidad de vida de las personas que viven con el VIH. Sin embargo, más de 4 millones de personas que viven con el VIH tienen más de cincuenta años y experimentan trastornos neurocognitivos asociados al VIH. Para comprender cómo afecta el VIH al sistema nervioso central, es necesario un modelo fiable y factible del VIH. Anteriormente, se desarrolló un nuevo sistema biológico que utilizaba la inoculación quimérica del VIH (EcoHIV) en un modelo de rata para investigar las deficiencias neurocognitivas y la disfunción sináptica. Sin embargo, sigue existiendo un desafío importante para aclarar la distribución neuroanatómica de EcoHIV, en particular su expresión diferencial en varios tipos de células en el cerebro. En el estudio actual, EcoHIV con marcaje de fluorescencia mScarlet se modificó y se inyectó retroorbitalmente en ratones knock-in Tmem119-EGFP (que expresan la proteína de fluorescencia verde mejorada principalmente en la microglía) para determinar si la microglía es el principal tipo de célula responsable de la expresión viral y los reservorios del VIH en el cerebro. Los datos actuales muestran que: (1) in vitro, las señales de fluorescencia de EcoHIV-mScarlet se localizaron predominantemente en células similares a la microglía entre las células cerebrales primarias de roedores; (2) in vivo, la inyección de EcoHIV-mScarlet en ratones Tmem119-EGFP indujo una expresión significativa del VIH en el cerebro del ratón. La colocalización de las señales mScarlet y EGFP sugiere que la microglía es el principal tipo de célula que alberga el VIH en el cerebro. En general, EcoHIV en roedores ofrece un valioso sistema biológico para estudiar las alteraciones microgliales, los reservorios virales en el cerebro y los mecanismos neurológicos de los trastornos neurocognitivos asociados con el VIH.
Introducción
A pesar de los profundos beneficios derivados de la terapia antirretroviral, las personas que viven con el VIH siguen experimentando trastornos neurocognitivos. Para comprender mejor los mecanismos neuronales del trastorno neurocognitivo asociado al VIH (HAND), existe una necesidad crítica de modelos de VIH para dilucidar aún más la participación específica del tipo de célula en el NeuroHIV.
La rata transgénica VIH-1, que tiene una exposición constitutiva a las proteínas virales del VIH-1, es un modelo de roedor popular utilizado para investigar los trastornos neurocognitivos 1,2,3,4 y las alteraciones neuroanatómicas 5,6,7 asociados con HAND. La deleción funcional de los dominios gag y pol impide la replicación viral, haciendo que la rata transgénica VIH-1 no sea infecciosa 8,9. Recientemente, Potash et al.10 informaron inicialmente de un modelo quimérico de infección por VIH (EcoHIV) en ratones10 y posteriormente se extendió a ratas, lo que puede ser ventajoso para futuros estudios sobre los trastornos por uso de sustancias yHAND11. En este novedoso sistema biológico, se observó la infección sistémica por VIH-1 junto con muchas características clínicas del VIH-1 en humanos, incluida la afectación de linfocitos y macrófagos, respuestas inmunitarias antivirales, neuroinvasividad e inflamación cerebral.
La microglía desempeña un papel fundamental como macrófagos especializados residentes en el cerebro en el mantenimiento de la función cerebral y la homeostasis. Para distinguir la microglía de los tipos de células estrechamente relacionados (por ejemplo, monocitos sanguíneos, macrófagos perivasculares, macrófagos meníngeos), el estudio actual utilizó la línea de ratón knock-in Tmem119-EGFP. Estudios previos han reportado que la proteína transmembrana 119 (Tmem119) exhibe un patrón de expresión exclusivamente específico de la microglía en tejido cerebral de roedores y humanos 12,13,14,15. La señal de EGFP en ratones knock-in Tmem119-EGFP se observó en todo el cerebro y se localizó específicamente en las células microgliales.
En el presente estudio, se inocularon ratones knock-in Tmem119-EGFP con el virus EcoHIV-mScarlet y se identificaron células positivas para EcoHIV en el sistema nervioso central. Aquí, presentamos un protocolo para la inoculación de EcoHIV-mScarlet en ratones knock-in Tmem119-EGFP , proporcionando un modelo confiable para atacar terapéuticamente las alteraciones microgliales en el VIH.
Protocolo
El Comité de Cuidado y Uso de Animales de la Universidad de Carolina del Sur aprobó todos los protocolos para animales (número de garantía federal: D16-00028). Todos los experimentos siguieron estrictamente las pautas establecidas por los Institutos Nacionales de Salud en la Guía para el Cuidado y Uso de Animales de Laboratorio. Los ratones knock-in Tmem119-EGFP (de 30 días de edad, machos, 23-26 g de peso corporal) se obtuvieron de una fuente comercial y se alojaron en grupo en instalaciones acreditadas por la AAALAC. Todos los animales fueron alojados bajo un ciclo de luz-oscuridad de 12/12 h con libre acceso a comida y agua. Los detalles de los animales, reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Empaque EcoHIV-mScarlet en celdas de 293FT
- Incubar las 293 células FT en un matraz de 75cm2 precubierto de gelatina. Mantener las células en crecimiento hasta un 30% confluentes en la transfección.
- Realice la transfección de ADN plasmídico (15 μg) de EcoHIV-mScarlet (Archivo Suplementario 1) utilizando Lipofectamine 3000 (22.5 μL) siguiendo las instrucciones del fabricante (ver Tabla de Materiales).
- Cultivar las células en medio DMEM con suero FBS al 10% durante 3 días a 37 °C.
- Recoja el medio condicional con suspensión viral. Centrifugar a 500 × g durante 10 min a 4 °C. Transfiera el sobrenadante con una pipeta de 10 mL a un tubo estéril de 50 mL.
- Agregue una cierta cantidad de concentrador Lenti-x (proporción 1:3) a la mezcla viral (por ejemplo, 8 mL de concentrador con 24 mL de mezcla viral). Invierta suavemente el tubo cinco veces.
- Mantenga la mezcla concentradora de virus y Lenti a 4 °C durante 2 días. Centrífuga a 1.500 × g, 45 min, 4 °C. Retire con cuidado el sobrenadante tanto como sea posible con una pipeta.
- Vuelva a suspender el pellet con 200 μL preenfriados de 100 mM de PBS. Almacene el virus a -80 °C.
NOTA: Los detalles del empaquetamiento de EcoHIV-mScarlet en células de 293 pies se describieron en nuestro estudio anterior16. No haga vórtices ni introduzca burbujas de aire en la solución viral.
2. Infección por EcoHIV-mScarlet en células cerebrales primarias de rata
- Realizar el aislamiento primario de células cerebrales de fetos de rata (18 días) siguiendo el informe publicado anteriormente16.
- Transfiera las células disociadas a placas de 12 pocillos prerrevestidas de poli-L-lisina con insertos de vidrio que contienen 1 mL de medio DMEM/F12 más 10% de FBS. Reemplace el medio al día siguiente por el medio Neurobasal con el suplemento B27.
- Cultivo de células cerebrales fetales primarias en una incubadora de CO2 al 5% durante 3 semanas.
- Añadir EcoHIV-mScarlet (60 μL, 1,26 × 106 TU/mL) en el medio de cultivo. Incubar las células cerebrales cultivadas con EcoHIV-mScarlet durante 6 días.
- Fije las células con PFA al 4% y realice la inmunotinción en las células cerebrales infectadas utilizando anticuerpos primarios específicos (CD11b/c, Iba1).
- Obtención de imágenes utilizando un objetivo de 40× bajo un sistema de microscopía confocal.
3. Infección por el virus EcoHIV-mScarlet en células gliales primarias de ratones adultos
- Anestesiar ratones adultos con sevoflurano al 5% durante 5 min (siguiendo protocolos aprobados institucionalmente). Esterilizar la piel de la cabeza con 70% de EtOH.
- Después de confirmar que el ratón ya no responde a los estímulos nocivos, use una tijera afilada esterilizada para realizar la decapitación. Transfiera la cabeza a una nueva placa de Petri llena de 5 mL de HBSS.
- Abra el cuero cabelludo y transfiera el tejido cerebral a otra placa de Petri que contenga 5 mL de HBSS esterilizado. Pele las meninges y transfiera la corteza frontal a 2 mL de HBSS.
- Añadir 20 μL de tripsina-EDTA al 0,25% a la mezcla. Incubar durante 15 min a temperatura ambiente; Agite suavemente el tubo cada pocos minutos.
- Transfiera las células disociadas a un matraz de poli-L-lisina prerrecubierto de 75cm2 que contiene 10 mL de medio DMEM/F12 y 10% de FBS.
- Cultivar células a 37 °C, incubadora con 5% de CO2, hasta un 90% de confluencia. Digiere las células cerebrales con 2 mL de tripsina-EDTA al 0,25%.
- Subcultive células cerebrales en placas con fondo de vidrio de 35 mm que contienen 5 mL de medio de crecimiento DMEM/F12 hasta un 80% de confluencia.
- Añadir EcoHIV-mScarlet (8 μL, 1,26 × 106 TU/mL) en el medio de cultivo. Incuba las células gliales de ratón durante 2 días.
- Revise las señales de fluorescencia rojas (mScarlet) diariamente bajo un microscopio fluorescente.
4. Inyección retroorbital del virus EcoHIV-mScarlet en ratones Tmem119-EGFP
- Utilice sevoflurano al 3% para anestesiar a los ratones Tmem119-EGFP (ratones machos y hembras a los 30 días de edad) hasta que ya no respondan a los estímulos nocivos.
- Asegure a los ratones en una posición lateral con el ojo de inyección hacia arriba y la respiración a través del cono de la nariz, que está conectado a un sistema de anestesia. Use un tamaño de cono nasal adecuado para proporcionar anestesia continua.
- Descongele el EcoHIV-mScarlet en hielo. Llene la solución viral en una jeringa inyectora intraocular con una aguja roma de 33 G.
- Coloque el ratón en la decúbito lateral derecho y mantenga la cabeza mirando hacia la izquierda. Identifique la ubicación del canto medial como el sitio de inyección.
- Después de sujetar el ojo, inserte lenta y suavemente una aguja (ángulo de 45 grados) en el canto medial del ojo. Inserte con cuidado la aguja hacia adelante en los vasos detrás del globo ocular (seno retroorbitario).
- Inyecte suavemente 6,5 μL de EcoHIV-mScarlet (1,26 × 106 TU/mL, inoculación ocular bilateral) en el seno retroorbitario. Retire con cuidado la aguja del seno retroorbitario y aplique presión suavemente sobre los párpados para proporcionar hemostasia.
- Aplique lubricante en el ojo para evitar que la córnea se seque o se lesione.
- Permita que los ratones se recuperen en una cámara de recuperación con una almohadilla térmica hasta que se despierten.
NOTA: El bisel de la aguja no debe colocarse demasiado profundo para que las arterias no se rompan o los huesos se fracturen. El tiempo de infusión viral depende de múltiples factores (p. ej., volumen de inyección, título, tamaño del animal). Para la infusión viral de EcoHIV, se ha observado una expresión significativa una semana después de las inyecciones retroorbitarias 11,16,17.
5. Visualización de cortes de tejido cerebral
- Anestesiar profundamente a los ratones con sevoflurano al 5%. Continúe con el paso 5.2 cuando los ratones no muestren respuesta a estímulos nocivos y los reflejos estén ausentes.
- Mantenga a los ratones en posición supina dentro de una campana de gases químicos.
- Abra la piel a lo largo de la línea media torácica. Separa el diafragma y abre el cofre con unas tijeras.
- Inserte una aguja 22 G1 1/2 en el ventrículo izquierdo. Abra la aurícula derecha con unas tijeras.
- Perfunde 50 mL de PBS preenfriado de 100 mM. Perfundir 100 mL de tampón de paraformaldehído al 4% preenfriado16.
- Retire todo el cerebro del ratón16.
- Fijar toda la noche con un 4% de paraformaldehído.
- Asegure el tejido cerebral con adhesivo para tejidos en la plataforma metálica del vibrátome. Corte de secciones coronales de 50 μm de espesor con cuchillas de acero al carbono.
- Coloque las rodajas de cerebro en portaobjetos de vidrio con un cepillo. Añada inmediatamente 0,1 ml del medio de montaje antidecoloración a cada sección.
- Coloque un cubreobjetos de 22 mm x 50 mm sobre las secciones del cerebro. Seque los toboganes superheladas en la oscuridad durante 1 día.
- Configure el sistema de microscopio confocal con un aumento de 60× (A/1,4, aceite) y establezca un intervalo de plano Z de 0,15 μm, con un tamaño de orificio de 30 μm y un radio de estenopeico retroproyectado de 167 nm.
- Utilice las longitudes de onda de 488 nm y 594 nm para adquirir imágenes multicanal de las regiones cerebrales de interés.
Resultados
Un fragmento de mScarlet (1858 pb) que contenía sitios enzimáticos de "Cla1" en el extremo 3' y "Not1" en el extremo 5' se insertó en el vector lentiviral pNL4-3-EcoHIV (Figura 1). Para validar la expresión de EcoHIV-mScarlet, las células cerebrales primarias aisladas de la corteza de los embriones E18 de rata se trataron con EcoHIV-mScarlet (60 μL, 1,26 × 106 TU/mL) durante 6 días in vitro. Los datos de la Figura 2 mostraron que las señales fluorescentes rojas de mScarlet se localizaban principalmente en los tipos de células gliales en función de la diferente morfología celular. Además, el marcaje de CD11b/c e Iba1 (marcadores celulares de microglía) mostró que las señales de mScarlet estaban colocalizadas con las células CD11b/c + y/o Iba1 +. Los datos indicaron que la microglía era el principal tipo de célula de distribución in vitro de EcoHIV-mScarlet. No hubo infección neuronal significativa en las células cultivadas (Figura suplementaria 1).
A continuación, se probó la infección de EcoHIV-mScarlet en células gliales mixtas primarias de ratón adulto. Para ello, primero se aislaron y purificaron células gliales mixtas de ratones adultos (2 meses) e infectados con EcoHIV-mScarlet (8 μL, 1,26 × 106 TU/mL) durante 2 días. Las imágenes de la Figura 3 mostraron que EcoHIV-mScarlet infectó con éxito la glía de ratón adulto.
Para abordar aún más el patrón de distribución de EcoHIV-mScarlet en el cerebro del ratón, específicamente para identificar el tipo de célula infectada, EcoHIV-mScarlet se inyectó retroorbital en una línea de ratones knock-in Tmem119-EGFP en la que las microglías se marcaron específicamente con señales EGFP sin ningún otro tipo de conflictos de macrófagos5. Los resultados de la Figura 4 (también en la Figura 2 suplementaria) muestran que se observaron señales de fluorescencia de rojo escarlata en células EGFP positivas, lo que sugiere que la microglía es el principal tipo de célula de expresión de EcoHIV en cerebros de ratones.
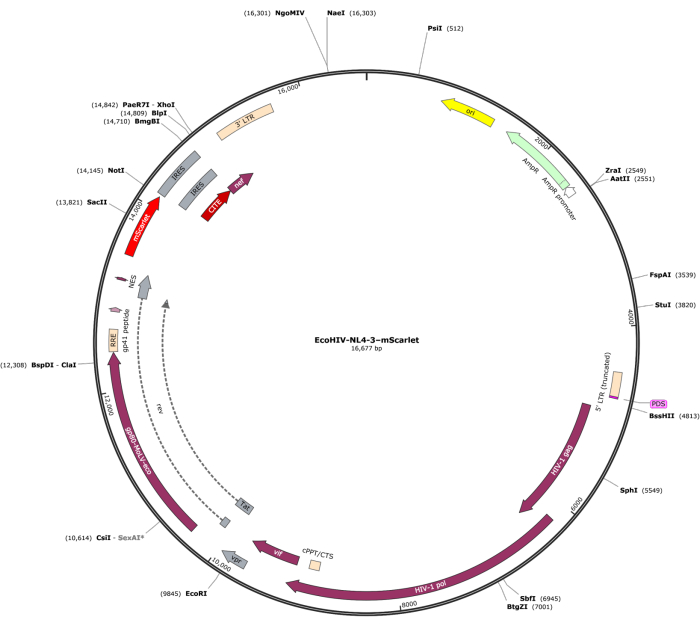
Figura 1: El mapa vectorial de EcoHIV-NL-4-3-mScarlet. Haga clic aquí para ver una versión más grande de esta figura.
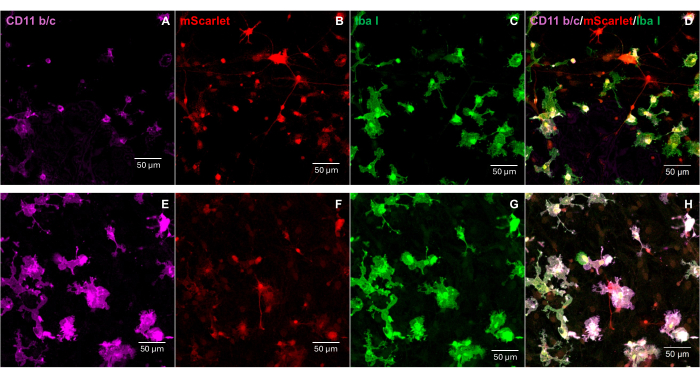
Figura 2: La infección por EcoHIV-mScarlet en células cerebrales primarias de rata. (A,E) Imágenes representativas de la tinción de CD11b/c en células cerebrales primarias. Las células cerebrales se aislaron de embriones de rata E18 y se infectaron con el virus EcoHIV-mScarlet durante 6 días. (B,F) Imágenes representativas de señales fluorescentes mScarlet de células cerebrales in vitro . (C,G) Imágenes representativas de la tinción de Iba1 en las células cerebrales primarias. (D,H) Imágenes combinadas de triple etiquetado de CD11b/c, mScarlet e Iba1. Barras de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
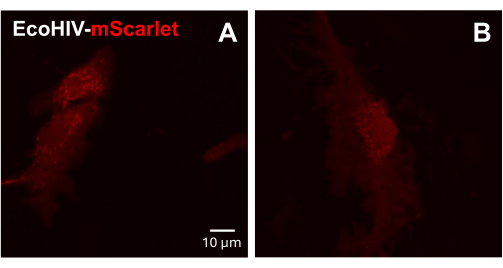
Figura 3: Infección por EcoHIV-mScarlet en células gliales mixtas primarias de ratón. (A,B) Imágenes confocales representativas de la distribución de mScarlet in vitro. Las células gliales mixtas primarias se aislaron de ratones C57BL6 adultos (de 2 meses de edad) y se cultivaron durante 2 semanas antes de la infección viral. El EcoHIV-mScarlet se añadió al medio de cultivo durante dos días y capturó las imágenes bajo el objetivo del 60× del microscopio Confocal. Barra de escala: 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
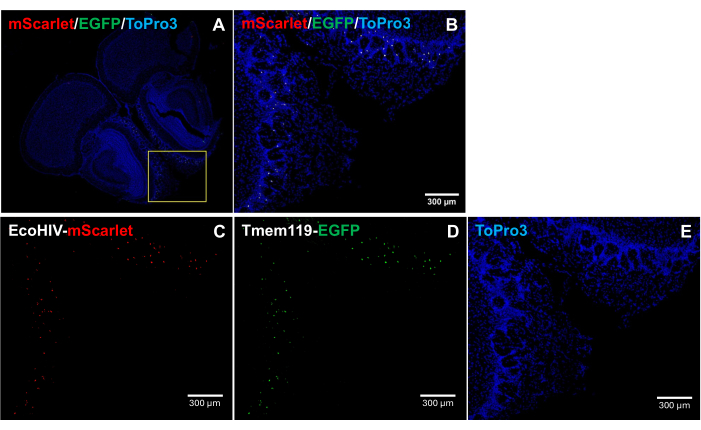
Figura 4: Distribución de EcoHIV-mScarlet en la línea de ratones knock-in Tmem119-EGFP . (A,B) Imágenes combinadas de señales mScarlet/EGFP/ToPro3 en secciones cerebrales. El marco amarillo indica el área objetivo de (B). Barra de escala: 300 μm. (C) Imagen representativa de la distribución de mScarlet en la capa plexiforme externa de la región olfativa de la línea de ratón knock-in Tmem119-EGFP . (D) Imagen representativa de la distribución de EGFP. Las señales fluorescentes se localizaron en células de microglía de la línea de ratones knock-in Tmem119-EGFP . (E) Imagen representativa de la tinción del núcleo TO-PRO-3. Barras de escala: 300 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Tinción de MAP2 y MOG de células cerebrales primarias de rata infectadas con el virus EcoHIV-mScarlet. Barras de escala: 50 μm. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Imágenes confocales de la infección por EcoHIV-mScarlet en la línea de ratones knock-in Tmem119-EGFP . Barras de escala: 75 μm. Haga clic aquí para descargar este archivo.
Archivo complementario 1: EcoHIV-mSecuencia de ADN plasmídico escarlata. Haga clic aquí para descargar este archivo.
Discusión
En el presente estudio, se encontró que (1) el nuevo EcoHIV-mScarlet infectó con éxito células cerebrales primarias de rata in vitro; (2) el triple marcaje de mScarlet, CD11b/c e Iba1 identificó a la microglía como el tipo de célula predominante para esta expresión de EcoHIV en células cerebrales de rata in vitro; (3) células cerebrales primarias de ratón de adultos in vitro evidencian aún más la infección por EcoHIV-mScarlet; (4) la distribución de EcoHIV-mScarlet en la línea de ratones knock-in Tmem119-EGFP demostró un patrón de distribución específico de la microglía de la infección por EcoHIV.
Estudios emergentes sugirieron que varios tipos de células cerebrales identificadas dentro del sistema nervioso central (neuronas, astrocitos, microglía, oligodendrocitos, etc.) exhiben alteración funcional y transcriptómica durante el VIH y los trastornos neurocognitivos asociados al VIH18,19. Por ejemplo, losastrocitos aportan entre el 30% y el 70% del cerebro y realizan vigilancia para mantener la homeostasis cerebral. Los astrocitos también modulan la función inmune y regulan la secreción de multicitocinas y quimiocinas, especialmente en la situación de inflamación cerebral y neurodegeneración en el VIH21,22. La infección por VIH de la microglía no solo resulta en una liberación continua de proteínas virales y citocinas proinflamatorias y quimiocinas, sino que también proporciona fuentes predominantes para los reservorios virales del VIH 23,24,25,26. Además, la microglía activada contribuye a una función inmunológica crítica en el SNC; sin embargo, la activación prolongada también puede exacerbar la neurodegeneración en la progresión del VIH10,27. Los oligodendrocitos también desempeñan una función importante, incluida la liberación de varias neurotrofinas (como el factor de crecimiento nervioso, el factor neurotrófico derivado del cerebro, etc.)28. Un estudio anterior encontró que el número de oligodendrocitos disminuyó significativamente en los cerebros de los pacientes con SIDA, lo que puede indicar daño directo a los oligodendrocitos por las proteínas virales del VIH29. Por lo tanto, un tipo específico de modelo de infección por VIH manipulado por células debería proporcionar medios fundamentales para identificar las funciones diferenciales de varias células cerebrales después de la infección. En el estudio actual, se desarrolló un sistema biológico para imitar las características del VIH-1 mediante la inoculación quimérica del VIH (EcoHIV). Esta inoculación del VIH también se combinó con la línea de ratones knock-in Tmem119-EGFP para generar y validar un modelo de roedor del VIH manipulado por microglía.
Sin embargo, las limitaciones del presente estudio deben ser reconocidas. Había algunas células Iba1/CD11b/c negativas que presentaban señales fluorescentes mScarlet in vitro. Otros tipos de células cerebrales, como los macrófagos cerebrales o los pericitos, pueden estar implicados en la infección por EcoHIV o, alternativamente, el entorno de cultivo celular puede promover patrones de infección aberrantes en relación con la inoculación in vivo . Los futuros estudios en animales enteros deberían aclarar aún más la función de la microglía mScarlet+ en el proceso de infección por EcoHIV y definir aún más la distribución regional de la microglía mScarlet+EcoHIV en el cerebro. Además, las alteraciones neurocognitivas que ocurren como resultado de infecciones microgliales también pueden abordarse en este modelo de roedores. En conjunto, la inoculación EcoHIV-mScarlet de ratones knock-in Tmem119-EGFP proporciona un modelo novedoso y una estrategia de investigación para investigar los mecanismos impulsados por la microglía de los trastornos neurocognitivos asociados al VIH.
Divulgaciones
Ninguno de los autores tiene conflictos de interés que declarar.
Agradecimientos
Este trabajo fue financiado por las subvenciones de los NIH DA059310, DA058586, AG082539 y GM109091. Agradecemos la generosa donación del EcoHIV-NL4-3-EGFP del Dr. Potash de la Escuela de Medicina Icahn en Mount Sinai.
Materiales
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
Referencias
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados