Method Article
Caracterización de la transferencia de electrones extracelular mediada en bacterias lácticas con un sistema bioelectroquímico de tres electrodos y dos cámaras
En este artículo
Resumen
En este trabajo se presenta un protocolo para caracterizar la transferencia extracelular de electrones (EET) mediada en bacterias lácticas utilizando un sistema bioelectroquímico de tres electrodos y dos cámaras. Ilustramos este método con Lactiplantibacillus plantarum y el mediador redox ácido 1,4-dihidroxi-2-naftoico y proporcionamos una descripción detallada de las técnicas electroquímicas utilizadas para evaluar la EET mediada.
Resumen
Muchas bacterias realizan la transferencia de electrones extracelular (EET), mediante la cual los electrones se transfieren de la célula a un aceptor de electrones terminal extracelular. Este aceptor de electrones puede ser un electrodo y los electrones se pueden administrar indirectamente a través de una molécula mediadora redox-activa. En este trabajo se presenta un protocolo para el estudio de la EET mediada en Lactiplantibacillus plantarum, una bacteria probiótica del ácido láctico ampliamente utilizada en la industria alimentaria, mediante un sistema bioelectroquímico. Detallamos cómo ensamblar un sistema bioelectroquímico de tres electrodos y dos cámaras y proporcionamos orientación sobre la caracterización de EET en presencia de un mediador soluble utilizando técnicas de cronoamperometría y voltamperometría cíclica. Utilizamos datos representativos de experimentos de EET mediados por ácido 1,4-dihidroxi-2-naftoico (DHNA) con L. plantarum para demostrar el análisis y la interpretación de los datos. Las técnicas descritas en este protocolo pueden abrir nuevas oportunidades para la electrofermentación y la bioelectrocatálisis. Las aplicaciones recientes de esta técnica electroquímica con L. plantarum demostraron una aceleración del flujo metabólico hacia la producción de productos finales de fermentación, que son componentes críticos del sabor en la fermentación de alimentos. Como tal, este sistema tiene el potencial de desarrollarse aún más para alterar los sabores en la producción de alimentos o producir productos químicos valiosos.
Introducción
Los sistemas bioelectroquímicos interconectan los microbios con los electrodos, lo que permite la investigación de los mecanismos de transferencia de electrones extracelulares (EET) y proporciona enfoques renovables para la bioelectrocatálisis 1,2,3. Los microbios que realizan EET de forma natural se conocen como exoelectrógenos, que transfieren electrones derivados del metabolismo a aceptores de electrones terminales extracelulares, por ejemplo, óxidos de hierro (hidr) y electrodos1. Caracterizadas por primera vez en las especies Geobacter y Shewanella 4,5, las vías EET se han identificado desde entonces en muchas bacterias. Estos exoelectrógenos desempeñan un papel central en varias tecnologías electroquímicas microbianas, como la generación de energía eléctrica a partir de flujos de desechos, la fijación deCO2 y la producción de productos químicos valiosos mediante electrosíntesis 1,6,7,8,9,10,11,12.
Uno de estos exoelectrógenos es Lactiplantibacillus plantarum, una bacteria grampositiva del ácido láctico13. L. plantarum es una bacteria probiótica nómada que reside en una amplia gama de ambientes, incluidos los intestinos de los seres humanos y otros vertebrados, así como en muchos tipos de alimentos como carne, cereales, verduras y alimentos y bebidas fermentados 14,15,16,17. Su genoma codifica un metabolismo flexible y heterofermentativo, lo que permite una adaptación exitosa a través de estos diversos entornos. Está bien estudiado, es ampliamente utilizado en las industrias de alimentos y salud, y generalmente reconocido como seguro por la Administración de Alimentos y Medicamentos18,19. Como tal, L. plantarum tiene el potencial de servir como una plataforma útil para las tecnologías basadas en EET.
Investigaciones recientes en L. plantarum han identificado un operón multigénico que codifica una vía compleja de EET originalmente caracterizada en Listeria monocytogenes13,20. En L. plantarum, las proteínas sintetizadas a partir de este operón facilitan la EET en un sistema bioelectroquímico (BES) cuando se les proporciona el ácido quinona 1,4-dihidroxi-2-naftoico (DHNA) como mediador de electrones13. La primera proteína esencial en esta vía es una NADH-quinona oxidorreductasa (Ndh2) unida a la membrana, que oxida el NADH y reduce el DHNA. El DHNA entrega electrones directamente a un electrodo o indirectamente a través de la proteína accesoria PplA (Figura 1)13,21,22. Investigaciones recientes indican que L. plantarum también puede usar otras quinonas que son estructuralmente similares al DHNA como mediadores de electrones; sin embargo, L. plantarum es incapaz de producir DHNA o estas quinonas alternativas, por lo que los mediadores deben estar exógenamente presentes en el ambiente para que ocurra la EET 13,22,23.
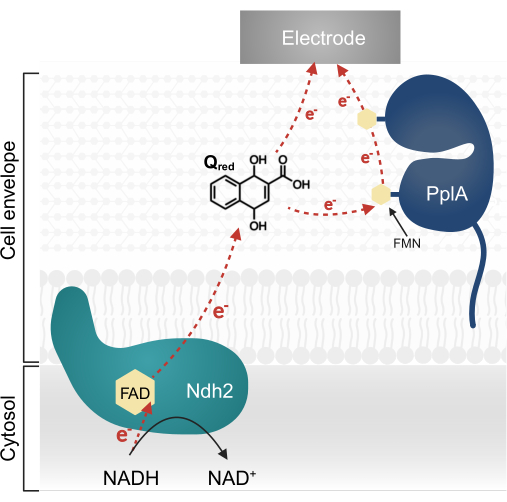
Figura 1: Flujo de electrones en Lactiplantibacillus plantarum EET. Ndh2 pasa electrones del NADH a la quinona DHNA. Los electrones se transportan al electrodo para producir corriente, ya sea directamente por quinona reducida o indirectamente a través de la proteína accesoria PplA. Abreviaturas: FAD = flavina adenina dinucleótido; FMN = Mononucleótido de flavina; EET = transferencia de electrones extracelulares; NADH = nicotinamida adenina dinucleótido reducido; Ndh2 = NADH-quinona oxidorreductasa; DHNA = ácido 1,4-dihidroxi-2-naftoico; PplA = fosfolipasa A. Haga clic aquí para ver una versión más grande de esta figura.
En este artículo, proporcionamos un protocolo completo para el uso de un método basado en BES para caracterizar la EET mediada por DHNA en L. plantarum. Un sistema de tres electrodos y dos cámaras confina las bacterias al electrodo de trabajo, lo que permite un control preciso del potencial aplicado a las bacterias y evita la diafonía entre el electrodo de trabajo y el contraelectrodo. Presentamos un protocolo completo que abarca 5 días, que cubre la preparación previa al experimento, el ensamblaje de BES, el análisis de EET utilizando cronoamperometría (CA) y voltamperometría cíclica (CV), y el análisis de muestras posterior al experimento. Este protocolo se puede aplicar para desentrañar los mecanismos de las vías de EET y construir sistemas para la electrofermentación y la electrocatálisis.
Protocolo
NOTA: Los conjuntos de BES de dos cámaras se denominarán "reactores" en el siguiente protocolo.
1. Preparación de los medios
- Preparar los medios de cultivo de L. plantarum .
- Prepare los medios comerciales MRS (de Man Rogosa Sharpe) según las instrucciones y los medios mMRS24 como se describe en la Tabla 1. Ajuste el pH de mMRS a 6,5. Filtre-esterilice ambos medios pasándolos a través de un filtro de 0,22 μm y almacene ambos a 4 °C hasta su uso.
- Prepare un Medio Químicamente Definido con manitol (mCDM)13,25 como se describe en la Tabla 2, y ajuste el pH a 6.5. Prepare suficiente medio para llenar la cámara anódica de cada reactor con 110 mL de medio. Filtrar-esterilizar mCDM a través de un filtro de 0,22 μm.
NOTA: el mCDM debe prepararse fresco el día de uso previsto. Las soluciones de componentes pueden prepararse con anticipación. Filtre-esterilice todas las soluciones de componentes a través de un filtro de 0,22 μm y almacene a 4 °C. Al preparar las vitaminas de Wolfe, ajuste el pH a 11 antes de esterilizar y guárdelas en la oscuridad o envuélvalas en papel de aluminio. Al preparar los minerales de Wolfe, ajuste el pH a 8 después de agregar ácido nitrilotriacético (NTA). Luego, agregue los componentes restantes, esterilice, y guárdelos en la oscuridad o envueltos en papel de aluminio.
- Prepare 1x PBS y autoclave para esterilizar. Almacenar a 4 °C para su uso en este protocolo.
- Prepare los medios comerciales M9 según las instrucciones (Tabla 3) y el autoclave para esterilizar. Prepare suficientes medios para llenar la cámara catódica de cada reactor con 110 mL. Almacene a temperatura ambiente.
2. Día 1: Montaje del reactor BES y cultivo inicialdeL. plantarum
NOTA: Consulte la Figura 2 para obtener un esquema de un reactor BES y un diagrama que detalla las piezas de montaje indicadas en el protocolo.
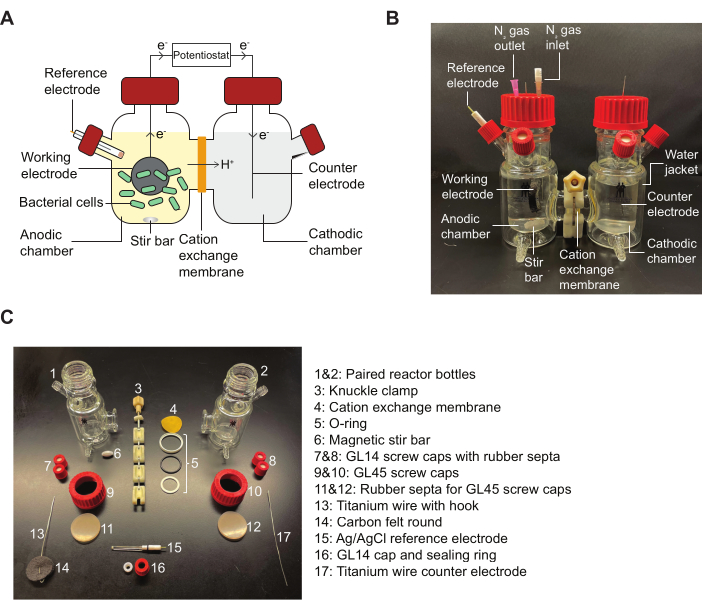
Figura 2: Componentes de BES y diagrama para el montaje. (A) Un esquema de un reactor BES de dos cámaras. Las bacterias (verde) en la cámara anódica transfieren electrones a un electrodo de trabajo (círculo negro) en presencia de un mediador de quinona. Los electrones fluyen a través del circuito hacia la cámara catódica, lo que permite que un potenciostato tome medidas de corriente entre el ánodo y el cátodo. (B) Una imagen que representa un reactor BES completamente ensamblado, incluyendo agujas de entrada y salida N2 en la cámara anódica. (C) Una imagen que represente todas las partes de un reactor desmontado. Abreviatura: BES = sistema bioelectroquímico. Haga clic aquí para ver una versión más grande de esta figura.
- Ensamblar y esterilizar reactores.
- Prepare los electrodos de trabajo y los contraelectrodos. Lije los hilos de titanio precortados de 1,0 mm de diámetro para el trabajo y los contraelectrodos con papel de lija de óxido de aluminio hasta que queden uniformemente brillantes. Con unos alicates, doble un extremo de cada alambre de electrodo de trabajo en un pequeño gancho. Deslice un tubo de fieltro de carbono de16 cm2 en cada alambre del electrodo de trabajo, tejiendo el alambre dentro y fuera del tubo de fieltro de carbono una vez y tirando del círculo hacia abajo del alambre hasta que quede asegurado en el gancho. Asegure los electrodos de trabajo y los contraelectrodos en las tapas GL45 perforando el tabique de goma con el cable y tirando de él unos centímetros.
- Para ensamblar reactores emparejados, primero ensamble la junta tórica y coloque una membrana de intercambio catiónico precortada que se haya empapado previamente en agua en la junta tórica ensamblada. Coloque la junta tórica con la membrana entre las grandes aberturas inferiores de dos botellas de reactor emparejadas. Asegure el par de reactores, las botellas y la junta tórica con la membrana con una abrazadera de nudillo para apretarla con los dedos. Coloque una barra de agitación magnética en cada cámara anódica y luego cierre todas las aberturas pequeñas en la parte superior de cada botella con tapas GL14 equipadas con tabiques de goma.
NOTA: No apriete demasiado las abrazaderas de los nudillos ni las tapas, ya que esto puede provocar grietas o roturas en las botellas. - Llene cada botella del reactor con 110 ml de agua desionizada (DI) y, a continuación, cierre cada botella con la tapa GL45 adecuada con electrodo. Inserte las tapas equipadas con un electrodo de trabajo redondo de fieltro de carbono presionando suavemente hacia abajo la parte superior del cartucho de fieltro para que el cartucho permanezca en el gancho.
NOTA: El fieltro de carbono fresco es hidrofóbico y repele el agua en el reactor en el ensamblaje inicial. El autoclave hará que el fieltro de carbono se vuelva adecuadamente hidrófilo para la experimentación. - Reúna las tapas de electrodos GL14 equipadas con anillos de sellado de silicona.
- Afloje suavemente todas las tapas GL45 antes de esterilizar en autoclave. Reactores llenos de agua en autoclave y tapas de electrodos para esterilizar. Después de esterilizar en autoclave, deje que los reactores se enfríen a temperatura ambiente.
- Cultivo L. plantarum NCIMB8826. En condiciones estériles, raspe algunas bacterias de la parte superior de una reserva de glicerol e inocule en 3 ml de medios comerciales de MRS. Cultive el cultivo durante la noche a 37 °C sin agitar.
NOTA: L. plantarum no utiliza oxígeno como aceptor terminal de electrones; Por lo tanto, no es necesario oxigenar el medio agitando26. Sin embargo, las condiciones de cultivo variarán si se utilizan otros microbios.
3. Día 2: Preparación de electrodos de referencia, preparación de reactores para el inicio del experimento y subcultivo de L. plantarum
- Preparar electrodos de referencia de Ag/AgCl.
NOTA: Estos pasos describen la preparación de los electrodos de referencia Ag/AgCl indicados en la Tabla de Materiales. Los usuarios deben seguir las instrucciones del fabricante si utilizan un electrodo de referencia diferente.- Desmonte los electrodos de referencia Ag/AgCl y lije los cables. Tire suavemente del electrodo de su carcasa de vidrio y mueva la carcasa de vidrio para vaciar la solución de KCl vieja. Lije suavemente los alambres de los electrodos con papel de lija de óxido de aluminio hasta que estén uniformemente brillantes para eliminar el material oxidado.
- Recoja todos los alambres de electrodos de referencia lijados en un vaso de precipitados pequeño con una pequeña barra de agitación y llene el vaso de precipitados con lejía al 100% hasta que los alambres estén completamente sumergidos. Clorure los alambres dejando que los alambres se blanqueen en una plataforma de agitación durante 30 minutos hasta que los electrodos se vuelvan grises más oscuros. Después del blanqueo, enjuague bien los cables de los electrodos con agua desionizada.
- Para volver a montar un electrodo de referencia, utilice una jeringa para llenar completamente la carcasa de vidrio con una solución de KCl 3 M saturada con cloruro de plata, golpeando suavemente el lado para desalojar las burbujas de aire. Con la misma jeringa, llene la tapa del alambre del electrodo con solución de KCl y luego inserte el alambre en la carcasa. Coloque la parte inferior de la carcasa de vidrio contra una toalla de papel en la mesa de trabajo, inserte el electrodo en la carcasa de vidrio y luego presione firmemente la tapa para cerrar el electrodo. Guarde los electrodos de referencia en un vaso de precipitados poco profundo con solución de KCl hasta que los necesite y repita con todos los electrodos de referencia restantes.
- Utilice un multímetro digital para medir el voltaje de los electrodos de referencia de Ag/AgCl caseros.
- Sumerja los extremos de los electrodos de referencia de Ag/AgCl (estimados en 197 mV en comparación con el electrodo de hidrógeno estándar, SHE) a poca profundidad en un vaso de precipitados lleno de KCl 3 M. Conecte firmemente el multímetro a un electrodo de calomel saturado comprado comercialmente (SCE, 241 mV frente a SHE) que también esté sumergido en los mismos electrolitos de KCl.
- Mida la diferencia de potencial entre cada electrodo de referencia y el SCE. Confirme que los electrodos de referencia difieren del SCE en 44 ± 10 mV. Desmonte y vuelva a montar cualquier electrodo de referencia que quede fuera de este rango.
- Selle la costura donde la tapa se une a la carcasa de vidrio con parafilm.
- Preparar los reactores para la experimentación.
- En una cabina de bioseguridad estéril, intercambie el agua esterilizada en autoclave en los reactores con los medios adecuados. Vierte el agua esterilizada en autoclave. Llene las cámaras catódicas con 110 mL de medio M9 esterilizado en autoclave. Llene las cámaras anódicas con 110 mL de mCDM recién preparado.
- Instale los electrodos de referencia. Retire una tapa GL14 de cada cámara anódica y reemplácela con una tapa de electrodo esterilizada en autoclave (tapa GL14 con un anillo de sellado de silicona). Rocíe los electrodos de referencia con etanol al 70% para esterilizar, luego coloque un electrodo de referencia a través de la tapa del electrodo en cada cámara anódica.
NOTA: Asegúrese de que el electrodo de referencia no entre en contacto directo con el cartucho de fieltro de carbono. - Antes de retirar los reactores del gabinete de bioseguridad, apriete todas las tapas y abrazaderas para que queden apretadas con los dedos para evitar fugas.
- Conecte los reactores al sistema de bomba de agua. Coloque cada reactor en la plataforma de barra agitadora adecuada. Conecte los grifos de la camisa de agua de cada reactor al siguiente con tubos de goma, conectando los reactores finales a los tubos de entrada y salida de la bomba de agua.
NOTA: Asegúrese de que todas las conexiones estén apretadas y sin fugas, use bridas para asegurar la tubería si es necesario. - Llene la bomba con agua y agregue 4-6 gotas de acondicionador de agua. Encienda el sistema de bombeo y ajuste la temperatura a 30 °C. Encienda la bomba y observe el flujo de agua a través de todas las camisas de agua del reactor, asegurándose de que no haya fugas en ninguna de las conexiones.
- Encienda las plataformas de agitación y configúrelas en agitación continua a 220 RPM.
- Conecte los reactores a las líneas de gas de rociado de nitrógeno. Conecte un filtro de aire a una aguja de 4 pulgadas y 22 G e inserte la aguja a través del tabique superior de una cámara anódica del reactor en el medio para que sirva como entrada de nitrógeno. Inserte otra aguja de 1 pulgada y 18 g en el tabique superior de la cámara anódica para que sirva como salida de nitrógeno. Conecte las líneas de gas de una fuente de nitrógeno al filtro de aire y abra la válvula para permitir que el gas burbujee suavemente a través del reactor. Asegúrese de que el nitrógeno burbujee a través de todas las cámaras anódicas de forma continua durante todo el experimento para mantener las condiciones anaeróbicas.
NOTA: Asegúrese de que la aguja de entrada esté alejada del cartucho de fieltro de carbono. El chorro de burbujas no debe entrar en contacto con el fieltro de carbono ni con los electrodos de referencia. - Conecte los biorreactores a los cables de potenciostato. Conecte los cables de la pinza de cocodrilo del electrodo de trabajo, de contador y de referencia del potenciostato a sus electrodos correspondientes.
NOTA: Utilice un multímetro para verificar la resistencia entre el colector de cable/corriente y los electrodos para garantizar las conexiones eléctricas adecuadas y minimizar los posibles errores de medición.
- Parámetros de potenciostato de entrada para la ejecución previa.
NOTA: A continuación se indican los ajustes críticos de la técnica. Consulte la Tabla 4 para obtener una lista ampliada de las configuraciones de software para cada técnica.- Encienda el potenciostato e inicialice el software EC-lab en el ordenador. Conecte el potenciostato a la computadora haciendo clic en el botón del símbolo de potenciostato en el panel superior izquierdo debajo de Dispositivos. Una vez conectado, el nombre del dispositivo aparecerá con un círculo verde en el cuadro de texto de abajo.
- Sincronice todos los canales conectados a los biorreactores en un grupo haciendo clic en la pestaña Editar y, a continuación, seleccionando sincronizar. Haga clic en las casillas de número de canal correspondientes | ok.
- Agregue la técnica de voltaje de circuito abierto (OCV) al potenciostato haciendo clic en el botón + en el panel Configuración de parámetros a la izquierda. En el cuadro de configuración azul; Configúrelo para medir el potencial del electrodo de trabajo (EWE) contra el electrodo de referencia (RE), registrando el tiempo en el intervalo dt cada 36 s durante un total de 3 h.
- A continuación, añada la técnica de voltamperometría cíclica (CV) al potenciostato. Ajuste el potencial inicial del EWE a Ei de 0 V frente a RE con una velocidad de escaneo de 2 mV/s. Barrido a un potencial de vértice (E1) de 0,4 V frente a RE, inversión a potencial de vértice (E2) de -0,7 V frente a RE. Repita el escaneo para un total de dos barridos.
NOTA: En los sistemas electroquímicos microbianos, la inoculación microbiana y la formación de biopelículas inducen altas capacidades en comparación con los materiales metálicos o las moléculas inorgánicas. Durante el escaneo de voltamperometría cíclica, el potencial varía y una corriente de carga actúa como fondo. Para lograr una alta relación señal-ruido, se necesitan velocidades de escaneo más bajas, aunque esto aumenta la duración del escaneo. Dado que escaneamos dos ciclos que cubren una amplia ventana electroquímica de 1,1 V, una velocidad de escaneo de 2 mV/s da como resultado un medio ciclo que tarda hasta 9,1 min. En consecuencia, dos ciclos tardan un total de 36,4 min. Reducir aún más la velocidad de escaneo llevaría demasiado tiempo. - Añadir la técnica cronoamperometría (CA). Aplique un potencial constante EWE de 0,2 V frente a RE durante un tiempo de t = 200 h, registrando el tiempo en intervalos dt cada 25-40 s. Ajuste el intervalo de tiempo en función del software de potenciostato para obtener el nivel de detalle deseado.
NOTA: El potencial del punto medio del DHNA es de aproximadamente -0,093 V frente a Ag/AgCl; por lo tanto, un potencial aplicado de 0,2 V frente a RE al electrodo de trabajo es suficiente para permitir la transferencia de electrones del DHNA al electrodo. - Después de ingresar todos los parámetros, comience la ejecución presionando el triángulo de inicio verde. Guarde el archivo como desee según las indicaciones del software y, a continuación, haga clic en Guardar. El software comenzará la técnica 1, "OCV". Observe las trazas de OCV durante unos minutos para asegurarse de que todos los reactores leen positivamente y se acercan con una señal constante. Deje que el experimento se ejecute durante la noche para completar el OCV y el CV inicial (consulte la figura complementaria S1 para ver el CV de control de medios) y permita que la CA se ejecute hasta que se estabilice.
- En condiciones estériles, subcultive el cultivo de MRS de L. plantarum 1:200 en 50 mL de mMRS. Haga crecer las células durante la noche a 37 °C sin agitar.
NOTA: Un cultivo nocturno de 50 mL suele producir celdas más que suficientes para seis reactores, suponiendo un diámetro exterior final de600 de 0,2 en el reactor. Ajuste los volúmenes de cultivo en consecuencia para experimentos más grandes o más pequeños.
4. Día 3: Inyección de células y DHNA/DMSO
- Lavar las células e inyectarlas en los reactores.
- Retire el cultivo de MMRS L. plantarum de la incubadora por la mañana. En condiciones estériles, transfiera el cultivo a un tubo cónico de 50 ml y coloque el cultivo en hielo.
- Lave las celdas 2 veces en PBS estéril, frío 1x. Para ello, centrifugar el cultivo a 4.000 × g durante 5 min en una centrífuga a 4 °C para peletizar las células. En condiciones estériles, vuelva a suspender las células de forma suave pero completa en 50 ml de PBS, y luego vuelva a centrifugar como antes; Repita para un segundo lavado. Después de la centrífuga final, vuelva a suspender las células en PBS frío a OD600 = 11.
- En condiciones estériles, cargue 2 mL de células resuspendidas en una jeringa de 3 mL provista de una aguja para cada reactor.
- En la estación del reactor, destape una jeringa de celda e inserte la aguja en la parte superior de la cámara anódica del reactor. No presione el émbolo de la jeringa en este momento; Repita el procedimiento para todos los reactores. Una vez que todas las jeringas estén en su lugar, presione los émbolos para inyectar las celdas en los reactores y registre el tiempo de inyección a partir de la traza de CA. Este volumen de celdas produce un OD final de600 de 0,2 en los reactores. Deseche todas las jeringas en cajas de riesgo biológico y las agujas en el contenedor designado para objetos punzocortantes de riesgo biológico. Deje que la corriente se estabilice a plana en la traza de CA durante 2-4 h.
NOTA: Tras la inyección, se pueden observar fluctuaciones de corriente en la traza de CA. Después de 2-4 h, estas fluctuaciones se estabilizarán a una corriente plana (cambio de corriente de <2 μA en el transcurso de una hora), momento en el que se puede inyectar DHNA.
- Mida el pH inicial e inyecte DHNA.
- Prepara una solución de DHNA. En un tubo de 1,5 mL, prepare 500 μL de una solución de DHNA de 20 mg/mL disolviendo DHNA en polvo en DMSO al 100%. Llene 3 jeringas de insulina con 110 μL de solución de DHNA y 3 jeringas de insulina con 110 μL de DMSO solamente.
NOTA: Si bien el DHNA es ligeramente soluble en agua, el DMSO es un mejor solvente para las existencias de DHNA a esta concentración. El solvente mediador puede variar si se utilizan otros mediadores. - En la estación de reactores BES, etiquete los reactores experimentales como + DHNA y los reactores de control de solventes como - DHNA. Destape una jeringa de DHNA e inserte la jeringa en la parte superior de cada cámara anódica designada como + DHNA. Inserte una jeringa de solo DMSO en cada cámara anódica designada como - DHNA. No presione los émbolos de la jeringa en este momento.
- Tome muestras de punto de tiempo de 0 h para el análisis de muestras. Usando una jeringa de 3 mL equipada con una aguja de 2 pulgadas y 21 G, tome una muestra de medio de 2 mL de cada cámara anódica a través del tabique de tapa pequeña no utilizado y transfiera las muestras a una placa de 24 pocillos profundos para tomar mediciones de pH para el punto de tiempo de 0 h (punto de inyección de DHNA). Si lo desea, tome 1 ml de medio gastado de cada cámara anódica y filtre a través de un filtro de 0,2 μm en tubos limpios etiquetados para cuantificar los metabolitos mediante HPLC u otros ensayos. Almacene las muestras de medios gastados a -80 °C.
- Presione los émbolos de todas las jeringas de DHNA y DMSO para inyectarlas en los reactores. Registre la hora de la inyección a partir del seguimiento de CA. Deseche todas las jeringas y agujas de manera adecuada.
- Mida y registre las muestras de pH 0 h para cada reactor.
- Prepara una solución de DHNA. En un tubo de 1,5 mL, prepare 500 μL de una solución de DHNA de 20 mg/mL disolviendo DHNA en polvo en DMSO al 100%. Llene 3 jeringas de insulina con 110 μL de solución de DHNA y 3 jeringas de insulina con 110 μL de DMSO solamente.
5. Día 4: Finalización del experimento y recogida de muestras
- Realizar análisis electroquímicos 24 horas después de la inyección de DHNA y tomar las muestras finales.
- Finalice la ejecución de CA 24 horas después de la inyección de DHNA.
- Tome muestras de puntos de tiempo de 24 h para el análisis de muestras de acuerdo con el paso 4.2.3.
- Vuelva a ejecutar CV para el punto de tiempo de 24 horas de acuerdo con los parámetros descritos en el paso 3.3.4.
- Mida y registre el pH de las muestras de 24 h de cada reactor.
- Desmontar y limpiar los reactores.
- Apague el potenciostato. A continuación, desconecte los cables de trabajo, de contador y de referencia de cada reactor. Limpie la humedad de las pinzas de cocodrilo de plomo potenciostato.
- Cierre el flujo de gas nitrógeno. Desconecte los cables de gas y, a continuación, retire las agujas de entrada y salida. Deseche todas las agujas de manera apropiada en un recipiente para objetos punzocortantes.
- Apague la bomba de agua. Desconecte los tubos de entrada y salida de la bomba y permita que el agua se drene en un balde. Al desconectar, mantenga los extremos de los tubos elevados por encima de la línea de agua de la bomba para evitar que el agua caiga en el suelo. Uno por uno, desconecte cada reactor de la tubería de la camisa de agua, trabajando desde el reactor de salida final hasta el reactor de entrada inicial.
- Vacíe todos los medios de los reactores en un recipiente grande para riesgos biológicos. Siga los métodos normales de blanqueo de cultivos para su eliminación.
- Una vez vaciado, desmontar y limpiar todas las piezas del reactor. Deseche las membranas de intercambio catiónico y las rondas de fieltro de carbono en los desechos de riesgo biológico adecuados. Limpie los electrodos de referencia y los cables de titanio con etanol al 70% y guarde los electrodos de referencia limpios en un vaso de precipitados poco profundo lleno de agua. Limpie suavemente las botellas, tapas, juntas tóricas y abrazaderas del reactor en agua tibia con detergente de laboratorio, enjuague a fondo con agua desionizada y seque al aire todas las piezas antes de almacenarlas.
6. Día 5: Análisis electroquímico
NOTA: A continuación se muestra una descripción general del trazado de datos para este protocolo. En la sección de Resultados Representativos se proporcionarán descripciones más detalladas sobre el análisis y la interpretación de los datos.
- Para el análisis de CA: Establezca el tiempo de inyección de DHNA como el punto de tiempo 0 h. Represente el promedio y la desviación estándar de la densidad de corriente medida (j en μA/cm2) tomada cada 36 s para todas las réplicas desde el punto de tiempo 0 h en función del tiempo (h). Calcule la densidad de corriente en función del área del electrodo de trabajo (16 cm2).
- Para el análisis de CV: Traza una traza de CV representativa para cada condición experimental (solo medios, DMSO o DHNA) que represente la densidad de corriente (j en μA/cm2) en función del potencial del electrodo de trabajo (EWE en V). Traza el segundo ciclo de la ejecución de CV seleccionada.
Resultados
Análisis de cronoamperometría
La EET de L. plantarum se puede observar a través de los datos de cronoamperometría (CA) representados en la Figura 3, en los que la traza de densidad de corriente visualiza la transferencia de electrones de L. plantarum al electrodo de trabajo. Monitoreamos la densidad de corriente (j) en función del tiempo mientras manteníamos un potencial constante de +200 mV frente a Ag/AgCl durante 24 h. Al inyectar 20 μg/mL de DHNA en la solución electrolítica de agitación, se observó un pico de oxidación abiótica de DHNA, seguido de un rápido aumento en la densidad de corriente biótica que alcanzó un máximo de 132,0 ± 2,47 μA/cm2 aproximadamente en el punto de tiempo de 8 h. Por el contrario, la inyección de DMSO dio como resultado una densidad de corriente insignificante. Estos resultados enfatizan la importancia del DHNA como un mediador necesario y eficiente para facilitar la transferencia de electrones entre L. plantarum y el electrodo. Los usuarios pueden ajustar la salida de corriente ajustando la concentración de DHNA en el BES. Investigaciones anteriores también indican que L. plantarum responde al DHNA de una manera dependiente de la dosis en una amplia gama de concentraciones de DHNA, produciendo una corriente significativa en presencia de concentraciones de DHNA tan bajas como 0,01 μg/mL13,22.
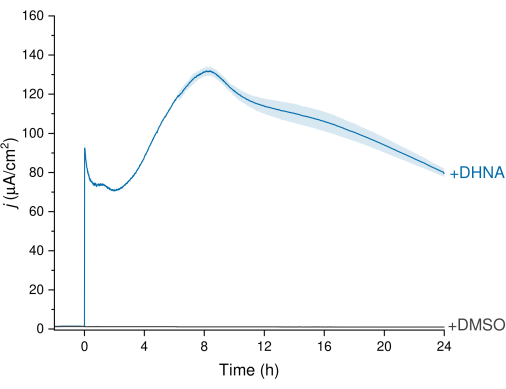
Figura 3: Análisis de cronoamperometría de EET de Lactiplantibacillus plantarum mediado por DHNA. Se inyectó DHNA (20 μg/mL) o DMSO en electrolitos mCDM (pH~ 6,5) con un tiempo de inyección identificado como t = 0. j representa la densidad de corriente en función del área del electrodo de trabajo. Los experimentos se llevaron a cabo a 200 mV frente a Ag/AgCl con un electrodo de fieltro de carbono (16cm2) y agitación. Los valores se representan como media ± sd obtenidos en reactores BES por triplicado. Abreviaturas: EET = transferencia extracelular de electrones; DHNA = ácido 1,4-dihidroxi-2-naftoico; DMSO = sulfóxido de dimetilo; mCDM = Medio Químicamente Definido con manitol. Haga clic aquí para ver una versión más grande de esta figura.
Análisis de voltamperometría cíclica
Para evaluar más a fondo la EET mediada por DHNA en L. plantarum, realizamos voltamperometría cíclica 24 h después de la inyección de DHNA. Aquí mostramos trazas CV para tres condiciones: L. plantarum con 20 μg/mL de DHNA, L. plantarum con DMSO y medios con 20 μg/mL de DHNA. Como se muestra en la Figura 4A, la presencia de 20 μg/mL de DHNA en los reactores que contenían L. plantarum dio lugar a un claro aumento de la corriente oxidativa a 50 mV que no se produjo en presencia de DMSO solo. Estos datos confirman que la adición del mediador redox DHNA es necesaria para facilitar la transferencia de electrones entre L. plantarum y el ánodo. Si bien observamos varios picos redox más pequeños en el rastro de L. plantarum + DMSO, estos picos fueron similares al rastro de control de medios y probablemente se atribuyen a componentes redox-activos en mCDM (Figura suplementaria S1). En la Figura 4B, comparamos trazas de DHNA en condiciones bióticas (L. plantarum + DHNA) frente a DHNA en condiciones abióticas (Media + DHNA). Si bien ambas trazas exhibieron un pico oxidativo distinto de DHNA alrededor de 50 mV, observamos un aumento sostenido en la corriente más allá de 50 mV solo en condiciones bióticas. El pico catalítico alcanzó una densidad de corriente de 129 μA/cm2 a 300 mV, lo que representa un aumento del 256% en comparación con la traza abiótica. Este perfil CV de recambio es característico del EET27 microbiano, lo que indica una rereducción de DHNA por parte de las células de L. plantarum en presencia de una fuente de electrones (manitol) después de la oxidación del DHNA en el ánodo. Además, la traza abiótica exhibió nuevos picos oxidativos alrededor de -240 mV y -180 mV. Investigaciones previas indican que la aparición de estos picos puede deberse a la degradación del DHNA en ACNQ (2-amino-3-carboxi-1,4-naftoquinona)21,28. No observamos estos picos en el rastro biótico, lo que indica que la interacción de las células de L. plantarum con el DHNA puede estabilizar el DHNA y prevenir la degradación. Un punto a tener en cuenta es que el rastreo de 24 h para medios con 20 μg/mL de DHNA se realizó por separado de acuerdo con este protocolo sin agregar células.
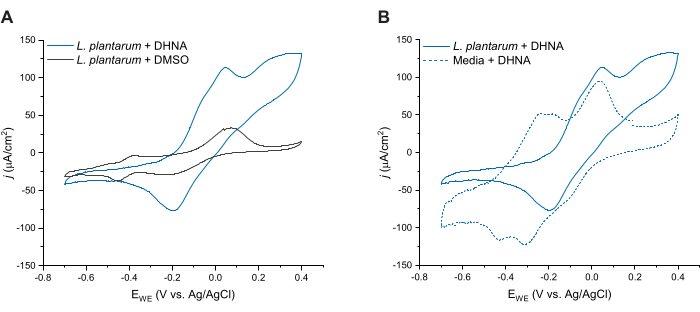
Figura 4: Trazas representativas de voltamperometría cíclica. Todos los experimentos de CV se realizaron en mCDM utilizando fieltro de carbono (16cm2) como electrodo de trabajo a una velocidad de barrido de 2 mV/s mientras se agitaba la solución. (A) Trazas CV para Lactiplantibacillus plantarum con DHNA (20 μg/mL) o DMSO a t = 24 h. (B) Trazas CV de 20 μg/mL de DHNA en L. plantarum (condiciones bióticas) o mCDM solo (condiciones abióticas) a t = 24 h. Abreviaturas: CV = voltamperometría cíclica; mCDM = Medio Químicamente Definido con manitol; DHNA = ácido 1,4-dihidroxi-2-naftoico; DMSO = sulfóxido de dimetilo. Haga clic aquí para ver una versión más grande de esta figura.
Análisis de pH
La actividad de EET en L. plantarum resultó en una caída notable del pH durante 24 h. Como se muestra en la Figura 5, el pH promedio de la muestra de L. plantarum expuesto a DHNA bajó a 3.33 ± 0.01 (p = 6.85 × 10-6, n = 3), mientras que el pH promedio de la muestra de L. plantarum expuesto a DMSO bajó a 6.50 ± 0.06 (p = 0.0409, n = 3). Como se ha demostrado en investigaciones previas, esta caída se atribuye a un aumento en el metabolismo fermentativo que ocurre cuando L. plantarum realiza EET13. L. plantarum normalmente metaboliza el manitol a través de la glucólisis y las vías fermentativas, que producen acetato, lactato y etanol como productos al final de la fermentación y generan ATP a través de la fosforilación a nivel de sustrato29. En condiciones de EET, el flujo metabólico a través de la fermentación aumenta, aumentando así la producción de productos finales de fermentación en el medio BES13. Este cambio metabólico hace que el pH del medio caiga más rápidamente en los reactores con DHNA en comparación con los reactores de control DMSO.
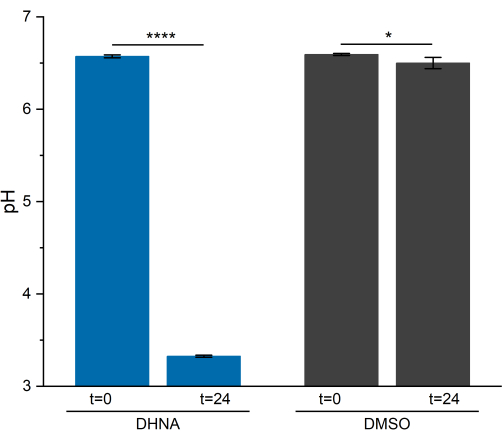
Figura 5: Análisis de pH del sistema bioelectroquímico de Lactiplantibacillus plantarum . Las muestras se recogieron a t = 0 y t = 24 h durante la cronoamperometría. Los valores se representan como media ± sd obtenidos en reactores BES por triplicado. La significación se determinó mediante una prueba t de una cola. DHNA: Valor P = 6,85 × 10-6. DMSO: Valor P = 0,0409. Abreviaturas: DHNA = ácido 1,4-dihidroxi-2-naftoico; DMSO = sulfóxido de dimetilo. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Ingredientes para la preparación de medios mMRS24. Haga clic aquí para descargar esta tabla.
Tabla 2: Ingredientes para la preparación de medios mCDM. Esta tabla se ha tomado de Tejedor-Sanz et al.13 y Aumiller et al.25. Haga clic aquí para descargar esta tabla.
Tabla 3: Ingredientes para la preparación de medios M9. Haga clic aquí para descargar esta tabla.
Tabla 4: Configuración de los parámetros de EC-Lab para las técnicas OCV, CA y CV. Abreviaturas: OCV = voltaje de circuito abierto; CA = cronoamperometría; CV = voltamperometría cíclica. Haga clic aquí para descargar esta tabla.
Figura suplementaria S1: Trazas representativas de voltamperometría cíclica de Lactiplantibacillus plantarum con DMSO y mCDM solos. Trazas de CV para L. plantarum con DMSO a t = 24 h y mCDM solo a t = 0 h. Todos los experimentos de CV se realizaron utilizando fieltro de carbono (16cm2) como electrodo de trabajo a una velocidad de barrido de 2 mV/s mientras se agitaba la solución. Abreviaturas: CV = voltamperometría cíclica; mCDM = Medio Químicamente Definido con manitol; DHNA = ácido 1,4-dihidroxi-2-naftoico; DMSO = sulfóxido de dimetilo. Haga clic aquí para descargar este archivo.
Discusión
Utilizando el sistema bioelectroquímico de tres electrodos y dos cámaras descrito aquí, mostramos la medición de la generación de corriente a partir de EET mediada por DHNA en L. plantarum. Estos experimentos BES generan datos de alta calidad; sin embargo, los BES son sensibles. Por lo tanto, el éxito del protocolo depende de la precisión del usuario, particularmente en el ensamblaje del reactor y el electrodo de referencia, el posicionamiento de las agujas y los electrodos dentro de la cámara anódica y el reemplazo de la membrana de intercambio catiónico. Es fundamental ensamblar los reactores con cuidado, asegurándose de que no haya fugas de agua/medios durante la esterilización en autoclave o la experimentación. Las fugas de agua se pueden resolver asegurándose de que las membranas de intercambio catiónico estén cortadas para que se ajusten con precisión a la junta tórica y apretando la abrazadera de los nudillos para que quede bien apretada con los dedos. También es esencial sumergir completamente el fieltro de carbono en agua durante el autoclave para permitir que se vuelva hidrófilo para la experimentación. Recomendamos a los nuevos usuarios que permitan que los reactores recién ensamblados llenos de agua permanezcan durante 2 horas antes de la esterilización en autoclave, verificando si hay signos de fugas lentas debajo de las uniones principales de la botella. Además, garantizar un conjunto de electrodos de referencia adecuado garantiza una replicación de datos coherente en todos los reactores. Si la frita de teflón dentro de la carcasa de vidrio se decolora, se agrieta o se seca, esto puede causar una alta resistencia del electrodo de referencia. Los usuarios pueden reemplazar la carcasa de vidrio para restaurar el rendimiento del electrodo de referencia.
La orientación adecuada de todas las agujas y electrodos dentro de la cámara anódica durante la experimentación es fundamental para el éxito del experimento. El electrodo de referencia no debe entrar en contacto directo con ninguna parte del electrodo de trabajo de fieltro de carbono. Los usuarios pueden ajustar la posición del fieltro de carbono girando suavemente el alambre de titanio del electrodo de trabajo desde arriba del reactor. Además, la colocación de la aguja para el rociado de nitrógeno no debe entrar en contacto directo con los electrodos dentro de la cámara ni con ninguna conexión de electrodo/potenciostato por encima de la cámara. La corriente de nitrógeno debe ajustarse para que no fluya hacia ninguno de los electrodos. Finalmente, los usuarios deben asegurarse de que la barra de agitación no entre en contacto con el electrodo de trabajo colocando el electrodo de trabajo 1-2 cm por encima de la barra de agitación. Si se observa una señal errática en OCV, esto generalmente se puede resolver asegurando la ubicación adecuada de los electrodos y la corriente de nitrógeno dentro del reactor, y verificando que las conexiones entre los cables de potenciostato y los electrodos del reactor sean correctas y seguras. Por último, nuestra experiencia muestra que los mediadores de electrones como el DHNA pueden ser retenidos dentro de la membrana de intercambio catiónico y causar una alta corriente de fondo si se reutilizan demasiadas veces. Recomendamos reemplazar la membrana de intercambio catiónico después de dos o tres usos, especialmente cuando se investiga la EET mediada, para garantizar resultados experimentales confiables.
A diferencia de la EET directa, donde la unión microbiana directa al electrodo facilita la transferencia de electrones, la EET mediada requiere una difusión constante de lanzaderas de electrones a través de la membrana celular y el electrodo, lo que da como resultado las configuraciones únicas de BES descritas aquí. En primer lugar, elegimos un BES de doble cámara en lugar de la contraparte de una sola cámara en nuestro protocolo para separar las reacciones anódicas y catódicas con una membrana de intercambio catiónico. Esta separación evita que los mediadores de electrones de difusión libre (DHNA) y los microbios interactúen con el cátodo, lo que garantiza que el EET microbiano sea la principal fuente de electrones para reducir los mediadores de electrones y el ánodo. La separación también permite un control preciso de parámetros como la concentración/distribución del mediador y el potencial alcanzado en el ánodo. Además, elegimos fieltro de carbono como material anódico entre otras opciones como varillas de grafito, electrodos metálicos, carbono vítreo u óxido de indio y estaño (ITO). Esto se debe a que la estructura porosa 3D del fieltro de carbono proporciona un área de superficie mucho mayor que esos electrodos30, lo que permite una utilización eficiente de los mediadores incluso a altas concentraciones. Nuestros ajustes de BES de tres electrodos y dos cámaras proporcionan una lectura fiable y reproducible de la EET mediada incluso durante la monitorización a largo plazo; sin embargo, este proceso tiene un rendimiento relativamente bajo. Este protocolo es adecuado para la comprensión a escala de laboratorio de los mecanismos de EET o para probar prototipos de aplicaciones de EET. Los investigadores pueden considerar arquitecturas BES alternativas, como BESs31,32 portátiles o impresas, matrices de semiconductores de óxido metálico complementarios (CMOS)33 o BESs34 a escala mejorada para diferentes propósitos fundamentales o de aplicación.
En este protocolo, proporcionamos instrucciones detalladas para las técnicas electroquímicas más utilizadas: cronoamperometría (CA) y voltamperometría cíclica (CV). Vale la pena señalar que otras técnicas electroquímicas, como la espectroscopia de impedancia electroquímica (EIS) y la voltamperometría de pulso diferencial (DPV), pueden proporcionar información más profunda sobre el BES mediante el análisis de la resistencia de transferencia de carga y la capacitancia de doble capa 35,36,37. Si bien este protocolo BES permite mediciones de EET, complementar los datos electroquímicos con mediciones de actividad metabólica y biomasa celular también puede ser esencial para un análisis completo. Microbios como L. plantarum se involucran con EET como uno de los sumideros de electrones junto con otros subproductos de la fermentación como el lactato y el etanol. Además, cabe destacar que el crecimiento de la biomasa celular también sirve como sumidero de electrones13. Por lo tanto, la cuantificación de los donantes de electrones consumidos (por ejemplo, manitol), la evaluación del crecimiento de la biomasa celular y el seguimiento de los subproductos de la fermentación ofrecen una visión más profunda de la eficiencia y las ramificaciones fisiológicas de la EET. Los metabolitos celulares se cuantifican comúnmente mediante cromatografía y ensayos enzimáticos, mientras que la viabilidad y el crecimiento celular se evalúan mediante el recuento de unidades formadoras de colonias y la medición de la densidad óptica de los medios gastados a 600 nm, respectivamente13. También es importante tener en cuenta que las mediciones de EET son sensibles a pequeñas perturbaciones en condiciones experimentales. Esto incluye, entre otros, el pH, la temperatura, la velocidad de agitación y la tasa de rociado de gas nitrógeno38. Por lo tanto, la normalización de los niveles medidos de EET con mediciones bioanalíticas actúa como un control interno, lo que facilita una evaluación coherente en todos los experimentos realizados en diferentes días.
Combinando técnicas electroquímicas con otras mediciones bioanalíticas, la EET mediada crea nuevas oportunidades para la electrofermentación y la bioelectrocatálisis. El uso convencional de electrocatalizadores orgánicos, inorgánicos o enzimáticos plantea desafíos debido a su alto costo y son propensos a la degradación. Por otra parte, el uso de microbios como electrocatalizadores vivos ofrece una solución menos costosa y más escalable debido a las capacidades de auto-reparación y auto-replicación de los microbios39. L. plantarum, generalmente reconocida como una bacteria de ácido láctico segura, es un chasis particularmente intrigante. Utilizando configuraciones electroquímicas idénticas descritas en este protocolo, hemos demostrado previamente que L. plantarum puede fermentar jugo de col rizada en condiciones de EET y acelerar el flujo metabólico hacia la producción de más productos finales de fermentación como lactato, acetato y succinato13; Estos ácidos orgánicos son compuestos de sabor esenciales en la fermentación de los alimentos. Esto implica que, mediante el uso de técnicas electroquímicas, la EET mediada en L. plantarum puede ser potencialmente secuestrada para manipular el flujo metabólico, alterar los sabores de los alimentos o producir productos químicos valiosos. Vale la pena señalar que las técnicas electroquímicas presentadas en este protocolo no solo se pueden aplicar a L. plantarum, sino que también se pueden aplicar genéricamente a otros microbios nativos o modificados que realizan EET mediada40,41. Diferentes mediadores de electrones, como flavina, ferroceno, rojo neutro, ferricianuro, lawona y menadiona pueden seleccionarse en función del mecanismo de transferencia de electrones del microbio específico que se utiliza22,42. Por otra parte, el protocolo BES establecido en este trabajo puede extenderse a exoelectrógenos que realizan EET sin mediador, como se demostró previamente con las especies Shewanella y Geobacter 43,44. Se debe utilizar un medio de crecimiento optimizado para apoyar la actividad celular del microbio en particular para facilitar su rendimiento de EET. Este protocolo ajusta los parámetros para la EET mediada por DHNA en L. plantarum, pero se esperan modificaciones cuando se aplican mediadores de microbios y electrones diferentes.
Divulgaciones
Los autores no tienen intereses contrapuestos que declarar.
Agradecimientos
Agradecemos a los miembros del laboratorio de Ajo-Franklin por sus perspicaces discusiones sobre el ensamblaje, el mantenimiento, los pasos críticos y la resolución de problemas de BES. La investigación fue patrocinada por la Oficina de Investigación del Ejército y se llevó a cabo bajo la subvención número W911NF-22-1-0239 (a C. M. A-F, apoyando a R. A.) y por el Instituto de Investigación y Prevención del Cáncer de Texas, subvención # RR190063 (a C. M. A-F, apoyando a R. C., S. L. y B. B. K.). La Figura 1 se creó con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,4-Dihydroxy-2-naphthoic acid (DHNA) | Sigma-Aldrich | 281255-25G | |
| 1.0 mm diameter titanium wire | Thermo Fisher Scientific | 045485.BY | Cut to size for working and counter electrodes |
| 120-C Aluminum Oxide Sheets 9" x 11" | Johnson Abrasives | 10108-15 | |
| 3 mL plastic syringes | Thermo Fisher Scientific | 14955457 | |
| 3M KCl solution saturated with silver chloride | Millipore Sigma | 60137-250ML | |
| 6.35-mm-thick carbon felt | Thermo Fisher Scientific | 043200.RF | Cut into 16 cm2 rounds |
| Ag/AgCl reference electrode | CH Instruments | CH111 | |
| Air-Tite Premium Hypodermic Needles | Thermo Fisher Scientific | 14-817-102 | |
| AlK(SO)4 * 12H2O | Sigma-Aldrich | 237086-100G | |
| Ammonium citrate tribasic | Millipore Sigma | A1332 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99517 | |
| BD Precision Glide Needle, 18 G x 1 inch | Thermo Fisher Scientific | 14-826-5G | |
| BD Precision Glide Needle, 21 G x 2 inch | Thermo Fisher Scientific | 14-821-13N | |
| Bel-Art SP Scienceware Cleanware Aqua-Clear Water Condtioner | Thermo Fisher Scientific | 23-278339 | |
| Biotin | Millipore Sigma | B4639 | |
| CaCl2 | Millipore Sigma | C4901 | |
| Calcium D-(+)-pantothenate | Millipore Sigma | 1087009 | |
| Casamino acids | Millipore Sigma | 2240-OP | |
| cation exchange membrane | Membranes International | CMI-7000 | Cut into rounds fit to the BES O-ring |
| CoCl2 * 6H2O | Millipore Sigma | C8661 | |
| CuSO4 * 5H2O | Millipore Sigma | C8027 | |
| Cysteine-HCl * H2O | Millipore Sigma | 30129 | |
| DMSO | Millipore Sigma | 5439001000 | |
| DS-11+ Spectrophotometer | Denovix | N/A | |
| EC-Lab Software | BioLogic | N/A | |
| ECO E 4 S heating circulator | Lauda-Brinkmann | Cat. No. 115 V; 60 Hz : L001191 | |
| FeSO4 * 7H2O | Millipore Sigma | 215422 | |
| Folic acid | Millipore Sigma | F8758 | |
| H3BO3 | Millipore Sigma | B6768 | |
| Insulin syringes with BD Micro-Fine IV Needle | Thermo Fisher Scientific | 14-829-1A | |
| Lactiplantibacillus plantarum NCIMB8826 | N/A | N/A | Reference: Tejedor-Sanz et al., 2022 |
| Lactobacillus MRS Broth | HiMedia | M369 | |
| M9 Broth | Milliport Sigma | 63011 | |
| Magnesium sulfate anhydrous | Millipore Sigma | 208094 | |
| Manganese sulfate monohydrate | Millipore Sigma | 221287 | |
| mannitol | Millipore Sigma | M1902-1KG | |
| Mettler Toledo FiveEasy Benchtop pH Meter | Hogentogler | F20-KIT | |
| MgCl2 * 6H2O | Millipore Sigma | M9272 | |
| MgSO4 * 7H2O | Millipore Sigma | M2773 | |
| Millex - GV 0.22 µm PVDF Membrane Filter Unit | Millipore Sigma | SLGV004SL | |
| MnCl2 * 4H2O | Millipore Sigma | 203734 | |
| MnSO4 * H2O | Millipore Sigma | 221287 | |
| MOPS | Millipore Sigma | M1442 | |
| N2 gas | Airgas | NI UHP300 | Filter before use |
| Na2MoO4 * 2H2O | Millipore Sigma | 331058 | |
| Na2SO4 | Millipore Sigma | 238597 | |
| NaCl | Millipore Sigma | S9888 | |
| NH4Cl | Millipore Sigma | A9434 | |
| Nicotinic acid | Millipore Sigma | N-0761 | |
| Nitrilotriacetic acid (NTA) | Millipore Sigma | 72560 | |
| p-Aminobenzoic acid | Millipore Sigma | P9879 | |
| Phosphate buffered saline, 10x solution | Thermo Fisher Scientific | BP399-1 | |
| Potassium phosphate dibasic | Millipore Sigma | P8281 | |
| potentiostat | BioLogic | VMP-300 | |
| Protease peptone #3 | Bacto | 211693 | |
| Pyridoxine HCl | Millipore Sigma | P6280 | |
| Riboflavin | Millipore Sigma | 555682 | |
| RO10 magnetic stir bar platform | IKA | 3691000 | |
| Sodium acetate trihydrate | Millipore Sigma | 935700 | |
| Stir bar, egg-shaped | Thermo Fisher Scientific | 14-512-121 | Place in anodic chamber of BES |
| Thiamine HCl | Millipore Sigma | V-014 | |
| Thioctic acid (α-Lipoic acid) | Millipore Sigma | T-1395 | |
| Tryptophan | Millipore Sigma | 9136 | |
| Tween80 | Millipore Sigma | P4780 | |
| Vitamin B12 | Millipore Sigma | V6629 | |
| Jacketed MCF set, 100 ml, NW25, 2 x GL14 port | Adams & Chittenden Scientific Glass | NA | Customized |
| Yeast extract | Millipore Sigma | Y1625 | |
| ZnSO4 * 7H2O | Millipore Sigma | Z0251 |
Referencias
- TerAvest, M. A., Ajo-Franklin, C. M. Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng. 113 (4), 687-697 (2016).
- Chen, H., Dong, F., Minteer, S. D. The progress and outlook of bioelectrocatalysis for the production of chemicals, fuels and materials. Nat Catal. 3 (3), 225-244 (2020).
- Chen, H., et al. Fundamentals, applications, and future directions of bioelectrocatalysis. Chem Rev. 120 (23), 12903-12993 (2020).
- Lovley, D. R., Phillips, E. J. P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Appl Environ Microbiol. 54 (6), 1472-1480 (1988).
- Myers, C. R., Nealson, K. H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science. 240 (4857), 1319-1321 (1988).
- Koch, C., Harnisch, F. Is there a specific ecological niche for electroactive Microorganisms. ChemElectroChem. 3 (9), 1282-1295 (2016).
- Zhao, J., et al. Microbial extracellular electron transfer and strategies for engineering electroactive microorganisms. Biotechnol Adv. 53, 107682 (2021).
- Zhang, J., Li, F., Liu, D., Liu, Q., Song, H. Engineering extracellular electron transfer pathways of electroactive microorganisms by synthetic biology for energy and chemicals production. Chem Soc Rev. 53 (3), 1375-1446 (2024).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7 (5), 375-381 (2009).
- Logan, B. E., Rabaey, K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies. Science. 337 (6095), 686-690 (2012).
- Gu, L., Xiao, X., Yup Lee, S., Lai, B., Solem, C. Superior anodic electro-fermentation by enhancing capacity for extracellular electron transfer. Bioresour Technol. 389, 129813 (2023).
- Boucher, D. G., et al. Bioelectrocatalytic synthesis: concepts and applications. Angew Chem Int Ed. 62 (46), e202307780 (2023).
- Tejedor-Sanz, S., et al. Extracellular electron transfer increases fermentation in lactic acid bacteria via a hybrid metabolism. eLife. 11, e70684 (2022).
- Martino, M. E., et al. Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats. Environ Microbiol. 18 (12), 4974-4989 (2016).
- Fidanza, M., Panigrahi, P., Kollmann, T. R. Lactiplantibacillus plantarum-nomad and ideal probiotic. Front Microbiol. 12, 712236 (2021).
- Duar, R. M., et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev. 41 (Suppl_1), S27-S48 (2017).
- Kaushik, J. K., et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLOS ONE. 4 (12), e8099 (2009).
- Seddik, H. A., et al. Lactobacillus plantarum and its probiotic and food potentialities. Probiotics Antimicrob Proteins. 9 (2), 111-122 (2017).
- Siezen, R. J., et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches. Environ Microbiol. 12 (3), 758-773 (2010).
- Light, S. H., et al. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature. 562 (7725), 140-144 (2018).
- Tolar, J. G., Li, S., Ajo-Franklin, C. M. The differing roles of flavins and quinones in extracellular electron transfer in Lactiplantibacillus plantarum. Appl Environ Microbiol. 89 (1), e0131322 (2023).
- Li, S., De Groote Tavares, C., Tolar, J. G., Ajo-Franklin, C. M. Selective bioelectronic sensing of pharmacologically relevant quinones using extracellular electron transfer in Lactiplantibacillus plantarum. Biosens Bioelectron. 243, 115762 (2024).
- Blackburn, B., Alba, R., Hatch, A., Ajo-Franklin, C. M., Mevers, E. Understanding the Chemical Properties that Drive Extracellular Electron Shuttles. ChemRxiv. , (2024).
- De Man, J. C., Rogosa, M., Sharpe, M. E. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 23 (1), 130-135 (1960).
- Aumiller, K., et al. A chemically-defined growth medium to support Lactobacillus-Acetobacter sp. community analysis. PLOS ONE. 18 (10), e0292585 (2023).
- Brooijmans, R. J. W., de Vos, W. M., Hugenholtz, J. Lactobacillus plantarum WCFS1 electron transport chains. Appl Environ Microbiol. 75 (11), 3580-3585 (2009).
- LaBelle, E., Bond, D. R. Cyclic voltammetry for the study of microbial electron transfer at electrodes. Bio-electrochemical systems: from extracellular electron transfer to biotechnological application. , (2009).
- Mevers, E., et al. An elusive electron shuttle from a facultative anaerobe. eLife. 8, e48054 (2019).
- Dirar, H., Collins, E. B. End-products, Fermentation balances and molar growth yields of homofermentative Lactobacilli. Microbiology. 73 (2), 233-238 (1972).
- Huong Le, T. X., Bechelany, M., Cretin, M. Carbon felt based-electrodes for energy and environmental applications: A review. Carbon. 122, 564-591 (2017).
- Zhou, A. Y., Baruch, M., Ajo-Franklin, C. M., Maharbiz, M. M. A portable bioelectronic sensing system (BESSY) for environmental deployment incorporating differential microbial sensing in miniaturized reactors. PLOS ONE. 12 (9), e0184994 (2017).
- Benjamin, S. R., de Lima, F., Nascimento, V. A. d. o., de Andrade, G. M., Oriá, R. B. Advancement in paper-based electrochemical biosensing and emerging diagnostic methods. Biosensors. 13 (7), 689 (2023).
- Kumashi, S. R., et al. A CMOS multi-modal electrochemical and impedance cellular sensing array for massively paralleled exoelectrogen screening. IEEE Trans Biomed Circuits Syst. 15 (2), 221-234 (2021).
- Jadhav, D. A., et al. Scale-up of the bioelectrochemical system: Strategic perspectives and normalization of performance indices. Bioresour Technol. 363, 127935 (2022).
- Kim, J., Cestellos-Blanco, S., Shen, Y., Cai, R., Yang, P. Enhancing biohybrid CO2 to multicarbon reduction via adapted whole-cell catalysts. Nano Lett. 22 (13), 5503-5509 (2022).
- He, Z., Mansfeld, F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energy Environ Sci. 2 (2), 215-219 (2009).
- Okamoto, A., Hashimoto, K., Nealson, K. H., Nakamura, R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proc Natl Acad Sci U S A. 110 (19), 7856-7861 (2013).
- Zhang, X., Li, X., Zhao, X., Li, Y. Factors affecting the efficiency of a bioelectrochemical system: a review. RSC Adv. 9 (34), 19748-19761 (2019).
- Kornienko, N., Zhang, J. Z., Sakimoto, K. K., Yang, P., Reisner, E. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis. Nat Nanotechnol. 13 (10), 890-899 (2018).
- Glasser, N. R., Saunders, S. H., Newman, D. K. The colorful world of extracellular electron shuttles. Annu Rev Microbiol. 71 (1), 731-751 (2017).
- Gemünde, A., Lai, B., Pause, L., Krömer, J., Holtmann, D. Redox mediators in microbial electrochemical systems. ChemElectroChem. 9 (13), e202200216 (2022).
- Kundu, B. B., et al. Extracellular respiration is a latent energy metabolism in Escherichia coli. bioRxiv. , (2024).
- O'Brien, J. P., Malvankar, N. S. A simple and low-cost procedure for growing Geobacter sulfurreducens cell cultures and biofilms in bioelectrochemical systems. Curr Protoc Microbiol. 43 (1), A.4K.1-A.4K.27 (2016).
- Su, L., Fukushima, T., Ajo-Franklin, C. M. A hybrid cyt c maturation system enhances the bioelectrical performance of engineered Escherichia coli by improving the rate-limiting step. Biosens Bioelectron. 165, 112312 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados