Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Establecer una clasificación exitosa para el aislamiento de vesículas extracelulares
En este artículo
Resumen
Este protocolo proporciona una descripción detallada de la clasificación de las vesículas extracelulares (VE) liberadas por las células estromales mesenquimales. En particular, se centra en el ajuste del instrumento y la optimización de las condiciones de clasificación. El objetivo es clasificar las vesículas extracelulares preservando sus características.
Resumen
Las vesículas extracelulares (VE) liberadas por las células estromales mesenquimales (MSC) contienen un conjunto de microARN con funciones regenerativas y antiinflamatorias. Por lo tanto, los MSC-EV purificados se conciben como una opción terapéutica de próxima generación para una amplia gama de enfermedades. En este protocolo, informamos sobre la estrategia para separar con éxito las VE del sobrenadante de las MSC derivadas del tejido adiposo (ASC), que se utilizan a menudo en aplicaciones de medicina regenerativa ortopédica.
En primer lugar, describimos la preparación de la muestra, centrándonos en los pasos de aislamiento y marcaje de EV con éster de carboxifluoresceína succinimidilo (CFSE) para la detección de fluorescencia; Posteriormente, detallamos el proceso de clasificación, que constituye la parte principal del protocolo.
Además de las reglas definidas por las directrices MISEV 2023 y MIFlowCyt EV, aplicamos condiciones experimentales específicas relativas al tamaño de la boquilla, la frecuencia y la presión de la vaina. Los parámetros morfológicos se establecen utilizando cordones de diámetros seleccionados para cubrir el rango teórico de tamaño EV. Después de la clasificación de los ASC-EVs, realizamos un control de pureza de la fracción clasificada volviéndola a analizar con el clasificador y verificando la distribución del tamaño del EV con la técnica de análisis de seguimiento de nanopartículas.
Debido a la creciente importancia de los vehículos eléctricos, tener una población pura para estudiar y caracterizar se está volviendo crucial. Aquí, demostramos una estrategia ganadora para configurar la clasificación para lograr este objetivo.
Introducción
Las vesículas extracelulares (VE) son un grupo heterogéneo de vesículas estructuradas en membrana liberadas por casi todas las células, delimitadas por una bicapa lipídica, incapaces de replicarse por sí mismas1. Se pueden encontrar en varios biofluidos como el plasma sanguíneo, el suero, la saliva, la leche materna, la orina, el líquido de lavado bronquial, el líquido amniótico, el líquido cefalorraquídeo y la ascitis maligna2. Una de las principales funciones de los VE es transportar varias moléculas, incluidos ácidos nucleicos, proteínas, lípidos y carbohidratos, entre una célula donante y una receptora. Esto puede ocurrir a través de varios mecanismos, como la fusión directa de la membrana, la interacción receptor-ligando, la endocitosis y la fagocitosis 3,4. Por esta razón, se ha demostrado que desempeñan un papel importante en muchos procesos fisiológicos y patológicos, y se muestran considerablemente prometedores como nuevos biomarcadores de enfermedad, como vehículos de administración de fármacos y como agentes terapéuticos 5,6.
Las células estromales mesenquimales (MSC) son células multipotentes que se pueden aislar de muchos tejidos, incluido el tejido adiposo, la pulpa dental, la sangre del cordón umbilical, la placenta, el líquido amniótico, la gelatina de Wharton e incluso el cerebro, el pulmón, el timo, el páncreas, el bazo, el hígado y el riñón. En los últimos años, han atraído un considerable interés por la medicina regenerativa7. Las células madre mesenquimales (ASC) derivadas del tejido adiposo pueden extraerse del tejido adiposo mediante un procedimiento menos invasivo en comparación con otras fuentes como la médula ósea, lo que reduce el riesgo de complicaciones graves y evita problemas éticos8.
Además, el tejido adiposo contiene una concentración significativamente mayor de MSC que la médula ósea (1% frente a >0,01%) y otras fuentes como la dermis, la pulpa dental, el cordón umbilical y la placenta. Las MSC son cruciales en la regeneración de tejidos y células lesionadas debido a su capacidad de diferenciación y su secreción de un amplio repertorio de factores de crecimiento, quimiocinas y citocinas; Estos beneficios terapéuticos son atribuibles a su capacidad de diferenciación, pero también al hecho de que segregan un amplio repertorio de factores de crecimiento, quimiocinas y citoquinas. Un ejemplo llamativo es el potencial terapéutico de las MSC para las afecciones ortopédicas, ya que el término "Enfermedades musculoesqueléticas" es el que tiene el mayor número de estudios clínicos registrados en el marco de la clinicaltrials.gov (consultado el 13de mayo de 2024).
Además, las MSCs también pueden secretar VEs que participan en la regeneración de tejidos a través de la transferencia de información a las células o tejidos dañados y ejercen una actividad biológica similar a la de las células madre 9,10. Por esta razón, las MSC-EVs pueden ser un valioso sustituto de la terapia celular para lograr un abordaje libre de células11, con dos estudios clínicos que involucran MSC-EVs para afecciones ortopédicas (NCT05261360 y NCT04998058). Sin embargo, aún existen varios desafíos para las aplicaciones clínicas de los vehículos eléctricos. Por ejemplo, existen algunas preocupaciones sobre las técnicas de aislamiento de VE: la mayoría de ellas no garantizan la pureza o integridad de las vesículas. Además, algunas técnicas de aislamiento son complejas, requieren mucho tiempo y tienen baja repetibilidad, lo que las hace inadecuadas para el uso clínico12.
La clasificación celular, por otro lado, es un método comúnmente utilizado que permite el aislamiento de células individuales a partir de suspensiones celulares heterogéneas mediante el uso de marcadores fluorescentes específicos13. Se puede utilizar para muchas aplicaciones y se puede adaptar a diferentes tipos de muestras. Sin embargo, aunque la clasificación de células es una tecnología bien establecida y ampliamente utilizada, la clasificación de vehículos eléctricos sigue siendo muy difícil porque la mayoría de los vehículos eléctricos están por debajo del umbral mínimo de detección incluso para los citómetros de flujo más sensibles. Hay algunas características que hacen que un clasificador sea más adecuado para este propósito. En primer lugar, utilizando un sistema de chorro en el aire en el que la corriente que suspende las partículas es interrogada por láseres en el aire, en lugar de dentro de una celda de flujo; Este sistema preserva la muestra disminuyendo la tensión a la que está sometida. Un segundo punto importante es la presencia de una barra de "oscurecimiento" entre la corriente y la lente colectora que disminuye el ruido óptico de fondo del instrumento. A pesar de ser bajo, el ruido de fondo no se elimina por completo y constituye una referencia que proporciona una ventana parcial a los eventos que caen bajo el umbral: es muy importante para el análisis de eventos que están cerca del "límite de detección" del instrumento14. Por último, el clasificador cuenta con una dispersión directa (FSC) de doble ruta con dos máscaras diferentes que permiten una mejor discriminación entre partículas pequeñas y grandes en la muestra.
Sobre la base de esto, desarrollamos un protocolo destinado a separar los MSC-EV marcados con éster de carboxifluoresceína succinimidilo (CFSE) mediante el uso de un clasificador celular de alta sensibilidad. Para minimizar la manipulación de los VE y preservar su integridad y cantidad, evitamos los pasos de ultracentrifugación durante la preparación de la muestra. Además, se ajustaron las condiciones de clasificación para minimizar la tensión en las vesículas, incluida una mayor optimización de nuestro instrumento al reducir la presión de clasificación asociada con el tamaño de la boquilla (boquilla de 70 μm para una presión de 35 psi).
Access restricted. Please log in or start a trial to view this content.
Protocolo
El protocolo aquí consta de cuatro partes: (1) Preparación de la muestra, (2) Caracterización de ASC-EVs, (3) Clasificación de ASC-EVs y (4) Análisis posterior a la clasificación. En la figura 1 se muestra un esquema que representa el flujo de trabajo.
Figura 1: Diagrama de flujo del protocolo. El diagrama de flujo muestra los pasos involucrados en el protocolo. (1) preparación de la muestra, (2) caracterización de las vesículas antes de la clasificación, (3) clasificación y (4) análisis de las vesículas después de la clasificación. Haga clic aquí para ver una versión más grande de esta figura.
1. Preparación de la muestra
- Colección de sobrenadantes enriquecidos con vesículas extracelulares (EV)
- Descongele o recoja las MSC adiposas (ASC) que se cultivaron antes de la recolección de EV (generalmente las pasadas 1 a 5) y siembre por cada ASC que aísle una cantidad idéntica de células (por ejemplo, 1 millón de células por cada 175cm2 de superficie del matraz da como resultado una confluencia de aproximadamente 60%-70%).
- Cultive ASC en el medio de cultivo apropiado (DMEM-F12 para este protocolo) suplementado con suero fetal bovino (FBS) libre de EV o lisado de plaquetas humanas (hPL), según el protocolo solicitado, durante 48-72 h.
- Para obtener FBS o hPL sin EV, ultracentrífugo a 120.000 x g durante la noche a 4 °C y utilice el sobrenadante.
NOTA: A partir de este punto, la fuerza centrífuga indicada siempre se entiende como promedio para el instrumento, el rotor y los tubos utilizados. Tenga en cuenta que los diferentes rotores o tubos pueden tener una fuerza g variable por rpm y un factor k. Para obtener una manera fácil de comparar rotores y ajustar la fuerza g y la velocidad, consulte una de las tablas de conversión disponibles https://www.beckman.it/centrifuges/rotors/calculator.
- Para obtener FBS o hPL sin EV, ultracentrífugo a 120.000 x g durante la noche a 4 °C y utilice el sobrenadante.
- Con una confluencia celular del 90%, separe y cuente las ASC y suspenda en un volumen adecuado de medio libre de suero, idealmente 1 ml por 1 x 106 ASC. Siembre ASC en suspensión en placas de 24 pocillos con 1 mL por pocillo. Sin suero, las células permanecerán en suspensión y formarán un esferoide. Pasadas las 96 h, recoger el sobrenadante.
- Elimine las células flotantes y los residuos mediante centrifugación en serie a 4 °C: 400 x g durante 10 minutos, 1.000 x g durante 10 minutos, 2.000 x g durante 10 minutos y dos veces 4.000 x g durante 10 minutos.
- Filtre el sobrenadante a través de un filtro de 0,22 μm para eliminar las partículas restantes de más de 220 nm.
NOTA: Úselo inmediatamente para aplicaciones posteriores, o almacene durante un máximo de una noche a 4 °C o congele a -80 °C si no se realizan pasos adicionales dentro de las 24 horas.
- Tinción de vehículos eléctricos para clasificación
- Prepare una solución de 5 mM de diacetato de 5(6)-carboxifluoresceína éster N-succinimidilo (CFSE). Úselo recién preparado o congele a -20 °C protegido de la luz.
- Proceda directamente desde los pasos 1.1.1-1.1.5 (dentro de las 24 h) o descongele a -80 °C los sobrenadantes almacenados que contengan EV a 4 °C.
- Antes de teñir, calentar los sobrenadantes a 37 °C y añadir CFSE hasta obtener una concentración final de 10 μM (dilución de 500 veces). Incubar durante 1 h a 37 °C en la oscuridad.
- Durante la incubación, agregue 2 mL de PBS a un concentrador centrífugo (membrana de celulosa regenerada, MWCO 100 kDa), tapón y centrifugue a 4,000 x g durante 10 min en un rotor de cubo oscilante. Retire el PBS sin filtrar de la parte inferior del dispositivo de filtro y aspire el filtrado del tubo de recolección.
NOTA: El protocolo de ultrafiltración centrífuga descrito se basa en el procesamiento de hasta 15 mL de la muestra (volumen máximo). - Agregue hasta 15 ml de muestra al concentrador centrífugo y tape el dispositivo. Centrífuga a 4.000 x g durante un máximo de 30 min.
NOTA: Esto producirá una muestra final de 500 μL en promedio. Sin embargo, dependiendo de factores como la naturaleza de la muestra y el caudal, el tiempo de centrifugación necesario para lograr la concentración deseada puede variar. - Retire el dispositivo de la centrífuga y vacíe el tubo de recolección. Agregue 14 mL de PBS al dispositivo de filtro. Centrífuga a 4.000 x g durante un máximo de 30 min.
- Repita el paso 1.2.6.
- Recupere una muestra concentrada de EVs teñida con CFSE del dispositivo de filtrado, aproximadamente 500 μL, y almacene 100 μL a 4 °C en la oscuridad mientras se procede a la clasificación de la muestra restante.
2. Caracterización de ASC-EVs
- Análisis de Western blot de marcadores EV
- Pellets ASC (1 x 106) a 376 x g a RT durante 5 min y suspender en tampón de lisis adecuado suplementado con inhibidores de la proteasa. Realice la cuantificación de proteínas con el ensayo de elección.
NOTA: Como se ha experimentado en este estudio, los mejores resultados de cuantificación se obtienen con la técnica de ensayo de ácido bicincónico. - Cuantificar el sobrenadante concentrado en ASCs equivalente a 1 x 106 ASCs con la técnica de Bradford o pellets EVs correspondientes a 1 x 106 ASCs a 100.000 x g a 4 °C durante 1 h y suspender en tampón de lisis adecuado suplementado con inhibidores de la proteasa. Realice la cuantificación de proteínas con el ensayo de elección.
NOTA: Como se ha experimentado en este estudio, los mejores resultados de cuantificación para los pellets de EV se obtienen con la técnica de ensayo de ácido bicinconínico. - Si se utiliza un sobrenadante concentrado en lugar de EV purificados, lisar las muestras en 2-Mercaptoetanol al 5% y tampón Laemmli 2x.
NOTA: Como se experimentó en este estudio, tanto el sobrenadante concentrado como los EV purificados dan resultados comparables para los marcadores EV positivos y negativos. - Cargue y separe las muestras (1-10 μg) en un gel de poliacrilamida al 10% a 110 V durante 90 min.
- Transferir a una membrana de nitrocelulosa a 250 mA durante 120 min.
- Membrana de tinción con Ponceau S para la visualización de muestras y transferencia de escalera. Retirar Ponceau S con PBS agitando suavemente.
- Bloquee las membranas con 5% de leche en polvo descremada y 0.1% de Tween en PBS durante 60 min.
- Sondee membranas con anticuerpos apropiados en diluciones de trabajo, incluyendo marcadores EV positivos (p. ej., en este trabajo CD9, CD81, TSG101 y Flotillin) y negativos (p. ej., en este trabajo Calnexin), a 4 °C durante la noche.
- Lavar con Tween al 0,1% en PBS e incubar con anticuerpos secundarios conjugados con peroxidasa apropiados durante 45 min en RT antes de que se revele la banda con el sistema ECL de elección. Adquiera imágenes con un sistema de imágenes disponible (Figura 2A).
- Pellets ASC (1 x 106) a 376 x g a RT durante 5 min y suspender en tampón de lisis adecuado suplementado con inhibidores de la proteasa. Realice la cuantificación de proteínas con el ensayo de elección.
- Análisis por citometría de flujo de marcadores EV: tinción superficial
- Antes de su uso, centrifugue cada anticuerpo monoclonal (mAb) a 15.000-17.000 x g durante 30 min a 4 °C para eliminar los agregados, que pueden causar señales falsas positivas. Además, filtre los mAbs en tubos de filtro centrífugo separados de 0,22 μm a 1.000 x g a 4 °C hasta que toda la mezcla haya pasado a través del filtro y no quede líquido de anticuerpos en la superficie del filtro. Almacene los anticuerpos monoclonales a 4 °C.
- Prepare una dilución 1:10 de EV teñidos con CFSE (ver paso 1.2.1-1.2.8) en PBS filtrado a 0,22 μm.
- Incubar 100 μL de muestras, o PBS filtrado con 0,22 μm, con o sin mAbs específicos de EV (anti-CD9/63/81) o mAbs específicos de MSC (anti-CD44), previamente titulados. Realice la incubación a 4 °C en la oscuridad durante 30 min.
NOTA: Este protocolo, desarrollado para detectar EVs típicos y marcadores de linaje MSC, puede extenderse a todos los demás lineamientos celulares o marcadores de superficie específicos del subtipo EVs. No utilice fluorocromos que caigan en el canal de isotiocianato de fluoresceína (FITC) para evitar la superposición con la tinción de CFSE de los EV. Realice una sola tinción utilizando cada mAb conjugado con un fluorocromo, por ejemplo, aloficocianina (APC). Es posible la tinción multicolor, pero se deben incluir controles para abordar los posibles problemas de obstáculo estérico de anticuerpos. Es necesario probar los anticuerpos individuales solos o dentro de una mezcla y asegurarse de que la señal sea comparable. Además, los FMO deben incluirse entre los controles. - Configure la calibración de dispersión como se describe en el paso 3.2.
- Cree un diagrama de puntos de la escala logarítmica de dispersión lateral (SSC) frente a la escala logarítmica FITC y ejecute un tubo de PBS filtrado de 0,22 μm o EV sin teñir; establezca el umbral en el canal FITC y ajústelo a los valores más altos que excluyan la mayoría del ruido de fondo. Dibuje una región que identifique los eventos positivos de CFSE.
- Cree un gráfico de histograma APC controlado en la región de eventos positivos de CFSE y ejecute un tubo de PBS filtrado de 0,22 μm o EV sin teñir.
NOTA: Para la ganancia APC, utilice la ganancia establecida con el QC del instrumento, aunque se recomienda realizar una gaintración específica para optimizar el rendimiento del instrumento. - Añada 200 μL de PBS filtrado de 0,22 μm a las muestras teñidas y adquiera. Utilice un caudal bajo (10 μL por minuto) para la adquisición y el registro. Si es posible, registre al menos 5.000 eventos en la puerta positiva de FITC.
- Utilice el control PBS teñido con mAb para detectar posibles señales específicas de los mAbs. Lea todos los tubos de muestra con el mismo caudal para garantizar la consistencia entre los tramos.
- Para evitar la contaminación cruzada de la muestra, deje correr un detergente durante 10 s entre cada tubo analizado, seguido de 10 s con agua desionizada (DI) (Figura 2B).
NOTA: Para evitar cualquier inestabilidad del instrumento fluídico, adquiera la muestra durante 10 s y luego comience a grabar.
- Análisis por citometría de flujo del marcador EV: tinción intracelular
NOTA: Para la tinción intracelular, utilice un kit específico que contenga reactivos de fijación y permeabilización. El mAb anti-Caveolin se conjuga con Alexa 488. La tinción de IC se ha realizado en ausencia de CFSE.- Antes de usar, centrifugue el mAb como se ha descrito anteriormente (paso 2.2.1).
- Para la tinción intracelular, siga las instrucciones del fabricante (Figura 2C).
- Caracterización de la concentración y el tamaño de EV mediante análisis de seguimiento de nanopartículas (NTA)
- Realice las diluciones adecuadas de las muestras para obtener de 20 a 120 eventos en el marco de visualización de la pantalla del instrumento NTA.
- Inyecte las muestras en la cámara de muestras del instrumento NTA utilizando una jeringa de insulina de 1 mL.
- Configure el software NTA para el registro de la siguiente manera: 5 mediciones estándar, de 60 s cada una, y una bomba de flujo configurada en 30.
- Ajuste la intensidad de la luz a un valor apropiado que permita distinguir claramente las partículas del fondo y ejecutar el script de captura en el software NTA.
NOTA: El ajuste del nivel de la cámara puede influir en la detección de partículas. Si el valor es demasiado alto, surge un fondo lechoso y una fuerte dispersión de la luz de las partículas, que cubre la mayoría de las señales de las partículas. Si el valor es demasiado bajo, aunque se obtenga un fondo más oscuro, es posible que se pierdan la mayoría de los eventos menos brillantes. Cada muestra debe ser monitoreada para un ajuste óptimo. - Ajuste el factor de dilución si las partículas por fotograma son inferiores a 20 o superiores a 80.
- Establezca el umbral en 4 para analizar el tamaño modal medio y la concentración de partículas del sobrenadante. Tenga en cuenta los factores de dilución iniciales.
- Limpie la cámara del instrumento con agua desionizada después de cada muestra para evitar la contaminación cruzada.
- Abra el software de análisis NTA y realice el análisis de las muestras adquiridas, teniendo en cuenta el factor de dilución (Figura 2D).
- Caracterización de la morfología del VE mediante microscopía electrónica de transmisión (TEM)
- Recoja el sobrenadante concentrado en ASC o aísle los EV por ultracentrifugación (100.000 x g a 4 °C durante 1 h) seguido de suspensión de pellets en el mismo volumen de PBS.
- Deje que 5 μL del sobrenadante concentrado o EV se absorban en rejillas recubiertas de carbono durante 10 minutos. Seque el exceso de gotas de líquido con papel de filtro.
- Realizar una tinción negativa con acetato de uranilo al 2% en suspensión acuosa durante 10 min utilizando un volumen idéntico de la gota de muestra (5 μL). Retire el exceso de acetato de uranilo tocando la rejilla con papel de filtro.
- Seque la rejilla a temperatura ambiente (RT) y examínela con un microscopio electrónico de transmisión a 120 kV (Figura 2E).
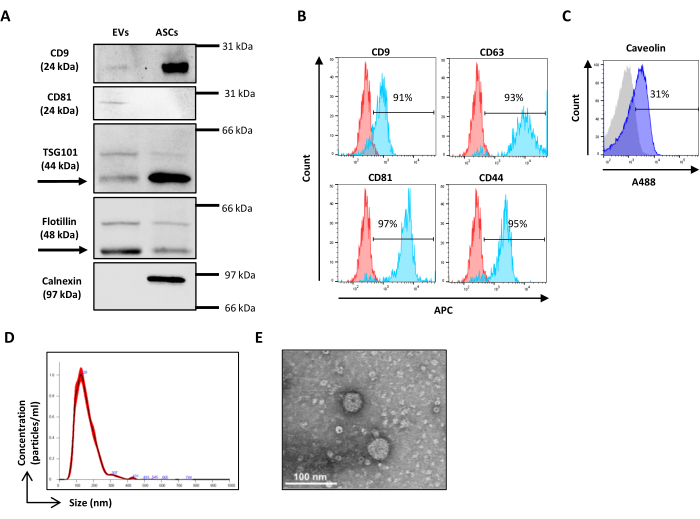
Figura 2: Caracterización de ASC-EVs. (A) Western blot representativo de los marcadores EVs positivos (CD9, CD81, TSG101 y Flotillin) y negativos (Calnexin). Se informan los pesos moleculares correspondientes y se han utilizado lisados de ASC como control. (B) Análisis por citometría de flujo de marcadores de EVs. Se analizó la expresión de los siguientes marcadores: CD9, CD63, CD81 y CD44. Solo se analizaron los ASC-EV positivos para CFSE para la expresión del marcador. Los histogramas representan ASC-EV sin teñir (histogramas rojos) y teñidos (histogramas azules). (C) Análisis intracelular por citometría de flujo del marcador EVs Caveolina. Los histogramas representan ASC-EV sin teñir (histograma gris) y teñidos (histogramas azules). d) Caracterización de los ASC-EV por NTA. Los histogramas representan la concentración (partículas/mL)/tamaño (nm) de la muestra. (e) Visualización de ASC-EVs por TEM. Barras de escala = 100 nm. Haga clic aquí para ver una versión más grande de esta figura.
3. Clasificación de ASC-EVs
- Configuración del clasificador de celdas
NOTA: Un clasificador de células es un citómetro de flujo que permite el aislamiento de una población pura a partir de una muestra inicial heterogénea. El clasificador de células separa las partículas objetivo haciendo oscilar la corriente con un piezoeléctrico a alta frecuencia para generar gotas que contienen un evento. Las gotas que contenían las partículas de interés, como células o vesículas, se cargan y desvían a través de placas de deflexión metálicas. La fracción ordenada se utiliza para realizar análisis posteriores.- Abra la línea de presión y aspire.
NOTA: Algunos clasificadores tienen un inicio automático, mientras que otros tienen un inicio manual. Es preferible un clasificador con arranque manual, ya que permite la optimización de algunas características técnicas como la frecuencia, la presión y la elección de la punta de la boquilla. En particular, se recomienda trabajar con una frecuencia de 66.000 Hz, una presión de 35 psi y una boquilla de 70 μm. - Encienda el instrumento, abra el armario de bioseguridad e inicie el software del clasificador.
- Presurice los fluidos y, a continuación, encienda el sistema de fluidos.
- Activa el Drop Drive, el cristal piezoeléctrico de la boquilla que vibra para tener gotas.
- Realice el procedimiento de desbarbado para eliminar la presencia de burbujas en el sistema y luego ejecute un tubo de 5 ml de solución de limpieza durante 5 minutos a alta presión diferencial y un tubo de 5 ml de agua desionizada durante 5 minutos.
- Realice el procedimiento de inicio manual.
- En la pestaña Control del láser, presione el botón de encendido del láser para encender el láser.
NOTA: Repita este procedimiento para todos los láseres: Azul 488 nm, Amarillo-Verde 561 nm, Violeta 405 nm y Rojo 640 nm. - Examine la alineación vertical de la corriente.
NOTA: En caso de necesidad, mueva la etapa de ensamblaje de la boquilla, en particular, el micrómetro delantero y posterior, el micrómetro izquierdo y derecho, y el cardán para ajustar la alineación vertical y verificar el flujo vertical con micrómetro hacia arriba y hacia abajo; Para obtener la mejor alineación, el flujo debe ser vertical en cada láser. Si esta es la primera vez que se usa una boquilla específica, se debe realizar un retardo láser . En el panel de la pantalla táctil, en la pestaña Laser and Stream Intercept (Intercepción láser y de flujo ), seleccione el tamaño correcto de la boquilla, presione el botón Laser Delay (Retardo láser) y siga las instrucciones de retardo láser para realizar el procedimiento de retardo láser. En general, al cambiar la presión de la vaina y, en consecuencia, la punta de la boquilla, la determinación del retardo láser se ejecuta antes de encontrar la alineación. Al final del procedimiento de retardo láser, se sugiere que se realice el procedimiento de sustracción de imagen de fondo siguiendo las instrucciones en pantalla para minimizar la señal de fondo. - Realice la determinación del punto láser presionando la pestaña Laser Stream Intercept , el botón Green Arrow y siguiendo las instrucciones en el monitor de pantalla táctil.
- En la pestaña Control del láser, presione el botón de encendido del láser para encender el láser.
- Inicialice Intellisort. Establezca la frecuencia de la unidad de caída y un valor de amplitud predeterminado, lo que hace que la transmisión forme una gota.
- Una vez realizado este paso, cargue una configuración guardada. Para cargar una configuración de configuración guardada, seleccione Cargar configuración de ordenación en la barra de herramientas del software del clasificador. Después de verificar diferentes frecuencias y amplitudes, elija la mejor que garantice la mejor estabilidad de caída. Trabaja a una frecuencia de 66.000 Hz y una amplitud de unos 40-45 V.
- Realice el procedimiento de alineación láser fina .
- Cargue en el muestreador un tubo de 5 mL de perlas de alineación de control de calidad y ejecútelo; seleccione en la pestaña Alineación fina el parámetro deseado en los ejes X e Y para visualizar los cordones bien compactados y colimados. En el área de visualización de datos, seleccione primero 488 - 513/26-H para el parámetro del eje Y y 488-FSC1-H para el parámetro del eje X. A continuación, para ajustar todos los láseres, seleccione 405-488/59-H para el parámetro del eje Y y 640-795/70-H para el parámetro del eje X.
NOTA: Los parámetros seleccionados dependen de la configuración láser del clasificador. La sugerencia manual del instrumento es la elección de los láseres que tienen la mayor separación espacial en la tira estenopeica. Para ello, utilice un láser violeta (405 nm) y un láser rojo (640 nm). - Una vez que el especialista en clasificadores verifique la alineación manual, realice el control de calidad automático. Seleccione el diámetro de las cuentas de control de calidad: 3 μm de diámetro.
NOTA: Al final de este procedimiento, el resultado podría ser QC no aprobado o QC aprobado. En caso de que el control de calidad falle, es necesario optimizar manualmente la alineación. - Guarde la adquisición de control de calidad en el protocolo de alineación del software.
- Cargue en el muestreador un tubo de 5 mL de perlas de alineación de control de calidad y ejecútelo; seleccione en la pestaña Alineación fina el parámetro deseado en los ejes X e Y para visualizar los cordones bien compactados y colimados. En el área de visualización de datos, seleccione primero 488 - 513/26-H para el parámetro del eje Y y 488-FSC1-H para el parámetro del eje X. A continuación, para ajustar todos los láseres, seleccione 405-488/59-H para el parámetro del eje Y y 640-795/70-H para el parámetro del eje X.
- Finalizar el procedimiento de Intellisort
- Coloque las placas de deflexión en la posición correcta en el clasificador y encienda el voltaje (se recomienda una carga de 3.000 V en las placas de deflexión).
- Elija la salida de clasificación de 6 soportes de tubos, habilite los flujos seleccionándolos en el indicador de flujo y realice la transmisión de prueba.
NOTA: Si los flujos no están claramente separados y definidos, ajuste la fase de carga, defanning o modifique otros parámetros para obtener un flujo claramente definido y no oscilante. - Habilite el botón Determinación automática de retraso de caída de Intellisort . Este paso permite establecer el retardo de caída correcto. Después de este paso, vuelva a verificar las transmisiones.
- Active el modo de mantenimiento de Intellisort. Verifique el retraso de caída manualmente.
- Cargue el protocolo manual de retraso de caída en el software del clasificador. Adquirir perlas de control fluorescentes.
- Inserte el soporte de corredera correcto. En el software clasificador, seleccione Ordenar > Asistente de retardo de eliminación. Seleccione Lógica de ordenación.
- Verifica con un microscopio fluorescente la presencia de un 97% de perlas fluorescentes en el quinto charco.
- Abra la línea de presión y aspire.
- Configuración del instrumento: Calibración de dispersión
NOTA: La calibración de la dispersión se realiza mediante el uso de perlas Verity Shells (en adelante, perlas de sílice orgánicas huecas). Estas perlas de sílice orgánica se caracterizan por una distribución del índice de refracción y propiedades de dispersión de la luz más cercanas a las EV que las perlas de poliestireno, lo que permite la configuración del voltaje SSC y FSC para discriminar mejor entre los eventos similares a los EV y el ruido electrónico. Las perlas de sílice orgánicas están constituidas por dos viales con mezclas de perlas, VER01A (perlas de 189 nm) y VER01B (perlas de 374 nm). Cada vial contiene una mezcla de perlas de organosílice huecas y perlas fluorescentes verdes de 380 nm, denominadas perlas de referencia. La concentración de las perlas de sílice orgánicas huecas es de 1 x 108 perlas/mL.- Prepare una muestra de perlas VER01A y VER01B diluyendo una gota (50 μL) de cada una en 1 mL de PBS filtrado de 0,22 μm con una concentración final de 5.000 perlas/μL.
NOTA: Agite las cuentas durante 5 segundos antes de usar. - Cree un diagrama de puntos de la escala logarítmica SSC frente a la escala logarítmica FITC.
- Adquiera perlas VER01B y ajuste el voltaje para discriminar bien las perlas de referencia en la parte superior derecha del diagrama de puntos SSC/FITC (Figura 3A).
- Establezca una región alrededor de esta población de cuentas.
- Cree un diagrama de puntos de la escala logarítmica SSC frente a la escala logarítmica FSC. Identifique las cuentas de referencia y la población de cuentas VER01B. Establezca una región alrededor de la población de cuentas VER01B (Figura 3B).
- Adquiera cuentas VER01A y cree una región alrededor de esta población de cuentas (Figura 3C).
NOTA: Esta población de cuentas se superpone parcialmente con el ruido de fondo del instrumento. - Adquiera PBS filtrado de 0,22 μm y ajuste el umbral para disminuir el ruido de fondo del instrumento sin perder la visualización de las cuentas más pequeñas.
NOTA: La calibración de la dispersión se puede realizar utilizando perlas FSC Megamix (en adelante, perlas de poliestireno FSC), una mezcla de perlas fluorescentes con los siguientes diámetros: 100 nm, 300 nm, 500 nm y 900 nm. El uso de las perlas de sílice orgánicas huecas debe preferirse a las perlas de poliestireno FSC porque tienen una distribución del índice de refracción y propiedades de dispersión de la luz similares a las de los EV. La población de perlas de poliestireno FSC de 300 nm se solapa con la referencia de las perlas de organosílice huecas. Por lo tanto, una puerta basada en perlas huecas de organosílice selecciona EV de tamaño similar en el citómetro de flujo.
- Prepare una muestra de perlas VER01A y VER01B diluyendo una gota (50 μL) de cada una en 1 mL de PBS filtrado de 0,22 μm con una concentración final de 5.000 perlas/μL.
- Adquisición de muestras
- Cree un diagrama de puntos de la escala logarítmica SSC frente a la escala logarítmica FITC, adquiera PBS filtrado de 0,22 μm y defina el ruido de fondo de referencia (Figura 4A).
NOTA: Ajuste el caudal del citómetro a Bajo y controle el caudal. El número de eventos no debe ser superior a 2.000 eventos. Caudal Bajo significa a baja presión diferencial. - Adquiera la muestra de control (EV sin teñir) y verifique el caudal. Asegúrese de que el número de eventos/s sea de alrededor de 5.000/s.
NOTA: Si el número de eventos supera el sugerido, diluya la muestra. - Adquiera PBS teñido y tratado como la muestra de CFSE y verifique que no haya eventos positivos visibles (Figura 4B).
- Adquiera la muestra teñida con CFSE. Dilúyelo en función del caudal. Dibuje una región que identifique los eventos positivos de CFSE y otra que identifique los eventos negativos de CFSE. Utilice una muestra sin tinción como control (Figura 5A, B). Estas son las regiones de clasificación.
- Cree un diagrama de puntos de la escala logarítmica SSC frente a la escala logarítmica FITC, adquiera PBS filtrado de 0,22 μm y defina el ruido de fondo de referencia (Figura 4A).
- Clasificación de muestras
- En el software clasificador, abra un nuevo protocolo (en la barra de herramientas, seleccione Archivo > Protocolo > Nuevo).
- En el software clasificador, haga clic en Configuración de adquisición de datos; en la ventana Parámetro de adquisición, seleccione los canales de interés y desactive los demás. Para este panel específico, las señales habilitadas son: 488-FSC1, 488-FSC2, 488-SSC y 488-513/26 (para señal CFSE).
- Localice en el muestreador un tubo de 5 mL de muestra. En la pantalla táctil, haga clic en el botón Cargar y, en la barra de herramientas del software del clasificador, seleccione Adquisición > Inicio (o presione el botón F2 ). Aparecerá una ventana de propiedades de muestra; Inserte el nombre de la muestra y haga clic en Aceptar.
- Cree el panel, con la parcela de interés y cree la estrategia de compuertas.
- En la barra de herramientas del software del clasificador, seleccione Histograma > Crear histograma.
- En el espacio de trabajo, cree tres diagramas de puntos, el primero con el parámetro 488-FSC1 Height-Log en el eje x y el eje Y 488-SSC Height-Log, el segundo con el parámetro 488-FSC2 Height-Log en el eje x y el eje Y 488-SSC Height-Log, el tercero con el parámetro 488-513/26 CFSE Height-Log en el eje x y el eje Y 488-SSC Height-Log.
- En la pestaña Ordenar, identifique las regiones que se van a ordenar. En el software de clasificación, haga clic en Configuración de clasificación. En la ventana Lógica de ordenación y estadísticas , seleccione la región que se va a ordenar en el generador de lógicas.
NOTA: Para tomar una decisión de ordenación, hay diferentes configuraciones a tener en cuenta: Lógica de ordenación, Modo de ordenación y Sobre de colocación. La lógica de ordenación se refiere a la estrategia de compuertas. Los eventos que están fuera de la puerta seleccionada no se ordenan. El modo de ordenación está relacionado con la salida final. Trabaje en un modo de purificación, de esta manera, todas las gotas clasificadas contienen solo los eventos positivos deseados. El Drop Envelope define cuántas gotas se cargarán y ordenarán en relación con la ubicación en la caída del evento positivo: elija 1-2 gotas para asegurarse de que todos los eventos positivos estén ordenados. - Cuando el caudal sea estable, detenga la adquisición (en la barra de herramientas del software del clasificador, seleccione Adquisición > Detener o vuelva a pulsar el botón F2 ). Comience a ordenar (en la barra de herramientas del software clasificador, seleccione Ordenar > Iniciar o presione el botón F4 ).
NOTA: Antes de comenzar con la clasificación, verifique la secuencia de prueba. Verifique que la fracción clasificada caiga correctamente en el tubo de recolección. - Guarde la configuración de ordenación. En la barra de herramientas del software clasificador, seleccione Ordenar > Guardar configuración de ordenación.
- Comprobación de la pureza de la población clasificada
- Lave el instrumento adquiriendo un tubo de 5 mL de solución de limpieza durante 10 min a alta presión diferencial y un tubo de 5 mL de agua desionizada durante 10 min.
- Adquiera PBS filtrado de 0,22 μm y compruebe que no haya eventos positivos para CFSE.
- Diluir 5 μL de la muestra clasificada en 100 μL de PBS filtrado de 0,22 μm.
- Adquiera y registre todos los volúmenes de muestra (Figura 5C, D).
NOTA: Se informa de un nuevo análisis de los EV clasificados positivos y negativos de CFSE.
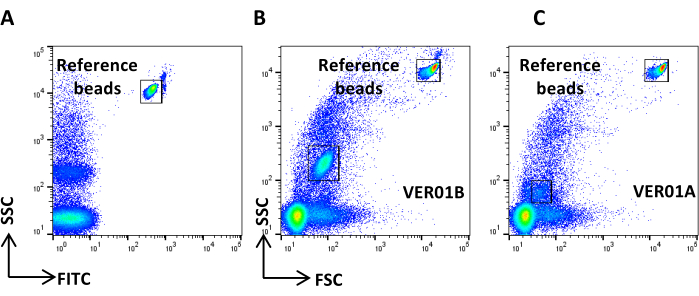
Figura 3: Ajuste de parámetros físicos con perlas huecas de organosílice. (A) Diagrama de puntos SSC / FITC: se han utilizado perlas fluorescentes de color verde de referencia para establecer el parámetro SSC. Diagrama de puntos SSC/FSC de (B) VER01B y (C) VER01A. Haga clic aquí para ver una versión más grande de esta figura.
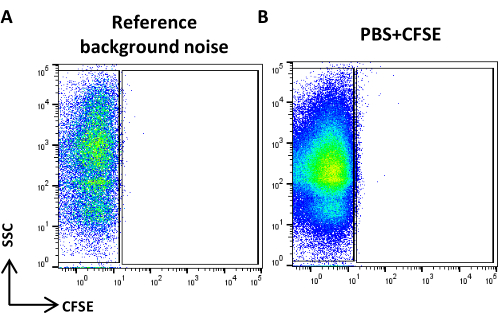
Figura 4: Ruido de fondo de referencia. (A) Diagrama de puntos SSC/CFSE de la muestra de PBS. (B) Diagrama de puntos SSC/CFSE de la muestra PBS + CFSE. Haga clic aquí para ver una versión más grande de esta figura.
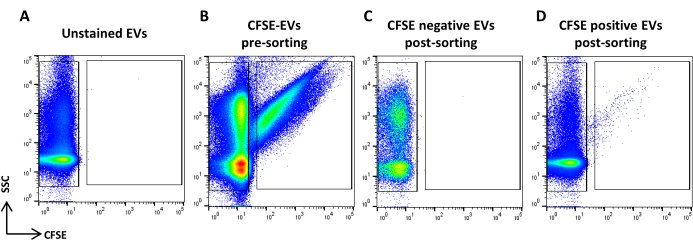
Figura 5: Clasificación de ASC-EVs teñidos con CFSE. (A) Diagrama de puntos SSC/CFSE de EVs no teñidos, (B) EVs teñidos con CFSE, (C) EVs negativos CFSE post-clasificación y (D) EVs CFSE positivos post-clasificación. Haga clic aquí para ver una versión más grande de esta figura.
4. Análisis de clasificación posterior
NOTA: Debido a la cantidad limitada de material después de la clasificación, es posible que no sea posible realizar todos los análisis. Con la cantidad obtenida, se realiza lo siguiente.
- Caracterización de EV por citometría de flujo: tinción superficial (ver paso 2.2)
NOTA: Como se describió anteriormente para la clasificación previa de muestras, excepto para la preparación de muestras. Las muestras, después de la clasificación, se pueden utilizar sin diluir.- Utilice muestras clasificadas sin diluir y proceda según el paso 2.2.3. (Figura 6A)
- Caracterización de la concentración y el tamaño de EV por NTA (ver paso 2.4)
NOTA: Como se describió anteriormente para la clasificación previa de muestras, excepto para la preparación de muestras. Las muestras, después de la clasificación, se pueden utilizar sin diluir.- Utilice muestras clasificadas sin diluir y proceda según el paso 2.4.2. (Figura 6B)
- Caracterización de la morfología del EV por TEM (ver paso 2.5)
NOTA: Como se describió anteriormente para la clasificación previa de muestras, excepto para la preparación de muestras.- Agregue 2 mL de PBS a un concentrador centrífugo (membrana de celulosa regenerada, MWCO 100 kDa), tapón y centrifuga a 4,000 x g durante 10 min en un rotor de cangilón oscilante. Retire el PBS sin filtrar de la parte inferior del dispositivo de filtrado.
- Aspire el filtrado del tubo de recolección. El protocolo de ultrafiltración centrífuga descrito se basa en el procesamiento de muestras de hasta 15 mL (volumen máximo).
- Agregue hasta 15 ml de muestra al filtro AU-15 y tape el dispositivo. Centrífuga a 4.000 x g durante un máximo de 30 min. Concéntrese hasta el volumen mínimo que permita el dispositivo, aproximadamente 100-150 μL.
- Recupere la muestra concentrada de EV clasificada del dispositivo de filtro y proceda como se describió anteriormente para la preclasificación de muestras TEM (paso 2.5.2) ( Figura 6C).
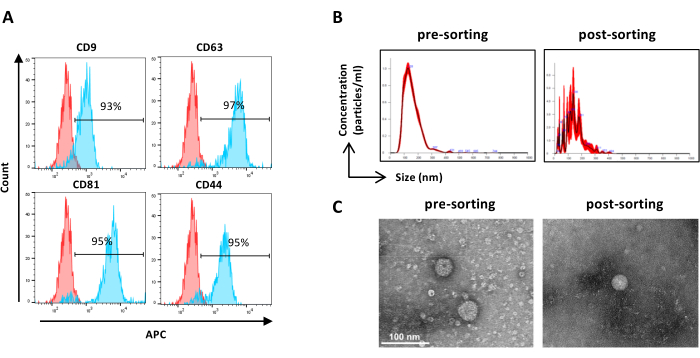
Figura 6: Caracterización de ASC-EVs clasificados. Análisis por citometría de flujo de marcadores EV. Se analizó la expresión de los siguientes marcadores: CD9, CD63, CD81 y CD44. Solo se analizaron los ASC-EV positivos para CFSE para la expresión del marcador. (A) Los histogramas representan ASC-EV sin teñir (histogramas rojos) y teñidos (histogramas azules). (B) Caracterización de ASC-EVs por NTA. Los histogramas representan la concentración (partículas/mL)/tamaño (nm) de las muestras de pre-clasificación (izquierda) y post-clasificación (derecha). (C) Visualización de ASC-EVs por TEM de la muestra pre-clasificación (izquierda) y post-clasificación (derecha). Barras de escala = 100 nm. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Las perlas de poliestireno FSC se han clasificado para validar la configuración del instrumento y las condiciones de clasificación. Las perlas de poliestireno FSC son una mezcla de perlas fluorescentes que van desde 100 nm, 300 nm, 500 nm y 900 nm y son visibles en el canal FITC. La Figura 7A muestra el diagrama de puntos de la escala logarítmica SSC frente a la escala logarítmica FITC con las cuatro poblaciones de cuentas antes de la clasificación. Las...
Access restricted. Please log in or start a trial to view this content.
Discusión
El análisis y la clasificación de los vehículos eléctricos es un reto debido a su pequeño tamaño y al hecho de que están cerca del límite de detección de la mayoría de los citómetros de flujo. Nuestro objetivo fue desarrollar un protocolo para aislar vehículos eléctricos derivados de AMSC marcados con CFSE. Se seleccionó CFSE como método de tinción debido a su alta eficiencia de marcaje de EVs (≥90%), sin la formación de partículas no deseadas como agregados de prote?...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Emanuele Canonico por su apoyo técnico. Parte de este trabajo se llevó a cabo en ALEMBIC, un laboratorio de microscopía avanzada establecido por IRCCS Ospedale San Raffaele y Università Vita-Salute San Raffaele. El trabajo de Enrico Ragni y Laura de Girolamo contó con el apoyo del Ministerio de Salud italiano, "Ricerca Corrente".
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
Referencias
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404(2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231(2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63(2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718(2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25(2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603(2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734(2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442(2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750(2020).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados