Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un modelo murino inmunocompetente para la terapia térmica intersticial con láser del glioblastoma
* Estos autores han contribuido por igual
En este artículo
Resumen
El glioblastoma es una forma devastadora de cáncer cerebral primario, y la terapia térmica intersticial con láser está emergiendo como una alternativa prometedora a la resección quirúrgica convencional para el glioblastoma inoperable. Este protocolo describe un modelo preclínico optimizado de ratón que se puede utilizar para estudiar los efectos del tratamiento o los tratamientos adyuvantes y combinatorios.
Resumen
El glioblastoma (GB), la forma más agresiva de cáncer cerebral primario, representa aproximadamente la mitad de todos los tumores cerebrales primarios de alto grado en adultos y no tiene cura. La terapia térmica intersticial con láser (LITT, por sus siglas en inglés) es un tratamiento aprobado por la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) para la GB y se usa en pacientes que pueden no ser candidatos para la resección quirúrgica convencional. Si bien se ha establecido la eficacia clínica de la LITT, la investigación más allá de los estudios de casos clínicos y las series de casos es limitada y se ve obstaculizada por la falta de un modelo animal establecido. Este protocolo utiliza ratones C57BL/6 y una línea celular de cáncer de glioma CT2A singénico para recapitular de cerca el GB humano, al tiempo que utiliza un láser de granate de itrio y aluminio dopado con neodimio (Nd:YAG) de 1064 nm, como el que se utiliza en uno de los dos sistemas LITT aprobados por la FDA, lo que proporciona una excelente relevancia preclínica. El establecimiento exitoso de este modelo murino de LITT proporcionará una plataforma valiosa para investigar las características únicas de la ablación con LITT y sus efectos en el microambiente tumoral, lo que podría conducir a mejores estrategias terapéuticas.
Introducción
El cáncer es la primera causa de muerte en Canadá. El glioblastoma (GB), la forma más común de tumor cerebral agresivo, representa del 48 % al 60 % de todos los tumores cerebrales primarios de alto grado en adultos1. El pronóstico de la GB es especialmente sombrío, con una supervivencia neta a 5 años del 4,8% con los tratamientos convencionales, incluyendo la resección quirúrgica, la quimioterapia y la radioterapia 1,2.
La terapia térmica intersticial con láser (LITT) es un procedimiento aprobado por la FDA que utiliza un láser para la ablación hipertérmica de tumores in situ en pacientes con tumores cerebrales inoperables y proporciona una alternativa terapéutica atractiva a la resección quirúrgica convencional3. Sin embargo, falta un modelo murino detallado y bien caracterizado para el tratamiento de la LITT de la GB, lo que dificulta la investigación preclínica.
Este protocolo tiene como objetivo mostrar un modelo murino preclínico optimizado para el tratamiento de GB con LITT. Hemos optado por utilizar ratones C57BL/6 y la línea celular de glioma singénico CT2A para este modelo, principalmente porque CT2A recapitula de cerca la GB humana de alto grado con características histológicas similares, invasividad, resistencia a la quimioterapia y a la radio, y características similares a las del tallo con autorrenovación y restablecimiento de tumores4. Estas características proporcionan una excelente plataforma para una variedad de estudios que involucran respuestas inmunes o estrategias terapéuticas novedosas. Además, los aspectos técnicos de este protocolo LITT también son fácilmente adaptables a otros modelos murinos de aloinjertos y xenoinjertos 4,5,6, de los que se hablará más adelante.
Las ventajas de este protocolo incluyen resultados consistentes con un paradigma de tratamiento LITT simple pero efectivo. El láser de granate de itrio y aluminio dopado con neodimio de 1064 nm (Nd:YAG) es el mismo que se utiliza clínicamente en uno de los dos sistemas actualmente aprobados por la FDA, lo que permite experimentos que son muy paralelos a la aplicación clínica de LITT para el tratamiento del glioma de alto grado. La principal desventaja de este protocolo es el extremo cuidado que se debe tener tanto durante la implantación de células tumorales como durante el tratamiento con LITT para lograr resultados reproducibles. Además, debido a la naturaleza agresiva de la línea celular CT2A, el protocolo es altamente sensible al tiempo. La mayoría de los experimentos deberán concluirse en un máximo de 20 días, lo que puede limitar las investigaciones de algunas respuestas inmunitarias adaptativas u otros mecanismos celulares y moleculares que ocurren durante un curso de tiempo más largo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
La ética animal para este protocolo fue aprobada por el Comité de Cuidado Animal de la Universidad de Manitoba de acuerdo con las pautas éticas establecidas por el Consejo Canadiense para el Cuidado de los Animales (CCAC). Este protocolo utilizó ratones inmunocompetentes C57BL/6 de 8 a 12 semanas de edad y la línea celular de glioma singénico CT2A para un modelo preclínico con una amplia gama de aplicaciones, incluidos experimentos centrados en análisis histológicos, cambios inmunológicos o intervenciones terapéuticas combinatorias. El protocolo se puede adaptar fácilmente a otras especies de ratones o líneas celulares en función de los requisitos experimentales.
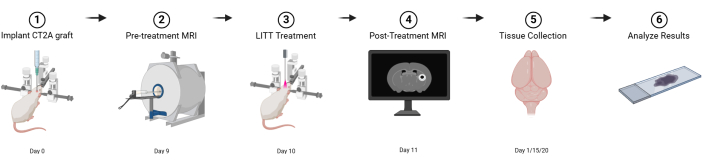
Figura 1: Esquema gráfico del diseño experimental básico. Creado con BioRender.com Haga clic aquí para ver una versión más grande de esta figura.
1. Preparación de la célula en breve (Día 0)
- Antes de comenzar el cultivo celular, asegúrese de que el armario y todas las pipetas necesarias estén completamente esterilizadas con UV y etanol.
- Caliente el DMEM/F12 con un 10% de medios FBS, solución salina tamponada con fosfato (PBS) y tripsina a temperatura ambiente (RT) usando un baño de agua.
- Pipetear los medios del matraz T25 y enjuagar brevemente las células con PBS. Añadir 1 mL de tripsina a las células e incubar durante 30-60 s hasta que las células se desprendan del matraz.
- Confirme las células desprendidas bajo un microscopio óptico y agregue 4 mL de medio para detener la actividad enzimática de tripsina.
- Cuente las celdas con un contador de celdas automatizado.
- Mezcle 10 μL de la suspensión celular con 10 μL de azul de tripano, luego agregue 10 μL al portaobjetos de conteo de células.
- Inserte el portaobjetos en la máquina contadora de células y registre el recuento total de células, el recuento de células vivas y el porcentaje de células vivas.
NOTA: Si no se dispone de una máquina automática de recuento de células, se puede realizar un recuento manual con un hemocitómetro.
- Calcule las celdas necesarias para todas las inyecciones planificadas.
NOTA: Para CT2A, se recomiendan 5000 células por 1,5 μL de volumen inyectado y un mínimo de 100 μL de volumen total para cada preparación. - Gire las celdas a 134 x g durante 5 minutos para granular las celdas y aspirar la mayor cantidad de medio posible.
- Vuelva a suspender el pellet de celda con un 5% de extracto de membrana basal en PBS para obtener el volumen necesario en un tubo de microcentrífuga. Si bien los tubos más pequeños serán los más adecuados para preparar la suspensión celular, un tubo de 2 ml es mejor para el almacenamiento durante la cirugía, ya que es menos probable que las células se agrupen en el fondo más redondeado y se redistribuyan fácilmente con un movimiento suave.
- Mantenga las células en hielo para la inyección, preparando suspensiones de células frescas cada 4-5 h según sea necesario.
2. Implante ortotópico (Día 0)
- Prepare el área quirúrgica y asegúrese de que todos los instrumentos necesarios estén estériles y listos para su uso.
- Anestesiar al ratón con isoflurano (3% vaporizado en 1 L/min O2) en una cámara mientras se controla la frecuencia respiratoria (objetivo 60 lpm).
- Obtener y registrar el peso del animal para la dosificación del medicamento.
- Afeita el área quirúrgica con cuidado para evitar los ojos, las orejas y los bigotes.
- Transfiera al animal a un marco estereotáctico.
- Coloque los incisivos en el orificio de la barra de mordida y ajuste la nariz hasta que quede ajustada, apretando el tornillo de retención para asegurarlo.
- Verifique la profundidad de la anestesia con pinzamientos bilaterales en los dedos de las extremidades traseras y, si corresponde, asegure el cráneo con alfileres y ajuste la cabeza del animal a una posición neutral y nivelada.
- Controle la temperatura central de los animales con una sonda de temperatura rectal lubricada y proporcione un calentamiento suplementario a 37 °C con una almohadilla térmica debajo del cuerpo.
PRECAUCIÓN: Tenga cuidado de no apretar demasiado el cono de la nariz, ya que incluso una presión moderada sobre el hueso nasal puede causar un paro respiratorio. Si se utiliza una almohadilla térmica eléctrica (por ejemplo, una almohadilla térmica para un terrario), asegúrese de que los ajustes de temperatura sean precisos y que la temperatura establecida permanezca constante.
- Aplique el ungüento oftálmico generosamente en ambos ojos para evitar que se seque.
- Administrar inyecciones profilácticas y comprobar la profundidad anestésica.
- Inyecte meloxicam subcutáneo (s.c.) u otro analgésico de acción prolongada de acuerdo con las pautas locales del animalario (p. ej., 5.0 mg/kg de meloxicam) con una jeringa de 28 G x 1/2".
- Administrar una inyección de 20 mg/kg de solución salina normal precalentada s.c. para el soporte profiláctico de líquidos durante procedimientos más largos.
- Reduzca el anestésico a 1.5%-2.0% de isoflurano para mantener la tasa de respiración objetivo.
- Utilizando una técnica aséptica, cubra al animal y prepare el área quirúrgica.
- Con un hisopo de algodón estéril, aplique una solución desinfectante de povidona yodada o clorhexidina. Comenzando medialmente en el sitio de la incisión y rotando el hisopo después de cada pasada, trabaje hacia afuera, luego, usando un hisopo de algodón estéril nuevo, aplique etanol al 70% en el sitio de manera similar.
- Repita el lavado con yodo seguido de etanol al 70% dos veces más (3 veces en total, cada una).
- Vuelva a verificar la profundidad anestésica antes de proceder con la exposición quirúrgica. Monitoree de cerca la frecuencia respiratoria durante todo el procedimiento y ajuste el anestésico según sea necesario.
- Comenzando la línea media y ligeramente posterior a los ojos, haga una incisión sagital media de 1-1,5 cm en la dirección caudal con un bisturí de hoja # 15. Alternativamente, extienda una incisión corta en bisturí con unas tijeras de iris.
NOTA: Las incisiones deben comenzar en la línea media pero, en el caso de las inyecciones unilaterales, pueden inclinarse ligeramente lateralmente para facilitar la visualización y el acceso simultáneos de Bregma y la ubicación del orificio de rebaba. - Con un hisopo de algodón estéril, refleje los bordes de la herida para visualizar el cráneo y frote suavemente cualquier tejido conectivo del área.
- Si es necesario, use un hisopo de algodón estéril empapado en peróxido de hidrógeno para limpiar la superficie del cráneo y visualizar las suturas craneales.
- Ubique Bregma donde las suturas coronales izquierda y derecha se unen en la línea media con la sutura sagital (véase la figura 2).
- Usando una resina acrílica coloreada no tóxica y un palillo de madera estéril o similar, haz una marca muy pequeña sobre Bregma.
NOTA: En algunos casos, las suturas coronales izquierda y derecha no se reflejan entre sí; En tales casos, use una "línea de mejor ajuste" para aproximar dónde deben intersecarse a lo largo del plano sagital medio.
- Usando una resina acrílica coloreada no tóxica y un palillo de madera estéril o similar, haz una marca muy pequeña sobre Bregma.
- Asegúrese de que la posición de la cabeza del animal no esté inclinada ni girada (es decir, en un plano plano).
- Cero coordenadas estereotácticas en Bregma. La coordenada x se refiere al movimiento en el plano medial-lateral (ML), la coordenada y en el plano antero-posterior (AP) y la coordenada z en el plano dorsal-ventral (DV).
- Asegúrese de que Lambda esté en el mismo plano DV que Bregma (es decir, z = 0 en ambos puntos de referencia). Del mismo modo, a +2,0 mm (x = 2) y -2,0 mm (x = -2,0) lateral a Bregma, asegúrese de que el cráneo esté en el mismo plano, con la coordenada DV/z aproximadamente igual. Asegúrese de que el cráneo esté seguro y no se mueva después de ningún ajuste.
- Taladre el orificio a +2,0 mm (ML) y +0,5 mm (AP) de Bregma (Figura 3).
- Con un accesorio de perforación estereotáctica, baje con cuidado la punta de la broca hasta que haga contacto con Bregma y ponga a cero las coordenadas.
- Levante ligeramente la broca y ajuste el taladro a las coordenadas AP y ML adecuadas.
- Baje el taladro lentamente, teniendo cuidado de rebabas solo a través del cráneo.
- Alternativamente, usando una jeringa de microlitros en el marco estereotáctico, baje la punta de la aguja hasta que entre en contacto con Bregma y ponga a cero las coordenadas.
- Levante ligeramente la aguja y ajústela a las coordenadas AP y ML adecuadas.
- Baje la punta hasta que toque el cráneo y observe la ubicación exacta.
- Levante ligeramente la aguja y haga una pequeña marca en el lugar objetivo con un marcador quirúrgico.
- Levante o gire el portador de la aguja para que no estorbe y, con un taladro manual, rebabe el cráneo, teniendo cuidado de evitar dañar el cerebro que se encuentra debajo. PRECAUCIÓN: En general, los ratones machos mayores tienen cráneos relativamente más gruesos y requieren un entrenamiento más extenso. El taladro manual debe realizarse con cuidado, aplicando una presión mínima, ya que las roturas repentinas a través del cráneo dañarán las meninges subyacentes y / o el cerebro.
NOTA: Es necesaria una extensión del orificio de rebaba para acomodar la sonda de termopar durante el procedimiento LITT. Esto se puede hacer más fácilmente durante la cirugía de inyección inicial y facilita una cirugía LITT más rápida y optimizada. Alternativamente, el orificio de rebaba se puede extender de la misma manera durante la cirugía LITT, lo que puede reducir el riesgo de crecimiento de tumores extracraneales.
- Cree un segundo orificio de fresa a +3,0 mm ML y +0,5 mm AP (1,0 mm lateral al lugar de inyección) para el termopar.
- Siga el procedimiento de perforación como se describe en el paso anterior.
- Para evitar dificultades relacionadas con el recrecimiento del hueso, retire el hueso entre los dos orificios.
NOTA: Se recomienda el uso de +2,0 mm ML, +0,5 mm AP y -2,5 mm DV de Bregma como coordenadas para la implantación del tumor. Esta ubicación en el cuerpo estriado superior produce un crecimiento tumoral consistente, que es bien tolerado por los animales, sin embargo, el protocolo se puede adaptar a otras ubicaciones.
- Prepare la suspensión de células de glioma de ratón CT2A en jeringa de microlitros (5000 células en 1,5 μL).
- Retire el tubo de microcentrífuga de células preparado previamente del hielo y frote suavemente con la yema de un dedo para volver a suspender.
- Extraiga suavemente 2 μL en una jeringa de 5 μL o 10 μL teniendo cuidado de evitar burbujas.
- Exprima 0,5 μL para eliminar el aire y asegurarse de que la aguja esté cebada y funcione correctamente.
- Limpie el tallo de la aguja con un hisopo con alcohol para eliminar el líquido extraído y cualquier célula de la superficie exterior (que puede causar crecimiento de tumores leptomeníngeos).
- Cargue la jeringa en una bomba de jeringa de microinyector (o accesorio estereotáctico manual) y baje lentamente la aguja.
- Baje la aguja lentamente hasta la profundidad (z = -3,0 mm) y haga una pausa de 1 min.
- Retraiga lentamente la aguja 0,5 mm (z = -2,50 mm) e inyecte las células (≤ 0,5 μL/min). Mantenga seca el área alrededor de la jeringa con una esponja microquirúrgica, teniendo cuidado de no romper la aguja.
- Espere un mínimo de 2 minutos después de completar la inyección, luego retraiga lentamente la jeringa durante un período de 3-4 minutos. Asegúrese de que los primeros 4-5 intervalos de retracción sean de 100 μm por retracción para evitar que las células se desprendan de su sitio de inyección original.
- Con un hisopo con alcohol, limpie suavemente el exterior de la aguja para eliminar cualquier sangre o líquido y enjuague y limpie la jeringa de acuerdo con las pautas del fabricante. Use PBS y agua destilada entre inyecciones para asegurarse de que la aguja no se obstruya. Una vez finalizadas las inyecciones, enjuague generosamente la aguja con etanol al 70% para eliminar las células restantes de la aguja.
PRECAUCIÓN: No enjuagar la aguja después de cada inyección puede resultar en una obstrucción. Si inyecta más de un tipo de célula, utilice una aguja separada para cada tipo para evitar cualquier posible contaminación cruzada.
- Vuelva a aproximar la incisión, teniendo cuidado de evertir ligeramente los bordes de la herida para que la dermis subyacente se toque. Cierre la herida con una pinza para heridas o 3 puntos interrumpidos con una sutura 5-0. Aplique una solución de povidona yodada sobre la herida cerrada.
- Retire al animal del marco estereotáctico y colóquelo en una jaula de recuperación forrada de papel sobre una almohadilla térmica ajustada a 37 ° C. Asegúrese de obtener la decúbito esternal antes de transferir al animal de regreso a la jaula de origen con un pequeño plato de comida húmeda ubicado en el piso de la jaula.
- Monitoree al animal al menos dos veces al día, comenzando el día de la cirugía, durante los siguientes 2 días. Vuelva a administrar meloxicam después de 24 h, 48 h y 72 h, o según las pautas de la institución.
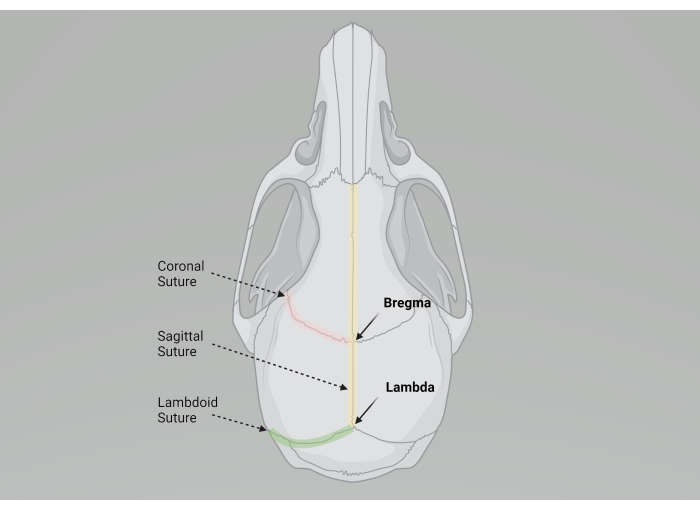
Figura 2: Ilustración gráfica del cráneo de un ratón y puntos de referencia anatómicos importantes para la cirugía estereotáctica. Creado con BioRender.com Haga clic aquí para ver una versión más grande de esta figura.
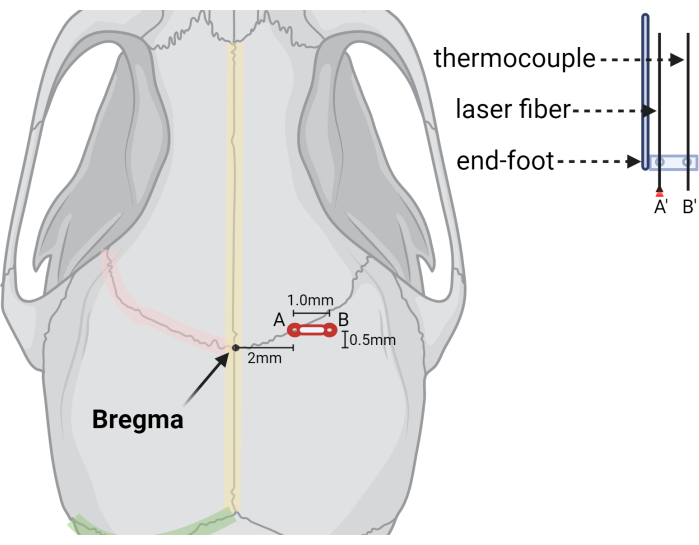
Figura 3: Ilustración gráfica que indica la ubicación de los agujeros de rebaba y el aparato láser. Ilustración que muestra las posiciones relativas del punto de referencia Bregma, (A) el orificio de rebaba inicial para la fibra láser (A') y (B) el segundo orificio de rebabilla o extendido para la sonda de termopar (B'). A la derecha se muestra una representación recortada de las sondas de fibra láser y termopar, que ilustra cómo se estabilizan las sondas en un pie final estereotáctico con orificios preperforados en el tamaño y espaciado deseados. Creado con BioRender.com Haga clic aquí para ver una versión más grande de esta figura.
3. Monitorización de la carga tumoral antes de la LITT (día 9)
- Realizar imágenes por resonancia magnética (RMN) ponderadas en T2, siguiendo las pautas institucionales, para evaluar el crecimiento tumoral el día anterior a la LITT.
NOTA: Los tumores deben tener ~1.5-2.0 mm de diámetro.- Obtenga una exploración coronal adecuada de todo el cerebro del ratón utilizando los siguientes parámetros: secuencia de eco de espín rápido, TR = 5000 ms, TE = 45 ms, trenes de eco = 7, FOV = 30 x 30 mm2, tamaño de la matriz = 250 x 256, cortes totales = 18, grosor de corte = 0,3 mm, promedios = 2.
NOTA: También se recomienda realizar una resonancia magnética periódica a partir del día 6 aproximadamente después de la implantación para confirmar el éxito del aloinjerto y controlar el crecimiento del tumor, especialmente durante los experimentos iniciales, ya que incluso los cambios sutiles en el procedimiento pueden alterar la línea de tiempo. La CT2A es muy agresiva y los animales deben ser monitoreados de cerca. Una gammagrafía coronal ponderada en T2 funciona bien para este propósito. El uso de células CT2A marcadas con fluorescencia o luciferina junto con el sistema de imágenes in vivo (IVIS) también puede ser adecuado cuando no se dispone de acceso a una resonancia magnética de animales pequeños. Sin embargo, la cinética de crecimiento y otras características tumorales diferirán de este protocolo.
- Obtenga una exploración coronal adecuada de todo el cerebro del ratón utilizando los siguientes parámetros: secuencia de eco de espín rápido, TR = 5000 ms, TE = 45 ms, trenes de eco = 7, FOV = 30 x 30 mm2, tamaño de la matriz = 250 x 256, cortes totales = 18, grosor de corte = 0,3 mm, promedios = 2.
4. Cirugía LITT (Día 10)
- Como se indicó anteriormente en la sección 2, repita los pasos 2.1 a 2.13 para preparar al animal para el LITT.
NOTA: La cicatrización de la herida de la cirugía previa puede estar en diferentes etapas según la especie y las variaciones en la línea de tiempo experimental. Tenga cuidado con el tejido más delgado o delicado al rehacer la incisión. - Con un hisopo estéril con punta de algodón, limpie suavemente el cráneo, eliminando cualquier tejido que oscurezca Bregma o el orificio de rebaba hecho anteriormente. Si es necesario, vuelva a perforar el orificio de rebaba, aunque debido a la velocidad de formación del tumor CT2A, se espera poco o nada de recrecimiento óseo.
- Con el accesorio LITT en su lugar en el marco estereotáctico, ponga a cero las coordenadas en Bregma para la punta de la fibra láser.
PRECAUCIÓN: La fibra láser es muy frágil y se agrietará si se dobla. Tenga cuidado de detenerse tan pronto como la punta de la fibra láser toque el cráneo. - Levante ligeramente la punta y muévala a las coordenadas ML y AP deseadas, luego baje lentamente las sondas a la coordenada DV del objetivo para llegar al objetivo (2,0 mm ML, 0,5 mm AP, -2,0 mm DV).
- Establezca los parámetros de tratamiento LITT: Modo: continuo; Potencia: 1 W
- Cambie el láser de Standby a Active y active el láser durante 60 s con el pedal. Si la temperatura aumenta más allá de los 46 °C, haga una breve pausa y luego vuelva a conectar, tratando de mantener la temperatura lo más cerca posible de los 46 °C.
- Retraiga lentamente el conjunto del láser y limpie suavemente la fibra láser y el termopar con un hisopo con alcohol. Gire el conjunto para que no estorbe, teniendo cuidado de que las sondas no entren en contacto con el marco.
- Cierre la herida y recupere al animal como se describe en los pasos 2.18-2.20 después de la implantación del tumor anterior.
5. Evaluación post-LITT (Día 11)
- Realice una resonancia magnética ponderada en T2 posterior a la LITT al día siguiente del tratamiento con LITT para evaluar el éxito de la ablación tumoral con LITT utilizando la secuencia y los parámetros del paso 3.1 anterior.
NOTA: Además, una secuencia de recuperación de inversión atenuada por líquidos (FLAIR, por sus siglas en inglés) también puede ser útil para evaluar el edema postoperatorio. - Realizar exploraciones de seguimiento antes del final del estudio para controlar los cambios posteriores al tratamiento o el recrecimiento del tumor.
6. Fin de estudio (Día 11/Día 15/Día 20)
- Sacrificar a los animales en los criterios de valoración experimentales elegidos según las directrices de la institución.
NOTA: Los criterios de valoración posteriores al día 20 no son factibles con CT2A, incluso con inoculaciones con un recuento de células extremadamente bajo, ya que los animales de control (es decir, cirugía simulada o ningún tratamiento) y algunos animales del grupo de tratamiento pueden estar moribundos y requerir eutanasia. Para experimentos más largos, considere modelos alternativos de células de glioma de ratón. - Recolectar tejidos para su fijación y procesamiento.
- Realizar perfusión cardíaca con paraformaldehído (PFA) al 4% y recoger los tejidos de interés.
- Post-fijación del tejido cerebral por inmersión en PFA al 4% durante la noche a 4 °C.
- Procese las muestras utilizando prácticas estándar para el análisis fijado en formol incrustado en parafina (FFPE) o congelado fijo.
7. Análisis
- Verifique el éxito de la ablación de LITT mediante resonancia magnética ponderada en T2 y valide mediante técnicas histológicas básicas, como una tinción de hematoxilina y eosina.
- Realizar cualquier análisis adicional requerido para los experimentos (por ejemplo, inmunohistoquímica, inmunofluorescencia).
Access restricted. Please log in or start a trial to view this content.
Resultados
El éxito de la implantación de tumores CT2A y los tratamientos con LITT se pueden caracterizar mediante resonancia magnética ponderada en T2, como se muestra en las figuras 4, 5 y 6. Las imágenes de resonancia magnética se obtuvieron utilizando un imán superconductor libre de criógeno 7T con un diámetro de 17 cm y una bobina de cabeza de ratón en cuadratura utilizando los p...
Access restricted. Please log in or start a trial to view this content.
Discusión
Existe un cuerpo de literatura en rápida expansión con respecto a LITT; sin embargo, se limita principalmente a estudios de casos clínicos en humanos o series de casos. De hecho, se han demostrado varios beneficios potenciales para la LITT, incluyendo menores tasas de complicaciones postoperatorias y costos, al tiempo que confieren una supervivencia libre de progresión comparable 7,8,9,10,11.
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Estamos agradecidos por el apoyo de Monteris Medical, incluida la donación en especie de equipos láser.
Agradecimientos
Las fuentes de financiación para este proyecto incluyen la Alianza del Consejo de Ciencias Naturales e Ingeniería de Canadá (NSERC), Mitacs-Accelerate, Research Manitoba-IPOC, los Institutos Canadienses de Investigación en Salud (CIHR) CGS-M y la Universidad de Manitoba Graduate Fellowship. Línea celular de glioma CT2A donada generosamente por el Dr. Peter Fecci en la Universidad de Duke, Durham, Carolina del Norte. También nos gustaría agradecer al Laboratorio del Servicio de Histología y al Centro de Imágenes de Animales Pequeños y Materiales de la Universidad de Manitoba por su excelente asistencia técnica con este proyecto.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Absorbion Spears | FST | 18105-01 | Hemostatic sponges. |
| Adson tissue forceps | FST | 11006-12 | |
| C57BL/6 mice | Jackson Laboratories | Strain #000664 | 6 to 12 week old male and female |
| Cotton Tipped Applicators (6") | Electron Microscopy Sciences | 72308 | |
| CT2A glioma cell line | Generously donated from Dr. Peter Fecci, Duke University. | ||
| Cultrex Reduced Growth Factor Basement Membrane Extract, PathClear | Biotechne, R&D systems | 3433-010-01 | |
| DMEM/F-12, HEPES | Gibco, ThermoFisher Scientific | 11330032 | |
| Dual-chamber slides | BIO-RAD | 1450003 | |
| Eppendorf Safe-Lock Tubes 2.0 mL | Eppendorf | 22363352 | |
| Ethyl Alcohol Anhydrous | Greenfield Global | P016EAAN | Dilute to 70% with ddH2O |
| Fetal Bovine Serum, qualified, Canada | Gibco, ThermoFisher Scientific | 12483020 | |
| Glad Press-n-Seal plastic wrap | Amazon.ca | 12587704417 | |
| High speed drill | Kopf Instruments | Model 1474 | |
| K & J Thermocouple temerpature meter | Omega | HH509R | |
| Metacam (meloxicam) | WDDC | 114424 | |
| Microinjection syringe pump | WPI | UMP3T-1 | |
| Microliter syringe (700 Series) | Hamilton | 87908 | Custom needles are available. A steep needle bevel helps with precise delivery, and a shorter needle length helps with stability. |
| Needle driver/Needle Holder | FST | 12500-12 | A fine tip is most suitable due to the confined working space, but many styles are suitable based on handle preference. |
| Opixcare Plus opthalmic ointment | WDDC | 135941 | |
| Phosphate Buffered Saline (10x) | Fisher bioreagents | BP399-4 | Dilute to 1x with ddH2O |
| Povidone-iodine | ThermoFisher Scientific | 3955-16 | Aliquat into into smaller tubes for use with cotton tipped applicators. |
| Saline (normal) | WDDC | 126588 | |
| Scalpel, single use (#15 Blade) | Feather | Feather NO15 | |
| Scissors, fine surgical | FST | 91460-11 | Fine student scissors, Iris, or Bonn are all suitable. |
| Stereotactic frame | Kopf Instruments | Model 940 | With digital display console and mouse nose-cone and ear-bars. |
| Stereotactic syringe holder | Kopf Instruments | Model 1772-F | If not using an injection pump. |
| Sutures (5-0 monofilament) | Ethicon | MCP463G | Monocryl violet monofilament with reverse cutting tip |
| Syringe, 28 G (0.5 mL) | BD | BD 329461 | BD Lo-Dose U-100 Insulin Syringes |
| TC20 Automated Cell Counter | BIO-RAD | 1450102 | |
| Thermocouple probe, fine diameter (Type K) | Omega | TJM-CA316-IM025G-150 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco, ThermoFisher Scientific | 25200072 | |
| Vetbond by 3M, veterinary tissue glue | WDDC | 126125 | |
| Wahl Peanut Clippers | WDDC/Wahl | 100963 | Also available directly from manufacturer. |
| Warming pad | Bensen Medical | 70308/121873 | Any similar item can be used. |
| Webcol Alcohol preps | Electron Microscopy Sciences | 71005-20 | Alcohol prep wipe, 2-ply, medium size. |
Referencias
- Canadian Cancer Society. Cancer Statistics 2023. , Canadian Cancer Statistics Advisory Committee in collaboration with the Canadian Cancer Society, Statistics Canada and the Public Health Agency of Canada. Toronto, ON. http://cancer.ca/Canadian-Cancer-Statistics-2023-EN (2023).
- Glioblastoma Research Organization. Glioblastoma Research Organization. , https://www.gbmresearch.org (2024).
- Carpentier, A., et al. Laser thermal therapy: Real-time MRI-guided and computer-controlled procedures for metastatic brain tumors. Lasers Surg Med. 43 (10), 943-950 (2011).
- Haddad, A. F., et al. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv. 3 (1), vdab100(2021).
- Chokshi, C. R., Savage, N., Venugopal, C., Singh, S. K. A patient-derived xenograft model of glioblastoma. STAR Protoc. 1 (3), 100179(2020).
- Alcaniz, J., et al. Clinically relevant glioblastoma patient-derived xenograft models to guide drug development and identify molecular signatures. Front Oncol. 13, 1129627(2023).
- Muir, M., et al. Laser interstitial thermal therapy for newly diagnosed glioblastoma. Lasers Med Sci. 37 (3), 1811-1820 (2022).
- Muir, M., Traylor, J. I., Gadot, R., Patel, R., Prabhu, S. S. Repeat laser interstitial thermal therapy for recurrent primary and metastatic intracranial tumors. Surg Neurol Int. 13, 311(2022).
- De Groot, J. F., et al. Efficacy of laser interstitial thermal therapy (LITT) for newly diagnosed and recurrent IDH wild-type glioblastoma. Neurooncol Adv. 4 (1), vdac040(2022).
- Holste, K. G., Orringer, D. A. Laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdz035(2020).
- Leuthardt, E. C., Voigt, J., Kim, A. H., Sylvester, P. A single-center cost analysis of treating primary and metastatic brain cancers with either brain laser interstitial thermal therapy (LITT) or craniotomy. Pharmacoecon Open. 1 (1), 53-63 (2017).
- Bastos, D. C. D. A., et al. Predictors of local control of brain metastasis treated with laser interstitial thermal therapy. Neurosurgery. 87 (1), 112-122 (2020).
- Darbinyan, A., Leelatian, N., Fomchenko, E. I. Histological changes associated with laser interstitial thermal therapy for radiation necrosis: illustrative cases. J Neurosurg Case Lessons. 4 (1), CASE21373(2022).
- Grant, G. A., Porter, B. E., Li, D., Barros Guinle, M. I., Kaur, H. Approach, complications, and outcomes for 37 consecutive pediatric patients undergoing laser ablation for medically refractory epilepsy at Stanford Children's Health. J Neurosurg Pediatr. 33 (1), 1-11 (2023).
- Ogasawara, C., et al. Laser interstitial thermal therapy for cerebral cavernous malformations: A systematic review of indications, safety, and outcomes. World Neurosurg. 166, 279-287.e1 (2022).
- Satzer, D., Mahavadi, A., Lacy, M., Grant, J. E., Warnke, P. Interstitial laser anterior capsulotomy for obsessive-compulsive disorder: lesion size and tractography correlate with outcome. J Neurol Neurosurg Psychiatry. 93 (3), 317-323 (2022).
- Salehi, A., et al. Therapeutic enhancement of blood-brain and blood-tumor barriers permeability by laser interstitial thermal therapy. Neurooncol Adv. 2 (1), vdaa071(2020).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados