Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La méthode de culture des embryons rongeurs entier en utilisant le système des rotateurs de type flacon de culture
Dans cet article
Résumé
Whole technique de culture d'embryons de souris nous permet de culture et d'embryons de rat Ex vivo durant des périodes limitées correspondant aux stades midgestation. Dans ce protocole vidéo, nous démontrons nos procédures standard de la culture d'embryon de rat entière après E12.5 en utilisant le système des rotateurs de type flacon de culture.
Résumé
Toute la culture d'embryons (CME) technique a été développée en 1950 par la Nouvelle et ses collègues, et appliquée pour la biologie du développement 1. Bien que le développement et la croissance des embryons de mammifères dépendent de façon critique sur la fonction du placenta, la technique du CME nous permet de culture et de la souris embryons de rat ex vivo état pendant des périodes limitées correspondant aux stades lors de midgestation jour embryonnaire (E) de 6,5 E12.5 dans le souris ou E8.5-E14.5 chez le rat 2, 3, 4. Dans le CME, nous pouvons cibler directement les zones souhaitées en utilisant des embryons fines capillaires en verre car les embryons peuvent être manipulés sous le microscope. Par conséquent, le CME rongeurs est une technique très utile quand on veut étudier les processus dynamiques de développement des embryons de mammifères postimplanted. Jusqu'à ce jour, plusieurs types de systèmes de CME ont été développés 1. Parmi ceux-ci, le système des rotateurs de type flacon de culture est le plus populaire et adapté à long terme de culture d'embryons au midgestation, c'est à dire, après E9.5 et E11.5 chez la souris et le rat, respectivement 1. Dans ce protocole vidéo, nous démontrons notre procédures standard du CME rat après E12.5 en utilisant un modèle raffiné de l'ancien système des rotateurs, qui a été conçu par la Nouvelle et de Cockroft 5, 6, et d'introduire diverses applications de la technique du CME pour les études en développement chez les mammifères biologie.
Protocole
1. Mise en place du système de CME
- Joint une membrane de 0,22 um de filtre sur le tube de silicone entrée dans le système de CME a).
- Ouvrez le robinet d'une bouteille de gaz contenant O 2 (95%) et de CO 2 (5%). Débit du mélange gazeux dans le tambour par l'intermédiaire de la bouteille contenant de l'eau bouillonnante autoclave.
- Régler le volume d'écoulement du mélange gazeux à 50 cc.
- Insérez le tube de silicone à laisser dans une bouteille d'eau et vérifier le flux de mélange gazeux.
- Tournez le tambour à la vitesse de 20 tr / min.
2. Préparation du milieu de culture
- Décongelez-rat, immédiatement centrifugé (IC) sérique à 37,0 ° C b). Ajouter D-glucose (2 mg / ml) dans le sérum dégelé dans un autoclave bécher de 100 ml. Le milieu de culture doit être préparé au niveau de la culture primaire (par exemple, en utilisant un capuchon).
- Ajouter aux antibiotiques antimycosiques (100X) liquide à l'sérum avec 1: 400 dilution.
- Vaporiser l'isoflurane restants (à cause de l'anesthésie des rats pendant la collecte de sang) dans le sérum pendant 20 minutes à température ambiante (TA) c).
- Stériliser le milieu de culture en utilisant un filtre de 0,45 um membrane.
- Verser 3,0 ml de milieu dans chaque flacon de culture et de sceller le dessus de chaque flacon avec un bouchon de silicone, recouvert d'une feuille d'aluminium (voir réf. 14) d).
- Préparer trois ou quatre boîtes de Petri contenant la disposition e salines de Tyrode).
3. Anesthésie du rat et de l'isolement de l'utérus
- Anesthetize un rat chronométré enceintes profondément avec anesthésiques par inhalation ou par voie parentérale.
- Nettoyez la zone abdominale du rat anesthésié enceinte avec 70% d'éthanol.
- Ramasser la peau avec une pince et extérioriser la paroi abdominale en coupant la peau avec de grands ciseaux f).
- Ramassez la paroi abdominale avec une paire de pinces et de faire en U de grandes incisions longitudinales sur la paroi abdominale avec des gros ciseaux à la g niveau thoracique).
- Ours loin de l'intestin vers le côté gauche avec une paire de pinces et d'exposer une extrémité de l'utérus reliés à l'ovaire.
- Ramassez la fin de l'utérus avec une pince et de réduire la position entre l'utérus et des ovaires avec des gros ciseaux.
- Sortez de l'utérus de la rate gestante en coupant la graisse autour de l'utérus jusqu'à l'autre extrémité de l'utérus.
- Transfert de l'utérus pour une boîte de Pétri contenant une solution saline de Tyrode.
- Euthanasier le rat par l'administration excessive d'anesthésiques ou la dislocation cervicale après avoir enlevé l'utérus.
4. Suppression des embryons dans l'utérus
- Rincer brièvement l'utérus dans une solution saline de Tyrode et le transférer sur le deuxième plat de Pétri avec une paire de pinces fines h).
- Sous un microscope binoculaire, ramasser la paroi utérine avec une paire de pinces fines et découper la paroi utérine du côté opposé à l'mésométrium connexion avec les vaisseaux sanguins à l'aide des ciseaux ophtalmiques droite.
- Insérer la pointe de ciseaux ophtalmiques droites dans l'espace entre la paroi utérine et la caduque. Couper la paroi utérine longitudinalement le long du côté antimesometrial.
- Clump la caduque sur le côté et le conceptus mesometrial séparer de l'utérus à l'aide de deux paires de pinces fines i).
- Transfert à l'conceptus troisième plat de Pétri avec une pipette en verre stérilisé avec un diamètre approprié.
5. Dissection d'embryons de rat
- Insérez une extrémité de la microforceps dans la decidua et faire une incision transversale sur la decidua autour du conceptus avec deux paires de pinces.
- Insérez le bout de la pince dans la decidua sur le côté du placenta et de faire deux incisions longitudinales sur la caduque au sommet.
- Retirez la caduque placentaire sur le côté en arrachant qu'avec deux paires de pinces. Retirez la decidua restant avec deux paires de pinces.
- Ramassez la membrane de Reichert, faire une incision horizontale sur elle, et séparée de la membrane du conceptus sur le côté anti-placentaire.
- Faire un petit trou sur le sac vitellin près de la tête de l'embryon avec les deux paires de pinces, et couper le sac vitellin avec une paire de ciseaux courbes ophtalmiques. Il est important de ne pas endommager les vaisseaux sanguins principaux.
- Ramassez l'amnios sur le site autour de la tête de l'embryon avec les deux paires de pinces fines, et tirez délicatement l'embryon à partir du sac vitellin en déchirant l'amnios h). Le corps de l'embryon doit être retiré du sac vitellin d'augmenter l'apport d'oxygène pour l'embryon au stade midgestation.
6. La culture d'embryons entiers
- Vérifiez les dommages sur le placenta, sac vitellin, et la condition de battre le cœur et la circulation sanguine.
- Être conscient de ne pas étirer le cordon ombilical, le transfertl'embryon d'un flacon de culture avec une pipette en verre stérilisé. Report d'une solution saline de Tyrode à des bouteilles de culture devrait être aussi peu que possible.
- Retirer un bouchon de silicone non-trous du tambour des rotateurs. Connecter le flacon de culture avec un bouchon avec un trou dans le tambour de rotateurs du système de CME perpendiculairement. Soyez prudent de ne pas mettre la force sur le tambour dans des directions impropres depuis le tambour des rotateurs est un équipement très fine. Les bouteilles contenant de l'embryon disséqués sont transférés à la culture, un par un, l'ouverture de la porte avant de l'incubateur doit être minimisée pour éviter que la température de l'incubateur est diminué j).
- Après 10 h de culture, d'augmenter le volume des flux de mélange gazeux jusqu'à 75 cc et 100 cc après 24 h (tableau 1).
- Le milieu de culture doit être changé environ 24 h par le transfert de l'embryon cultivé dans une bouteille nouvelle culture avec un milieu fraîchement préparé. Augmenter le volume du débit jusqu'à 125 cc après 34 h et jusqu'à 150 cc après 48 heures (tableau 1)
- Occasionnellement vérifier l'état des embryons cultivés en comptant rythme cardiaque (par exemple, 120-150/min est optimale) et en observant la circulation sanguine. Si nécessaire de compter le nombre de somites de juger de la croissance des embryons dans une solution saline de Tyrode. Dans le développement normal, un somite est ajouté en deux heures.
- Lorsque le CME est terminée, arrêtez la fourniture de mélange de gaz et débrancher le tube d'entrée et le filtre à membrane pour éviter le refoulement dans le tube d'entrée de la bouteille de bulles.
7. Remarques
- La température à l'intérieur du système de CME est constamment maintenu à 37,0 à 37,5 ° C.
- 100% du rat IC sérum est utilisé en routine dans notre CME pour les embryons de rat et de souris, et conservés à -20 ° C avant utilisation.
- Nous achetons chez le rat IC sérum, qui est recueillie à partir de rats qui sont anesthésiés à l'isoflurane.
- Bouteilles jetables sont également disponibles auprès de Ikemoto Rika. Bouteilles et bouchons de silicone doivent être autoclavés.
- Dissection d'embryons doit être réalisée à température ambiante car le maintien des embryons à basse ou haute température lors de la dissection affecter le développement ultérieur de CME.
- Outils pour la dissection sont stérilisés par chaleur sèche.
- La peau et la paroi abdominale doit être coupée séparément pour éviter la contamination des poils dans un plat que possible. Nous changeons d'une paire de gros ciseaux et des pinces avec une nouvelle paire d'entre eux lorsque nous avons coupé la peau et d'isoler de l'utérus, respectivement.
- En utilisant des pinces dont les extrémités sont fines est très important de disséquer les tissus certainement. Nous manuellement aiguiser les pointes de forceps avec une pierre et l'huile de machine.
- Nous utilisons un côté de la pince comme un couteau pour éviter une pression excessive pour les embryons.
- Lorsque la température à l'intérieur du système de CME diminue en ouvrant la porte à plusieurs reprises, nous continuons à allumer la lumière pour garder la température à l'intérieur du système.
8. Les résultats représentatifs
La figure 1 montre les procédures de dissection de l'embryon de rat et d'embryons de rat en culture.
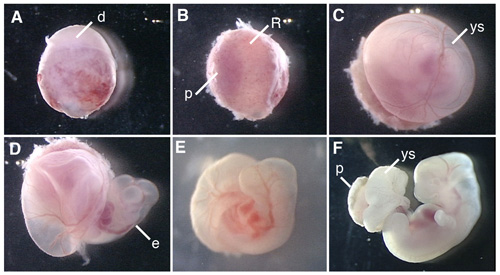
Figure 1. Culture d'embryons entiers de l'embryon E12.5 rat. (A) Une conceptus disséqué de l'utérus de la rate gestante. (B) retrait de la caduque du côté du placenta. (C) l'enlèvement de la membrane de Reichert. (D) L'ouverture du sac vitellin. (E) La culture d'embryon de rat dans la bouteille pendant 6 heures après le début du WEC. (F) L'embryon de rat en culture pour 42 hr. d, caduque; R; membrane de Reichert; p, le placenta; ys, sac vitellin; e, embryon.
| 0 h | 12 h | 24 h | 36 h | 48 h | |
| E12.5 embryon de rat | 95% 50 cc | 95% 75 cc (10 h) | 95% 100 cc | 95% 125 cc (34 h) | 95% de 150 cc |
Tableau 1. Condition de l'oxygène optimale.
Discussion
Il ya deux étapes essentielles dans la CME rongeurs pour le succès. Tout d'abord, la procédure de dissection doit être juste pour ne pas endommager les embryons, en particulier les vaisseaux sanguins. Deuxièmement, la procédure devrait être aussi rapidement que possible parce que l'oxygène et les nutriments ne sont plus alimentés via le placenta après l'isolement de l'utérus. Cela est essentiel pour les anciens embryons. Dans le cas du WEC rat après E12.5, nous devrions le transfert des embry...
Déclarations de divulgation
Remerciements
Nous remercions M. Hajime Ichijo pour des conseils d'enregistrement vidéo et utiles pour l'édition de la vidéo. Nous remercions également Drs.Yuji Tsunekawa et Kaichi Yoshizaki pour l'assistant genre pour l'enregistrement vidéo. Ce travail est soutenu par KAKENHI sur B Young Scientist et sur la science du cerveau domaines prioritaires-moléculaire de MEXT du Japon. Nous reconnaissons l'appui de Global COE Program "centre de recherche fondamentale et translationnelle pour les sciences du cerveau global" du MEXT du Japon et de la recherche de base pour la science évolutive et la technologie (CREST) de la Science et Technology Corporation japonaise de Science and Technology Agency japonaise (JST) .
matériels
| Name | Company | Catalog Number | Comments | |
| Nom | Tapez | Société | Nombre de catalogue | Commentaire |
| Mise en place du CME | ||||
| WEC système (10-0310) | Outil | Ikemoto Rika | 010-0310 | Un autre petit modèle est également disponible. |
| Plug Silicon sans trou | Outil | Ikemoto Rika | 010-032-08 | |
| Cylindres mélange de gaz | Outil | Nikko Sanso | - | Contenant au moins 95% d'oxygène et de dioxyde de carbone de 5%. Afin personnalisé. |
| Le régulateur de gaz | Outil | Ono Seisakusho | WR-11 | |
| 0,22 um filtre Millex GS | Outil | Millipore | SLGS033SS | |
| L'anesthésie et l'isolement de l'utérus | ||||
| Gros ciseaux | Outil | Napox | B-7H | |
| Forceps | Outil | Napox | A-3-2 | |
| Élimination boîte de Petri (90 mm x 15 mm) | Outil | Iwaki | SH90-15 | Deep-type de plat est le meilleur pour la dissection. |
| L'isoflurane | Réactifs | Abbott | B506 | Pour l'anesthésie |
| Pentobarbital sodique | Réactifs | Santé animale de Schering-Plough | - | Pour l'anesthésie |
| Tyrode salines | Réactifs | - | - | Selon que le protocole de Réf. 2. Enregistrer à 4 ° C. |
| Timed-rates Sprague-Dawley rats | Des animaux | Charles Rivers Laboratories au Japon | - | |
| Préparation du milieu de culture | ||||
| Bouteille en verre de la culture | Outil | Ikemoto Rika | 010-032-05 | |
| Flacon de culture élimination | Outil | Ikemoto Rika | 010-032-06 | |
| Plug Silicon avec trou | Outil | Ikemoto Rika | 010-032-07 | |
| Le papier d'aluminium | Outil | Toute entreprise | - | |
| Sac autoclavage | Outil | Hogy | HM-26 | Pour les bouteilles de la culture |
| Sac autoclavage | Outil | Hogy | HM-14A | Pour les bouchons de silicone |
| 0,45 um filtre Millex HA | Outil | Millipore | SLHA033SS | |
| 50 ml tube conique | Outil | Becton Dickinson | 352070 | |
| Bécher de 100 ml | Outil | Iwaki | TE-32 | |
| Rat IC sérique | Réactifs | Charles Rivers Laboratories au Japon | - | Reportez-vous à: M. Kunihiko Morisaki, TEL: +81- (0) 45-474-9336 Fax: +81- (0) 45-474-9340 |
| D (+)-Glucose | Réactifs | Wako | 041-00595 | |
| Antibiotiques antimyotic liquides | Réactifs | Gibco | 15240 | |
| Dissection d'embryons | ||||
| Ciseaux ophtalmique droites | Outil | Napox | MB50-7 | Pour la coupe de la paroi utérine |
| Des ciseaux courbes ophtalmique | Outil | Napox | MB54-2 | Pour couper le sac vitellin |
| Pince # 5 | Outil | Vigueur | T6715 | |
| Pince # 5F | Outil | Régine | T6819 | |
| Verre pipette | Outil | - | - | Fait à la main en utilisant une pipette Pasteur. |
| Sac autoclavage | Outil | Hogy | HM-4 | Pour pipettes en verre |
| Microscope binoculaire | Outil | Leica | Mz7s | |
| Lumière | Outil | Leica | CLS 150XD | |
| Huile de pierre | Outil | Uchida Yoko | 833-2000 | Pour l'affûtage des forceps |
| Huile de machine | Outil | Uchida Yoko | 835-0000 | Pour l'affûtage des forceps |
Références
- New, D. A. T., Copp, A. J., Cockroft, D. L. Intoroduction. In mammalian postimplantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 1-14 (1990).
- Cockroft, D. L., Copp, A. J., Cockroft, D. L. Dissection and culture of post implantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 15-40 (1990).
- Morris-Kay, G. M. Postimplantation mammalian embryos. Essential Developmental Biology A Practical Approach. , 55-66 (1993).
- Fujinaga, M., Tuan, R. S., Lo, C. W. In vitro culture of rodent embryos during the early postimplantation period. Developmental Biology Protocols. , 53-76 (2000).
- Eto, K., Takakubo, F. Improved development of rat embryos in culture during the period of craniofacial morphogenesis. J. Craniofac. Genet. Dev. Biol. 5, 351-355 (1985).
- New, D. A., Cockroft, D. L. A rotating bottle culture method with continuous replacement of the gas phase. Experientia. 35, 138-140 (1979).
- Osumi-Yamashita, N., Ninomiya, Y., Eto, K. Mammalian craniofacial embryology in vitro. Int. J. Dev. Biol. 41, 187-194 (1997).
- Inoue, T., Nakamura, S., Osumi, N. Fate mapping of the mouse prosencephalic neural plate. Dev. Biol. 219, 373-383 (2000).
- Nomura, T., Holmberg, J., Frisen, J., Osumi, N. Pax6-dependent boundary defines alignment of migrating olfactory cortex neurons via the repulsive activity of ephrin A5. Development. 133, 1335-1345 (2006).
- Inoue, Y. U., Asami, J., Inoue, T. Genetic labeling of mouse rhombomeres by Cadherin-6::EGFP-BAC transgenesis underscores the role of cadherins in hindbrain compartmentalization. Neurosci. Res. 63, 2-9 (2009).
- Calegari, F., Huttner, W. B. An inhibition of cyclin-dependent kinases that lengthens, but does not arrest, neuroepithelial cell cycle induces premature neurogenesis. J. Cell Sci. 116, 4947-4955 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Arai, Y. Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. J. Neurosci. 25, 9752-9761 (2005).
- Takahashi, M., Nomura, T., Osumi, N. Transferring genes into cultured mammalian embryos by electroporation. Dev. Growth Differ. 50, 485-497 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon