Method Article
Imagerie des récepteurs d'estrogènes α chez le rat artérioles Pial aide d'un microscope numérique immunofluorescence
Dans cet article
Résumé
Le but de cet article est de démontrer une méthode pour optimiser la détection par immunofluorescence des récepteurs d'estrogènes α (ERa) chez le rat piales tranches artérielle en utilisant un microscope numérique immunofluorescence.
Résumé
Beaucoup d'effets de l'oestrogène sur la réactivité vasculaire sont médiés par l'interaction avec une récepteurs d'oestrogène, 2, 3. Bien que deux sous-types existent (récepteurs des œstrogènes α-β et l'), récepteurs d'estrogènes α a été identifié dans les muscles lisses et des cellules endothéliales de la pie-mère segments artériels utilisant une coloration fluorescente combinée avec la microscopie confocale à balayage laser 4. Par ailleurs, ER-α est située dans les noyaux et dans le cytoplasme des artères basilaires de rat 5. Les récepteurs sont abondantes et fluorescentes vives, mais la visualisation claire des groupes discrets de récepteurs est difficile sans doute à cause du nombre de couches de cellules situées dans de nombreux segments de vaisseaux piales. De plus, de nombreux rapports en utilisant des techniques d'immunohistochimie couplé à la microscopie confocale mal en détail les exigences essentielles pour la reproduction des expériences 6. Notre objectif pour cet article est de décrire une technique simple pour optimiser tIl coloration et la visualisation des ER-α en utilisant transversale des tranches de artérioles piales obtenir de cerveaux de rats femelles. Nous avons d'abord perfuser rats avec bleu Evans pour identifier facilement les artères piales de surface dont nous isolons dans un microscope à dissection. L'utilisation d'un cryostat à la tranche de 8 um sections des artères nous permet d'obtenir des coupes fines cuve pour que les avions des navires différents sont plus clairement visibles. Coupe à travers le navire plutôt que l'utilisation d'un segment de vaisseau petite a l'avantage de faciliter la visualisation des couches endothéliales et musculaires lisses. En outre, l'utilisation d'un microscope numérique immunofluorescence avec le logiciel de profondeur prolongée produit des images claires de dix à douze avions navire différente et est moins coûteuse que l'utilisation d'un microscope confocal à balayage laser.
Protocole
1. L'isolement et la préparation des artères Pial
- Alors que le rat est anesthésié et insérez sécurisé d'un cathéter dans une artère et perfuser avec 1% de bleu Evans dans du PBS 1X. Vaisseaux Pial tache bien avec le bleu Evans rendant plus faciles à isoler.
- Extrait du cerveau et de conserver à -70 ° C jusqu'à ce que nécessaire. Idéalement, les cerveaux doivent être stockés plus de 2 mois.
- En utilisant un microscope à dissection retirer artérioles piales (diamètre moyen de 35 à 50 um) de la surface du cerveau. Retirer avec précaution toutes les artérioles colorées en bleu à partir dorsale et latérale de la surface du cortex à l'aide à pointe fine pince. Retirez l'excès de tissu cortical adhérente avant de placer dans le fixateur.
- Fixer les artérioles récoltés dans du paraformaldéhyde à froid à 2% dans 0,1 M PBS pendant 30 min.
- Pour préparer les artérioles pour sectionner versez milieu d'inclusion sur le gel du disque / Chuck (fixé à -20 ° C).
- Placez la section artériole à plat sur le mandrin uneND attendre qu'il gèle. Fermement placer le récipient en haut à droite sur le disque de gel cryostat sur l'intégration des médias avec le bout de l'artère en face de vous. Tenez avec des pincettes jusqu'à ce qu'il soit solidement gelé.
- Placez le disque de congélation avec le navire dans la tête et couper cryostat 8 anneaux um artériole piales avec le cryostat.
- Montez les sections artériole sur le chrome-potassium-gélatine diapositives subbed.
- Stocker les lames préparées dans une boîte de glisser dans le réfrigérateur à 4 ° C pendant la nuit.
2. ER-α en immunofluorescence
Jour 1
- Retirez les diapositives du réfrigérateur et amener chacun à température ambiante.
- Pour laver les lames versez 1 à 1,5 ml de PBS 0,1 M (assez pour couvrir toutes les sections) laissez reposer pendant 10 minutes, égoutter et répéter la procédure à deux reprises. Chaque bord de la diapositive a un marqueur hydrophobe. Par conséquent, le liquide reste sur la surface de la lame. Avec chaque lavage, le liquide est verséet remplacé par du PBS frais 0,1 M.
- Incuber les lames dans 1 ml de chlorure d'ammonium 50 mM pendant 30 min à température ambiante pour réduire la fluorescence endogène.
- Laver les lames dans du PBS 0,1 M 3x10 min. telle que décrite au point 2.2
- Diapositives bloc de 0,1% de Triton X-100, plus 1% de sérum de chèvre normal (NGS) dans du PBS pendant 30 min. pour réduire la liaison non spécifique.
- Incuber les échantillons avec l'anticorps primaire (polyclonal de lapin anti-ER-α; 1:500) dans du PBS + 0,1% de Triton-X + 1% de NGS nuit à 4 ° C.
Jour 2
- Retirez les diapositives du réfrigérateur et amener chacun à température ambiante.
- Laver les lames dans du PBS 0,1 M 3x10 min. telle que décrite au point 2.2
- Incuber avec Oregon Green 488 secondaire anti-lapin de NGS 1% 0.1% de Triton-X100 + PBS pendant 2 heures dans le noir à température ambiante. A partir de cette étape, les prochaines étapes qui doit être fait dans l'obscurité.
- Laver les lames dans du PBS 0,1 M 3x10 min. telle que décrite au point 2.2
- Sous un VECapuche ntilated, placez 1 goutte de 4 ', 6-diamidino-2-phénylindole (DAPI), plus les médias de montage sur les navires et ensuite placer une lamelle sur l'échantillon.
- Appliquer à ongles vernis transparent pour sceller les bords de la lamelle. Ne pas déplacer les diapositives jusqu'à séchage complet, ce qui prend environ 24 heures.
3. Numérique imagerie par fluorescence
- Pour l'imagerie ER-α dans la cuve piales tranche, nous utilisons un Nikon Eclipse 80i numériques microscope à fluorescence avec des filtres pour 3 couleurs (bleu, vert et rouge) équipé d'une caméra numérique.
- Insérer les diapositives préparées avec les segments tachés navire piales sous le microscope et à s'adapter à visualiser les zones marquées par fluorescence d'intérêt. Démarrer à un grossissement x100 x600, puis augmenter à un grossissement.
- Utilisez l'appareil photo pour capturer des images dans DAPI (bleu) et FITC (vert) pour les chaînes de noyaux de cellules (DAPI) et ER-α (Oregon Green) en utilisant le logiciel Nikon étendue accent Profondeur de convertir de vue multipless de segments de navire dans images 2-D.
4. Les résultats représentatifs:
Nous avons localisé récepteurs d'estrogènes α dans les artères piales aide de sondes fluorescentes et optimisé notre visualisation des récepteurs numériques en utilisant la microscopie à fluorescence. Pour détecter la présence du récepteur, un lapin d'anticorps polyclonaux primaire et une verte l'Oregon 488 anticorps secondaire marqué a été utilisé pour l'image des récepteurs dans les artères piales isolé de la surface du cerveau. En outre, un colorant nucléaire (DAPI) a été utilisé pour identifier les noyaux des cellules et déterminer si nous avons pu détecter des récepteurs situés dans le noyau depuis ER-α a été signalé à être présents dans les cellules cyotosol et le noyau. En outre, nous avons mené des expériences de confirmation pour valider la spécificité de l'anticorps primaire et de vérifier la liaison de l'secondaires à l'anticorps primaire.

Figure 1. La coloration par immunofluorescence pour ER-α (vert) et une contre-coloration au DAPI (bleu) dans un anneau artères piales isolées de cerveau de rat femelle. Figure 1A montre les images fusionnées suggérant la présence de certains oestrogènes récepteurs intranucléaires une. (Flèche) Fig 1B et 1C sont l'image focalisée sur ER-α qui est une combinaison d'images Z-stack. Les images ont été prises à un grossissement x600 et de l'anneau de coupe de la même navire dans des plans différents. Les flèches indiquent les récepteurs d'estrogènes α.
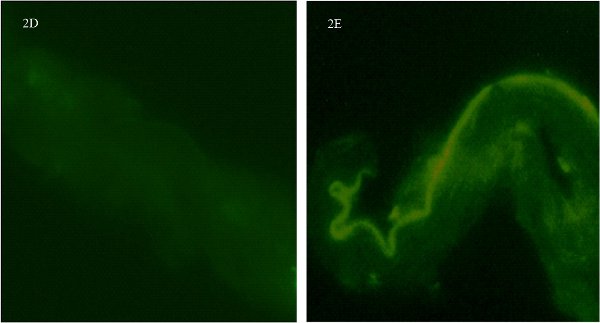
Figure 2. La coloration par immunofluorescence pour les groupes de contrôle dans un anneau de l'artère piales isolées de cerveau de rat femelle. Figure 2D montre le navire sans anticorps primaire. 2E figure montre le navire sans l'anticorps secondaire (autofluorescence noter distincts le long du côté endothélial). Les images ont été prises à un grossissement x600 et de l'anneau de coupe de la même navire dans différent des avions.
Discussion
Auparavant, nous avons montré que, après une lésion cérébrale transitoire globale ischémique de la capacité des artères piales de changer de diamètre en réponse aux deux vasodilatateurs 7, 8 et 9 vasoconstricteurs est nettement déprimée chez les jeunes rats ayant subi une ovariectomie. Réplétion oestrogène chronique restaure réponses vasomotrices 7-9. En outre, le remplacement d'oestrogène retardé renverse les effets bénéfiques des œstrogènes sur l'artère la capacité de vasodilatation piales 10 nous conduit à se demander si l'épuisement oestrogènes à long terme affecte ER-α densité dans le cerebrovasculature. Nous avions prévu d'utiliser l'étiquetage immunofluorescence combiné avec Western blot pour évaluer les changements dans les ER-α expression en réponse à l'épuisement des oestrogènes chronique. Parce que nous avons eu quelques difficultés dans la visualisation des groupes discrets de récepteurs, nous avons modifié la méthode que nous démontrons ici. Par conséquent, notre objectif principal dans cette étude était de développer d'abord une méthode relativement simple pour optimiser le visuelsation des récepteurs dans les artérioles piales. En accord avec plusieurs rapports 6,11,12 nous avons jugé nécessaire de faire des ajustements pour le type de tissu nous sonder, l'épaisseur de l'échantillon, la répartition des ER-α dans la cuve, ainsi que le degré de liaison non-spécifique .
Notre méthode est très efficace de visualiser la présence de ER-α en tranches navire piales. Mais comme d'autres l'ont déjà souligné la bonne utilisation de ces méthodes est très dépendante de la spécificité et des concentrations de l'anticorps, la localisation subcellulaire des protéines d'intérêt, la fixation et le blocage des protocoles et 12 manipulation des tissus. Avant de visualisation de nos préparatifs, nous avons passé des navires de temps pour travailler sur toutes ces variables. Nous avons souligné combien nous avions besoin d'ajuster certains de notre approche dans ce document.
Nous avons cherché à visualiser de manière optimale ER-α dans les artérioles piales et cela a présenté un certain nombre de défis.Tout d'abord, la taille moyenne d'une artère de rat piales est entre 35-50 um faisant l'isolement et le retrait de la surface du cerveau assez délicat. Nous avons constaté que la perfusion avec bleu Evans avant le sacrifice fait la dissection des artères plus facile. Bleu Evans peut affecter la fluorescence, mais nous pensons que l'avantage d'utiliser ce colorant l'emportent sur ses inconvénients mineurs. Dans notre protocole, les navires sont lavées plusieurs fois. Cela minimise le colorant résiduel dans les vaisseaux et réduit les effets possibles de la teinture sur la fluorescence. Une autre difficulté rencontrée est que l'épaisseur de la pie-mère fait les segments de flotte visualisation claire des récepteurs difficile. De plus, nous n'avons pas pu obtenir des images particulièrement claires probablement dû au fait que les ER-α a été dispersée à travers plusieurs couches de cellules. Nous avons essayé de travailler avec des tranches de navires longitudinales (comme d'autres l'ont), mais en raison de la petite taille piales il était difficile de gérer les navires et éviter la torsion des vaisseaux pendant le montagesur des lames, même à l'aide d'un microscope. Enfin, nous avons réussi modifié notre technique en utilisant un cryostat et la découpe du navire de la Croix-sage dans les anneaux à 8 um d'épaisseur. Les anneaux sont plus faciles à manipuler et à plusieurs peut être monté sur une glissière.
Une fois que nous avons acquis les bateaux nous avons jugé nécessaire de tester l'efficacité du premier flash geler le tissu, puis fixer les vaisseaux comme suggéré par Danseshatalb et associés 11. Bien que nous avons trouvé immunofluorescence de fond un peu moins, nous avons également noté que les récepteurs tachés moins intensément rendant la visualisation des récepteurs plus difficile. Par conséquent, nous préférons d'abord de geler l'ensemble du cerveau et de stocker jusqu'à ce que nécessaire (généralement entre 1-2 mois). Nous avons ensuite retirer les vaisseaux tels que décrits et fixer les bateaux avant le tranchage avec le cryostat. comme nous le démontrons ici.
Une étape nécessaire consiste à exécuter des contrôles à la fois avec le primaire et l'anticorps secondaire séparémentpour déterminer la spécificité et l'immunofluorescence fond. Récepteurs aux œstrogènes α-anticorps peut être difficile de travailler avec. En fait, nous avons essayé trois différents anticorps primaires (1 et 2 monoclonal polyclonaux) avant que nous soyons satisfaits de la réussite de notre coloration récepteur. Dans le cadre de nos contrôles nous avons d'abord vérifié la spécificité de l'anticorps primaire par omission de l'ajout de l'anticorps primaire. Figure 2D montre le navire sans anticorps primaire. Il n'ya pas de coloration et juste un signal de fond peu. Depuis l'anticorps primaire est polyclonale, il ya une certaine coloration fond diffus non spécifique. Deuxièmement, nous avons ajouté l'anticorps primaire, mais pas l'anticorps secondaire (Fig. 2E). On peut voir une belle marge représentant la autofluoresence le long des frontières endothéliales des vaisseaux. Ceci est cohérent avec le travail de Dan et associés 5. Toutefois, ni les petits points de l'immunofluorescence qui représentent ER-α, ni la ref aspect granuleuxlecting la présence de nombreux récepteurs peuvent être détectées sans la combinaison de deux anticorps primaires et secondaires. Nous avons noté une tendance distincte des autofluoresence le long des marges endothéliales des vaisseaux. Ces tests indépendants pour la spécificité des anticorps sont importants car ils confirment la spécificité de l'anticorps pour ER-α et l'anticorps secondaire se lie à la primaire.
En conclusion, comme l'a démontré par d'autres 4, 5 vaisseaux sanguins du cerveau contiennent de nombreux ER-α sous-type de récepteurs. Dans nos mains, la préparation de la Croix-8μm tranches transversales du isolées artères piales améliore la coloration et la visualisation des récepteurs. Les méthodes traditionnelles utilisent la microscopie confocale pour examiner les échantillons. Ayant la capacité de visualiser des sections optiques de série à partir de spécimens d'épaisseur est un avantage important de la microscopie confocale. Toutefois, l'achat d'un microscope confocal à bonne peut être très coûteux. En utilisant Extended Depth (FED) de logiciels, nous avons constaté quepourraient réduire nos coûts d'équipement. En utilisant un microscope à fluorescence avec EDF, nous avons obtenu des images claires et sont capables de visualiser piales artérielle ER-α sur plusieurs niveaux en utilisant Z-piles. Un avantage significatif du logiciel d'EDF est qu'il permet la capture d'image de manière à créer efficacement une image 3-D à partir des images. Pour les laboratoires qui n'ont pas accès à un microscope confocal ou les fonds pour acheter un microscope numérique fluorescent avec le logiciel approprié peut être une option pratique et moins coûteux en fonction des objectifs de l'enquêteur.
Déclarations de divulgation
Les opinions exprimées sont celles des auteurs et ne reflètent pas la politique ou la position officielle de l'Uniformed Services University Health Sciences de l', le ministère de la Défense ou le gouvernement des Etats-Unis.
Remerciements
Les travaux pour ce projet a été soutenu par des subventions du National Institutes of Health R01-NR5339 et de la Uniformed Services University de la Santé de Sciences-R061LD.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
| Bleu Evans | Sigma | E-2129 | |
| PBS 10X | Sigma | P-5493 | |
| Paraformaldéhyde | Fisher Scientific | T353 | |
| Tissue-Tek octobre Compound | VWR | 25608-930 | |
| Le chlorure d'ammonium | Sigma | A9434 | |
| Triton X-100 | Sigma | T9284 | |
| Sérum de chèvre normal | Invitrogen | 16210-064 | |
| Anticorps de lapin polyclonal ER-α | Santa Cruz | H-184 | |
| Oregon Green 488 chèvres de lapin anti-IgG | Invitrogen | O-11038 | |
| Vectashield de montagemoyenne pour fluorescence avec DAPI | Vecteur Lab | H-1200 |
Références
- Smiley, D. A., Khalil, R. A. Estrogen compounds, estrogen receptors and vascular cell signaling in the aging blood vessels. Curr. Med. Chem. 16, 1863-1887 (2009).
- Miller, V. M., Duckles, S. P. Vascular actions of estrogens: functional implications. Pharmacol. Rev. 60, 210-241 (2008).
- Duckles, S. P., Krause, D. N. Cerebrovascular effects of oestrogen: multiplicity of action. Clin. Exp. Parmacol. Physiol. 34, 801-808 (2007).
- Stirone, C., Duckles, S. P., Krause, D. N. Multiple forms of estrogen receptor-a incerebral blood vessels: regulation by estrogen. Am. J. Physiol. Endocrinol. Metab. 284, E184-E192 (2003).
- Dan, P., Cheung, J. C., Scriven, D. R., Moore, E. D. Epitope-dependent localization of estrogen receptor-alpha, but not -beta, in en face arterial endothelium. Am. J. Physiol. Heart Circ. Physiol. 284, 1295-1306 (2003).
- Fritschy, J. M. Is my antibody staining specific? How to deal with pitfalls of immunohistochemistry. Eur. J. Neurosci. 28, 2365-2370 (2008).
- Watanabe, Y., Littleton-Kearney, M. T., Traystman, R. J., Hurn, P. D. Estrogen restores post-ischemic pial and microvascular dilation. Am. J. Physiol. Heart and Circ. 281, H155-H160 (2001).
- Li, M., Zeynalov, E., Li, X., Miyazaki, C., Koehler, R. C., Littleton-Kearney, M. T. Effects of estrogen on postischemic pial artery reactivity to ADP. Microcirculation. 16, 403-413 (2009).
- Qin, X. Y., Hurn, P. D., Littleton-Kearney, M. T. Estrogen restores postischemic sensitivity to thromboxane mimetic U46619 in rat pial artery. Cereb. Blood. Flow. Metab. 25, 1041-1046 (2005).
- Miyazaki, C., Koelher, R. C., Littleton-Kearney, M. T. Effects of HET0016 and estrogen on pial artery vasodilatory capacity. FASEBJ Abstracts. , (2007).
- Daneshtalab, N., Dore, J. J. E., Smeda, J. S. Troubleshooting tissue specificity and antibody selection: procedures in immunohistochemical studies. J. Pharmacol. Toxical. Methods. 61, 127-135 (2010).
- Lorincz, A., Nusser, Z. Specificity of immunoreactants. J. Neurosci. 28, 9083-9086 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon