Production et analyse optimisées de vésicules remplies de protéines recombinantes à partir d’E. coli
Dans cet article
Résumé
Le présent protocole décrit une méthode détaillée pour la production bactérienne de protéines recombinantes, y compris des protéines typiquement insolubles ou contenant des liaisons disulfures, emballées à l’intérieur de vésicules extracellulaires liées à la membrane. Cela a le potentiel d’être appliqué à des domaines polyvalents de la recherche scientifique, y compris la biotechnologie appliquée et la médecine.
Résumé
Ce système innovant, utilisant un marqueur peptidique court, qui exporte plusieurs protéines recombinantes dans des vésicules liées à la membrane à partir d’E. coli, fournit une solution efficace à une gamme de problèmes associés à l’expression bactérienne des protéines recombinantes. Ces vésicules recombinantes compartimentent les protéines dans un micro-environnement qui facilite la production de protéines autrement difficiles, toxiques, insolubles ou contenant des liaisons disulfures à partir de bactéries. Le rendement en protéines est considérablement augmenté par rapport à l’expression bactérienne typique en l’absence de l’étiquette peptidique nucléant les vésicules. La libération de protéines emballées par vésicules favorise l’isolement du milieu de culture et permet le stockage à long terme des protéines actives. Cette technologie donne lieu à des rendements accrus de protéines fonctionnelles emballées dans des vésicules pour un traitement simplifié en aval pour un large éventail d’applications allant de la biotechnologie appliquée à la science de la découverte et à la médecine. Dans le présent article et la vidéo associée, un protocole détaillé de la méthode est fourni, qui met en évidence les étapes clés de la méthodologie pour maximiser la production de vésicules remplies de protéines recombinantes.
Introduction
La bactérie à Gram négatif E. coli est un système attrayant pour la production de protéines recombinantes à l’échelle industrielle et académique. Il est non seulement rentable et simple à cultiver en lots à haute densité, mais un large spectre de réactifs, de souches, d’outils et de promoteurs a été établi pour favoriser la génération de protéines fonctionnelles dans E. coli1. De plus, les techniques de biologie synthétique surmontent maintenant les obstacles généralement liés à l’application de modifications post-traductionnelles et au repliement de protéines complexes2. La capacité de cibler la sécrétion de protéines recombinantes dans les milieux de culture est intéressante pour améliorer le rendement et réduire les coûts de fabrication. L’emballage contrôlé de protéines définies par l’utilisateur dans des vésicules membranaires contribue au développement de produits et de technologies dans les industries de la biotechnologie appliquée et de la médecine. Jusqu’à présent, il y avait un manque de méthodes largement applicables pour sécréter des protéines recombinantes à partir d’E. coli 3.
Eastwood et coll. ont récemment mis au point une méthode basée sur le marquage peptidique pour produire et isoler des vésicules contenant des protéines recombinantes à partir d’E. coli1. Ce peptide de nucléation des vésicules (VNp) permet la production de vésicules membranaires bactériennes extracellulaires, dans lesquelles la protéine recombinante de choix peut être ciblée pour simplifier la purification et le stockage de la protéine cible, et permet des rendements nettement plus élevés que ceux normalement autorisés par des cultures de flacons agités. Des rendements de près de 3 g de protéines recombinantes par litre de culture en flacon ont été rapportés, avec des rendements > 100 fois supérieurs à ceux obtenus avec des protéines équivalentes dépourvues du marquage VNp. Ces vésicules enrichies en protéines recombinantes peuvent être rapidement purifiées et concentrées à partir des milieux de culture et fournir un environnement stable pour le stockage. Cette technologie représente une percée majeure dans la production de protéines recombinantes d’E. coli. Les vésicules compartimentent les protéines toxiques et contenant la liaison disulfure sous une forme soluble et fonctionnelle, et favorisent la purification simple, efficace et rapide des protéines fonctionnelles emballées dans les vésicules pour le stockage à long terme ou le traitement direct1.
Les principaux avantages de cette technologie par rapport aux techniques actuelles sont les suivants : 1) l’applicabilité à une gamme de tailles (1 kDa à >100 kDa) et de types de protéines; (2) faciliter la formation de liaisons disulfures inter- et intra-protéiques; 3° applicable aux complexes multiprotéiques; (4) peut être utilisé avec une gamme de promoteurs et de souches standard d’E. coli de laboratoire; 5) la production de rendements en protéines à partir de flacons agités normalement observés uniquement avec des cultures de fermentation; les protéines sont exportées et emballées dans des vésicules liées à la membrane qui (6) fournissent un environnement stable pour le stockage de la protéine soluble active; et (7) simplifie le traitement en aval et la purification des protéines. Cet outil de protéines recombinantes simple et rentable est susceptible d’avoir un impact positif sur les industries biotechnologiques et médicales, ainsi que sur la science de la découverte.
Ici, un protocole détaillé, développé sur plusieurs années, décrit les conditions optimales pour produire des vésicules remplies de protéines recombinantes à partir de bactéries avec la technologie VNp. Des exemples d’images de ce système dans la pratique sont montrés, avec une protéine fluorescente exprimée, permettant de visualiser la présence de vésicules à différentes étapes de la production, de la purification et de la concentration. Enfin, des conseils sont fournis sur la façon d’utiliser l’imagerie de cellules vivantes pour valider la production de vésicules contenant la fusion VNp à partir des bactéries.
Protocole
Les travaux bactériens entrepris respectent les règlements locaux, nationaux et internationaux sur le confinement de la biosécurité adaptés au niveau de risque de biosécurité particulier de chaque souche.
1. Sélection de différents VNps
- Identifiez les séquences VNp.
REMARQUE : Pour la présente étude, trois séquences VNp ont été identifiées1 qui entraînent un rendement maximal et une exportation vésiculeuse des protéines examinées à ce jour : VNp2, VNp6 et VNp15. Il n’est pas clair actuellement pourquoi certaines variantes de VNp fonctionnent plus efficacement avec certaines protéines que d’autres; par conséquent, il est recommandé de générer des fusions entre une nouvelle protéine d’intérêt avec chaque variante de VNp (c.-à-d. VNp2, 6 ou 15).
VNp2: MDVFMKGLSKAKEGVVAAAEKTKQGVAEA
AGKTKEGVL
VNp6: MDVFKKGFSIADEGVVGAVEKTDQGVTEA
AEKTKEGVM
VNp15: MDVFKKGFSIADEGVVGAVE
Des plasmides qui permettent l’expression de la protéine d’intérêt avec différentes fusions terminales d’amino VNp ont été commercialisés (voir le tableau des matériaux). - Concevoir une stratégie de clonage pour insérer le gène d’intérêt à l’extrémité 3' de l’ADNc codant pour le VNp dans l’une de ces constructions, ou adapter un plasmide existant en intégrant l’ADNc VNp synthétisé en amont du premier codon ATG du gène codant pour la protéine d’intérêt. Utilisez les méthodes décrites aupoint 1.
- Pour les protéines toxiques, utilisez un vecteur avec un promoteur d’expression répressible ou un promoteur avec un bruit d’expression non induit minimal.
- Cloner l’étiquette de séquence VNp au niveau de l’amino-terminal de la protéine de fusion. Assurez-vous que les étiquettes d’affinité, les séquences de clivage de la protéase, etc., et la protéine d’intérêt sont situées du côté carboxyle de l’étiquette VNp. Il est recommandé de séparer le VNp du peptide en aval avec une région de liaison flexible, telle que deux ou trois répétitions d’une séquence polypeptidique -G-G-S-G- (Figure 1).
REMARQUE: Utilisez des plasmides avec une sélection d’antibiotiques qui ne cible pas le peptidoglycane, ce qui affaiblit la surface cellulaire et réduit le rendement des vésicules. La kanamycine et le chloramphénicol (voir le tableau des matières) étaient les antibiotiques préférés utilisés dans cette étude.
2. Culture cellulaire bactérienne et induction de protéines
NOTE: Les souches bactériennes généralement utilisées dans ce protocole sont Escherichia coli BL21 (DE3) ou W3110. Les cellules d’E. coli sont cultivées dans un bouillon de lysogénie (LB) (10 g/L de tryptone; 10 g/L de NaCl; extrait de levure de 5 g/L) ou d’un bouillon formidable (TB) (12 g/L de tryptone; 24 g/L d’extrait de levure; 4 mL/L de glycérol à 10 %; 17 mM KH 2 PO 4; 72 mM K2HPO4, sels autoclavés séparément) (voir le tableau des matières). Des exemples d’images montrant chaque étape de l’induction de la protéine et le processus ultérieur d’isolement et de purification sont présentés à la figure 2.
- Cultivez des démarreurs de 5 mL LB à partir de transformations bactériennes fraîches à 37 °C jusqu’à saturation et utilisez-les pour inoculer 25 mL de TB dans une fiole conique de 500 mL, le tout avec une sélection appropriée d’antibiotiques.
- Le rapport surface/volume est un facteur important dans l’optimisation de ce système. Utiliser une fiole aussi grande que possible (p. ex., fiole de 5 L contenant 1 L de culture; pour les cycles d’optimisation, utiliser 25 mL de média dans une fiole de 500 mL).
- Incuber les plus grandes cultures de flacons agités dans un incubateur à 37 °C avec agitation à 200 tr/min (≥25 mm de projection orbitale) jusqu’à ce qu’une valeur de densité optique de 600 nm (OD600) de 0,8-1,0 soit atteinte.
NOTE: La vésiculation est optimale lorsque les cellules sont cultivées à 37 ° C. Cependant, certaines protéines recombinantes nécessitent une expression à des températures plus basses. Si tel est le cas pour la protéine d’intérêt, l’étiquette VNp6 doit être utilisée, car elle permet l’exportation de vésicules à haut rendement à des températures allant jusqu’à 25 ° C. - Pour induire l’expression de protéines recombinantes à partir du promoteur T7, ajouter l’isopropyle β-D-1-thiogalactopyranoside (IPTG) à une concentration finale allant jusqu’à 20 μg/mL (84 μM) (voir le tableau des matériaux). L’induction de l’expression de protéines recombinantes doit se produire à la phase logarithmique tardive (c.-à-d. OD600 typique de 0,8-1,0) pour la production de vésicules.
REMARQUE: La durée de la période d’induction peut varier d’une protéine à l’autre, certaines atteignant une production maximale à 4 heures et d’autres pendant la nuit (18 heures). À ce jour, l’exportation maximale de vésicules a été obtenue dans les cultures de nuit.
3. Isolement des vésicules recombinantes
- Enduire les cellules par centrifugation à 3 000 x g (4 °C) pendant 20 min.
- Pour stériliser les milieux contenant des vésicules en vue d’un stockage à long terme, faire passer le milieu de culture dégagé dans un filtre en polyéthersulfone (PES) de 0,45 μm stérile et sans détergent (voir le tableau des matériaux).
NOTE: Pour tester l’exclusion des cellules viables du filtrat contenant des vésicules, plaquer sur gélose LB et incuber pendant une nuit à 37 °C. - Pour concentrer les vésicules dans un plus petit volume, faire passer le milieu stérile contenant des vésicules à travers un filtre stérile d’esters cellulosiques mixtes (ECM) de 0,1 μm (voir le tableau des matériaux).
- Lavez doucement la membrane avec 0,5 à 1 mL de PBS stérile à l’aide d’un grattoir cellulaire ou d’un épandeur en plastique pour retirer soigneusement les vésicules de la membrane. Transférer dans un tube microfuge neuf.
REMARQUE: Les vésicules purifiées peuvent être conservées dans un milieu stérile ou une solution saline tamponnée au phosphate (PBS) à 4 ° C. Il existe des exemples de protéines recombinantes stockées dans ces vésicules pendant 6 mois, de cette façon, sans perte d’activité enzymatique.
4. Libération de protéines solubles par les vésicules isolées
- Une fois que les vésicules contenant des protéines ont été isolées dans le milieu stérile/tampon, soumettre les membranes lipidiques vésiculaires à la sonication en utilisant un calendrier approprié pour l’appareil (p. ex. 6 x 20 s sur et hors cycles) et centrifuger à 39 000 x g (4 °C) pendant 20 minutes pour enlever les débris vésiculaires.
NOTE: Le choc osmotique ou le traitement détergent peut être utilisé comme alternative pour briser les vésicules, mais il faut tenir compte de l’impact sur la fonctionnalité des protéines et / ou l’application en aval. - Si la fusion VNp reste cytosolique et ne se libère pas dans le milieu, isoler la protéine à l’aide de protocoles standard (p. ex., remettre en suspension les pastilles cellulaires dans 5 mL d’un tampon d’extraction approprié (20 mM tris, 500 mM NaCl), sonifier et enlever les débris cellulaires par centrifugation).
5. Détermination de la concentration en protéines
- Déterminer la concentration de protéines par analyse par gel densitométrique d’échantillons triplicates1. Appliquer les normes de charge en albumine sérique bovine (BSA) sur les gels d’électrophorèse en polyacrylamide de sodium dodécylsulfate colorés à la coomassie (SDS-PAGE). Numériser et analyser les gels à l’aide d’un logiciel approprié (p. ex., image J; voir le tableau des matériaux).
6. Visualisation de la formation des vésicules et des vésicules isolées par microscopie à fluorescence
REMARQUE: Si les cellules contiennent des marqueurs de fusion VNp ou de membrane marqués par fluorescence, l’imagerie de cellules vivantes peut être utilisée pour suivre la formation de vésicules. Alternativement, des colorants lipidiques fluorescents peuvent être utilisés pour visualiser les vésicules afin de confirmer la production et la purification.
- Montage de cellules
- Induisez l’expression de fusion VNp pendant plusieurs heures avant de monter sur la lame.
- Méthode du tampon d’agarose (figure 3A-C) : pipeter les cellules sur un tampon LB-agarose circulaire mince (<1 mm) (2%) qui a été laissé se former et fixé sur une lame de verre propre. Laissez les cellules se déposer et s’équilibrer et placez une lame de couverture de 50 mm x 25 mm sur le tampon et les cellules. Maintenez le couvercle en place avec des entretoises et du ruban adhésif.
- Méthode à la polyéthylèneimine (PEI) (figure 3D-F) : étaler 20 μL de PEI à 0,05 % (endH2O) sur une lamelle de couverture à l’aide d’une pointe de pipette et laisser agir 3 à 5 min pour se lier au verre sans laisser sécher. Ajouter 50 μL de culture cellulaire et laisser agir pendant 5 à 10 minutes pour s’assurer que les bactéries se sont associées à la surface recouverte d’Île-du-Prince-Édouard4. Lavez la lamelle de couverture avec 100 μL de média avant de la placer sur la lame et maintenez-la en place avec des entretoises et du ruban adhésif.
- Montage des vésicules
- Pipette vésicules purifiées sur un mince tampon (<1 mm) circulaire LB-agarose (2%) qui a été laissé se former et fixé sur une lame de verre propre. Une fois le liquide séché, placez une glissière de couverture de 50 mm x 25 mm sur le tampon et les vésicules. Maintenez le couvercle en place avec des entretoises et du ruban adhésif.
- Le colorant lipidique fluorescent FM4-64 est capable de colorer les membranes5, et peut donc être utilisé pour visualiser les vésicules. Ajouter FM4-64 (voir le tableau des matières) aux vésicules purifiées à une concentration finale de 2 μM (à partir d’un stock de 2 mM dissous dans du diméthylsulfoxyde [DMSO]) et imager après une incubation de 10 minutes. Ceci est particulièrement utile pour identifier les vésicules contenant des cargaisons non marquées par fluorescence5.
- Rincer les lamelles de couverture avec le même milieu que celui utilisé pour cultiver les cellules observées.
REMARQUE : Certains milieux complexes (p. ex., la tuberculose) peuvent présenter une autofluorescence, ce qui peut entraîner un excès de signal de fond.
- Vésicules d’imagerie
REMARQUE : Des exemples d’images microscopiques de vésicules recombinantes VNp sont présentés à la figure 4.- Montez la lame sur un microscope inversé (voir Tableau des matériaux) à l’aide d’un objectif d’immersion dans l’huile et laissez reposer 2-3 minutes pour permettre à l’échantillon de se déposer et à la température de s’équilibrer.
REMARQUE : Toutes les images de cellules vivantes pour chaque échantillon doivent être effectuées dans les 30 minutes suivant le montage des cellules sur des lames de couverture afin de minimiser l’impact de la phototoxicité et du stress anaérobie. Pour cette raison, les images à plan unique sont préférées aux piles z. - Utiliser des sources lumineuses appropriées (p. ex. diode électroluminescente [DEL] ou ampoule halogène; voir le tableau des matériaux) et des combinaisons de filtres pour la ou les protéines fluorescentes/colorants utilisés6.
- Utilisez une lentille à fort grossissement (c.-à-d. 100x ou 150x) et à grande ouverture numérique (c.-à-d. NA ≥1,4) pour imager les cellules microbiennes et les vésicules.
- Déterminer l’intensité lumineuse minimale requise pour visualiser les signaux de fluorescence des cellules et / ou des vésicules. Cela peut nécessiter un certain ajustement des paramètres d’exposition et de gain pour l’appareil photo utilisé.
REMARQUE: Les temps d’exposition typiques des caméras CMOS (complementary metal-oxide semiconductor) actuelles varient entre 50 et 200 ms selon le système d’imagerie. - Pour les images à image unique, utilisez la moyenne à trois images pour réduire le bruit de fond aléatoire dépendant du matériel.
- Pour l’imagerie accélérée, prévoyez 3 à 5 minutes entre les images individuelles.
REMARQUE: Selon la configuration du microscope, la mise au point peut avoir besoin d’être ajustée par intermittence au cours d’expériences plus longues.
- Montez la lame sur un microscope inversé (voir Tableau des matériaux) à l’aide d’un objectif d’immersion dans l’huile et laissez reposer 2-3 minutes pour permettre à l’échantillon de se déposer et à la température de s’équilibrer.
Résultats
BL21 DE3 E. coli contenant la construction d’expression VNp6-mNeongreen ont été cultivés jusqu’à la phase logarithmique tardive (figure 2A). L’expression de VNp6-mNeongreen a été induite par l’ajout d’IPTG à la culture (concentration finale de 20 μg/mL ou 84 μM), qui a ensuite été laissée croître pendant la nuit à 37 °C avec agitation vigoureuse (200 tr/min, ≥25 mm de projection orbitale). Le lendemain matin, la culture présentait une fluorescence mNeongreen7 (Figure 2B), qui est restée visible dans le milieu après l’élimination des cellules bactériennes par centrifugation (Figure 2C). La présence de VNp-mNeongreen dans les milieux de culture et de culture défrichés a été confirmée par SDS-PAGE (figure 2D). Les vésicules contenant du vert mnéonvert ont été isolées sur un filtre MCE de 0,1 μm (figure 2E) et remises en suspension dans du PBS (figure 2F). Les vésicules purifiées ont ensuite été montées sur un tampon d’agarose (figure 3A-C) et imagées par microscopie à fluorescence à grand champ (figure 4A). La présence de vésicules a été confirmée à l’aide du colorant fluorescent lipophile FM4-64 (figure 4B). Les cellules E. coli exprimant la protéine de membrane interne CydB fusionnée à mNeongreen (vert) et VNp6-mCherry2 (magenta)8 montrent la production de vésicules et l’insertion de cargaison dans des cellules bactériennes vivantes (Figure 4C). Les figures 4A,B ont été capturées à l’aide d’un microscope à fluorescence à grand champ, tandis que la figure 4C a été acquise à l’aide de la microscopie à illumination structurée (SIM), en utilisant les méthodes décrites précédemment 9,10.
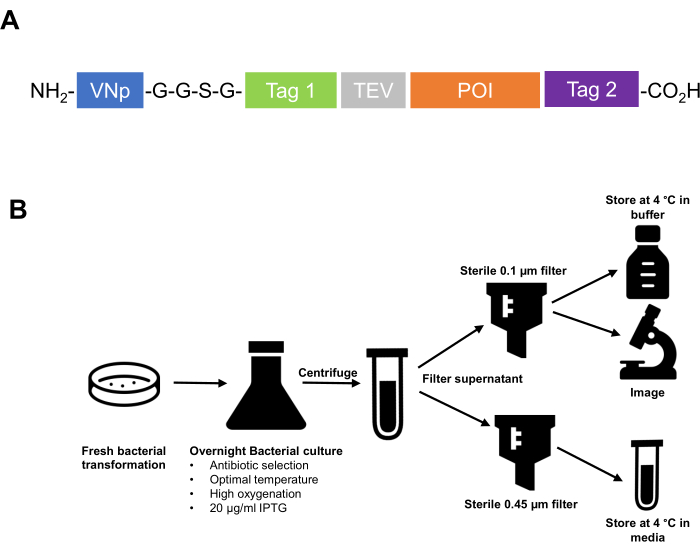
Figure 1 : Résumé de la technologie VNp depuis la conception d’une stratégie de clonage jusqu’à la purification et le stockage des vésicules extracellulaires. (A) Schéma d’une protéine de fusion VNp typique. VNp à l’extrémité NH2, suivi d’un agent de liaison flexible et d’une combinaison appropriée de marqueurs d’affinité et de fluorescence (Tag1, Tag 2, site de clivage de la protéase [p. ex., TEV]) et de protéines d’intérêt. (B) Schéma de principe résumant le protocole d’expression et de purification des vésicules membranaires remplies de protéines recombinantes à partir d’E. coli. Veuillez cliquer ici pour voir une version agrandie de cette figure.
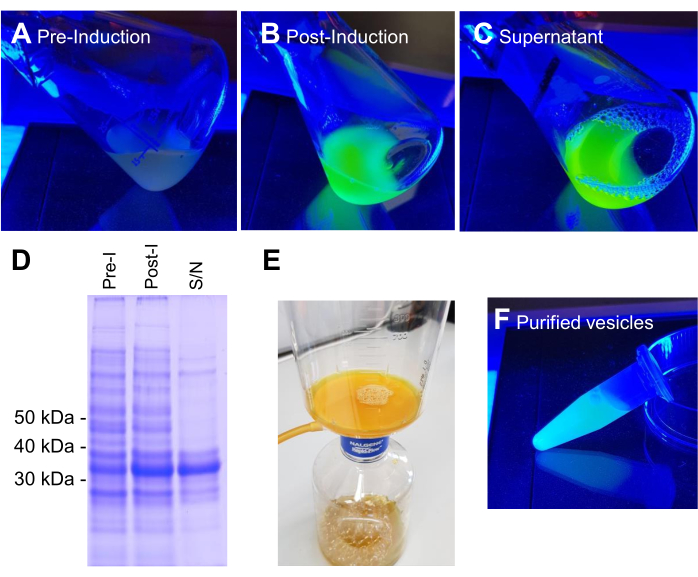
Figure 2 : Étapes de production et de purification des vésicules VNp6-mNg. Les cultures de cellules E. coli contenant l’expression VNp-mNeongreen se construisent en lumière bleue avant (A) ou après (B) l’expression induite par IPTG de la protéine de fusion. Les cellules de (B) ont été retirées par centrifugation, laissant des vésicules remplies de VNp-mNeongreen dans le milieu (C). (D) Des échantillons équivalents de A, B et C ont été analysés par FDS-PAGE et coloration coomossie. Les vésicules ont été isolées sur un filtre de 0,1 μm (E) et ensuite lavées dans un volume approprié de tampon (F). Veuillez cliquer ici pour voir une version agrandie de cette figure.
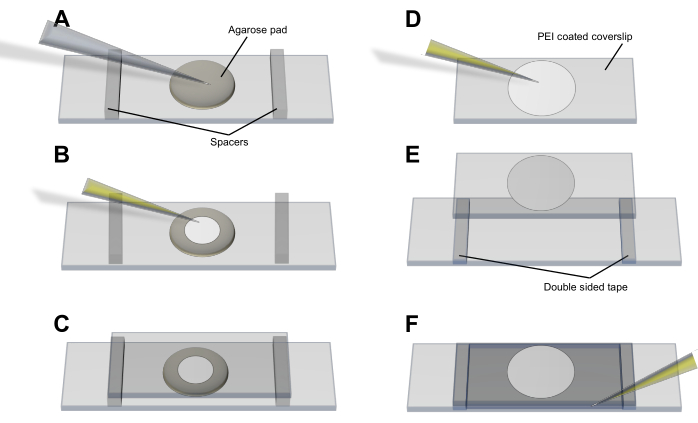
Figure 3 : Procédure de montage des cellules pour l’imagerie des vésicules et la production de vésicules. (A-C) La méthode du tampon d’agarose et (D-F) la méthode PEI pour le montage des cellules d’E. coli sur la lamelle de couverture. Veuillez cliquer ici pour voir une version agrandie de cette figure.
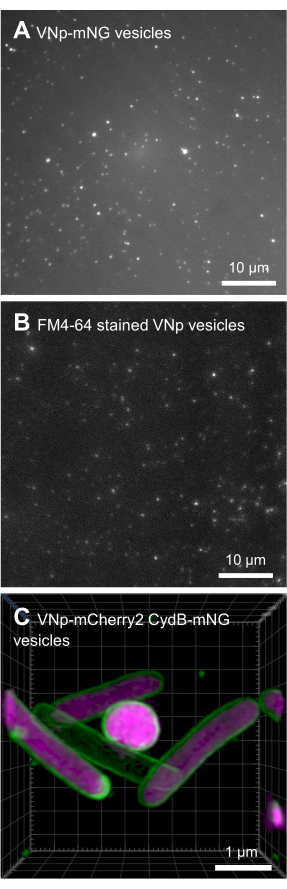
Figure 4 : Images microscopiques des vésicules recombinantes VNp. Images d’émission vertes (A) et rouges (B) provenant de différents champs de vésicules contenant du VNp6-mNeongreen marquées VNp6-mNeongreen montées sur un tampon d’agarose. (C) L’imagerie des cellules d’E. coli exprimant la protéine de membrane interne CydB fusionnée à mNeongreen (vert) et VNp6-mCherry2 (magenta) montre la production de vésicules et l’insertion de cargaison dans les cellules bactériennes vivantes. (A, B) ont été imagés à l’aide d’un microscope à fluorescence à grand champ, tandis que (C) a été acquis à l’aide de la microscopie à illumination structurée (SIM). Barres d’échelle: (A,B) = 10 μm; (C) = 1 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La méthode de peptide amino-terminal marqué pour la production de protéines recombinantes décrite ci-dessus est un processus simple, qui produit constamment de grandes quantités de protéines qui peuvent être efficacement isolées et / ou stockées pendant des mois.
Il est important de souligner les étapes clés du protocole qui sont nécessaires pour une utilisation optimale de ce système. Tout d’abord, la balise VNp1 doit être située à l’extrémité N, suivie de la protéine d’intérêt et de toute étiquette appropriée. Il est également important d’éviter d’utiliser des antibiotiques qui ciblent la couche de peptidoglycane, tels que l’ampicilline.
En termes de conditions de croissance, des milieux riches (par exemple, LB ou TB) et un rapport surface/volume élevé sont nécessaires pour maximiser la production de vésicules. La température optimale pour la production de vésicules extracellulaires est de 37 °C, mais les conditions généralement requises pour l’expression de la protéine d’intérêt doivent également être prises en compte. Pour des températures d’induction plus basses, VNp6 doit être utilisé. Fondamentalement, l’induction du promoteur T7 doit être réalisée en utilisant pas plus de 20 μg/mL (84 μM) IPTG une fois que les cellules atteignent une OD600 de 0,8-1,0. Les protéines exprimées à l’aide du système atteignent la production maximale de vésicules à 4 h ou après une induction nocturne.
Malgré la simplicité de ce protocole, il nécessite une optimisation. La fusion des variantes VNp, les températures d’expression et les périodes d’induction peuvent différer en fonction de la protéine d’intérêt. En outre, il est nécessaire d’optimiser la purification et la concentration ultérieure des vésicules extracellulaires du milieu. La procédure actuelle n’est pas évolutive et peut prendre beaucoup de temps. Ce sont les limites de cette méthodologie.
La technologie VNp présente de nombreux avantages par rapport aux méthodes traditionnelles2. Il permet l’exportation vésiculeuse de diverses protéines, la taille maximale exprimée avec succès à ce jour étant de 175 kDa pour les vésicules qui restent internes et de 85 kDa pour celles qui sont exportées. En outre, cette technologie peut augmenter considérablement le rendement des protéines recombinantes avec une gamme de propriétés physiques et d’activités. Les vésicules exportées contenant la protéine d’intérêt peuvent être isolées par simple filtration à partir du milieu préautorisé et peuvent ensuite être stockées, dans des milieux de culture stériles ou tampons, à 4 °C pendant plusieurs mois.
Les applications de ce système sont diverses, de la science de la découverte à la biotechnologie appliquée et à la médecine (p. ex., par la production de thérapies fonctionnelles)3. La facilité de production, la transformation en aval et le rendement élevé sont autant de qualités attrayantes dans ces domaines et en particulier dans l’industrie.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent ou autre conflit d’intérêts.
Remerciements
Les auteurs remercient les divers utilisateurs de Twitter qui ont soulevé des questions sur le protocole présenté dans l’article décrivant la technologie VNp. La figure 1A a été générée à l’aide d’icônes de flaticon.com. Ces travaux ont été financés par l’Université du Kent et financés par le Conseil de recherches en biotechnologie et en sciences biologiques (BB/T008/768/1 et BB/S005544/1).
matériels
| Name | Company | Catalog Number | Comments |
| Ampicillin | Melford | 69-52-3 | |
| Chloramphenicol | Acros Organics (Thermofisher Scientific) | 56-75-7 | |
| E. coli BL21 (DE3) | Lab Stock | N/A | |
| E. coli DH10β | Lab Stock | N/A | |
| Filters for microscope | Chroma | ||
| FM4-64 | Molecular Probes (Invitrogen) | T-3166 | Dissolved in DMSO, stock concentration 2 mM |
| ImageJ | Open Source | Downloaded from: https://imagej.net/ij/index.html | |
| Inverted microscope | Olympus | ||
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Melford | 367-93-1 | |
| Kanamycin sulphate | Gibco (Thermofisher Scientific) | 11815-024 | |
| LED light source for micrscope | Cairn Research Ltd | ||
| Lysogeny Broth (LB) / LB agar | Lab Stock | N/A | 10 g/L Tryptone; 10 g/L NaCl; 5 g/L Yeast Extract (1.5 g/L agar) |
| Metamorph imaging software | Molecular Devices | ||
| MF-Millipore Membrane filter (0.1 µm, MCE) | Merck | VCWP04700 | |
| Millipore Express PLUS membrane filter (0.45 µm, PES) | Merck | HPWP04700 | |
| Phosphate buffered saline (PBS) | Lab Stock | N/A | |
| Plasmids allowing expression of protein of interest with different VNp amino terminal fusions | Addgene | https://www.addgene.org/Dan_Mulvihill/ | |
| Terrific Broth (TB) | Lab Stock | N/A | 12 g/L Tryptone; 24 g/L Yeast Extract; 4 ml/L 10% glycerol; 17 mM KH2PO4 72 mM K2HPO4 |
Références
- Eastwood, T. A., et al. High-yield vesicle-packaged recombinant protein production from E. coli. Cell Reports Methods. 3 (2), 100396 (2023).
- Makino, T., Skretas, G., Georgiou, G. Strain engineering for improved expression of recombinant proteins in bacteria. Microbial Cell Factories. 10, 32 (2011).
- Peng, C., et al. Factors influencing recombinant protein secretion efficiency in gram-positive bacteria: Signal peptide and beyond. Frontiers in Bioengineering and Biotechnology. 7, 139 (2019).
- Lewis, K., Klibanov, A. M. Surpassing nature: rational design of sterile-surface materials. Trends in Biotechnology. 23 (7), 343-348 (2005).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6 (3), 365-371 (1996).
- Mulvihill, D. P. Live cell imaging in fission yeast. Cold Spring Harbor Protocols. 2017 (10), (2017).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nature Methods. 10 (5), 407-409 (2013).
- Shen, Y., Chen, Y., Wu, J., Shaner, N. C., Campbell, R. E. Engineering of mCherry variants with long Stokes shift, red-shifted fluorescence, and low cytotoxicity. PloS One. 12 (2), e0171257 (2017).
- Periz, J., et al. A highly dynamic F-actin network regulates transport and recycling of micronemes in Toxoplasma gondii vacuoles. Nature Communications. 10 (1), 4183 (2019).
- Qiu, H., et al. Uniform patchy and hollow rectangular platelet micelles from crystallizable polymer blends. Science. 352 (6286), 697-701 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon