Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthodologie pour inactiver métaboliquement les bactéries pour la recherche sur Caenorhabditis elegans
Dans cet article
Résumé
La source de nourriture de Caenorhabditis elegans en laboratoire est Escherichia coli vivant. Étant donné que les bactéries sont métaboliquement actives, elles présentent une variable confondante dans les études métaboliques et médicamenteuses chez C. elegans. Un protocole détaillé pour inactiver métaboliquement les bactéries à l’aide de paraformaldéhyde est décrit ici.
Résumé
Caenorhabditis elegans est un organisme modèle commun pour la recherche en génétique, développement, vieillissement, métabolisme et comportement. Étant donné que C. elegans consomme un régime de bactéries vivantes, l’activité métabolique de leur source de nourriture peut confondre les expériences visant à rechercher les effets directs de diverses interventions sur le ver. Pour éviter les effets confondants du métabolisme bactérien, les chercheurs de C. elegans ont utilisé plusieurs méthodes pour inactiver métaboliquement les bactéries, y compris l’irradiation ultraviolette (UV), l’élimination par la chaleur et les antibiotiques. Le traitement UV est relativement faible et ne peut pas être utilisé en culture liquide car chaque plaque doit être examinée pour une destruction bactérienne réussie. Une deuxième méthode de traitement, la chaleur meurtrière, affecte négativement la texture et la qualité nutritionnelle de la bactérie, conduisant à l’arrêt du développement de C. elegans. Enfin, le traitement antibiotique peut modifier directement la physiologie de C. elegans en plus d’empêcher la croissance bactérienne. Ce manuscrit décrit une méthode alternative pour inactiver métaboliquement les bactéries à l’aide du paraformaldéhyde (PFA). Le traitement PFA réticulant les protéines dans les cellules bactériennes pour empêcher l’activité métabolique tout en préservant la structure cellulaire et le contenu nutritionnel. Cette méthode est à haut débit et peut être utilisée dans la culture liquide ou les plaques solides, car le test de croissance d’une plaque de bactéries traitées au PFA valide l’ensemble du lot. L’inactivation métabolique par traitement PFA peut être utilisée pour éliminer les effets confondants du métabolisme bactérien sur les études de supplémentation en médicaments ou en métabolites, la résistance au stress, la métabolomique et le comportement chez C. elegans.
Introduction
Caenorhabditis elegans a été proposé à l’origine comme organisme modèle en 19651 et a depuis été largement adopté dans les études sur la génétique, le développement, le comportement, le vieillissement et le métabolisme2. En raison de la grande taille de son couvain et de sa cuticule transparente, C. elegans est particulièrement bien adapté au criblage à haut débit avec des rapporteurs fluorescents3. Leur cycle de vie court, leur reproduction hermaphrodite et leur homologie génétique avec l’homme font également de C. elegans un système modèle précieux pour les études sur le développement4 et la biologie du vieillissement5. De plus, C. elegans est relativement facile à entretenir. Les vers peuvent être cultivés en culture liquide ou sur des plaques de gélose solide et consommer un régime de bactéries vivantes Escherichia coli OP504.
Cependant, la source de nourriture vivante de C. elegans peut confondre les études sur le métabolisme, la supplémentation en médicaments et le comportement. Étant donné que les bactéries vivantes ont leur propre métabolisme, les conditions expérimentales qui affectent les bactéries modifient également les nutriments et les métabolites disponibles pour les vers. Par exemple, les différences dans les concentrations bactériennes de fer, d’acides aminés et de folate ont des effets divers sur le développement, la physiologie et la durée de vie de C. elegans 6. De nombreuses pratiques de laboratoire courantes peuvent provoquer de tels changements dans la composition nutritionnelle et les métabolites produits par l’OP50. Plus précisément, l’exposition à la 5-fluoro-2'-désoxyuridine (FUdR), un composé couramment utilisé pour empêcher la reproduction chez C. elegans, provoque de grands changements dans l’expression du gène OP50, y compris les voies de biosynthèse des acides aminés7. Les bactéries vivantes peuvent également confondre les études dans lesquelles C. elegans est complété par de petites molécules, car les bactéries peuvent métaboliser partiellement ou complètement les composés actifs. De plus, les effets de ces petites molécules sur les bactéries peuvent, à leur tour, modifier la physiologie de C. elegans, comme cela a été rapporté avec le médicament qui prolonge la durée de vie, la metformine8. Enfin, les bactéries vivantes peuvent modifier l’environnement du ver d’une manière qui modifie le comportement, par exemple en sécrétant des odorants attrayants9, en produisant des neuromodulateurs exogènes10 et en créant des gradients d’oxygène dans une pelouse bactérienne dense11.
Afin d’atténuer les effets confondants du métabolisme bactérien sur la recherche sur C . elegans , plusieurs méthodes ont été mises au point pour tuer les bactéries (tableau 1). Trois stratégies courantes pour tuer l’OP50 sont l’irradiation UV, l’élimination de la chaleur et le traitement antibiotique. Bien qu’elles soient simples et relativement peu coûteuses, chacune de ces méthodes peut avoir des effets indésirables sur les bactéries et C. elegans. La destruction des UV via un réticulant UV12 est à faible débit et le taux est limité par le nombre de plaques pouvant contenir le réticulant UV. De plus, l’efficacité de la destruction des UV peut varier d’une plaque à l’autre au sein d’un lot, et les tests de croissance sur toutes les plaques peuvent devenir difficiles dans les grandes expériences. L’OP50 qui tue la chaleur en exposant la culture à des températures de >60 °C s’accompagne d’un ensemble distinct de défis. Une chaleur élevée peut endommager les nutriments essentiels pour le ver et détruire la structure cellulaire des bactéries, créant une texture plus douce qui diminue le temps que les vers passent sur la nourriture13. Cette méthode ne peut pas non plus être utilisée tout au long du cycle de vie de C. elegans , car les vers nourris avec des bactéries tuées par la chaleur peuvent s’arrêter tôt dans leur développement13. Le traitement antibiotique est une troisième méthode courante pour supprimer le métabolisme bactérien14, mais les antibiotiques peuvent également modifier la croissance et le métabolisme des vers15.
Une solution pour éliminer les effets métaboliques des bactéries vivantes tout en préservant la structure bactérienne et les nutriments essentiels est de tuer l’OP50 avec du paraformaldéhyde (PFA)16. Le PFA est un polymère de formaldéhyde qui peut réticuler les protéines à l’intérieur des cellules17 pour empêcher la réplication bactérienne sans détruire les structures cellulaires internes comme la membrane plasmique interne18. En raison de cette préservation de la structure cellulaire interne, les bactéries traitées au PFA ne présentent aucune croissance ni activité métabolique, mais restent une source de nourriture comestible et riche en nutriments pour C. elegans16. Ici, un protocole détaillé est fourni qui montre comment inactiver métaboliquement les bactéries à l’aide de paraformaldéhyde.
| Méthode | Matériel requis | Évolutif? | Nutritionnel? | Effets sur le ver ? | ||||
| UV | Réticulant UV | Limité par : | Oui | Effets variables sur la durée de vie sur NGM12, 23, 24 | ||||
| Nombre de plaques pouvant s’adapter à la réticulation UV | Effets variables sur la durée de vie sur FUdR24, 26, 27 | |||||||
| Temps d’irradiation par plaque | Diminution des préférences alimentaires16 | |||||||
| Possibilité de vérifier la croissance de chaque plaque8 | ||||||||
| Chaleur | Incubateur >60 °C | Oui | Non : détruit la paroi cellulaire, diminue la valeur nutritionnelle | Arrêt développemental 13 | ||||
| Diminution de la préférence alimentaire13 | ||||||||
| Prolonge la durée de vie du NGM31 | ||||||||
| Antibiotiques | Antibiotiques (kanamycine, carbénicilline, etc.) | Oui | Oui | Retarde la croissance et le développement15 | ||||
| Prolonge la durée de vie en milieu liquide19 | ||||||||
| Prolonge la durée de vie du NGM15 | ||||||||
| L’APF | 0,5 % de paraformaldéhyde | Oui | Oui | Diminution de la petite taille du couvain16 | ||||
| Faible augmentation du temps de développement16 | ||||||||
| Diminution des préférences alimentaires16 | ||||||||
Tableau 1. Comparaisons des méthodes pour tuer l’OP50. L’élimination des UV, l’élimination de la chaleur, le traitement antibiotique et le traitement par PFA ont des effets variés sur l’état nutritionnel des bactéries et la santé des vers nourris avec des bactéries traitées. Ces méthodes d’inactivation réplicative d’E. coli diffèrent également par les matériaux requis et l’évolutivité.
Protocole
1. Inoculation des bactéries
- Préparez le bouillon Luria (LB) en dissolvant 10 g de tryptone, 5 g d’extrait de levure et 10 g de chlorure de sodium (NaCl) dans 950 mL d’eau distillée.
- Ajustez le pH de la LB à 7,0 en ajoutant de l’hydroxyde de sodium (NaOH) 5M. Cela ne devrait nécessiter qu’environ 0,2 mL de NaOH.
- Autoclaver le média LB ajusté au pH sur un cycle liquide pendant 45 min à 15 psi. Laissez la solution refroidir et conservez-la à température ambiante.
- Inoculer une seule colonie de bactéries dans 100 mL de LB dans un erlenmeyer de 500 mL. Cultivez les bactéries pendant une nuit dans un incubateur à secousses à 37 °C.
- En fonction de l’état de santé de la colonie bactérienne, de la taille du flacon et de la vitesse à laquelle l’agitateur est réglé, le temps nécessaire à la croissance des bactéries peut varier. Après ~14 h, vérifier la densité optique (OD) des bactéries à 600 nm (OD600).
- Retirez les bactéries de l’agitateur lorsque le diamètre extérieur600 est de 3,0 (1 x 109 unités formant colonie (UFC)/mL). Si le diamètre extérieur600 est inférieur à 3,0, remettez le ballon dans l’incubateur à agitation jusqu’à ce que le diamètre extérieur souhaité soit atteint.
- Aliquotez les bactéries dans des tubes coniques de 50 mL et conservez-les à 4 °C ou passez à l’étape suivante.
2. Travailler avec du paraformaldéhyde
REMARQUE : La concentration de paraformaldéhyde (PFA) utilisée et la durée de l’exposition peuvent varier quelque peu en fonction du climat, de l’emplacement et du type de bactéries traitées. Un bon point de départ pour l’OP50 est l’exposition à 0,5 % de PFA pendant 1 h, tandis que 0,25 % de PFA pendant 1 h peut suffire pour HT115.
- Préparez du bouillon à 32 % de PFA ou utilisez une solution à 32 % de PFA achetée dans le commerce. Utilisez un équipement de protection individuelle (EPI) approprié lorsque vous travaillez avec de l’APF. Portez des gants et des lunettes de protection.
- Ajoutez du PFA à l’intérieur d’une hotte chimique avec une ventilation adéquate. Jetez les produits de lavage et les embouts contenant du PFA dans des récipients appropriés pour les risques chimiques dans la hotte.
3. Traitement bactérien au paraformaldéhyde
- Une fois que les bactéries ont atteint un OD600 de 3,0, utiliser une pipette sérologique pour transférer 50 mL dans un nouveau erlenmeyer de 250 mL. Conservez le reste pour un témoin en direct, un témoin traité simulé (voir l’étape 4) ou pour traiter aussi bien avec de la PFA que nécessaire.
- Évitez de verser d’une fiole à l’autre et veillez à ne pas éclabousser les parois de la nouvelle fiole avec des bactéries. Les colonies situées sur le côté de la fiole peuvent recevoir une dose plus faible de PFA.
- Dans la hotte chimique, ajouter 781 μL de PFA à 32 % de bactéries à 50 mL pour porter la concentration finale à 0,5 %. Jetez l’embout utilisé dans un conteneur de déchets solides présentant des risques chimiques.
- Couvrir le flacon de papier d’aluminium et le remettre dans l’incubateur à 37 °C pendant 1 h. Après 1 h, retirez le flacon de l’incubateur et passez à l’étape 5.
4. Contrôle simulé
- Une fois que les bactéries ont atteint un diamètre extérieur de600 de 3,0, utiliser une pipette sérologique pour transférer 50 mL de bactéries dans un tube conique de 50 mL.
- Passez à l’étape 5.3 pour effectuer les étapes de lavage similaires à celles du groupe traité au PFA.
5. Laver les bactéries pour éliminer les résidus de PFA
- Dans la hotte chimique, à l’aide d’une pipette sérologique, transférer les bactéries traitées de l’erlenmeyer vers un tube conique de 50 ml. L’utilisation d’une pipette sérologique au lieu de verser les bactéries empêchera la contamination par des colonies bactériennes sur le bord de la fiole qui auraient pu éviter un traitement direct avec de la PFA.
- Centrifuger les bactéries traitées à environ 3000 x g pendant 20 min. Retirez le surnageant en le jetant dans un récipient à risque chimique pour déchets liquides dans la hotte chimique.
- Ajouter 25 mL de LB et de vortex pour remettre la pastille bactérienne en suspension (le remplissage complet du tube rend plus difficile la remise en suspension de la pastille). Répétez la centrifugation et la remise en suspension des granulés 4 fois.
- Remettre le granulé en suspension dans des volumes optimaux pour différents dosages. Pour les essais de durée de vie, ensemencer des plaques de 60 mm avec 200 μL de bactéries remises en suspension dans 10 mL de LB. La remise en suspension des bactéries dans 10 mL de LB permet d’obtenir une concentration 5 fois supérieure à celle de la culture originale de 50 mL.
- Conservez les bactéries à 4 °C.
6. Contrôle de la qualité de la croissance bactérienne
- Après le lavage final et la remise en suspension, strier une plaque LB (à l’aide d’une pointe de pipette stérile) avec les bactéries préparées. Il est recommandé de rayer le LB utilisé pour le lavage et la remise en suspension sur une plaque séparée afin de s’assurer que le LB utilisé n’a pas été contaminé.
- Placez les assiettes dans un incubateur à 37 °C pendant la nuit. Vérifiez s’il y a des croissances. Les bactéries sont considérées comme mortes de manière réplicative lorsque les colonies ne se développent pas sur la plaque LB.
7. Contrôle de la qualité du métabolisme bactérien à l’aide d’un respiromètre
- Après le lavage final et la remise en suspension de l’étape 5.4, confirmez que les bactéries sont métaboliquement mortes à l’aide des outils disponibles tels que les respiromètres19,20 et la mesure du taux de consommation basale d’oxygène (OCR).
- Préparer la solution de M9 : Dissoudre 3 g de phosphate de potassium monobasique (KH2 PO 4), 6 g de phosphate de sodium dibasique (Na2HPO4) et 5 g de chlorure de sodium (NaCl) dans 950 mL d’eau distillée. Autoclavez sur un cycle liquide pendant 45 min à 15 psi, puis laissez la solution refroidir à température ambiante. Ajouter 1 mL de sulfate de magnésium 1 M (MgSO4) et conserver à température ambiante.
- Hydrater la cartouche du respiromètre : Ajouter 200 μL de calibrant à tous les puits d’une plaque de 96 puits. Placez la cartouche dans la plaque à 96 puits et incubez-la toute la nuit dans un incubateur à 37 °C.
- Étalonnage du dosage : Le lendemain, placez la cartouche hydratée dans la machine et commencez l’étalonnage.
- Configuration de la plaque d’essai d’analyse : À l’aide d’une nouvelle plaque à 96 puits, ajouter 160 μL de M9 et 40 μL de bactéries préparées (1 x 109 UFC/mL) dans les puits d’essai. Ajouter 200 μL de M9 dans les 4 puits d’angle pour les utiliser comme puits vides. Ajouter 160 μL de M9 et 40 μL de LB utilisés pour le lavage et la remise en suspension pour les utiliser comme témoins négatifs. Ajouter 200 μL de M9 au reste des puits qui ne seront pas utilisés.
- Exécuter le test : Une fois l’étalonnage de la cartouche terminé, insérez la plaque de dosage de l’étape 7.5 dans la machine pour analyse. Les paramètres comprennent des étapes de mixage, d’attente, de mesure et de boucle. Les résultats seront affichés sous forme de taux de consommation d’oxygène (OCR). Les bactéries sont métaboliquement mortes et prêtes à l’emploi lorsque l’OCR est nul.
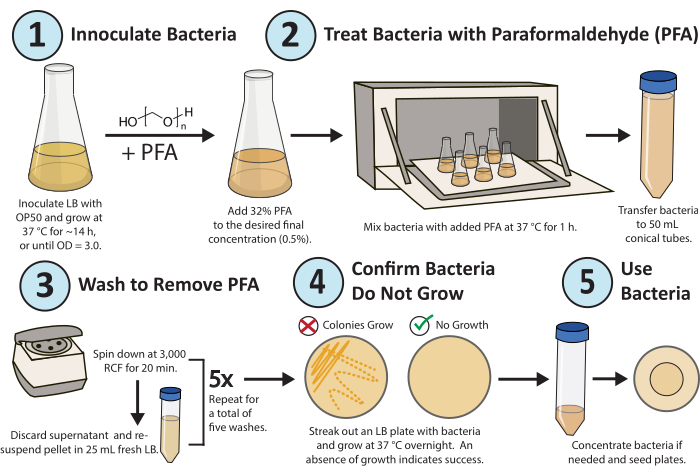
Graphique 1. Flux de travail pour le traitement du paraformaldéhyde. Une seule colonie de la bactérie E. coli OP50 est cultivée pendant la nuit. Le PFA est ajouté à une concentration finale de 0,5 % et la culture traitée au PFA est agitée pendant 1 h à 37 °C. Enfin, le PFA est éliminé en lavant la culture avec du LB 5x frais. Pour confirmer que les bactéries traitées sont inactives de manière réplicative, sortez une plaque LB des bactéries traitées et développez-les pendant la nuit. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Un flux de travail détaillé du protocole est illustré à la figure 1. Une méthode à haut débit a été mise au point et optimisée pour inactiver de façon constante la réplication bactérienne (figure 2A) et le métabolisme (figure 2B) pour les études métaboliques et médicamenteuses dans le cadre de la recherche sur C. elegans à l’aide du paraformaldéhyde16. L’objectif était de dét...
Discussion
Avantages de la destruction des PFA par rapport aux autres méthodes de destruction des bactéries
Le traitement par PFA est une méthode à haut débit pour prévenir le métabolisme bactérien tout en maintenant une source de nourriture nutritive pour C. elegans. L’élimination des bactéries par le biais d’un traitement PFA présente de multiples avantages par rapport aux autres méthodes. Contrairement au traitement UV, où chaque plaque doit être testée pour réussir à tuer, une s...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ces travaux ont été financés par le NIH R21AG059117 et les laboratoires Paul F. Glenn pour la recherche sur la biologie du vieillissement de l’Université du Michigan. SB a été financé par T32AG000114. ESK a été financé par NSF DGE 1841052.
matériels
| Name | Company | Catalog Number | Comments |
| Aluminum Foil | Staples | 2549291 | |
| Bunsen burner | VWR | 470121-700 | |
| Cell Density Meter | Denville | 80-3000-45 | |
| Centrifuge | Eppendorg | 5430 | |
| Chemical fume hood | Labcono | 975050411384RG | |
| Conincal tubes (50 mL) | Fisher | 339652 | |
| Cuvettes | Fisher | 14-955-127 | |
| E. coli OP50 | CGC | OP50 | |
| Erlenmyer flasks | Fisher | 250 mL: FB501250 500 mL: FB501500 1000 mL: FB5011000 | |
| Inoculation loop | Fisher | 22-363-605 | |
| LB Agar | Fisher | BP1425500 | |
| Liquid waste collection bottle | Thomas Scientific | 1230G50 | |
| Magnesium Sulfate (MgSO4) | Sigma | M7506 | |
| Paraformaldehyde (32%) | Electron Microscopy Sciences | 15714-S | Paraformaldehyde – methanol free solution |
| Pipettor | Eppendorf | Eppendorf Easypet 3 | |
| Plastic dishes (100 mm) | Fisher | FB0875712 | |
| Potassium Phosphate Monobasic (KH2PO4) | Fisher | P2853 | |
| Seahorse XF Calibrant | Agilent | 100840-000 | |
| Seahorse XFe96 Extracellular Flux Assay Kit and Cell Culture Microplate | Agilent | 101085-004 | |
| Serological pipettes (50 mL) | Genesee Scientific | 12-107 | |
| Shaker incubator | Thermo | 11 676 083 | |
| Sodium Chloride (NaCl) | Fisher | S640-3 | |
| Sodium Hydroxide (NaOH) | Fisher | S318500 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Sigma | S374-500 | |
| Solid waste collection bucket | M&M Industries | 5.0 Gallon M1 Traditional Pail | |
| Tryptone | Genesee Scientific | 20-251 | |
| Vortex | Thermo | 11676331 | |
| Weighing balance | C Goldenwall | HZ10K6B | |
| Yeast Extract | Genesee Scientific | 20-255 |
Références
- Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R. C. . Elegans II. 33, (1997).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on caenorhabditis elegans. WormBook. , 1-31 (2015).
- Kaletta, T., Hengartner, M. O. Finding function in novel targets: C. elegans as a model organism. Nature reviews. Drug discovery. 5 (5), 387-398 (2006).
- Meneely, P. M., Dahlberg, C. L., Rose, J. K. Working with worms: Caenorhabditis elegans as a model organism. Current Protocols Essential Laboratory Techniques. 19 (1), (2019).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Frontiers in Endocrinology. 11, 554994 (2020).
- Feng, M., Gao, B., Garcia, L. R., Sun, Q. Microbiota-derived metabolites in regulating the development and physiology of Caenorhabditis elegans. Frontiers in Microbiology. 14, 1035582 (2023).
- McIntyre, G., Wright, J., Wong, H. T., Lamendella, R., Chan, J. Effects of FUdR on gene expression in the C. elegans bacterial diet OP50. BMC Research Notes. 14 (1), 207 (2021).
- Cabreiro, F., et al. Metformin retards aging in c. Elegans by altering microbial folate and methionine metabolism. Cell. 153 (1), 228-239 (2013).
- Worthy, S. E., et al. Identification of attractive odorants released by preferred bacterial food found in the natural habitats of c. Elegans. PLoS One. 13 (7), e0201158 (2018).
- Chen, Y. C., Seyedsayamdost, M. R., Ringstad, N. A microbial metabolite synergizes with endogenous serotonin to trigger C. elegans reproductive behavior. Proceedings of the National Academy of Sciences of the United States of America. 117 (48), 30589-30598 (2020).
- Kim, D. H., Flavell, S. W. Host-microbe interactions and the behavior of Caenorhabditis elegans. Journal of Neurogenetics. 34 (3-4), 500-509 (2020).
- Gems, D., Riddle, D. L. Genetic, behavioral, and environmental determinants of male longevity in Caenorhabditis elegans. Genetics. 154 (4), 1597-1610 (2000).
- Qi, B., Kniazeva, M., Han, M. A vitamin-b2-sensing mechanism that regulates gut protease activity to impact animal's food behavior and growth. eLife. 6, e26243 (2017).
- Garigan, D., et al. Genetic analysis of tissue aging in caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Virk, B., et al. Folate acts in E. coli to accelerate C. elegans aging independently of bacterial biosynthesis. Cell Reports. 14 (7), 1611-1620 (2016).
- Beydoun, S., et al. An alternative food source for metabolism and longevity studies in Caenorhabditis elegans. Communications Biology. 4 (1), 258 (2021).
- Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., Ranganathan, K. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Felix, H. Permeabilized and immobilized cells. Methods in Enzymology. 137, 637-641 (1988).
- Lobritz, M. A., et al. Antibiotic efficacy is linked to bacterial cellular respiration. Proceedings of the National Academy of Sciences of the United States of America. 112 (27), 8173-8180 (2015).
- Nadanaciva, S., et al. Assessment of drug-induced mitochondrial dysfunction via altered cellular respiration and acidification measured in a 96-well platform. Journal of Bioenergetics and Biomembranes. 44 (4), 421-437 (2012).
- Shtonda, B. B., Avery, L. Dietary choice behavior in Caenorhabditis elegans. The Journal of Experimental biology. 209 (Pt 1), 89-102 (2006).
- MacNeil, L. T., Watson, E., Arda, H. E., Zhu, L. J., Walhout, A. J. Diet-induced developmental acceleration independent of tor and insulin in C. elegans. Cell. 153 (1), 240-252 (2013).
- Kumar, S., et al. Lifespan extension in C. elegans caused by bacterial colonization of the intestine and subsequent activation of an innate immune response. Developmental Cell. 49 (1), 100-117 (2019).
- Nakagawa, H., et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri sbt2055 in Caenorhabditis elegans. Aging Cell. 15 (2), 227-236 (2016).
- Kaeberlein, T. L., et al. Lifespan extension in Caenorhabditis elegans by complete removal of food. Aging Cell. 5 (6), 487-494 (2006).
- Beaudoin-Chabot, C., et al. The unfolded protein response reverses the effects of glucose on lifespan in chemically-sterilized C. elegans. Nature Communication. 13 (1), 5889 (2022).
- Komura, T., Takemoto, A., Kosaka, H., Suzuki, T., Nishikawa, Y. Prolonged lifespan, improved perception, and enhanced host defense of Caenorhabditis elegans by Lactococcus cremoris subsp. cremoris.Microbiology Spectrum. 10 (3), e0045421 (2022).
- Ye, X., Linton, J. M., Schork, N. J., Buck, L. B., Petrascheck, M. A pharmacological network for lifespan extension in Caenorhabditis elegans. Aging Cell. 13 (2), 206-215 (2014).
- Hastings, J., et al. Wormjam: A consensus C. elegans metabolic reconstruction and metabolomics community and workshop series. Worm. 6 (2), e1373939 (2017).
- O'Donnell, M. P., Fox, B. W., Chao, P. H., Schroeder, F. C., Sengupta, P. A neurotransmitter produced by gut bacteria modulates host sensory behaviour. Nature. 583 (7816), 415-420 (2020).
- Stuhr, N. L., Curran, S. P. Bacterial diets differentially alter lifespan and healthspan trajectories in C. elegans. Communications Biology. 3 (1), 653 (2020).
- Dirksen, P., et al. Cembio - the Caenorhabditis elegans microbiome resource. G3 (Bethesda). 10 (9), 3025-3039 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon