Activation neuronale à distance couplée à un prélèvement sanguin automatisé pour induire et mesurer l’hormone lutéinisante circulante chez la souris
Dans cet article
Résumé
La pulsatilité de l’hormone lutéinisante (LH) est une caractéristique de la fonction reproductive. Nous décrivons un protocole d’activation à distance de populations neuronales spécifiques lié à un prélèvement sanguin automatisé en série. Cette technique permet une modulation hormonale chronométrée, un multiplexage et une minimisation des effets de manipulation sur les niveaux de LH chez des animaux conscients en mouvement libre et non dérangés.
Résumé
Les taux d’hormone lutéinisante (LH) circulante sont un indice essentiel du fonctionnement du contrôle hypothalamo-hypophysaire de la reproduction. Le rôle de nombreuses entrées et populations neuronales dans la modulation de la libération de LH est encore inconnu. Mesurer les changements dans les niveaux de LH chez les souris est souvent un défi car elles sont facilement perturbées par le stress environnemental. Les techniques actuelles de mesure de la libération et de la pulsatilité de LH nécessitent un entraînement à long terme pour que les souris s’adaptent au stress de manipulation, à une certaine retenue, à la présence de l’investigateur et au travail sur des animaux individuels, ce qui réduit son utilité pour de nombreuses questions de recherche.
Cet article présente une technique permettant d’activer à distance des populations neuronales spécifiques à l’aide de la technologie DREADDs (Designer Receptor Exclusively Activated by Designer Drugs) couplée à un prélèvement sanguin séquentiel automatisé chez des souris conscientes, en mouvement libre et non dérangées. Nous décrivons d’abord le protocole de chirurgie stéréotaxique pour délivrer des vecteurs de virus adéno-associés (AAV) exprimant des DREADS à des populations neuronales spécifiques. Ensuite, nous décrivons le protocole de canulation de l’artère carotide et de la veine jugulaire et la connexion postopératoire au système automatisé de prélèvement sanguin CULEX. Enfin, nous décrivons le protocole d’injection intraveineuse de clozapine-N-oxyde pour l’activation neuronale à distance et le prélèvement sanguin automatisé. Cette technique permet un prélèvement automatisé programmé toutes les 5 minutes ou plus pendant une période donnée, associé à une injection intraveineuse de substances à un moment ou à une durée souhaités. Dans l’ensemble, nous avons trouvé que cette technique était une approche puissante pour la recherche sur le contrôle neuroendocrinien.
Introduction
L’axe hypothalamo-hypophyso-gonadique (HPG) est régulé de manière centralisée par la libération pulsatile de l’hormone de libération des gonadotrophines (GnRH) dans le système porte hypophysaire. Dans l’hypophyse, la GnRH contrôle la libération pulsatile de gonadotrophines, d’hormone lutéinisante (LH) et d’hormone folliculo-stimulante (FSH) dans le système circulatoire. La libération pulsatile LH sert de caractéristique pour le fonctionnement de l’axe HPG central 1,2,3,4. Par exemple, il montre les effets des altérations génétiques ou des changements de facteurs hormonaux ou environnementaux sur la partie neurale de l’axe 5,6,7. Jusqu’à récemment, la mesure du profil pulsatile de LH était limitée aux grands mammifères8 et aux rats9, étant donné la fréquence élevée des prélèvements et les grands volumes sanguins nécessaires pour identifier les impulsions.
La détection des impulsions de LH chez la souris est souhaitable car cette espèce dispose de vastes modèles génétiques et peut être facilement manipulée à l’aide de technologies d’ingénierie génomique pour étudier plus en détail des gènes et des populations cellulaires spécifiques. Au cours de la dernière décennie, une grande avancée dans l’analyse des concentrations de LH chez la souris à l’aide d’un test immuno-enzymatique (ELISA) en sandwich a permis de détecter la LH dans une quantité infime de sang10. Le développement de la technique de prélèvement sanguin fréquent en bout de queue a rendu possible le prélèvement fréquent nécessaire pour détecter la fréquence et l’amplitude des impulsions LH chez la souris10,11. Cependant, le prélèvement sanguin au bout de la queue est limité à son utilisation chez les animaux éveillés conscients ; Il faut une longue période d’entraînement pour que les souris s’adaptent à la manipulation et à la présence d’un investigateur désigné lors de l’échantillonnage. Son succès est très sensible aux facteurs de stress environnementaux et peut ne pas convenir à une utilisation dans les souches de souris présentant des niveaux élevés d’anxiété. La canulation intra-auriculaire a également été utilisée pour des prélèvements sanguins fréquents chez des souris conscientes se déplaçant librement12. Cependant, cette configuration nécessite toujours des prélèvements sanguins manuels répétés et restreint l’espace de déplacement des animaux, tandis que la canulation auriculaire peut entraîner des changements dynamiques de la fonction cardiaque. Il est donc souhaitable d’établir une méthode de collecte de sang dans des conditions sans stress chez des souris conscientes, en mouvement libre et non dérangées, sans avoir besoin d’une formation préalable ou d’une manipulation ou d’une présence humaine.
Le prélèvement automatisé de sang ou de dialysat a déjà été utilisé pour mesurer différents niveaux d’hormones (par exemple, la mélatonine13,14) et leur sécrétion pulsatile (par exemple, l’hormone de croissance)15 chez des rongeurs non attachés. Nous présentons ici un protocole pour des prélèvements sanguins fréquents automatisés à long terme chez des animaux conscients et non attachés, couplé à une activation à distance opportune de populations neuronales spécifiques à l’aide de technologies chimiogénétiques : les récepteurs de conception exclusivement activés par des drogues de synthèse (DREADD). Nous décrirons l’administration stéréotaxique d’un vecteur de virus adéno-associé (AAV) et l’activation à distance par une administration intraveineuse automatisée (IV) de N-oxyde de clozapine (CNO)16,17. Ce protocole permet la détection séquentielle des niveaux basaux et des changements induits de la pulsatilité de la LH chez plusieurs animaux en même temps. Le prélèvement sanguin et l’administration intraveineuse du composé sont effectués de manière contrôlée dans le temps via un programme informatique, éliminant la présence physique de l’investigateur ou la nécessité d’une formation préalable de la souris. Cette méthode permet de surmonter les principales limites du prélèvement sanguin manuel. Il permet un prélèvement sanguin dans des conditions sans stress et une administration simultanée de composés IV couplée à un contrôle à distance de l’activité neuronale. Nous montrons des résultats représentatifs de l’utilisation du prélèvement sanguin automatisé seul ou combiné à l’activation neuronale à distance et discutons de ses avantages, de ses limites et de ses utilisations supplémentaires.
Protocole
Toutes les procédures sur les animaux sont effectuées conformément au Guide du Conseil national de recherches sur les soins et l’utilisation des animaux de laboratoire18 ainsi qu’aux lois fédérales, étatiques et locales. Des souris femelles adultes (âgées de 3 à 6 mois) ont été utilisées pour cette démonstration du protocole, dont quatre femelles C57BL/6J et quatre Kiss1-Cre ; ChR2-eYFP (Kiss1-eYFP) femelles. Les souris ont été maintenues sous un cycle lumière/obscurité de 12 :12, à température contrôlée à 22 °C et nourries ad libitum avec un régime pauvre en phytoestrogènes. Les procédures et les protocoles ont été approuvés par le Comité institutionnel de protection et d’utilisation des animaux de l’Université du Michigan (IACUC, Animal Protocols : PRO00010420 and PRO00010138).
1. Administration stéréotaxique d’AAV à une population cellulaire spécifique
- Préparation à la chirurgie
- Stérilisez tous les outils. Préparez plusieurs paquets d’outils chirurgicaux pour vous assurer que chaque paquet n’est pas utilisé chez plus de cinq animaux. Préparez des gants stériles, un minimum d’une paire pour chaque animal.
- Tirez les micropipettes en verre pour les injections en utilisant les réglages suivants (voir le tableau des matériaux) pour les micropipettes longues et fines qui injectent lentement et régulièrement et ne se bouchent pas facilement : Heat 1 : 915, Heat 2 : 630, Pull : 630. Optimisez ces paramètres pour chaque extracteur.
- Effectuer des interventions chirurgicales dans un espace chirurgical désigné. Désinfecter les surfaces chirurgicales avec de l’éthanol à 70 %.
- Utilisez des champs stériles pour maintenir la stérilité du champ opératoire. Portez une blouse de laboratoire propre ou une blouse jetable et un masque.
- Préparez le système d’anesthésie par inhalation. Ouvrez l’alimentation en oxygène et régulez le débit à 0,8 L/min.
- Chirurgie
- Placez la souris dans une boîte d’anesthésie et ouvrez l’isoflurane à 2,5%. Réduire le débit d’isoflurane à 2 % après l’induction initiale ; maintenir le flux tout au long de la procédure. Pour d’autres méthodes d’anesthésie, reportez-vous au protocole animal et aux directives du comité d’éthique local.
- Injecter un analgésique préventif (carprofène 5 mg/kg s.c.) conformément à la recommandation du comité d’utilisation des animaux et aux réglementations locales.
- Rasez la tête de la souris à l’aide d’une tondeuse.
- Installez l’animal sur une table stéréotaxique, placez des barres d’oreille et assurez-vous que la tête est correctement fixée et stable. Fixez la bouche de la souris à l’embout buccal, en veillant à placer la langue sur le côté à l’extérieur de la bouche pour éviter la suffocation.
- Vérifiez que l’animal est profondément anesthésié avec un pincement des orteils avant de commencer la chirurgie et surveillez l’haleine et la couleur de la souris tout au long de la procédure.
- Placez le support d’élévation sous la souris pour maintenir le corps et la tête à niveau en position horizontale. Gardez l’animal au chaud avec un tampon chaud recouvert de papier. Appliquez une pommade pour les yeux sur les deux yeux pour éviter le dessèchement.
- Gardez la zone chirurgicale aussi propre que possible. Portez des gants stériles. Désinfectez la tête de la souris avec de l’iode et de l’alcool avant d’ouvrir la peau. À l’aide d’un scalpel, coupez la peau de la tête le long de la ligne médiane, approximativement de l’arrière des yeux jusqu’à l’arrière de la suture lambda. Gardez le crâne exposé et nettoyez-le avec un coton-tige incorporé dans du NaCl stérile à 0,9 %.
- Trouvez la veine rhinale rostrale (RRV) et marquez-la avec un crayon stérile. Utilisez le stéréoscope pour le reste de la procédure.
NOTE : Nous obtenons de meilleurs résultats en utilisant le RRV comme référence antéropostérieure, mais il est standard d’utiliser le bregma comme référence. - En utilisant une aiguille stérile comme référence, assurez-vous que l’orientation du cerveau est correcte avant de procéder à des mesures stéréotaxiques. Assurez-vous également que les hauteurs de la surface du crâne au RRV et au lambda, ainsi que l’inclinaison latérale, sont les mêmes (± 0,02 mm).
REMARQUE : L’inclinaison latérale devient plus pertinente pour l’injection dans des structures cérébrales plus latérales. - Chargez une pipette en verre stérile avec la solution virale à injecter. Apportez-le à la référence RRV pour la référence 0 antéropostérieure (AP). Avancez le long de la suture sagittale jusqu’à la coordonnée AP de votre choix. Marquez cette position avec un crayon stérile, soulevez l’aiguille et procédez à la craniotomie.
- Percez soigneusement un petit cercle autour de la position marquée pour éviter de casser le sinus sagittal supérieur. Positionnez la perceuse dans une position inclinée plutôt que perpendiculaire pour réduire la pression pendant le perçage. Retirez le morceau du crâne avec une petite pince.
- Une fois le système vasculaire exposé, utilisez le milieu du sinus sagittal supérieur pour l’utiliser comme référence médiolatérale (ML) (point 0) ; C’est plus précis que d’utiliser la suture sagittale. Passez à la position ML de votre choix. Abaissez la pipette pour toucher la dure-mère comme référence dorso-ventrale (DV) (point 0). Cassez légèrement la dure-mère et descendez la pipette jusqu’à la position DV de votre choix.
- Injecter la quantité désirée d’AAV (50-200 nL) et laisser la canule en place pendant 3 min pour permettre une dispersion adéquate du liquide. Retirez délicatement la pipette du cerveau.
- Relâchez la souris des barres d’oreille. Fermez la peau à l’aide de clips chirurgicaux ou de toute autre méthode de votre choix. Mettez l’animal dans une cage chauffée séparée pour la récupération. Surveillez la récupération, la réactivité et l’activité après l’éveil de la souris. Une fois complètement récupérée, remettez la souris dans sa cage d’origine.
- Attendez un minimum de 3 à 4 semaines pour l’expression virale avant de procéder à la deuxième partie de la procédure.
2. Canulation de la veine jugulaire et de l’artère carotide
- Préparation à la chirurgie
- Effectuer des interventions chirurgicales dans un espace chirurgical désigné. Désinfecter les surfaces chirurgicales avec de l’éthanol à 70 % avant de commencer les procédures. Préparez plusieurs paquets d’outils chirurgicaux pour vous assurer que chaque paquet n’est pas utilisé chez plus de cinq animaux.
- Autoclave tous les instruments chirurgicaux. Ensuite, nettoyez avec de l’eau stérile ou une solution saline et désinfectez les outils avec un stérilisateur à billes chaudes pendant au moins 15 s (selon les instructions du fabricant) entre les chirurgies.
- Utilisez des champs stériles pour maintenir la stérilité du champ opératoire. Portez une blouse de laboratoire propre ou une blouse jetable et un masque.
- Préparez des micro-cathéters pour les canulations dans l’artère carotide et la veine jugulaire. Construisez le cathéter artériel en joignant un petit segment de tube en microrénathane (étiré de 0,025 pouce de diamètre extérieur [OD] x 0,012 pouce de diamètre intérieur [ID]) avec un tube silastique (0,025 pouce OD x 0,012 pouces ID). Construisez le cathéter veineux uniquement à l’aide d’un tube silastique (0,025 pouce de diamètre extérieur x 0,012 pouce de diamètre intérieur). Faire tremper tous les cathéters dans de l’éthanol à 70 % pendant la nuit avant la chirurgie.
- Biseautez les extrémités coupées des deux cathéters à 45° à des longueurs préestimées en fonction du poids corporel et de la longueur de l’animal.
- Interventions chirurgicales
- Anesthésier les animaux sous 2 % d’isoflurane avec un système d’isoflurane à faible débit de table pour contrôler avec précision le stade et le plan de l’anesthésie pendant la chirurgie.
- Injecter la dose préventive d’analgésique (carprofène 5 mg/kg s.c.) et appliquer une pommade ophtalmique pour prévenir la dessiccation et les lésions cornéennes.
- Rasez les zones ventrales et arrière du cou et nettoyez la peau avec trois gommages à l’iode alternés avec de l’éthanol à 70%. Découpez une incision cutanée verticale (12 mm) entre les omoplates et couvrez-la de gaze chirurgicale pour une utilisation ultérieure. Placez l’animal en position couchée avec la tête vers le chirurgien.
- Utilisez un oscilloscope de dissection stéréoscopique pour la plupart des procédures décrites ci-dessous.
- Faites une petite incision verticale (~10 mm) sur le côté droit du cou, au-dessus de la clavicule pour exposer l’artère carotide droite et la veine jugulaire. Coupez la peau avec des ciseaux et effectuez une dissection contondante pour séparer les tissus sous-cutanés à l’aide de micro-pinces non dentées à pointes fines, exposant la veine jugulaire externe droite et l’artère carotide commune droite.
- Attachez l’extrémité distale de la veine jugulaire pour arrêter la circulation sanguine et faites un petit trou dans la veine affaissée à l’aide de micro-pinces et de ciseaux. Insérez le biseau du cathéter veineux vers le bas et proximalement à l’aide d’une paire de micro-pinces pour le faire avancer à travers la veine cave supérieure pour atteindre le niveau de l’oreillette droite. La longueur insérée est de ~10-12 mm pour une souris maigre de 30 g. Attachez le cathéter pour le fixer avec le vaisseau à l’aide de sutures en soie 7-0.
REMARQUE : Avec le cathéter au bon endroit, le sang peut être facilement prélevé ; sinon, le cathéter peut être mal placé dans la veine thoracique latérale et doit être réinséré. - Disséquez soigneusement les tissus conjonctifs pour exposer l’artère carotide commune droite située dans une zone triangulaire entourée par le muscle sternohyoïde, le muscle sterno-mastoïdien et le muscle digastrique. Utilisez un écarteur de fil pour séparer ces muscles si nécessaire. Attachez l’artère au niveau de la bifurcation des artères carotides internes et externes à l’aide de sutures en soie 7-0. Placez deux boucles de suture non nouées de manière proximale.
- Arrêtez temporairement le flux sanguin en tirant sur une boucle de suture préremplacée et coupez ou percez un petit trou sur la paroi du vaisseau à l’aide de micro-ciseaux ou d’une aiguille de 27 G. Insérez le biseau du cathéter artériel vers le bas et proximalement à une longueur préestimée atteignant l’arc de l’aorte mais sans toucher la valve aortique. La longueur insérée est de ~9-10 mm pour une souris maigre de 30 g. Attachez le cathéter pour le fixer au vaisseau à l’aide des deux sutures remplacées.
- Tunneliser tous les cathéters par voie sous-cutanée et les extérioriser à l’arrière du cou via l’incision prédécoupée et les joindre aux orifices veineux ou artériels d’un connecteur de tubulure recouvert de silicone fabriqué à partir d’une tubulure à aiguille de 25 G : MASA19 modifié à l’aide de deux tubulures à aiguille de 25 G et de deux tubulures de 4,0 cm en PE-20, gainées d’une tubulure silastique de 2,0 cm de 0,062 pouce de diamètre intérieur attachée à un petit anneau en fil métallique. Le volume lumineux total de chaque cathéter, y compris le connecteur, est de 6 à 8 μL (Figure 1A).
- Fermez l’incision ventrale et fixez le connecteur sous-cutané lors de la fermeture de la peau du dos avec des sutures. Remplissez les deux cathéters avec une solution saline héparinée (200 U/mL) et bouchez-les fermement à l’extrémité avec des fils chirurgicaux en acier inoxydable.
- Les souris se remettent de l’anesthésie à l’isoflurane en quelques minutes et se rétablissent complètement de la chirurgie en 5 jours. Placez les animaux dans la chambre d’hébergement automatisée de prélèvement sanguin 24 heures après la chirurgie et connectez-les au système en joignant le crochet d’attache du système à l’anneau métallique fixé au connecteur de tube implanté à l’arrière du cou. Connectez les cathéters artériels et veineux aux lignes d’injection et de prélèvement, respectivement, 24 heures avant le début du prélèvement (figure 1B). La longueur totale de la ligne d’échantillonnage est de 55 cm de longueur ou 40 μL par volume lumineux.
REMARQUE : Les configurations des lignes d’injection et de prélèvement, la programmation de la méthode de prélèvement et les mécanismes d’équilibre de la cage du système automatisé de prélèvement sanguin ont été décrits en détail20,21. Le système maintient le cathéter ouvert en délivrant automatiquement 10 μL de solution saline héparinisée toutes les 20 minutes. - Réglez le temps et la fréquence de prélèvement préinjection, d’injection et post-injection via le programme informatique du système. Voir l’étape 3.1 ci-dessous pour les paramètres actuels.
- Le système permet à l’animal de se déplacer librement sans emmêler les lignes d’échantillonnage et/ou de perfusion en détectant le mouvement de la souris tout en faisant pivoter la chambre du logement dans une direction opposée au mouvement de la souris21 (Figure 1).
- Remplissez la ligne de perfusion ou d’injection avec le composé et reconnectez-la au cathéter veineux au moins 2 heures avant le début de la perfusion ou de l’injection.
REMARQUE : Des complications chirurgicales peuvent survenir et les animaux doivent être surveillés de près pour la récupération et les jours suivant la chirurgie. Reportez-vous au protocole de l’animal pour connaître les exigences et les procédures de surveillance correctes.
3. Prélèvement sanguin automatisé et injection intraveineuse
- Prélèvement sanguin automatisé
- Pour suivre ce protocole, utilisez un volume d’échantillonnage de 20,0 μL et fixez un intervalle (c.-à-d. 7,0 min) entre chaque échantillonnage pour avoir une fréquence d’échantillonnage de 10,0 minutes par échantillon. La dose maximale est de prélever un échantillon continu à 3,0 min/échantillon ; le volume d’échantillonnage minimal possible est de 5,0 μL. Une quantité égale de solution saline est automatiquement restituée par le système pour remplacer le sang prélevé et maintenir l’équilibre des fluides corporels.
- Fixer la durée totale du prélèvement à 30 (t = -30 - 0) min avant et 30 (t = 0 - 30) min après l’injection intraveineuse de CNO (0,5 mg/kg, figure 2).
- Chaque échantillon de sang prélevé (20,0 μL) est automatiquement dilué dans 50 μL de solution saline (contenant de l’héparine à 10 U/mL) et stocké individuellement dans un microtube maintenu dans un carrousel d’échantillons réfrigéré par le système.
- Injection intraveineuse automatisée
- Débranchez la ligne veineuse du cathéter veineux pour remplir à nouveau l’ONC (dose par volume calculée individuellement de ~50-60 μL à 0,5 mg/kg) au moins 2 heures avant le début du prélèvement sanguin.
- Prélevez manuellement la solution (légèrement supérieure au volume calculé) de la ligne rétrogradée avec la seringue d’injection, en laissant une petite bulle d’air entre la solution et la solution saline existante dans la ligne.
- Rebrancher la ligne d’injection au cathéter veineux et régler le débit d’injection à 500 μL/min et le temps de début de l’injection à 2 min après t = 0 prélèvement. Le temps total d’injection pour chaque animal est de 5 à 6 s.
REMARQUE : Si nécessaire, le composé peut également être administré par injection intrapéritonéale manuelle (IP), mais cela nécessitera de déranger l’animal pendant ou avant le protocole de prélèvement sanguin. Nous montrons également cette alternative dans les résultats.
4. Perfusion animale et prélèvement de cerveau (FACULTATIF)
REMARQUE : Cette procédure ne doit être suivie que si le cerveau est nécessaire pour analyser le site cérébral de l’activation neuronale ou des réponses en aval.
- Déconnectez la souris du système de prélèvement sanguin à la fin du protocole de prélèvement. Deux heures après l’injection intraveineuse, perfuser l’animal avec du formol tamponné neutre à 10 % (FBN), en utilisant la méthode préférée ou comme décrit ailleurs22.
- Disséquez le cerveau et conservez-le dans du saccharose à 20 % dans du 10 % de FBN pendant 3 h pour continuer la fixation.
- Après 3 h, transférer le cerveau fixe à 20 % de saccharose dans du PBS et conserver à 4 °C jusqu’au moment de la section.
REMARQUE : Évitez la surfixation car cela masquera les antigènes cFOS. Dans la solution de saccharose à 20%, le cerveau doit couler au fond du récipient. - Faites des coupes à l’aide d’un microtome de congélation ou d’un cryostat et utilisez la méthode préférée pour examiner l’activation neuronale (par exemple, l’immunohistochimie du FOS est montrée).
REMARQUE : Les anticorps utilisés pour les résultats actuels sont décrits dans la table des matières.
5. Traitement et analyse des échantillons
- Retirez les échantillons de sang de l’échantillonneur automatique immédiatement après la fin de l’expérience et mettez-les sur de la glace.
- Faire tourner les échantillons à 14 000 × g pendant 30 s.
- Récupérez le plasma. Conservez-le à -80 °C jusqu’à l’analyse.
- Analyser les échantillons de sang par LH ELISA comme décrit ci-dessus10,23.
Résultats Représentatifs
Les neurones exprimant la kisspeptine (gène Kiss1) situés dans le noyau arqué de l’hypothalamus sont un puissant stimulateur de la GnRH, et donc de la libération de LH par l’hypophyse24,25. Dans cette démonstration de protocole, nous avons utilisé la sécrétion de LH induite par la kisspeptine pour illustrer le fonctionnement de la technique de prélèvement sanguin automatisé. La figure 2 montre des profils de LH représentatifs chez les femelles adultes de Kiss1-eYFP qui ont déjà reçu une injection stéréotaxique unilatérale d’AAV-hM3Dq-mCherry dans le noyau arqué (AP : -4,95, ML : -0,35, DV : -5,7). Le ChR2-eYFP a été utilisé comme rapporteur fluorescent pour les cellules Kiss1. Un mois après la chirurgie stéréotaxique, les souris ont subi une canulation de l’artère carotide et de la veine jugulaire et ont été connectées à l’échantillonneur de sang automatique 4 jours après la chirurgie. Les prélèvements sanguins pour déterminer les taux de LH basaux ont commencé le lendemain à une fréquence de prélèvement de 10 minutes (intervalle de 7 minutes entre les échantillons et 3 min/prélèvement), suivis d’une injection intraveineuse automatisée de CNO et d’un prélèvement sanguin continu toutes les 10 minutes pendant 30 minutes. Les taux de LH diœstraux sont généralement faibles (Figure 2A), mais des variations sont généralement observées en raison de sa libération pulsatile (Figure 2B). Après l’injection de CNO (et l’activation des neurones kisspeptine), l’augmentation de la LH a été forte (en 10 minutes). Le niveau d’augmentation et la durée du pic dépendent de nombreux facteurs, dont le site d’injection, le nombre de neurones activés ou la population ciblée.
La figure 3 montre le site d’injection cérébral dans le noyau arqué de la souris femelle représentée sur la figure 2A. Les neurones Kiss1-eYFP sont marqués en vert, tandis que l’immunoréactivité mCherry montre le site d’injection et d’activation de l’AAV après CNO. Les neurones activés ont été détectés à l’aide de l’immunoréactivité des FOSc, marqués avec du DAB. La plupart des neurones mCherry ont colocalisé avec Kiss1-eYFP, et beaucoup ont montré une immunoréactivité FOSc, démontrant que l’activation virale et neuronale était spécifique à la population ciblée.
Un schéma de libération pulsatile LH représentatif chez les souris de type sauvage diestrous (C57BL/6J) suivi de la réponse à une injection IP de kisspeptine-10 est illustré à la figure 4. La souris a subi une canulation de l’artère carotide et a été connectée au système de prélèvement sanguin automatique 4 jours après l’opération. Le lendemain matin, les cycles œstraux ont été vérifiés et le prélèvement sanguin et l’injection de kisspeptine-10 ont été effectués le26e jour diétérique. Des échantillons de sang ont été prélevés toutes les 7 minutes pendant 2 h (intervalle de 4 minutes, plus 3 minutes/prélèvement pendant 120 minutes avant l’injection) pour déterminer les niveaux de base et la pulsatilité de la LH, suivis d’une injection IP de kisspeptine-10 (65 μg/kg) et d’un prélèvement sanguin continu toutes les 7 minutes pendant 30 minutes supplémentaires. Des impulsions de LH claires typiques d’une femme en régime diestrucal ont été observées, montrant de faibles niveaux de LH basaux, une fréquence d’impulsion de ~2 impulsions/h et une amplitude d’impulsion de ~1 ng/mL27. Une augmentation immédiate et robuste de la LH a été détectée en réponse à l’administration de kisspeptine28. Les schémas de sécrétion de LH et les changements après stimulation sont en accord avec d’autres études utilisant un prélèvement sanguin manuel 10,27,29,30. Ces résultats démontrent que la méthode automatisée de prélèvement sanguin capture la sécrétion de LH typique et stimulée dans des conditions sans stress.
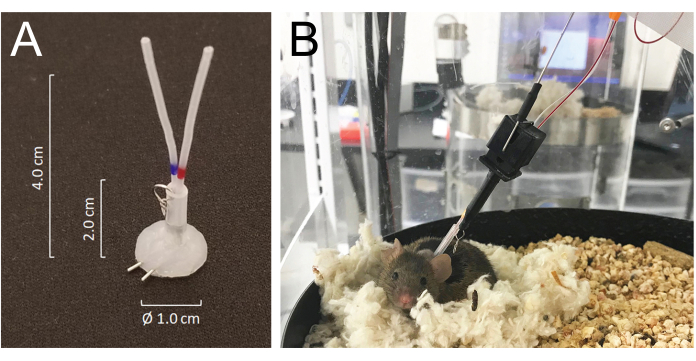
Figure 1 : Détails du système de connecteurs et des connexions de la souris à la tubulure du système de perfusion et d’échantillonnage. (A) Un connecteur de tubulure recouvert de silicone (MASA) construit à partir de deux tubulures à aiguille 25G et de deux tubulures PE-20, gainées dans un tube silastique fixé par un petit anneau métallique. (B) Une souris connectée à la perfusion et à la tubulure d’échantillonnage dans la cage d’échantillonnage, reposant dans son nid pendant le prélèvement sanguin. Veuillez cliquer ici pour voir une version agrandie de cette figure.
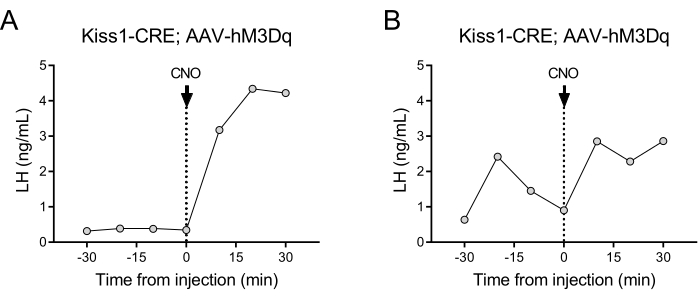
Figure 2 : Résultats représentatifs des impulsions LH chez des souris femelles Kiss1-Cre injectées d’AAV-hM3Dq dans le noyau arqué et activées à distance avec CNO. Les niveaux de LH basaux ont été mesurés toutes les 10 minutes pendant une demi-heure. Au temps 0 suivant le prélèvement sanguin, la femme a reçu une injection intraveineuse de N-oxyde de clozapine (0,5 mg/kg) et le sang a continué à être prélevé dans l’artère carotide toutes les 10 minutes pendant une demi-heure supplémentaire. (A) Montre une femelle avec de faibles niveaux de LH basale. (B) Montre une femelle présentant une pré-injection d’impulsion LH. Abréviations : Kiss1 = Kisspeptine ; AAV = virus adéno-associé ; CNO = N-oxyde de clozapine ; LH = hormone lutéinisante. Veuillez cliquer ici pour voir une version agrandie de cette figure.
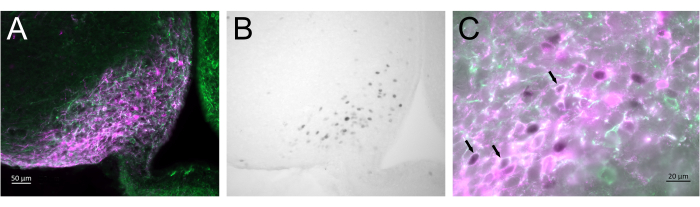
Figure 3 : Activation cérébrale dans le noyau arqué de la Kiss1-Cre ; Chr2-eYFP (Kiss1-eYFP) femelle représentée sur la figure 2A. ChR2-eYFP n’a été utilisé que comme gène rapporteur pour marquer les neurones kiss1. (A) Image de fluorescence à faible grossissement montrant le site d’injection de l’AAV dans le noyau arqué. Vert : immunoréactivité eYFP, Magenta : immunoréactivité mCherry. (B) Image en fond clair à faible grossissement de la zone correspondant à la figure 3A, montrant l’immunoréactivité du FOSc (noir) au site d’injection de l’AAV dans le noyau arqué. (C) Image de fluorescence à fort grossissement et de fond clair combinée montrant un examen plus approfondi des neurones dans la figure 3A,B. Les neurones Kiss1-eYFP coexprimant AAV-mCherry qui ont été activés sont ceux avec un cytoplasme blanc et un noyau noir (flèches). Barres d’échelle = 50 μm (A,B), 20 μm (C). Abréviations : Kiss1 = Kisspeptine ; AAV = virus adéno-associé ; eYFP = protéine fluorescente jaune améliorée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
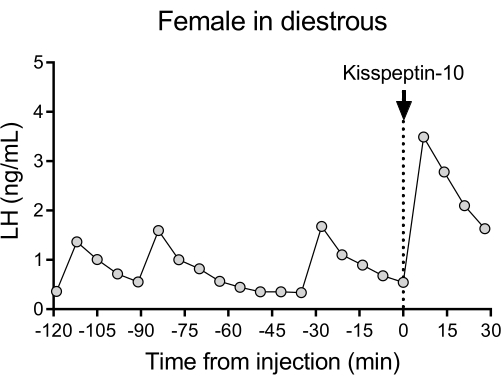
Figure 4 : Pulsatilité basale de LH chez une femelle de type sauvage diestrique mesurée toutes les 7 min pendant 2 h. La femelle a ensuite reçu une injection intrapéritonéale de kisspeptine-10 (65 μg/kg) au temps 0, et des échantillons de sang ont été prélevés en continu toutes les 7 minutes pendant une demi-heure. Abréviation : LH = hormone lutéinisante. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
En utilisant ce protocole, nous avons pu montrer la pulsatilité basale de la LH et la sécrétion de LH après stimulation d’une population neuronale. Les grands avantages du système sont l’environnement sans stress dans lequel le prélèvement a lieu, sans présence humaine ni manipulation pendant le prélèvement sanguin. De plus, aucun entraînement laborieux préalable des animaux et aucune adaptation à la présence ou à la manipulation humaine pendant l’expérience n’ont été nécessaires. Les expériences précédentes utilisant des prélèvements sanguins manuels nécessitaient beaucoup de temps et d’efforts pour minimiser les facteurs de stress 7,31,32. Cependant, couper la queue seule est un facteur de stress33. La mise en œuvre d’un environnement non stressant et d’un paradigme de formation dans les animaleries partagées, où les interruptions sont imprévisibles, peut également être une contrainte. Dans certains laboratoires, les animaux doivent souvent être transportés vers d’autres salles d’intervention pour des prélèvements sanguins. Ces limites peuvent rendre la méthode manuelle inappropriée pour la détection de changements subtils dans les niveaux de LH et, par conséquent, une approche non interventionniste peut être utile dans ces situations. L’échantillonnage automatisé est effectué dans une pièce calme où les souris sont placées plusieurs jours à l’avance pour s’acclimater au nouvel environnement. Notre expérience antérieure avec ce protocole a permis une détection précise des schémas de sécrétion de corticostérone et d’hormone de croissance pulsatile chez la souris, ne montrant aucun taux élevé de corticostérone lors de l’échantillonnage automatisé15. Dans les expériences actuelles, tous les animaux étaient bien adaptés au système d’échantillonnage, montrant la construction du nid dans la chambre d’échantillonnage après ~24 h et une couleur de poils vive, indiquant une absence de stress et un bon état de santé général (Figure 1).
La principale difficulté conduisant à des résultats négatifs est probablement le ciblage inapproprié de l’AAV sur la population neuronale requise. La précision des injections stéréotaxiques est essentielle et une formation doit être faite à l’avance pour vérifier les coordonnées et les volumes d’injection. L’entraînement peut être effectué en injectant une petite quantité de 0,5 à 1 % d’Evans Blue à l’endroit souhaité lors d’une chirurgie sans récupération, puis en prélevant une tranche du cerveau fraîchement disséqué à l’aide d’une matrice cérébrale de souris (par exemple, Ted Pella) pour vérifier le site et la taille de l’injection à l’aide d’un stéréoscope.
Il est également important de tenir compte du fait que le sang et le plasma prélevés à partir du système automatisé de prélèvement sanguin seront dilués dans une solution saline héparinée (p. ex., 20 μL de sang dans 50 μL de solution saline dans nos résultats)20, et que le taux de dilution peut devoir être ajusté en fonction de la sensibilité de la méthode d’analyse choisie. Nous avons testé les niveaux de LH dans le sang total dilué dans du BSA-PBS (comme recommandé pour la LH ELISA ultra-sensible)10 ou une solution saline et n’avons trouvé aucune différence dans les valeurs de LH. Tween ne peut pas être utilisé dans le diluant car il circulera dans le système sanguin pour extraire les échantillons en remplaçant les liquides de l’échantillon20. D’après notre expérience, des dilutions inférieures à 1 :10 ont donné de bons résultats en LH mais ont légèrement sous-estimé les niveaux de LH par rapport à 1 :3,5. Cela indique que la dilution peut être ajustée davantage pour réduire la quantité de sang recueillie, si nécessaire.
Une alternative à l’administration automatisée de composés consiste à faire des injections manuelles via le cathéter veineux. Dans ce cas, l’investigateur est brièvement présent dans la salle pour administrer l’injection. Cependant, il n’y a pas de contact direct avec les animaux ou leur logement et leur environnement et, contrairement aux injections intrapéritonéales ou sous-cutanées, l’ensemble de la procédure passe souvent inaperçu pour l’animal. Les avantages d’une injection manuelle sont que la dilution du composé n’a pas besoin d’être configurée à l’avance, ce qui peut être critique pour les composés trop coûteux à utiliser en plus grands volumes ou sensibles à la dégradation au fil du temps ; car le volume de fonctionnement est plus petit que dans l’administration automatisée, où la ligne de perfusion et le cathéter doivent être préremplis avec plus de solution composée.
Le prélèvement sanguin automatique offre une occasion unique d’étudier les variations de la LH pendant le sommeil, par exemple. Nous avons régulièrement observé des animaux dormant dans leurs nids pendant le temps d’échantillonnage. Il est possible de relier cet échantillonnage à des enregistrements EEG pour générer une analyse plus détaillée de la relation entre l’activité neuronale et le modèleLH 34. Comme le montre ici, les possibilités d’utilisation du prélèvement sanguin automatisé sont nombreuses : du prélèvement basal de LH au test de la réponse de la LH à des composés endogènes ou exogènes, ou à l’activation ou à la suppression de populations neuronales. Les manipulations neuronales peuvent être mises en œuvre de manière aiguë avec la chimiogénétique ou l’optogénétique, ou de manière permanente à l’aide de modèles de souris transgéniques et d’outils de silençage apoptotique ou neuronal. Le prélèvement sanguin automatisé permet également de mesurer d’autres hormones à forte sécrétion pulsatile (par exemple, l’hormonede croissance 15). Chez les souris femelles, si une phase spécifique du cycle œstral est nécessaire, des frottis vaginaux peuvent être soigneusement prélevés des heures avant le début du protocole26 sans perturber les lignes de perfusion et de prélèvement. Les animaux peuvent être connectés au système d’échantillonnage pendant 7 à 10 jours, le risque de coagulation de la ligne artérielle augmentant avec le temps.
Cette technique, cependant, est limitée à une utilisation chez les animaux à logement unique et, par conséquent, elle peut ne pas convenir à l’étude des interactions sociales. Il est également invasif et nécessite une intervention chirurgicale techniquement difficile, de sorte qu’il peut ne pas être possible de l’appliquer avec des animaux juvéniles ou certains modèles de maladies. Enfin, comme le coût d’achat du système peut être trop élevé pour un seul laboratoire de recherche, il serait conseillé de l’installer dans un laboratoire central fournissant le protocole expérimental mentionné en tant que services.
En conclusion, ce protocole montre comment effectuer une administration stéréotaxique d’AAV combinée à un prélèvement sanguin automatisé. Le contrôle spatial et temporel précis obtenu avec cette technique, ainsi que sa flexibilité d’application à différents modèles, protocoles de mesure et hormones, en font une méthode puissante pour l’étude de la régulation hormonale chez les rongeurs. Plus important encore, la méthode offre un environnement sans stress en éliminant la présence et la manipulation humaines pendant l’injection et/ou l’échantillonnage, et le dressage préalable des animaux. Ces avantages, ainsi que la possibilité de multiplexage, font de cette méthode un outil unique pour étudier le contrôle neuronal des changements hormonaux chez des souris conscientes, libres et non perturbées.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions le Dr Daniel Haisenleder pour son aide dans le test de différentes méthodes de dilution du sang. Les tests d’hormones sériques ont été effectués au Centre de recherche sur le test et l’analyse des ligands de reproduction de l’Université de Virginie, soutenu par la subvention Eunice Kennedy Shriver NICHD R24 HD102061. Le Michigan Mouse Metabolic Phenotyping Center-Live est soutenu par le NIH Center Grant U2C DK135066. JF et NQ sont soutenus par des subventions DK020572 (CRDM) et DK089503 (MNORC). La CFE et la CSM sont soutenues par la subvention R21 HD109485 et R01 HD096324 du NICHD.
matériels
| Name | Company | Catalog Number | Comments |
| AAV8-hSyn-hM3D(Gq)-mCherry | Addgene | 44361 | Not necessarily this virus but this was the one used for representative results |
| Alcohol | Disinfection | ||
| Anesthesia Induction box | Vetequip | ||
| Anesthesia induction machine | Kent Scientific Equipment | SomnoSuite | |
| Anesthesia masks for mice | Kent Scientific Equipment | SOMNO-0801 | |
| Autoclip applier 9 mm | Clay Adams | 427630 | |
| Autoclip remover 9 mm | Clay Adams | 427637 | |
| Autoclips 9 mm | Clay Adams | 427631 | |
| BASi Culex Controller | Culex | SN: 2151, 2152, 2156, 2158 | 4 stations |
| BASi Honey Comb Fraction Collector | Honey Comb | SN: 2105, 2106, 2107, 2108 | 4 stations |
| BASi Ratrun Rotation Control | RATURN 2 | SN: 5680, 5681, 5682, 5683 | 4 stations |
| C57BL/6J mice | JAX # 000664 | ||
| Carprofen | Zoetis | Rimadyl | Analgesic |
| Clippers | Braun | ||
| Clozapine-N-oxide | ENZO | BLM-NS105-0005 | |
| Cotton tipped applicators | |||
| CULEX Automated In Vivo Sampling System | BASi | DS000627 | with CX-4000S Replacement Tubing Sets |
| Curved forceps serrated | FST | 11151-10 | |
| Drill | Dremel | 61100 | |
| Empis control Module | EMPIS CM | SN: 174 | |
| Empis Programmable Infusion System | EMPIS | SN: 2125 , 2126, 2127, 2128 | With CX-7010S 4 BAS-2 Infusion Sets; 4 stations |
| Envigo 2016 diet | low-phytoestrogen diet | ||
| Eye ointment | Dechra | Puralube Vet Ointment | Petrolatum Ophtalmic oinment |
| Glass pipettes | World Precision Instruments | MIB100-6 | |
| Hemostats | Roboz Surgical | RS-7101 | |
| Iodine | Betadine Surgical scrub | ||
| Isoflurane | VetOne | Fluriso | Anesthetic |
| Isoflurane Vaporizer or SomnoSuite Low-Flow Anesthesia System | Surgivet or Kent Scientific Corp | SS-01 | Anesthesia Machine |
| Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) mice | JAX # 023436 and #024109 | ||
| Kisspeptin-10 | Phoenix Pharmaceuticals | 048-56 | |
| Micro-renathane tubing | Braintree Scientific | MRE025 | Surgical catheterization |
| Micro-Scissors | Roboz Surgical | RS-5606 | |
| Needle Holder | Roboz Surgical | RS-7842 | |
| Picoliter injector | Warner Instruments | PLI-100A | |
| Pipette puller | Sutter Instruments | P30 | |
| Rodent Warmer X2 | Stoelting | 53850 | |
| Scalpel | FST | 10003-12 | |
| Scissors | Roboz Surgical | RS-6808 | |
| Silicon tubing | Liveo Laboratory Tubing | NO.508-001 | 0.012 in I.D x 0.025 in O.D. |
| Stereotaxic table | RWD | E06208 | |
| Sterile 0.9% saline | Baxter | 2F7124 | |
| Sterile towel drapes | Dynarex | 4410 | |
| Surgical blades | SKLAR | 06-3011 | |
| Surgical stereoscope | Zeiss | f-160 | |
| Tweezers | Roboz Surgical | RS-4960 | |
| Tweezers | Roboz Surgical | RS-4972 | |
| Tweezers | Roboz Surgical | RS-5058 | |
| Antibodies | |||
| Anti-cFos | Millipore | ABE457 | Antigen target: N-terminus cFos; Host organism: Rabbit; Dilution used: 1:5,000; RRID: AB_2631318 |
| Anti-GFP | Aves Labs | GFP-1010 | Antigen target: recombinant GFP null; Host organism: Chicken; Dilution used: 1:10,000; RRID: AB_2307313 |
| Biotin-SP-conjugated AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Labs | 711-065-152 | Antigen target: Rabbit IgG (H+L); Host organism: Donkey; Dilution used: 1:1,000; RRID: AB_2340593 |
| Donkey anti-Rat IgG, AlexaFluor 594 | Thermo Fisher Scientific | A-21209 | Antigen target: Rat IgG (H+L); Host organism: Donkey; Dilution used: 1:500; RRID: AB_2535795 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A-11039 | Antigen target: Chicken, IgY (H+L); Host organism: Goat; Dilution used: 1:500; RRID: AB_2534096 |
| mCherry monoclonal (16D7) | Thermo Fisher Scientific | M11217 | Antigen target: mCherry tag; Host organism: Rat; Dilution used: 1:5,000; RRID: AB_2536611 |
Références
- Kokoris, G. J., Lam, N. Y., Ferin, M., Silverman, A. J., Gibson, M. J. Transplanted gonadotropin-releasing hormone neurons promote pulsatile luteinizing hormone secretion in congenitally hypogonadal (hpg) male mice. Neuroendocrinology. 48 (1), 45-52 (1988).
- Coquelin, A., Desjardins, C. Luteinizing hormone and testosterone in young and old male mice. American Journal of Physiology - Endocrinology and Metabolism. 243 (3), E257-E263 (1982).
- Carmel, P. W., Araki, S., Ferin, M. Pituitary stalk portal blood collection in rhesus monkeys: Evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Endocrinology. 99 (1), 243-248 (1976).
- Schuiling, G., Gnodde, H. Site of origin of the pulsatile secretion of luteinizing hormone in long-term ovariectomized rats. Journal of Endocrinology. 70 (1), 97-104 (1976).
- Hackwell, E. C. R., Ladyman, S. R., Brown, R. S. E., Grattan, D. R. Mechanisms of lactation-induced infertility in female mice. Endocrinology. 164 (5), 1-12 (2023).
- Bahougne, T., Kretz, M., Angelopoulou, E., Jeandidier, N., Simonneaux, V. Impact of circadian disruption on female mice reproductive function. Endocrinology. 161 (4), (2020).
- Kreisman, M. J., McCosh, R. B., Tian, K., Song, C. I., Breen, K. M. Estradiol Enables Chronic Corticosterone to Inhibit Pulsatile Luteinizing Hormone Secretion and Suppress Kiss1 Neuronal Activation in Female Mice. Neuroendocrinology. 110 (6), 501-516 (2020).
- Moenter, S. M., Evans, N. P. Gonadotropin-releasing hormone GnRH measurements in pituitary portal blood. Journal of Neuroendocrinology. 34 (5), 13065 (2022).
- Maeda, K. I., et al. The LHRH pulse generator: A mediobasal hypothalamic location. Neuroscience and Biobehavioral Reviews. 19 (3), 427-437 (1995).
- Steyn, F. J., et al. Development of a methodology for and assessment of pulsatile luteinizing hormone secretion in juvenile and adult male mice. Endocrinology. 154 (12), 4939-4945 (2013).
- Steyn, F. J., et al. Development of a method for the determination of pulsatile growth hormone secretion in mice. Endocrinology. 152 (8), 3165-3171 (2011).
- Minabe, S., Uenoyama, Y., Tsukamura, H., Maeda, K. Analysis of pulsatile and surge-like luteinizing hormone secretion with frequent blood sampling in female mice. Journal of Reproduction and Development. 57 (5), 660-664 (2011).
- Perreau-Lenz, S., Kalsbeek, A., Pévet, P., Buijs, R. M. Glutamatergic clock output stimulates melatonin synthesis at night. European Journal of Neuroscience. 19 (2), 318-324 (2004).
- Herwig, A., Pévet, P., Bothorel, B., Steinlechner, S., Saboureau, M. Trans-pineal microdialysis in the Djungarian hamster (Phodopus sungorus): A tool to study seasonal changes of circadian clock activities. Journal of Pineal Research. 40 (2), 177-183 (2006).
- Adams, J. M., Otero-Corchon, V., Hammond, G. L., Veldhuis, J. D., Qi, N., Low, M. J. Somatostatin is essential for the sexual dimorphism of GH secretion, corticosteroid-binding globulin production, and corticosterone levels in mice. Endocrinology. 156 (3), 1052-1065 (2015).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Krashes, M. J., et al. reversible activation of AgRP neurons drives feeding behavior in mice. Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- National Research Council. Guide for the Care and Use of Laboratory Animals. Eighth edition. National Research Council. , (2011).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Peters, S., et al. Culex ABS Part I: Introduction to automated blood sampling. Current Separations. 18 (4), 139-145 (2000).
- Bohs, C., Cregor, M., Gunaratna, G., Kissinger, C. Culex Automated blood sampler part II Managing freely-moving animals and monitoring their activity. Current Separations. 18 (4), 147-151 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kreisman, M. J., Mccosh, R. B., Breen, K. M. A Modified ultra-sensitive ELISA for measurement of LH in mice. Endocrinology. 163 (9), (2022).
- Pielecka-Fortuna, J., Chu, Z., Moenter, S. M. Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol. Endocrinology. 149 (4), 1979-1986 (2008).
- Kumar, D., et al. Specialized subpopulations of kisspeptin neurons communicate with GnRH neurons in female mice. Endocrinology. 156 (1), 32-38 (2015).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , 1-8 (2009).
- Czieselsky, K., et al. Pulse and surge profiles of luteinizing hormone secretion in the mouse. Endocrinology. 157 (12), 4794-4802 (2016).
- Wang, L., et al. Genetic dissection of the different roles of hypothalamic kisspeptin neurons in regulating female reproduction. eLife. 8, 43999 (2019).
- McCosh, R. B., Kreisman, M. J., Breen, K. M. Frequent tail-tip blood sampling in mice for the assessment of pulsatile luteinizing hormone secretion. Journal of Visualized Experiments. (137), e57894 (2018).
- Vanacker, C., Defazio, R. A., Sykes, C. M., Moenter, S. M. A role for glial fibrillary acidic protein (Gfap)-expressing cells in the regulation of gonadotropin-releasing hormone (GnRH) but not arcuate kisspeptin neuron output in male mice. eLife. 10, e68205 (2021).
- Dulka, E. A., Defazio, R. A., Moenter, S. M. Chemogenetic suppression of GnRH neurons during pubertal development can alter adult GnRH neuron firing rate and reproductive parameters in female mice. eNeuro. 7 (3), 0223 (2020).
- Talbi, R., et al. Characterization of the Action of Tachykinin Signaling on Pulsatile LH Secretion in Male Mice. Endocrinology. 162 (8), 1-9 (2021).
- Tuli, J., Smith, J., Morton, D. Corticosterone, adrenal and spleen weight in mice after tail bleeding, and its effect on nearby animals. Laboratory Animals. 29 (1), 90-95 (1995).
- Lucien, J. N., Ortega, M. T., Shaw, N. D. Sleep and puberty. Current Opinion in Endocrine and Metabolic Research. 17, 1-7 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon