Évaluation de l’effet des médicaments antidiarrhéiques et des extraits de plantes sur Drosophila melanogaster
Dans cet article
Résumé
Ici, une méthode est décrite pour nourrir Drosophila melanogaster avec des médicaments et des extraits de plantes et évaluer leur effet sur le tractus gastro-intestinal en analysant les dépôts fécaux des mouches des fruits. Les mouches traitées par des médicaments peuvent être utilisées comme modèle pour d’autres recherches.
Résumé
Pour étudier la physiologie gastro-intestinale humaine, les scientifiques biomédicaux se sont appuyés sur l’utilisation d’organismes modèles. Bien que de nombreux chercheurs aient utilisé des souris comme modèle pour étudier la fonction intestinale, seuls quelques rapports se sont concentrés sur Drosophila melanogaster (D. melanogaster). Par rapport aux souris, les mouches des fruits présentent de nombreux avantages, tels qu’un cycle de vie court, un entretien simple et rentable et aucun problème éthique. De plus, la physiologie, l’anatomie et les voies de signalisation gastro-intestinales des mammifères sont hautement conservées chez D. melanogaster. Les extraits de plantes sont traditionnellement utilisés pour traiter la diarrhée et la constipation. Par exemple, Psidium guajava (P. guajava) est l’un des agents antidiarrhéiques les plus connus sous les tropiques. Cependant, aucune étude n’a évalué l’effet des médicaments antidiarrhéiques et laxatifs et des extraits de plantes chez D. melanogaster, et on ne sait toujours pas si des effets similaires (par exemple, des dépôts fécaux plus petits, plus concentrés et moins abondants dans le cas des médicaments antidiarrhéiques) peuvent se produire chez les mouches des fruits par rapport aux mammifères. Dans cette étude, un effet antidiarrhéique induit par P. guajava est démontré dans une souche de D. melanogaster qui présente un phénotype diarrhéique. L’échantillonnage des matières fécales produites par les mouches est surveillé à l’aide d’un aliment enrichi en colorant. Ce protocole décrit la méthode utilisée pour préparer les aliments avec des médicaments, évaluer les dépôts fécaux des mouches nourries avec ces préparations alimentaires et interpréter les données obtenues.
Introduction
Le tractus gastro-intestinal (GI), également appelé tube digestif, est responsable de la digestion et de l’absorption des nutriments et de l’excrétion des produits non digérés1. Le tractus gastro-intestinal est vulnérable à une gamme de troubles qui peuvent causer de l’inconfort, de la douleur et des perturbations dans la vie quotidienne. Les troubles gastro-intestinaux comprennent les douleurs et l’inconfort abdominaux, les ballonnements, les brûlures d’estomac, l’indigestion ou la dyspepsie, les nausées, les vomissements, la diarrhée et la constipation2. La diarrhée est le symptôme le plus courant des troubles gastro-intestinaux3, et elle est définie comme une maladie avec au moins trois selles molles et liquides au cours d’une période de 24 heures4. La diarrhée est causée par un large éventail d’agents pathogènes, notamment des bactéries, des virus, des parasites, des champignons, et peut également être causée par des médicaments 5,6. À l’échelle mondiale, la diarrhée continue d’être la deuxième cause de mortalité chez les enfants de moins de 5 ans7. Bien que la diarrhée puisse se résoudre d’elle-même, elle peut également indiquer une affection sous-jacente plus grave si elle dure plus de quelques jours.
Pour étudier le tractus intestinal, les chercheurs se tournent vers des modèles animaux tels que des souris, des rats et des porcs 8,9. Cependant, l’utilisation de ces animaux peut être coûteuse et prendre du temps, car ils nécessitent des installations spécialisées et des considérations éthiques. Des études récentes ont montré que D. melanogaster peut être utilisé comme modèle pour étudier le tractus gastro-intestinal et étudier certains mécanismes tels que le maintien de l’homéostasie régénérative, le développement de la sénescence immunitaire, la perte de la fonction de barrière épithéliale et le déclin de l’homéostasie métabolique10,11. D. melanogaster, connue sous le nom de mouche des fruits, partage un degré élevé d’homologie génétique avec les humains ; On pense qu’environ 75 % des gènes de la maladie humaine ont un homologue fonctionnel chez la mouche12. Ils ont également un système digestif simple composé d’un intestin antérieur, d’un intestin moyen et d’un intestin postérieur13. D. melanogaster est facile à cultiver en laboratoire et peut être génétiquement modifié de différentes manières14. Par conséquent, l’utilisation de D. melanogaster pour des tests in vivo est un outil puissant qui permet aux chercheurs d’étudier des processus biologiques complexes dans un environnement contrôlé.
Selon l’Organisation mondiale de la santé (OMS), environ 80 % des personnes vivant dans les pays en développement utilisent la médecine traditionnelle pour leurs besoins de santé primaires15. La forte utilisation des plantes médicinales peut s’expliquer par le fait qu’elles sont facilement disponibles, peu coûteuses et ont peu d’effets secondaires16. Les principales parties de la plante utilisées en phytothérapie comprennent les feuilles, l’écorce, les racines, les graines17 tandis que les principales méthodes de préparation sont l’infusion, la décoction et la macération18. Ces remèdes à base de plantes contiennent des substances phytochimiques telles que des alcaloïdes, des terpénoïdes, des flavonoïdes, des stéroïdes, des tanins et des glucides19, qui ont des effets thérapeutiques sur le corps humain. Les gens utilisent une variété de plantes médicinales pour traiter les troubles gastro-intestinaux tels que la diarrhée, les maux d’estomac et la dysenterie20. Par exemple, Psidium guajava est l’une des plantes les plus couramment utilisées pour traiter la diarrhée dans le monde. Divers tests pharmacologiques et cliniques ont déjà montré son innocuité, ce qui en fait un bon candidat antidiarrhéique à étudier21,22. Cependant, les principales limites des médicaments à base de plantes sont le manque d’efficacité et d’évaluation de la sécurité, ainsi que le manque d’informations précises et complètes sur la composition des extraits de plantes utilisés23. Pour valider l’efficacité et l’innocuité des médicaments à base de plantes, une approche systématique impliquant une validation expérimentale et clinique est nécessaire et l’approche doit être étayée par suffisamment de données provenant d’études in vivo et in vitro.
Pour évaluer l’efficacité des remèdes traditionnels dans le traitement de la diarrhée, l’utilisation de souris et de rats a été prédominante au cours des dernières décennies24,25. En raison des principaux avantages mentionnés précédemment, c’est-à-dire la facilité d’utilisation, l’accessibilité, la réplicabilité, les fonctions absorbantes et digestives conservées entre les mouches et les mammifères, nous proposons d’utiliser D. melanogaster comme modèle pour évaluer l’activité antidiarrhéique des plantes. Le phénotype diarrhéique de D. melanogaster peut être caractérisé par plusieurs caractéristiques, notamment une abondance accrue de dépôts fécaux, des dépôts de plus grande taille, une coloration plus claire (moins concentrée) et une matière fécale plus élevée26. Ce phénotype peut être quantifié à l’aide de différents paramètres : nombre de dépôts fécaux, surface totale des dépôts, légèreté moyenne et densité optique intégrée totale (IOD). L’IOD total est défini comme la teneur totale en colorant du dépôt, c’est-à-dire la matière fécale totale excrétée27. Auparavant, un test a été développé pour analyser les dépôts fécaux de D. melanogaster27,28. Dans ce test, le lecteur ultime de bouse (T.U.R.D.) a été utilisé comme outil d’analyse fécale, ce qui permet de vérifier le nombre, la taille et la légèreté des dépôts fécaux et ainsi de surveiller la physiologie intestinale des mouches des fruits. Cependant, cette méthode n’a jamais été appliquée pour évaluer le phénotype diarrhéique chez les mouches. Le gène du peptide de transport ionique (PTI) est un important régulateur endocrinien de la soif et de l’excrétion et combine l’homéostasie de l’eau avec l’alimentation chez D. melanogaster. Dans une étude récente, il a été démontré que la vitesse de transit des aliments dans le tractus gastro-intestinal et la fréquence des événements de défécation étaient diminuées par la surexpression du PTI et augmentées par le knockdown du PTI. Ce dernier phénotype a été décrit comme diarrhéique par les auteurs de cette étude29.
Dans ce protocole, une version modifiée du test des dépôts fécaux est utilisée pour évaluer l’effet d’un agent antidiarrhéique (c.-à-d. l’extrait de feuille de goyave) sur le tractus gastro-intestinal de D. melanogaster en utilisant la souche ITPi comme modèle diarrhéique. L’objectif global de cette méthode est : 1) de fournir une méthode simple et fiable pour évaluer l’effet antidiarrhéique des médicaments et des extraits de plantes, et 2) de permettre la découverte de composés bioactifs responsables de l’effet antidiarrhéique dans les extraits de plantes en appliquant une approche guidée par la bioactivité.
Protocole
1. Préparation de l’extrait de plante
- Récoltez les feuilles de Psidium guajava L.30 sur un arbre adulte et traitez comme suit : séchez les feuilles dans un four à 40 °C pendant 6 jours, puis séchez-les à l’air libre pendant 6 jours, puis séchez-les à nouveau au four à 40 °C pendant 4 jours, et enfin préparez la poudre de feuilles en broyant les feuilles sèches dans un moulin à broyer ou un moulin à café.
- Macérer 100 g de poudre séchée dans 1 L d’éthanol à 96% pendant 24 h, en remuant continuellement à l’aide d’un shaker. Soumettre à nouveau le résidu de l’installation au même processus et évaporer les filtrats obtenus à sec à l’aide d’un évaporateur rotatif sous vide à pression réduite (175 mbar) à 40 °C.
- Dissoudre l’extrait végétal dans de l’éthanol pour obtenir la concentration souhaitée. Déterminez la concentration optimale (à l’aide du protocole décrit ici) en testant une série de concentrations.
- Pour les extraits de plantes, testez une plage de concentrations de 100 μg/mL, 1 mg/mL, 10 mg/mL, 100 mg/mL et utilisez ceux qui n’affectent pas le taux de survie de la mouche. Pour les composés purs, tester la gamme de concentrations suivante : 0,05, 0,5, 5 et 50 mM12.
2. Préparation du milieu alimentaire
- Mesurez 100 mL d’eau distillée et versez-la dans le bécher avec 4 g de sucre et 0,8 g d’agar-agar (voir tableau des matériaux). Chauffer à 100 °C (en remuant) et maintenir pendant 10 min.
- Baissez la température à 80 °C, ajoutez 7,4 g de farine et 2,8 g de levure tout en remuant. Chauffer pendant au moins 20 min en remuant toujours et en contrôlant la température qui doit être d’environ 80 °C.
- Ajouter la solution d’acide moldex-propionique (1 mL de moldex et 0,3 g d’acide propionique bien mélanger). Attendez que la température descende à environ 50 °C, ajoutez la solution d’extrait de plante (1 mg/mL) et 0,5 g de poudre de bleu de bromophénol.
REMARQUE : Veuillez vous référer à la section 1.3.1 pour plus de détails sur les autres concentrations à tester. - Versez les aliments dans les boîtes de Pétri et arrêtez-les lorsque la boîte de Pétri est pleine (Figure 1A). Laisser refroidir les boîtes de Pétri à température ambiante (environ 3 h), puis fermer le couvercle et conserver au réfrigérateur à 4 °C.
REMARQUE : Les boîtes de Pétri ne doivent pas être conservées au réfrigérateur plus de 2 semaines pour éviter l’évaporation de l’eau.
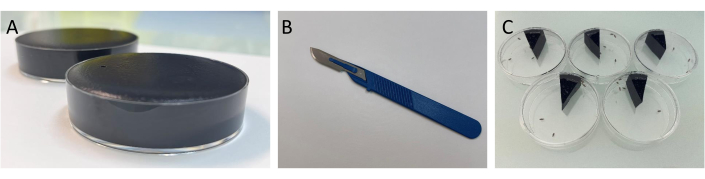
Figure 1 : Démonstration du procédé expérimental pour l’essai des dépôts fécaux. (A) Image montrant des boîtes de Pétri remplies de milieu alimentaire. Assurez-vous d’avoir suffisamment de nourriture dans la boîte de Pétri, afin qu’aucun espace ne piège les mouches et ne les empêche de se déplacer. Cependant, ne surchargez pas la boîte de Pétri avec de la nourriture afin que la surface puisse être recouverte uniformément. (B) Image de la spatule telle que décrite dans le protocole. (C) Image de l’analyse des dépôts fécaux telle que décrite dans le protocole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparation des mouches
- Préparez les réservoirs de CO2 , la soufflette de CO2 avec des aiguilles, un tampon à mouches, un pinceau et un microscope. La station de vol fournit du CO2 à la fois au tapis anti-mouches et à la soufflette. Le coussin anti-mouches est utilisé pour trier les mouches, tandis que la soufflette CO2 est utilisée pour anesthésier les mouches dans les flacons, les bouteilles et les boîtes de Pétri.
- Normalisez l’âge des mouches en sélectionnant des flacons contenant des pupes (au moins 10) et jetez les mouches adultes du tube en utilisant la méthode suivante. Un par un, retournez les flacons et insérez l’aiguille entre le bouchon en coton et la paroi latérale du flacon. Anesthésiez les mouches adultes avec la soufflette CO2 jusqu’à ce que toutes les mouches soient endormies sur le bouchon en coton (quelques secondes sont nécessaires pour les anesthésier, et l’action anesthésiante durera quelques secondes après avoir relâché la soufflette). Ouvrez le flacon au-dessus d’une bouteille en verre contenant 70 % d’éthanol et déposez-y les mouches. Fermez le flacon avec le bouchon en coton et conservez-le dans un incubateur à 25 °C avec 60% d’humidité. Réglez le cycle d’éclairage de l’incubateur sur 12 h lumière/12 h obscurité.
- Après l’incubation (maximum 8 h), triez-les en femelles et mâles vierges au microscope et au fly pad en les retournant sur le dos et en regardant leurs organes génitaux.
- Les organes génitaux féminins sont pâles par rapport aux organes génitaux masculins, qui sont de couleur rougeâtre. Les mâles peuvent également être identifiés par la présence de poils foncés, appelés peignes sexuels, sur leur paire de pattes avant. Répartissez les mouches dans deux tubes frais (un pour les mâles et un pour les femelles) et incubez-les pendant 6 à 8 jours à 25 °C.
REMARQUE : À 25 °C, les femelles restent vierges pendant environ 8 h après l’éclosion.
- Les organes génitaux féminins sont pâles par rapport aux organes génitaux masculins, qui sont de couleur rougeâtre. Les mâles peuvent également être identifiés par la présence de poils foncés, appelés peignes sexuels, sur leur paire de pattes avant. Répartissez les mouches dans deux tubes frais (un pour les mâles et un pour les femelles) et incubez-les pendant 6 à 8 jours à 25 °C.
4. Test de dépôt fécal
- Étiquetez les boîtes de Pétri avec la souche, le sexe et le médicament correspondants pour éviter toute confusion entre les boîtes de Pétri. Empilez les boîtes de Pétri les unes sur les autres.
- Prenez les boîtes de Pétri contenant les aliments teints et retournez-les sur le papier buvard pour absorber le liquide supplémentaire. À l’aide d’une spatule (figure 1B), coupez les aliments en 12 parties égales, puis utilisez la spatule pour mettre une tranche dans une boîte de Pétri vide.
REMARQUE : Selon le nombre de répétitions, le nombre de tranches à couper peut être augmenté jusqu’à 20 par boîte de Pétri. Chaque tranche doit être de la même taille. - Anesthésiez les mouches avec du CO2 jusqu’à ce que toutes les mouches soient endormies sur le bouchon en coton. Transférez six mouches saines dans chaque boîte de Pétri (Figure 1C) et fermez immédiatement le couvercle, puis placez-les dans l’incubateur (25 °C, 60 % d’humidité, 12 h de lumière / 12 h d’obscurité).
- Pour vous assurer que les mouches ne s’échappent pas de la boîte de Pétri pendant l’expérience, fixez les couvercles supérieur et inférieur de la boîte de Pétri avec du ruban adhésif. Pour chaque groupe d’essai, préparez six boîtes de Pétri répétées (au moins).
- Après avoir laissé les mouches se cabrer pendant 24 h, utilisez du CO2 pour les anesthésier, transférez les mouches dans un récipient rempli d’éthanol à 70 % et jetez toute nourriture restante.
- Conservez les boîtes de Pétri et passez à l’étape 5.
5. Quantification des boîtes de Pétri
- Définissez un dossier sur l’ordinateur et renommez-le, en incluant le nom de la souche expérimentale, le sexe des mouches et le type de médicaments utilisés. Dans ce dossier, créez des sous-dossiers nommés Original, Découpe et Analyse.
- Scannez les boîtes de Pétri à l’aide d’un scanner haute résolution avec une résolution optique de 6 400 pixels par pouce (ppp). Scannez les couvercles supérieur et inférieur de chaque boîte de Pétri séparément en les plaçant individuellement au milieu du champ du scanner.
- Ouvrez l’application installée sur l’ordinateur. Une fenêtre d’accueil s’ouvre sur l’écran de l’ordinateur avec tous les paramètres généraux (Figure 2A).
REMARQUE : Ne modifiez pas les paramètres avancés. Cette étape n’est valable que pour les utilisateurs qui disposent du même scanner que celui proposé dans la table des matériaux. Veuillez vous référer aux directives si vous utilisez un autre logiciel.- Nommez la boîte de Pétri dans l’application, en incluant le numéro de séquence, le couvercle supérieur ou inférieur, le sexe et le type d’aliment utilisé. Sélectionnez le sous-dossier d’origine défini à l’étape 5.1.
- Prévisualisez la boîte de Pétri. Cliquez sur Aperçu en bas de la fenêtre, attendez quelques secondes que le scanner pré-scanne, puis une fenêtre apparaît sur l’écran de l’ordinateur. Déplacez le carré affiché à l’écran pour entourer la boîte de Pétri.
- Cliquez sur Scanner en bas à droite de la fenêtre sur l’écran de l’ordinateur, le scan est automatiquement enregistré sous forme d’image dans le dossier de votre choix.
- Recadrez l’image à l’aide d’une application (par exemple, l’application Fidji open source), afin qu’aucun artefact ou résidu alimentaire ne soit considéré comme un dépôt.
REMARQUE : Les étapes suivantes ne sont valables que pour les utilisateurs disposant de l’application Fidji. Veuillez vous référer aux directives si vous utilisez un autre logiciel.- Ouvrez l’application Fidji, attendez quelques secondes jusqu’à ce qu’une barre d’outils apparaisse à l’écran.
- Faites glisser l’image à recadrer sur la barre d’outils. Sélectionnez la 3e icône Sélections de polygones dans la barre d’outils, recadrez la partie indésirable de la photo (le diagramme circulaire coloré) en cliquant sur l’écran pour marquer un angle autour du graphique circulaire (figures 2B-1,2).
REMARQUE : Lors de la délimitation de la zone de recadrage dans une image, il est impératif que les images choisies soient connectées de bout en bout de manière transparente. - Cliquez sur Modifier en haut à gauche de la barre, puis sur Remplir/Effacer à l’extérieur (Figure 2B-3).
- Pour enregistrer la photo, cliquez sur Fichier en haut à gauche de la barre, puis sur Enregistrer sous, et enfin sur Tiff. Choisissez le sous-dossier Cut set à l’étape 5.1.
REMARQUE : Lors de l’enregistrement de l’image recadrée, assurez-vous qu’aucun caractère spécial (par exemple, !, &, $, #, _,-,...) ou trop de caractères n’est présent dans le nom de fichier .
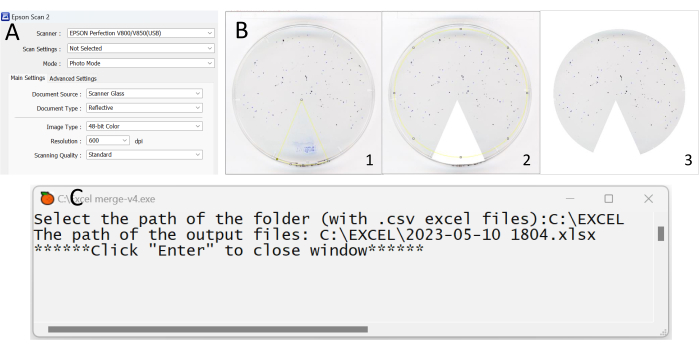
Figure 2 : Étapes clés du processus d’analyse des données de l’analyse des dépôts fécaux. (A) Capture d’écran montrant les informations de réglage de l’application de numérisation. (B) Images recadrées à l’aide de l’application Fidji. Assurez-vous qu’aucun artefact et résidu alimentaire n’est considéré comme un dépôt. (C) Capture d’écran montrant à quoi cela ressemble lors de l’ouverture de l’application Excel_merge-v4. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Identification des dépôts fécaux à l’aide du lecteur ultime de logiciels open source de fumier
NOTE : L’introduction et l’utilisation du logiciel de lecture ultime des excréments se trouvent dans le fichier supplémentaire 1.
- Tout d’abord, ouvrez le logiciel T.U.R.D. (Figure supplémentaire 1). Créez une expérience et donnez un nom au document, puis enregistrez-le dans le sous-dossier Analyse défini à l’étape 5.1.
- Cliquez sur Assiettes , puis sur Ajouter une plaque. Sélectionnez la boîte de Pétri à traiter. Une nouvelle fenêtre apparaît avec les noms des plaques sélectionnées et de nouveaux paramètres. Définissez la taille de bloc, le décalage, la taille minimale et la taille maximale (Figure supplémentaire 2).
- Pour vérifier que les dépôts fécaux détectés sont les bons, cliquez sur Plaques, puis sur Inspecter les plaques sélectionnées, puis sur Graphiques et sur Afficher les images annotées (Figure supplémentaire 3). Effectuez un zoom avant et regardez les chiffres. S’il n’y a que quelques dépôts qui ne devraient pas être inclus dans l’analyse, désélectionnez les dépôts à exclure (figure supplémentaire 4).
- Pour chaque nouvelle image à traiter, recommencez à partir de l’étape 6.3.
- Après avoir analysé les plaques avec le logiciel T.U.R.D., modifiez le nombre de mouches en cliquant sur Non. Mouches (figure 5 supplémentaire).
- Modifiez le nom du groupe en cliquant sur Plaques > Modifier les groupes > Ajouter, puis sur Colonne Groupe , choisissez le nom du groupe.
- Exportez les différentes données répliquées séparément en cliquant sur Analyser > statistiques descriptives > Sélectionner un groupe (Figure supplémentaire 6). Conservez tous les fichiers de feuille de calcul (.csv) dans le même dossier.
- Afin de rassembler tous les fichiers (obtenus à l’étape 6.7) dans une feuille de calcul unique, ouvrez l’application Excel_merge-v4 (Fichier de codage supplémentaire 1), attendez que la phrase suivante apparaisse Sélectionnez le chemin du dossier (avec .csv fichiers) :, puis collez l’adresse du dossier ci-dessus. Par exemple, le chemin d’accès peut être C :\Experiment\Fecal deposit test\, puis cliquez deux fois sur Entrée sur le clavier (Figure 2C). Après cela, un nouveau fichier de feuille de calcul est créé dans le même dossier. Le nouveau fichier de feuille de calcul comprend tous les fichiers exportés dans différentes feuilles.
- Dans le tableur précédent, ajoutez une autre feuille pour recueillir la moyenne de chaque paramètre de toutes les répliques (utilisez la fonction RECHERCHEV pour traiter les données). Un exemple est donné dans le tableau supplémentaire 1.
- Analysez la valeur de p.
Résultats Représentatifs
L’étude présentée ici montre que la mesure de la diarrhée chez D. melanogaster peut être réalisée grâce à l’utilisation du test des dépôts fécaux. Des différences significatives entre les phénotypes (diarrhéiques ou non) peuvent être déterminées en analysant divers paramètres, notamment le nombre de dépôts fécaux, la superficie totale des dépôts, la surface moyenne des dépôts, la légèreté moyenne et la densité optique intégrée totale (IOD), qui est une mesure de la quantité totale de colorant présente dans le dépôt et représente la teneur totale en matières fécales excrétées27.
L’inactivation du gène ITP chez les mouches peut induire un phénotype diarrhéique, caractérisé par une fréquence accrue de défécation, ce qui en fait un modèle approprié pour l’étude de la diarrhée29. Dans le cadre de cette expérience, la souche ITPi (w1118 ; daughterless-GeneSwitch, UAS-ITPi /(CyO)) a été utilisée et élevée sur un milieu standard. L’extrait de feuilles de Psidium guajava a été choisi comme intervention antidiarrhéique, étant donné l’utilisation répandue de cette plante dans les régions tropicales pour gérer la diarrhée. Crofelemer, un agent antidiarrhéique, a été approuvé par la Food and Drug Administration (FDA) des États-Unis pour soulager les symptômes de la diarrhée non infectieuse chez les patients adultes atteints du VIH/sida subissant un traitement antirétroviral31. Crofelemer est un extrait du latex de Croton lechleri Müll.Arg. écorce de tige32. Le lopéramide est un médicament synthétique utilisé dans le monde entier pour traiter la diarrhée33. Le Crofelemer et le Lopéramide ont tous deux été utilisés comme témoins positifs potentiels.
L’hypothèse était que nourrir les mouches avec de l’extrait de P. guajava , du Crofelemer et du Lopéramide réduirait le phénotype diarrhéique par rapport à celles nourries avec de la nourriture normale. Pour examiner cette hypothèse, une mesure des dépôts fécaux a été effectuée chez D. melanogaster en comparant plusieurs paramètres entre les mouches nourries avec des aliments normaux et celles nourries avec de l’extrait de P. guajava (1 g/100 mL), Crofelemer (1 g/100 mL) et Lopéramide (10 mM). Pour la configuration de l’expérience, des femelles ou des mâles vierges âgés de 6 à 7 jours ont été utilisés. Chaque boîte de Pétri contenait six mouches, et six répétitions ont été effectuées. Les mouches ont été élevées pendant 24 h, puis chaque groupe a été analysé. Le test t de l’étudiant a été utilisé pour comparer la différence significative entre le groupe test. Les résultats démontrent que le nombre de dépôts fécaux (figure 3A), la surface totale des dépôts (figure 3B) et l’IOD total (figure 3C) présentaient des valeurs significativement plus élevées dans le groupe alimentaire normal par rapport au groupe extrait de P. guajava (1 g/100 mL), tant chez les femelles vierges que chez les mâles. Malheureusement, le lopéramide n’a montré aucun effet chez les deux sexes (mais il a déjà été démontré qu’il agit comme un agent antispasmodique chez D. melanogaster)34 alors que le crofelemer n’a eu d’effet que sur les femelles.
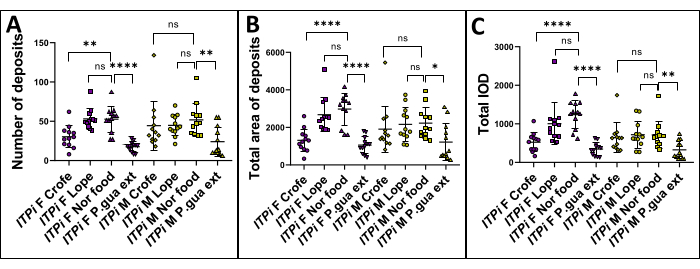
Figure 3 : Analyse de la déformation ITPi. La souche ITPi a été analysée dans quatre conditions : alimentation avec des aliments normaux, aliments supplémentés avec 1 g/100 mL d’extrait de P. guajava, 1 g/100 mL de Crofelemer et 10 mM de Lopéramide. Les données sont présentées sous forme de moyenne ± écart-type de chaque affection chez les femmes et les hommes (pour six répétitions des deux côtés d’une boîte de Pétri). L’analyse statistique a été effectuée à l’aide d’un test t d’un étudiant comparant deux groupes. Les valeurs de p sont indiquées comme suit : * : p < 0,05 ; ** : p < 0,01 ; : p < 0,001, **** : p < 0,0001. (A) Le nombre de dépôts fécaux de la souche ITPi a été comparé chez des mouches nourries avec de la nourriture complétée par 1 g/100 mL de Crofelemer, 10 mM de Lopéramide, 1 g/100 mL d’extrait de P. guajava et chez des mouches nourries avec des aliments normaux. De plus, la différence dans le nombre de dépôts fécaux entre les femelles vierges et les mâles a également été analysée. Dans les deux groupes, le nombre de dépôts fécaux était significativement plus élevé chez les mouches nourries avec de la nourriture normale que chez celles nourries avec 1 g/100 mL d’extrait de P. guajava. (B) La surface totale des dépôts fécaux de la souche ITPi a été comparée chez des mouches nourries avec des aliments normaux et chez des mouches nourries avec de la nourriture supplémentée avec 1 g/100 mL d’extrait de P. guajava, 1 g/100 mL de Crofelemer et 10 mM de Lopéramide. Chez les mâles et les femelles, la surface totale des dépôts fécaux était significativement plus élevée chez les mouches nourries avec de la nourriture normale que chez celles nourries avec 1 g/100 mL d’extrait de P. guajava. (C) La différence dans l’IOD total de la souche ITPi a été analysée entre les mouches nourries avec des aliments normaux et les mouches nourries avec des aliments supplémentés avec 1 g/100 mL d’extrait de P. guajava, 1 g/100 mL de Crofelemer et 10 mM de lopéramide. Chez les mâles et les femelles, l’IOD total était significativement plus élevé chez les mouches nourries avec de la nourriture normale que chez celles nourries avec 1 g/100 mL d’extrait de P. guajava. Abréviations : F = Femelle ; M = Mâle ; Crofe = Crofelemer ; Lope = lopéramide ; Ni nourriture = Nourriture normale ; P. gua ext = Extrait de Psidium guajava. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour démontrer que la réduction de l’excrétion observée dans le groupe extrait de P. guajava est due à l’effet inhibiteur de l’extrait et non à une réduction de la consommation alimentaire, nous avons effectué la méthode35 d’estimation et de suivi de l’apport direct de la consommation d’aliments solides (DIETS). Les résultats ont montré qu’il n’y avait pas de différences significatives dans la consommation alimentaire entre les groupes ayant reçu des médicaments et ceux n’ayant pas consommé de médicaments, à l’exception du lopéramide chez les mâles, qui a amené les mouches à consommer moins de nourriture que la normale (figure 4).
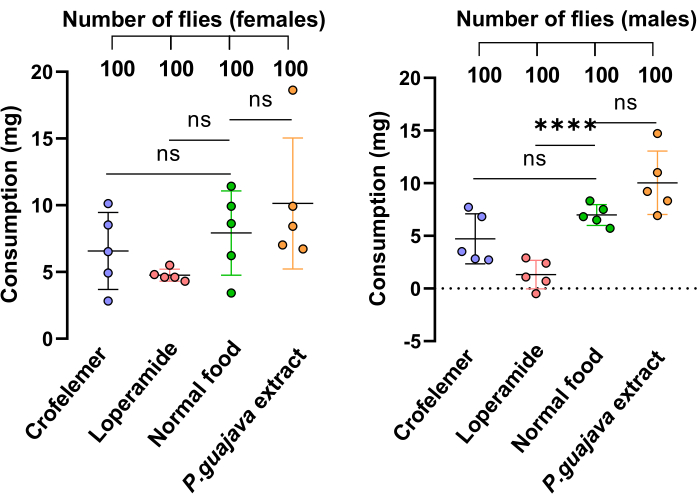
Figure 4 : Dosage de l’alimentation. Le test d’alimentation a mesuré la consommation d’aliments solides chez les mouches. Les mouches ont été nourries avec quatre milieux différents : 1 g/100 mL d’extrait de P. guajava, 1 g/100 mL de Crofelemer, 10 mM de Lopéramide et de la nourriture normale. Chaque groupe était composé de 20 mouches avec cinq répétitions. Les données sont présentées sous forme de moyenne ± écart-type de chaque affection chez les femmes et les hommes. L’analyse statistique a été effectuée à l’aide d’un test t d’un étudiant comparant deux groupes. Les valeurs de p sont indiquées comme suit : * : p < 0,05 ; ** : p < 0,01 ; : p < 0,001, **** : p < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les dépôts fécaux et les résultats des tests d’alimentation ont montré que l’extrait de P. guajava est une plante médicinale fiable pour traiter la diarrhée chez les mouches des fruits.
Figure supplémentaire 1 : Fenêtre d’ouverture de la T.U.R.D. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Fenêtre T.UR.D. avec réglages à régler. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Fenêtre T.U.R.D. avec une image annotée. Veuillez cliquer ici pour télécharger ce fichier.
Figure 4 supplémentaire : Fenêtre T.U.R.D. présentant chaque point détecté à partir d’une image déjà traitée. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 5 : Fenêtre T.U.R.D. présentant chaque image traitée. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 6 : Fenêtre T.U.R.D. montrant le processus d’exportation des données pour chaque groupe. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 1 : Guide rapide pour l’utilisation du logiciel T.U.R.D. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Exemple de feuilles de calcul finales prêtes à être analysées. Veuillez cliquer ici pour télécharger ce fichier.
Fichier de codage supplémentaire 1 : Demande de fusion de feuilles de calcul. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
D. melanogaster a été largement accepté comme modèle pour divers processus biologiques en raison de la similitude des gènes entre D. melanogaster et les humains36. L’utilisation de D. melanogaster comme modèle pour l’étude du tractus intestinal est répandue et l’application de T.U.R.D. a été utilisée pour estimer le nombre, la superficie et la quantité de dépôts fécaux. Cependant, la méthode de détection phénotypique n’a pas été utilisée pour évaluer la diarrhée chez les mouches des fruits. Par conséquent, ce protocole introduit une nouvelle méthode pour évaluer grossièrement la présence de diarrhée en détectant les dépôts fécaux.
Les dépôts fécaux sont un indicateur essentiel de la fonction et de la santé du tractus intestinal37. Dans ce contexte, une méthode d’élevage de D. melanogaster sur milieu contenant du médicament est proposée afin d’étudier divers paramètres des dépôts fécaux. En surveillant le nombre de dépôts, il est possible de déterminer la fréquence de la défécation et d’évaluer si un médicament a un impact sur le transit intestinal. La surface totale des dépôts peut être mesurée pour évaluer la concentration et la dilution des matières fécales, ce qui est un facteur important pour déterminer la santé globale du tractus intestinal. De plus, la densité optique totale intégrée (IOD) peut être utilisée pour détecter la quantité totale de matières fécales présentes dans les dépôts. Ce protocole fournit une méthode efficace pour dépister et évaluer les médicaments ainsi que les extraits de plantes qui affectent le tractus intestinal. Lorsque D. melanogaster est utilisé comme organisme modèle, il est possible d’évaluer l’efficacité de médicaments potentiels, ce qui peut aider à accélérer le processus de découverte de médicaments. En appliquant cette méthode sur des extraits de plantes, les chercheurs peuvent aider à valider leur utilisation comme agents antidiarrhéiques.
Il y a plusieurs étapes critiques à prendre en compte lors de l’utilisation de ce protocole pour étudier les dépôts fécaux chez D. melanogaster. Tout d’abord, il est essentiel de calculer la masse nécessaire pour atteindre la concentration souhaitée du médicament dans le milieu. De plus, il est important d’assurer de bonnes conditions de préparation lors de l’ajout du médicament au milieu, car des températures élevées peuvent dégrader le médicament et affecter sa puissance. Deuxièmement, la sélection des mouches femelles est importante dans ce protocole. Il est important d’utiliser des mouches femelles vierges pour éviter les différences de production fécale entre les femelles vierges et accouplées. Par exemple, les taches produites par les femelles vierges sont plus circulaires que les femelles accouplées, et les femelles accouplées ont tendance à excréter plus de matières fécales que les femelles vierges27,28. Par conséquent, il est recommandé de ramasser les mouches avant 8 h d’éclosion pour s’assurer que toutes les femelles récoltées sont vierges. De plus, les mouches testées doivent être fortes et en bonne santé, car leur santé peut influencer la prise alimentaire et la production fécale. Par exemple, les mouches ayant une forme anormale d’ailes peuvent avoir de la difficulté à obtenir la nourriture. Enfin, pour utiliser T.U.R.D. avec succès, la taille des blocs (pixels) et les paramètres de décalage sont cruciaux. En raison de la différence de contraste de la lumière des images, il peut être nécessaire d’essayer différents réglages pour obtenir la meilleure identification possible des dépôts fécaux.
Bien que la méthode présentée soit efficace, il existe plusieurs limites. L’un d’eux est la précision de la concentration de médicament dans le milieu. Comme le milieu est chauffé pendant la préparation, une partie de l’eau peut s’évaporer, ce qui peut affecter la concentration du médicament. Une autre limitation est le balayage des boîtes de Pétri. Certaines parties des boîtes de Pétri (c’est-à-dire les bords) ne sont pas scannées, ce qui pourrait entraîner une erreur de calcul du total des dépôts fécaux. De plus, les mouches ne produisent pas la même quantité de dépôts fécaux sur les couvercles supérieur et inférieur des boîtes de Pétri. Étant donné qu’ils ont tendance à produire plus de dépôts sur le couvercle inférieur, l’écart-type de l’analyse entre le couvercle supérieur et le couvercle inférieur peut être élevé, ce qui peut affecter la précision des résultats.
À l’aide de ce protocole, les chercheurs peuvent étudier la diarrhée chez D. melanogaster. En modifiant le milieu contenant le médicament, cette méthode peut être utilisée pour cribler les plantes antidiarrhéiques, ce qui offre une nouvelle approche de la découverte de médicaments. La médecine traditionnelle et les produits naturels sont utilisés depuis des siècles pour traiter différentes maladies, y compris les troubles gastro-intestinaux. En utilisant ce protocole pour évaluer l’efficacité des extraits de plantes sur les dépôts fécaux, de nouveaux traitements potentiels pour les troubles du tractus intestinal peuvent être identifiés et une justification scientifique pour leur utilisation comme agents antidiarrhéiques peut être fournie. Cette approche peut apporter une contribution précieuse au domaine de la découverte de médicaments et de l’ethnopharmacologie.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions le Dr Martina Gáliková de nous avoir fourni les souches de drosophile . Nous sommes reconnaissants à l’équipe de Michelle Crozatier-Borde et Marc Haenlin d’avoir fait part de leurs commentaires sur notre étude et de nous avoir aidés à améliorer notre modèle. Nous tenons à remercier Napo Pharmaceuticals Company de nous avoir fourni le médicament Crofelemer. Les auteurs remercient également l’éditeur invité, le Dr Hugues Petitjean, de nous avoir donné l’occasion de publier ce protocole. Cette étude a été financée par l’Agence Nationale de la Recherche (ANR) dans le cadre du projet ANR-22-CE03-0001-01.
matériels
| Name | Company | Catalog Number | Comments |
| Chemical & Food medium | |||
| Agar | Sigma Aldrich | A7002 | 5 Kg bucket |
| Bromophenol blue | Sigma Aldrich | 34725-61-6 | B5525-25G |
| Corn flour | Nature et Cie | *910007 | 25 Kg bag |
| Crofelemer | Napo pharmaceuticals | - | - |
| Ethanol 96% | - | - | - |
| Loperamide | Sigma Aldrich | L4762 | 5 grams |
| Moldex | VWR | 1.06757.5000 | 5 Kg bag |
| Propionic acid | Dutscher | 409553-CER | 1 Liter bottle |
| Sugar | Pomona EpiSaveurs | 52705 | 1 Kg bag |
| Yeast | Dutscher | 789195 | 10 Kg bag |
| Materials | |||
| Beaker | DWK LIFE SCIENCE | - | 250 mL |
| Centrifugation tube | Eppendorf | 30119401 | Eppendorf tubes 5.0 mL |
| CO2 tank | - | - | - |
| Erlen Meyer flask | - | - | 500 mL (for extraction) |
| Filter paper grade | Whatman | - | 3 mm chr. |
| Flowbuddy socle | Genesis | - | - |
| Flugs Narrow Plastic vials | Genesis | 49-102 | - |
| Flystuff Blow gun | Genesis | - | - |
| Flystuff Ultimate Flypad | Genesis | - | - |
| Flystuff Foot pedal | Genesis | - | - |
| Forceps | Dumostar | 11295-51 | - |
| Graduated cylinder | - | - | 100 mL |
| Inox spatula | - | - | - |
| Micropipette | Eppendorf | 4924000088 | Eppendorf Reference 2 |
| Micropipette tip | Eppendorf | 30000919 | epT.I.P.S. Standard |
| Narrow Drosophila vials | Genesis | 32-120 | - |
| Paintbrush | - | - | - |
| Petri dish | Greiner | 628162 | Size: 60 x 15mm |
| Round-bottom flask | - | - | 500 mL (for evaporation) |
| Thermometer | Avantor | 620-0916 | |
| Whisk | - | - | - |
| Equipments | |||
| Chiller | HUBER | Minichiller | - |
| Heating bath | BÜCHI | B-490 | - |
| Heating plate | BIOBLOCK SCIENTIFIC | - | Magnetic stirrer hot plate |
| Incubator | Memmert | - | HPP110eco |
| Rotary evaporator | BÜCHI | R-200 | - |
| Scanner | Epson | V850 pro | - |
| Shaker | Edmund Bühle | KS 10 | - |
| Stereomicroscope binocular | Zeiss | Stemi 305 | - |
| Vacuum pump | VACUUBRAND | PC500 series | - |
| Vortex mixer | Sigma Aldrich | CLS6776-1EA | Corning LSE vortex mixers |
| Weighing scale | OHAUS Scout | SKX622 | - |
Références
- Cheng, L. K., et al. Gastrointestinal system. WIREs Sys Bio Med. 2 (1), 65-79 (2010).
- Greenwood-Van Meerveld, B., Johnson, A. C., Grundy, D. Gastrointestinal physiology and function. Handb Exp Pharmacol. 239, 1-16 (2017).
- Doyle, L. A., et al. A clinicopathologic study of 24 cases of systemic mastocytosis involving the gastrointestinal tract and assessment of mucosal mast cell density in irritable bowel syndrome and asymptomatic patients. Am J Surg Pathol. 38 (6), 832-843 (2014).
- Levine, G. A., Walson, J. L., Atlas, H. E., Lamberti, L. M., Pavlinac, P. B. Defining pediatric diarrhea in low-resource settings. J Pediatric Infect Dis Soc. 6 (3), 289-293 (2017).
- Abraham, B., Sellin, J. H. Drug-induced diarrhea. Curr Gastroenterol Rep. 9 (5), 365-372 (2007).
- Badry, A. H. H., Jameel, A. Y., Mero, W. M. S. Pathogenic microorganisms associated with arrhea in infants and children in Duhok Province, Kurdistan Region / Iraq. Sci J Uni Zakho. 2 (2), 266-275 (2014).
- Manetu, W. M., M'masi, S., Recha, C. W. Diarrhea disease among children under 5 years of age: A global systematic review. Open J Epidemiol. 11 (3), 207-221 (2021).
- Fu, J., et al. Aquatic animals promote antibiotic resistance gene dissemination in water via conjugation: Role of different regions within the zebra fish intestinal tract, and impact on fish intestinal microbiota. Mol Ecol. 26 (19), 5318-5333 (2017).
- Zhang, Q., Widmer, G., Tzipori, S. A pig model of the human gastrointestinal tract. Gut Microbes. 4 (3), 193-200 (2013).
- Cox, C. R., Gilmore, M. S. Native microbial colonization of Drosophila melanogaster and its use as a model of Enterococcus faecalis pathogenesis. Infect Immun. 75 (4), 1565-1576 (2007).
- Jasper, H. Exploring the physiology and pathology of aging in the intestine of Drosophila melanogaster. Invertebr Reprod Dev. 59, 51-58 (2015).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol Rev. 63 (2), 411-436 (2011).
- Miguel-Aliaga, I., Jasper, H., Lemaitre, B. Anatomy and physiology of the digestive tract of Drosophila melanogaster. Genetics. 210 (2), 357-396 (2018).
- Jennings, B. H. Drosophila- a versatile model in biology & medicine. Materials Today. 14 (5), 190-195 (2011).
- Kumar, V. S., Navaratnam, V. Neem (Azadirachta indica): Prehistory to contemporary medicinal uses to humankind. Asian Pac J Trop Biomed. 3 (7), 505-514 (2013).
- Shrestha, P., Adhikari, S., Lamichhane, B., Shrestha, B. G. Phytochemical screening of the medicinal plants of Nepal. J Environ Sci Tech Food Tech. 1 (6), 11-17 (2015).
- Perveen, S., Al-Taweel, A. Pharmacognosy: Medicinal Plants. IntechOpen. , (2019).
- Noumi, E., Yomi, A. Medicinal plants used for intestinal diseases in Mbalmayo Region, Central Province, Cameroon. Fitoterapia. 72 (3), 246-254 (2001).
- Njoku, V. O., Obi, C., Onyema, O. M. Phytochemical constituents of some selected medicinal plants. African J Biotechnol. 10 (66), (2011).
- Rokaya, M. B., et al. Traditional uses of medicinal plants in gastrointestinal disorders in. Nepal. J Ethnopharmacol. 158, 221-229 (2014).
- Birdi, T., Krishnan, G. G., Kataria, S., Gholkar, M., Daswani, P. A randomized open label efficacy clinical trial of oral guava leaf decoction in patients with acute infectious diarrhoea). J Ayurveda Integr Med. 11 (2), 163-172 (2020).
- van Vuuren, S. F., Nkwanyana, M. N., de Wet, H. Antimicrobial evaluation of plants used for the treatment of diarrhoea in a rural community in northern Maputaland, KwaZulu-Natal, South Africa. BMC Complement Altern Med. 15, 53 (2015).
- Firenzuoli, F., Gori, L. Herbal medicine today: Clinical and research issues. Evid Based Complement Alternat Med. 4, 37-40 (2007).
- Rawat, P., Singh, P. K., Kumar, V. Evidence based traditional anti-diarrheal medicinal plants and their phytocompounds. Biomed Pharmacother. 96, 1453-1464 (2017).
- Palombo, E. A. Phytochemicals from traditional medicinal plants used in the treatment of diarrhoea: modes of action and effects on intestinal function. Phytother Res. 20 (9), 717-724 (2006).
- Koyama, T., et al. A nutrient-responsive hormonal circuit mediates an inter-tissue program regulating metabolic homeostasis in adult Drosophila. Nat Commun. 12 (1), 5178 (2021).
- Wayland, M. T., et al. Spotting the differences: Probing host/microbiota interactions with a dedicated software tool for the analysis of faecal outputs in Drosophila. J Insect Physiol. 69, 126-135 (2014).
- Cognigni, P., Bailey, A. P., Miguel-Aliaga, I. Enteric neurons and systemic signals couple nutritional and reproductive status with intestinal homeostasis. Cell Metab. 13 (1), 92-104 (2011).
- Gáliková, M., Dircksen, H., Nässel, D. R. The thirsty fly: Ion transport peptide (ITP) is a novel endocrine regulator of water homeostasis in Drosophila. PLoS Genet. 14 (8), 1007618 (2018).
- Chassagne, F., Quave, C. L. Collection, extraction, and in vitro antibacterial evaluation of plants used in traditional medicine. Methods Mol Biol. 2296, 19-41 (2021).
- Patel, T. S., Crutchley, R. D., Tucker, A. M., Cottreau, J., Garey, K. W. Crofelemer for the treatment of chronic diarrhea in patients living with HIV/AIDS. HIVAIDS. 5, 153-162 (2013).
- Cottreau, J., Tucker, A., Crutchley, R., Garey, K. W. Crofelemer for the treatment of secretory diarrhea. Expert Rev Gastroenterol Hepatol. 6 (1), 17-23 (2012).
- Wu, P. E., Juurlink, D. N. Loperamide cardiac toxicity: Pathophysiology, presentation, and management. Can J Cardiol. 38 (9), 1378-1383 (2022).
- Benguettat, O., et al. The DH31/CGRP enteroendocrine peptide triggers intestinal contractions favoring the elimination of opportunistic bacteria. PLoS Pathog. 14 (9), 1007279 (2018).
- Thakare, M. R., et al. Direct intake estimation and longitudinal tracking of solid-food consumption (DIETS) in Drosophila. bioRxiv. , 543033 (2023).
- Miller, J., et al. Drosophila melanogaster as an emerging translational model of human nephrolithiasis. J Urol. 190 (5), 1648-1656 (2013).
- Zierer, J., et al. The fecal metabolome as a functional readout of the gut microbiome. Nat Genet. 50 (6), 790-795 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon