Culture d’organoïdes de gliome dérivés ex vivo de patients à l’aide d’un hachoir à tissus
Dans cet article
Résumé
Cette étude présente une méthode automatisée pour générer des organoïdes tridimensionnels de glioblastome dérivés de patients à l’aide d’un hachoir à tissus. La méthode fournit une approche appropriée et efficace pour obtenir de tels organoïdes pour des tests thérapeutiques.
Résumé
Le glioblastome de type sauvage IDH, grade 4 de l’OMS du SNC (GBM) est une tumeur cérébrale primitive associée à une faible survie des patients malgré un traitement agressif. Le développement de modèles ex vivo réalistes reste difficile. Les modèles d’organoïdes tridimensionnels (PDO) dérivés de patients offrent des plateformes innovantes qui capturent l’hétérogénéité phénotypique et moléculaire du GBM, tout en préservant les caractéristiques clés des tumeurs d’origine. Cependant, la dissection manuelle pour la génération d’AOP prend du temps, coûte cher et peut entraîner un certain nombre d’AOP irrégulières et de taille inégale. Cette étude présente une méthode innovante de production de PDO à l’aide d’un hachoir à tissus automatisé. Des échantillons tumoraux de quatre patients atteints de GBM et d’un astrocytome, mutant IDH, CNS de grade 2 de l’OMS ont été traités manuellement ainsi qu’à l’aide du hachoir tissulaire. Dans l’approche manuelle, le matériel tumoral a été disséqué à l’aide de scalpels sous contrôle microscopique, tandis que le hachoir à tissus a été utilisé sous trois angles différents. Après culture sur un agitateur orbitaire à 37 °C, les changements morphologiques ont été évalués par microscopie à fond clair, tandis que la prolifération (Ki67) et l’apoptose (CC3) ont été évaluées par immunofluorescence après 6 semaines. La méthode du hachoir à tissus a réduit près de 70 % du temps de fabrication et a entraîné un nombre moyen d’AOP significativement plus élevé que le nombre moyen de PDO par rapport aux tissus traités manuellement à partir de la deuxième semaine (semaine 2 : 801 contre 601, P = 0,018 ; semaine 3 : 1105 contre 771, P = 0,032 ; et semaine 4 : 1195 contre 784, P < 0,01). L’évaluation de la qualité a révélé des taux similaires d’apoptose et de prolifération des cellules tumorales pour les deux méthodes de fabrication. Par conséquent, la méthode du hachoir automatisé offre une approche plus efficace en termes de temps et de rendement PDO. Cette méthode est prometteuse pour le dépistage médicamenteux ou immunothérapeutique des patients atteints de GBM.
Introduction
Les gliomes de bas grade (LGG) sont un groupe de tumeurs cérébrales relativement rares qui se présentent généralement comme à croissance lente et moins agressives que les gliomes de haut grade comme le glioblastome. Ils peuvent survenir chez les adultes et les enfants, avec une prévalence légèrement plus élevée chez les adultes. La prévalence exacte varie selon la région et la population, mais les LGG représentent environ 15 à 20 % de toutes les tumeurs cérébrales primitives1. Les stratégies de traitement des LGG impliquent souvent une combinaison de chirurgie, de radiothérapie et de chimiothérapie, visant à maximiser la résection tumorale tout en préservant la fonction neurologique. La prise en charge des LGG peut être complexe et le choix du traitement peut dépendre de facteurs tels que la localisation de la tumeur et les caractéristiques moléculaires2. Les progrès réalisés dans la compréhension des fondements génétiques et moléculaires des LGG ont conduit à des thérapies plus ciblées, et les recherches en cours continuent d’affiner les approches thérapeutiques.
Le glioblastome de type sauvage IDH, grade 4 de l’OMS du SNC (GBM), quant à lui, est la tumeur cérébrale primitive la plus répandue chez les adultes, avec un taux d’incidence compris entre 3,19 et 4,17 cas pour 100 000 années-personnes3. Le GBM provoque des symptômes tels que des maux de tête, des convulsions, des déficits neurologiques focaux, des changements de personnalité et une augmentation de la pression intracrânienne. Le traitement standard du GBM implique une réduction tumorale de la tumeur, si possible, suivie d’une radiothérapie associée au témozolomide4. De plus, la combinaison du témozolomide et de la lomustine pourrait améliorer le taux de survie global médian chez les patients présentant une méthylation5 du promoteur de l’O 6-méthylguanine-méthyltransférase (MGMT). Cependant, malgré ces approches thérapeutiques récentes, le GBM reste une maladie incurable de mauvais pronostic, caractérisée par un taux de survie global médian des patients de 16 mois à 20,9 mois lorsque les champs de traitement des tumeurs (TTFields) sont ajoutés 3,6. Plusieurs approches immunothérapeutiques ont été étudiées dans le GBM mais ont démontré une efficacité limitée in vivo. De plus, les limitations cliniques et précliniques entravent les percées thérapeutiques7. L’établissement d’un modèle ex vivo approprié et réaliste a été difficile en raison de l’hétérogénéité inter-8 et intratumorale9 du GBM.
Les lignées cellulaires conventionnelles de patients en 2D représentent des populations cellulaires homogènes et conviennent au criblage de médicaments à haut débit. Cependant, les lignées cellulaires dérivées de patients et immortalisées ne parviennent pas à imiter correctement le GBM en raison des différences dans les conditions de croissance et des déviations des caractéristiques génotypiques et phénotypiques après de multiples passages 10,11,12.
D’autre part, les modèles organoïdes 3D sont récemment apparus comme des systèmes prometteurs qui reproduisent l’hétérogénéité phénotypique et moléculaire des organes et de divers types de cancer 13,14,15,16,17,18. Dans le contexte du GBM, les organoïdes cérébraux ont été génétiquement modifiés pour simuler des caractéristiques tumorales16,17 ou co-cultivés avec des GSC ou des sphéroïdes pour induire l’infiltration des cellules tumorales18,19. Bien que les organoïdes GBM dérivés de patients cultivés avec Matrigel et EGF/bFGF présentent des caractéristiques GBM telles que l’hétérogénéité des cellules souches et l’hypoxie20, on ne sait pas dans quelle mesure ce modèle peut représenter les propriétés moléculaires clés des néoplasmes des patients.
Les organoïdes GBM dérivés de patients (PDO) sont des modèles prometteurs qui peuvent maintenir les caractéristiques prédominantes de leurs tumeurs parentales analogues, y compris les caractéristiques histologiques, la diversité cellulaire, l’expression génique et les profils mutationnels. De plus, ils sont rapidement infiltrés lors de l’implantation dans le cerveau des rongeurs adultes, fournissant un modèle réaliste pour les tests de médicaments et la thérapie personnalisée21. Cependant, la dissection manuelle du tissu tumoral pour générer des AOP prend du temps et est coûteuse. Par conséquent, il existe un besoin urgent d’une méthode rapide capable de produire un grand nombre d’AOP, permettant une évaluation complète des différentes approches thérapeutiques prometteuses pour les tests de médicaments individualisés. Cette étude décrit une nouvelle méthode de fabrication de PDO directement à partir de tissu tumoral fraîchement disséqué à l’aide d’un hachoir à tissus automatique. De plus, les PDO générées par cette méthode ont été comparées à des PDO disséquées manuellement chez les mêmes patients en termes de nombre de PDO, de caractéristiques morphologiques, d’apoptose et de prolifération des cellules tumorales.
Protocole
Tous les patients ont été traités au service de neurochirurgie de l’hôpital universitaire de Würzburg, en Allemagne, après avoir donné un consentement éclairé écrit conformément à la déclaration d’Helsinki et à l’approbation du comité d’examen institutionnel de l’Université de Würzburg (#22/20-me). Le matériel de tissu tumoral de quatre patients atteints de GBM et d’un astrocytome, mutant IDH, patients de grade 2 de l’OMS du SNC (gliome de bas grade, LGG) (tableau 1) a été obtenu par chirurgie et traité selon le protocole suivant. Le processus automatisé de génération d’AOP à l’aide d’un hachoir à tissus est appelé hacheur (C) et le processus de coupe manuelle des tissus avec deux scalpels sous contrôle microscopique est manuel (M). Six sections de taille égale (1-2 cm3) ont été disséquées à partir de l’échantillon tumoral, puis chacune a été coupée en deux et traitée de manière homogène en utilisant les deux méthodes. En raison de l’hétérogénéité intratumorale susmentionnée, une plaque à 6 puits pour chaque approche a été générée à partir de chaque patient, chaque puits représentant des PDO d’un site différent dans la tumeur d’origine. Les deux procédures ont eu lieu sous une armoire à flux d’air laminaire et tous les instruments utilisés ont été stérilisés avant utilisation. La figure 1 illustre l’aperçu de l’approche.
1. Préparation des blocs d’agarose (pour l’approche C uniquement, facultatif)
- Verser 50 mL de solution saline tamponnée au phosphate (PBS) dans un bécher, ajouter un comprimé d’agarose (voir le tableau des matières) et bien mélanger jusqu’à ce qu’il soit en suspension.
- Faites chauffer le mélange au micro-ondes pendant 30-40 s, en évitant de bouillir. Refroidissez ensuite le mélange jusqu’à ce qu’il atteigne 47 °C.
- Versez le mélange d’agarose dans un moule de coulée scellé en forme de cylindre et évitez toute formation de bulles. Refroidissez immédiatement le plâtre à l’aide d’une pince congelée (-20 °C) ou en le plaçant sur de la glace carbonique pendant 30 min.
2. Traitement du matériel tumoral
- Préparez une boîte de glace pour refroidir le matériel tumoral sur le chemin de la salle d’opération au laboratoire.
- Transférez le tissu tumoral (4-5 cm³) dans un tube stérile de 50 mL contenant 25 mL d’Hibernate A (voir le tableau des matériaux) recouvrant la tumeur et placez le tube dans la glacière.
- Sous une armoire à flux d’air laminaire, transférez le matériel tumoral avec l’Hibernate A dans une boîte de Pétri en verre stérilisé.
- Éliminez le tissu nécrotique et disséquez soigneusement les vaisseaux sanguins à l’aide d’un scalpel et d’une pince à tissus sous contrôle microscopique. Identifier les tissus nécrotiques par les zones hémorragiques présentant une teinte brunâtre résultant d’un saignement, ou les tissus présentant un aspect plus pâle ou plus blanc par rapport au tissu viable adjacent. Faites attention à ne pas serrer ou perturber les tissus.
- Coupez le matériel tumoral en six morceaux d’une taille approximative de 1 à 2 cm3. Répartir les morceaux dans des boîtes de Pétri en plastique (n = 6) pré-remplies de 3 mL de milieu H-GPSA (tableau 2), chacune22. Placez les boîtes de Pétri sur de la glace.
3. Mise en place du hachoir à tissus
- Positionnez la lame comme décrit dans le manuel du fabricant23.
- Ajustez l’épaisseur de la tranche à 0,45-0,50 mm. Réglez la force de la lame sur moyenne. Fixez le bouton de déverrouillage de la table en mode « démarrage ».
4. Traitement des morceaux de tissu tumoral
- Traitement du tissu tumoral avec le hachoir (méthode C)
- Coupez les blocs d’agarose en cylindres de 2 cm de long et collez l’un de ces cylindres sur le hachoir en plastique circulaire à l’aide de la colle histoacrylique (voir tableau des matériaux).
- Créez un approfondissement dans le cylindre d’agarose à l’aide d’un scalpel, puis ajustez le tissu tumoral du premier puits (étape 2.5) dans cette fosse.
REMARQUE : Le matériel tumoral doit être manipulé avec précaution et ne doit pas être pressé ou poussé dans l’espace. L’espace doit être suffisamment grand pour s’adapter facilement à la tumeur, mais suffisamment petit pour maintenir le matériau tumoral stable pendant le processus de coupe. Étapes 4.1.1. et 4.1.2. sont facultatifs. - Positionnez le disque en plastique sur le disque de montage de la table de découpe (voir Tableau des matériaux).
- Allumez le hachoir et appuyez sur le bouton de réinitialisation. Le hachoir commence maintenant à couper (premier tour). La machine s’arrête automatiquement lorsque la table atteint la fin et que l’agarose et le tissu tumoral sont coupés au diamètre souhaité.
- Faites pivoter le disque de montage de 90°, puis réglez le bouton de la table de déverrouillage en mode de démarrage.
- Appuyez sur le bouton de réinitialisation et laissez la machine couper à nouveau le tissu en créant un tissu de forme rectangulaire (deuxième tour).
- Retirez le disque en plastique avec le matériau traité et faites pivoter soigneusement uniquement le tissu tumoral de 90° à l’aide d’une spatule à tissu.
- Placez le disque en plastique sur la table de découpe, puis réglez le bouton de la table de déverrouillage sur le mode de démarrage et appuyez sur le bouton de réinitialisation pour un dernier tour de coupe (troisième tour).
- Éteignez le hachoir et retirez le disque en plastique. Nettoyez le hachoir et les lames.
- À l’aide d’une pipette monocanal de 5 ml, aspirer le matériau traité avec le milieu dans la pipette et rincer la suspension dans le plat.
- Répétez l’étape précédente 2 à 3 fois pour séparer correctement le tissu.
- Remettez la boîte de Pétri sur de la glace et répétez les étapes (4.1.1-4.1.12.) avec les 5 autres boîtes de chaque tumeur.
- Traitement manuel du tissu tumoral (méthode M)
- Transférez le tissu tumoral de la première boîte de Pétri en plastique (étape 2.5) avec 3 ml de milieu H-GPSA (tableau 2) dans une boîte de Pétri en verre. Disséquez le segment manuellement au microscope en sections de 0,5 mm à l’aide de deux scalpels.
- Transférer le tissu disséqué dans sa boîte de Pétri en plastique à l’aide d’une pipette de 2 ml.
- Répétez les étapes (4.2.1.-4.2.3.) pour les coupes tumorales dans les cinq autres boîtes de Pétri (étape 2.5).
5. Lavage du tissu tumoral
- Inclinez chaque boîte de Pétri vers le haut à 45° et attendez 30 secondes jusqu’à ce que les morceaux de tumeur coulent au fond de la boîte.
- Aspirer soigneusement 2,5 mL de milieu H-GPSA (Tableau 2) à l’aide d’une pipette de 1 mL et veiller à ne pas prélever de tissu tumoral.
- Ajouter 2 mL de tampon de lyse des globules rouges (voir le tableau des matières) à chaque échantillon. Les morceaux tumoraux traités doivent être complètement recouverts d’un tampon de lyse.
- Placez les 6 paraboles sur une machine à secouer orbital de laboratoire à vitesse lente pendant 10 min.
- Aspirez soigneusement 2 ml du tampon de lyse pour ne pas absorber de tissu tumoral.
- Répétez les étapes de lavage précédentes (étapes 5.1 à 5.5) deux fois en utilisant 2 mL de milieu H-GPSA (tableau 2) au lieu d’un tampon de lyse à chaque fois.
6. Culture du tissu tumoral
- Aspirer le milieu H-GPSA (tableau 2) de chaque boîte et le remplacer par 4 mL de milieu PDO (tableau 2).
- Transférer les morceaux de tissu de chaque plat dans un puits respectif d’une plaque à 6 puits à fixation ultra-basse (voir le tableau des matériaux).
- Placez la plaque sur un agitateur orbital à l’intérieur d’un incubateur et incubez à 37 °C, 5 % de CO2 et 150 tr/min pendant 2 à 4 semaines.
- Effectuer un demi-changement de milieu tous les deux jours en aspirant 2 mL de milieu de chaque puits et en le remplaçant par 2 mL de milieu PDO frais (tableau 2) préchauffé à 37 °C.
- Observez les tissus au microscope (morphologie, croissance, couleur moyenne) et coupez les PDO en croissance (>0,7 mm) ou les tissus adhésifs pour prévenir l’hypoxie tissulaire.
- Pour ce faire, transférez les PDO du puits d’attache ultra-bas dans une boîte de Pétri en verre stérilisé et utilisez un scalpel pour couper. Alternativement, les PDO adhésifs peuvent être résolus en les aspirant avec une pipette de 1 ml. Veillez à ne pas serrer les AOP et à les manipuler doucement.
- Évaluez la formation d’AOP en comptant l’AOP tous les deux jours et vérifiez soigneusement la morphologie ronde souhaitée (figure 2).
7. Fixation et intégration des AOP
- Fixer deux PDO de chaque puits de chaque patient avec du formol à 4 % pendant 24 heures après 6 semaines de culture.
- Immerger les AOP fixées dans du formol à tampon neutre (phosphate de sodium) jusqu’à l’enrobage.
- Placez chaque PDO dans une cassette (voir le tableau des matériaux) pour un traitement ultérieur.
- Lancez un processus de déshydratation en immergeant la cassette dans les solutions suivantes comme mentionné dans la REMARQUE ci-dessous :
REMARQUE : 50% d’éthanol pendant 20 min, 70% d’éthanol pendant 20 min, 80% d’éthanol pendant 20 min, 96% d’éthanol pendant 20 min, 100% d’éthanol pendant 20 min, 100% d’éthanol pendant 30 min, 100% éthanol + chloroforme (rapport 1:1) pendant 30 min, 100% éthanol + chloroforme (rapport 1:1) pendant 30 minutes, Chloroforme absolu pendant 30 min, Chloroforme absolu pendant 30 min, Paraffine pendant 30 min, paraffine pendant 30 min avec le STP 120. - Incorporer les AOP déshydratées dans de la cire de paraffine à 58-60 °C.
- Coupez les PDO intégrés à 2,5 μm d’épaisseur et montez-les sur des lames pour la coloration.
8. Coloration par immunofluorescence
- Montez les PDO après 6 semaines de culture.
- Par la suite, effectuer une double coloration contre la protéine acide fibrillaire gliale (GFAP, dilution : 1:100) et le marqueur de prolifération Ki67 (dilution : 1:1000) (voir Tableau des matériaux), comme indiqué précédemment22.
- De même, évaluer l’apoptose en double coloration des PDO contre GFAP et anti-caspase-3 (CC3, dilution : 1:400) (voir Tableau des matériaux).
- Capturez des images des PDO à l’aide d’un microscope à fluorescence à un grossissement de 40x.
- Analysez les images pour les cellules positives GFAP, Ki67 et CC3, ainsi que les cellules doublement positives GFAP/Ki67 et GFAP/CC3.
- Utilisez le programme open-source Fiji (ImageJ-win 32) pour l’analyse d’images.
9. Évaluation et analyse des données
- Capturez quotidiennement des images microscopiques en fond clair pendant la première semaine de culture avec des réglages standard et un grossissement de 5x.
- Observez les changements morphologiques et suivez le processus de maturation dans des approches de traitement manuelles et automatisées.
- Effectuez une analyse morphologique à l’aide du microscope en mode fond clair standard.
- Évaluer le nombre et la morphologie des PDO au cours des 4 premières semaines de culture dans les AOP des cinq patients.
- Obtenez trois lectures de chaque compte de PDO de chaque patient pour calculer la moyenne et l’erreur-type de la moyenne (MEB).
- Étudier la prolifération et l’apoptose dans les PDO de trois patients.
- Analyser les données à l’aide d’un logiciel statistique disponible dans le commerce (voir Tableau des matières).
- Appliquer les tests Students-T et Mann-Whitney U pour déterminer les différences entre la génération manuelle et automatisée de PDO en termes de comptage, de prolifération et d’apoptose.
Résultats Représentatifs
Quatre patients atteints de GBM et un patient atteint de LGG ont été inclus après confirmation pathologique par un neuropathologiste expérimenté (CMM). La majorité des patients avaient un promoteur MGMT non méthylé, et tous les patients atteints de GBM étaient de type sauvage IDH1 et IDH2 (tableau 1). En moyenne, le processus de fabrication a duré 88,8 min (+/- 6,3 min) en approche C et 322 min (+/- 17,2 min) en approche M. Le taux de réussite global était de 87 % dans l’approche manuelle et de 93 % dans l’approche par hachoir après 4 semaines de culture (n = 5). De plus, les PDO dérivées du groupe C ont atteint la forme arrondie souhaitée en 1 semaine et étaient suffisamment matures pour être utilisées dans des expériences in vitro , tandis que les PDO du groupe M sont restées pour la plupart fortement arrangées et indéfinies (Figure 2). Le tissu tumoral traité avec l’approche C a donné un total de 281 PDO (moyenne par patient = 56 +/- 43) après la première semaine de culture, tandis que 250 PDO (moyenne par patient = 50 +/- 41) se sont développées avec l’approche M. Au cours de la deuxième semaine de culture, les tissus des cinq patients ont donné un nombre de PDO plus élevé lorsqu’ils ont été générés avec l’approche C (801 ; Moyenne par patient = 130 +/- 38) par rapport à l’approche M (601 ; Moyenne par patient = 76 +/- 44 ; P = 0,018). Au cours de la troisième semaine de culture, l’approche C a accumulé au total 1105 PDO de tous les patients (moyenne par patient = 221 +/- 32) contre 771 PDO (moyenne par patient = 155 +/- 34) dans l’approche M (P = 0,032). De plus, un total de 1195 PDO (moyenne par patient = 239 +/- 50) se sont formés après quatre semaines de culture lorsqu’ils ont été générés avec l’approche C, contre 784 (moyenne par patient = 157 +/- 36) en utilisant l’approche M (P < 0,01). Par conséquent, la méthode C a montré un nombre significativement plus élevé de PDO à partir de la deuxième semaine (Figure 3). De plus, les fluctuations relatives du nombre d’AOP ont été évaluées afin d’explorer les tendances dynamiques entre les semaines successives. L’analyse a révélé une augmentation impressionnante du nombre de PDO au cours de la transition initiale de la première à la deuxième semaine dans l’approche C (265 %), ce qui indique des progrès rapides. Par la suite, il y a eu une augmentation plus faible des comptes au cours de la troisième semaine (75 %), ce qui reflète un ajustement temporaire. En revanche, l’approche M a démontré une augmentation constante et régulière du nombre de PDO (92 % au cours de la deuxième semaine, respectivement 67 % au cours de la troisième semaine), ce qui a contribué à une stabilité remarquable du nombre de personnes au cours de la quatrième semaine. Cette tendance à la hausse constante du nombre d’AOP souligne la fiabilité et la résilience de l’approche C tout au long de la période d’observation.
Deux patients atteints de GBM et un patient LGG ont été inclus pour l’analyse du nombre d’astrocytes (GFAP) dans les DO, de la prolifération des cellules PDO (Ki67) et de l’apoptose (CC3). Le nombre d’astrocytes déterminé n’a révélé aucune différence significative entre les deux méthodes de traitement, avec une moyenne de 43 % dans l’approche C et de 45 % dans l’approche M (Figure 4 et Figure 5, Figure supplémentaire 1 et Figure supplémentaire 2). De même, les taux de prolifération au sein des AOP étaient comparables entre les approches C (3 %) et M (1 %). Seules les PDO générées avec l’approche C du patient 5 présentaient un taux de prolifération de 26 % contre 1 % avec l’approche M (P = 0,001 ; Figure 4C). Dans l’ensemble, de faibles taux d’apoptose ont été détectés dans les OPP traitées avec l’approche C (3 %) contre 2 % avec l’approche M pour tous les patients, qui n’étaient pas significativement différents (Figure 5C). De plus, il n’y avait pas de différence significative entre les deux méthodes en ce qui concerne le nombre d’astrocytes subissant l’apoptose (Figure 5D).
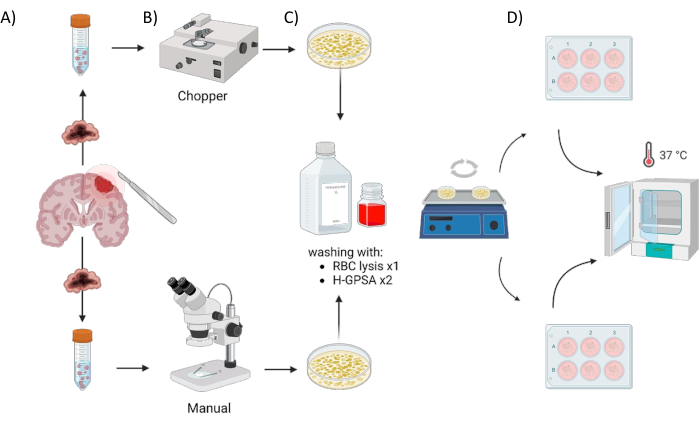
Figure 1 : Aperçu graphique du processus de fabrication d’organoïdes dérivés de patients (PDO) à l’aide d’un hacheur automatisé par rapport à une approche manuelle. L’illustration représente les différentes étapes impliquées, y compris (A) le prélèvement d’échantillons, (B) la dissection du matériel tumoral, (C) le lavage et (D) l’incubation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
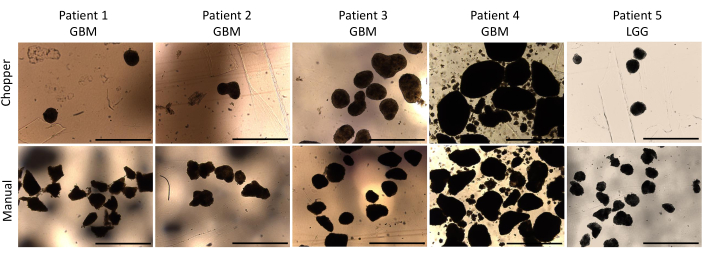
Figure 2 : Morphologie de l’AOP au cours de la première semaine de culture. Comparaison de la formation des AOP après dissection à l’aide du broyeur automatisé et de la méthode manuelle. Barres d’échelle = 1000 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
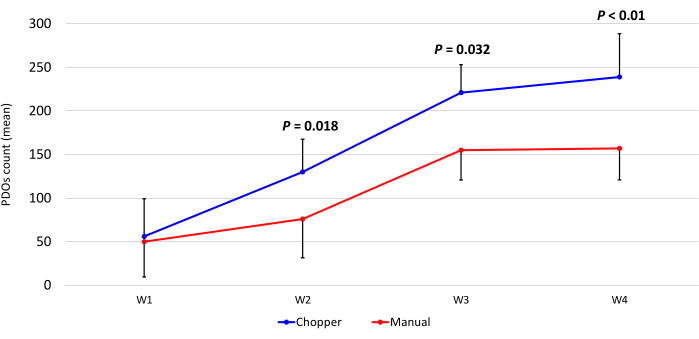
Figure 3 : Nombre d’AOP au cours des quatre premières semaines de culture. L’axe des x affiche le temps en semaines (W) et l’axe des y le nombre d’ODO de l’approche C (bleu) et M (rouge) (n = 5). Chaque point de données représente le nombre moyen, avec des barres d’erreur indiquant l’erreur type de la moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
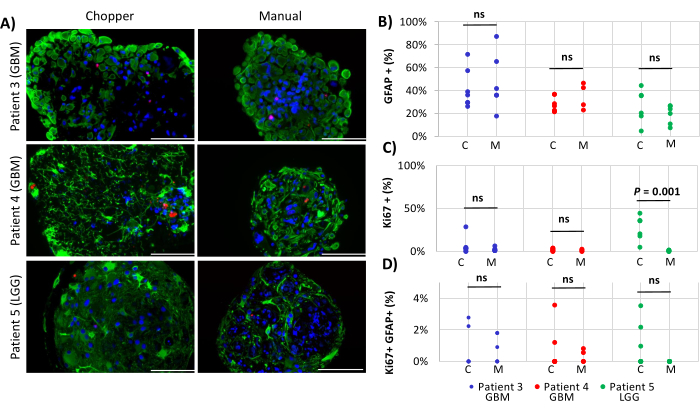
Figure 4 : Taux de prolifération cellulaire dans les PDO (A) Images d’immunofluorescence représentatives (n = 3) des cellules GFAP positives (vert), Ki67 positives (rouge) et DAPI (bleu) dans les PDO des patients 3, 4 et 5 (Tableau 1). Toutes les AOP ont été traitées à l’aide des méthodes du hacheur (C) et manuelle (M). Barres d’échelle = 100 μm. (B) Comparaison des deux méthodes concernant le nombre relatif de cellules positives à la GFAP, (C) cellules positives au Ki67 et (D) cellules positives au Ki67/GFAP double. Les résultats non significatifs sont indiqués par « ns ». Veuillez cliquer ici pour voir une version agrandie de cette figure.
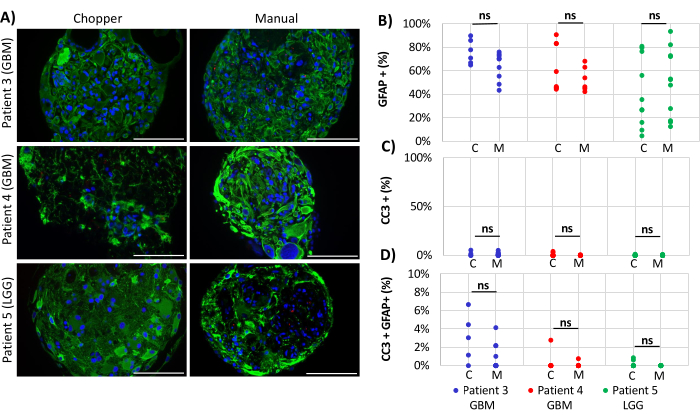
Figure 5 : Taux d’apoptose dans les PDO (A) Images d’immunofluorescence représentatives (n = 3) des cellules GFAP positives (vert), CC3 positives (rouge) et DAPI (bleu) dans les PDO des patients 3, 4 et 5 (Tableau 1). Toutes les AOP ont été traitées à l’aide des méthodes du hacheur (C) et manuelle (M). Barres d’échelle = 100 μm. (B) Comparaison des deux méthodes concernant le nombre relatif de cellules positives à la GFAP, (C) cellules CC3 positives et (D) cellules CC3/GFAP doublement positives. Les résultats non significatifs sont indiqués par « ns ». Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Caractéristiques et paramètres cliniques des patients. GBM = glioblastome de type sauvage IDH, grade 4 de l’OMS du SNC ; LGG = gliome de bas grade ; KPS = score de performance de Karnofsky ; MGMT = O 6-méthylguanine-ADN méthyltransférase ; IDH1 = isocitrate déshydrogénase 1, IDH2 = isocitrate déshydrogénase 2, ATRX = α-thalassémie/retard mental, gène lié à l’X ; M = morphologie ; CC = nombre de cellules ; p = prolifération ; A = apoptose. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Compositions moyennes. H-GPSA = Hibernate A-Glutamax pencillin streptomycine amphotéricine B. PDO = Organoïdes dérivés du patient DMEM : Dulbecco’s Modified Eagle’s Medium. NEAA : acides aminés non essentiels. Streptocoque stylo : Pénicilline/Streptomycine Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Aperçu des techniques utilisées pour générer des modèles de culture cellulaire. Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire 1 : Canaux individuels de coloration de la prolifération des DO. (A) DAPI (bleu), (B) cellules GFAP positives (vert), (C) cellules Ki67 positives (rouge) et (D) canal de recouvrement dans les PDO des patients 3, 4 et 5. Barres d’échelle = 100 μm. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Canaux individuels de coloration par apoptose des PDO. (A) DAPI (bleu), (B) cellules GFAP positives (vert), (C) cellules CC3 positives (rouge) et (D) canal de recouvrement dans les PDO des patients 3, 4 et 5. Barres d’échelle = 100 μm. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Cette étude présente une méthode rapide et efficace pour générer des PDO. Le GBM reste une tumeur difficile à traiter, souvent caractérisée par une rechute et une charge de morbidité élevée 3,6. Des approches thérapeutiques innovantes sont nécessaires de toute urgence, car les résultats prometteurs observés in vitro ne parviennent souvent pas à démontrer l’efficacité in vivo lors des essais de phase I. L’une des raisons de cet écart pourrait être la capacité limitée des lignées cellulaires immortalisées dérivées de patients, cultivées en cultures monocouches, à refléter les interactions complexes cellule-cellule et les propriétés génétiques de la tumeur parentale. Compte tenu de la forte hétérogénéité inter- et intratumorale du GBM 8,9, les thérapies ciblées personnalisées sont préférées et pourraient être prometteuses pour de futures applications. Contrairement aux lignées cellulaires adhérentes 2D, les organoïdes ont la capacité de conserver les propriétés du tissu parental21, mais les interactions complexes entre la tumeur et le cerveau normal sont d’une importance capitale et pourraient potentiellement être négligées par ce modèle. Cependant, la génération manuelle d’AOP est un processus qui prend du temps, et les lésions tissulaires causées par la compression avec des scalpels pendant la coupe peuvent entraver la croissance réussie des AOP. Par conséquent, une méthode automatisée a été optimisée à l’aide d’un broyeur de tissus pour générer un plus grand nombre de PDO avec moins de temps et d’efforts. De plus, nous avons démontré que les taux globaux de prolifération et d’apoptose ne différaient pas entre les deux approches.
L’approche C est simple, facile à mettre en œuvre et permet de générer un plus grand nombre d’AOP (Figure 3). La rotation du tissu entre la deuxième et la troisième série de hachage a été identifiée comme une étape critique du protocole. À ce stade, le tissu a déjà perdu son intégrité et peut facilement se désagréger, ce qui entraîne des morceaux plus gros qui nécessitent une coupe supplémentaire ou une dissection manuelle au microscope. Alors que l’approche du hacheur automatisé permet une taille de coupe prédéfinie avec une plus grande précision, l’approche manuelle manque de précision dans la détermination de la taille des AOP, ce qui entraîne des PDO de forme et de taille inégales, ce qui est un inconvénient pour le dépistage comparatif des drogues (Figure 2). Néanmoins, avec la méthode proposée, la normalisation du nombre de cellules par PDO n’est pas réalisée, ce qui pourrait poser un inconvénient pour les protocoles de dépistage de drogues standardisés. Les avantages et les inconvénients des différentes techniques de génération d’organoïdes 18,19,20,24,25,26,27,28,29,30,31,32,33,34,35,36,
37,38,39,40,41,42 et leurs applications sont résumées dans le tableau 3.
La consistance du tissu GBM peut varier, allant de dure (zone d’infiltration) à molle (noyau nécrotique), ce qui peut poser des défis pour l’approche du hacheur automatisé. Si le tissu est trop dur, le hachoir peut le presser et l’endommager, tandis que les tissus trop mous peuvent être écrasés. Le tissu choisi présentait des attributs distinctifs, notamment un niveau intermédiaire de fermeté, présentant sporadiquement une coloration rosâtre-grisâtre plutôt que de manifester une décoloration brune ou jaune. Les tissus possédant une texture spongieuse et facilement friable ont démontré une conservation supérieure dans les blocs d’agarose, tandis que les tissus tumoraux extrêmement délicats et liquéfiés ont été omis de la procédure d’échantillonnage. Cependant, l’approche du hacheur a permis de générer avec succès un plus grand nombre d’AOP par rapport à l’approche manuelle, même avec des tissus de consistance sous-optimale. La solution clé est de maintenir une interaction étroite avec le chirurgien effectuant la résection de la tumeur pour traiter les tissus de différentes zones de la tumeur. En cas de consistance tissulaire sous-optimale, le retravail manuel du tissu au microscope était un ajout utile après le hachage. Pour tenir compte de l’hétérogénéité, le tissu tumoral a d’abord été divisé en six segments, chacun divisé par deux par la suite pour l’approche C ou M. Au sein de ces six sections distinctes, un degré important d’hétérogénéité est prévu. De plus, même au sein des AOP d’une même section ou d’un même puits, la présence de sous-populations distinctes est plausible.
Comme preuve de concept, les données de prolifération et d’apoptose ont été rapportées chez deux patients atteints de GBM et un patient atteint de LGG, qui ne montrent aucune différence significative entre les deux méthodes. La génération de PDO ne se limite pas aux tumeurs cérébrales hautement malignes, mais peut également être appliquée aux LGG. Cette étude souligne que LGG présente rarement une croissance dans la culture 2D, ce qui rend le développement d’un modèle précis pour leur étude très précieux. Ce protocole vise à démontrer la polyvalence de cette approche pour générer rapidement et efficacement des AOP à partir de GBM et de LGG.
Dans l’ensemble, les PDO pourraient être utilisées à l’avenir pour des tests préthérapeutiques axés sur le patient de thérapies ciblées dans les tumeurs cérébrales malignes. Il est essentiel de fournir une méthode rapide et efficace pour le dépistage individualisé des médicaments, car la progression tumorale se produit rapidement et les options de traitement de sauvetage sont désespérément nécessaires. Dans une prochaine étape, le modèle PDO pourrait être évalué avec diverses approches immunothérapeutiques pour mieux imiter les réponses réelles au traitement. À l’avenir, les AOP pourraient être utilisées pour tirer des conclusions sophistiquées concernant la nécessité d’explorer et d’évaluer davantage les thérapies dans un cadre clinique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par le Centre interdisciplinaire de recherche clinique (IZKF, B-450) de Würzburg, le Centre bavarois de recherche sur le cancer (BZKF) et la publication soutenue par le Fonds d’édition en libre accès de l’Université de Würzburg. Nous tenons à remercier Dagmar Hemmerich et Siglinde Kühnel, toutes deux de la section de neurochirurgie expérimentale, département de neurochirurgie, hôpital universitaire de Würzburg, pour leur soutien technique. La figure 1 a été créée à l’aide de www.biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol (1000x) | Gibco | 21985023 | |
| 30% formaldehyde methanol-free | Carl Roth | 4235.1 | Used in 4% concentration |
| 70% ethanol solution | For sterilisation | ||
| Agarose tablets 0.5 g | Carl Roth | HP67.7 | |
| Amphotericin B 250 µg/mL | Gibco | 15290018 | |
| Anatomical forceps | Hartstein | N/A | |
| Anatomical spatula | Hartstein | N/A | |
| B-27 Supplement without vitamin A (50x) | Gibco | 12587010 | |
| Biopsy cassette with cover | Resolab | 37001-b | |
| Blades for McIlwain Tissue Chopper | Campden instruments | Model TC752-1 | |
| CC3 antibody (Asp 175) | Cells signaling technology | 9661 | |
| Disposable scalpel | Feather | 0200130015 | |
| Distilled water | Gibco | 15230089 | To dilute the formaldehyd |
| Dulbecco's Modified Eagle Serum Nutrient Mixture (DMEM) F-12 (1:1) (1x) | Gibco | 11330032 | Includes L-Glutamine and 15 mM HEPES |
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma Life Sciences | D8537-500ML | Modified, without calcium, chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| eBioscience 1x RBC Lysis Buffer | Invitrogen | 433357 | |
| Falcon tube 50 ml Cellstar | Greiner Bio-One | 227261 | |
| GFAP antibody | Santa Cruz Biotechnology | sc33673 | |
| Glass beaker | N/A | N/A | |
| Glass petri dish | N/A | N/A | |
| GlutaMAX (100x) | Gibco | 35050061 | |
| Heracell 240i CO2 Incubator | Thermo scientific | 51032875 | |
| Herasafe 2025 Biological Safety Cabinet | Thermo scientific | 5016643 | |
| Hibernate-A | Gibco | A1247501 | |
| Histoacryl glue | B. Braun surgical | 1050052 | |
| Human Insulin, Solution | Santa Cruz Biotechnology | sc-360248 | |
| Ice box | N/A | N/A | |
| Ki67 antibody | Abcam | ab16667 | |
| McIlwain Tissue Chopper | Cavey Laboratory Engineering | 51350V | |
| Microscope Leica DMI 3000B, DMI 4000B, DMI 6000B | Leica | DMI6000B | For brightfield and immunofluorescence pictures |
| Microscope stereozoom S9D | Leica | W841832 | For manual cutting and to organoids monitoring |
| Microwave | Bosch | N/A | To heat the agarose solution |
| Mounting plastic discs | Cavey Laboratory Engineering | 51354 | |
| N-2 Supplement (100x) | Gibco | 17502048 | |
| NEM Non-Essential Amino Acids (NEAA) (100x) | Gibco | 11140050 | |
| Neurobasal (1x) | Gibco | 21103049 | |
| Orbital shaking machine Rotamax120 | Heidolph | 10304491 | |
| Penicilin Streptomycin | Gibco | 15140122 | |
| Plastic petri dishes Cellstar | greiner bio-one | 628160 | n = 12 |
| Single channel pipette 1000 µm | Eppendorf | 4924000010 | |
| Single channel pipette 5000 µm | Eppendorf | EP3123000276 | |
| Statistical Package for the Social Sciences (SPSS) version 23.0 | IBM | ||
| Surgipath Paraplast | Leica | 39601006 | Embedding medium |
| Ultra-low attachment Nucleon Sphera 6-well plate | Thermo Scientific | 174932 |
Références
- Gatto, L., et al. IDH inhibitors and beyond: the cornerstone targeted glioma treatment. Mol Diagn Ther. 25 (4), 457-473 (2021).
- Buckner, J. C., et al. Radiation plus Procarbazine, CCNU, and Vincristine in low-grade glioma. N Engl J Med. 374 (14), 1344-1355 (2016).
- Grochans, S., et al. Epidemiology of glioblastoma multiforme-literature review. Cancers (Basel). 14 (10), 2412 (2022).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma). N Engl J Med. 352 (10), 987-996 (2005).
- Herrlinger, U., et al. Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial. Lancet. 393 (10172), 678-688 (2019).
- Stupp, R., et al. Effect of tumor-treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial. Jama. 318 (23), 2306-2316 (2017).
- Desbaillets, N., Hottinger, A. F. Immunotherapy in glioblastoma: a clinical perspective. Cancers (Basel). 13 (15), 3721 (2021).
- Gularyan, S. K., et al. Investigation of inter- and intratumoral heterogeneity of glioblastoma using TOF-SIMS). Mol Cell Proteomics. 19 (6), 960-970 (2020).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Lathia, J. D., Mack, S. C., Mulkearns-Hubert, E. E., Valentim, C. L., Rich, J. N. Cancer stem cells in glioblastoma. Genes Dev. 29 (12), 1203-1217 (2015).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Timerman, D., Yeung, C. M. Identity confusion of glioma cell lines. Gene. 536 (1), 221-222 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-528 (2018).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nat Methods. 15 (8), 631-639 (2018).
- Ogawa, J., Pao, G. M., Shokhirev, M. N., Verma, I. M. Glioblastoma model using human cerebral organoids. Cell Rep. 23 (4), 1220-1229 (2018).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Rep. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discov. 23 (8), 862-868 (2018).
- Hubert, C. G., et al. A three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Res. 76 (8), 2465-2477 (2016).
- Jacob, F., et al. A patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Nickl, V., et al. Glioblastoma-derived three-dimensional ex vivo models to evaluate effects and efficacy of tumor treating fields (TTFields). Cancers (Basel). 14 (21), 5177 (2022).
- Klein, E., Hau, A. C., Oudin, A., Golebiewska, A., Niclou, S. P. Glioblastoma organoids: pre-clinical applications and challenges in the context of immunotherapy. Front Oncol. 10, 604121 (2020).
- Golebiewska, A., et al. Patient-derived organoids and orthotopic xenografts of primary and recurrent gliomas represent relevant patient avatars for precision oncology. Acta Neuropathol. 140 (6), 919-949 (2020).
- Bougnaud, S., et al. Molecular crosstalk between tumour and brain parenchyma instructs histopathological features in glioblastoma. Oncotarget. 7 (22), 31955-31971 (2016).
- Chua, C. W., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nat Cell Biol. 16 (10), 951-954 (2014).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. J Neurosci Methods. 59 (1), 5-9 (1995).
- Kato, H., Ogawa, T. A technique for preparing in vitro slices of cat's visual cortex for electrophysiological experiments. J Neurosci Methods. 4 (1), 33-38 (1981).
- Teyler, T. J. Brain slice preparation: hippocampus. Brain Res Bull. 5 (4), 391-403 (1980).
- Schulz, E., et al. Preparation and culture of organotypic hippocampal slices for the analysis of brain metastasis and primary brain tumor growth. Methods Mol Biol. 2294, 59-77 (2021).
- Driehuis, E., Gracanin, A., Vries, R. G. J., Clevers, H., Boj, S. F. Establishment of pancreatic organoids from normal tissue and tumors. STAR Protoc. 1 (3), 100192 (2020).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proc Natl Acad Sci U S A. 116 (52), 26580-26590 (2019).
- Neal, J. T., et al. Organoid modeling of the tumor immune microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Li, X., et al. Oncogenic transformation of diverse gastrointestinal tissues in primary organoid culture. Nat Med. 20 (7), 769-777 (2014).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15 (6), 701-706 (2009).
- Zhao, Z., et al. Organoids. Nat Rev Methods Primers. 2, 94 (2022).
- Toh, Y. C., et al. A novel 3D mammalian cell perfusion-culture system in microfluidic channels. Lab Chip. 7 (3), 302-309 (2007).
- Zhang, C., Zhao, Z., Abdul Rahim, N. A., van Noort, D., Yu, H. Towards a human-on-chip: culturing multiple cell types on a chip with compartmentalized microenvironments. Lab Chip. 9 (22), 3185-3192 (2009).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nat Methods. 16 (3), 255-262 (2019).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Kengla, C., Atala, A., Sang Jin, L. Bioprinting of organoids. Essentials of 3D Biofabrication and Translation. , 271-282 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon