2.1 : תגובה כימית
משוואה כימית מאוזנת מספקת את המידע של נוסחאות כימיות של המגיבים והתוצרים המעורבים בשינוי הכימי. הסטוכיומטריה של תגובה עוזרת לחזות כמה מהמגיב נחוץ כדי לייצר את כמות התוצר הרצויה, או במקרים מסוימים, כמה תוצר ייווצר מכמות מסוימת של המגיב.
הכמויות היחסיות של מגיבים ומוצרים המיוצגים במשוואה כימית מאוזנת מכונות לעתים קרובות כמויות סטוכיומטריות. עם זאת, במציאות, המגיבים לא תמיד קיימים בכמויות הסטוכיומטריות המצוינות על ידי המשוואה המאוזנת.
בתגובה כימית, המגיב שנצרך ראשון, ומגביל את כמות המוצר שנוצר, הוא המגיב המגביל, בעוד שהחומר השני הופך למגיב העודף. לעתים קרובות נעשה שימוש בעודף של מגיב אחד או יותר כדי להבטיח את ההמרה המלאה של המגיב השני למוצר.
חשבו על התגובה להיווצרות מים המיוצגת על ידי המשוואה:
סטוכיומטריה מצביעה על כך ששני מול מימן ומול חמצן מגיבות לייצור שני מול מים; כלומר, מימן וחמצן מתחברים ביחס של 2:1.
תארו לעצמכם אם קיימים 5 מול של מימן ו-2 מול של חמצן. היחס בין המגיבים הוא כעת 5:2 (או 2.5:1), שהוא גדול מהיחס הסטוכיומטרי של 2:1. מימן, אם כן, קיים בעודף, והחמצן הוא המגיב המגביל. תגובה של כל החמצן שסופק (2 מול) תצרוך 4 מול מ-5 מול מימן שסופק, ותותיר 1 מול מימן ללא תגובה. חישוב הכמויות המולריות של כל מגיב שסופק והשוואתם לכמויות הסטוכיומטריות המיוצגות במשוואה הכימית המאוזנת היא אחת הדרכים לזהות את המגיבים המגבילים והעודפים.
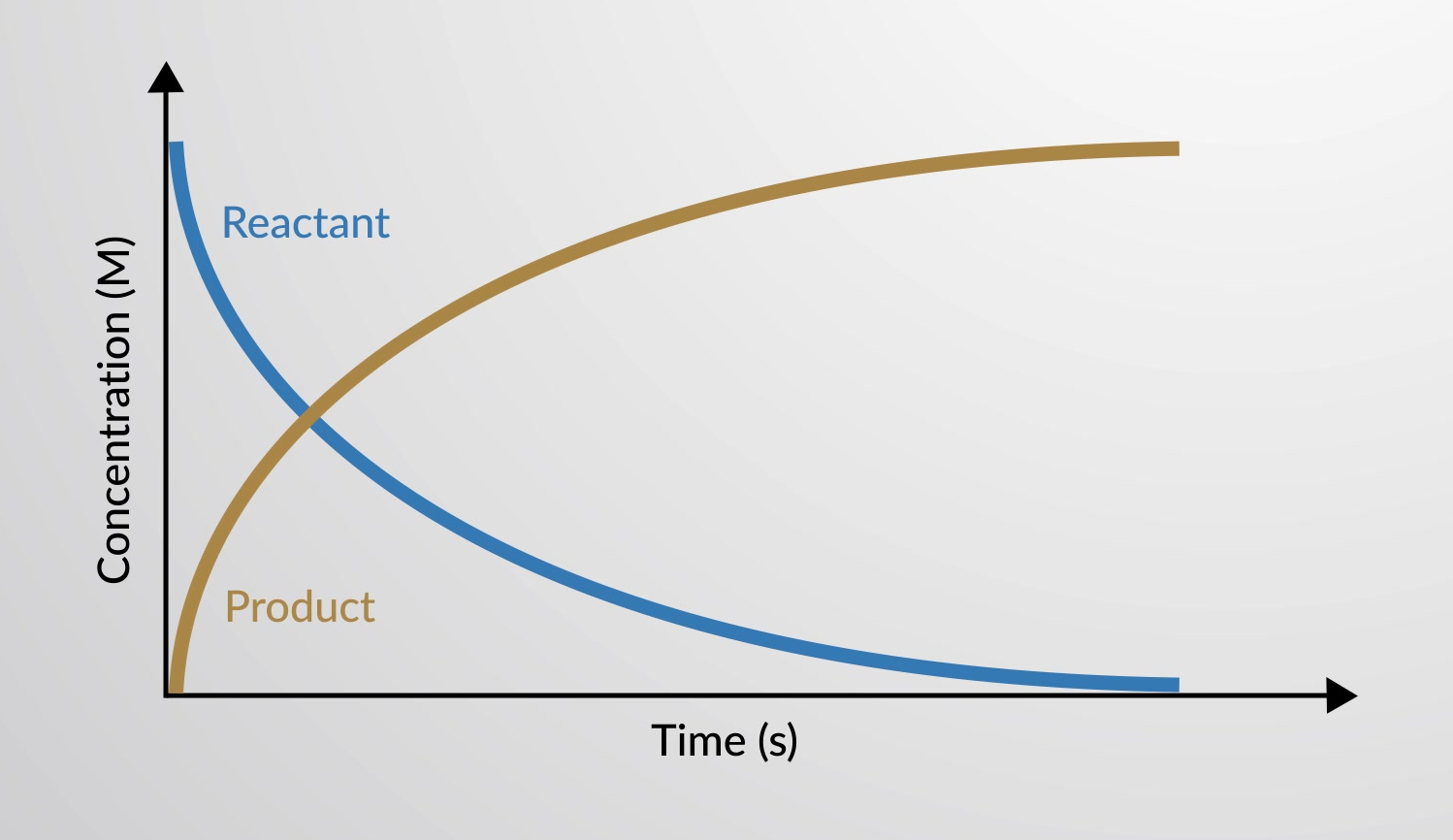
קצב התגובה הוא השינוי בכמות מגיב או תוצר ליחידת זמן. שיעורי התגובה נקבעים לפיכך על ידי מדידת התלות בזמן של משתנה כלשהו שיכול להיות קשור לכמויות מגיבים או מוצר.
ניתן לשרטט את קצב התגובה הכימית בגרף בתור השונות בריכוזים של מגיבים ומוצרים כפונקציה של זמן.
תגובה כימית הפיכה מייצגת תהליך כימי שמתקדם הן בכיוון קדימה (משמאל לימין) והן בכיוון ההפוך (מימין לשמאל). מצבה של תגובה הפיכה מוערך בנוחות על ידי הערכת מנת התגובה שלה (Q).
לתגובה הפיכה המתוארת על ידי מנת התגובה הנגזרת ישירות מהסטוכיומטריה של המשוואה המאוזנת כאשר המספר התחתון c מציין את השימוש בריכוזים מולריים בביטוי.
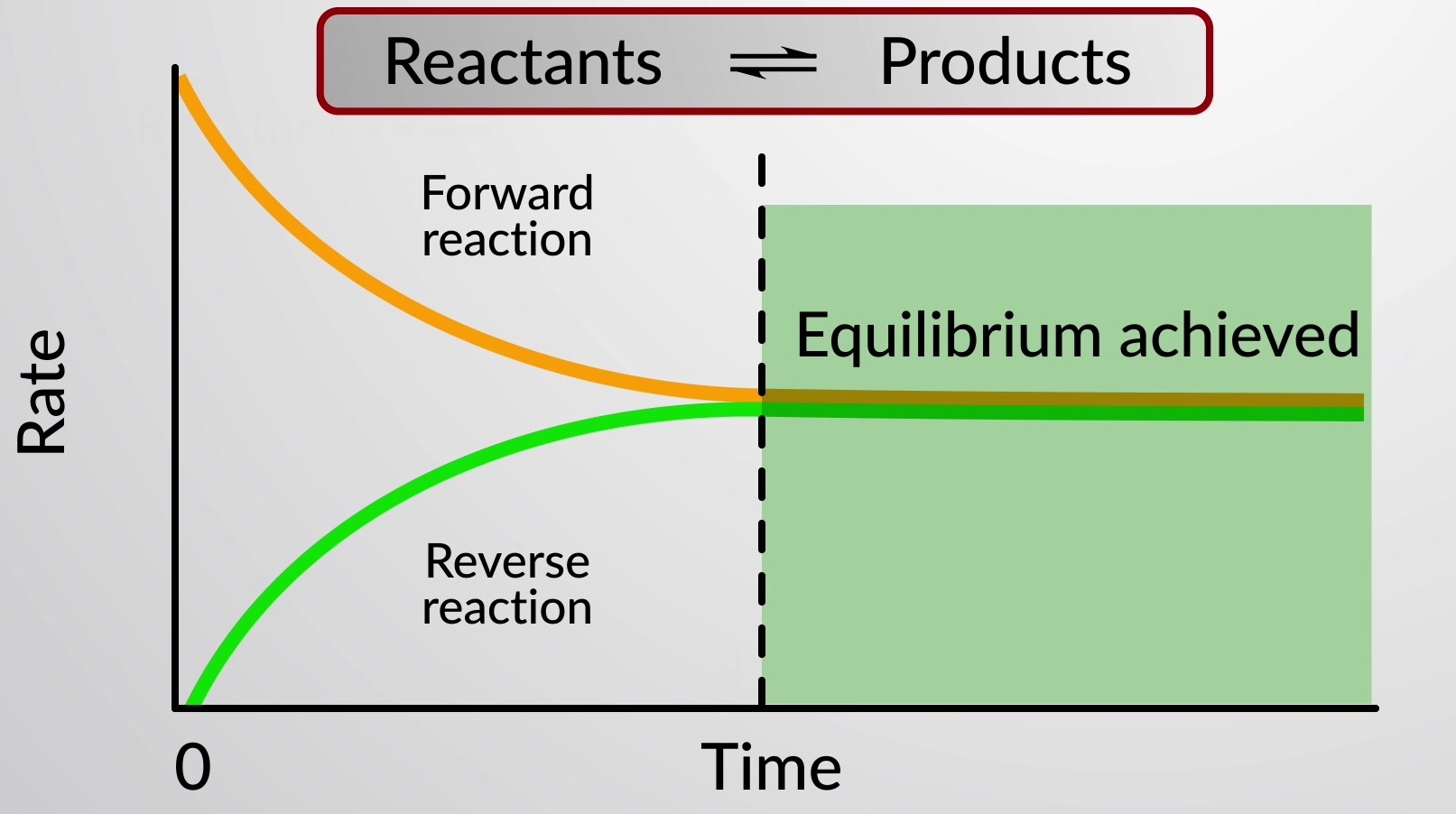
כאשר קצבי התגובות קדימה ואחורה שווים, הריכוזים של המגיבים והצורונים של התוצר נשארים קבועים לאורך זמן והמערכת נמצאת בשיווי משקל. חץ כפול מיוחד משמש להדגשת האופי הפיך של התגובה.
טקסט זה מותאם מ OpenStax Chemistry 2e, Section 4.3: Reaction Stoichiometry ; Section 4.4: Reaction Yield ; Section 12.1: Chemical Reaction Rates ; Section 13.1 Chemical Equilibria , Section 13.2 Equilibrium Constants .
From Chapter 2:

Now Playing
2.1 : תגובה כימית
Thermodynamics and Chemical Kinetics
9.8K Views

2.2 : אנתלפיה וחום התגובה
Thermodynamics and Chemical Kinetics
8.3K Views

2.3 : אנרגטיקה של היווצרות פתרונות
Thermodynamics and Chemical Kinetics
6.7K Views

2.4 : אנטרופיה ופתרון
Thermodynamics and Chemical Kinetics
7.0K Views

2.5 : אנרגיה חופשית של גיבס והעדפה תרמודינמית
Thermodynamics and Chemical Kinetics
6.7K Views

2.6 : שיווי משקל כימי ומסיסות
Thermodynamics and Chemical Kinetics
4.1K Views

2.7 : חוק התעריפים וסדר התגובה
Thermodynamics and Chemical Kinetics
9.3K Views

2.8 : השפעת שינוי הטמפרטורה על קצב התגובה
Thermodynamics and Chemical Kinetics
4.0K Views

2.9 : תגובות מרובות שלבים
Thermodynamics and Chemical Kinetics
7.2K Views

2.10 : אנרגיית דיסוציאציה של הקשר ואנרגיית שפעול
Thermodynamics and Chemical Kinetics
8.7K Views

2.11 : דיאגרמות אנרגיה, מצבי מעבר ומצבי ביניים
Thermodynamics and Chemical Kinetics
16.1K Views

2.12 : חיזוי תוצאות תגובה
Thermodynamics and Chemical Kinetics
8.2K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved