A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
לדמיין את חיים תסיסנית גליה-neuromuscular צומת עם צבעי ניאון
In This Article
Summary
אנו תיאר תכונות מבניות של גליה-neuromuscular הסינפסות הכנה בתוך-out רקמת הרומן של זחלי זבוב חי באמצעות צבעי ניאון עם מיקרוסקופיה confocal. אנחנו שכותרתו מסופי נוירון לחיות עם נוגדנים העיקרי ניאון HRP, וגם דמיינו את החלל perisynaptic עם Dextrans ניאון.
Abstract
הפרויקט שלנו זיהו מבנים GFP גליה שכותרתו בבית סינפסה בפיתוח לטוס הזחל neuromuscular. כדי להסתכל על ההתפתחות של עצב גליה-שרירים וסינפסות לחיות, פיתחנו הכנה רקמות הזחל כי היו תכונות של זחלים חיים שלמים, אך גם תכונות אופטיות טובות. זו הכנה החדשה אפשרה גישה של perfusates כדי הסינפסה. השתמשנו זחלי זבוב, טובל אותם hemolymph מלאכותי, רגוע הצירים הרגילים שלהם על ידי גוף קצבית מצמררת אותם. לאחר מכן ניתחנו את פלחי האחורי של כל חיה עם סיכה חרקים בוטה דחף את חלקי הפה לאחור דרך חלל הגוף. זה everted הקיר גוף הזחל, כמו הפיכת גרב מבפנים החוצה. סיימנו את דיסקציה עם Ultra-בסדר מספריים לנתיחה וחשוף ולכן הצד הקרביים של שרירי הגוף הקיר. המבנים גליה ב NMJ הביע GFP קרום ממוקד בשליטת היזמים ספציפי גליה. הממברנה הפוסט סינפטית, SSR (Reticula Subsynaptic) בשריר הביע ממוקד synaptically dsRed. היינו צריכים בחריפות התווית מסופי הנוירון המוטורי, החלק השלישי של הסינפסה. כדי לעשות זאת אנחנו מוחלים נוגדנים העיקרי HRP, מצומדות כדי flurophore מרחיקות אדום פולטות. כדי לבדוק תכונות דיפוזיה צבע לחלל perisynaptic בין מסופי הנוירון המוטורי ואת SSR, אנו ליישם פתרון של מולקולות גדולות dextran מצומדות כדי flurophore מרחיקות אדום פולטות ותמונות שנאספו.
Protocol
חלק 1: הכנת רקמות
- המטרה שלנו היא הכנה רקמה של זחלי זבוב שבו מערכת העצבים לא נפגעה, אך את פני השטח הפנימי של שריר קיר הגוף חשוף hemolymph מלאכותי, והוא יכול להיות ממוקם קרוב לחמוק מיקרוסקופ לחפות על אופטיקה טובה. במילים אחרות, לפני ולפנים הכנה הזחל.
מאז ההכנות לערב חיתוך הרקמה קונבנציונאלי, מרתק ומותח את השריר קיר הגוף, ולפעמים הסרת חלק של מערכת העצבים, אנחנו צריכים גישה שונה.
רצינו את החיות מבפנים החוצה כי רצינו לקבל מבט טוב על תכונות מבניות ושינויים מבניים לאורך זמן בסינפסה, ורצינו לשמור על מערכת העצבים ללא פגע. רצינו גם כדי למנוע מתיחת הרקמה, והפעלת קולטני המתיחה, אשר יגרום לשרירים עווית ולהרוס התמונות שלנו. - בתור התחלה, בשלב החיות. האכלת הרימות השלישי הנודד הזחלים שלישי גדול קל לנתח כך נצטרך להוכיח על זחלים W3. חיה זו היא בעלת פנוטיפ טאבי, והוא רחב, ולכן קל אוורט.
אנו נעשה שימוש רק זחלים שראינו פעיל זחילה, כולל הזחלים W3. - נקו את פני השטח של תולעת עם מברשת צבע רך מאוד בצלחת פטרי של פעמיים מזוקקים H2O. הזחלים נקי יש אופטיקה טובה יותר וניקוי מפחית חיידקים.
- מעבירים את החיה כדי בצלחת פטרי קטנה של כ 3 מ"ל קרח קר HL-6 ו hemolymph מלאכותית. שים את צלחת על הקרח עד שהחיה מפסיק לנוע, מרגיע (כ -5 דקות).
- החזק מלקחיים טיפ מצוין ביד אחת ומספריים האביב השני. אני משתמש במספריים ביד הדומיננטית שלי. עושים חור קטן בקיר גוף עם מספריים כדי equlibrate את הלחץ על הקיר הגוף.
- החזק את החיה בעדינות עם מלקחיים על החלק התחתון של התבשיל ומנותקים האחורי שני קטעים. לנתח משם את הקרביים ואת השומן בגוף צפוי לעזוב את חלל הגוף. גזור משם זה גם רקמות.
- החזק את הזחלים נגד תחתית צלחת עם מלקחיים בסדר. החזק סיכה # 0 חרק (עם קצה קהה) ולדחוף אותו כלפי חלקי הפה של הזחלים. לחצו על חלקי הפה דרך חלל הגוף כמו שאתה מפנה גרב.
- ולפנים רקמות תיראה דמות: להלן. בעזרת כלי אולטרה בסדר לנתח, לנתח משם את שומן הגוף ואת trachioles מהקיר הגוף. נסה באמת קשה לא למשוך את trachioles, או לנתק את מערכת העצבים. קורעת trachioles יהיה לקרוע חורים בקיר השריר בגוף.
הסרה של שומן הגוף כמה שאתה יכול. שני מבנים אלה לשבש את איכות אופטית של רקמה שלך. אולי כדאי לוותר על הקפה לפני ההכנה עושה את זה. - כשתסיים השריר יהיה שקוף, לא אטום או לבן. אם אתה מכין את הרקמות לתוך HL-6 ללא גלוטמט, טמפ 'חדר בבית, סביר להניח כי חוזה בקצב גנרטורים דפוס המנוע CNS פועלים.
הימנע משימוש preps עם שרירים מכווצים ברור, או חוזה סדיר קיר הגוף.
בתוך קיר שלם מחוץ לגוף בקלות נוטה לקפל לשניים לאורך midlines הגבי ו הגחון, ולכן מכין נותן שמאלה או ימינה "חמי חיה" לדמיין. - 1.9 הר רקמות בתא או נפח קטן מסחריים, כגון תא וורנר, או שקופיות מיקרוסקופ עם הסדר כיסוי לגשר להחליק. ראה חלק 3 הצעות על רקמת גובר.
חלק 2: תיוג באוטון העצבית עם נוגדן ראשוני שכותרתו fluorescently נגד HRP.
- שים 50 מיקרו ליטר של שכותרתו fluorescently גוף אנטי העיקרית נגד HRP ב HL-6 בטיפת על צלחת פטרי. לטבול את החלק הפנימי החוצה קיר הגוף מכין באמבט צבע. אתה יכול לראות תיוג נוירון מסוף לאחר כ -5 דקות, אבל דגירה של 10-20 דקות, עבור תווית מלא ובהיר.
- שטפו את את צבע עבור 10-30 שניות HL-6 בטמפרטורת החדר. Non-מחויב לצבוע את שטיפות מהר, כך מחזור שטיפה לא צריך להיות אגרסיבי.
- שנו את צבע ריכוז וזמן הדגירה כנדרש.
חלק 3: תיוג מרחב Perisynaptic עם dextran flurophore המצומד
- מדולל מצומדות fluorescently dextran צבע מדולל HL-6. ריכוז זה עבד היטב למטרות שלנו:
- אם אתם לא מודאגים עיתוי גישה צבע לתוך לחלל תאיים שלך, לשים טיפה 20 מיקרו ליטר של צבע על coverslip "לגשר" (ראה חלק 4) ו ההפקדה הכנה באמבט צבע.
חלק 4: הרכבה רקמת להדמיה (עם מיקרוסקופיה confocal).
אם אתה לא צריך perfuse הכנה שלך (תצפיות קצר) או שאתה רוצה לשמור את נפח רחצה HL-6 קטן, השתמש בשיטה הכפולה שקופיות לגישור
אם אתה רוצה perfuse הכנה שלך, נסה להשתמש קאמרית זלוף. השתמשנו מולשכת dified ממכשירים וורנר.
פרטים עבור שניהם לעקוב.
הרכבה הכנה בשקופית פעמיים לגישור.
- השתמש שקופיות מיקרוסקופ נקי מאוד. הפלא two רבועים, 18mm (# 1.5) coverslips לשקופית. השאירו מרווח 2 מ"מ בין הקצוות של coverslips.
- בואו הדבק יבש לחלוטין, או שזה יהיה בצורת סרט מוזר על התקשורת מימית סביב הכנה שלך.
- מקם את ולפנים הזחלים בין הקצוות של coverslips. ייתכן שיהיה עליך למקם את הכנה באלכסון אם הזחלים הוא גדול ורכישת את התמונה למערכת יש מערך פיקסל מוגבל.
- מכסים את הרקמה עם # 1.5 coverslip, 18mm (נקי מאוד). ציית coverslip "מלמעלה" להחליק את מודבקת תלושי רקמות איגוף, עם וזלין מינימלית.
- שים טיפת שמן מטרה אישית קרגיל עם מקדם שבירה של 1.3379 (אם אתה משתמש HL-6) על coverslip העליון להעיף זה על הרכבה.
- מקם את הרכבה רקמה על מיקרוסקופ בצד שלך שמן, לכיוון המטרה, ולמקד את המטרה שלך.
הרכבה רקמת בתא זלוף שונה. - דבק coverslip 1.5 להקים הרצפה בחדר RC 20. מקם את רקמת בתא לפי RC-20 הוראות. השתמש חתיכת Nytex רשת במקום coverslip להקים גג החדר.
חלק 5: תוצאות נציג:
- Inside-out הכנה רקמות לנתיחה רצף:
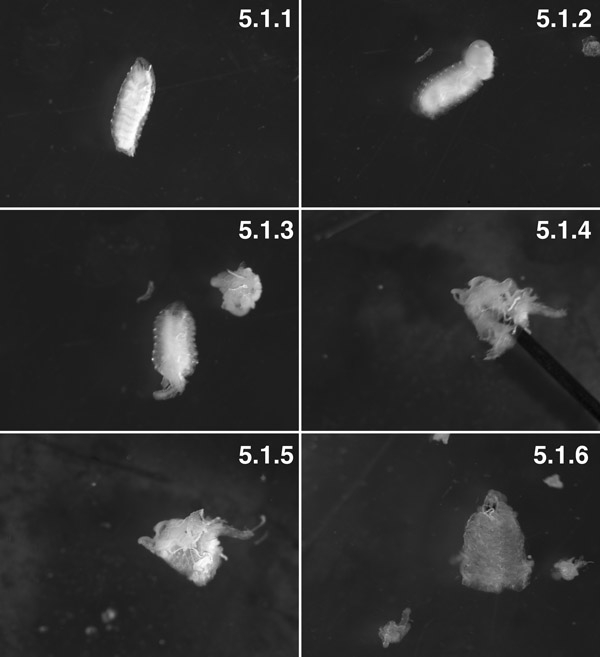
W3 זחלים, שטף (פנוטיפ "טאבי") (5.1.1). W3 זחלים, האחורי 2 פלחי גזור. אתה יכול לראות את שומן הגוף נדחף מתוך חלל הגוף על ידי טרנס גוף הלחץ קיר (חץ). נסו לצמצם את "התפרצות" הקרביים על ידי יצירת חור קטן בגוף ברגע קיר 1 לפני דיסקציה (5.1.2). הכנה עם הקרביים גזור לפני הפעלת הכנה ולפנים (5.1.3). הכנה, everted בעיקר, עם סיכה (חץ) בתוך לומן של הכנה (5.1.4). השריר הוא עכשיו מבחוץ לציפורן היא מבפנים, עם הגוף קצת שומן trachioles המצורפת (5.1.5). הכנת רקמות גזור באופן מלא עם הגוף כמעט כל שומן trachioles גזור (5.1.6).
- חיים תיוג באמצעות אנטי HRP בבית NMJ הזחל. נציג W3 סינפסה הזחל עצב שריר עם סיומת גליה (מבפנים החוצה, הכנה). הנוירון המוטורי מסופי באוטון מסומנים עם ראשוני נגד הגוף מפני HRP (מג'נטה), אשר מצומדות כדי Cy5. התהליכים גליה מסומנים עם GFP (ירוק).
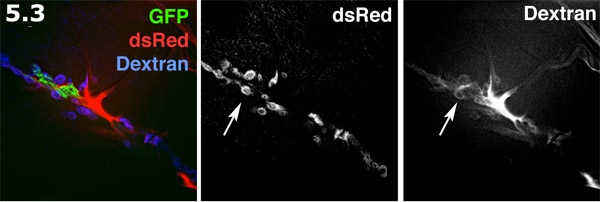
- מרחב Perisynaptic fluorescently דמיינו עם אלכסה 680 dextran בפנים החוצה הכנה. התהליך גליה (ירוק) מסומן עם GFP קרום ממוקדות. SSR הפוסט סינפטי על פני השריר (כחול) התווית dsRed. Dextran אלקסה (אדום) צורות מתרכז באזורים תאיים. לצבוע dextran צורות בריכות בצורת סופגנייה בחללים perisynaptic. תיוג dextran ו SSR שכותרתו dsRed יוצגו בגווני אפור. שים לב מרובים בצורת סופגנייה לצבוע בריכות המדגיש את החללים perisynaptic (חץ).
Access restricted. Please log in or start a trial to view this content.
Discussion
הליך זה מאפשר לטווח ארוך הדמיה של חלבונים שכותרתו לחיות תהליכים בתא. הכנה ברקמות באתרו שתיארנו יש CNS שלם ומתפקד, PNS ומעגלים רפלקס. זו הכנה רקמה יש יתרונות על פני תקן הזחל שריר פרוטוקולים לעוף, שבו השריר הזחל קיר הגוף נמתח (כאשר הוא ניצח בחוץ). מתיחה יכול לעוות מורפו?...
Access restricted. Please log in or start a trial to view this content.
Acknowledgements
פרויקט זה מומן על ידי CIHR ו NSERC. ברצוננו להודות Jusiak ברב לתרום ליצירת זני לטוס להביע SSR שכותרתו dsRed (קו ב"ג), ואת מתקן ביו הדמיה UBC.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | N/A | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma).2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph.References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes, Life Technologies | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearch | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes, Life Technologies | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tools | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum Technologies | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
References
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved