A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בשנת vivo Ca 2 + - הדמיה של נוירונים גוף אינפקטד במהלך הלמידה חוש הריח של דבורת הדבש
In This Article
Summary
דבורים יכול להיות מותנה פרדיגמה למידה תיאבון חוש הריח (PER מיזוג). באמצעות ריחות כמו גירויים, הקמנו שיטה שבה התנהגות נרשם ובמקביל הדמיה סידן משמשת למדידת פעילות ריח עורר בנוירונים גוף הפטרייה In vivo.
Abstract
In vivo למחצה בהכנת vivo הדמיה סידן פותחה במעבדה שלנו על ידי Joerges, קוטנר ואת גליציה לפני יותר מעשר שנים, כדי למדוד את פעילות ריח עורר באונה מחושים 1. מכאן ואילך זה כבר מעודן ברציפות להחיל neuropiles שונים במוח הדבורה. כאן, אנו מתארים את הכנת המשמש כיום במעבדה כדי למדוד פעילות הנוירונים בגוף הפטרייה באמצעות מצמידים dextran סידן רגיש צבע (Fura-2). אנו retrogradely כתם נוירונים גוף הפטרייה על ידי הזרקת צבע לתוך האקסונים שלהם או באזור סומה. אנו מתמקדים בהפחתת הפולשנות, כדי להשיג הכנה שבו עדיין אפשר לאמן את הדבורים באמצעות PER מיזוג. אנו מסוגלים לפקח לכמת את התגובה ההתנהגותית באמצעות הקלטה אלקטרו myograms של השריר השולט PER (M17) 2.
לאחר הניסוי פיזיולוגיים המבנים צילמו נחקרות ביתר פירוט באמצעות מיקרוסקופ סורק confocal לכתובת זהותו של הנוירונים.
Protocol
Bee הכנה לראש מילוי
- תפוס מלקטי מזון דבש דבורים אל הכוורת ומקררים על קרח immobilization.
- הר של פרספקס 3 חדרי הקלטה. תיקון עיניים החזה על הקירות של החדר הקלטה בשעווה נקודת התכה נמוכה קשה.
- משוך זכוכית נימים כמו נפוץ electrophysiology ולשבור בקצה להשיג בקוטר טיפ של CA. 10μm. כיסוי קצה של נימי עם לצבוע ולהדביק. הדבק דיי מורכב מתערובת של 10:01 Fura-2 dextran וליזין ניתן לתקן tetramethylrhodamine dextran.
- במשך ההליך מכתים לשתק אנטנות עם לפרטי פרטים או n-eicosane. הסר חתיכת לציפורן מעל המוח לדחוף בלוטות קנה הנשימה בצד כדי לאפשר גישה גוף הפטרייה.
- להזריק לתוך הנימים סומה או אזור axonal של נוירונים הגוף פטריות. ניתן לעשות זאת ביד חופשית או באמצעות מניפולטור מיקרו. ואז לשחזר פיסת לציפורן על הקפסולה הראש לשחרר אנטנות.
- הזנת דבורים עם פתרון סוכרוז 30% לפני אחסונם במקרה humidified לפחות ארבע שעות או יותר בלילה 20 ° C.
בשנת vivo הדמיה
- מניעת תנועות למשל דבורה עם חתיכה קטנה של ספוג כי הוא נלחץ הבטן קבוע עם קליפ או סרט לתא הקלטה.
- כדי למנוע תנועה של המוח הנובע שאיבה של הוושט, לחתוך חתך קטן לתוך לציפורן מעל labrum ולשלוף בזהירות הוושט ומבנים המקיפים שלה מוצק לשים את זה תחת מתח מבלי לפגוע הוושט 4. עם כיסוי סיליקון דו רכיבי.
- לעשות חורים עם מחט ולהכניס אלקטרודות חוט הקלטה של M17.
- הסר פיסת לציפורן, קנה הנשימה ובלוטות מעל המוח. תמצצי heamolymph בתוך הקפסולה בראש עם פיסת נייר.
- מלאו את הקפסולה עם ראש סיליקון דו רכיבי. חשוב המוח מכוסה לחלוטין.
- המקום דבורה על הבמה מיקרוסקופ ומקום טיפת מים על פני השטח של סיליקון כדי לטבול את המטרה מטבל של המיקרוסקופ לתוך אגל. פוקוס על נוירונים מוכתם.
ריח גירויים הקלטה של אותות
Olfactometer: אנו משתמשים במחשב מבוקר, גירוי אישית בנוי המכשיר, או "olfactometer" כפי שתואר לעיל על ידי גליציה ו וטר 3. ריחות הם מדולל לתוך זרם אוויר קבוע מכוונת האנטנות. כל גירוי מורכב הדופק -3 ריח של אוויר רווי ריח 0.2ml. פרוטוקול גירוי ניתן להגדיר TILLVision את תוכנת ההקלטה.
מיקרוסקופ והדמיה הגדרת: אנו משתמשים מיקרוסקופ פלואורסצנטי Zeiss. תמונות נרשמות 25 מעלות צלזיוס עם קצב הדגימה של 5 הרץ באמצעות מכשיר עד-Photonics הדמיה רכוב על המיקרוסקופ. אותות סידן נרשמים דרך X60, 0.9 W אולימפוס לטבול אובייקטיבי עם CCD Imago המצלמה (640x480 פיקסלים, 4X זרקת לפח על שבב כדי 160x120 פיקסלים). Fura-2 הוא נרגש עם אור מונוכרומטי של אורך גל 340 ו 380nm עבור מדידות ratiometric. Fluorescence מזוהה באמצעות מראה dichroic 410nm ו 440nm מסנן לעבור זמן רב. הפרמטרים של ההקלטה נקבעים בתוכנת הצריבה. מדידת משך כל 10s זמן חשיפה לשני אורכי הגל יכול להיות מותאם לעוצמת מכתים לקראת כל אחד.
M17 הקלטה: השריר מד של labium (M17) היא רשמה extracellularly לפקח על תגובות התנהגותיות הקשורות למידה, כלומר 5 אחוזים, 6. להזריק חוטי נחושת לתוך השריר קרוב חלקי הפה. הזרק אלקטרודה הקרקע לתוך העין. פוטנציאלים השריר הם מוגבר עם מגבר טרום אישית לבנות, ו דיגיטלית המאוחסן במחשב. תחילת Stimulus מופעלת על ידי olfactometer.
ניתוח נתונים
- במהלך הניסוי: ההקלטות של האות סידן מוזנים למחשב ומאוחסנים. TILLVision תוכנת הצריבה מאפשר בדיקה ראשונית של אותות, כמו חישוב היחס בין אורכי הגל (340nm/380nm) וחישוב deltaF (חיסור של הבסיס).
- עיבוד תמונה מבוצעת עם תוכניות נכתב מותאם אישית IDL. חישוב יחס של Ca 2 + אותות 340nm ו 380nm מדידות עבור כל פיקסל. קביעת רקע הקרינה (F) על ידי ממוצע של מעל מסגרות לפני הגירוי ואת לגרוע האות ratiometric (deltaF).
- כדי להגדיר אזור אינטרסים (ROI): חישוב ממוצע של מסגרות במהלך הגירוי ואת להחיל מסנן לעבור נמוכה (3X3px). המרת מידה אפור בקנה מידה צבע שווא. קביעת פעילות מבנים עצביים כמו כתמים פעילות בתמונות צבע שווא מגדירים את ההחזר על ההשקעה.
- חישוב הדינמיקה הזמני של האזורים הפעילים על ידי חישוב ממוצע הפיקסלים ההחזר על ההשקעה על פני כל המסגרות ללא סינון או תיקון.
> ניתוח לשיקום מורפולוגיים
יחד עם dextran Fura-2 אנחנו ממלאים את הנוירונים ניתן לתקן עם צבע rhodamine dextran ("מיני אודם"). צבעים לשניהם משקל מולקולרי דומה: הם צריכים להיות שותף נמצא הנוירונים. רחב בתחום ההדמיה מאפשר רק ברזולוציה מרחבית מוגבל מאוד, ולכן מומלץ לבדוק את המבנים מוכתם לאחר הניסוי באמצעות מיקרוסקופ סורק confocal.
- אחרי מדידות פיזיולוגיות, לנתח מוח לקבע.
- יש לשטוף ב PBS ו מייבשים בשלבים באתנול וברור salycilate מתיל.
- עבור מיקרוסקופיה confocal להטביע במוח salycilate מתיל.
- אנו משתמשים במיקרוסקופ TCS לייקה SP2. גל עירור הוא 543nm.
- אנחנו לסרוק את המוח עם אוויר או טבילה אובייקטיבי שמן ולהשוות את המבנים מוכתם נתוני הדמיה.
נציג תוצאות:
אם מכתים והכנת היה מוצלח, האות בסולם צבע שווא, למשל פטריות הגוף אלפא נוירונים באונה חיצוני, יכול להיראות כמו באיור 1.
התגובה ההתנהגותית (PER) ניתן לחשב את תדירות ספייק במהלך הגירוי מינוס תדירות ספייק לפני הגירוי (figure2).
המבנים מוכתם עשוי להיחקר ביתר פירוט באמצעות מיקרוסקופ confocal (figure3).

איור 1: נציג הדמיה סידן אותות (גירוי עם heptanal). ת: אזור הדמיה של המוח דבורה. ב ': תמונה פלורסנט גלם כמו לראות דרך X20 לטבול אובייקטיבי עירור באורך גל 380nm, את אלפא האונה של הגוף פטריות המתואר סגול. דיי היה מוזרק לשפה ventro-לרוחב של אלפא האונות להכתים הנוירונים החיצוניים. C: תמונת צבע שקר נגזר האות הממוצע, deltaF (340/380), גירוי במהלך שלוש השני; אלפא האונה המתוארות סגול, התווה ROI נבחרים שחור. D: הדינמיקה הזמני של האות סידן בתגובה לגירוי ריח, האות הממוצע מאזור ריבית כפי שמצוין ב C. E: הדינמיקה הזמני של האות סידן בתגובה גירוי סוכרוז של ipsi ו-קונטרה לרוחב אנטנה בהתאמה ROI המצוין ב C.

איור 2: תגובה נציג M17. לאחר מיזוג הריח הדבורה מרחיב את חוטם כאשר ריח מוצג ללא תגמול. הקו האדום מציין גירוי ריח. הבלעה: PER של דבורת דבש.
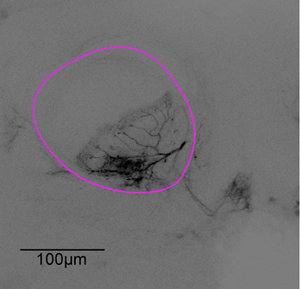
איור 3: מחסנית תמונה ייצוגית. לאחר הניסוי הדמיה מוחית היה גזור. הנוירון מדמות 1 נסרק באמצעות מיקרוסקופ confocal עם מטרה X20 שמן טבילה, אלפא האונה המתוארות סגול.
Discussion
במצגת זו אנו עברו את כל השלבים לחקור אותות סידן vivo של דבורת דבש. אנחנו מוחלים בטכניקה זו כדי נוירונים הגוף פטריות, אבל הדמיה ניתן לעשות על כל הנוירונים אשר טכניקה מכתים ניתן להקים. התמקדנו נוירונים במסלול חוש הריח של הדבורה דבש. הניסויים מתבצעים כל בחדר חושך....
Acknowledgements
עבודה זו ממומנת על ידי DFG.
Materials
| Name | Company | Catalog Number | Comments |
| low melting point hard wax Deiberit 502 | Dr. Böhme Schöps Dental GmbH | ||
| FURA-2 dextran potassium salt, 10 000 MW | Invitrogen | F-3029 | Protect from light. |
| tetramethylrhodamine dextran 10 000 MW | Invitrogen | D-3312 | Protect from light. |
| n-eicosane | Sigma-Aldrich | 21, 927-4 | |
| Kwik Sil Adhesive | World Precision Instruments, Inc. | KWIK SIL | |
| Imaging Set-up | TILL Photonics | ||
| CCD camera | Imago | ||
| CED | Texas Instruments |
References
- Joerges, J., Küttner, A., Galizia, C. G., Menzel, R. Representations of odors and odor mixtures visualized in the honeybee brain. Nature. 387 (6630), 285-288 (1997).
- Rehder, V. Quantification of the honeybee's proboscis reflex by electromyiographic recordings. J. Insect Physiol. 33, 501-507 (1987).
- Galizia, C. G., Vetter, R. S., Christensen, T. A. Optical Methods for Analyzing Odor-Evoked Activity in the Insect Brain. Methods in Insect Sensory Neuroscience. , 345-388 (2004).
- Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. J Neurophysiol. 69 (2), 609-625 (1993).
- Kuwabara, M. Bildung des bedingten Reflexes von Pavlovs Typus bei der Honigbiene Apis mellifica, Hokaido Univ. Zool. J. Sci. 13, 458-464 (1957).
- Bitterman, M. E., Menzel, R., Fietz, A., Schafer, S. Classical conditioning of proboscis extension in honeybees (Apis mellifera. Journal of Comparative Psychology. 97 (2), 107-119 (1983).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved