A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תיוג של פלורסנט תסיסנית לב מבנים
In This Article
Summary
כאן אנו מתארים פרוטוקול בסיסי תיוג הניאון של אלמנטים שונים של צינורות הלב של הזחל והמבוגר תסיסנית melanogaster. דגימות אלו הן היטב מתאים דימות באמצעות מיקרוסקופ פלואורסצנטי או confocal. טכניקה זו מאפשרת ניתוח מבני מפורט של התכונות של לבבות מן אורגניזם מודל עוצמה.
Abstract
Protocol
לפני שתתחיל
- הכן את הפתרונות הבאים:
- חיץ מרגיע (מלאכותי תסיסנית hemolymph (ADH) (ראה "לדמיין את הלב הפועם תסיסנית") המכיל 10 mM EGTA)
- מקבע (פורמלין 4% 1x PBS)
- PBSTx (PBS המכיל 0.1% Triton-X-100)
- מדולל כראוי נוגדנים ראשוניים מינים ספציפיים משני שכותרתו fluorescently ב PBSTx
- לנתח תסיסנית לחשוף את צינורות הלב (של זבובים בוגרים ו / או זחלים) הבא
- חצי שלם הכנה תסיסנית לב פרוטוקול "לדמיין את הלב הפועם תסיסנית", או
- תסיסנית הזחל NMJ Dissection פרוטוקול 1 בשינויים הבאים: השתמש מחומצן ADH במהלך דיסקציה הזחל וכן לעקור את הסיכה האחורי מעט קו האמצע הגחון. הזחלים נחתכים לאורך קו האמצע הגחון. אין להסיר את כל רקמת לפני קיבעון.
פלורסנט מכתים
- בדוק כי כל הלבבות הם בקצב פועם ADH מחומצן. מהר להחליף ADH עם מרגיעה חיץ. לבחון כל צינור לב כדי להבטיח התכווצויות מעוכבים.
- תקן את ליבם על ידי החלפת חיץ מרגיע עם מקבע. דגירה בטמפרטורת החדר למשך 20 דקות עם רעד עדין. (לקבלת לוחץ הכנה הזחל אין צורך בשלב כלשהו, יכולה להיחשב מזיק שלמות רקמת לב).
- לשטוף דגימות שלוש פעמים במשך עשר דקות עם PBSTx בטמפרטורת החדר עם רעד מתמשך.
- למבוגרים, בזהירות לקצץ שוב את הקצוות הגחון של לציפורן בטן כזאת מה שנותר הוא אליפטי יותר מעוגל פחות. בנוסף, עם חתך בודד בין הבטן לבין בית החזה, בזהירות למשעי נפרדים בשני מגזרים הגוף להבטיח נזק מינימלי באזור הקדמי של הלב. עבור לבבות הזחל, בזהירות להסיר את השומן בגוף באמצעות מלקחיים בסדר. הסרת שומן חייב להתבצע בזהירות רבה, שכן לב הזחל הוא שברירי במיוחד ויש לו תמיכה מועטה מאוד שרירים אחרים או רקמת חיבור. אין להסיר את הענפים קנה הנשימה כמו זה עלול לגרום נזק ללב.
- מעבירים את אזור הגב גזוז לציפורן של הבטן על ידי הקצוות, הימנעות ממגע עם הצינור לב במיקום מרכזי, לתוך צלחת 96 היטב עם בארות המכילים 50-100 μl של נוגדן ראשוני מדולל PBSTx. המקום לא יותר מ 12 דגימות בכל טוב. דגירה בטמפרטורת החדר למשך 2 שעות עם תסיסה מתמדת. דגירה יכול להיעשות גם בין לילה ב -4 ° C.
- הסר פתרון נוגדן ראשוני. לשטוף את הלבבות שלוש פעמים במשך עשר דקות עם PBSTx 100 μl בטמפרטורת החדר עם רעד מתמשך.
- בעקבות הסרת החיץ לשטוף הסופי, להוסיף 100 μl של נוגדנים משני PBSTx, בתוספת Alexa594-phalloidin (1:1000). דגירה במשך שעה אחת עם רעד מתמשך בטמפרטורת החדר. שמור דגימות מכוסה כדי למנוע הלבנת fluorophore.
- לאחר דגירה משנית, לשטוף את הלבבות שלוש פעמים במשך עשר דקות עם 100 μl של PBSTx בטמפרטורת החדר עם רעד מתמשך. שמור את דגימות מכוסה בכל הצעדים כביסה.
- למען הסר של טריטון-X-100, יש לשטוף את ליבם בפעם האחרונה בשנת 100 μl של PBS למשך 10 דקות. דגימות ניתן לאחסן בחושך על 4 מעלות צלזיוס במשך כמה ימים לפני הרכבה.
הרכבה של לבבות למבוגרים
- ציית two 18 x 18 מ"מ מכסה מחליק כדי להחליק מיקרוסקופ עם 10 μl של המדיום Vectashield גובר. Coverslips צריכה להיות מחולקת ~ 10-15 מ"מ זה מזה. המקום טיפה קטנה של third הרכבה בינונית, בין שתי coverslips.
- מקום 20 μl של Vectashield במרכז coverslip שלישי.
- בזהירות להסיר כל הלבבות מפתרון לשטוף PBS על ידי הקצוות הקיצוניים של לציפורן, ומניחים בעדינות להם לב בצד למטה על ירידה של המדיום גובר על coverslip השלישי. המקום לא יותר מחמישה לבבות לכל טיפה על coverslip.
- בדוק תחת מיקרוסקופ כדי להבטיח לבבות כל פונה כלפי מטה.
- בזהירות להפוך את coverslip המכיל את הלבבות במהירות למקם אותו על השקופית המכילה את צמד coverslips כזה אגל עם נתיכים צינורות לב עם אגל Vectashield בין זוג coverslip. "גשר" צריך להיות שנוצר על ידי coverslips. לבבות יושעה בין coverslip לבין שקופיות מיקרוסקופ.
- בדוק תחת מיקרוסקופ כדי להבטיח ליבם כי הם עכשיו פונה כלפי מעלה.
- תקן coverslips בקצוות שלהם עם לק.
- לבבות מוכנים כעת להיות צילמו באמצעות מיקרוסקופ פלואורסצנטי או confocal.
ילדה = "jove_title"> הרכבה עבור לבבות הזחל
- המקום טיפה (~ 20 μl) Vectashield בשקופית מיקרוסקופ.
- להעביר בזהירות עד שתי דגימות הזחל אל צד להם Vectashield ו להתמצא הגב למטה באמצעות מחטים טונגסטן.
- בנפרד לגרור את דגימות מתוך המדיום הרכבה וליישר כל במקביל.
- מניחים coverslip על צדדים מנוגדים של הדגימה. בעזרת מלקחיים, במקום השלישי coverslip העליון, תחילה על ידי הנחת צד אחד על coverslip האחורי והורדת אותו עד coverslip הקדמי ובכך ליצור גשר. כוחות נימי יגרום לזרימת Vectashield מן האחורי אל הקדמי אשר מסייע יישור תקין של הלב הזחל.
- תקן כל coverslips במקום, בקצוות שלהם, עם לק בזהירות למלא את החלל בין coverslips עם Vectashield 20-30 μl.
- חותם עם לק ולאחסן ב 4 ° C, או לצורך אחסון לטווח ארוך ב -20 ° C.
נציג תוצאות
כאשר מבוצע כראוי, את כל המרכיבים והרקמות הקשורים כלי הגבי צריך להישאר שלם להיות דמיינו בקלות. הקרינה רקע צריך להיות מינימלי. למבוגרים, הגחון האורך שכבת השריר כתמים היטב מייצר אות ממשי (איור 1 ואיור 2). Cardiomyocytes מעגלי הבסיסית לעומת זאת, נוטים שלא להפיק אות אינטנסיבי כמו זה של השכבה שמעליה הגחון. Myocytes של "תא חרוטי" הקדמי של הלב למבוגרים מכילים כמות משמעותית של חומר כויץ, וכתוצאה מכך, האזור הזה מופיע ביחס החזקה ביותר שארית הצינור לב. הלב הזחל מראה ההסדר מתפתלת myofibrillar דומה לזה של cardiomyocytes כויץ מבוגר (איור 3).
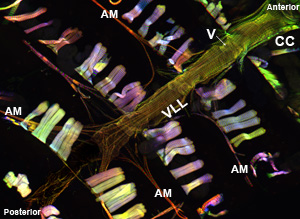
איור 1: למעלה. מיקרוסקופ פלואורסצנטי מראה את הצינור כולו לב של מבוגר תסיסנית melanogaster המבטא שרירן-GFP. התמונה צולמה עם מיקרוסקופ Imager Z1 Zeiss פלורסנט מצויד מודול הזזה Apotome. שרירן-GFP מוצג בירוק, אקטין הוא מוכתם AlexaFluor ® 594 phalloidin (אדום) α-actinin מתויג עם נוגדן אנטי-α actinin (כחול). הערה הליך preparative היתרי התאוששות של דגימות לב עם המבנים השתמרו היטב. CC = חרוטי קאמרית: AM = שריר כנפי: V = שסתום פנימי; VLL = שריר הגחון שכבת האורך. בוטום. באזור של הצינור לב מבוגר מ CC דרך קטע הבטן 3 הלב פשוט מתחת לשכבת אורך הגחון מראה את ההסדר מתפתלת myofibril של cardiomyocytes התכווצות. אנא לחץ כאן עבור גרסה גדולה יותר של איור 1a ו כאן עבור גרסה גדולה יותר של דמות 1b
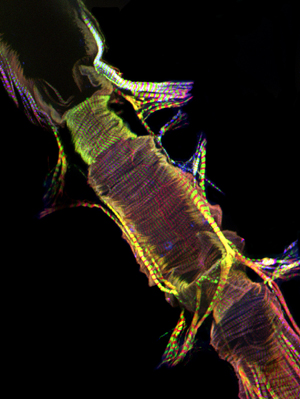
איור 2: ערימות confocal נציג החלק הקדמי של הלב המבוגר מוכתם AlexaFluor ® 594 phalloidin (אדום) אנטי Pericardin (קולגן מסוג IV) (ירוק) נוגדן. Pericardin קשורה בלב פני השטח הגחון, סביר להניח שמקורו myofibrils אוריינטציה longitudinally של שכבת השריר הגחון. אנא לחץ כאן עבור גרסה גדולה יותר של הדמות 2.

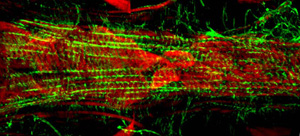
איור 3: מיקרוסקופ פלואורסצנטי של קטע A7 הלב התקין של הזחל שלושה שלבים תסיסנית. התמונה צולמה עם מיקרוסקופ Imager Z1 Zeiss פלורסנט מצויד מודול הזזה Apotome. אקטין התווית AlexaFluor ® 594 phalloidin (ירוק) ו α-actinin הוא מוכתם נוגדן אנטי-α actinin (אדום). אנא לחץ כאן עבור גרסה גדולה יותר של הדמות 3.
Access restricted. Please log in or start a trial to view this content.
Discussion
כאן אנו מציגים פרוטוקול שימושי עבור הכנת מכתים את כלי melanogaster תסיסנית הגב ורקמות הקשורים עבור דימות באמצעות מיקרוסקופ פלואורסצנטי או confocal. אנו מספקים דיווח תמציתי על הפעולות מעודן על ידי והעסיק נפוץ מכתים יעיל המאפשר היטב נפתרה הדמיה באתרו של הזחל והמ?...
Access restricted. Please log in or start a trial to view this content.
Acknowledgements
המחברים מודים SI ברנשטיין (סן דייגו סטייט) לקריאה ביקורתית הצעות מועילות לגבי הכנת כתב היד הזה. עבודה זו נתמכה על ידי NIH מענקים SI ברנשטיין, SDSU, וכן ר בודמר, BIMR, ועל ידי אחווה פוסט דוקטורט מ שותפים המערבי הברית של איגוד הלב האמריקני אל G. Vogler ו א Cammarato.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
References
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. The internal anatomy and histology of the imago of Drosophila melanogaster. , Wiley. New York. (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , Academic Press. New York. (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved