A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השתלת קנה הנשימה Heterotopic ו orthotopic ב עכברים משמשים מודלים לחקר התפתחות המחלה Airway סותם
In This Article
Summary
וידאו זה מציג ומשווה שני דגמים ניסיוניים ללמוד על התפתחות המחלה בדרכי הנשימה סותם (OAD) בעכברים, במודל heterotopic ו orthotopic השתלת קנה הנשימה.
Abstract
סותם דרכי הנשימה מחלות (OAD) היא הסיבוך העיקרי לאחר השתלות ריאות שמגבילה ההישרדות לטווח ארוך (1-7).
כדי לחקור את פתופיזיולוגיה, טיפול ומניעה של מודלים שונים של בעלי חיים OAD השתלת קנה הנשימה במכרסמים פותחו (1-7). כאן, אנו משתמשים בשני דגמים הוקמה של השתלת קנה הנשימה, את המודל heterotopic ו orthotopic ולהפגין יתרונות ומגבלות.
עבור המודל heterotopic, התורם הוא עטוף לתוך קנה הנשימה omentum גדולה יותר של הנמען, ואילו התורם קנה הנשימה הוא anastomosed ידי השקה end-to-end במודל orthotopic.
בשני המודלים, התפתחות נגעים סותם היסטולוגית דומה OAD קליניים הוכח (1-7).
וידאו זה מראה כיצד לבצע את שניהם, heterotopic כמו גם את הטכניקה orthotopic השתלת קנה הנשימה אצל עכברים, ומשווה את מהלך הזמן של התפתחות OAD בשני מודלים באמצעות היסטולוגיה.
Protocol
- זכר Balb / C עכברים (8-12 שבועות) נרכשים מבית מעבדות צ'רלס ריבר (Sulzfeld, גרמניה). העכברים הם שוכנו בתנאים רגילים, נמאס מזון רגיל עכברים כרצונך מים.
- Isofluran 2% משמש הרדמה.
תורמים הכנה
- לגלח את שיער הבטן לחטא את האזור באמצעות betaisodona.
- תחת נוף מיקרוסקופי, לבצע חתך צוואר הרחם קו האמצע מהרמה של הגרון אל עצם החזה.
- הסרת שומן תת עורי ושרירי הרצועה כדי לקבל תצוגה ברורה של קנה הנשימה.
- מנתחים את קנה הנשימה מכל הרקמות הסובבות, כמו הוושט, עצבים, עורקים, ורקמות החיבור.
- הסר את כל קנה הנשימה (מתוך הגרון אל הסתעפות).
- פלאש ההשתלה עם מי מלח קרים בחנות שתל ב 4 ° C.
- התורם הוא מורדמים על ידי נקע בצוואר הרחם לאחר הקציר של קנה הנשימה.
נמען: השתלת HETEROTOPIC
- לגלח את השיער בטן בהפרש גדול סביב האתר חתך ולחטא את האזור שלוש פעמים באמצעות betaisodona (בבטאדין) ואחריו אלכוהול. עיניים צריכים להיות משומנים עם מוצר משחה עיניים כדי למנוע את קרניות מהתייבשות.
- בצע laparotomy החציוני והמקום המעי לתוך כפפה, סטרילי moistured.
- מורחים את omentum יותר בזהירות. מניחים את השתל לתוך המרכז לקבע אותו עם תפר יחיד באמצעות 8-0 (Prolene, Ethicon, גרמניה).
- לכסות באופן מלא את ההשתלה עם omentum יותר לתקן את השתל עם תפר אחד 8-0 (Prolene, Ethicon, גרמניה).
- מקמו מחדש את המעיים בחזרה לתוך הבטן מיושר עם מלוחים, חמימים סטרילי לפני הסגר.
- תקריב ב 2 שכבות - דופן הבטן ואת שכבת העור עם דפוס מתמשך באמצעות 7-0 Prolene עבור השריר ואת 7-0 Vicryl לעור.
נמען: השתלת orthotopic
- לגלח את השיער בטן בהפרש גדול סביב האתר חתך ולחטא את האזור שלוש פעמים באמצעות betaisodona (בבטאדין) ואחריו אלכוהול. עיניים צריכים להיות משומנים עם מוצר משחה עיניים כדי למנוע את קרניות מהתייבשות.
- מחלקים את רצועת שרירים כדי להמחיש את מורכבות laryngotracheal כולו.
- בזהירות לנתח את קנה הנשימה של הרקמות הסובבות, לדאוג לשמר את העצבים חוזרות בגרון.
- מחלקים את קנה הנשימה שלוש טבעות הזנב בין cricoid. חיה שומרת הנשימה הפיזיולוגי באמצעות צינורית הנשימה.
- ודא נקי קצוות קנה הנשימה של הנמען, כמו גם השתל.
- השתל הוא התערב בין הפגמים הנמען קנה הנשימה ואת חוקיים כדי לשמור על קוטביות אנטומיים.
- שימוש 8-0 (Prolene, Ethicon, גרמניה) anastomose את השתל מתורם עם דיסטלי (mediastinal) קנה הנשימה. ההיבט האחורי של השקה מתבצע באופן רציף ריצה. ההיבט הקדמי הושלם ולאחר מכן באמצעות תפרים קטע.
- הסר את כל הפרשות דרכי הנשימה.
- השקה הפרוקסימלי הושלמה אז באותו אופן כמו אחד דיסטלי.
- להבטיח שלמות של דרכי האוויר והנשימה נאותה, ספונטנית.
- מקמו מחדש את השרירים רצועת ולסגור את הרקמה התת עורית ועל שכבת העור באמצעות 6-0 תפרים (Vicryl, Ethicon, גרמניה) עם דפוס מתמשך.
- השתמש הרדמה זריקה של הנמען, ולכן החיה ישמרו הנשימה הפיזיולוגית דרך קנה הנשימה. שילוב של 75/1/0.2 מ"ג / ק"ג של propofol, medetomidine ו פנטניל, בהתאמה, משמש הרדמה ip בעכברים.
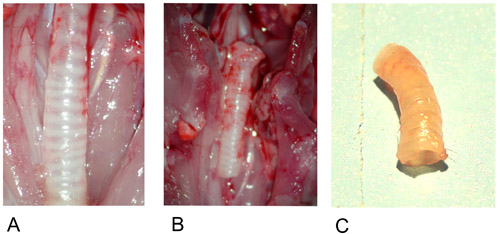
איור 1: תורמים קנה הנשימה.
1A: תורמים קנה הנשימה באתרו לאחר הכנה.
1B: קנה הנשימה התורם נכרת.
1C: תורמים קנה הנשימה לאחר explantation.
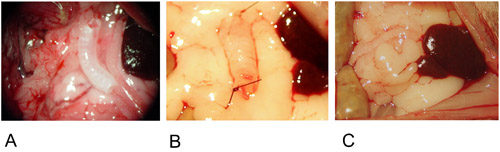
איור 2: דגם Heterotopic.
2A: השתל ממוקם במרכז של omentum יותר.
2B: שתל קבוע בשני הקצוות עם תפר אחד.
2C: שתל הוא עטוף לתוך omentum יותר קבוע עם תפר אחד.
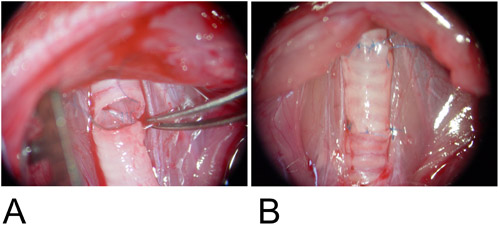
איור 3: דגם orthotopic.
3A: שתל הוא התערב בין הפגמים הנמען קנה הנשימה לבין הקיר האחורי הוא anastomosed באופן ריצה רציפה.
3B: הקיר הקדמי הושלם באמצעות תפר אחד.
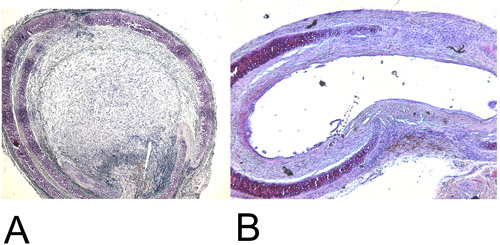
איור 4: היסטולוגיה.
4A: ששוחזרו קנה הנשימה להשתיל heterotopic לאחר 28 ימים + H E staining (15x). שים לב הכחדה luminal 100%.
4B: ששוחזרו קנה הנשימה להשתיל orthotopic לאחר 60 ימים של H + E מכתים (15x). מקסימלי הכחדה luminal השיגה כ 45%.
| Heterotopic השתלת קנה הנשימה דגם | Orthotopic השתלת קנה הנשימה דגם | |
| יתרונות | + קל לבצע + הכחדה לומינל עם חסימה בדרכי האוויר מלא לאחר 28 ימים + אין חיבה פיזית של בעלי חיים על ידי OAD | + אוורור פיזי של השתל + והתרופות בשאיפה אפשרי + התגובות החיסוניות חזקות כגון ייצור נוגדנים IgM alloreactive + המילייה החזי פיזיולוגיים + קנה הנשימה קנה הנשימה, השקה מחקה את ההגדרה הקלינית |
| חסרונות | - אין אוורור של קנה הנשימה להשתיל - אין הערכה של פתוגנים בשאיפה אפשרי - עיכוב של פינוי mucociliary וההפרשות שמר - Microenvironment פריטוניאלית במקום המילייה החזי | - הכשרה כירורגית הכרחי - הכחדה לומינל המונה חסימה luminal. 45% לאחר 60 ימים - בעלי חיים עלולים לפתח תסמינים של OAD |
טבלה 1: יתרונות וחסרונות של השתלת קנה הנשימה Heterotopic ו orthotopic.
Discussion
עכברים זמינים transgeneic שונים מודל בנוקאאוט, ומתאים אפוא ללמוד מכניסטית שאלות הקשורות OAD (4).
שני הדגמים של השתלת קנה הנשימה המוצג בסרטון זה יכול לשמש כמודל אמין לחקר התפתחות OAD.
עם זאת, מודל זה מדגים את יתרונות ומגבלות.
השת?...
Disclosures
סוניה Schrepfer קיבל מענק מחקר של דויטשה Forschungsgemeinschaft (DFG) (SCHR992/3-1).]
כל החיות קיבלו טיפול אנושי מתיישב עם עקרונות של טיפול בבעלי חיים מעבדה, ניסויים בבעלי חיים בוצעו בהתאם להנחיות והתקנות שנקבעו על ידי האגודה הלאומית למחקר רפואי המדריך לטיפול ושימוש בחיות מעבדה שפורסם על ידי המכונים הלאומיים לבריאות (National Institutes of Health פרסום 85-23, מתוקנת 1985).
כל החיות התקבלו צ'ארלס ריבר מעבדות (Sulzfeld, גרמניה) נשמרו על מרכזים בעלי חיים של החולים האוניברסיטאי בהמבורג Eppendorf. החיות קיבלו תקן ושולחת כרצונך מים המודעה.
Acknowledgements
המחברים מודים כריסטיאן Pahrmann (Lab Manager).
References
- Adams, B., Berry, G., Huang, X., Shorthouse, R., Brazelton, T., Morris, R. Immunosuppressive therapies for the prevention and treatment of obliterative airway disease in heterotopic rat trachea allografts. Transplantation. 69, 2260-2266 .
- Adams, B., Brazelton, T., Berry, G., Morris, R. The role of respiratory epithelium in a rat model of obliterative airway disease. Transplantation. 69, 661-665 .
- Deuse, T., Schrepfer, S., Reichenspurner, H., Hoyt, G., Fischbein, M., Robbins, R., Pelletier, M. Techniques for experimental heterotopic and orthotopic tracheal transplantations – when to use which model; Transplant Immunology 17. , 255-261 (2007).
- Hele, D., Yacoub, M., Belvisi, M. The heterotopic tracheal allograft as an animal model of obliterative bronchiolitis. Respiratory Research. 2, 169-183 .
- Hertz, M., Jessurun, J., King, M., Savic, S., Murray, J. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways. American Journal of Pathology. 142, (1993).
- McDyer, J. Human and murine obliterative bronchiolitis in transplant. Proceedings of the American Thoracic Society. 4, 37-43 .
- Schrepfer, S., Deuse, T., Hoyt, G., Sheikh, A., Hoffmann, J., Reichenspurner, H., Robbins, R., Pelletier, M. Experimental orthotopic tracheal transplantation: the stanford technique. Microsurgery. 27, 187-189 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved