A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בשנת vivo, כמו תרבות Wholemount Murine Organotypic רשתית
In This Article
Summary
מאמר זה מדגים וידאו הקמת organotypic תרבויות wholemount הרשתית הליך cytospin לניתוח תופעות המושרה exogenously. Organotypic תרבויות wholemount רשתית לחקות את In vivo המצב להקל באופן משמעותי את הנגישות של הרשתית Murine עבור מניפולציות ניסיוני תוך עקיפת והחסרונות של קלאסית במודלים של בעלי חיים Murine.
Abstract
כריתה ממוקדת של גנים ואנליזה של מודלים של בעלי חיים היא האסטרטגיה הקלאסית עבור להרשם ספציפיים פונקציה גן הרשתית. עם זאת, מהונדס, הרשתית ספציפי או מותנה עכבר מודלים בנוקאאוט לעתים קרובות להציג הקטלניות מוקדם או סובלים ממומים קשים, מניעת ניתוח מעבר בשלבים עובריים או לאחר לידה מוקדמת.
תרבית תאים ראשונית מהווה חלופה כדי לחקור את ההשפעות של גורמים exogenously רקומביננטי מיושם, overexpression של גנים או siRNA בתיווך מציאה גן בסביבה מבוקרת. תרבית תאים ניתק יש את היתרון כי אותות אנדוגני להגיע לתאי היעד מופחתים, ובכך להקל על זיהוי תופעות מופעלות exogenously לאחר מניפולציה תרופתי. עם זאת, חשוב תאים תאים אינטראקציות נהרסים בתחילה על ידי עיכול אנזימטי או ניתוק מכני, גם אם מחדש מצטברים תרבויות retinospheroid 1 משמשים.
לעומת זאת, organotypic תרבויות wholemount רשתית לספק מערכת קרוב פיזיולוגיים במצב vivo עם אינטראקציות קשרים עצביים 2-5 נשמר עדיין.
במאמר זה אנו מספקים וידאו צעד אחר צעד הפגנה של הממסד (1) in vivo של דמוי organotypic תרבויות wholemount ברשתית כולל מוזרויות דיסקציה של העיניים Murine עובריים, לאחר הלידה למבוגרים ו (2) הליך התנתקות cytospin לניתוח של נוירונים אפופטוזיס ובחלוקה של תאים ברשתית ב wholemounts organotypic, למשל אחרי התרבות בנוכחות exogenously גורמים רקומביננטי מיושם.
Protocol
כל הציוד ריאגנטים צריך להיות סטרילי לרכוש או צריך להיות חום או קיטור מעוקר או מעוקר עם ETOH 70%.
המדינה המחברים כי ניסויים בבעלי חיים בוצעו בהתאם הקהילות האירופיות Council Directive (86/609/EEC), בעקבות הנחיות של NIH לגבי טיפול השימוש בבעלי חיים הפרוצדורות והתקנות שנקבעו על ידי בעלי חיים המוסדי טיפול השתמש הוועדה (IACUC) באוניברסיטת דואיסבורג-אסן (גרמניה).
חלק 1: Enucleation העיניים Murine של שלבי התפתחות שונים
Enucleation העיניים עובריים
- הזדווגויות זמן בהריון הן להגדיר את הבוקר של היום שבו תקע הנרתיק מזוהה ההזדווגות הנקבות מיועדת 0 יום ההריון.
- הנקבה בהריון היא הקריבה על ידי נקע בצוואר הרחם, כאשר התפתחות העוברים הגיע השלב הרצוי (כאן: יום עובריים (E) 15) קבוע על שעווה לוח 6.
- דופן הבטן היא טבולה ETOH 70%, לחתוך לאורך קו האמצע לבין דשי העור קבועים רוחבית של 6 פינים.
- Uterusses יוסרו מן הבטן, מנותקת והועברו מבחנה עם PBS קר 6.
- עוברים מופרדים, הועבר צלחת פטרי קיר הרחם והקרומים עובריים יוסרו בקפידה על ידי שימוש במלקחיים 6.
- עוברים נהרגים על ידי עריפת ראש.
- העיניים הן enucleated להיות בשימוש, מלקחיים בסדר מעוקל, "פילינג" העיניים של ארובת העין.
Enucleation העיניים הלידה למבוגרים
- גורים צעירים נהרגים על ידי, עריפת ראש גורים גדולים ומבוגרים על ידי נקע בצוואר הרחם.
- עד שלב הלידה p15, נקודת הזמן שבו עכברים לפקוח את עיניהם, חרכים לעיניים יש להיפתח באופן מכני על ידי שימוש במלקחיים והורחב על ידי שני חתכים רוחביים של העפעפיים העין במספריים האביב.
- העיניים הן enucleated על ידי עזרה של מלקחיים מעוקל, הפעלת לחץ על מסלול.
הערה: בכל יום לאחר הלידה 2, עצמות מסלולית עדיין סחוסי, חשוב לא להפעיל לחץ רב מדי בעת שניסה להסיר את העיניים.
לעומת זאת, בעכברים בוגרים, העצמות הן מסלולית המשרד. לפיכך, על מנת enucleate בעיני זה מספיק כדי להפעיל לחץ על מסלול ללא הגדלת חרכים לעיניים מראש.
חלק 2: Dissection של הרשתית Murine עובריים, לאחר הלידה למבוגרים
Dissection של הרשתית
- העיניים ממוקמות בתוך צלחת פטרי קטנה עם סטרילי PBS ואת שכבות העין מסביב מוסרים תחת מיקרוסקופ לנתיחה.
- כדי להסיר את שכבות העין החיצונית, בשלבי הלידה ועיניים המבוגר עצב הראייה צריכה להיות מנותקת על ידי עזרה של מספריים באביב או לבטל צבט ידי מלקחיים כמו לסגור את הבסיס האפשרי.
- הפעל את העין, כך הצד האחורי עם חור שבו עצב הראייה התגוררו במקור הוא פונה אליך. הזן את החלל subretinal בין הרשתית לבין אפיתל הפיגמנט בקצות שני מלקחיים יפה מאוד מהאתר שבו עצב הראייה חדרה שכבות העין.
הערה: בדרך כלל, אפיתל הפיגמנט ניתן לזהות בקלות לפי צבעו הכהה. בכמה זני עכבר מוטנטי - בעיקר אצל בעלי חיים לבקנים - זו שכבת פיגמנט עשויים עם זאת, לא להיות בצבע ולכן לא ניתן לזהות בקלות. - הסר את אפיתל הפיגמנט עם קרום דמית העין sclera מצורף בקפידה על ידי קריעה צד עם מלקחיים שניהם.
- לקלף את השכבות עד לרמה של הקרנית, ולאחר מכן להפוך את הכוס עין לצד העדשה להסיר את הקרנית יחד עם פיגמנט האפיתל, קרום דמית העין והלחמית, בעוד מחזיק את כוס הרשתית הנותרים על ידי מלקחיים אחרות.
- אחוז זגוגי יחד עם עדשה קטנה תוך קריעת עם מלקחיים, לשמור על wholemount הרשתית במקום עם מלקחיים השני.
הערה: כאשר מנתחים את העיניים עובריים, הקפד להסיר לחלוטין את משולש, דמוי אוהל מתחת מקלעת נימי הגוף הזגוגי יחד עם הזגוגית.
בעיני המבוגרים, הזגוגית צריך להיות תפס בצדדים טיפול יש לקחת לא הזגוגית לחדור בקצות מלקחיים כמו התוכן שלה הוא צמיג ומקלות על מלקחיים, פוגע הסרתו. - במשך תרבות wholemount organotypic כוסות הרשתית נאספים צלחת 96-היטב המכיל 200 בינוני μl שונה Dulbecco של הנשר (ראה להלן).
הערה: בין דיסקציה של הרשתית בודדים, להשאיר את צלחת 96-גם אוסף המכיל את המדיום תרבות בחממה כמו ה-pH של המדיום תרבות מופעלת על ידי ה-CO 2 באמצעות מערכת קרבונט.
חלק 3: Murine wholemount רשתית organotypicתרבות
- הכן 500 מ"ל ידי בינוני תרבות שונה שקלול 7.8g Dulbecco של הנשר / תערובת מזין F-12 HAM (DMEM) ו 0.6g NAHCO 3 והמסה הן מים MiIliQ. התאם את ה-pH על 7.15. הוסף 50 מ"ג apo-transferin, 50μl putrescin (מניות: 60mg/ml), נתרן סלניום 50μl (מניות: 52μg/ml), פרוגסטרון (מניות: 60μg/ml), ו - 2.5 מ"ל gentamicine (200 מ"מ) מתחת למכסה המנוע. לערבב ולסנן דרך פילטר בראש הבקבוק. מיד לפני השימוש להוסיף גלוטמין 10μl (200 מ"מ) לכל מדיום תרבות מ"ל.
הערה: בינוני בסרום ו אינסולין ללא יכול להיות מאוחסן על 4 מעלות צלזיוס עד 2 שבועות המשמשים בניסויים אינדוקציה אפופטוזיס כמו אינסולין לא מנטרל את ההשפעות. אם הדגירה של wholemounts יותר מ 24 שעות הוא הרצוי ומוות שיעורי התא לא תוערך, סרום אינסולין (למשל העובר עגל בסרום; FCS) או תוספי יש להוסיף כדי לשפר את שיעורי ההישרדות. - לפני שמתחילים את התרבות, wholemounts הרשתית הם מראש מודגרות במשך 15 דקות ב 37 מעלות עם 200 μl חם, pH מאוזן DMEM המכיל hyaluronidase 0.5mg/ml מראש לעכל את hyaluronidase המכיל קרום הגבלת הפנימיים והחיצוניים של גליה ller M תאים, חדירה של חומרים להקל להחיל exogenously.
- הרשתיות מועברים צלחת 24 גם עם hyaluronidase כמו מעטים ככל האפשר ותרבותיים כמו wholemounts organotypic ב 2ml הגדרה כימית מדיום שונה נשר של Dulbecco.
הערה: העברת הרשתית, השתמש פיפטה 1ml וחתך את קצה פיפטה כמה מילימטרים כדי להרחיב את הפתח. עבור העיניים עובריים, טיפ 200 פיפטה μl מספיק. קצוות חיתוך צריך להיות והחלקתי על ידי החדרת מתפתל של קצה פיפטה השני.
במשך 24-48 שעות לטווח קצר תרבויות, כל השלבים יכול להתבצע על הספסל, אבל אם זיהום של תרבויות מתברר שיש בעיה, צריך לעבוד מתחת למכסה המנוע. - תרבויות נשמרות במשך 24-48 שעות ב 37 ° C באווירה 5% CO 2 ו למשל נתון טיפול תרופתי עם גורמים רקומביננטי.
חלק 4: דיסוציאציה של wholemounts רשתית תרבותי
- לאחר זמן תרבות הרצוי, הרשתית נאספים צינורות 2ml Eppendorf עם תחתית עגולה המכילה 850 μl PBS ו 50 μl שור בסרום albumine (BSA, 30 מ"ג / מ"ל).
- המקום צינורות Eppendorf עם הרשתיות לגוש חימום, התחממו על 37 ° C.
- הוסף 25 μl collagenase (200 U / ml) ו - 25 hyaluronidase μl (20mg/ml) על צינור אחד Eppendorf ולהתחיל dissociating לתוך הרשתית ההשעיה תא בודד על ידי 3 עובר siliconized פיפטה פסטר.
- הוסף 10 μl טריפסין (1mg/ml), להמתין 3-5 דקות, ואז לאט לאט פיפטה 3-5 פעמים למעלה ולמטה עם siliconized פיפטה פסטר כדי לנתק את הרקמה באופן מכני.
- הוסף 10 μl DNase אני (5mg/ml), שוב להמתין 3-5 דקות, ואז לאט לאט פיפטה 3-5 פעמים למעלה ולמטה עם siliconized פיפטה פסטר.
הערה: זמן הדגירה של דיסוציאציה האנזימטית משתנה תלוי בגודל של העיניים ואת השלב ההתפתחותי, בהתאמה. בדוק את שלב עיכול אנזימטי של הרקמה על ידי pipetting בעדינות מעלה ומטה. - אם ההשעיה התא אינו הומוגני עד עכשיו אבל עדיין מכיל תא מרכזי אגרגטים, להוסיף טריפסין נוספים μl 10 ו 10 μl DNase I.
- כאשר ההשעיה התא הוא הומוגני, עיכול של רקמת הוא נעצר על ידי תוספת של 10 μl EDTA (0.5 מ '), צינורות Eppendorf יוסרו מן התנור ואת השעיות תא קבועים עבור 1h על ידי תוספת של paraformaldehyde 1ml טריים, קרח קר 8% (PFA) בטמפרטורת החדר על סיבוב שייקר.
חלק 5: כביסה של המתלים התא ניתק
- המתלים התא centrifuged 5 דקות ב 4 ° C ו ב RCF 0.2 בצנטריפוגה קירור.
- Supernatant הוא מושלך לבין גלולה מחדש תלויה 1ml PBS המכיל 3mg/ml BSA.
- לאחר שחזר הפעולות כביסה פעמיים, גלולה הוא סוף סוף מחדש תלויה 500 μl PBS המכיל 3mg/ml BSA, EDTA 5mm ו אזיד הנתרן 0.1%.
הערה: תוספת של חומצה נתרן לאפשר אחסון של השעיה התא במשך כמה ימים בבית 4 ° C. עם זאת, אם מכתים immunocytochemical יעברו, לא מוסיפים חומצה נתרן למאגר resuspension, כמו זו גורמת לאובדן איכות מכתים.
חלק 6: Cytospin של המתלים התא אפופטוזיס כמותי וניתוח התפשטות
- שקופית חלבית סוף מיקרוסקופ, מסנן cytospin עם אחד או שניים חורים משפך cytospin מוכנסים לתוך סרטון שקופיות cytospin. קליפ השקופית סגור מיקומו הרוטור cytospin.
- ההשעיה התא ניתק הוא הומוגני ידי pipetting בעדינות מעלה ומטה.
הערה: בהתאם לשלב ההתפתחותי של הרשתית, על השעיית התא מההליך דיסוציאציה ייתכן שתצטרךלהיות מדולל עם PBS לקבל מספר מנייה של תאים. - Aliquot (100 μl) השעיה של התא מוחל משפך cytospin.
הערה: כאשר pipetting ההשעיה התא המשפך, קצה פיפטה צריך להגיע את כל הדרך למטה אל החלק התחתון של המשפך. חשוב לא לדחוף דרך נקודת הלחץ השני של פיפטה כמו זה יוצר בועות אוויר, אשר יוצגו במקום התא לאחר cytospin וצידניות ספירת התאים. - ההשעיה התא הוא הבחין בשקופית בסל"ד 700 דקות 7.
- לקביעת ההשפעה של גורמים להחיל exogenously על רמות אפופטוזיס בתאי ניתן מוכתם 4 ',6-Diamidino-2-phenylindole (DAPI; 2μg/ml), רכוב עם פלורסנט בינוני גובר. שינויים אפופטוזיס בתא ניתן לקבוע על ידי ספירת לפחות 1000 תאים (הכוללת לפחות 10 גרעינים pycnotic) במקומות תא cytospin ושיעור מוות של תאים מחושבים כאחוז של תאים הכולל סעיפים 3,4.
הערה: לחלופין, הפצת גרעין אפופטוטיים ניתן להעריך flatmounts 3 או cryostat sections4 של wholemounts רשתית תרבותי על ידי תיוג TdT בתיווך ניק סוף dUTP (TUNEL). - לצורך זיהוי של התפשטות תאים, BrdU (5 מיקרומטר) ניתן להוסיף 6 שעות לפני תום התרבות ושילוב BrdU דמיינו cytospins homogenates של התא על ידי מכתים immunocytochemical באמצעות נוגדן אנטי BrdU (למשל התפתחותית מחקרים Hybridoma בנק, איווה, ארה"ב).
- ההשפעה של הטיפול על סוגי תאים שונים ברשתית ניתן דמיינו ב cytospins על ידי נוגדנים ספציפיים כמו Brn3a נוירון (תא סמן גנגליון) או opsin (photoreceptor סמן) ו counterstaining עם DAPI.
חלק 7: תוצאות נציג
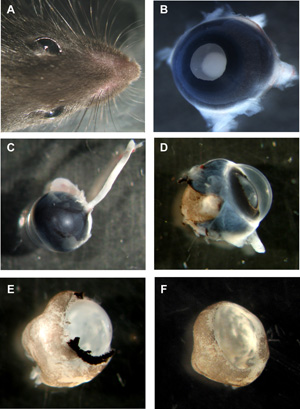
איור 1: שלבים בהכנת Murine wholemounts רשתית organotypic
ראש של עכבר עם שתי העיניים. B עין Murine עם הצד העדשה למעלה, כל השכבות עדיין במקום. C עין Murine מהישבן עם עצב הראייה עדיין מחוברת. העין D Murine עם בלובן העין ו פיגמנט האפיתל שהוסרה חלקית. E הרשתית Murine עם אפיתל, הקרנית והלחמית פיגמנט להסיר לחלוטין, אבל העדשה זגוגי עדיין במקום. F Murine כוס wholemount הרשתית עם העדשה זגוגי הוסרו. אנא לחץ כאן כדי לראות גרסה גדולה יותר של דמות 1.
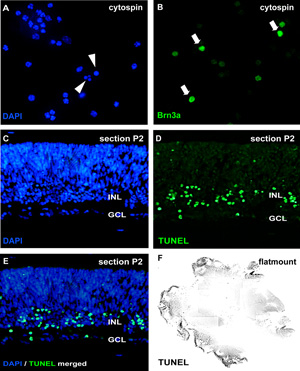
איור 2: ניתוח של תרבויות organotypic wholemount הרשתית על ידי cytospin וחתכים
לניתוח של אפופטוזיס, cytospins של המתלים התא ניתק מוכתמות DAPI גרעינים pycnotic ניתן להבחין על ידי פיצול גרעיני או עיבוי הכרומטין (ראשי חץ ב). לחלופין, קטעים wholemount (לסה"נ; יום הרשתית Murine לאחר הלידה (P) 2) או flatmount הרשתית (F) יכולה להיות נתונה assay TUNEL ו counterstained עם DAPI (E). ההשפעה של הטיפול על סוגי תאים שונים ברשתית ניתן דמיינו ב cytospins על ידי נוגדנים ספציפיים כמו נוירון לתא הגנגליון סמן Brn3a (החצים B) GCL, תא שכבת הגנגליון;. INL, פרוספקטיבי שכבת הגרעין הפנימית. אנא לחץ כאן כדי לראות גרסה גדולה יותר של הדמות 2.
Discussion
היתרון של 2-5 תרבויות Murine רשתית organotypic wholemount על דיסוציאציה, monolayer, retinospheroid או מחדש מצטברים תרבויות spheroid 3D 1 טמון בשימור אינטראקציות קשרים עצביים, מחקה את המצב vivo. לשם השוואה דיווחים 2 לשעבר, במאמר וידאו שלנו מספק הדגמה מפורטת של מוזרויות ב enucleation...
Acknowledgements
המחברים מבקשים להודות E. דה לה רוזה ו-AI Valenciano לעזרה ראשונית עם הקמתה של התרבויות organotypic ו ע ו U. לאוב Gerster לקבלת סיוע טכני.
Materials
| Name | Company | Catalog Number | Comments | |
| Mice | Animal | Charles River Laboratories | ||
| Dissection microscope | Tool | Carl Zeiss, Inc. | ||
| PBS | Reagent | Sigma-Aldrich | PBS should be cold (> 4°C) and sterile | |
| Dulbecco`s modified eagle`s medium / nutrient mixture F-12 Ham | Reagent | Sigma-Aldrich | D 8900 | DMEM / F-12 |
| Apo-transferin | Reagent | Sigma-Aldrich | T 1147 | |
| Putrescin | Reagent | Sigma-Aldrich | P 5780 | |
| Sodium selenite | Reagent | Sigma-Aldrich | S 9133 | |
| Progesterone | Reagent | Sigma-Aldrich | P 6149 | |
| Gentamicine | Reagent | Invitrogen | ||
| L-Glutamine | Reagent | Invitrogen | 25030-024 | 200 mM (100X), liquid |
| Bovine serum albumine (BSA) | Reagent | Carl Roth Gmbh | 8076.3 | 30 mg/ml |
| Collagenase | Reagent | Sigma-Aldrich | C 0773 | 200 U/ml |
| Trypsin | Reagent | Sigma-Aldrich | T4799 | From porcine pancreas; 1 mg/ml |
| Hyaluronidase | Reagent | Sigma-Aldrich | H 3884 | 200 mg/ml |
| DNase I | Reagent | Roche Group | 1 284 932 | 10 mg/ml |
| EDTA | Reagent | Sigma-Aldrich | E 6511 | |
| Silicone solution | Reagent | SERVA Electrophoresis | 35130 | |
| Paraformaldehyde (PFA) | Reagent | Sigma-Aldrich | P6148 | 8% PFA in 0.1M phosphate buffer (pH 7.4). |
| 4’,6-diamidino-2-phenylindole dihydrochloride | Reagent | Sigma-Aldrich | D 0542 | DAPI |
| Fluorescent Mounting Medium | Reagent | Dako | S3023 | |
| BrDU | Reagent | Sigma-Aldrich | B 9285 | |
| 96-well plates | Tool | Falcon BD | 3072 | |
| 24-well plates | Tool | Falcon BD | 3047 | |
| Pasteur pipettes | Tool | Brand GmbH | 747720 | |
| Forceps DUMONT #5 | Tool | Fine Science Tools | 11252-30 | bevelled very fine shanks (0.05 mm x 0.02 mm tip) |
| Forceps DUMONT #7 | Tool | Fine Science Tools | 11271-30 | curved shanks (0.07 mm x 0.10 mm tip) |
| Spring scissors,straight, 8cm | Tool | Fine Science Tools | 15000-00 | fine, small straight blades |
| Standard scissors, straight, sharp/blunt | Tool | Fine Science Tools | 14007-14 | Use for decapitation or cervical dislocation |
| Eppendorf tubes | Tool | Eppendorf | 2ml; round bottom for better precipitation of pellet during centrifugation /cytospin | |
| Cooling centrifuge | Tool | Eppendorf | ||
| Rotation shaker | Tool | CAT | ||
| Cytospin | Tool | Thermo Fisher Scientific, Inc. |
References
- Rieke, M., Gottwald, E., Weibezahn, K. -. F., Layer, P. G. Tissue reconstruction in 3D-spheroids from rodent retina in a motion-free, bioreactor-based microstructure. Lab. Chip. 8, 2006-2213 (2008).
- Donovan, S. L., Dyer, M. A. Preparation and square wave electroporation of retinal explant cultures. Nature Protocols. 1, 2710-2718 (2006).
- Duenker, N., Valenciano, A. I., Franke, A., Hernandez-Sanchez, C., Dressel, R., Behrendt, M., de Pablo, F., Krieglstein, K., de la Rosa, E. J. Balance of pro-apoptotic transforming growth factor-beta and anti-apoptotic insulin effects in the control of cell death in the postnatal mouse retina. Eur. J. Neurosci. 22, 28-38 (2005).
- Franke, A. G., Gubbe, C., Beier, M., Duenker, N. Transforming growth factors beta and Bone morphogenetic proteins: Cooperative players in chick and murine programmed retinal cell death. J. Comp. Neurol. 495, 263-278 (2005).
- de la Rosa, E. J., Díaz, B., De Pablo, F. Organoculture of the chick embryonic neuroretina. Curr. Top. Dev. Biol. 36, 133-144 (1998).
- Dohle, D. S., Pasa, S. D., Gustmann, S., Laub, M., Wissler, J. H., Jennissen, H. P., Duenker, N. Chick ex ovo culture and ex ovo CAM assay: How it really works. J Vis Exp. 32, (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved